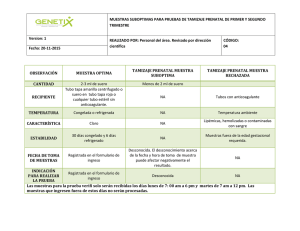
idoc.pub manual-de-inmunohematologia-y-medicina-transfusional
Anuncio
INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL Do d MANUAL TECNICO INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL TMs: Leonor Armanet, Juana Vargas, Amalia Cárcamo, Carolina Hernández Ste 2012 CURSO 2015 Actualizado por TMs Josefina Barrera y Catalina Salinas ____________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL INTRODUCCION La Medicina Transfusional es un área de la Medicina que ha sufrido diversos y rápidos cambios a lo largo de su historia, en especial en los últimos años, lo que constituye un constante desafío para los que trabajan en ésta área. Hemos desarrollado este texto que pretende servir de guía tanto a estudiantes de la Carrera de Tecnología Médica como a profesionales que trabajan en Servicios de Sangre. En el presente Manual se describen aspectos básicos de Inmunohematología y Medicina Transfusional, se describen las técnicas y procedimientos que se utilizan con mayor frecuencia en una Unidad de Medicina Transfusional y en un Centro de Sangre. Se incorpora un cuestionario de autoevaluación al término de cada una de las unidades temáticas, que permite que el estudiante pueda conocer el nivel de comprensión y manejo de las materias que aquí tratamos. Pretendemos además hacer reflexionar a quienes se inician en esta disciplina sobre aspectos relevantes del quehacer del Tecnólogo Médico en Medicina Transfusional, en tópicos como control de calidad, metodologías, registros, etc., con el propósito de lograr en ellos un espíritu crítico y autonomía en su quehacer profesional. Pretendemos reforzar el aprendizaje y comprensión del texto con talleres dirigidos y discusión de casos, buscando a través del trabajo cooperativo las respuestas a las interrogantes que aquí planteamos, y así también fortalecer aspectos que pueden no estar explícitamente tratados en éste manual. 2 INDICE UNIDAD DONACIÓN DE SANGRE SELECCION DE UN DONANTE DE SANGRE 1.- INTRODUCCION: 2.- EL LLENADO DE LA FICHA DE DONANTE Y EL CUESTIONARIO: 3.- SELECCION DEL DONANTE: 4.- CONDICIONES DE LA ENTREVISTA DEL DONANTE DE SANGRE 5.- PRINCIPIOS DE UNA ENTREVISTA: 6.- CRITERIOS DE SELECCIÓN PREGUNTAS A REALIZAR DURANTE LA ENTREVISTA AL DONANTE PROCEDIMIENTOS A UTILIZAR EN LA ATENCION Y SELECCION DE UN DONANTE DE SANGRE I.- DETERMINACION DE Hb UTILIZANDO SULFATO DE COBRE. II.-DETERMINACION DE HEMOGLOBINA EN DONANTES CON EL METODO HEMOCUE III.- TECNICA EN LAMINA PARA CONTROLAR ANTIGENOS ABO EN GLOBULOS ROJOS. IV.- CONTROL DE CALIDAD DEL PROCEDIMIENTO DE EXTRACCION EN UN DONANTE 1.- CULTIVO BACTERIOLÓGICO DEL SITIO DE PUNCIÓN. 2.- CULTIVO BACTERIOLÓGICO DE LAS UNIDADES DE SANGRE. 3.- CONTROL DE CALIDAD DEL VOLUMEN DE SANGRE EXTRAÍDO A CADA DONANTE. V.- MEDICION DE LA PRESION ARTERIAL VI.- PREPARACION DE LA ZONA DE PUNCION VENOSA. VII.- PUNCION VENOSA Y EXTRACCION DE SANGRE. VIII.- ATENCION DEL DONANTE DESPUES DE LA EXTRACCION REACCIONES ADVERSAS A LA DONACION DE SANGRE I.- REACCIONES LOCALES: II.-REACCIONES GENERALIZADAS: 6 7 7 8 8 8 9 11 12 21 21 22 24 26 26 26 26 27 28 29 31 31 31 32 REGISTROS 34 ALMACENAMIENTO Y TRANSPORTE DE HEMOCOMPONENTES GESTION DE STOCK EN BANCO DE SANGRE 37 37 UNIDAD INMUNOHEMATOLOGIA 44 INTRODUCCION A LA INMUNOHEMATOLOGIA REACTIVOS BASICOS A USAR EN INMUNOHEMATOLOGIA Y BANCO DE SANGRE 1.- BUFFER FOSFATO Y BUFFER FOSFATO SALINO 2.- PREPARACION DE SUERO AB INERTE 3.- MEDIO DE BAJA FUERZA IÓNICA (LISS): 4.- EDTA - SALINO 5.- SOLUCION DE ALSEVER MODIFICADA: 6.- CONVERSION DE PLASMA A SUERO TRATAMIENTO DE MUESTRAS CON COAGULACION INCOMPLETA PREPARACION DE LECTINAS PARA USO EN INMUNOHEMATOLOGIA REACCION DE CELULAS POLIAGLUTINABLES CON LECTINAS LAVADO DE ERITROCITOS Y PREPARACION DE SUSPENSIONES CELULARES GRADUACION DE LOS RESULTADOS INMUNO-HEMATOLOGICOS CALIBRACION DE CENTRIFUGAS SEROLOGICAS PARA INMUNOHEMATOLOGIA CARACTERISTICAS DE LOS SUEROS CLASIFICADORES. ESPECIFICIDAD: POTENCIA: AVIDEZ E INTENSIDAD: TITULO CLASIFICACION DEL SISTEMA ABO 44 46 48 49 49 50 50 51 51 52 53 53 54 56 58 58 59 59 60 61 3 ____________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL DETERMINACION DE ANTIGENOS SOLUBLES ABH Y LEWIS EN SALIVA FRECUENCIAS GENICAS DE SISTEMAS SANGUINEOS EN DIFERENTES POBLACIONES CARACTERISTICAS GENERALES DE SISTEMAS SANGUINEOS DE IMPORTANCIA CLINICA TEST ANTIGLOGULINA HUMANA TEST ANTIGLOBULINA HUMANA DIRECTO (TAD) TEST DE COOMBS DIRECTO TEST ANTIGLOBULINA HUMANA INDIRECTO (TAI) TEST DE COOMBS INDIRECTO PREPARACION DE GLOBULOS ROJOS CONTROL PARA TEST ANTIGLOBULINA HUMANA CLASIFICACION RH (D): TÉCNICA EN TUBO CLASIFICACION DE GRUPO ABO Y RH: TÉCNICA EN MICROPLACA DETERMINACION DE GENOTIPO RH Frecuencia de los haplotipos Rh en población chilena. ALGORITMO A UTILIZAR EN LA CLASIFICACIÓN RH D DETECCION DE ANTICUERPOS IRREGULARES: TÉCNICA EN TUBO DETECCION DE ANTICUERPOS IRREGULARES EN PAPAINA DETECCIÓN DE ANTICUERPOS EN MEDIO LISS DETECCIÓN DE ANTICUERPOS IRREGULARES: TÉCNICA EN COLUMNA IDENTIFICACION DE ANTICUERPOS IRREGULARES COMPORTAMIENTO SEROLOGICO DE LOS PRINCIPALES ANTICUERPOS IRREGULARES CALCULO DE PROBABILIDAD: TECNICA DE IDENTIFICACION DE AC. EN BROMELINA TITULACION DE ANTICUERPOS PRUEBA CRUZADA O CROSMATCH ESTANDARIZACION DEL MEDIO DE BAJA FUERZA IONICA (LISS) PREPARACION Y ESTANDARIZACION DE SOLUCIONES USO DE DTT PARA DIFERENCIAR ANTICUERPOS IGM DE IGG TRATAMIENTO DE ERITROCITOS CON DTT ABSORCION DE ANTICUERPOS ELUCION DE ANTICUERPOS ESTUDIO RH EN CELULAS CON TAD POSITIVO AUTOADSORCION DE ANTICUERPOS CALIENTES (ZZAP) ADSORCION DIFERENCIAL EN CALIENTE USANDO ZZAP DETERMINACION DE ESPECIFICIDAD DE AUTO ANTICUERPOS FRIOS DEMOSTRACION DE AUTOAGLUTININAS FRIAS (CRIOAGLUTININAS) DE ALTO TITULO ESTUDIO DE CALIDAD DE UN SUERO ANTIGLOBULINA HUMANA I.-ESPECIFICIDAD: II.-EVALUACIÓN DE LA ACTIVIDAD ANTICOMPLEMENTO III.- POTENCIA Y SENSIBILIDAD DEL SUERO AGH: CARACTERISTICAS GENERALES DE METODOS USADOS EN INMUNOHEMATOLOGIA ERITROCITOS CONGELADOS PARA FINES DE LABORATORIO ESTUDIO INMUNOHEMATOLÓGICO DE UNA MUESTRA SANGRE Y COMPONENTES SANGUINEOS PREPARACION Y CONSERVACION DE COMPONENTES SANGUINEOS CONTENIDO DE LAS SOLUCIONES PRESERVADORAS (g/L) CAMBIOS BIOQUIMICOS DE SANGRE CONSERVADA CON CPD Y CPDA-1 PREPARACION DE COMPONENTES SANGUINEOS POR CENTRIFUGACIÓN. CARACTERISTICAS DE LOS PRINCIPALES COMPONENTES SANGUINEOS CONTENIDO APROXIMADO DE LEUCOCITOS EN LOS COMPONENTES SANGUINEOS REDUCCION DE LEUCOCITOS EN LOS COMPONENTES SANGUINEOS: DATOS BIOLOGICOS DE ALGUNOS FACTORES DE COAGULACION EFECTOS ADVERSOS DE LA TRANSFUSION SANGUINEA EFECTOS ADVERSOS DE LA TRANSFUSION SANGUINEA 4 65 74 74 75 75 77 79 66 71 72 73 74 80 84 85 82 86 86 89 91 92 94 96 97 100 101 102 103 105 106 107 109 110 110 111 112 115 118 118 120 122 123 123 123 123 126 128 128 129 130 131 A.- REACCIONES TRANSFUNSIONALES INMEDIATAS B.- REACCIONES TRANSFUSIONALES RETARDADAS CUADRO RESUMEN DE LOS EFECTOS ADVERSOS DE LA TRANSFUSIÓN SANGUÍNEA INVESTIGACION DE UNA REACCION TRANSFUSIONAL ENFERMEDADES DE TRANSMISION SANGUINEA TESTS SEROLOGICOS EN EL DIAGNOSTICO DE HEPATITIS VIRAL CAUSAS POSIBLES DE RESULTADOS FALSOS EN TEST ELISA EVALUACION DE PROCEDIMIENTOS DE TAMIZAJE O SCREENING BIBLIOGRAFIA 131 135 137 139 141 142 142 143 145 5 ____________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL UNIDAD DONACIÓN DE SANGRE 6 ___________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL SELECCION DE UN DONANTE DE SANGRE 1.- INTRODUCCION: La seguridad de la transfusión de sangre o de sus componentes comienza con la apropiada selección del donante. Para lograr este objetivo se dispone de una Ficha de Donante y un Cuestionario para aplicar durante la entrevista a los posibles donantes, con la que pretendemos lograr una correcta selección de ellos, apoyándose además con folletos informativos (Ver anexos al término de la unidad) acerca de las enfermedades que se transmiten por la sangre y de la seguridad de la extracción sanguínea. Es necesario enfatizar también la necesidad de ofrecer al donante un proceso seguro y controlado. El proceso de atención de donantes de sangre consta de las siguientes etapas: a.- Recepción, identificación y codificación del donante: La recepción debe ser cálida. Solicite la información necesaria para identificar con seguridad al donante y carnet de identidad o documento con RUT y foto, llenando con el máximo de precisión todos los datos que aparecen en la Ficha de Donante de Sangre, e ingresándolos al sistema informático. El sistema asignará un número único de donación y emitirá etiquetas con código de barras, que deberán adherirse a los registros, bolsas y tubos. b.- Verificación del estado general del donante: Incluye peso, pulso, presión arterial, hemoglobina y aspecto general del donante, información que también debe registrar en la Ficha de Donante de Sangre. c.- Entrevista y aplicación del cuestionario:comprende una serie de preguntas específicas que tienen por objeto recoger una clara información para que determine si el donante cumple o no con los requisitos exigidos para donar. La duración de este procedimiento es de 8 a 10 minutos. d.- Compromiso del donante: Todo donante debe firmar el Consentimiento Informado contenido en la Ficha de Donante de Sangre, declarando entender las preguntas formuladas, que la información entregada es verdadera yque autoriza el procedimiento. e.- Agradecimiento por la donación e invitación a ser donante voluntario: Usted debe incentivar la donación voluntaria y pedir el consentimiento para ser invitado a donar sangre en el futuro como donante voluntario. f.- Prevención y control de reacciones adversas a la donación: Debe estar atento a cualquier reacción que presente el donante durante o después de la donación, anotando signos, síntomas, incidentes de la venopunción, momento de la ocurrencia y otras características; también debe registrar el manejo y la evolución, y registrarlo en la Ficha de Donante. g.- Identificación del profesional que selecciona y del flebotomista: El responsable de la entrevista (usted) debe anotar su nombre en el lugar correspondiente de la Ficha de Donante y del Cuestionario. El técnico paramédico que realiza la extracción de sangre también debe firmar. 7 ____________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 2.- EL LLENADO DE LA FICHA DE DONANTE Y EL CUESTIONARIO: a.- Quien: El Tecnólogo Médico responsable de la sección. b.- Como: Preguntando al donante uno a uno los aspectos que contiene la "Ficha de Donante de Sangre" y el “Cuestionario”, recogiendo la información pertinente, teniendo presente la importancia de explicar en términos simples cada punto y de ganar la confianza del donante para lograr respuestas verdaderas. La entrevista que se realiza para llenar el cuestionario debe ser confidencial. c.-Cuando: Una vez que el posible donante ha leído la información acerca de las infecciones de transmisión sanguínea, tendientes a lograr la autoexclusión y se ha interiorizado sobre el procedimiento de la extracción (Revisar folletos relativos al tema). 3.- SELECCION DEL DONANTE: a.- Se entrevistará al donante de sangre, utilizando un cuestionario basado en las normas de selección establecidas en el país. b.- Se evaluará la información recogida, determinando la aceptación o exclusión del posible donante. c.- En caso de exclusión se explicará al donante en la forma más clara y completa posible, si la causa es definitiva o transitoria, se dará las recomendaciones pertinentes, verificando que el donante ha comprendido la situación, y se registrará la causa en la ficha del donante, utilizando el código respectivo. d.- Si no hay motivos de exclusión, se someterá al donante a un examen físico dirigido la toma de signos vitales y a revisar especialmente las zonas de punción. La piel de la zona de venopunción en ambos brazos no debe presentar lesiones o signos que indiquen que es adicto a drogas endovenosas. Lesiones poco importantes de la zona, como dermatitis y sarna serán causa de exclusión temporal. 4.- CONDICIONES DE LA ENTREVISTA DEL DONANTE DE SANGRE La entrevista se diferencia de la conversación corriente en que está dirigida y orientada hacia un propósito, y tiene una duración definida (aproximadamente 12 minutos). El propósito de la entrevista que se realiza al donante de sangre es obtener información fidedigna, lo que requiere un constante entrenamiento ya que la automatización de esta función lo puede llevar a cometer errores. Dos son los ingredientes de una entrevista bien hecha: “EL CONTENIDO” y “LA DIRECCION”. El contenido se refiere a los temas a tratar en la entrevista, y la dirección corresponde a la forma en que el entrevistador presenta el contenido. 8 ___________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 5.- PRINCIPIOS DE UNA ENTREVISTA: 1) Iniciar -CEOR: Cállese, escuche, observe, registre. En general a las personas les resulta interesante hablar de sí mismos, por lo tanto al aplicar este principio se consigue más información. Este principio permite que el donante le hable, se explaye. Es importante observar su comunicación no verbal (gestos, posiciones, miradas, movimientos). Escuchar activamente le permitirá captar el mensaje, detectar incongruencias o nerviosismo, que pueden ser una pista para obtener mayor información. Puede obtener información a nivel consciente o subconsciente; esta última se conoce con el nombre de tincadas, corazonada, palpito, etc. Debe sondear y luego adquirir más información, contrastar para así decidir si solo es una “idea” o realmente es un antecedente de importancia. Debe hacer hablar al entrevistado por medio de preguntas abiertas. 2)Mantener el control de la entrevista: Con una actitud serena, objetiva, clara, conociendo la estructura de la entrevista, no hay posibilidad de que el entrevistado maneje la situación. Frente a un donante agresivo, prepotente, seductor, coqueto, amistoso, lloroso, angustiado, etc. lo importante es que el entrevistador (usted) no se involucre; hay que observar su actuación, ya que todas estas manifestaciones son en su mayoría mecanismos de defensa. Un donante agresivo, prepotente o expansivo es más fácil de conocer y de obtener información, ya que basta con dejarlo hablar. Por el contrario, si el donante es evasivo debe confrontarlo ya sea en forma directa o indirecta (ingenuamente). Frente a un donante alterado emocionalmente, debe darle tiempo a que se tranquilice pero no involucrarse en su emoción. 3)Escuchar activo: Significa leer las características del donante y concentrarse en el foco externo, observando cuidadosamente su conducta no verbal. Recordar los temas a tratar y así organizar el orden de la entrevista. 4)Tolerancia: Es la “aceptación de lo que sea” dentro del ámbito de la entrevista. No corresponde que evalúe moralmente al donante, ya que el propósito de la entrevista es aceptarlo o excluirlo como donante de sangre. Por consiguiente sus valores y creencias son irrelevantes en este caso. En esta situación su autocontrol es importante para no evidenciar la valoración positiva o negativa que pueda tener de una respuesta que el donante le entregue. La práctica de la empatía incrementa la tolerancia. 5)Cuidar la comunicación no verbal: Es importante vigilar su propia conducta. Durante la entrevista es fundamental observar la conducta del entrevistado, por lo tanto es importante no coartarla con comentarios, gestos o expresiones. No conviene decir “que bueno”, “que bien”, etc. Los comentarios positivos hacen que el donante abunde sobre el tema, sobredimensionando la situación. Por el contrario los comentarios negativos tienen el efecto inverso, reduce el tema, le resta importancia, lo minimiza. Sus gestos pueden modificar la conducta del donante, ya sea incrementándola o cohibiéndola. 9 ____________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 6)Uso del silencio: Es fundamental para escuchar. Debe hacer un contacto visual laxo, permanecer en silencio con semi sonrisa, ladear ligeramente la cabeza para intensificar el efecto ya que es una invitación a hablar. Si el donante deja de hablar, debe mantener la posición de silencio, no interrumpir. Esto hace que el donante se incomode, sube su ansiedad, y trata de romper el silencio, por lo tanto hablará y entregará información. Los silencios del donante frente a una pregunta por ejemplo de su vida sexual, puede significar que él está evaluando su respuesta. Es importante estar alerta a los silencios del donante y debe volver a sondear, preguntar y confrontar. Es importante que recuerde, el silencio del donante de sangre no significa necesariamente que terminó de hablar, sobre todo si la información que le entregó le merece duda, sino que está organizando el pensamiento. 7)Facilitación: Si realiza pequeñas intervenciones pueden animar al donante para que hable o amplíe un tema en particular. Por ejemplo: Verbal: Sí, ya, ya veo, hum, ajá. Preguntas cortas: ¿Cómo así? “Ud. mencionó”. Repetir la última frase que dijo el donante (con el fin de que continúe el relato), resumir en una frase lo que dijo (técnica del reflejo – sirve para que amplíe el tema). No verbal: cabeza, sonrisa, levantar cejas, levantar hombros. Cuide especialmente las facilitaciones no verbales, debe administrarlas en momentos muy precisos ya que pueden llevar implícitamente a una valoración del tema que puede inhibir o ampliar la respuesta del donante, recogiendo errores en la respuesta; es recomendable que no las utilice. Recuerde que durante la entrevista debe mantener una expresión neutra que no induzca la respuesta del donante. En resumen debe facilitar que el donante hable pero mantener una expresión neutra. 8) Confrontación y contrastación: Contrastar durante toda la entrevista las inconsistencias y dudas que le merecen las respuestas del donante, para confrontárselas al final y así obtener respuestas más fidedignas. La contrastación es un ejercicio que debe realizar en forma íntima, señalando con asteriscos o marcas aquellos aspectos que ameritan ser confrontados. Es necesario confrontar hasta quedar tranquilo, pero cuidando que no sea molesto o amenazante para el donante porque entonces él puede entregar una respuesta de compromiso social. Es recomendable usar la técnica del ingenuo. 9) Desanimar la comunicación improcedente: Cuando el donante le entregue información improcedente, tratar de discriminar si es o no irrelevante porque puede estar entregando información indirecta. Cuando el donante se emociona, desvíe su atención empleando preguntas directas a un tema específico o confrontándolo. No use el silencio o la facilitación. 10) Atmósfera adecuada: Es conveniente ser cordial, cálido al inicio y al final de la entrevista. Consolar o reconfortar si el donante se emociona pero con límites, no involucrarse. Es importante dar también la posibilidad de que el donante le pregunte. La calidez da seguridad y con la confianza el sujeto se abre por lo tanto entrega la información deseada. 10 ___________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 6.- CRITERIOS DE SELECCIÓN (Basados en la Norma General Técnica Nº 0146 – 2013: Norma que regula el procedimiento de atención de donantes de sangre (en sitio fijo o móvil). 1.- EDAD: - entre 18 y 60 años. Los donantes regulares que han donado una vez al año en los últimos 5 años se pueden aceptar hasta los 65 años, si cumplen con los requisitos de la entrevista y exámenes pre donación. 2.- FRECUENCIA DE DONACIÓN: debe existir un intervalo mínimo entre donaciones de sangre de 3 meses en los hombres y 4 meses en las mujeres. 3.- PESO: Mínimo 50 kilos. ESTATURA: Verificar que esté relacionada con el peso. Los donantes que pesan 50 Kgs. o más, pueden donar un máximo de 450 ml +/- 10% de sangre, es importante que las muestras para la calificación biológica de la donación, no excedan los 30 ml. La obtención de más del 13% de la volemia en un donante de 50 Kgs. puede significar una mayor frecuencia de reacciones adversas en el donante. El volumen debe ser controlado para asegurar que los componentes sanguíneos obtenidos cumplan con las especificaciones establecidas. 4.- ALIMENTACIÓN: los donantes que han comido en los horarios habituales, considerando cuatro ingestas alimentarias por día, pueden donar. Si un donante se ha saltado una comida se le debe dar a beber algo de líquido antes de la extracción. Se recomienda la ingestión de 500 mL de agua antes de la donación, ya que reduce significativamente la incidencia de reacciones adversas. 5.- PRESION ARTERIAL: (Tomada en reposo) - Sistólica: menor a 180 mmHg - Diastólica: menor a 100 mmHg 6.- PULSO: lo menos. Entre 60 y 100 pulsaciones por minuto, regular y palpado por 30 segundos a 7.- HEMOGLOBINA:sobre 13,5 grs/dL en hombres sobre 12,5 grs/dL en mujeres 8.- MICROHEMATOCRITO: 40% en hombres; 38% en mujeres 7.- REGISTROS EN LA FICHA DE DONANTE Y APLICACION DEL CUESTIONARIO AL POSIBLE DONANTE DE SANGRE: Los formularios que se utilicen para seleccionar al posible donante deben estar en conformidad con las normas del Ministerio de Salud; revisados y actualizados periódicamente, y se deben aplicar a todo donante de sangre. A continuación, usted podrá analizar las diferentes partes de un modelo de ficha de donante y de un cuestionario: Ficha de donante de sangre § Identificación del donante 11 ____________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL § § § § § § § § § § § § § Examen físico Consentimiento informado Firma del profesional y del donante Antecedentes de la extracción Características de la bolsa Incidentes de la venopunción Identificación del técnico paramédico Reacciones adversas Tipo de donante Lugar de colecta Cuestionario Preguntas Responsabilidad del donante sobre veracidad de las respuestas Aprobación – exclusión ALGUNAS PREGUNTAS A REALIZAR DURANTE LA ENTREVISTA AL DONANTE § ¿HA LEÍDO Y COMPRENDIDOEL INFORMATIVO? Dirigida a saber si recibió, leyó y comprendió los folletos explicativos que contienen los requisitos generales establecidos para donar sangre,para protegerlo como donante y para proteger al paciente/ receptor de ella. § ¿DURMIÓ MÍNIMO 5 HORAS? NO: debe diferirse temporalmente al donante hasta que haya dormido esta cantidad de horas. § ¿HA BEBIDO ALCOHOL EN LAS ÚLTIMAS 24 HORAS? Donantes bajo la influencia del alcohol, deben excluirse transitoriamente hasta cumplir 24 horas sin ingesta de alcohol, debido a que generalmente no es posible obtener antecedentes clínicos fidedignos, la donación además puede ser dañina para el propio donante. El donante no debe tener síntomas o signos de intoxicación por alcohol o drogas. Preguntar sobre antecedentes de alcoholismo crónico, daño hepático crónico, hemorragias digestivas etc. Si existen estos antecedentes, excluir en forma definitiva al donante. Una pequeña cantidad de alcohol ingerida recientemente, en especial durante las comidas, no es causa de rechazo ya que en ese caso no existe riesgo para donante ni receptor. § ¿HA DONADO SANGRE ANTES? Dirigida a tener antecedentes sobre el lugar y fecha de donaciones previas, con el objeto de proteger tanto al donante como al receptor. SI: NO: § 12 Se acepta solo si su donación fue hace más de 3 meses. Se acepta. ¿SE HA SENTIDO MAL DURANTE O DESPUÉS DE DONAR SANGRE?: ___________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL Dirigida a detectar alteraciones o problemas en donaciones previas. Debe quedar registrada la característica de la reacción adversa a la donación. SI: No debe donar si tiene historia de un desmayo severo o 2 desmayos consecutivos. A CRITERIO: si se decide aceptar, se requiere una observación cuidadosa. NO: Se acepta como donante. INFORMACION ADICIONAL: Una historia de predisposición a desmayos aumenta las posibilidades de una reacción adversa a la donación Debe excluirse a las personas que en donaciones anteriores, tuvieron un desmayo severo o en donaciones sucesivas tuvieron desmayos. § ¿HA SIDO RECHAZADO ALGUNA VEZ COMO DONANTE DE SANGRE? ¿POR QUÉ? Dirigida a conocer alguna causa temporal o definitiva que lo inhabilite como donante. Enfatizar acerca del conocimiento de resultados alterados de exámenes realizados a su sangre. Excluir todo donante con antecedentes de exámenes positivos para: Hepatitis, Chagas, Sida, HTLV-I. En caso de Sífilis dependerá si hubo tratamiento, aceptándolo si existió y fue dado de alta hace un año por lo menos. Evaluar si el rechazo anterior fue por una causa definitiva o transitoria, en este último caso, el donante se acepta si el plazo determinado se ha cumplido. SI: NO: § Preguntar la causa y verificar si es causal o no de rechazo. Se acepta como donante. ¿HA TOMADO ASPIRINA O ANTINFLAMATORIOS EN LOS ÚLTIMOS 3 DÍAS? La sangre de donantes que hayan ingeridoaspirina o piroxicam los últimos 3 días o ha recibido otro AINES en las últimas 48 horas previas a la donación, no debe ser utilizada para preparar concentrados plaquetarios. La aspirina y productos que la contienen (Ewin, Mejoral, Gluspirin, Cafiaspirina, Cardioaspirina, etc.), inhiben la actividad plaquetaria durante 1 a 5 días. SI: Se acepta como donante, rotulando la bolsa "NO PREPARAR PLAQUETAS". NO: Se acepta como donante. § ¿EN LAS ÚLTIMAS DOS SEMANAS HA TENIDO FIEBRE, RESFRÍO, VÓMITOS O DIARREA? La diarrea es a menudo, un signo de infección del aparato digestivo, especialmente de su segmento intestinal. En este caso puede ser motivado por bacterias, virus, parásitos, hongos. Estas infecciones pueden traspasar la barrera intestinal y pasar a la sangre constituyendo "bacteremias" o "viremias". Al momento de la entrevista, al no poder hacer diagnóstico diferencial con aquellas infecciones que no traspasan la barrera intestinal, ni tampoco con diarreas de causa no infecciosa (como la secundaria a colon irritable), se debe excluir como donante. NO: Se acepta como donante. SI: Se excluye en forma transitoria hasta que cumpla 1 semanadesde el último episodio. Sugerirle que consulte un médico § ¿EN LAS ÚLTIMAS 8 SEMANAS, LE HAN PUESTO ALGUNA VACUNA O INYECCIÓN? NO:Se acepta como donante. SI: Analizar si es o no causal de rechazo, en caso positivo, explicarle si es definitivo o transitorio. 13 ____________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL OBLIGATORIO: no debe donar si han transcurrido menos de 8 semanas de la vacunación con microorganismos vivos: • • • • • • Fiebre amarilla Parotiditis Polio oral Rubeola Sarampión Tifoidea oral A CRITERO: aceptar si la vacunación se realiza con microorganismos no vivos: • Ántrax • Botulismo • Cólera • Difteria • Haemophilus influenzae • Influenza • Meningococo • Neumococo • Polio inyectable • Tifoidea inyectable • Coqueluche CASOS ESPECIALES: consultar NGT 146 para mayores detalles: Rabia: si se administró después de una mordedura animal, no debe donar hasta 12 meses después de la exposición. Tétanos: no debe donar si han transcurrido menos de 4 semanas de la exposición. BCG: no debe donar si el sitio de inoculación no ha sanado o si han pasado menos de 8 semanas desde la inoculación. Viruela: no debe donar si el sitio de inculación o cualquier sitio de infección secundaria no han sanado completamente, o han transcurrido menos de 8 semanas desde la inculación o aparición de un sitio de infección secundario. La vacunación contra viruela es con virus vivo, por lo que si no ha sanado completamente existe riesgo de tranmitir el virus u otra infección. Hepatitis A:no debe donar si han pasado menos de 6 semanas desde la vacunación o la admistración de inmunoglubulina intramuscular. Hepatitis B: no debe donar si han pasado menos de 12 meses desde la vacunación. Última dosis en el caso de exposicion a riesgo y 7 días si es vacunación preventiva INFORMACIÓN ADICIONAL: las vacunas que utilizan virus o bacterias vivos atenuados estimulan el sistema inmune, pero normalmente no causan una enfermedad severa. Sin embargo pueden hacerlo en personas inmunodeprimidas. Al diferir por 8 semanas la donación, se evita la transmisión causada por la vacuna, pues esta ya estaría controlada. § ¿EN LOS ÚLTIMOS12 MESES HA SIDO OPERADO U HOSPITALIZADO? DEFINICIÓN: Cirugía mayor: todo procedimiento quirúrgico que requiere una estadía hospitalaria de más de 5 días. OBLIGATORIO: no debe donar si 14 . ___________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL • • • • • • • La cirugía se debió a un cáncer No han sanado todas las heridas Hay cualquier infección No se ha restablecido la movilidad normal Han transcurrido menos de 12 meses de una cirugía mayor Han transcurrido menos de 7 días de cualquier otra cirugía Si requiere tratamiento post operatorio o atención hospitalaria regular NO: § Acepte al donante ¿EN LOS ÚLTIMOS 12 MESES SE HA REALIZADO ENDOSCOPIA? El antecedente de endoscopía, está destinado a detectar donantes en riesgo de infección por hepatitis B o similares, con el uso de endoscopio flexible. NO: SI: § • § SI: ð ð ð ð ð ð Se acepta como donante Evaluar según norma ¿SE HA REALIZADO EXAMEN DE SANGRE U OTRO TIPO DE EXAMEN? OBLIGATORIO: no debe donar si: Está en espera de exámenes o de resultados para una condición no diagnosticada aún y que podría significar el rechazo de la donación. ¿EN LOS ÚLTIMOS 6 MESES HA RECIBIDO ALGÚN TRATAMIENTO MÉDICO? ¿HA TOMADO ALGÚN MEDICAMENTO EN EL ÚLTIMO TIEMPO? ¿CUÁL? En general los medicamentos que toma un donante no son perjudiciales para el receptor. Pueden ser aceptados como donantes la mayoría de las personas que toman medicamentos, incluso los que lo hacen por indicación médica. Normalmente el rechazo debido a la ingesta de algún medicamento no se debe a las propiedades de este sino a las características de la enfermedad que justifica su administración. Debe quedar registrado el medicamento que tomó el donante y cuando. NO: Se acepta como donante. Preguntar cual y en que dosis.Consultar NGT 0146. No son causa de exclusión: Anticonceptivos orales, analgésicos comunes, vitaminas, sustitutos hormonales y pastillas para adelgazar. La aspirina y productos que la contengan (Ewin, Mejoral, Gluspirin, Cardioaspirina etc.), inhiben la actividad plaquetaria durante 1 a 5 días. La sangre de donantes que estén ingiriendo estosmedicamentos hasta3 días antes de la donación, no debe ser utilizada para preparar concentrados plaquetarios. Lo mismo se aplica para aquellos que tomaron Piroxicam. Se excluyen personas con antecedentes de ingestión reciente (1 semana atrás) o actual de los siguientes medicamentos: Antibióticos Antihistamínicos Corticoides Neurolépticos (Antipsicóticos y tranquilizantes mayores) Antiepilépticos - anticonvulsivantes. VER LISTADO DE MEDICAMENTOS 15 ____________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL § § § § ¿EN LOS ÚLTIMOS 12 MESES HA IDO AL MÉDICO, MATRONA, DENTISTA U OTRO PROFESIONAL DE SALUD? ¿HA TENIDO CÁNCER ALGUNA VEZ? ¿TIENE O HA TENIDO ALGUNA ENFERMEDAD AL CORAZÓN, PULMÓN, RIÑON, TIROIDE O TIENE HIPERTENSIÓN, DIABETES, ALERGIA, TENDENCIA A SANGRAR U OTRA? Preguntas dirigidas a detectar patologías que lo inhabiliten como donante. a) Enfermedades Cardiovasculares: Se excluyen: Cardiopatías con insuficiencia cardíaca, Enfermedad reumática en tratamiento y Enfermedad coronaria (angina, infarto), por la posibilidad de una nueva crisis. b) Diabetes: Se excluye quienes están bajo tratamiento con medicamentos normoglicemiantes, insulinodependientes. Se aceptan los que controlan su diabetes sólo con régimen. c) Hipertensión: Se excluye aquellos que estén en tratamiento. En caso de detectar valores de presión fuera de los rangos establecidos, se debe esperar 15 minutos y volver a tomar la presión con el donante acostado. d) Enfermedades Gastrointestinales: Se excluye las diarreas agudas o crónicas reactivadas. Se aceptan donantes con antecedentes de úlcera péptica asintomáticos y sin tratamientos. Otras patologías como pólipos rectales o hemorroides, pueden ser aceptados como donantes si en el momento del interrogatorio están asintomáticos y sin tratamiento médico. e) Enfermedades Respiratorias: Se excluye las enfermedades broncopulmonares activas, Tuberculosis activa. Cuadros respiratorios agudos se excluyen hasta su curación. Se acepta a las personas que han padecido tuberculosis y que después de 1 año de haber cumplido el tratamiento y dado de alta. Resfríos activos se excluyen transitoriamente. f) Cáncer: Se excluye. Se aceptará solo con autorización médica, después de 5 años sin tratamiento. g) Enfermedades Hematológicas: Se excluye si ha presentado anemia crónica o enfermedades oncohematológicas como Linfomas, Leucemia, etc. h) Enfermedades Inmunológicas no alérgicas: Se excluye en forma definitiva a quienes presenten enfermedades tales como: Lupus Eritematoso Sistémico, Artritis Reumatoidea, Enfermedad Mixta del Tejido Conectivo, Esclerodermia. i) Enfermedades Endocrinológicas: Se excluye en forma definitiva como donante a las personas que sufran endocrinopatías activas y las que han recibido hormona del crecimiento de origen humano. j) Enfermedades Hepáticas: Hepatitis ver pregunta Nº 15. Se excluye en forma definitiva a quienes sufran Hepatopatías (cirrosis hepática). k) Malaria: Se excluye por un período de 3 años a quienes hayan sufrido de Malaria, tomado drogas antimaláricas, o quienes han vivido en países endémicos. l) Piel: Se excluye a quienes presenten lesiones en la piel especialmente en las áreas de punción venosa o vecinas. Lesiones poco importantes como dermatitis y sarna serán causa de rechazo temporal. m) EnfermedadesRenales: Se excluye personas con enfermedades crónicas. Se excluyen por 2 meses las pielonefritis aguda. No se excluye personas con antecedentes de cálculos renales (Litiasis). n) Retraso mental:Seexcluye en forma definitiva por no tener discriminación y por pertenecer a grupo de riesgo de enfermedades de transmisión sexual. 16 ___________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL o) Sífilis y Gonorrea: Se excluye por un período de 12 meses, ya que pudieran asociarse con transmisión de VIH. p) Sangramientos importantes: Consultar causa, frecuencia y temporalidad. Se excluye si es frecuente, importante y activo. q) Enfermedades crónicas: Dirigida a detectar patologías que lo inhabiliten como donante. En caso de exclusión permanente, explicarle que nunca debe donar sangre y por qué. r) Pérdida inexplicable de peso: El peso es el parámetro biomédico de gran importancia. En el adulto tiende a mantenerse estable en el tiempo. La ganancia de peso por sobre los valores normales para estatura y sexo se definen como obesidad. La pérdida injustificada de peso (4 - 5 Kg. y más en los últimos meses sin causa aparente) puede constituir un elemento de juicio médico indicador de enfermedad crónica como: cáncer, SIDA, TBC, hipertiroidismo, anorexia psicógena, etc. Por lo tanto, constituye motivo de rechazo como donante de sangre. Hace excepción la baja de peso motivada por régimen, asistida por médico. § ¿EN LOS ÚLTIMOS 12 MESES LE HAN PUESTO SANGRE A USTED O A SUPAREJA SEXUAL? NO: Acepte al donante. SI: Se excluye hasta cumplir 12 meses desde el momento de la transfusión. Consultar la causa de la transfusión y registrarla en el cuestionario. § • • • § PARA SER RESPONDIDO SOLO POR MUJERES:¿EN LOS ÚLTIMOS 6 MESES HA TENIDO EMBARAZO, PARTO O ABORTO? INFORMACIÓN ADICIONAL: durante el embarazo, especialmente en los últimos meses, una cantidad importante de fierro es transferida de la madre al feto. Es importante dar tiempo para que este fierro perdido sea reemplazado a través de la dieta. OBLIGATORIO: no debe donar si: Hay embarazo actual Se trató de embarazo molar invasivo Se trató de embarazo molar no invasivo que está bajo tratamiento y estudio. SI: Diferir por un periodo de seis meses post parto con o sin lactancia. ¿TIENE ANTECEDENTES DE EPILEPSIA, CONVULSIONES O DESMAYOS? Dirigido a detectar personas que hayan sufrido desmayos frente a estímulos banales (stress, extracción de sangre, etc.), durante su vida adulta, o que estén en tratamiento por epilepsia. NO: Acepte al donante. SI:Se excluye si ha presentado desmayos frente a estímulos banales (stress, extracción de sangre, etc.) y si está en tratamiento por epilepsia. Se acepta si ha cumplido 3 años sin crisis y sin tratamiento para la epilepsia. § ¿TIENE O HA TENIDO HEPATITIS DESPUÉS DE LOS 12 AÑOS? Dirigida a detectar antecedentes de hepatitis viral. Es necesario en algunos casos explicar el término hepatitis en base a "ponerse amarillo". NO: Se acepta al donante. SI:Se excluye. Debe instruírsele en que nunca puede ser un donante de sangre. Solo se acepta un donante que refiere ictericia de causa obstructiva comprobada. Si 17 ____________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL documenta una hepatitis de tipo A, puede ser aceptado como donante, si han pasado más de 12 meses de su recuperación. § ¿HA RECIBIDO TRATAMIENTO CON HORMONA DE CRECIMIENTO ANTES DE 1985? No debe donar si ha recibido gonadotrofinahipofisaria u hormona de crecimiento de origen humano. § ¿HA VIVIDO EN INGLATERRA ENTRE LOS AÑOS 1980 Y 1996 O HA RECIBIDO ALLÍ TRANSFUSIÓN DE ALGÚN COMPONENTE SANGUÍNEO? § ¿TIENE HISTORIA FAMILIAR DE LA ENFERMEDAD DE CREUTZFELDT JAKOB? Estas preguntas están enfocadas a prevenir la transmisión de la enfermedad de Creutzfeldt-Jakob, una alteración rara, degenerativa y fatal del sistema nervioso. No se ha demostrado aún la transmisión de la enfermedad por la transfusión sanguínea, sin embargo, no hay test para detectar la enfermedad, por lo tanto, se recomienda que no donen sangre aquellas personas que han recibido hormona del crecimiento de origen humano, Hormona Pituitaria de origen humano o injertos de duramadre o quienes tienen algún familiar que padezca de la enfermedad de Creutzfeldt-Jakob. NO: Se acepta como donante. SI: Se excluye en forma definitiva si la hormona recibida es de origen humano o con historial familiar de la Enfermedad de Creutzfeldt-Jakob. § ¿USTED O SU FAMILIA TIENE(N) ENFERMEDAD DE CHAGAS O HA(N) SIDO PICADO POR UNA VINCHUCA? Destinado a pesquisar donantes portadores del agente causal de la enfermedad de Chagas. NO: Se acepta como donante SI:Excluirlo en forma definitiva § ¿HA VIAJADO FUERA DE CHILE EN LOS ÚLTIMOS 3 AÑOS? § ¿HA TENIDO MALARIA, DENGUE O FIEBRE INEXPLICABLE DURANTE O DESPUÉS DE UN VIAJE FUERA DE CHILE? Estas preguntas están enfocadas a prevenir la transmisión de enfermedades parasitarias y otras tales como la Malaria, Babeiosis, y otras infecciones como el Dengue. Las personas deben detallar su estadía en las zonas endémicas para ser diferidas temporal o definitivamente. La Historia de Babesiosis, Dengue es causal de exclusión definitiva. NO: SI: Se acepta como donante Se evalúa la condición de diferido o excluido. Para la malaria, se recomienda que aquellos que la han tenido, deben ser diferidos por tres añosdesde que se vuelven asintomáticos, diferir por un año a aquellos que han estado en alguna zona endémica para malaria (ver anexo zonas endémicas), y diferir por tres años a aquellos que han vivido en una zona endémica. Exposición al riesgo con o sin profilaxis, excluir por 3 años. 18 ___________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL § EN LOS ÚLTIMOS 12 MESES, ¿UD. O SU PAREJA SE HAN REALIZADO ALGÚN TATUAJE, PIERCING, ACUPUNTURA, O HA SUFRIDO ALGÚN PINCHAZO ACCIDENTAL CON AGUJA O JERINGA CON SANGRE? Dirigida también a la identificación de personas que pueden estar en fase de incubación de VIH, hepatitis u otra infección de transmisión sanguínea. Personal de salud no se considera grupo de riesgo, a menos que haya sufrido accidentes corto-punzantes con material presuntamente contaminado, en los últimos 12 meses, en cuyo caso debe excluirse por igual periodo. NO: Se acepta al donante. Si: Tatuajes: se excluye por un periodo de 12 meses Acupuntura y perforación auricular: se excluye por un periodo de 12 meses NOTA: preguntar por tratamientos inyectables con material no desechable, ya que sería causal de exclusión. § § § § § • § ¿HA COMPARTIDO AGUJA O JERINGA CON OTRA PERSONA? ¿HA PROBADO ALGÚN TIPO DE DROGA COMO MARIHUANA, COCAÍNA, PASTA BASE U OTRA? ¿SE HA INYECADO DROGAS ILEGALES NO INDICADAS POR UN MÉDICO? ¿HA TENIDO RELACIONES SEXUALES CON ALGUIEN QUE ALGUNA VEZ SE HAYA INYECTADO DROGAS? Dirigido a detectar personas que están en riesgo de infección por VIH y otras enfermedades infecciosas que podrían ser transmitidas al receptor de productos sanguíneos. Averiguar el tipo de droga, el período en que se consumió, excluir en forma permanente si es drogadicto crónico, drogadicto endovenoso, o si ha tenido conductas de riesgo en los últimos 12 meses, producto de su drogadicción. ADICCIÓN Y ABUSO DE DROGAS: INFORMACIÓN ADICIONAL: la inyección de drogas ha sido vinculada con la transmisión de muchas infecciones, incluyendo la Hepatitis B y el VIH. Puede que pasen muchos años antes de la aparición de la infección y muchos consumidores de drogas no tienen conciencia que pueden ser transmisores de infección años después de la última vez que consumieron drogas OBLIGATORIO: Rechazar si: ha usado drogas endovenosas ilegales no prescritas por un médico: rechazo permanente. ¿HA ESTADO PRIVADO DE LIBERTAD EN LOS ÚLTIMOS 12 MESES? Los individuos que han estado en una institución correccional (cárcel o prisión), por más de 72 hrs. consecutivas, se excluyen como donantes por 12 meses desde la fecha de última detención, por riesgo de conducta sexual y/o drogas. NO: SI: § § § § § Se acepta como donante Se excluye por un periodo de 12 meses. ¿HA TENIDO ENFERMEDAD DE TRANSMISIÓN SEXUAL COMO SÍFILIS, GONORREA U OTRA? ¿HA TENIDO RELACIONES SEXUALES CON UNA PAREJA NUEVA EN LOS ÚLTIMOS 12 MESES? ¿HA TENIDO RELACIONES SEXUALES CON MÁS DE UNA PERSONA EN LOS ÚLTIMOS 12 MESES? ¿HA PAGADO O RECIBIDO DINERO, DROGA U OTRO, POR TENER RELACIONES SEXUALES EN LOS ÚLTIMOS 12 MESES? ¿CREE HABER TENIDO ALGUNA VEZ RIESGO DE INFECTARSE CON VIH? 19 ____________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL Preguntas dirigidas a detectar personas que están en riesgo de infección por VIH y otras enfermedades infecciosas que podrían ser transmitidas al receptor de productos sanguíneos. NO: Se acepta como donante. SI: Evaluar el riesgo real y la promiscuidad de la conducta sexual. Si es el caso, excluir por 12 meses § ¿HA TENIDO CONTACTO SEXUAL CON ENFERMO O PORTADOR CRÓNICO DE HEPATITIS B o CEN LOS ÚLTIMOS 12 MESES? Dirigida a identificar pacientes que pueden estar en fase de incubación de Hepatitis. Consultar Norma. NO: SI: Se acepta Donantes con antecedentes de este tipo de contacto se excluyen por 12 meses. ANTES DE TERMINAR LA ENTREVISTA, ES NECESARIO INDAGAR SI EL DONANTE: § QUIERE DONAR SANGRE PARA HACERSE EL EXAMEN DEL SIDA Si es así consultar la razón y enviarlo a los consultorios de CONASIDA en que lo hacen en forma gratuita. NO: SI: § Se acepta como donante Excluirlo como donante VIENE A DONAR SANGRE POR DINERO Dirigida a detectar donantes pagados. Explicar en forma clara y precisa la inconveniencia de la donación pagada. Asegurarse que el donante comprendió el concepto. Se le otorga al donante la oportunidad de aclarar sus motivaciones para donar sangre. NO: SI: Se acepta como donante Excluirlo en forma transitoria, asegurándose que él comprendió el concepto. CONSENTIMIENTO INFORMADO Dirigido a comprometer la responsabilidad del donante en cuanto a la comprensión del procedimiento y la veracidad de la información por el entregada. Con su firma autoriza la realización de los exámenes para detectar infecciones transmisibles por vía sanguínea, de acuerdo a las normas vigentes. NOTA: Cualquier duda que se le presente frente a las respuestas entregadas por un donante, y que signifique aplicar un criterio diferente al escrito en este manual, o aparezcan aspectos no consignados en él deben ser aclarados oportunamente con sus instructores o el médico a cargo del servicio de sangre. 20 ___________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL PROCEDIMIENTOS A UTILIZAR EN LA ATENCION Y SELECCION DE UN DONANTE DE SANGRE I.- DETERMINACION DE Hb UTILIZANDO SULFATO DE COBRE. PRINCIPIO: Se basa en la gravedad específica. Una gota de sangre introducida en una solución de Sulfato de Cobre queda encapsulada por proteinato de cobre, que evita cualquier cambio de gravedad específica durante 15 segundos. Si la gota tiene una gravedad específica superior a la solución, caerá en 15 segundos. Si no es así, la gota oscilará, permanecerá suspendida o subirá hacia la superficie de la solución. Es una prueba cualitativa que demuestra sólo si la hemoglobina se encuentra por encima o por debajo de límites aceptables. MUESTRA: Sangre, obtenida por punción capilar del pulpejo del dedo, de acuerdo a procedimiento estandarizado. MATERIALES: 1- 23456- Soluciones de Sulfato de Cobre de densidad 1.053 para Hombres, la que corresponde a una Hb. de 12,5 grs./dl y de 1.052 para Mujeres, que corresponde a una Hb. de 12,0 grs./dl. Para preparar estas soluciones pese 89 grs. de sulfato de cobre y agregue agua destilada csp 1000cc.Mida la densidad y ajústela a 1.053 agregando más agua o sulfato según corresponda. Para preparar una solución de densidad 1052 agregue a un litro de solución preparada de la forma anterior 40 cc. de agua destilada y ajuste la densidad. Estas soluciones deben almacenarse a Tº ambiente y en recipientes cerrados para evitar su evaporación. Dos vasos pp. de 6-10 cm. de alto. Lancetas estériles. Tórulas de algodón. Alcohol Yodado. Capilares heparinizados. PROCEDIMIENTO: 1.Coloque 75-80 ml. de cada solución en 1 vaso pp. que tenga 6-10 cms. de alto, limpio y seco. Estos vasos deben estar rotulados HOMBRES o MUJERES según corresponda. Cambiar las soluciones cada vez que haya cambio de turno o después de 30 determinaciones. Antes de usar las soluciones mezclarlas bien. 2.- Limpie la zona de la piel donde se va a efectuar la punción (pulpejo del dedo) con alcohol yodado, deje secar. Pinche el dedo firmemente, cerca del extremo distal y ligeramente lateral, con una lanceta estéril. Descarte la lanceta en el recipiente destinado al material cortopunzante. Es importante un buen flujo libre de sangre. No comprimir repetidamente el dedo, ya que esto puede diluir la gota de sangre con un exceso de líquido tisular y dar resultados falsamente bajos. 3.- Recoja la sangre en un tubo capilar con anticoagulante impidiendo que penetre aire en su interior. 21 ____________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 4.- Deje caer suavemente del tubo capilar 1 gota de sangre desde una altura de aproximadamente 1 cm. sobre la superficie de la solución de Sulfato de Cobre. 5.- Observe durante 15 segundos. Si la gota de sangre se va al fondo, el nivel de Hb. está sobre el mínimo aceptable para donar sangre. Si la gota queda en la superficie o bien cae y luego se devuelve, significa que el nivel de Hb. está bajo el mínimo aceptable para donar sangre. Compruebe esto haciendo un microhematocrito. REGISTRO DE RESULTADOS: Los resultados quedarán registrados en la Ficha de Donante. CONTROL DE CALIDAD: 1.- Realícelo cada vez que se prepare una nueva solución de Sulfato de Cobre. 2.- Seleccione muestras de sangre tomadas con anticoagulante y de Hb. conocidas, que estén entre 0,5 - 1,0 gr./dl bajo y sobre el rango aceptado respectivamente. 3.- Lleve a cabo la técnica de acuerdo a lo detallado en el procedimiento. 4.- Anote sus resultados en el registro de control de calidad. NIVELES MINIMOS DE HEMOGLOBINA Y HEMATOCRITO EN DONANTES DE SANGRE ORIGEN DE LA MUESTRA DEDO O VENA METODO NIVEL MINIMO HOMBRES MUJERES Hb 125 g/l 12.5 g/dl 120 g/l 12.0 g/dl Hto 0,38 38% 1.050 0,36 36% 1.052 Sulfato de cobre NOTA: Puede presentarse resultados falsos debido a un exceso de proteínas o a un alto recuento de leucocitos en la muestra. II.-DETERMINACION DE HEMOGLOBINA EN DONANTES DE SANGRE CON EL METODO HEMOCUE PRINCIPIO Este método determina la concentración de hemoglobina como metahemoglobina, a dos longitudes de onda (570 y 880 mm) sin necesidad de dilución de la muestra. Para la realización de esta técnica se cuenta con microcubetas que contienen el reactivo (desoxicolato sódico) seco y un fotómetro destinado a la lectura de la muestra, el que está calibrado sobre la base del método internacional de referencia para la determinación de Hb que es la hemocianhemoglobina (HiCN) INSUMOS NECESARIOS 1. Fotómetro para lectura de HemoCue 2. Cubeta control de HemoCue 22 ___________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 3. 4. 5. 6. 7. Microcubetas HemoCue para determinación Lancetas desechables Algodón Desinfectante Caja de descarte de material cortopunzante CONTROL DE CALIDAD Realizar cada día al iniciar el trabajo: Ø Chequee en Nº de serie del equipo y de la cubeta de control Ø Coloque en ON el aparato Ø Tire el porta cubeta hacia la posición de inserción de la muestra. La pantalla mostrará las letras "Hb". Ø Después de 6 segundos aparece la palabra "READY" en la pantalla Ø Coloque la cubeta roja standard de control en el porta cubeta y empújelo hacia la posición de medición. La pantalla mostrará la palabra "MEASURING". Ø Después de 10-15 segundos se completa la medición y el fotómetro muestra el valor en g/dL. En el registro de control de calidad anote este valor, el Nº de serie de la cubeta, el valor standard de la cubeta de control utilizada y el Nº de lote de las microcubetas que utilizará en las determinaciones de los donantes. El valor del control no debe desviarse del valor standard más de +/-0.3 g/dL. Ø Si el standard está fuera de rango aceptable, limpie el porta cubeta, séquelo completamente y vuelva a realizar la determinación del estándar. Si continua fuera del rango aceptable, informe al TM. Jefe. Ø Si el equipo no puede ser calibrado, utilice el método alternativo determinado para estos casos. MANEJO DE LAS MICROCUBETAS DEL HEMOCUE 1. Coloque la fecha al set de microcubetas cada vez que este se abre por primera vez Ø Las microcubetas son estables por 90 días a partir de la apertura del set. 2. Retire solo las microcubetas que utilizará para los test inmediatos 3. Los reactivos incluidos en la microcubeta son sensibles a la humedad por lo que debe guardarlas con un desecador. 4. COLOQUE LA TAPA INMEDIATAMENTE DESPUES DE HABER RETIRADO CADA MICROCUBETA DEL CONTENEDOR. 5. Las microcubetas que no se ha usado deben permanecer en el contenedor original. 6. Debido a que este es un método fotocolorimétrico, es importante no tomar las microcubetas por el lado donde se realizará la lectura 7. Mantenga las microcubetas almacenadas entre 15 a 30ºC. No refrigerar. PROCEDIMIENTO 1. Coloque el fotómetro en ON. Asegúrese que el portacubeta está afuera (para colocar la microcubeta). Cuando parpadea la palabra READY en la pantalla, el fotómetro está listo para usar. El aparato muestra en la pantalla la sigla Hb durante 2 segundos cuando está funcionando. 2. Utilice siempre guantes mientras realiza la punción capilar y manipula las microcubetas. Cámbiese guantes entre cada donante. 3. La forma y partes de la cubeta se observa en la figura Nº1. 4. Saque una microcubeta nueva del contenedor, tomándola por el lado de sostén y no de lectura. 5. Realice la punción capilar de acuerdo a lo descrito en el procedimiento en este Manual 6. Asegúrese de lograr una gota de sangre que llene completamente la cubeta. 23 ____________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 7. Tomar la cubeta por la parte posterior y poner en contacto con la sangre la porción donde se encuentran los reactivos de manera de llenarla completamente por capilaridad. Evite contaminar el ojo óptico. No rellene la cubeta. Si hay burbujas de aire en el ojo óptico de la cubeta debido a un lleno inadecuado de la cubeta, debe descartarla y utilizar una nueva para realizar el test. 8. Una vez llenada completamente, limpie el exterior de la cubeta con un papel absorbente limpio. No tocar la ranura de la microcubeta. 9. Coloque la cubeta en el portacubeta del fotómetro. 10. Empuje el portacubeta hacia adentro. Una vez que el brazo alcanza la posición de lectura, aparece en pantalla el mensaje MEASURING. 11. Después de 30-50 segundos se logra el estado estable de la reacción química y el fotómetro muestra en pantalla el resultado. El valor aparece durante 5 minutos si la cubeta ha permanecido en la posición de lectura. Después de 5 minutos la pantalla muestra la sigla Hb. 12. Una nueva lectura puede realizarse si se lleva hacia fuera el porta cubeta, se espera que aparezca en pantalla la palabra READY, se coloca una nueva muestra y se vuelve el portacubeta a la posición de lectura. Estas nuevas lecturas demorarán solo 10-20 segundos para mostrar el resultado en la pantalla. 13. Registre el valor de hemoglobina obtenido en el lugar correspondiente del cuestionario al donante. 14. Realice una segunda lectura de la muestra y anótela en el registro correspondiente. 15. Elimine las microcubetas en el contenedor de desechos una vez finalizada la técnica. 16. Si la segunda lectura de una muestra se diferencia de la primera en más de +/-0.3 g/dL, la lectura no es válida. Repita el método desde el paso 5. Si nuevamente los resultados no son válidos, notifique al TM. jefe para recibir instrucciones. 17. Si aparece un código de error en el procedimiento, siga el siguiente procedimiento: 18. Apague el equipo. Si el fotómetro tiene baterías recargables, manténgalas en el cargador mientras no está en uso. 19. Limpie el porta cubeta todos los días con alcohol o una solución jabonosa suave, retirándolo del fotómetro. Es importante que el portacubeta esté completamente seco antes de volver a colocarlo en el equipo. 20. Guarde y traslade el fotómetro dentro de su caja III.- TECNICA EN LAMINA PARA CONTROLAR ANTIGENOS ABO EN GLOBULOS ROJOS.(No debe usarse como técnica para definir ABO en donantes o pacientes) PRINCIPIO: Se basa en la detección de antígenos A y B presentes en el glóbulo rojo mediante antisueros específicos. MUESTRA. Sangre obtenida por punción capilar del pulpejo del dedo, según lo descrito en el procedimiento estandarizado. MATERIALES. - Lanceta estéril - Tórulas de algodón - Desinfectante - Lámina de vidrio - Sueros clasificadores para ABO - Fuente de luz para lectura 24 ___________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL - Baguetas PROCEDIMIENTO. 1.-Coloque en una lámina limpia y seca una gota de cada uno de los antisueros, primero anti-A, después anti-B y finalmente anti-AB. 2.- Proceda a realizar una punción capilar en el pulpejo del dedo según el procedimiento estandarizado, obteniendo una suficiente cantidad de sangre. Añada a cada gota de antisuero una gota de la muestra de sangre, teniendo cuidado de dejarla caer libremente sin contaminar el capilar con antisuero. 3.- Mezcle bien utilizando baguetas diferentes, los antisueros con la sangre. La mezcla debe esparcirse en un área de aproximadamente 20 mm. de diámetro. 4.- Balancee suavemente la lámina durante 2 min. 5.- Observe la lámina en busca de aglutinación frente a una fuente de luz. La aglutinación de los glóbulos rojos en presencia de cualquier antisuero para la tipificación ABO, constituye un resultado positivo. Una suspensión uniforme de los glóbulos rojos es un resultado negativo. Realice la interpretación de acuerdo al siguiente esquema: GRUPO ABO AB-I A-II B-III O-IV anti-A + + - anti-B + + - anti-AB + + + - 6.- Después de usar las láminas, póngalas en una solución de Cloro al 0,5% por 30 minutos antes de lavarlas. CONTROL DE CALIDAD: 1.- Observe diariamente el aspecto de los sueros clasificadores. Los antisueros deberán ser claros y transparentes, si se observa turbidez o cambio de color no deben usarse. 2.- Diariamente deberá realizar controles positivos y negativos: ANTISUERO anti-A anti-B anti-AB 3.- CONTROL + G.R. A2 G.R. B G.R. A2B CONTROL G.R. B G.R. A1 G.R. O Anote los resultados en el registro de Control de Calidad. NOTA: Este método no debe considerarse útil para informar un grupo sanguíneo, dada su baja sensibilidad y el alto porcentaje de error que presenta, solo puede ser usado para tamizaje. 25 ____________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL IV.- CONTROL DE CALIDAD DEL PROCEDIMIENTO DE EXTRACCION EN UN DONANTE DE SANGRE. 1.- CULTIVO BACTERIOLÓGICO DEL SITIO DE PUNCIÓN. Debe realizarlo una vez al mes o según lo establezca el manual de procedimientos del servicio, para lo cual elegirá un donante al azar, efectuando el siguiente procedimiento: 1.-Usando una tórula estéril tome una muestra del brazo del donante, en el sitio elegido para realizar la flebotomía, antes de limpiar la zona. 2.- Tome otra muestra después de realizada la limpieza de esta zona. 3.- Envíe ambas muestras al laboratorio de bacteriología para su cultivo. En el laboratorio de bacteriología las muestras se cultivarán por 48 horas en un medio de agar sangre. El resultado ( de la muestra post limpieza) del cultivo debe ser negativo, de lo contrario deberá investigar y corregir la causa. Los resultados obtenidos quedarán anotados en un registro especial para estos fines. 2.- CULTIVO BACTERIOLÓGICO DE LAS UNIDADES DE SANGRE. Debe realizarlo una vez al mes, eligiendo al azar una bolsa de sangre que sea no reactiva para las enfermedades de transmisión sanguínea. Preferentemente elegir bolsas que tengan más de 15 días de extracción y de aspecto dudoso. Esta bolsa será enviada al laboratorio de bacteriología donde será cultivada en caldo de tioglicolato en una proporción de 1:10 (use una muestra de sangre de por lo menos 10 ml.). Las muestras deberán incubarse a 37ºC durante 7 días, al tercer y quinto día se harán subcultivos. Los resultados obtenidos se anotarán en el registro dispuesto para estos fines. De acuerdo a los resultados deben tomarse las medidas correspondientes. 3.- CONTROL DE CALIDAD DEL VOLUMEN DE SANGRE EXTRAÍDO A CADA DONANTE. Debe controlar el 1% de todas las unidades de sangre. Controlará dos aspectos: a) Que el volumen de sangre extraído a cada donante en tubos pilotos, ya sea para uso del Banco de Sangre u otros laboratorios, no exceda, bajo ningún concepto los 30 ml. b) Que el volumen de sangre extraído en cada bolsa, sea de 450 +/- 50 ml. Esto lo deberá controlar el TM. responsable de la unidad, pesando diariamente 6 bolsas de sangre, tomadas al azar (3 en el turno de mañana y 3 en el turno de tarde). El peso de las bolsas vacías debe ser determinado para cada marca comercial por el TM. responsable de la unidad. DETERMINACIÓN DEL PESO DE LAS BOLSAS: Considere que 1 ml. de sangre pesa 1,052 grs. (suponiendo una Hb. de 12,0 gr./dl). Por lo tanto cada bolsa debe pesar: 473 +/- 52 grs. + PESO DE LA BOLSA CON ANTICOAGULANTE Debe anotar los resultados en un registro especialmente dispuesto para estos fines. En caso de detectar anomalías debe tomar las medidas correspondientes para corregir el error. 26 ___________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL V.- MEDICION DE LA PRESION ARTERIAL La medición de la presión arterial se obtiene mediante el uso de un manómetro de mercurio y/o sistema digital automatizado. Al utilizar el manómetro se persigue auscultar los ruidos del latido arterial mediante un estetoscopio. SELECCIÓN DEL MANGUITO: El tipo de manguito a utilizar dependerá del grosor del brazo de la persona a examinar. Una cámara de goma de un ancho no apropiado a la circunferencia del brazo del paciente entrega mediciones de PA con un error sistemático. Si la cámara es muy ancha, la presión se subestima; por el contrario, si la cámara es muy angosta, la presión se sobreestima, esto es frecuente cuando se usa el manguito de adulto estándar en personas obesas. El ancho de la cámara de goma debe corresponder al 40% de la circunferencia del brazo; dicho de otra forma, el ancho de la cámara multiplicado por 2.5 define la circunferencia de brazo para el cual es adecuado ese manguito en particular: para una circunferencia braquial de 30 cm es adecuada una cámara de un ancho de 12 cm manguito adulto estándar). Para medir la circunferencia de brazo, determine la distancia entre el acromium y el olécranon y marque el punto medio; en ese lugar realice la medición. En un adulto con una circunferencia de entre 26-30 cm, utilice el manguito estándar de adulto. PROCEDIMIENTO: 1. El donante debe estar en posición sentada, con el brazo a la altura del corazón, apoyado en una mesa. Relajado, sin ejercicio exagerado ni emociones fuertes minutos previos al examen. 2. Libere el brazo a examinar de prendas de vestir que puedan ejercer presión adicional a la del esfingomanómetro. 3. Apoye el antebrazo sobre la mesa, incluyendo el codo. El eje del antebrazo con el brazo puede quedar en semiflexión. 4. Disponga el manguito alrededor del brazo ajustado y firme, y de modo que el borde inferior de este quede a 2.5 cm sobre el pliegue del codo. Asegure que el balón neumático está ubicado en la cara interna del brazo. 5. Ubique la arteria radial por palpación. Insufle aire al manguito hasta dejar de percibir dicho pulso radial (presión sistólica palpatoria). Proceda a desinflar el manguito, bajando aproximadamente 3 mm Hg/ segundo. Espere 30 segundos antes de re inflar. 6. Disponga la membrana del estetoscopio sobre la arteria braquial previamente ubicada. Vuelva a insuflar el manguito 20 a 30 mmHg más que la medición hecha en el punto anterior, lo que constituye el nivel máximo de insuflación. 7. Libere el aire de la cámara a una velocidad aproximada de 2 a 4 mm Hg por segundo. EL PRIMER RUIDO que se ausculta corresponde a la PRESION SISTOLICA, siga auscultando cuidadosamente y notará que los ruidos se debilitan y terminan por desaparecer. La desaparición de ruidos marca el punto de la PRESION DIASTOLICA. 8. Registre la presión sistólica y diastólica en números pares e identifique en qué brazo efectuó la medición. 9. Espere 1 a 2 minutos antes de una nueva medición en el mismo brazo. 10. Si la presión sistólica o diastólica esta fuera de los rangos establecidos en las normas, el donante debe ser excluido temporalmente hasta ser evaluado por un médico. PRECAUCIONES: Brazalete ubicado a nivel del corazón. Paciente relajado para que no influya sobre gasto cardíaco y resistencia periférica. Bajar presión con velocidad uniforme. Registrar en que brazo se tomó la presión y en qué posición. 27 ____________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL VI.- PREPARACION DE LA ZONA DE PUNCION VENOSA. La sangre debe extraerse de una vena grande y firme, en un área libre de lesiones. Es aconsejable inspeccionar ambos brazos y aplicar torniquete con una presión de 40-60 mm de Hg. para hacer las venas más prominentes. Una vez seleccionada la mejor vena, se liberará la presión y preparará la zona para la punción. No existe ninguna forma completamente aséptica de preparar una zona de venopuntura, pero se pueden conseguir condiciones higiénicas que garanticen al máximo la obtención de una unidad estéril empleando varios métodos. METODO 1: Prepare un área de 6 cm de diámetro a partir del sitio de punción previsto, utilizando en todo momento material estéril. 1. Limpie vigorosamente la piel del área de punción con jabón acuoso o solución detergente no alcohólica al 15 % (Zefirol o Kabacilin 1: 10.000) durante un mínimo de 15 seg. para eliminar grasa, suciedad, células cutáneas y otros. Hacerlo en un solo sentido (de abajo hacia arriba o de dentro hacia afuera). 2. Elimine el jabón con acetona al 10% en alcohol isopropílico al 70% (1 parte de acetona y 9 partes de alcohol) y deje secar. 3. Aplique tintura de yodo al 3% (PVP en alcohol etílico al 70%) que actúa como antiséptico rápido; dejar secar por solo unos minutos. Mantener la tintura de yodo en frasco oscuro y bien cerrado para evitar evaporación. Altas concentraciones de yodo pueden provocar reacción cutánea. 4. Elimine el yodo con acetona al 10% en alcohol isopropílico al 70%. Dejar secar la superficie. 5. Si la punción no se realiza inmediatamente, cubra el área con gasa estéril. 6. ¡NO VOLVER A PALPAR EL ÁREA! Para donantes sensibles al yodo se puede establecer otro método: METODO 2 Prepare un área de 6 cm de diámetro a partir del sitio de punción previsto, utilizando en todo momento material estéril. 1. Limpie con una solución jabonosa acuosa al 0.7% en compuesto iodóforo (complejo PVP-Yodo o polímero - yodo). Eliminar el exceso de espuma pero no dejar secar el brazo antes del paso siguiente. 2. Aplique solución de complejo iodóforo al 10%. y dejar por 30 seg. Esta solución sólo contiene un 1% de yodo libre y no debe eliminarse antes de la punción. 3. Si la punción no se realiza inmediatamente, cubra el área con gasa estéril. ¡NO VOLVER A PALPAR EL ÁREA! 28 ___________________________________________________________________________________________INMUNOHEMATOLOGIA Y BANCO DE SANGRE VII.- PUNCION VENOSA Y EXTRACCION DE SANGRE. 1. Compruebe que la bolsa de extracción, registro, tubos de análisis y otros, tengan la misma identificación entre ellos y el donante (nombre, número etc.). 2. Inspeccione la bolsa en busca de defectos. Aplique presión para verificar que no tiene fallas. La solución de anticoagulante debe ser clara y transparente. 3. Deposite la bolsa a un nivel inferior al del brazo del donante. Asegure el control de la cantidad de sangre a extraer. 4. Clausure temporalmente el ingreso de aire a la bolsa pinzando la tubuladura (tripa) y deje un nudo suelto. 5. Seleccione la vena y prepare la zona a puncionar según el método establecido en el manual de procedimientos, que garantice al máximo la obtención de una unidad estéril. 6. Una vez realizado el procedimiento anterior, aplique nuevamente el torniquete (4 dedos sobre el pliegue del codo) sin tocar el área desinfectada. Solicite al donante que abra y cierre la mano para hacer más prominente la vena previamente seleccionada. 7. Descubra la aguja estéril y puncione inmediatamente con el bisel hacia arriba. Sólo puede usar una vez cada equipo. Fije con tela adhesiva para mantener la aguja en su sitio y cubra con gasa estéril. 8. Abra el cierre provisional y solicite al donante que abra y cierre la mano suave y lentamente 9. Observe y atienda al donante durante toda la extracción a fin de pesquisar en forma oportuna cualquier reacción adversa. 10. Mezcle suavemente la sangre con el anticoagulante, ya sea en forma con agitador mecánico. manual, o 11.Controle cada cierto tiempo que se mantenga un buen flujo sanguíneo para evitar coagulación. La extracción no debe demorar más de 10 minutos. 12. Controle el volumen de sangre extraído. Si se utiliza un sistema de balanza: 1 ml de sangre pesa como mínimo, 1.052 grs., la gravedad específica mínima admisible para mujeres donantes. Una cifra adecuada para usar es 1.062 grs.; una unidad de 405- 495 ml deberá pesar 425-520 grs., más el peso de la bolsa y anticoagulante. 13. Una vez completado el volumen: Libere la presión del torniquete a 20 mm. de Hg. Cerrar el nudo o sellar la tubuladura más cerca de la punción. 14. Recolecte las muestras de sangre para análisis mediante un sistema que evite la contaminación de éstas y de la unidad extraída. Existen varios métodos, uno de ellos puede ser: 29 ____________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL - Obturar la tubuladura más cerca de la punción por sobre el nudo sellado, con una pinza hemostática. - Cortar la tripa por sobre el nudo, asegurándose antes que este pinzada, de modo que la bolsa quede sellada. - Introducir el extremo de la tubuladura que viene del brazo del donante, en el tubo para análisis, abrir la pinza, llenarlo y volver a pinzar. 15. Desinflar y retirar el torniquete. Retirar la aguja del brazo y ejercer presión sobre la gasa por algunos minutos. Desechar la aguja y el resto en un recipiente de paredes duras para evitar lesiones y contaminación del personal. 16. Solicitar al donante que eleve el brazo (codo recto) manteniendo firme la gasa sobre la flebotomía con la otra mano. 17. Exprimir la tubuladura que lleva la sangre hacia dentro de la bolsa, empezando en el punto de sellado y en forma rápida para evitar coagulación. Invertir la bolsa varias veces y dejar que la tubuladura se llene de sangre con anticoagulante 18. Sellar la tubuladura en varios segmentos numerados de manera clara y fácil de leer. 19. Inspeccionar de nuevo la bolsa por si hay defectos. 20. Volver a comprobar la identificación de la bolsa, tubos de análisis y registros con el donante (nombre, número etc.) 21. Dejar la unidad en refrigerador a 4ºC., excepto si está destinada a preparar concentrados plaquetarios. 21. Examinar el brazo del donante para verificar que no sangra, colocar un apósito y fijar con tela adhesiva. ETAPAS DE LA EXTRACCIÓN DE SANGRE IDENTIFICAR AL DONANTE INSPECCIONAR EL EQUIPO SELECCIONAR DE LA MEJOR VENA REALIZAR DESINFECCION FLEBOTOMIA TERMINAR DE LA EXTRACCION ENTREGAR RECOMENDACIONES AL DONANTE OFRECER UN REFRIGERIO AGRADECER DONACION 30 ___________________________________________________________________________________________INMUNOHEMATOLOGIA Y BANCO DE SANGRE VIII.- ATENCION DEL DONANTE DESPUES DE LA EXTRACCION 1. El donante debe permanecer acostado en el sillón de donación por unos 5 minutos más, bajo la observación directa del personal de la sala de extracción. 2. Puede sentarse, previa autorización de quien lo atendió, y esperar algunos minutos antes de ponerse de pie; cuando lo haga y camine hasta el área de observación, debe estar acompañado por personal de la unidad de donante. 3. Indicarle ciertas normas o cuidados que debe observar después de la extracción: - - - No marcharse sin que algún miembro del CS/ UMT lo autorice. Beber más líquido del acostumbrado en las 4 hrs. siguientes. No es recomendable beber alcohol. No fumar durante las 2 hrs. siguientes. Si continúa sangrando por el sitio de punción, presionar sobre éste y levantar el brazo. Si siente vértigo o mareo, recostarse o sentarse y poner la cabeza entre las rodillas. Si alguno de los síntomas persiste, volver centro de sangre/ UMT, o consultar un médico. Puede reanudar la actividad normal después de 1 hr. si se siente bien. Si realiza determinado tipo de trabajo que supone riesgo o esfuerzo, se recomienda esperar 12 hr. antes de reanudar su actividad normal. Indicar retirar el apósito pasado algunas horas. 4. Ofrecer de beber leche, jugos u otro refrigerio según lo establecido por cada banco de sangre. 5. Agradecer la donación; animarle a hacer una nueva donación después de transcurrido el intervalo de tiempo recomendado entre una y otra (tres meses). 6. Registrar en el expediente del donante, cualquier reacción que éste haya sufrido. REACCIONES ADVERSAS A LA DONACION DE SANGRE Es muy importante saber cómo proceder frente a una reacción adversa a la extracción.Las reacciones adversas que puede presentar un donante de sangre se clasifican en generalizadas o localizadas en el sitio de punción. I.- REACCIONES LOCALES: a) Hematomas. Es el escape de sangre de la vena hacia el tejido circundante y puede resultar de una mala técnica de punción, traspaso de la vena, sacar la aguja teniendo ligado el brazo, no aplicar suficiente presión cuando se retira la aguja al finalizar la extracción. El hematoma produce dolor y posteriormente cambio de color en la zona por la destrucción de los glóbulos rojos los que liberan hemoglobina. Para una reabsorción más rápida de un hematoma ya instalado, puede colocarse compresas tibias sobre él. Si el donante presenta un hematoma Ud. debe proceder de la siguiente forma: 31 ____________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL ♦ ♦ ♦ Suelte la ligadura y retire la aguja Coloque dos tórulas limpias de algodón sobre el hematoma y haga presión con los dedos por 7 minutos. Puede colocar hielo en la zona por 5 minutos. Si sospecha que ha puncionado una arteria: ♦ ♦ ♦ Desligue y saque la aguja de inmediato. Presione con dos tórulas limpias la zona por 10 minutos Coloque un vendaje compresivo b) Nervio dañado. No es frecuente, pero cuando ocurre el donante manifiesta tener un dolor agudo en todo el brazo el que permanecerá por bastante tiempo. Si sospecha que esto ha ocurrido, retire inmediatamente la aguja del sitio de punción y siga las instrucciones dadas por el médico jefe del Servicio. Es conveniente puncionar venas superficiales, para evitar dañar algún nervio. II.-REACCIONES GENERALIZADAS: a) Síndrome vaso-vagal Se produce por factores síquicos. Los síntomas pueden ser: debilidad, palidez, ansiedad, piel fría y sudorosa, con o sin pérdida del conocimiento, puede haber también nauseas, vómitos y relajación de esfínteres. La presión y el pulso bajan. Si el donante presenta signos como palidez sudoración, desmayo o fatiga durante la donación: 1.-Suspenda la extracción. 2.- Colocar al donante tendido de espaldas y con los pies más altos que la cabeza. 3.- Asegurarse que él tiene las vías aéreas expeditas. 4.-El donante debe inhalar sales de amoníaco. El TM. que lo atiende debe inhalarlas primero para comprobar la intensidad del aroma, ya que si es demasiado fuerte puede afectar las membranas nasales y si es excesivamente suave no es efectivo; deben provocar la tos del donante, lo que elevará su tensión arterial. 5.-Deje reposar al donante en la camilla por un tiempo prudente hasta que se recupere, (15 minutos como mínimo). 6.- Debe permanecer en estricta vigilancia del Tecnólogo Médico a cargo. En caso de agravarse la situación, dé aviso al médico del servicio, o siga las instrucciones entregadas por él. Si el donante presenta signos de un síndrome vaso-vagal después de la donación: 1.-Coloque al donante tendido de espalda y con los pies más altos que la cabeza. 2.- Suéltele el cinturón, la corbata u otra prenda de ropa ajustada. 3.- Verifique que las vías aéreas estén expeditas 4.- Aplique compresas frías sobre la frente 5.-Hágalo inhalar sales de amoníaco, teniendo igual precaución que las ya descritas. 6.- Es muy importante calmarlo y no demostrar nerviosismo 7.- Vigile su estado hasta que el donante se reponga totalmente. 8.- En caso de agravarse la situación del donante, siga las instrucciones entregadas por el médico del Servicio para esta situación. 32 ___________________________________________________________________________________________INMUNOHEMATOLOGIA Y BANCO DE SANGRE Si el donante presenta vómitos o nauseas: 1.- Procure calmarlo y que esté cómodo. 2.- Recomiéndele que respire lenta y profundamente (inspirando por la nariz y botando el aire la boca). 3.- Aplique compresas frías en la frente y/o la nuca. 4.- Vuélvale la cabeza hacia un lado, para evitar que pueda aspirar su propio vómito. 5.- Si el donante vomita, proporciónele un recipiente adecuado y toallas de papel. Asegúrese de mantener la cabeza hacia un lado para evitar que aspire vómito. 6.- Pídale que permanezca tendido hasta que se haya recuperado. 7.- Mantenga al donante bajo continua vigilancia hasta que se haya recuperado totalmente. 8.- Ofrézcale agua para enjugarse la boca. b) Tetania (temblores y espasmos musculares): Cuando el donante se encuentra ansioso y nervioso, puede comenzar a respirar rápidamente y profundamente, esta hiperventilación trae como consecuencia una pérdida excesiva de CO2 generando un estado de alcalosis, que produce ligeros temblores musculares y espasmos tetánicos de las manos y la cara, pudiendo llegar a presentar convulsiones e inconsciencia. Observe al donante durante la extracción procurando mantenerlo siempre calmado, y para detectar la aparición de alguno de estos síntomas. Si el donante está hiperventilando puede interrumpir el proceso con algún tema de conversación para distraer su atención. Si el donante de sangre presenta los síntomas descritos, proceda como sigue: 1. Suspenda la extracción. 2. Haga que el donante respire durante un rato dentro de una bolsa de papel. 3. Espere que se relaje (no forzar el brazo). 4. Si presenta convulsiones pida ayuda para evitar que se lastime. 5. Mantenga al dador bajo vigilancia directa y controle pulso y presión. 6. No administrar oxígeno. c) Convulsiones verdaderas (epilepsia) 1. Pida ayuda para evitar que se lastime. 2. Impida que se muerda la lengua, colocando una gasa estéril 3. Avise de inmediato al médico jefe del servicio. bajo la lengua. d) Problemas cardíacos. Se pueden observar con muy poca frecuencia, pero si sospecha que el donante presenta problemas cardíacos avise de inmediato al médico jefe del servicio. 33 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL REGISTROS Uno de los elementos más importantes de un sistema de Garantía de Calidad son los registros. Ellos pueden ser de diverso tipo y cumplir varios objetivos. A continuación mostramos algunos ejemplos de registros a usar en la unidad de donante de sangre CONTROL BACTERIOLOGICO DEL SITIO DE PUNCION FECHA Nº DADOR FLEBOTO MISTA RESULTADO MUESTRA PREVIA RESULTADO MUESTRA POSTERIOR COMENTARIOS CONTROL DE VOLUMEN DE SANGRE EXTRAIDA AL DONANTE FECHA 34 Nº DADOR PESO DE LA BOLSA VOLUMEN EXTRAÍDO FLEBOTOMISTA COMENTARIO ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL TRANSPORTE DE SANGRE Para estos fines es indispensable contar con un programa de control de calidad que garantice que la sangre a usar en transfusiones, desde este punto de vista es segura. Es muy importante vigilar la integridad de las bolsas de sangre, es recomendable realizar cultivos si se observa que el aspecto de la sangre y de los componentes no es normal, o si el paciente experimenta una reacción adversa que clínicamente pueda ser debida a algún tipo de contaminación en la sangre del donante. Las técnicas elegidas para el cultivo de la sangre deben seleccionarse cuidadosamente para obtener un buen rendimiento, y el Banco de Sangre debe verificar que se han realizado de forma adecuada. Algunos aspectos a considerar son: READMISION DE UNIDADES DE SANGRE La sangre devuelta al Banco no debe destinarse nuevamente a la transfusión, hasta que no se hayan comprobado los siguientes puntos: El cierre de la bolsa no debe haber sido abierto ni manipulado de ninguna forma. Esto garantiza que se ha mantenido la esterilidad. La sangre debe en todo momento haberse mantenido entre 1 y 10_C, preferentemente entre 1 y 6 _C. El hecho de que la sangre alcance temperaturas superiores a estos valores, aunque se enfríe posteriormente, tiende a acelerar el metabolismo de los eritrocitos, provoca la hemólisis y puede permitir el crecimiento bacteriano en la unidad. Muchos servicios de transfusión no consideran válidas las unidades de sangre que hayan permanecido fuera de un refrigerador controlado por más de 30 minutos. Si la sangre cumple las normas establecidas para ser utilizada, al menos un segmento sellado del tubo de conexión con el donante debe permanecer adosado a la bolsa, para ser usado en las pruebas cruzadas. Los registros deben indicar que la sangre ha sido readmitida y considerada apta para ser utilizada y que ha sido inspeccionada previamente. Debe existir un TM. responsable de este hecho. TRANSPORTE DE LA SANGRE Y COMPONENTES SANGUINEOS La temperatura de la sangre y de los concentrados de eritrocitos debe mantenerse en todo momento entre 1 y 10ºC durante el transporte. Esto se puede conseguir empleando cajas resistentes y bien aisladas y/o, que contengan suficiente material refrigerante, siendo el más recomendado para la mayoría de los envíos, el hielo húmedo en recipientes impermeables, como bolsas plásticas. Sin embargo los cubitos de hielo excesivamente fríos, el hielo envasado y el hielo seco, no deben emplearse para transportar o almacenar sangre total o eritrocitos ya que pueden hacer bajar tanto la temperatura en el recipiente que se produzca la hemólisis de los eritrocitos más próximos. La sangre transportada por vía aérea puede congelarse si se transporta en un compartimento no presurizado. Los compartimentos de carga de los autobuses y camiones alcanzan a menudo temperaturas superiores a los 38ºC. La temperatura de la 35 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL sangre y de los componentes debe controlarse rigurosamente durante el transporte con algún sistema de registro de temperatura y también en el momento de la recepción. El hielo debe colocarse encima de la sangre, ya que el aire frío se mueve hacia abajo. Durante los viajes largos con altas temperaturas, el hielo y la sangre deben estar en contacto directo, ya que si quedan separados por una lámina de cartón o una franja de aire se produce un aislamiento interno que no permite que el hielo proteja adecuadamente la sangre de las altas temperaturas del entorno. Es necesario colocar hielo húmedo encima y debajo de la sangre si el tiempo es muy caluroso o si el viaje dura varias horas. El hielo húmedo utilizado en cubos es mejor que en láminas o en trozos porque se derrite más lentamente. En las cajas enviadas a grandes distancias o en condiciones ambientales de elevada temperatura, el volumen de hielo debe ser, como mínimo, igual al de la sangre. En un recipiente aislado se puede considerar que la temperatura está entre 1 y 6ºC mientras que quede hielo sin derretir. El control de la temperatura de la sangre y los eritrocitos durante el transporte puede poner de manifiesto la necesidad de mejorar el aislamiento de los recipientes o de colocar en ellos una mayor cantidad de hielo. En los envases debe periódicamente colocarse controles para el registro de las temperaturas. Los registros de temperatura deben ser completados y remitidos a su origen por el personal del Banco de Sangre que recibe el envío, para poder saber si el aislamiento es correcto y si la cantidad de hielo es adecuada. El personal encargado de enviar o distribuir la sangre, tiene la responsabilidad de garantizar que los sistemas de envío puedan mantener durante el transporte la temperatura de la sangre por debajo de 10ºC. La decisión sobre la utilización de la sangre que ha estado expuesta a temperaturas superiores a los 10ºC debe tomarla, preferentemente, el personal de Tecnólogo Médico calificado. Deben tenerse en cuenta factores como el tiempo y el tipo de transporte, los grados en que la temperatura ha sobrepasado los 10ºC, la presencia de hielo residual en los envases y la aparición de hemólisis. El personal encargado de efectuar los envíos debe ser informado si se registran temperaturas elevadas que no son aceptables. UNIDADES MOVILES DE RECOLECCION Si la sangre se envía desde una unidad móvil de recolección a un centro donde se procesa y se preparan diversos componentes, debe mantenerse en frío a la temperatura anteriormente indicada, excepto en el caso de que esté destinada a la obtención de plaquetas, en que no debe bajar de 20ºC, ya que éstas se separan mejor de la sangre total a temperatura ambiente. Estas unidades deben transportarse desde el área de recolección hasta el lugar de procesamiento lo antes posible, y en el caso de la obtención de plaquetas no deben pasar más de 8 horas entre la recolección y la centrifugación. La sangre almacenada entre 1 y 6ºC alcanza los 10ºC o más si permanece aproximadamente 30 minutos a temperatura ambiente, por este motivo la sangre debe enviarse al centro en un período no superior a los 30 minutos. 36 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL ALMACENAMIENTO Y TRANSPORTE DE HEMOCOMPONENTES COMPONENTE ALMACENAMIENTO EN BANCO DE SANGRE TRANSPORTE Glóbulos rojos en AS-5, 1-6ºC, en refrigerador con No puede permanecer por También leucorreducidos registro de temperatura, más de 30 minutos fuera de en circuito cerrado hasta 42 días un refrigerador con registro de temperatura. Glóbulos rojos o sangre 1-6ºC, en refrigerador con La temperatura de la y de los total en CPD, También registro de temperatura, sangre concentrados de eritrocitos leucorreducidos en circuito hasta 21 días debe mantenerse en todo cerrado momento entre 1 y 10ºC Glóbulos rojos o sangre 1-6ºC, en refrigerador con durante el transporte total en CPD-A, También registro de temperatura, leucorreducidos en circuito hasta 35 días cerrado Glóbulos rojos lavados o 1-6ºC, en refrigerador con circuito abierto registro de temperatura, hasta 24 horas después del lavado Concentrado de Plaquetas 20-22ºC en agitación preparados de sangre total constante hasta 5 días. o por aféresis Expiran 4 horas después de realizar un pool Plasma fresco congelado -18ºC o menos en freezer hasta 1 año. Expira en 4 horas después de hacer pool *El día de expiración corresponde a la medianoche del día final de almacenamiento. GESTION DE STOCK EN BANCO DE SANGRE La gestión del stock de productos sanguíneos en un banco de sangre es un punto administrativo crítico, que necesita de una acuciosa coordinación y que involucra diferentes elementos: a) b) c) d) e) Adquisición Corresponde a la disponibilidad de componentes sanguíneos, lo ideal para estos fines es disponer de un sistema de Captación de Donantes Voluntarios, lo que permite programar y manejar el número de productos disponibles Tratamiento de la sangre Se refiere a las decisiones de fraccionamiento Transporte Disponibilidad en el momento y lugar preciso Almacenamiento Contar con condiciones satisfactorias de almacenamiento en todos los procesos Utilización 37 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL Disponer de un sistema que garantice una utilización adecuada de cada componente sanguíneo. ESTUDIOS PREVIOS PARA GESTIONAR STOCK. Para realizar una adecuada gestión de stock, cada Banco de Sangre debe evaluar los siguientes elementos: 1. 2. 3. 4. 5. 6. 7. 8. 9. Requerimientos de cada componente sanguíneo, de acuerdo a grupo ABO y Rh D. Conocer los recursos humanos, físicos y financieros que dispone. Conocer el sistema administrativo de gestión de pedidos y su frecuencia. Sistema de Identificación y etiquetado de los productos. Sistemas de controles. Mecanismos a seguir cuando se tiene stock mínimo y emergencias inesperadas. Mecanismos para notificar acerca de déficit. Acciones a seguir cuando las solicitudes no pueden ser cumplidas. Procedimientos y registros de distribución, almacenamiento, transporte, productos no conformes, solicitud y entrega de pedido. 10. Cálculo de reservas para afrontar impacto inicial de desastres y catástrofes. 11. Determinar frecuencia de control de estado de inventario. METODOS DE ESTIMACION DE REQUERIMIENTOS DE HEMOCOMPONENTES (STOCK) 1. 2. 3. 4. Correspondería al 2-5% de la población del área. 50 unidades de sangre por 1000 habitantes y por año. 6-7 unidades de sangre por cama de agudos y por año. Uso histórico por grupo y por componente sanguíneo. FACTORES A CONSIDERAR PARA CALCULAR STOCK ÓPTIMO 1. Distancia entre el Centro de Sangre y las Unidades de Medicina Transfusional que abastece. (distancias cortas 15-20%). 2. Condiciones de tránsito y climáticas. 3. Espacio de almacenamiento en los refrigeradores-y freezer. 4. Personal disponible, carga y distribución de trabajo. 5. Frecuencia de las peticiones 6. Vencimiento de componentes sanguíneos 7. Déficit de productos 8. Tipo de cirugías que se realizan en el hospital: traumatología, oncología. (15-20%) 9. Indicación de Transfusión. 10. Relación prueba de compatibilidad hecha / transfusiones realizadas. 11. Satisfacción de la demanda transfusional. 12. Postergación de cirugías 13. Ingresos y egresos de componentes sanguíneos de y a otros hospitales 14. Desarrollo previsto del establecimiento. PROCEDIMIENTO PARA CALCULAR SOLICITUR DE COMPONENTES SANGUÍNEOS DE UMT AL CS. 1. 38 Conocer previamente el stock mínimo y óptimo semanal y diario sanguíneo. por grupo ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 2. 3. 4. 5. 6. 7. 8. Determinar las existencias disponibles por grupos sanguíneos al momento del pedido. Determinar las reservas disponibles. Estar en conocimiento de cirugías y procedimientos programados durante el período que cubrirá el pedido. Considerar eventos y fechas con mayores riesgos en el área. Ejemplo: fiestas, eventos, etc. Calcular las unidades óptimas de componentes sanguíneos por grupo según período a cubrir. Restar a las unidades óptimas calculadas, las existencias disponibles. Analizar si corresponde un aumento extra según análisis. (puntos. 1 y 8) MANEJO DE STOCK EN CENTRO DE SANGRE El Centro de Sangre es el encargado de la captación de donantes, el procesamiento de la sangre y la distribución de los componentes sanguíneos, para ello es fundamental conocer y manejar algunas variables que influirán en su stock disponible. 1. 2. 3. 4. 5. 6. 7. 8. Número de donantes que concurren diario, semanal y mensualmente, y sus variaciones estacionales. Potencial de captación de donantes voluntarios y frecuencias prevista de las donaciones Calcular los stocks mínimos y óptimos. Conocer stock de UMTs (inventario externo). Conocer stock disponible y no disponible del C.S. (inventario interno) Comparar stock óptimo con el existente. Relacionar el stock no disponible con el disponible y colecciones programadas. Hacer solicitud a unidad de fraccionamiento y donantes de acuerdo a las necesidades. REGISTROS DE DESPACHO DE PRODUCTOS DEL C.S. Los registros son un punto crítico de calidad en la gestión de stock, ellos deben contener como mínimo: 1. Detalle de la entrega con Nº de donación, tipo de componente, grupo. 2. Resumen del total de entrega con firma de la persona que despacha y de la que retira. 3. Solicitud desde UMT a CS. 4. Control de Stock. 5. Solicitud de CS a sección de fraccionamiento. ESTRATEGIAS PARA EVITAR VENCIMIENTOS Para una correcta gestión de stock de componentes sanguíneos, es importante cautelar la sobre o sub demanda de productos. Existen varios aspectos que entregan evidencias sobre la calidad de este manejo, entre ellas: 1. Solicitudes de emergencias (fuera de las fechas establecidas de distribución). Si las unidades solicitadas en forma extraordinaria no se utilizan, esto debe tenerse presente. 2. Buena comunicación entre UMTs para intercambiar componentes de grupos sanguíneos escasos, de conservación limitada, etc. 3. Normas claras que establezcan como debe elegir la unidad a transfundir. 4. Normas de indicación de transfusión. (Relación PC/transfusión). 39 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 5. Pautas de solicitud transfusional para cirugía según diagnóstico. 6. Revisión diaria de stock, por fecha de vencimiento de todos los tipos de componentes sanguíneos. 7. Criterios de distribución bien establecidos. 8. Control sobre el uso e indicación de componentes sanguíneos. ANALISIS Y EVALUACION Este proceso debe estar sujeto a permanente análisis y evaluación, para ello debe conocer ciertos indicadores como: 1. Índice de caducidad de los componentes debe ser menor a 7% 2. Índice de Déficit de productos debe ser igual o menor 1%. 3. Frecuencia de envíos de emergencias. 4. Postergación de transfusiones. 5. Cumplimiento de pedidos de componentes. 6. Stock por mes, grupo, tipo de componentes. 7. Unidades no conformes. 8. Unidades intercambiadas. 9. Cumplimiento de captación de donantes y de producción. 40 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL CÁLCULO SEMANAL DE STOCK MÍNIMO HEMOCOMPONENTES = _________ EJ.: grupo O+ A+ B+ AB+ O- semana 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 Total transf= a Valor más alto transf=b c=a-b c/25 stock mín. semanal Stock óptimo = stock mínimo + X % X = Porcentaje calculado en base otros factores ( ) A- B- AB- G.R. O+ 4 15 0 16 15 0 7 12 5 4 24 10 11 13 13 10 10 8 9 10 10 14 13 12 11 8 264 24 c=240 240/25 9.6 41 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL U.M.T. HOSPITAL CARLOS VAN BUREN FECHA. / / HORA: REGISTRO DE EXISTENCIA / PEDIDO CONDICION O+ TRA RET DISP A+ TRA RET DISP B+ TRA RET DISP AB+ TRA RET DISP O- TRA RET DISP A- TRA RET DISP B- TRA RET DISP AB- TRA RET DISP HEMO O+ S E GR EXISTENCIA GLR PFC PSF CPP PLQ SOLICITAMOS NOS REMITAN LOS SIGUIENTES HEMOCOMPONENTES EN EL DÍA DE HO Y PEDIDO : DE / / A / / GRUPO ABO / D A+ B+ AB+ OABABS E S E S E S E S E S E S E GR GLR PFC PSF CPP PLQ NOTA PRODUCTO G.R/GSL PFC/PSF CPP PLQ T.M: EVE TOTAL Nº UNIDADES ENTREGADO POR: FECHA: HORA: RECIBIDO POR: TRANSPORTADO POR: HORA: Manejo de Stock ha sido escrito con la colaboración de la Sra. Mª Cecilia Lyng Falcone, TM Supervisora del Centro de Sangre Valparaíso. 42 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL UNIDAD INMUNOHEMATOLOGIA l Ag Duffy 43 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL UNIDAD INMUNOHEMATOLOGIA INTRODUCCION A LA INMUNOHEMATOLOGIA El Sistema Inmune está compuesto por la piel, órganos linfoides primarios (Timo, Médula Ósea), órganos linfoides secundarios (Bazo y ganglios linfáticos), las células y proteínas asociadas a la defensa del organismo contra lo no propio y lo propio transformado. Podemos dividir a la respuesta inmune según su especificidad en Innata y adaptativa. La Respuesta Inmune Innata (RII) está dirigida contra patrones moleculares comunes a diversos microrganismos o células, su diversidad es limitada asociada a líneas germinales y no presenta respuesta de memoria. Es la primera en reaccionar ante noxas y su función es activar y dirigir a la respuesta inmune adaptativa y mantener una respuesta localizada y controlada mediante citoquinas y quimioquinas. La RII está compuesta por elementos celulares (células dendríticas y células natural killer) y componentes séricos (citoquinas y proteínas del complemento). La Respuesta Inmune adaptativa (RIA)está dirigida contra antígenos pertenecientes a estructuras específicas de microrganismos o células diferentes a las propias, siendo muy diversa en su respuesta, con capacidad para generar memoria inmunológica, lo que permite que su intensidad ante un segundo estímulo sea más rápida y específica. La RIA está compuesta por linfocitos (B y T) y componentes séricos (citoquinas y anticuerpos. La Inmunohematología estudia los procesos inmunológicos asociados a la respuesta a elementos sanguíneos, siendo las más importantes aquellas dirigidas a antígenos eritrocitarios pertenecientes a los diferentes grupos sanguíneos. Otros elementos que pueden iniciar una respuesta inmune son los antígenos leucocitarios, plaquetarios y séricos (ejemplo factores de la coagulación). Los antígenos eritrocitarios son moléculas presentes en la superficie eritrocitaria capaces de iniciar y activar una respuesta inmune (inmunógenos). Estos se caracterizan por ser productos génicos derivados de variantes alélicas, por lo que no todos los individuos presentan una misma composición antigénica. Ante una transfusión eritrocitaria heteróloga, el ingreso de eritrocitos del donante a circulación aportará una gran cantidad de moléculas que podrán ser reconocidas por el sistema inmune como “no propias”, activando una respuesta inmune principalmente humoral del tipo IgM y/o IgG. Esta respuesta dependerá del grado de inmunogenicidad del antígeno y del estado inmunológico del receptor. Las respuestas más importantes son aquellas asociadas a antígenos del grupo sanguíneo ABO y Rh. El grado de gravedad de las respuestas dependerá principalmente de los anticuerpos involucrados y las características de estos en cuanto al isotipo, título, afinidad,avidez, y activación del complemento. Por ejemplo: una reacción a antígenos eritrocitarios mediada por IgM en alto título, podría asociarse a precipitación de complejos inmunes o a la activación de la vía clásica del complemento. Si esta última llega hasta la formación del complejo de ataque a membrana (MAC), se producirá una hemólisis intravascular, con todos los riesgos que esto conlleva. Una reacción mediada por IgG, dependiendo del isotipo, opsonizará al antígeno, permitiendo su reconocimiento por el sistema monocítico-macrofágico, asociándose principalmente a una hemólisis extra-vascular (Recordemos que solo los isotipos IgG 1 y 3 activan complemento). La respuesta humoral se caracteriza por la expansión clonal de todos aquellos linfocitos B que reconozcan al inmunógeno presente, es decir todos aquellos linfocitos cuya región variable reconozca zonas de una misma molécula reconocida como “no propia”. Como las moléculas presentan distintos sitios de reconocimiento, siempre que hablemos de una reacción mediada 44 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL por anticuerpos ante una molécula completa, es decir, ante distintos antígenos de una misma molécula, debemos pensar en una reacción policlonal. Cuando nos refiramos a un proceso caracterizado por la presencia de un solo tipo de anticuerpos, hablaremos de una respuesta monoclonal. Este proceso ocurre in vitro o por biología molecular donde se selecciona y expande un solo clon de linfocitos antígeno específico. Esta estará caracterizada por la presencia de anticuerpos dirigidos contra un solo epitopo, es decir con la misma región variable y provenientes de un clon único de linfocitos B. El diagnóstico inmunohematológico previo a la transfusión es clave para la prevención de reacciones post- transfusionales a antígenos eritrocitarios. Siempre buscaremos la compatibilidad entre el receptor y el donante. Para esto deberemos testear tanto antígenos (es decir eritrocitos) como anticuerpos (suero del paciente o antisueros comerciales) mediante reacciones de inmunoaglutinación o activación del complemento. Es fundamental que exista un gran dominio en los términos de inmunología básica, de tal forma de poder conocerlos y aplicarlos al trabajo diario de una Unidad de medicina transfusional. 45 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL Glosario básico de términos inmunológicos e inmunohematológicos: Término Antígeno Inmunógeno Epitopo Paratopo Idiotipo Isotipo Avidez Afinidad Título Alogénico Respuesta Autóloga Respuesta Heteróloga Suero Monoclonal Suero Policlonal Significado Secuencia molecular reconocida por el sistema inmune. Puede ser de distintas naturalezas (glicosilada, lipídica o proteica) Antígeno capaz de activar una respuesta inmune adaptativa. Región del antígeno reconocida por la región variable del anticuerpo. Puede ser lineal o conformacional. Región del anticuerpo que reconoce y une al epitopo. Se ubica en la fracción Fab (antigen binding fragment). Región del anticuerpo caracterizada por la fracción variable (Fv). Está formada por la región variable de la cadena liviana y pesada. Contiene al paratopo. Región del anticuerpo caracterizada por la fracción cristalizable (Fc) del anticuerpo. Está formado por la cadena pesada. Es determinado genéticamente. Fuerza de interacción no covalente con la que el paratopo une al epitopo. Sumatoria de interacciones que unen a un antígeno con el anticuerpo. Depende de la afinidad y valencia de las interacciones. Concentración sérica del anticuerpo. Se cuantifica mediante diluciones seriadas del suero. Refiere a la respuesta inmune a estructuras variables dentro de una misma especie. Respuesta inmune a estructuras moleculares propias. Asociada a una respuesta autoinmune. Respuesta inmune a estructuras moleculares variables entre individuos de una misma especie. Es secundaria a la presencia de moléculas de otro individuo que generen activación de la respuesta inmune. Antisuero que contiene anticuerpos provenientes de un solo clon linfocitario, por lo tanto todos tendrán la misma región variable dirigida a un epitopo específico. Antisuero que contiene anticuerpos provenientes de distintos clones linfocitarios dirigidos hacia distintos epitopos pertenecientes a una misma molécula REACTIVOS BASICOS A USAR EN INMUNOHEMATOLOGIA Y SERVICIOS DE SANGRE 1.- GENERALIDADES: A.- Definiciones generales: 1.- Mol, peso molecular en gramos: Es el peso, en gramos, de una sustancia igual al peso molecular de la sustancia (sumatoria de los pesos atómicos). 2.- Solución molar: Una solución 1 molar (1M) contiene 1 mol de soluto en 1 litro de solución. Si no se indica lo contrario, el solvente siempre debe suponerse que es agua destilada. 46 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 3.- Solución molal: Una solución molal contiene 1 mol de soluto por Kg. de solvente. Si el solvente es agua, hay poca diferencia práctica entre solución molar y molal. 4.-Equivalente gramo: El peso, en gramos, de una sustancia que producirá o reaccionará con 1 mol de ión hidrógeno. 5.- Solución normal: Una solución 1 normal (1N) contiene el peso de un equivalente gramo de soluto en 1 litro de solución. 6.- Soluciones porcentuales: El porcentaje de una solución da el peso o volumen de soluto presente en 100 unidades de solución total. El porcentaje puede expresarse como: - Peso/peso (p/p), dando gramos de soluto en gramos 100 gramos de solución. - Volumen / volumen (v/v), dando mililitros de soluto en 100 ml de solución. - Peso / volumen (p/v), dando gramos de soluto en 100 ml de solución. Si no se indica lo contrario, se supondrá que una solución expresada en porcentaje corresponde a p/v. B.- Dilución de suero: En las pruebas serológicas, suele emplearse suero diluido para determinar entre otros aspectos, la concentración de un anticuerpo en dicho suero. Normalmente se expresa el volumen de suero diluido en unidades (1), indicando 1 parte de suero contenido en el número total de partes de la dilución. Por ejemplo si se desea diluir 10 veces un suero, debe hacerse una dilución 1/10, mezclando 1 parte de suero concentrado con 9 partes de diluyente, por lo tanto 1/10 no es 1+10 sino 1+9, de manera que el volumen final es 10. Cada una de las 10 partes de la dilución contendrá un décimo (1/10 o 0.1) del suero. Puede prepararse fácilmente una dilución mayor a partir de una menor, añadiendo la cantidad necesaria de diluyente. La fórmula para calcular la cantidad de diluyente a añadir para obtener la nueva dilución mayor deseada es: 𝑉𝑎𝑙𝑜𝑟 𝑟𝑒𝑐í𝑝𝑟𝑜𝑐𝑜 𝑑𝑒 𝑉𝑎𝑙𝑜𝑟 𝑟𝑒𝑐í𝑝𝑟𝑜𝑐𝑜 𝑑𝑒 𝑙𝑎 𝑑𝑖𝑙𝑢𝑐𝑖ó𝑛 𝑎𝑐𝑡𝑢𝑎𝑙 = 𝑙𝑎 𝑑𝑖𝑙𝑢𝑐𝑖ó𝑛 𝑓𝑖𝑛𝑎𝑙 𝑉𝑜𝑙𝑢𝑚𝑒𝑛 𝑑𝑒 𝑑𝑖𝑙𝑢𝑦𝑒𝑛𝑡𝑒 𝑉𝑜𝑙𝑢𝑚𝑒𝑛 𝑓𝑖𝑛𝑎𝑙 𝑡𝑜𝑡𝑎𝑙 EJEMPLO: Se tiene un ml de suero diluido 1/2 y se le añadieron 4 ml de solución salina ¿Cuál será la dilución final? 2 𝑋 1 = = 10 𝑜 𝑑𝑖𝑙𝑢𝑐𝑖ó𝑛 1 5 10 C.- Dilución de soluciones expresadas en porcentaje: Puede preparase diluciones a partir de soluciones más concentradas expresadas en % utilizando la siguiente fórmula: 𝑉𝑜𝑙𝑢𝑚𝑒𝑛 1 𝑥 𝐶𝑜𝑛𝑐𝑒𝑛𝑡𝑟𝑎𝑐𝑖ó𝑛 1 = 𝑉𝑜𝑙𝑢𝑚𝑒𝑛 2 𝑥 𝐶𝑜𝑛𝑐𝑒𝑛𝑡𝑟𝑎𝑐𝑖ó𝑛 2 47 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL V1 X C1 = V2 X C2, donde V1 y C1 representan el volumen y concentración original, y V2 y C2 representan el volumen y la concentración final. D.- Cálculo de la fuerza centrífuga relativa en g: 𝐹𝑅𝐶 𝑒𝑛 𝑔 = 28,38 R ∗ 𝑟𝑝𝑚 1.000 *= Radio del rotor de centrífuga en pulgadas. Los tiempos incluyen el tiempo de aceleración pero no el de deceleración. Son sólo aproximados. Debe evaluarse cada centrífuga para la preparación de cada componente sanguíneo y de cada método de laboratorio. E.- Rangos de temperaturas aceptados en inmunohematología: Cuando se establece en un método una temperatura específica de incubación, los rangos aceptados son: TEMPERATURA ESTABLECIDA 4ºC AMBIENTE 37ºC 56ºC RANGO ACEPTADO 2-8 ºC 20-24 ºC 36-38 ºC 54-58 ºC F.- Tiempos de incubación aceptados en inmunohematología: Debe cumplirse estrictamente los tiempos de incubación establecidos en cada método. Es aconsejable seguir las instrucciones de cada fabricante de antisueros e incluir controles positivos y negativos en cada metodología. INCUBACION ESTABLECIDA CENTRIFUGACION INMEDIATA 1-5 MINUTOS 5-30 MINUTOS 30-120 MINUTOS RANGO ACEPTABLE INMEDIATAMENTE 1-10 MINUTOS 5-60 MINUTOS 30-180 MINUTOS 1.- BUFFER FOSFATO Y BUFFER FOSFATO SALINO 1.- 2.- 3.- 48 Preparar una solución madre ácida (solución A) disolviendo 22.16 g de NaH2PO4 x H2O en 1 litro de agua destilada. Esta solución 0.16 M de la sal fosfato monobásico tiene un pH de 5.0, Preparar una solución madre alcalina (solución B), disolviendo 17.2 g de Na2HPO4 en 1 litro de agua destilada. Esta solución 0.16 M de la sal de fosfato dibásico tiene un pH de 9.0. Preparar soluciones de trabajo del buffer al pH deseado, mezclando volúmenes adecuados de ambas soluciones. Por ejemplo: ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL pH 5.5 7.3 7.7 4.5.- Solución A 94 ml 16 ml 7 ml Solución B 6 ml 84 ml 93 ml Comprobar el pH de la solución de trabajo antes de usarla. Añadir pequeños volúmenes de la solución a o b para alcanzar el pH deseado. Para preparar el BUFFER FOSFATO SALINO (PBS) a un pH deseado, añadir un volumen de buffer fosfato a ese pH a nueve volúmenes de solución salina normal (suero fisiológico). 2.- PREPARACION DE SUERO AB INERTE El suero AB inerte tiene múltiples usos en inmunohematología, desde suero control negativo de reacciones serológicas hasta diluyente de anticuerpos en titulaciones. Tiene las ventajas de ser barato, fácil de preparar y de tener las mismas características de los sueros a estudiar, lo que lo convierte en el control negativo ideal. Es preferible usar suero en vez de plasma en los test serológicos, ya que el fibrinógeno puede formar pequeños coágulos que eventualmente se confunden con aglutinación. Al calentar un plasma a 56ºC durante 1 hora, el fibrinógeno se denatura, precipitando y al mismo tiempo se inactiva el complemento. MATERIALES: - Plasma AB de un donante con serología negativa. - Baño termorregulado a 56ºC - Centrífuga adecuada. PROCEDIMIENTO: 1.Separe una bolsa de plasma fresco grupo AB, compruebe que el donante no posee anticuerpos irregulares en ningún medio, haciendo los estudios a 4ºC, 22ºC y 37ºC. 2.Ponga la bolsa transfer bien sellada en un baño a 56ºC durante 1 hora. 3.Centrifugue a alta velocidad y transfiera el sobrenadante a una bolsa limpia. 4.Deje la bolsa durante toda la noche a 4ºC. 5.Centrifugue nuevamente a alta velocidad por lo menos durante 10 minutos. 6.Filtre el suero y guárdelo a - 30ºC en alícuotas. 7.Compruebe la ausencia de aglutinación con un panel a 4, 22 y 37ºC. 3.- MEDIO DE BAJA FUERZA IÓNICA (LISS): 1.2.3.4.5.- PREPARACIÓN: En un matraz volumétrico de 1 litro agregue 1.75 g de NaCl y 18 g de glicina. Prepare un buffer fosfato, combinando 11.3 ml de KH2PO4 0.15M, y 8.7 ml de Na2HPO4 0.15M. Agregue 20 ml de este buffer al matraz dispuesto en pto. 1. Agregue agua destilada hasta completar 1 litro. Ajuste a pH 6.7 con NaOH. Agregue 0.5 g de azida de sodio como preservativo. NOTA: Al agregar esta cantidad de azida de sodio, la fuerza iónica sube de 0.0355 a 0.043. Esto no establece diferencias prácticas en la reactividad serológica de los anticuerpos. 49 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 4.- EDTA - SALINO(para suspender GR testigos A y B) Los anticuerpos anti-A y Anti-B causan directamente aglutinación y/o lisis de los GR. El uso de EDTA en el medio de suspensión, produce quelación del Ca++, quien es esencial para la integridad de la molécula C1 del sistema del complemento. De esta forma se inhibe la lisis celular. REACTIVOS: - EDTA dipotásico dihidratado(K2EDTA x 2H2O): - Hidróxido de sodio(Na OH): - Salino normal 0.85% o Cloruro de sodio 0.9%: 25 g 2g 1 litro PROCEDIMIENTO: 1.Mezcle el EDTA con el salino normal en un matraz apropiado. 2.Agregue el NaOH y mezcle sobre un agitador magnético. 3.Deje la mezcla durante toda la noche para que se estabilice. 4.Mezcle nuevamente y realice control de calidad correspondiente (pH). Coloque nombre y fecha al reactivo. NOTAS: 1.Antes de usar cada lote de EDTA hay que comprobar pH y que inhibe la lisis celular en presencia de anti-A y anti-B hemolíticos. 2.La osmolaridad del EDTA salino debe ser 450 mOsm/kg y su pH 6.7 +/- 0.2. 5.- SOLUCION DE ALSEVER MODIFICADA: Esta solución permite almacenar eritrocitos "in vitro" para uso de laboratorio a 4ºC por varias semanas. Contiene antibióticos que retarda el crecimiento bacteriano. REACTIVOS: - Cloranfenicol: - Ácido cítrico monohidratado: (C6H8O7 x H2O) - Dextrosa: (C6H12O6 - sulfato de neomicina: - Cloruro de sodio: (NaCl) - Citrato trisódico: (C6H5Na3O7 x 2H2O) 0.33 g 0.5 g 19.0 g 0.5 g 4.2 g 8.0 g PROCEDIMIENTO: 1.- Disolver en aproximadamente 600 ml de agua destilada el ácido cítrico, dextrosa, cloruro y citrato de sodio. 2.- Agregue el cloranfenicol, y neomicina; mezcle bien. 3.- Diluya hasta completar 1 litro con agua destilada. 4.- Guarde a 4ºC. 5.- Para su uso mezcle 1 volumen de esta solución con 1 volumen de sangre total. También puede preparar soluciones al 3-5% en solución Alsever. Guardar a 4ºC. 50 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 6.- CONVERSION DE PLASMA A SUERO Es preferible usar suero a plasma en tests serológicos, porque el fibrinógeno que hay en el plasma puede formar pequeños coágulos que conducen a error en la lectura al ser confundidos con aglutinación. Técnica por calor. Al calentar el plasma a 56ºC por 60 min. se denatura el fibrinógeno, el que precipita, y al mismo tiempo se inactiva el complemento. MATERIALES: - Baño termorregulado a 56ºC. - Centrífuga adecuada. - Tubos de vidrio adecuados. MÉTODO: 1.Centrifugar la muestra a altavelocidad y separar el plasma de los elementos celulares. 2.Colocar el plasma a un envase de vidrio preferentemente, y volver a centrifugar a alta velocidad para eliminar toda contaminación celular. 3.Depositar el plasma en un tubo limpio y dejar incubar a 56ºC por una hora. 4.Centrifugar el plasma tratado con calor y transferir a un tubo limpio (idealmente estéril). 5.El suero puede necesitar más centrifugación y/o filtrado antes de su uso. TRATAMIENTO DE MUESTRAS CON COAGULACION INCOMPLETA En muestras que no han completado el proceso de la coagulación, puede continuar generándose fibrina una vez separado el suero de los GR, especialmente durante su incubación a 37ºC. Este proceso hace que las proteínas atrapen eritrocitos, haciendo muy difícil la lectura y la evaluación de la aglutinación. La sangre obtenida de pacientes que están en tratamiento con heparina, puede no coagular, y aquella obtenida de pacientes con actividad fibrinolítica excesiva, puede licuarse, o contener fragmentos que interferirán en la lectura en busca de aglutinación. MATERIALES: - Trombina: humana/bovina seca o solución de trombina (50 unidades/mL en salino) - Baguetas de vidrio - Sulfato de protamina: 10 mg/mL en salino - Acido epsilon aminocaproico (EACA): 0.25 g/mL en salino PROCEDIMIENTO: 1.Para acelerar el proceso de coagulación pueden utilizarse diferentes técnicas: a) Agregar a la sangre total o al suero obtenido la cantidad de trombina seca que se adhiera a una bagueta seca, o 1 gota de la solución de trombina por mL de sangre. b) Agitar suavemente el suero obtenido en un tubo con una bagueta de vidrio, mientras se incuba a 37ºC por varios minutos. Centrifugue y use el suero sobrenadante. 2.Para neutralizar la heparina, agregar 1 o más gotas de la solución al 1% de sulfato de protamina (10 mg/mL) en salino a 4 mL de sangre total. 51 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 3.- Para inhibir la actividad fibrinolítica, agregue 0.1 mL de EACA a 4 ml de sangre total fresca. NOTAS: 1.-Use la protamina con precaución, ya que usada en exceso causa formación de rouleaux, y en gran cantidad actúa inhibiendo la coagulación. 2.-La trombina de origen humano puede estar contaminada con anti-A y anti-B. PREPARACION DE LECTINAS PARA USO EN INMUNOHEMATOLOGIA Los extractos salinos de las semillas pueden servir como reactivos en Inmunohematología y son altamente específicos en diluciones apropiadas. Son fáciles de preparar y de usar pero pueden ser difíciles de obtener. Los más usados son el extracto de Dolichos Biflorus, que aglutina glóbulos rojos A1 y A1B, y el de Hulex Europeus que reacciona con células con actividad antigénica H en forma proporcional a la cantidad existente. Existen otras lectinas que se utilizan para la tipificación de antígenos M y N, y para el estudio de los fenómenos de poliaglutinación. PREPARACIÓN: 1.- Muela la semilla hasta que quede como arena gruesa. Puede usar un mortero o bien usar la semilla entera. 2.- Coloque en un vaso o en tubo las semillas molidas y agregue 3 o 4 veces más su volumen de suero salino. (Para 1 gr. de Hulex Europeus utilizar 10 ml de salino) 3.- Incube a temperatura ambiente por 4 - 12 horas agitando de vez en cuando. 4.- Centrifugue durante 5 minutos a 3500 rpm el sobrenadante. Fíltrelo. 5.- Determine la actividad del extracto con las células apropiadas. PARA DOLICHOS BIFLORUS: 1.- Coloque 1 gota de extracto a cada uno de 3 tubos marcados A1, A2 y 0. Pueden usarse eritrocitos B, A1B y A2B. 2.- Agregue a cada tubo una gota de eritrocitos correspondientes suspendidos en salino al 3% 3.- Centrifugue el tiempo estandarizado para lectura en salino en su centrífuga. 4.- Observe los tubos en busca de aglutinación y anote los resultados. 5.- La lectina debe aglutinar los eritrocitos A1 y A1B pero no los 0, A2 y A2B. A menudo el extracto nativo aglutina todos los eritrocitos estudiados, por lo que hay que buscar la dilución adecuada en cada caso. (Buscar la dilución que de una reacción de 3+ o 4+ con A1 y A1B pero no con los otros grupos. PARA ULEX EUROPAEUS: 1.- Enfrente la lectina con glóbulos rojos A1, A2, A1B, A2B, y O. 2.- La fuerza de la aglutinación deberá ser en la siguiente secuencia: O, A2, B, A1, A1B 3.- Diluya con salino si fuera necesario de manera que los eritrocitos O aglutinen 3+ o 4+, con A2 de una intensidad menos y reacción negativa o muy débil con A1 y A1B. 4.- Guarde el extracto en el refrigerador por varios días o en freezer por períodos más largos, que pueden ser indefinidos. 5.- Al usar la lectina use siempre controles positivos y negativos. 52 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL REACCION DE CELULAS POLIAGLUTINABLES CON LECTINAS ______________________________________________ LECTINA T Tn Tk Cad ______________________________________________ Arachis hypogoea + + Salvia sclarea + Salvia horminum + + Glycine Soya + + + Dolichos Biflorus + + LAVADO DE ERITROCITOS Y PREPARACION DE SUSPENSIONES CELULARES Los eritrocitos lavados son necesarios en la mayoría de las técnicas inmunohematológicas. Los eritrocitos deben ser lavados al menos 1 vez para eliminar el plasma, ya que este puede inducir resultados falsos positivos en los métodos utilizados al generarse pequeños coágulos o interferir con la reacción Ag-Ac. También las sustancias de grupo sanguíneo presentes en el plasma pueden producir reacciones falsas negativas debido a la neutralización del anticuerpo. Para los test Inmunohematológicos se usan generalmente suspensiones globulares débiles ya que la proporción suero/células afecta directamente la sensibilidad de la mayoría de los test, para producir aglutinación o ser detectados por medio del test antiglobulina humano indirecto (TAI), debe existir un mínimo de moléculas de anticuerpo recubriendo los eritrocitos para que la reacción se observe como positiva. MATERIALES - Muestra de sangre o eritrocitos - Buffer fosfato salino (PBS) o salino tamponado - Tubos de Khan - Centrífuga para Inmunohematología METODO 1.- Coloque la cantidad deseada de eritrocitos en un tubo Khan (nomás de 0.5 ml). 2.- Llene el tubo hasta 1 cm del borde superior 3.- Centrifugue a la velocidad y el tiempo estandarizado para lavado de células. 4.- Elimine cuidadosamente el sobrenadante. 5.- Agite el tubo para resuspender en el líquido residual, los eritrocitos que han quedado adheridos a la pared del tubo. Esto constituye 1 lavado, repita los pasos 1 - 5 las veces que estipule cada procedimiento. 6.- El último lavado siempre debe presentar un sobrenadante claro, sin signos de hemólisis. 7.- Para hacer una suspensión al 5%, agregue 1 volumen de eritrocitos concentrados a 19 volúmenes de PBS. 8.- Para hacer una suspensión al 3%, agregue 1 volumen de eritrocitos concentrados a 32 volúmenes de PBS. NOTA: Salino tamponado se refiere a una solución de NaCl al 0.85%, cuyo pH se ha ajustado a 7. Los eritrocitos se suspenden en salino o PBS a no ser que se establezca lo contrario. 53 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL GRADUACION DE LOS RESULTADOS INMUNO-HEMATOLOGICOSEN TUBO: Una reacción positiva se manifiesta por medio de aglutinación o hemólisis. Debe estandarizarse la graduación de la intensidad de reacción de los resultados de los test inmunohematológicos, entre los miembros de un servicio de Banco de Sangre, con el fin de uniformar criterios y reproductibilidad de los resultados. La graduación puede ser en cruces o en puntaje según sea el caso. MATERIAL - Centrífuga serológica para aglutinación. - Lector de aglutinación - Eritrocitos y anticuerpos específicos METODO 1.- Luego de una centrifugación estandarizada para lectura, agite suavemente el tubo haciéndolo rotar hacia adelante y hacia atrás por varias veces. 2.- Observe la forma como los eritrocitos se liberan del botón producido por la centrifugación previa. 3.- Registre los resultados de acuerdo a lo establecido en el esquema de la página siguiente. NOTAS: 1.- Después de la centrifugación debe examinarse el sobrenadante en busca de hemólisis, la que debe registrarse como un resultado positivo. 2.- Signos de la tabla: Grumos= Aglutinación Macro= Macroscópico Micro= Microscópico GR= Glóbulos rojos 54 FUERZA 4+ 3-1/2+ 3+ GRADO C 4+w o 3+s 3+ PUNTAJE 12 11 10 2-1/2+ 3+w o 2+s 9 APARIENCIA Botón único, sin células libres Reacción fuerte. Numerosos aglutinados grandes ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 2+ 2+ 8 2+w 2+w 7 1-1/2+ 1+s 6 1+ 1+ 5 1+w 1+w 4 1/2+ +/- Macro 3 Trazas o Micro Dudoso 0 (+) Micro (OR) 0 2 1 0 Grumos grandes en un mar de grumos pequeños. Sin GR libres Muchos grumos medianos y pequeños sin GR libres Muchos grumos medianos y pequeños. Con GR libres Muchos grumos pequeños en un mar de GR libres Muchos grumos muy pequeños con muchos GR libres Granularidad débil en la suspensión de GR Algunos grumos macro y muchos micro. Macro -, Algunos grumos de 6-8 GRS en muchos campos Raros grumos micro No se detectan grumos GRADUACION DE LOS RESULTADOS INMUNO-HEMATOLOGICOS COLUMNA (TARJETA): Esta técnica consiste en una tarjeta plástica con 6 a 8 microcolumnas, las cuales tienen una cámara de reacción en la parte superior y en la parte inferior tienen un gel transparente o microesferas de vidrio, los que pueden contener suero anti-globulina humana o cualquier otro antisuero dependiendo de lo que se quiera determinar(también pueden ser neutros). La determinación de aglutinación en por medio de esta técnica se basa en la separación de los eritrocitos en un gel poroso o microesferas de vidrio en relación a su tamaño, posterior a una centrifugación, donde los de mayor tamaño debido a la aglutinación, quedarán atrapados en la región superior de la columna y los de menor tamaños, y que por lo tanto no han aglutinado, o lo han hecho en menor grado, quedan atrapados a lo largo de la columna o pasan al fondo de esta. Esta técnica tiene como objetivo estandarizar el uso de rectivos y la lectura de la reacción antígenos anticuerpo con facilidad y repetitividad, permitiendo de esta forma disminuir la influencia del operador. MATERIALES: -Pipeta automática y puntas desechables. -Tubos de vidrio. 55 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL -Centrífuga para tarjetas. -Incubador para tarjetas. MUESTRA BIOLÓGICA : - Glóbulos rojos - suero con anticuerpo específico RECTIVOS: -Tarjetas para aglutinación en columna. -Solución salina o PBS METODOS: 1. .Aplicar a cada columna de los eritrocitos debidamente diluidos y los anticuerpos específicos . 2. Centrifugar la tarjeta de geles según indicaciones del fabricante. 3. Observar cómo se distribuyen los eritrocitos a través de cada columna. 4. Registrar los resultados en cruces según la siguiente imagen. CALIBRACION DE CENTRIFUGAS SEROLOGICAS PARA INMUNOHEMATOLOGIA Cada centrífuga debe ser calibrada al recibirla o después de un ajuste o reparación. La calibración de una centrífuga evalúa el comportamiento de las células en soluciones de diferente viscosidad por lo que cada procedimiento debe estandarizarse teniendo esto presente. A.- Calibración para lectura: 1.- Utilice un suero que contenga un anticuerpo que produzca una aglutinación macroscópica de 1+. 2.- Seleccione eritrocitos positivos y negativos para el Ag en cuestión y prepara suspensiones frescas en las concentraciones utilizadas rutinariamente en el laboratorio, por ejemplo 2 y 3%: a.- Para anticuerpos activos en salino: Utilice suero Anti-A diluido en albúmina al 6%, hasta dar una reacción macroscópica de 1+. (3 ml de albúmina al 22% + 1 ml salino = albúmina al 6%). b.- Para anticuerpos reactivos en medios de alto contenido proteico: Utilice 1 parte de AntiD diluido con 25 a 30 partes de albúmina al 22 - 30% hasta dar una aglutinación macroscópica de 1+. 3.- Para cada set de prueba (punto a y b), prepara 5 tubos Khan para reacciones positivas y 5 para reacciones negativas. Agregue el suero y las células correspondientes justo antes de centrifugar. 56 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 4.- En parejas, un positivo con un negativo, centrifugue los tubos a una misma velocidad pero durante tiempos diferentes y observe en busca de aglutinación. Anote los resultados en su registro de acuerdo al siguiente ejemplo: CRITERIO Sobrenadante claro Botón celular claramente delimitado Células se resuspenden fácilmente Aglutinaciones Control negativo TIEMPO EN SEGUNDOS 15 20 30 NO SI SI NO SI SI 10 NO NO 45 SI SI SI SI SI SI NO + - + - 1+ - 1+ - 1+ + 5.-El tiempo óptimo de centrifugación para lectura, es el tiempo mínimo necesario para cumplir con todos los criterios establecidos. En el ejemplo corresponde a 20 segundos. B.- Calibración para lavado de células: El lavado es una fase fundamental de la técnica de Antiglobulina Humana, por lo que es fundamental establecer claramente las condiciones de centrifugación para lavado y lectura de este método. Puede determinarse en un solo procedimiento las condiciones óptimas de lavado y lectura para el test AGH. MATERIALES 1.- Suero antiglobulina humana 2.- Control positivo: Una suspensión al 2-4% en salino de eritrocitos D + incubados durante 15 minutos a 37ºC, con un suero anti-D que presente una reacción de 1+ al agregarse suero AGH. 3.- Control negativo:Una suspensión al 2-4% en salino de los mismos eritrocitos D +, incubados durante 15 minutos a 37ºC con una solución de albúmina al 6% 4.- PBS. METODO 1.- Prepare dos baterías de 5 tubos Khan, una para los controles positivos y la otra para los negativos y márquelos de acuerdo al tiempo elegido 2.- Agregue a cada tubo los eritrocitos que correspondan. 3.- Llene los tubos con suero salino y centrifugue los pares por el tiempo estipulado. CRITERIO Línea de eritrocitos en la pared del tubo Botón celular claramente delimitado 1 NO TIEMPO EN MINUTOS 1,5 2 2,5 NO SI SI 3 SI NO NO SI NO SI 4.- Observe cuidadosamente los eritrocitos después de la centrifugación, ellos deben estar en el fondo del tubo, formando un botón delimitado. No debe haber eritrocitos en la 57 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL pared formando una línea que atraviesa a lo largo del tubo. En el cuadro anterior se seleccionaría el Tiempo de 2,5 Minutos. 5.- Lavar TODOS los tubos tres veces más por el tiempo seleccionado (2,5 minutos según el ejemplo) 6.- Elimine el salino sobrenadante por inversión de todos los tubos, evitando perder eritrocitos y el botón debe quedar seco. 7.- Agregue 1 o 2 gotas de suero AGH a cada tubo y centrifugue por diferentes tiempos (de acuerdo al cuadro de lectura). 8.- Seleccione el tiempo óptimo aplicando los criterios descritos en los puntos 4 y 5 del procedimiento de calibración de lectura. CRITERIO Sobrenadante claro Botón celular claramente delimitado Células se resuspenden fácilmente Aglutinaciones Control negativo 10 NO NO TIEMPO EN SEGUNDOS 15 20 30 NO SI SI NO SI SI 45 SI SI SI SI SI SI NO + - + - 1+ - 1+ - 1+ + CARACTERISTICAS DE LOS SUEROS CLASIFICADORES. La confiabilidad de todo examen de laboratorio depende, entre otras variables, de la calidad de los reactivos utilizados, por lo tanto, es fundamental conocer su origen, composición, modo de preparación, uso y conservación. De igual importancia es seguir estrictamente las instrucciones dadas por el fabricante y efectuar control de calidad, para comprobar si reúnen los requisitos mínimos que otorgarán seguridad a los resultados obtenidos. En un Servicio de Banco de Sangre, dadas las características propias de su quehacer, esto adquiere especial importancia para lograr seguridad transfusional en beneficio del paciente. REQUISITOS: Los sueros clasificadores de grupo sanguíneo deben cumplir ciertos requisitos mínimos. 1. Ausencia de hemólisis, grasas, precipitado. 2. Ausencia de contaminación bacteriana. 3. Ausencia de formación de rouleaux, fenómeno de prosona, poliaglutinación y de aglutinación inespecífica. 4. Ausencia de anticuerpos irregulares. 5. Libre de enfermedades infecciosas de transmisión sanguínea. 6. Especificidad. 7. Potencia. 8. Avidez. ESPECIFICIDAD: Es la reactividad selectiva de un anticuerpo con su antígeno específico. Se puede determinar estudiando el suero reactivo con glóbulos rojos de 4 diferentes muestras que contengan el antígeno específico y con igual número de muestras conocidas que carezcan de él. 58 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL El suero en estudio debe dar reacciones intensas de aglutinación (sin hemólisis) con los glóbulos rojos que poseen el antígeno específico y no deben reaccionar con aquellos que carecen de él. MUESTRA: Suero clasificador en estudio. MATERIAL: - Tubos de vidrio 12 x 75 mm. (Kahn) - Pipetas Pasteur con capuchón de goma. - Centrífuga para inmunohematología previamente calibrada. - Fuente luminosa para lectura. REACTIVOS: - Buffer salino fosfatado PBS - EDTA al 5% - Glóbulos rojos de grupo A1, A 2, B, A1B, A 2B, O, previamente lavados. - Glóbulos rojos de grupo A,B,O r'r (Cde/cde) O r0r (CdE/cde) O r"r (cdE/cde) O r r (cde/cde) METODO: 1.- Preparar una suspensión al 3% en EDTA 5% de glóbulos rojos de grupo A1, A 2, B, A1B, A2B, O. (4 de c/u). 2.- Marcar igual número de tubos de Kahn por cada suero en estudio. 3.- Agregar a cada tubo 1 gota de la suspensión de glóbulos rojos correspondiente. 4.- Agregar a cada tubo 2 gotas del suero en estudio. 5.- Mezclar y centrifugar inmediatamente, según tiempo y velocidad estandarizados. 6.- Efectuar lectura macroscópica verificando la presencia o ausencia de aglutinación y hemólisis. Anotar los resultados. POTENCIA: Fuerza del anticuerpo que se mide test de avidez, intensidad y titulación. La avidez es influenciada por: fuerza del antígeno presente en los glóbulos rojos reactivos, el medio y concentración de la suspensión y la temperatura. AVIDEZ E INTENSIDAD: Medida de capacidad de unión y rapidez con que el Ac. se combina correspondiente Ag. con su MATERIAL: - Lámina y baguetas de vidrio - Pipetas Pasteur con capuchón de goma - Cronómetro REACTIVOS: - Buffer salino fosfatado PBS - Glóbulos rojos de grupo A1, A 2, B, A1B, A 2B, O. - Suero clasificador en estudio. MÉTODO: 59 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 1.- Depositar en una lámina de vidrio a temperatura ambiente, 2 gotas del suero en estudio sin diluir, más 1 gota de glóbulos rojos al 40% en suero homologo y que posean el antígeno específico. 2.- Mezclar con bagueta de vidrio y describir un círculo de 2,5 cm de diámetro. 3.- Cronometrar el tiempo transcurrido a partir de la mezcla y el inicio de la reacción y el grado de aglutinación al cumplirse 1 min. TITULO Medida de fuerza del Ac, obtenida por dilución seriada del suero que lo contiene y en contacto con su Ag. específico. MÉTODO:Efectuar técnica de titulación de Ac. IgM. REQUISITOS MINIMOS EXIGIDOS PARA SUEROS CLASIFICADORES ABO ________________________________________________________________ * AVIDEZ * INTENSIDAD ________________________________________________________________ AABB OMS MINSAL AABB OMS MINSAL ANTI A GR A1 15" 10" 10" 4+ 4+ 3+ 4+ s/d GR A2 30" 20" 20" 3+ 3+ 3+ s/d GR A2B 45" 30" 30" 1+ 2+ 2+ s/d ANTI B GR B 15" 10" 10" 4+ 4+ 3+ 4+ s/d ________________________________________________________________ * Método en lámina ___________________________________________ TITULO ___________________________________________ AABB OMS MINSAL ANTI A GR A1 256 64 128 GR A2 128 32 64 GR A2B 64 8 32 ANTI B GR B 256 64 128 ___________________________________________ 60 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL CLASIFICACION DEL SISTEMA ABO TÉCNICA EN TUBO MUESTRA Sangre completa con o sin anticoagulante MATERIAL - Pipetas Pasteur - Tubos Khan (11x75) - Gradillas para tubos Khan - Centrífuga para Inmunohematología - Lector de aglutinación REACTIVOS - Sueros anti-A y anti-B si utiliza reactivos monoclonal. - Eritrocitos testigos A1 y B lavados y suspendidos al 2-4% en EDTA o PBS (1 volumen de eritrocitos y 32 volúmenes de diluyente). Ellos deben ser frescos e idealmente Rh negativos. La suspensión debe prepararse diariamente. - EDTA al 1,5% en suero fisiológico. - PBS o suero fisiológico tamponado METODO 1.- Numerar las muestras a clasificar y colocarlas ordenadamente en una gradilla apropiada. 2.- Colocar en la gradilla 5 tubos previamente marcados con las letras A, B, GRA, GRB, PA, bajo cada muestra a clasificar. 3.- Deposite en un tubo previamente marcado una alícuota de eritrocitos de la muestra en estudio, y proceda a lavarlos por al menos 1 vez con PBS. 4.- Colocar 2 gotas de suero anti-A en el tubo marcado A; 2 gotas de suero anti-B en el tubo marcado B; 1 gota de GR testigos A1 en el tubo marcado GRA; 1 gota de GR testigos B en el tubo marcado GRB. 5.- Agregar a los tubos marcados GRA, GRB y PA, 2 gotas del suero de la muestra. 6.- Agregar a los tubos marcados A, B, y PA 1 gota de la suspensión al 3% de los eritrocitos de la muestra. 7.- Mezclar y centrifugar todos los tubos por el tiempo estandarizado para lectura en su centrífuga. 8.- Girar suavemente hacia adelante y atrás el tubo, y ayudándose con un lector de aglutinación proceda a registrar los resultados en intensidad de cruces. NOTA: 1.- El punto 7 puede ser reemplazado por una incubación de 1 hora a temperatura ambiente y luego lectura sin centrifugar. 2.- Cuando se desea clasificar un gran número de muestras, puede en vez de lavar como lo indica el punto 4, proceder a resuspender los eritrocitos en suficiente cantidad de PBS como para lograr una suspensión al 2-3%. INTERPRETACION En el cuadro siguiente se presentan los resultados esperados, correspondiendo a los fenotipos ABO más frecuentes. 61 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL Reacción de células con Reacción del suero con células Interpretación antisueros testigo. GRUPO Anti-A Anti-B Células A Células B 0 0 + + O + 0 0 + A 0 + + 0 B + + 0 0 AB 0= no aglutinación += aglutinación Cuando los resultados entre ambas pruebas no concuerdan, existe una discrepancia, la que debe ser investigada antes de informar el grupo ABO. Si la discrepancia se presenta en una unidad de sangre donada, ésta debe mantenerse aparte y no transfundirla hasta resolver el problema. Cuando la discrepancia se presenta en un paciente que requiere una transfusión, él puede ser transfundido con eritrocitos concentrados del grupo O, Rh compatible, para solucionar la emergencia, teniendo la precaución de obtener previamente una muestra suficiente como para resolver el caso. Las discrepancias en una clasificación ABO pueden deberse a: 1- Errores técnicos - Material sucio. - Contaminación bacteriana de las muestras. - Contaminación de reactivos, sueros y células. - Proporción incorrecta de la relación suero/células - Exceso o falta de centrifugación - Falta de adición de reactivos y muestra - Temperatura de incubación incorrecta - Pérdida de actividad de los reactivos - Empleo inadecuado de reactivos y células testigos - Presencia de hemólisis en la muestra - Identificación incorrecta de la muestra, tubos. - Registros mal llevados e incompletos. - Etc. 2- Problemas inherentes a las células - Presencia de gelatina de Wharton en muestras de cordón - Pacientes recientemente transfundidos. -Autosensibilización de los GR del paciente (autoanticuerpos) o EHRN - Poliaglutinación - Antígenos débiles de A y/o B -Pacientes que sufren de patologías infecciosas importantes (Ag. B adquirido) u otras patologías malignas. -Presencia de altas concentraciones de sustancias de grupo sanguíneo en el plasma. - Etc. 3- Problemas inherentes al suero -Presencia de anticuerpos irregulares fríos -Patologías que se caracterizan por alto contenido de proteínas plasmáticas - Pacientes que están recibiendo expansores plasmáticos de alto peso molecular - Pacientes que carecen de anticuerpos, o los presentan en títulos muy bajos. 62 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL - Etc. CONTROL DE CALIDAD: a.-Tipificación de antígenos: GR A2, A2B, B, O y autocontrol. b.-Detección de anticuerpos: Suero AB inerte c.-Chequear los GR. testigos Estos controles deben incluirse en cada serie de tests. PREGUNTAS A RESPONDER: 1.- ¿Cuál es la causa de cada uno de los factores de error descritos? 2.- ¿Cómo interfieren en la clasificación ABO los factores de error descritos? 3.- ¿Producen resultados falsos positivo o negativo? 4.- ¿Existen otras causas de error en la clasificación ABO que no aparezcan en este listado? 5.- ¿Cómo se resuelve cada una de las discrepancias indicadas? 6.- Elabore un esquema a aplicar en el laboratorio en que se describa paso a paso lo que debe realizarse en la resolución de una discrepancia. Existen subgrupos de A y B, que corresponden a expresiones fenotípicas más débiles de los antígenos habituales y que en el laboratorio pueden investigarse apoyándose en el siguiente esquema: 63 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL SUBGRUPO A1 Aint A2 A3 Ax Ael Am B B3 Bx REACCION CON ANTISUEROS Anti Anti Anti Anti A AB A1 H 4+ 4+ 4+ 0 4+ 4+ 2+ 3+ 4+ 4+ 0 2+ 2+# 2+# 0 3+ 0/º 2+ 0 3+ 0 0 0 4+ 0/º 0/º 0 4+ 0 4+ 0 0 0 2+# 0 4+ 0 0/2+ 0 4+ *: ocasionalmente forman anti-A1 REACCION CON ERITROCITOS A1 A2 B O 0 0 0 0 0* 0 0* 0 2+º 0 2+º 0 0 0 4+ 4+ 4+ 4+ 4+ 4+ 4+ 4+ 4+ 4+ 4+ 4+ 4+ 0 0 0 0 0 0 0 0 0 0 0 0 0 ANTIGENOS EN SECRECION SALIVA AyH AyH AyH AyH H H AyH ByH ByH H #: campo mixto. º: frecuentemente forman anti-A1. TECNICA DE AGLUTINACIÓN EN COLUMNA ( TARJETA): Para realizar una determinación ABO con esta técnica, debemos utilizar una tarjeta que contenga columnas con Anticuerpos anti-A, anti-B, y 2 columnas neutras para realizar la preuba inversar con suero o plasma del paciente y glóbulos rojos testigos A1 y B. MUESTRA -Sangre completa con anticoagulante. MATERIALES -Pipeta automática. -Puntas desechables para pipeta. -Tubos Khan. -Gradilla para tubos Khan. -Centrifuga para tarjetas. REACTIVOS -Tarjetas de gel para tipificación ABO. -Solución salina. -Eritrocitos testigos anti- A1y anti- B. METODO -Numere las muestras a clasificar y colocarlas ordenadamente en una gradilla apropiada. -Colocar tras cada muestra un tubo khan numerado igual que la muestra. -Preparar en el tubo Khan una suspensión de hematíesen medio Salino(según instrucciones del fabricante). -Añadir la suspensiónde glóbulos rojos previamente hecha a las columnas identificadas como A, B y Ctl. - Añadir los GR testigos A1 a la columna identificada como NA1 y los GR testigos B a la columna identificada como NB. -Añadir plasma de la muestra a las columnas marcadas como NA1y NB l. -Centrifugar la tarjeta por el tiempo estandarizado. -Leer la tarjeta según ubicación de los eritrocitos a lo largo de la columna. 64 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL INTERPRETACIÓN La interpretación de la determinación de grupo ABO al igual que en tubo se realiza en cruces de 1 a 4. DETERMINACION DE ANTIGENOS SOLUBLES ABH Y LEWIS EN SALIVA En Chile aproximadamente el 83% de la población presenta antígenos solubles del sistema ABO en la saliva, y por lo tanto poseen el gen Se, quien es el responsable de su presencia en este y otros fluidos corporales. RECOLECCION DE LA SALIVA 1.- Obtenga entre 5 a 10 ml de saliva en un tubo ancho, de preferencia enjuagándose la boca previamente con abundante agua. La mayoría de los individuos puede acumular esta cantidad en varios minutos. Para fomentar la salivación, el paciente puede mascar cera especial, lámina de parafina o cinta de goma, pero no chicle ni cualquier material que contenga azúcar o proteínas. 2.- Centrifugue la saliva a alta velocidad durante 10 minutos. Transfiera el sobrenadante a un tubo limpio. 3.- Coloque el tubo con la saliva en un baño María hirviendo por 10 min para inactivar las enzimas salivares. 4.- Obtenga en otro tubo el sobrenadante claro y transparente, descartando la parte sólida y opaca. Diluya la saliva con un volumen igual de salino. 5.- Refrigere si el test no se realizará en las próximas horas. Si este no se realiza en el día de colección, congele la muestra la que permanecerá estable por varios años. REACTIVOS: -(seleccione el reactivo de acuerdo al antígeno que desee detectar) -Anti-A y anti-B policlonal (humano). -Lectina anti-H de Ulex europeus. -Anti-Lea policlonal (conejo/cabra). -GR testigos A1 y B, de iguales características a los utilizados en la clasificación ABO. -GR grupo O, Lea +, con las características de los usados en detección de anticuerpos irregulares PROCEDIMIENTO: A.- Selección de la dilución del antisuero: 1.- Prepare diluciones seriadas del anticuerpo seleccionado. Puede usar lectina anti-H para ABO y anti-Lea para el sistema Lewis. 2.- Coloque en tubos previamente rotulados con la dilución correspondiente una gota de dilución y una gota de la suspensión al 2-5 % en salino de los eritrocitos apropiados. 3.- Centrifugue y observe en busca de aglutinación macroscópica. 4.- Seleccione para el test la menor dilución que presente una aglutinación de 2+. B.- Estudio de la condición de secretor: 1.- Marque 4 tubos como: control+, control-, test y control de dilución. 2.- Agregue a cada uno de los tubos ya marcados, una gota del antisuero apropiado y previamente seleccionado de acuerdo al procedimiento descrito en A. 3.- Agregue al tubo marcado control+ una gota de saliva control de un individuo no secretor, al tubo control- una gota de saliva de un individuo secretor, al tubo test una gota de la saliva en estudio y al tubo control dilución una gota de suero salino. 4.- Mezcle los tubos e incúbelos por 10 minutos a temperatura ambiente. 65 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 5.- Agregue una gota de suspensión al 3% en salino de eritrocitos que posean el antígeno para el antisuero que se está utilizando. 6.- Mezcle el contenido del tubo e incube 30 a 60 minutos a temperatura ambiente. 7.- Centrifugue el tiempo estandarizado para lectura en salino en su centrífuga, y observe los tubos en busca de aglutinación macroscópica. Registre los resultados. INTERPRETACION DEL TEST DE SALIVA Compare sus resultados con la siguiente tabla: Saliva Test Saliva Se Saliva no SE 2+ - - 2+ 2+ Control Dilución 2+ 2+ Interpretación No Secretor Secretor 1.- La aglutinación de los GR testigos en el tubo test indica ausencia del correspondiente Ag en la saliva. 2.- No aglutinación de los GR testigos en el tubo test indica presencia del Ag correspondiente en la saliva. 3.- Ausencia de aglutinación en el tubo control dilución indica que el reactivo (Ac) empleado está demasiado diluido. Debe repetir el paso A de este procedimiento. NOTA: Este test puede ser adaptado para hacer mediciones semicuantitativas de actividad de grupo sanguíneo al estudiar diluciones seriadas en salino de la saliva. Mientras más alta sea la dilución necesaria para eliminar la actividad neutralizante, mayor cantidad de antígeno ABH soluble existe. CLASIFICACION Rh (D): TÉCNICA EN TUBO MUESTRA: Sangre con o sin anticoagulante. MATERIAL: - Pipetas Pasteur - Tubos Khan (11x75) - Gradilla para tubos - Lector para inmunohematología - Baño termo regulable - Centrífuga para Inmunohematología. REACTIVOS: - Suero anti-D: Existen sueros de alto contenido proteico, químicamente modificados de bajo contenido proteico, o mezclas IgM + IgG de bajo contenido proteico. Debe seguir cuidadosamente las instrucciones de uso del fabricante y hacer los ajustes pertinentes. - Suero Antiglobulina Humana - Suero fisiológico tamponado o PBS - Suero control Rh (solo si es necesario). - Células control AGH (eritrocitos sensibilizados) 66 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL METODO: 1.- Enumerar las muestras a tipificar. 2.- Lavar por lo menos una vez una alícuota de eritrocitos de la muestra con PBS, y preparar con ellos una suspensión al 2-4% en salino, suero AB inerte u otro. (Puede usar la misma suspensión preparada para la clasificación ABO). 3.- Depositar 1 gotas de suero anti-D en un tubo Khan previamente marcado D. 4.- Colocar una gota de suero Rh control en otro tubo marcado, o albúmina al 30% si usa reactivos con alto contenido proteico (como control negativo). 5.- Agregar una gota de la suspensión de eritrocitos preparada en el punto 2 a ambos tubos. 6.- Centrifugar el tiempo establecido para lectura en la estandarización de su centrífuga. 6.- Girar suavemente el tubo y observar si existe o no aglutinación macroscópica frente a una buena fuente de luz. 7.- Si el resultado es negativo, incubar por un mínimo de 15 minutos y un máximo de 1 hora a 37ºC. (de acuerdo con las instrucciones del fabricante). 8.- Proceder igual que en los puntos 6 y 7. INTERPRETACIÓN: - - Si hay aglutinación = o > a 2+ en el tubo test, y no se observa en el control, la persona presenta el antígeno D en los eritrocitos, por lo tanto es D+ (Rh positiva). Si la aglutinación es < de 2+ o negativa en el tubo test, no debe interpretarse como Rh + sino que debe continuarse el estudio en busca de expresiones débiles o variantes del antígeno D, para definir así el grupo Rh. Si el tubo control Rh presenta aglutinación, no informar antes de verificar con otro tipo de reactivo el grupo Rh de la muestra. Investigación de antígeno D débil: 9.- Incubar ambos tubos cuya lectura fue negativa por 15 a 30 minutos a 37ºC. 10.- Centrifugar y leer igual que en los puntos 5 y 6. 11.- Si el resultado es positivo en el tubo test y negativo en el control, la persona es Rh positivo. Si la lectura es negativa proceder como sigue: 12.- Lavar los eritrocitos de ambos tubos con abundante PBS por 4 veces. 13.- Después del último lavado, eliminar tanto salino como sea posible dejando los eritrocitos resuspendidos en el salino residual adherido a las paredes. 14.- Agregar una gota de suero Antiglobulina Humana. 15.- Centrifugar y leer de la forma descrita en los puntos 5 y 6. 16.- Registrar los resultados en cruces. 17.- Si el resultado del test es positivo, éste debe ser validado por un test Antiglobulina Humana directa de los eritrocitos de la muestra. NOTA: En caso de utilizar un suero anti-D que requiere el uso de un control Rh trabajado en paralelo, el TAD puede ser reemplazado por el TAI que se realiza con este último suero, ya que este asegura que están representados todos los componentes de la reacción que pueden causar resultados falsos positivos. INTERPRETACIÓN: Si el resultado de esta segunda fase es negativo, se puede decir que no hay antígeno D en los eritrocitos y por lo tanto la persona es Rh negativo, si al agregar células control AGH se obtiene un resultado positivo. 67 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL En aquellos casos en que se obtiene un resultado positivo en el punto 17, y el test AGH directo (que se usa para confirmar que el anticuerpo adherido a los eritrocitos en estudio corresponde al anti-D agregado y no a un anticuerpo previamente adherido), es negativo, se debe informar como Rh +. Si el AGH directo es positivo, no se puede informar Rh, si se trata de un receptor de transfusión debe usarse sangre Rh negativa mientras se estudia su Rh. Es incorrecto informar una muestra como Rh - Du +, la nomenclatura actual se refiere al Du como un antígeno débil pero Rh positivo, lo que implica presencia de él en los eritrocitos. El cuadro siguiente muestra algunos posibles resultados: ANTI-D CONTROL Rh + + - + - INV. D DEBIL (Du) + + TAD INFORME + Rh positivo ¿ Rh negativo Rh positivo ¿ En aquellos casos en que no se puede informar el Rh (?), se debe utilizar otro tipo de reactivo Rh y eventualmente aplicar otras técnicas como elución y absorción. CONTROL DE CALIDAD: Todos los resultados son válidos si se usan en cada serie de tests, controles adecuados usando células con antígenos débiles y negativos para el antígeno en estudio, ej.: GR R1r y rr para anti-D, y se validan los resultados de AGH negativos con células control de AGH. RESULTADOS FALSOS: Las causas de que se produzcan reacciones falsas en la determinación del grupo Rh, pueden asociarse a: 1.- Uso de reactivos de alto contenido proteico: Por su contenido pueden causar reacciones falsas positivas si los hematíes del paciente están recubiertos de anticuerpos. La incubación de los GR y el antisuero durante un tiempo excesivo, antes de efectuar la lectura de la prueba, puede tener como consecuencia que el reactivo con alto contenido proteico provoque la formación de rouleaux, confundiéndose con aglutinación. 2.- Utilización inadvertida de reactivos erróneos: Para evitar errores el CFR americano autoriza el uso de un código de colores en las etiquetas de algunos reactivos empleados en la determinación de grupos sanguíneos. En el sistema Rh el color aprobado para el anti-D es gris, rosa para el anti-C, café para el anti-E, azul para el antic, verde para el anti-e y naranja para el anti-CDE. A pesar de estas medidas, es importante leer la etiqueta cada vez que se utilice ya que fiarse solo del color no es suficiente para tener la seguridad de que ha elegido el reactivo correcto. 3.- Presencia en el reactivo de un anticuerpo irregular con especificidad distinta. Los fabricantes prueban la especificidad de cada reactivo con eritrocitos que poseen los antígenos más comunes en la población (más de 1% en la población), y con el método descrito, por lo que cambios en los métodos pueden dar lugar a resultados falsos. En casos críticos es recomendable hacer la técnica por duplicado con dos reactivos de diferente origen. 68 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 4.- Hematíes poliaglutinables pueden ser aglutinados por cualquier reactivo que contenga suero humano, pero rara vez existe este error ya que la edad, dilución y los diferentes pasos del proceso de fabricación, tienen tendencia a eliminar estos anticuerpos. 5.- Contaminación bacteriana de los reactivos, o con sustancias extrañas, o con reactivos provenientes de otros frascos. Es recomendable nunca sacar a la vez el cuentagotas de más de un reactivo, y debe inspeccionarse periódicamente los frascos en busca de deterioro. Es importante recordar que en los reactivos de alto contenido proteico, la contaminación bacteriana puede no producir una turbidez detectable, ya que el índice de refracción de las bacterias es similar al del propio material. 6.- No se ha añadido el antisuero al tubo. Un buen habito es fomentar el colocar en primer lugar el antisuero al tubo, controlar su presencia y luego colocar la suspensión de hematíes. 7.- Un antisuero específico no reacciona con un antígeno variante o deprimidos. 8.- Es posible que un antisuero que contenga un anticuerpo dirigido principalmente contra un antígeno compuesto Rh no presente una reacción detectable con los hematíes portadores de antígenos individuales como producto de genes independientes. Esto ocurre más frecuentemente con los sueros anti-C, cuyas reacciones con el antígeno C, casi invariablemente son más fuertes cuando este ha sido producto de R1 o r'. 9.- No se siguen las instrucciones de los fabricantes y en consecuencia se ha usado incorrectamente el antisuero. 10.- Si se realiza una agitación demasiado enérgica al resuspender el botón de hematíes después de la centrifugación, puede dispersarse una aglutinación débil. 11.- Reactivo inactivo por falla en su manipulación y almacenamiento. El anti-D químicamente modificado es especialmente sensible a la destrucción del IgG por enzimas proteolíticas que podrían producir las bacterias. TÉCNICA DE AGLUTINACION ENCOLUMNA MUESTRA Sangre completa con anticoagulante. MATERIAL Micropipetas Puntas para micropipetas Tubos khan. Gradilla para tubos khan. Incubador para tarjetas. Centrifuga para tarjetas REACTIVOS Tarjetas para aglutinación en columna que contengan anticuerpos anti-D. Solución salina. METODO 1. Identificar las muertras a analizar 2. Marcar los tubo khan de la misma forma que hizo con las muestras y ubicarlos tras estas 3. Preparar en cada tubo khan suspensiones de hematíes según las indicaciones del fabricante a partir e las muestras a analizar. 4. Abrir los pocillos del cassette a utilizar. 5. Añadir a los pocillos la suspensión de hematíes según indicaciones del fabricante. 6. Centrifugar la tarjeta según el tiempo estimado por el proveedor . 7. Leer aglutinación en las tarjetas. 8. Las muestras que parezcan ser D negativo o presenten una intensidad de aglutinación 69 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL menor a 2+ deben ser confirmadas. ALGORITMO A UTILIZAR EN LA CLASIFICACIÓN Rh D MUESTRA SANGRE con o sin anticoagulante Suspensión eritrocitos al 3% en PBS GR 3% + anti-D POSITIVO Controles OK NEGATIVO INFORME Rh Positivo AGH DE Rh o test Du NEGATIVO Controles OK POSITIVO INFORME Rh negativo NO INFORMAR REALIZAR TAD TAD NEGATIVO INFORME Rh POSITIVO D DEBIL TAD POSITIVO ELUCION del Ac. Usar anti-D salino TAD negativo repetir Rh Controles OK Controles OK INFORMAR INFORMAR 70 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL CLASIFICACION DE GRUPO ABO Y Rh: TÉCNICA EN MICROPLACA Las técnicas en microplacas pueden usarse para investigar antígenos ABO en los glóbulos rojos y anticuerpos en el suero. La microplaca es una matriz de 96 tubos de ensayo, en los cuales puede visualizarse hemaglutinación con sueros clasificadores diluidos y en bajo volumen. Las microplacas pueden ser flexibles o rígidas, con microcubetas en forma de U o V. Las más usadas son las en forma de U porque permiten la lectura de los resultados después de centrifugar la placa y observar las características de los GR resuspendidos o analizar el patrón de flujo de las células cuando se inclina la placa, pudiendo finalmente estimar la intensidad de la aglutinación. MUESTRAS: -Adultos: sangre con EDTA -Recién nacidos: sangre de cordón. MATERIALES: -Microplacas con fondo en “U” -Pipetas Pasteur. -Tubos de Kahn. -Gradillas. EQUIPOS: -Centrífugas con soporte para microplacas. -Agitador. -Lector. REACTIVOS: -Sueros clasificadores anti-A y anti-B monoclonales diluidos, según estandarización hecha previamente. -Suero clasificador anti-D, diluido según estandarización. -Glóbulos rojos A-1,A-2, B, O R1r y O rr suspendidos al 1% en EDTA. -PBS pH 7.3. TÉCNICA: -Identificar las microplacas de acuerdo al siguiente esquema. Cada columna corresponde a una muestra, Las columnas 11 y 12 se ocupan para control de calidad. 1 anti- A anti- B anti - AB anti- D anti- D P.A. g.r. A g.r. B A B C D E F G H 2 3 4 5 6 7 8 9 10 C+ 11 A2 B R1r C12 B A1 rr 71 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 1. Repartir los sueros de la siguiente forma: una gota de anti-A en todos los pocillos de la primera fila, una gota de anti-B en la segunda fila , una gota de anti-AB en la tercera fila, una gota de anti -D en la cuarta y quinta fila y una gota de PBS en la sexta fila. 2. Repartir las muestras de la siguiente manera: una gota de suero en los pocillos G y H. 3. En un tubo aparte prepare una suspensión de GR de la muestra a estudiar al 1% en PBS, reparta una gota de esta suspensión en los pocillos A al F. 4. Reparta una gota de la suspensión de GR A1 en los 10 primeros pocillos de la fila G. 5. Reparta una gota de la suspensión de GR B en la fila H. 6. Reparta 1gota de las suspensiones de GR control según se muestra en el esquema anterior. 7. Centrifugue las placas a 1400 r.p.m. durante 20 segundos. 8. Agite las placas durante 20 seg. Con el agitador en alta revolución y 20 seg. Con el agitador en baja revolución. 9. Lleve las placas al lector para ver presencia o no de aglutinación. Registre el resultado en el protocolo correspondiente en intensidad de cruces, siguiendo el mismo criterio que en la clasificación en tubo. Si existe alguna discrepancia en la clasificación se debe repetir en tubo. Del mismo modo, todas las muestras que resulten negativas con anti-D, se deben clasificar en tubo. ABO Rh B + A + A + A + O + O + A + O + O + B + AB + A + DETERMINACION DE GENOTIPO RH Las pruebas de rutina para determinar el grupo sanguíneo de donantes y pacientes solo comprende la determinación del antígeno D. Las pruebas para determinar otros antígenos Rh se realizan en caso de que existan razones especiales que lo justifiquen, por ejemplo: investigación de paternidad, estudios de enfermedad hemolítica del recién nacido, apoyo en identificación de anticuerpos, preparación de un panel de células detectoras de anticuerpos y células para realizar control de calidad de las técnicas inmunohematológicas. En la selección de sangre compatible para un paciente que en el suero tenga un anticuerpo Rh comparativamente débil, la determinación de los hematies negativos respecto de un antígeno, mediante técnicas que emplean antisueros reactivos, es más fiable que el resultado negativo obtenido en la prueba cruzada. MUESTRA: Sangre con o sin anticoagulante METODO: Se utilizan sueros anti-D, anti-C, anti-c, anti-E, y anti-e, los que se enfrentan a una suspensión de los eritrocitos en estudio de acuerdo estrictamente a las instrucciones del fabricante de los antisueros, siguiendo rigurosamente los tiempos y temperaturas de incubación. Es necesario incluir controles positivos para cada antisuero, que deben corresponder a células heterocigotos para el antígeno en estudio, y controles negativos con células que no poseen el antígeno. CALCULO DE GENOTIPO MÁS PROBABLE: 72 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL Para realizar este cálculo debemos recurrir a la frecuencia de los haplotipos Rh en la población chilena y basarnos en el equilibrio de Hardy-Weinberg. Si se desea calcular por ejemplo la frecuencia en Chile del genotipo CDe/cde, debe calcularse 2 X (CDe)(cde) = 2 (0.500 X 0.2192) = 0.22 Frecuencia de los haplotipos Rh en población chilena. CDE (Rz) CDe (R1) cDE (R2) cDe (Ro) CdE (Ry) Cde (r') cdE (r'') cde (r) 0.0132 0.5001 0.2259 0.0255 0.0000 0.0064 0.0097 0.2192 REFERENCIA: Rev. Med. de Chile 116: 28-33. 1988. NUMERO DE SITIOS ANTIGENICOS DE ACUERDO AL GENOTIPO CELULAR GENOTIPO R1R1 R1r R1R2 R2R2 Rºr Rr D 14.500 19.300 9.900 14.600 23.000 31.000 15.800 33.300 12.000 20.000 - C 46.000 56.000 21.000 40.000 25.000 40.000 - ANTIGENO E 15.000 25.000 - - - - c 37.000 53.000 37.000 53.000 70.000 85.000 70.000 85.000 70.000 85.000 e 18.200 24.000 18.200 24.000 13.400 14.500 18.200 24.000 18.200 24.000 ORDEN DE FUERZA DEL Ag. D cDE/cDE > CDe/cDE > CDe/CDe > cDE/cde > CDe/cde R2/R2 R1/R2 R1/R1 R2/r R1/r NOMENCLATURA ACTUALMENTE UTILIZADA PARA REFERIRSE AL Ag.D D D débil D parcial D parcial débil D aumentado Ag D común, todos los epitopos presentes Ag. D presente en menor cantidad, anteriormente llamado Du. Ausencia de algunos epitopos del Ag. D, los otros presentes en cantidad normal o reducida. Ag. D parcial presente en cantidad considerablemente reducida, muy débil para categorizarlo. Se reconoce solo por la presencia de anti-D. Ag. D normal presente en cantidad considerablemente aumentada. 73 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL FRECUENCIAS GENICAS DE SISTEMAS SANGUINEOS EN DIFERENTES POBLACIONES SISTEMA MIXTA CHILENA ESPAÑOLA MAPUCHES AYMARAE ATACAMEÑ S OS NEGRA ABO A B O N: 0.1824 0.0698 0.7477 321 0.2864 0.0670 0.6465 20000 0.018 0.000 0.9820 148 0.0549 0.0160 0.9286 183 0.0562 0.0027 0.9407 182 0.1780 0.1143 0.7077 858 Duffy Fya No Fya N: 0.5805 0.4195 379 0.3966 0.6034 1988 0.7080 0.2920 141 0.7823 0.2177 654 0.7008 0.2990 180 0.0607 0.9393 365 Rh CDE CDe .cDE .cDe CdE Cde .cdE .cde N: 0.0093 0.4999 0.2224 0.0230 0.0000 0.0089 0.0139 0.2223 679 0.0008 0.4036 0.1670 0.0186 0.0000 0.0049 0.0029 0.3820 8297 0.0320 0.6930 0.2550 0.0210 0.0000 0.0000 0.0000 0.0000 258 0.0267 0.3657 0.5757 0.0329 0.0000 0.0000 0.0000 0.0000 183 0.0465 0.4727 0.4340 0.0267 0.0000 0.0000 0.0000 0.0198 181 0.0000 0.0256 0.0427 0.7395 0.0000 0.0707 0.0000 0.1184 644 CARACTERISTICAS GENERALES DE SISTEMAS SANGUINEOS DE IMPORTANCIA CLINICA 74 Nº NOMBRE SIMBOL O Nº Ag NOMBRE DEL GEN 4 ESTRUCTURA DE MEMB ASOCIADA H de C 001 ABO ABO 002 MNSs 004 GEN CLONAD O SI CROMOSOM A MS 38 GPA/GPB GYPA/GYP B RHD/RHCE SI 4 Rh RH 45 Proteína SI 1 005 Lutheran LU 18 006 Kell KELL 21 008 Duffy FY 6 009 Kidd JK 3 019 Kx XK 1 Superfamilia de Igs de memb. Glicoproteín a Receptor de quimokinas (ECR) Transporte de urea Glicoproteín a LU SI 19 KELL SI 7 FY SI 1 JK POSIBLE 18 XK SI X ABO 9 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL TEST ANTIGLOGULINA HUMANA - El test Antiglobulina Humana (AGH) o test de Coombs, se basa en principios elementales simples: Las moléculas de anticuerpos y los componentes del complemento son globulinas. Al inyectar a un animal globulina humana, se estimula la producción de anticuerpos frente a esta proteína extraña. Se remueven del suero las proteínas y anticuerpos no deseados dejando solamente el ANTICUERPO ANTIGLOBULINA HUMANA. Este suero AGH reaccionará específicamente con globulinas humanas tanto si están unidas a eritrocitos como libres en el suero. La porción Fab de la molécula AGH reaccionará con la porción Fc del anticuerpo unido a cada glóbulo rojo por separado produciendo la aglutinación. Las globulinas libres no unidas, pueden neutralizar el AGH si no se eliminan completamente y causar resultados negativos falsos. Es uno de los test de laboratorio más usados en inmunohematología, se utiliza 2 tipos de test AGH 1. 2. - El test Antiglobulina Directo TAD. - El test Antiglobulina Indirecto TAI. TEST ANTIGLOBULINA HUMANA DIRECTO (TAD) TEST DE COOMBS DIRECTO TÉCNICA EN TUBO El TAD se utiliza para demostrar anticuerpos IgG y/o complemento (C3dg), que se han unido "in vivo" a los eritrocitos del paciente. Se utilizan directamente los eritrocitos lavados del paciente y el suero AGH. MUESTRA: Sangre obtenida con EDTA como anticoagulante, para evitar la unión de complemento "in vitro" que puede ocurrir en muestras sin anticoagulante. REACTIVOS: Suero Antiglobulina Humana: Existen sueros AGH poliespecíficos que detectan tanto IgG como Complemento, sueros monoespecíficos anti-IgG, anti-C3d, anti-C4, anti-C3dg, etc... Los métodos de rutina usan sueros AGH poliespecíficos. Es muy importante leer cuidadosamente las instrucciones del fabricante al comenzar a trabajar con cada lote de SAGH. PBS PROCEDIMIENTO: 1.- Prepare cuidadosamente una suspensión de eritrocitos del paciente al 2-4% en su propio plasma. 2.- Lave 1 gota de la suspensión anterior de eritrocitos del paciente por 4 veces con PBS. Después del último lavado, elimine totalmente el sobrenadante e inmediatamente agregue 1 o 2 gotas del suero AGH poliespecífico. 3.- Centrifugue el tiempo y velocidad estandarizado para lectura de AGH, y examine en busca de aglutinación. Regístrela en intensidad de cruces. La lectura es muy importante en este test para lo cual rote suavemente el tubo hasta lograr que se desprendan todos los eritrocitos del fondo. 75 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 4.- Si al usar suero AGH poliespecífico o anti-C3d la reacción es negativa, incube por 5 minutos a temperatura ambiente el tubo y proceda igual que en el punto 3. Esto le otorga mayor sensibilidad a la detección del complemento, especialmente en anemias hemolíticas autoinmune. Esta segunda lectura jamás puede reemplazar a la lectura inmediata ya que la reacción del anticuerpo IgG puede hacerse débil o negativa. 5.- Agregue 1 gota de células control de AGH (GR sensibilizados con IgG) a todo test cuyo resultado es negativo. 6.- Proceda igual que en el punto 3. Si los eritrocitos de la muestra no fueron adecuadamente lavados, quedando Igs libres, el suero AGH se neutralizará obteniendo en esta fase un resultado negativo. Para que el resultado del TAD sea válido, el resultado de esta etapa debe ser positivo. INTERPRETACIÓN: 1.- El TAD es positivo cuando se detecta aglutinación desde la centrifugación inmediata o después de la incubación de 5 minutos a temperatura ambiente. Las reacciones por IgG se observan en la centrifugación inmediata y el complemento generalmente se presenta mejor luego de la incubación a temperatura ambiente. Es necesario el uso de SAGH monoespecíficos para confirmar el tipo de globulinas presentes. 2.- El TAD es negativo cuando no se observa aglutinación en la centrifugación inmediata, luego de la incubación a temperatura ambiente, y si aparece la reacción positiva al agregar los eritrocitos sensibilizados con IgG en la última fase. NOTA: Un test con resultado negativo no necesariamente indica ausencia de globulinas sensibilizando los eritrocitos, los sueros AGH poliespecíficos y anti-IgG, detectan aproximadamente 200-500 moléculas de IgG por eritrocito, se han publicado casos de AHAI con un número inferior de anticuerpos por célula y por lo tanto con un TAD negativo. TECNICA DE AGLUTINACIÓN EN COLUMNA ( TARJETA): MUESTRA -Sangre obtenida con EDTA. REACTIVOS -Tarjetas para aglutinación en columna. -Solucion salina. PROCEDIMIENTO 1. Prepare una suspensión de eritrocitosen medio salino según indicaciones del fabricante. 2. Los hematíes obtenidos de cordon umbilical o procedentes de pacientes con proteínas sericas anormales se deben labar como minimo una vez con solución salina fisiológica. 3. Marcar la tarjeta con la muestra que se va a analizar. 4. Abrir la tira de aluminio exponiendo únicamente las columnas que se van a utilizar. Agregar la suspención de eritrocitos a las columnas. 5. Centrifugar las tarjetas. 6. Leer la aglutinación en cruces. 76 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL TEST ANTIGLOBULINA HUMANA INDIRECTO (TAI) TEST DE COOMBS INDIRECTO TÉCNICA EN TUBO El Test Antiglobulina Indirecto (TAI) se utiliza para comprobar el recubrimiento "in vitro" de los eritrocitos por anticuerpos y/o complemento, mediante incubación del suero (Ac) con hematíes (Ag) que posteriormente se lavan para eliminar las globulinas no adheridas. El hecho de que se produzca aglutinación después de añadir el reactivo AGH indica que el suero contiene anticuerpo(s) que reacciona(n) con antígeno (Ag) presente en el glóbulo rojo. Se utiliza para detección, identificación y titulación de anticuerpos, pruebas cruzadas, determinación de grupos sanguíneos con ciertos antisueros. TAI USANDO GLOBULOS ROJOS SUSPENDIDOS EN SALINO MUESTRA: Sangre total sin anticoagulante. - MATERIALES: Tubos Kahn (11 x 75mm). Gradilla para tubos Kahn. Centrífuga para inmunohematología. Fuente de luz. Pipetas Pasteur con capuchón de goma. REACTIVOS: - PBS o Suero fisiológico tamponado pH 7.3 - Suero antiglobulina humana poliespecífico. -Glóbulos rojos grupo O de al menos 2 donantes distintos que en suma posean los Ags. de importancia clínica. (D, C, E, c, e, Fya, Fyb, MNSs, JKa, JKb, K). Cada célula debe enfrentarse por separado al suero en estudio, el uso de pool de células da resultados falsos negativos. - Células control AGH - Suero control que posea un anticuerpo IgG débil (reacción de 2+ en AGH) METODO 1. Marcar los tubos con la identificación: paciente, suero control. 2. Depositar 2 gotas del suero en estudio y del suero control en los tubos correspondientes. 3. Agregar 1 gota de suspensión al 5% en salino de glóbulos rojos reactivos al tubo correspondiente y mezclar. 4. Centrifugar y leer de la forma previamente estandarizada. 5. Incubar los tubos a 37ºC por 60 min. 6. Centrifugar el tiempo establecido según estandarización de la centrífuga. 7. Leer en busca de hemólisis y/o aglutinación, rotando suavemente el tubo frente a una fuente de luz. Anotar los resultados tubo en mano. 8. Un resultado positivo de aglutinación o hemólisis en estas etapas no debe ser interpretado como producido por recubrimiento por IgG o Complemento. 9. Lavar los tubos débilmente positivos y negativos por 4 veces con PBS, eliminando al máximo el sobrenadante del último lavado. 10. Agregar a cada tubo 2 gotas del suero AGH. 11. Mezclar y centrifugar según punto 4. 77 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 12. Leer en busca de hemólisis y/o aglutinación, rotando suavemente el tubo frente a una fuente de luz. Anotar los resultados tubo en mano. 13. Confirmar los resultados negativos, agregando 1 gota de células control AGH (Coombs) a los tubos en que el resultado del test fue negativo. 14. Centrifugar y leer según punto 4. INTERPRETACIÓN: Se considera que un TAI es positivo cuando se detecta aglutinación después de agregar AHG. Esta positividad significa presencia de anticuerpo(s) de tipo IgG y/o de anticuerpo(s) que se manifiesta a través de la fijación de Complemento. Para que el test se considere válido, el tubo con suero control positivo debe presentar un resultado positivo y el resultado de las células control AGH debe ser positivo. NOTA: Puede acortarse el tiempo de incubación si en el punto 3, los eritrocitos se suspenden en medio de baja fuerza iónica (LISS), teniendo la precaución de utilizar los tiempos y volúmenes previamente estandarizados para este reactivo. TÉCNICA DE AGLUTINACIÓN EN COLUMNAS ( TARJETA): MUESTRA -Sangre total REACTIVOS -Solucion salina o PBS - Potenciador de la técnica -Tarjetas para aglutinación en columnas. -Globulos rojos grupo O de al menos 2 donantes diferente que en suma posean los Ags.de importancia clínica. METODO 1. Marcar las tarjetas según la muestra a identificar. 2. Abrir la tira de aluminio únicamente en las columnas que se van a utilizar para la reacción. 3. Añadir a las columnas ambas suspenciónes de los glóbulos rojos según indicaciones del fabricante. 4. Añadir suero de la muestra a las correspondientes columnas según indicaciones del fabricante. 5. Incubar. 6. Centrifugar la tarjeta. 7. Leer microplacas buscando aglutinación o hemolisis. FACTORES QUE AFECTAN LA SENSIBILIDAD DE UN TAGH 1.2.3.4.- Temperatura Fuerza iónica del medio Proporción suero/células Tiempo de incubación Para fines didácticos puede considerarse que el TAGH tiene diferentes fases, en cada una de las cuales existen causas de error que deben manejarse para un correcto resultado del test: 78 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL FASE 1: Selección de los eritrocitos de prueba: 1.Deben ser grupo O Rh positivo y contener todos los antígenos de importancia clínica. 2.Usarse por separado, nunca en pool. 3.Prepararse una suspensión al 2-4% en PBS, y 1,5 - 2% en LISS FASE 2: Sensibilización de los eritrocitos: 1.- Proporción correcta suero/células: para TAI en salino = 2:1 a 4:1 para TAI en LISS = 1:1 2.- Tiempo de incubación: Para TAI salino = 45 minutos a 1 hora Para TAI LISS = 15 a 20 minutos, según la estandarización del test. FASE 3: Lavado de las células: 1.- Trabajar con centrífugas calibradas. 2.- Uso de 4 lavados con abundante PBS. 3.- No interrumpir el proceso de lavado en ningún momento ya que los anticuerpos pueden eluirse. 4.- Mezclar bien los GR después de cada lavado, cuidando de soltar todas las células del fondo del tubo. 5.- Remoción de todo el sobrenadante del último lavado, idealmente secando el borde del tubo con papel absorbente muy limpio. 6.- Uso de células control AGH (sensibilizadas con IgG o Complemento, según corresponda) FASE 4: Lectura: 1.- Agregar la cantidad suficiente de suero AGH. 2.- Cuidar que el suero AGH en uso sea de calidad óptima conocida y que las condiciones de almacenamiento y uso sean las adecuadas. 3.- La lectura debe realizarse inmediatamente después de haber terminado el último lavado. 4.- Calibrar la centrifugación para lectura. 5.- lectura macroscópica: Agitación suave del tubo, idealmente Tip and Roll (rotación suave del tubo hasta desprender todas las células del fondo). 6.- Lectura microscópica: Observar el tubo colocado en forma horizontal bajo aumento lupa, o transferir su contenido a un porta objeto, colocar un cubre objeto y luego examinar con aumento 10X y 40X. En este caso sonimportantes los controles positivos y negativos (células de prueba solas), como así mismo la experiencia en este tipo de lectura. Es muy importante para obtener resultados confiables el uso en paralelo con los tubos test de un suero control conocido que presente una reactividad débil en AGH (2+) con los eritrocitos de prueba usados en el test. PREPARACION DE GLOBULOS ROJOS CONTROL PARA TEST ANTIGLOBULINA HUMANA En el test AGH, la presencia de suero residual después del último lavado puede llevar a neutralización parcial del reactivo AGH, que implicaría reacciones más débiles o negativas del test. Se recubren eritrocitos grupo O Rh positivo con IgG anti-D de modo que den una reacción de ++ a +++ al ser agregados a los test Antiglobulina Humana negativos. METODO I: MATERIALES: 79 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL - Eritrocitos grupo O Rh positivo (pool de 4 células R1r, con TAD negativo y con menos de 3 semanas de almacenamiento) - Anti-D con título 32 o 64. METODO: 1.- Lave los eritrocitos seleccionados por 3 veces con abundante PBS. 2.- Coloque 10 ml de PBS en un tubo y agregue 10 gotas del suero anti-D. Agregue una cantidad suficiente de los eritrocitos O previamente lavados como para obtener una concentración al 3% (aprox. 150 microlitros) 3.- Mezcle e incube a 37ºC durante 30-60 minutos. 4.-Lave los glóbulos rojos 4 veces con PBS y resuspendalos hasta alcanzar una concentración final del 2-3%. 5.- Realice un TAD a los eritrocitos tratados con el suero Antiglobulina Humana que Ud. utiliza de rutina en su Banco de Sangre. Debe obtener una reacción de +++. 6.- Estos eritrocitos pueden ser guardados a 4ºC por 48 hrs. METODO II MATERIALES: - Eritrocitos grupo O Rh positivo (pool de 4 células R1R1, con TAD negativo y con menos de 3 semanas de almacenamiento) - Anti-D con título = o superior a 128 (1 UI/ml) METODO: Se colocan 2 ml de GR concentrados, con 4 ml del suero anti-D; incubar durante 1 hora a 37ºC, centrifugar, eliminar sobrenadante y lavar por 4 veces con PBS. Para guardar use 1 ml de eritrocitos sensibilizados y 2 ml de sol. Alsever, puede guardarse durante 10 a 15 días a 4ºC, cuidando de mantener la esterilidad. Para uso diario, almacenar en alícuotas de 2 ml. Para su uso, suspender los eritrocitos a una concentración del 3% en PBS. DETECCION DE ANTICUERPOS IRREGULARES: TÉCNICA EN TUBO Los anticuerpos irregulares representan una inmunización a antígenos eritrocitarios de los otros sistemas sanguíneos y son distintos de los anticuerpos "naturales" anti-A y anti-B. La inmunización a estos antígenos eritrocitarios puede estar desencadenada por embarazo o transfusión, o por inyección deliberada de material inmunógeno. En algunos casos, el causante es desconocido. Los anticuerpos dirigidos contra antígenos eritrocitarios del propio individuo se denominan autoanticuerpos, a diferencia de los aloanticuerpos que reaccionan contra antígenos eritrocitarios de otros individuos de la misma especie. La determinación y selección de estos anticuerpos se realiza mediante técnicas de hemólisis y aglutinación principalmente, capaces de pesquisar Ac. clase IgM e IgG en el suero sanguíneo. Las características físico-químicas de los anticuerpos involucrados hacen necesario la utilización de medios y temperaturas óptimas y diferentes para cada tipo, como también eritrocitos reactivos con fenotipo adecuado. 80 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL MUESTRA: - Sangre sin anticoagulante, con no más de 48 hrs .de extraída. MATERIALES: - Tubos de Khan (vidrio 12x 75 mm) Pipetas Pasteur con capuchón de goma. Gradillas para tubos. Centrífuga para inmunohematología previamente calibrada. Lector para Inmunohematología. REACTIVOS: - Suero salino isotónico tamponado pH 7.0,o PBS. - Suero antiglobulina humana poliespecífico. - Eritrocitos reactivos de grupo O Rh +,con las siguientes características: 1.- Provenientes como mínimo de 2 donantes diferentes, uno R1R1 y el otro R2R2. Marcarlos como I y II. 2.- En conjunto posean los antígenos eritrocitarios de importancia clínica: D, C, E, c, e, M, N, S, s, Fya, Fyb, JKa, Jkb, Lea, Leb, P1. 3.- Que posean los antígenos que presentan efecto de dosis en estado homocigoto. - Células control de test AGH. - Suero AB inerte. - Suero control positivo débil. MÉTODO: 1. Marcar 3 tubos con las siglas I, II , PA. Depositar en cada uno 2 gotas del suero en estudio. 2. Agregar al tubo I, 1 gota de la suspensión al 2-4% en salino de eritrocitos reactivos seleccionados como I (lavado previo 4 veces). 3. Agregar al tubo II, 1 gota de la suspensión al 2-4% en salino de eritrocitos reactivos seleccionados como II (ídem). 4. Agregar al tubo PA, 1 gota de la suspensión al 2-4% en salino de los eritrocitos de la muestra en estudio (ídem). 5. Mezclar y centrifugar al tiempo y velocidad establecida en la estandarización de la centrífuga. 6. Leer, frente a una fuente luminosa, rotando suavemente el tubo en busca de hemólisis y/o aglutinación macroscópica. Anotar los resultados en el protocolo. 7. Incubar por 15 min. a temperatura ambiente y proceder luego como en los puntos 3 y 4. 8. Incubar en un baño María a 37ºC, por 45 min. y luego proceder como en los puntos 3 y 4. 9. Lavar los tubos negativos o débilmente positivos por 4 veces con salino tamponado o PBS para realizar la prueba de AGH. 10. Después de eliminar totalmente el sobrenadante del último lavado, agregar 1 gota de suero AGH poliespecífico y proceder como en los puntos 3 y 4. 11. En los tubos que resultaron negativos, agregar 1 gota de células control AGH y proceder como en los puntos 3 4. 81 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL NOTA: a) b) si se dispone de un set de eritrocitos comercial, utilizar según las indicaciones del fabricante. El tiempo de incubación puede acortarse si en el punto 2 los eritrocitos se suspenden en medio de baja fuerza iónica, LISS, teniendo la precaución de utilizar los tiempos previamente establecidos en la estandarización del reactivo, por ej.: 10-15 min a 37ºC y los reactivos en proporción volumen a volumen. INTERPRETACIÓN: Se considera como positiva una detección de anticuerpos irregulares, cuando en cualquiera de sus fases se observa aglutinación o hemólisis. Este método proporciona además las características de reacción, medio y temperatura óptimos del anticuerpo pesquisado, así como también la condición de alo o autoanticuerpo. EJEMPLOS: Aloanticuerpo S 37º AGH S 37º AGH I - II 1+ PA - Auto + Aloanticuerpo I II 1+ 4+ PA 1+- Crioaglutininas S 37º AGH I 3+ - S 37º AGH I 1+ 2+ II 3+ - PA 3+ +/- II 1+ 2+ PA 1+ 2+ Autoanticuerpo CONTROL DE CALIDAD: 1.-En cada set de tests debe incluirse en paralelo como control positivo un suero que posea un anticuerpo débil, con una reacción de 1+ o 2+ en AGH y un control negativo con suero AB inerte. 2.-Si utiliza LISS debe tener las precauciones establecidas para este medio. TÉCNICA EN COLUMNAS (TARJETAS). La detección de anticuerpos irregulares en gel utiliza glóbulos rojos diluidos solos o con plasma para el uso en TAD, TAI como también en pruebas cruzadas. El fundamento de esta técnica se basa en una reacción de Coombs dentro del tubo de la tarjeta de gel, la cual se 82 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL incuba junto a los glóbulos rojos y plasma a probar para observar aglutinación. Luego de un proceso de centrifugación, las células que den reacción negativa (no aglutinación) pasaran por la matriz de gel hasta el fondo del tubo, en cambio las reacciones positivas (aglutinación) quedaran atrapadas en la matriz con diferentes intensidades según sea la reacción. MUESTRAS: - Suero o plasma obtenido de muestras de sangre tomadas con EDTA. MATERIALES - Pipetas automáticas de 25 y 50 microlitros. - Puntas de pipetas desechables. - Gradillas. EQUIPOS: - Centrífuga con soporte para geles. - Incubador a 37°C. REACTIVOS - Glóbulos rojos comerciales para la detección de Acs. Irregulares al 1% en medio de Baja Fuerza Iónica. - Tarjeta Gel Coombs. (Pool I y II), diluidos METODO 1. Identifique las columnas de gel según corresponda. Debe utilizar dos columnas para cada muestra en estudio. 2. Dispense en los pocillos de incubación de los microtubos (columna de gel) correspondientes 50 microlitros de glóbulos rojos del Pool I y del Pool II respectivamente. 3. Añada 25 microlitros de suero o plasma del paciente. 4. Incube por 15 minutos a 37ª C. 5. Centrifugue las tarjetas de geles. 6. Lea e interprete los resultados. Se recomienda una lectura inmediata de los resultados después de la centrifugación de las tarjetas, sin embargo se pueden leer hasta 24 horas después, si se conservan en posición vertical, refrigeradas y selladas con parafilm, para evitar la evaporación del sobrenadante. INTERPRETACIÓN DE RESULTADOS. (Figura 1) Reacción negativa: Banda de hematíes en el fondo de la columna, resto de la columna sin aglutinados visibles. Reacción positiva: +/- : Escasos aglutinados de pequeño tamaño en la mitad inferior de la columna. 1+ : Algunos aglutinados de pequeño tamaño en la columna. 2+ : Aglutinados de tamaño pequeño o mediano a lo largo de la columna. 3+ : Banda superior de aglutinados, de tamaño mediano en la mitad superior de la columna. 4+ : Banda de Hematíes aglutinados en la parte superior de la columna. 83 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL Doble población: Doble banda de hematíes, en el fondo y en la parte superior de la columna. Hemólisis: Sobrenadante y columna de color rosa. Figura 1 DETECCION DE ANTICUERPOS IRREGULARES EN PAPAINA Técnica enzimática en dos etapas REACTIVOS: - Papaína al 1% - PBS - Eritrocitos de prueba seleccionados igual que en el método anterior - Suero AB inerte - Suero control de reactividad débil. A. Preparación de los eritrocitos papainizados. 1.- Descongelar 2 alícuotas de papaína al 1% 2.- Agregar a cada una 0.9 ml. de PBS y marcarlos con las siglas I y II respectivamente. 3.- Adicionar a cada solución de Papaína al 0.1%, 250 ul de eritrocitos reactivos seleccionados como I y II, previamente lavados y concentrados, en el tubo correspondiente. 4.- Incubar a 37ºC según los minutos establecidos al estandarizar la técnica con cada lote de papaína. Ej. : 16 min. 5.- Centrifugar, eliminar el sobrenadante y lavar las células por 2 veces con PBS. 6.- Resuspenderlas al 2% en PBS. Mantener en refrigeración a 4ºC. En estas condiciones duran 48 hrs. 7.- Efectuar los controles necesarios para el uso de papaína. METODO 1.- Marcar dos series de 4 tubos cada una con las siglas I y II, + y -. 2.- Depositar en los tubos I y II, 2 gotas del suero en estudio, 2 gotas de suero reactivo débil en el tubo + y 2 gotas de suero AB inerte en el tubo marcado -. Agregar a todos los tubos de la primera serie 1 gota de los eritrocitos papainizados I y a la segunda serie 1 gota de los eritrocitos papainizados II. 3.- Incubar 1 hr. a 37ºC no centrifugar y leer en la forma estandarizada. 84 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL INTERPRETACIÓN La presencia de anticuerpos se visualiza en forma de aglutinación o hemólisis en los tubos I y/o II. Para un resultado válido, el tubo + debe resultar positivo y el - debe ser negativo. CONTROL DE CALIDAD: - Uso de técnicas enzimáticas previamente estandarizadas. - Uso de controles positivos y negativos diarios en cada set de tests. - Solo lecturas macroscópicas. - Controlar las condiciones de almacenamiento de la solución stock de enzima (- 30ºC) y de las células papainizadas (duración máxima 24 horas a 4ºC). DETECCIÓN DE ANTICUERPOS EN MEDIO LISS Se usa para evidenciar la presencia de un anticuerpo dirigido contra algún sistema sanguíneo, en un medio de baja fuerza iónica o LISS, lo que permite acortar el tiempo de incubación y favorecer la aglutinación a algunos anticuerpos que presentan constantes de asociación a su antígeno relativamente bajas. Al usar este tipo de medio es muy importante hacer una estandarización previa y trabajar con control positivo (anticuerpos débilmente reactivos) y control negativo (suero AB inerte). Revisar las limitaciones del método. REACTIVOS: - Suero salino isotónico tamponado pH 7.0,o PBS. - Suero antiglobulina humana poliespecífico. - Eritrocitos reactivos de grupo O Rh +, con iguales características que las descritas en la técnica de detección de anticuerpos irregulares. - Células control de test AGH. - Suero AB inerte. - Suero control positivo débil. - Medio LISS. MÉTODO: 1.- Marcar 3 tubos con las siglas I, II, PA. Depositar en cada uno 2 gotas del suero en estudio. 2.- Agregar al tubo I, 2 gotas de la suspensión al 2% en LISS de eritrocitos reactivos seleccionados como I (hacer un lavado previo con PBS por 3 veces, eliminar todo el sobrenadante y suspender las células en LISS). Agregar al tubo II, 2 gota de la suspensión al 2% en LISS de eritrocitos reactivos seleccionados como II (preparados igual que las células I) Agregar al tubo PA, 2 gota de la suspensión al 2% en LISS de los eritrocitos de la muestra en estudio (preparados igual que las células I). NOTA: si se dispone de un set de eritrocitos comercial, dispensar según las indicaciones del fabricante. 3.- Mezclar y centrifugar al tiempo y velocidad establecida en la estandarización de la centrífuga. 4.- Leer, frente a una fuente luminosa, rotando suavemente el tubo en busca de hemólisis y/o aglutinación macroscópica. Anotar los resultados en el protocolo. 5.- Incubar por el tiempo establecido en la estandarización del medio LISS, a 37ºC y proceder luego como en los puntos 3 y 4. 85 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 7.- Lavar los tubos negativos o débilmente positivos por 4 veces con salino tamponado o PBS para realizar la prueba de AGH. 8.- Después del último lavado, eliminar totalmente el sobrenadante, agregar 1 gota de suero AGH poliespecífico y proceder como en los puntos 3 y 4. 9.- En los tubos que resultaron negativos, agregar 1 gota de células control AGH y proceder como en los puntos 3 y 4. NOTA: Al utilizar LISS debe tener las siguientes precauciones: a) Uso de una proporción suero/células 1/1. Esto es obligatorio. b) Los eritrocitos deben lavarse previamente en PBS, para luego suspenderlos en LISS. c) Dejar que las células alcancen temperatura ambiente antes de su uso, ya que de lo contrario puede inducirse reacciones falsas positivas. d) La suspensión de células en LISS se asocia con un acelerado deterioro de algunos antígenos como Fya, Fyb, S, s, por lo que ellos no deben ser usados más allá de 24 horas. e) Puede utilizarse azida de sodio como preservativo, para evitar contaminación. f) Debe usarse un método previamente estandarizado, para determinar los tiempos de incubación, según el método descrito en este manual. IDENTIFICACION DE ANTICUERPOS IRREGULARES Los aloanticuerpos irregulares son anticuerpos distintos a los anticuerpos naturales anti-A y antiB. Estos aloanticuerpos se encuentran en aproximadamente un 0.3 - 2% de la población, según sea el grupo estudiado y la sensibilidad del método utilizado. Una vez detectada la presencia de un anticuerpo irregular, debe determinarse su especificidad y su significación clínica. Un anticuerpo clínicamente significativo es aquel que acorta la sobrevida prevista de los hematíes incompatibles transfundidos, o que se asocia con enfermedad hemolítica del recién nacido (EHRN). No obstante el grado de significación clínica es variable. Algunos anticuerpos producen la destrucción de los G.R. en pocas horas e incluso minutos, mientras que otros acortan la sobrevida prevista en solo unos pocos días. Por lo tanto, puede utilizarse la experiencia documentada de un anticuerpo con la misma especificidad para evaluar la significación clínica de un anticuerpo dado. COMPORTAMIENTO SEROLOGICO DE LOS PRINCIPALES ANTICUERPOS IRREGULARES AC M N S S U Lua Lub K K Fya Fyb Jka Jkb Dia Dib 86 LISIS In vitro No No No No No No No No No No No Alg Alg No No SALINO 4ºC 22ºC May Alg May Pocos Pocos Alg 0 Pocos 0 Pocos Alg May Pocos Pocos Pocos Pocos Raros Raros Pocos Pocos Alg AGH Pocos Ocas May May May Pocos May May May May May May May May May ENZIMA 37ºC AGH 0 0 0 0 May Pocos Pocos Alg Alg 0 0 Alg Alg Alg Alg May Pocos Pocos May May 0 0 Si Si Si Si ASOCIADO A EHRN RPT Pocos Pocos Raros ¿ Si Si Si Si Si Si No ¿ Mod Si Si Si Si Si Si Si Si Si Si Si Si Si Si Si ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL alg= algunos; may= mayoría; ? = desconocido; O = negativo No existen datos concretos de algunos anticuerpos, por lo que se considera que un anticuerpo es clínicamente significativo, si él es activo a 37ºC y en test AGH. La determinación de la especificidad de un aloanticuerpo es importante para valorar la necesidad de seleccionar para la transfusión, sangre antígeno negativa. PRINCIPIO DEL TEST: Usando las condiciones bajo las cuales el anticuerpo fue originalmente detectado, se mezcla el suero con cada tipo celular del panel de identificación, observando la presencia o ausencia de lisis o aglutinación y comparando el patern de reactividad con el perfil antigénico de las células. PROCEDIMIENTO GENERAL MUESTRA: Idealmente 10 ml de sangre total sin anticoagulante MATERIALES: Tubos Khan Gradilla para tubos Khan Baño termorregulable Centrífuga para Inmunohematología Pipetas Pasteur Lector para test inmunohematológicos. REACTIVOS: Suero antiglobulina humana poliespecífica. PBS o suero fisiológico tamponado pH 7.0 Panel de células para identificación de anticuerpos. Células control para test AGH. Suero AB inerte. METODO: 1.Leer cuidadosamente las instrucciones del panel a usar. 2.Numerar tantos tubos de Khan como muestras tenga el panel a usar, agregue un tubo más para el autocontrol. 3.Agregue a cada tubo, incluyendo el autocontrol 2 gotas del suero en estudio, usando una pipeta Pasteur. 4.Coloque en cada tubo 1 gota de eritrocitos del correspondiente frasco del panel de identificación. Ej.: En el tubo Nº1 agregar 1 gota de las células del frasco Nº1 y así sucesivamente. En el tubo destinado al autocontrol, coloque 1 gota de células del paciente suspendidas al 3% en salino o en solución diluyente de células. 5.Mezclar y centrifugar el tiempo estandarizado para lectura en su centrífuga. 6.Lea en busca de hemólisis o aglutinación en cada tubo y anote los resultados en cruces, tubo en mano. 7.Incubar por 45 minutos a 37ºC todos los tubos. 8.Proceda igual que en los puntos 5 y 6. 87 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 9.- 10.11.12.13.- Lave con abundante PBS todos los tubos cuyo resultado sea débilmente positivo o negativo, por cuatro veces, cuidando de eliminar bien el sobrenadante del último lavado. Agregue a cada tubo una gota de suero antiglobulina humana poliespecífico. Proceda igual que en los puntos 5 y 6. En los tubos cuya prueba de AGH fue negativa, agregue 1 gota de células control AGH, centrifugue y lea. Interprete los resultados en la tabla del panel. NOTA: Existen varios tipos de paneles (fríos, calientes, tratados con enzimas, etc.) en que el procedimientos para realizar este test varía de acuerdo a las características de cada tipo de panel. Puede usarse LISS como medio de suspensión de cada célula del panel, teniendo la precaución de lavarlas por lo menos 1 vez con LISS y luego resuspenderlas en ese reactivo al 2%. De esa forma puede disminuirse el tiempo de incubación. CONTROL DE CALIDAD: - Uso de paneles de células de reactividad conocida y probada. - Validación de los resultados AGH negativos con células control - Uso de suero AB inerte como control negativo. - Uso de prueba autóloga. AGH. CONSIDERACIONES EN LA INTERPRETACION DE LOS RESULTADOS SEROLOGICOS Los aloanticuerpos de ciertas especificidades de grupo sanguíneo muestran a menudo características serológicas constantes (ver tabla anterior). Al interpretar los resultados de los estudios serológicos, es importante buscar estas características y examinar los fenotipos tanto de las muestras de hematíes reactivos como no reactivos. Deben considerarse los puntos siguientes: a.b.c.d.- ¿Cuáles son los efectos de la temperatura, medio de suspensión o enzimas proteolíticas sobre la reacción? ¿Hay alguna variación de intensidad de la aglutinación observada entre las muestras de hematíes reactivos? ¿Hay hemólisis? ¿Los hematíes autólogos son o no reactivos?. A continuación se detalla una serie de puntos a seguir para interpretar los resultados de las pruebas de identificación de aloanticuerpos y seleccionar pruebas adicionales necesarias para la confirmación: 1.- AUTOCONTROL: Evaluar las reacciones del autocontrol. Si son negativas, se excluye la presencia de autoanticuerpos. Si son positivas, considerar la presencia de autoanticuerpos o aloanticuerpos producidos en respuesta a una transfusión previa reciente. 2.- HEMATIES REACTIVOS: No considerar inicialmente los antígenos presentes en las muestras no reactivas. 3.- HEMATIES AUTOLOGOS: No considerar anticuerpos contra antígenos presentes en los hematíes autólogos. 4.- HEMATIES TRATADOS CON ENZIMAS: Examinar los fenotipos (Ej.: S, Fya) de las muestras que reaccionan con los hematíes no tratados, pero no son reactivas (o más débiles) frente a hematíes tratados con enzimas. 88 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 5.- PATRON DE REACCION: Examinar los patrones de reacción en cada fase de la prueba, recordar las posibles especificidades implicadas y considerar posibles especificidades en relación a la fase de la prueba y el tipo de especificidad (Ej.: aglutinación con anti-P1, hemólisis a 37ºC con anti Lea, falta de reactividad con anti-Fya y hematíes tratados con enzima) 6.- PRUEBAS ADICIONALES: Analizar un número suficiente de muestras de hematíes de fenotipo adecuado para obtener un valor p (probabilidad) inferior a 0.05 para cada anticuerpo sospechado. Analizar el suero frente a hematíes con dosis doble de antígeno contra los cuales el suero puede tener anticuerpos, si estos no se encontraban presente en las muestras anteriormente no reactivas. Analizar hematíes autólogos con antisueros adicionales (en caso necesario) para demostrar la ausencia de todos los antígenos contra los cuales el suero tiene anticuerpos. CALCULO DE PROBABILIDAD: Para la identificación definitiva del anticuerpo, debe realizarse un Nº suficiente de muestras de hematíes que carezcan del antígeno frente al cual el anticuerpo parece mostrar especificidad, y un Nº suficiente de hematíes que contengan dicho antígeno. Es necesario comprobar que el patrón de reactividad observado no es producto del azar. La tabla siguiente muestra las probabilidades de diversas combinaciones de pruebas reactivas y no reactivas calculadas según el método exacto de Fisher para estimar probabilidades. Los valores de probabilidad (p) que se muestran en la tabla siguiente son el resultado de pruebas estadísticas que demuestran la probabilidad de que un conjunto dado de resultados sea producto únicamente del azar. Un valor de p de 0.05 indica que los mismos resultados se obtendrían por azar en 1 de 20 estudios parecidos; las posibilidades de que la interpretación de los datos sea correcta es de 19:1 (95%). Una p de 0.05 es el valor mínimo aceptado en el que una interpretación se considera estadísticamente válida. Debido a estos requisitos estadísticos, para confirmar la especificidad del anticuerpo, la mayoría de los paneles de hematíes tienen una capacidad limitada para identificar de forma concluyente algunos anticuerpos. VALORES DE PROBABILIDAD Nº muestras analizadas 6 6 7 7 8 8 8 8 9 9 9 10 10 10 10 10 Nº muestras positivas 4 3 5 4 7 6 5 4 8 7 6 7 9 8 6 5 Nº muestras negativas 2 3 2 3 1 2 3 4 1 2 3 3 1 2 4 5 P 0.067 0.050 0.048 0.029 0.125 0.036 0.018 0.014 0.111 0.028 0.012 0.008 0.100 0.022 0.005 0.004 89 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL CALCULO: Los niveles de probabilidad para la identificación de anticuerpos se calculan construyendo tablas de 2x2 en las que la presencia y ausencia de reactividad sérica se relaciona con la presencia o ausencia de un antígeno concreto en las muestras de hematíes analizadas. Una tabla 2x2 se construye como sigue: HEMATIES REACCIONES SERICAS POSITIVO Ag PRESENTE Ag AUSENTE TOTAL A B A+B NEGATIVO C D C+D TOTAL A+C B+D N A: Nº de reacciones positivas observada con células Ag positivas. B: Nº de reacciones positivas observada con células Ag. negativas C: Nº de reacciones negativas ob. con células Ag. positivas D: Nº de reacciones negativas ob. con células Ag. negativas N: Nº total de muestras de hematíes analizadas. La fórmula para calcular la probabilidad (p) a partir de una tabla 2X2 es la siguiente: p= (A+B)! x (C+D)! x (A+C)! x (B+D)! N! x A! x B! x C! x D! NOTA: !: símbolo de factorial, que es el producto de todos los números enteros desde 1 hasta el número en cuestión. Ej.: 6!: 6x5x4x3x2x1= 720 3!: 3x2x1= 6 1!: 1 0!: 1 EJEMPLO DE CÁLCULO: Para un suero reactivo con 3 muestras de células E+ y no reactivo con 3 muestras E-, la tabla 2X2 es: REACCIONES SERICAS POSITIVO Ag PRESENTE E+ 3 HEMATIES Ag AUSENTE E0 NEGATIVO 0 3 3 TOTAL 3 3 6 p: 90 3! x 3! x 3! x 3! = 6! x 3! x 0! x 3! x 0! 36 = 720 1 = 20 TOTAL 3 0.05 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL Esto indica que hay una probabilidad de 1 en 20 de que un anticuerpo distinto de anti-E pudiera, debido al azar, haber ocasionado las reacciones observadas. Este nivel de probabilidad es el mínimo aceptable para la significación estadística. La prueba del suero frente a 10 muestras de hematíes, 6 E- y 4 E+, mejora drásticamente el nivel de probabilidad para anti-E. TECNICA DE IDENTIFICACION DE AC. EN BROMELINA MUESTRA: Suero en estudio REACTIVOS: • 1.- Solución stock bromelina al 0.5% -Pesar 0.5 gr de bromelina en polvo (con al menos 2 cristalizaciones de pureza 2x). -Disolver homogenizando en 90 ml de suero fisiológico (no agitar bruscamente ni agitar con bagueta, demora aprox. 1 o 2 horas). -Agregar 10 ml de buffer Soerensen 15 molar pH 5.5. -Centrifugar o dejar decantar. -Almacenar el sobrenadante en alícuotas y congelar a -30ºC, es estable por 2 - 3 meses. • 2.- Buffer Soerensen 15 molar pH 5.5: Solución A: KH2PO4 0.91 gr H2O csp 100ml Solución B: Na2HPO4 + 2H2O 1.2 gr H2O csp 100 ml Mezclar 97 ml de solución A con 3 ml de solución B. Ajustar pH con las mismas soluciones. • 3.- Bromelina al 0.1% : -Diluir 1/4 bromelina al 0.5% recién descongelada con buffer Soerensen diluido 1/10 con suero fisiológico, si no se dispone de buffer podría diluirse en fisiológico. -Panel de células para identificación. -Suero AB inerte -Suero AGH poliespecífico -Células control AGH. METODO: 1.Marcar 11 tubos y agregar a cada uno el glóbulo rojo correspondiente del panel de identificación, más una prueba autóloga. 2.Agregar a cada tubo 1 o 2 ml de suero fisiológico (no PBS), centrifugar y eliminar todo el sobrenadante, secando muy bien el borde del tubo. 3.Agregar a cada tubo 1 gota de bromelina al 0.1% recién preparada y agitar. 4.Incubar a temperatura ambiente por 5 minutos. 5.Inmediatamente agregar a cada tubo 2 gotas del suero en estudio, agitar. 6.Incubar a 37ºC por 20 minutos. 7.Centrifugar el tiempo estandarizado para lectura. 8.Leer contra controles positivos y negativos. 9.Terminar el test en AGH si es necesario. 91 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL TITULACION DE ANTICUERPOS La titulación es una forma semicuantitativa de medir la cantidad de anticuerpos presentes en una muestra a estudiar. Una de las aplicaciones más útiles de la titulación es el seguimiento de muestras de pacientes embarazadas, con anticuerpos que pueden causar Enfermedad Hemolítica del Recién Nacido. Para que los resultados sean significativos es importante titular en paralelo y bajo las mismas condiciones, las muestras tomadas en las distintas etapas de la gestación. Los títulos también puede ayudar a identificar la especificidad de los anticuerpo en una mezcla, cuando el suero se titula contra células de fenotipos diferentes; a determinar la fuerza relativa de un antígeno dado en diferentes muestras celulares (ej.: el título de un anticuerpo anti-M será más alto con células MM que con células MN); y a revelar la presencia de anticuerpos de "alto título, baja avidez" (ATBA). Al proceder a titular un anticuerpo es necesario conocer previamente su medio, tiempo y temperatura óptima de reacción y utilizar estas mismas condiciones en la técnica de titulación. MATERIALES: - Tubos de Kahn (vidrio 12x 75 mm). - Pipeta automática de 1 ml y de 100ul. - Puntas desechables para pipeta automática. - Centrífuga para inmunohematología calibrada previamente. - Gradilla para tubos Kahn. - Fuente luminosa para lectura. REACTIVOS: - Suero en estudio. - Suspensión celular de fenotipo adecuado. - Medio de suspensión adecuado al anticuerpo en estudio. MÉTODO: Se preparan diluciones madres dobles en la siguiente forma: 1. Marcar 10 tubos del 1 al 10; colocar a partir del tubo nº 2 un volumen constante (ej.: 0.5ml) del diluyente apropiado (suero AB inerte, PBS, etc.). El tubo 1 corresponde al suero sin diluir. 2. Depositar en los tubos 1 y 2, igual volumen de suero en estudio al usado para diluir (ej.: 0.5ml). Mezclar varias veces el contenido del tubo 2 con una punta de pipeta limpia, evitando la formación de burbujas. Se obtendrá en este tubo una dilución de 1 en 2. 3. Tomar del tubo 2 igual volumen elegido (0.5ml) y agregarlo al tubo 3. Mezclar en forma similar al punto 2. Se obtendrá una dilución 1 en 4. 4. Repetir el proceso utilizando cada vez una punta de pipeta limpia para cada dilución, hasta terminar la corrida de tubos. En el tubo nº 10 obtendrá una dilución 1 en 1024. Retirar un volumen del suero diluido del último tubo y guardarlo para realizar nuevas diluciones si fuera necesario. 5. Marcar nuevamente 10 tubos del 1 al 10. 6. Depositar 100ul de cada dilución madre en los tubos correspondientes y agregar 50ul de la suspensión en salino al 4% de las células apropiadas. Puede utilizar la misma punta si se dispensa primero la dilución mayor (ej. desde el tubo 10). 92 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 7. Efectuar la técnica que haya sido seleccionada de acuerdo a las características de reacción óptima del anticuerpo a titular (ej.: salino, TAI, 37ºC) 8. Examinar macroscópicamente las reacciones, evaluar y registrar los resultados. Como el fenómeno de prozona puede producir reacciones más débiles o negativas en las diluciones menores, es preferible empezar la lectura por el tubo que contiene la mayor dilución. INTERPRETACIÓN: El título es recíproco a la mayor dilución que presenta aglutinación de 1+, o hemólisis, ej.: si la dilución 1/64 da una reacción positiva pero la dilución siguiente 1/128 es negativa, el título es 64. En estudios comparativos, una diferencia mayor a 2 diluciones entre dos sueros se considera significativa. Las variaciones de la técnica y del operador, puede hacer que los resultados de las pruebas duplicadas se diferencien hasta +/- una dilución. Una mejor idea de la fuerza del anticuerpo, está dada por el score o puntaje de reacción. Por ejemplo, cuando se comparan dos sueros de la misma especificidad: Suero X Y 1/1 4+ 12 ½ 4+ 12 ¼ 3+ 10 1/8 2+ 8 4+ 12 4+ 12 4+ 12 3+ 10 Dilución 1/16 1/32 1+ 1+ 5 5 3+ 10 2+ 8 1/64 1+ 5 1/128 0 1/256 0 1+ 5 0 0 Score 55 71 Ambos sueros tienen el mismo título de 64 ; el suero Y contiene el anticuerpo más potente con un score de 71, comparado con el suero X que muestra un score de 55. Una diferencia mayor de 10 en el score es significativa. Para mejor interpretación del clínico, es conveniente informar título y score. NOTAS: 1.- Es esencial una técnica de pipeteo cuidadosa. Se recomienda el uso de pipetas automáticas con puntas desechables, las que deben cambiarse después de efectuar cada dilución. 2.- Deben utilizarse siempre los tiempos, temperaturas de incubación y centrifugación considerados óptimos. 3.- La edad, fenotipo y concentración de la suspensión de GR puede influir en los resultados. Cuando haya que comparar los títulos de diferentes muestras de un anticuerpo, todos los sueros deberán ser enfrentados a una muestra de hematies del mismo donante. Si no es posible, se debe emplear GR del mismo fenotipo. Cuando vaya a analizarse un mismo suero frente a distintas muestras de GR, las muestras de suero deben extraerse y conservarse en las mismas condiciones, y diluirse a la misma concentración antes de su uso. 4.- Es imposible la interpretación de los resultados si las muestras a comparar no se titulan en paralelo, bajo las mismas condiciones de trabajo. Un ejemplo es el seguimiento de muestras de pacientes embarazadas, con anticuerpos que pueden causar Enfermedad Hemolítica del Recién Nacido. Para que los resultados sean significativos es fundamental titular en paralelo y bajo las mismas condiciones las muestras tomadas en las distintas etapas de la gestación. 5.- En las pruebas de un suero único frente a distintos tipos de GR, debe usarse la misma muestra o suero diluido en todas ellas. 93 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 6.- Las determinaciones son más exactas si se emplean mayores cantidades de suero en las diluciones, por lo que se debe trabajar con dilución madre, ya que da resultados más confiables que las diluciones individuales. 7.- Para tener resultados confiables es necesario usar en paralelo, como control de calidad, un suero standard de referencia para compararlo con los resultados de la muestra en estudio. PRUEBA CRUZADA O CROSMATCH El objetivo de la prueba cruzada o crosmatch es seleccionar, para cada receptor, la unidad de sangre total, glóbulos rojos u otro componente sanguíneo que, una vez transfundidos, tendrán una sobrevida aceptable, no experimenten destrucción clínicamente significativa y no afecten los hematies del receptor. Se han descrito 2 tipos de prueba cruzada: mayor y menor. La prueba cruzada mayor es la más importante y se aplica rutinariamente en los Bancos de Sangre, ya que permite detectar en el receptor, anticuerpos clínicamente significativos que pueden producir acortamiento de la sobrevida o destrucción de los hematíes a transfundir. La prueba cruzada menor, consiste en detectar anticuerpos presentes en el componente a transfundir que pudieran destruir los eritrocitos del receptor. Se usa solo en ocasiones muy especiales. PRUEBA CRUZADA (mayor): TÉCNICA EN TUBO MUESTRA: - Sangre total sin anticoagulante, que represente bien el estado inmunológico del receptor en el momento de realizar la transfusión. MATERIALES: - Pipetas Pasteur con capuchón de goma. - Tubos Kahn de vidrio (12x75mm) - Centrífuga para inmunohematología. - Baño termo regulable. - Gradillas para tubos Kahn. - Fuente de luz. REACTIVOS: - Suero Antiglobulina Humana poliespecífica. - Suero fisiológico tamponado o PBS. - Medio de baja fuerza iónica.(LISS) - Suero control de reactividad débil - Suero AB inerte. - o en su defecto controles comerciales MÉTODO: 1.- Marque un tubo con el nº de la unidad a transfundir. Prepare en él, una suspensión al 2% en LISS de los eritrocitos a transfundir, previamente lavados( 2 veces) y concentrados. El último lavado debe ser en LISS.(0.5ml.de LISS + 10microltde GR) 94 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 2.- Marque un tubo con el Nº de la unidad a transfundir y las iniciales del receptor. Deposite 2 gotas del suero del receptor y 2 gotas de la suspensión de eritrocitos a transfundir. 3.- Mezcle, centrifugue a velocidad y tiempo establecidos. Lea en busca de hemólisis o aglutinación, rotando suavemente el tubo frente a una fuente de luz. Anote los resultados tubo en mano 4.- Incube a 37ºC por 10 -15 min; según tiempo establecido en estandarización de LISS. 5.- Proceda igual al pto. 3. 6.- Lave los tubos negativos 4 veces con abundante PBS. Elimine totalmente el sobrenadante del último lavado. 7.- Agregue 1 gota de suero antiglobulina humana poliespecífico. 8.- Proceda igual al puntoNº 3. 9.- Agregue a los tubos que dieron resultados negativos, 1 gota de células control AGH (Coombs). 10.- Proceda igual al punto Nº 3. INTERPRETACIÓN Las pruebas cruzadas con resultados negativos en todas sus etapas (excepto células control), indican que las unidades estudiadas son compatibles. CONTROL DE CALIDAD: 1.- Junto con cada prueba cruzada es necesario realizar un autocontrol o prueba autóloga, bajo las mismas condiciones de trabajo que la muestra. 2.- El control de calidad, realizado diariamente y en cada turno, consta de un control positivo que se obtiene contactando suero con Ac. débil pero clínicamente significativo y eritrocitos con el ag. respectivo; y de un control negativo utilizando suero AB inerte sin Ac. irregulares y los eritrocitos adecuados. 3.- Al utilizar PBS o salino en la suspensión de los hematíes, incubar por 60 min. en proporción 2 de suero / 1 de suspensión. 4.- Al usar LISS la proporción suero/célula es 1/1. PRUEBA CRUZADA(mayor): TÉCNICA EN GEL MUESTRAS: - Suero o plasma obtenido de muestras de sangre tomadas con EDTA. - Glóbulos Rojos obtenidos de la tubuladura de la unidad a utilizar. MATERIALES - Pipetas automáticas de 25 y 50 microlitros. - Puntas de pipetas desechables. - Gradillas. EQUIPOS: - Centrífuga con soporte para geles. - Incubador a 37°C. REACTIVOS REVISAR - Tarjeta Gel Coombs. - solución diluyente de GR según inserto METODO 1. Seleccionar una unidad de donante compatible. 95 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 2. Identifique las columnas de gel según corresponda, con el número de la unidad seleccionada y las iniciales del paciente. Debe utilizar una columna para cada muestra en estudio. 3. Obtener una alícuota desde la tubuladura en un tubo Khan (preparar suspensión según indicaciones del inserto). 4. Dispense en otro tubo Khan, 200 ul 5. Tomar 5 ul de GR lavados, y traspasarlo al tubo con la solución diluyente (GR 1%). 6. Dispense en los pocillos de incubación de los microtubos (columna de gel) correspondientes, 50 microlitros de glóbulos rojos diluidos. 7. Añada 25 microlitros de suero o plasma del paciente. 8. Incube por 15 minutos a 37ª C. 9. Centrifugue las tarjetas de geles. 10. Lea e interprete los resultados. Se recomienda una lectura inmediata de los resultados después de la centrifugación de las tarjetas, sin embargo se pueden leer hasta 24 horas después, si se conservan en posición vertical, refrigeradas y selladas con parafilm, para evitar la evaporación del sobrenadante. INTERPRETACIÓN RESULTADOS: Página 104 ESTANDARIZACION DEL MEDIO DE BAJA FUERZA IONICA (LISS) Previo al uso de un medio LISS, más aún si es preparado en el propio laboratorio, es necesario realizar una acuciosa estandarización para determinar el tiempo óptimo de incubación necesario para revelar de buena forma la presencia de un anticuerpo irregular. MUESTRA: - LISS a estandarizar MATERIALES: - Tubos Khan - Centrífuga y lector para inmunohematología. - Pipetas pasteur y micropipetas. - Baño termo-regulable. - GR frescos R1r, Fy(a+b+), Kk. (heterocigotos para los antígeno involucrados). - Anticuerpos controles anti-D, anti-Fya, anti-K, que presenten una reacción débil 1+ a 2+ en AGH. - Suero AGH poliespecífico. - Suero AB inerte. - Células control AGH METODO: A.- Selección del tiempo de óptimo incubación: 1.- Preparar 4 baterías de tubos marcados con diferentes tiempos de incubación: 5, 10, 15, 20 y 25 minutos. Ellas son para el anti-D, anti-Fya, anti-K y suero AB inerte. 2.- Preparar una suspensión al 2% en el LISS que se está probando de los eritrocitos de prueba. 96 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 3.- Colocar en cada tubo una proporción idéntica (1:1) de suero y de eritrocitos apropiados. 4.- Incubar a 37ºC por los tiempos previamente establecidos y marcados en cada tubo. Conviene iniciar la incubación por el tiempo mayor, para procesar posteriormente en forma simultánea todos los tubos. 5.- Hacer un test AGH a todos los tubos. 6.- Validar los resultados negativos con células control AGH. 7.- Registrar los resultados en intensidad de cruces. INTERPRETACIÓN: El tiempo de incubación a elegir es el mínimo que muestre una aglutinación igual o superior a la lograda al incubar el mismo suero durante 1 hora en medio NISS (fuerza iónica normal), y en AGH. Ejemplo: MEDIO Y TIEMPO DE REACCION LISS - 5' LISS - 10' LISS - 15' LISS - 20' LISS - 25' NISS -1 Hr AGH INDIRECTO ANTI-D 1+ 1+ 2+ 2+ 2+ 2+ ANTI-Fya +/1+ 1+ 1+ ANTI-K +/1+ 1+ +/1+ AB INERTE - En este caso el tiempo de incubación a elegir es 20 minutos. B.- Otros parámetros a medir: 1.- pH entre 6.6 y 6.8 2.- Conductividad entre 3.4 y 3.8 mOhm/cm a 23ºC 3.- Osmolaridad entre 280 y 305 mosmol/Kg. NOTAS: 1.- Los parámetros aquí indicados deben aplicarse a cada lote nuevo de reactivo o cada vez que se prepara en el laboratorio. 2.- El control diario de su uso incluye trabajar en paralelo con la muestra problema, sueros que posean anticuerpos de reactividad débil y suero AB inerte. 3.- Revisar las recomendaciones para trabajar con medios LISS, en la técnica correspondiente. PREPARACION Y ESTANDARIZACION DE SOLUCIONES ENZIMÁTICAS PARA USO EN INMUNOHEMATOLOGIA Las enzimas proteolíticas modifican los antígenos de los eritrocitos de tal forma que incrementan la reactividad de algunos sistemas antígeno-anticuerpo (Rh, Kidd) y, deprimen la expresión antigénica de otros (M, N, Fya y Fyb). El tratamiento enzimático también modifica las propiedades físicas de la suspensión celular y puede causar agregación espontanea de las células. Las preparaciones enzimáticas usadas en Banco de Sangre pueden variar de lote a lote, de tal forma que cada vez que se prepara una solución, debe 97 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL estandarizarse su actividad y tiempo de incubación para garantizar una óptima función del método. MATERIALES Y REACTIVOS: 1. -Papaína tipo II Sigma Chem. 2. -Alfa Cisteína Hydrocloride (C3 H7 NO2 S HCl) 3. -Buffer de Soerensen: (pH: 5.4) o PBS pH 5.5. El Buffer Soerensen se prepara: a) Fosfato potásico dihidrogenado (KH2 PO4) 8.83 gr b) Fosfato disódico hidrogenado x 12 H2O x 2 H2O anhidro c) H2O destilada c.s.p. 1000 cc 4. - NaOH 1N 0.72 gr 0.36 gr 0.29 gr PREPARACION DE LA SOLUCION STOCK: (Papaína al 1%) 1.- Moler en un mortero 0.5 gr de papaína, con unos pocos ml de buffer de Soerensen pH 5.4, o PBS pH 5.5. 2.- Lave la suspensión de papaína en un matraz de 250 ml, con 25 ml de buffer de Soerensen pH 5.4, o con 190 ml de PBS pH 5.5. 3.- Agregue 0.219 gr de L - Cisteína, llevar a 50 ml con más buffer de Soerensen. Si ha usado PBS, agregue 0.6 g L-cysteine hydrocloride disuelta en 10 ml de agua destilada y neutralizada con NaOH 1N. 4.- Incube a 37ºC durante 1 hora. El tiempo de incubación debe considerarse a partir del momento en que la solución alcance los 37ºC. 5.- Centrifugue la solución, conserve el sobrenadante y descarte la papaína no disuelta. 6.- Guarde la solución de papaína activada a = o< de -20ºC en alícuotas de 0.1 ml. Esta solución no es estable a 4ºC. Una vez que la solución es descongelada debe eliminarse el resto al terminar el día, conservándola en vidrio. La solución puede guardarse hasta por 6 meses. ESTANDARIZACIÓN DEL PROCEDIMIENTO: Para un test enzimático en dos etapas, el tiempo y condiciones de incubación y la dilución óptima, debe determinarse para cada lote nuevo de solución stock. MATERIALES: 1.-Solución stock de papaína (al 1%). 2.-Varios sueros sin anticuerpos irregulares 3.-Sueros anti-D débiles, que aglutinen solamente eritrocitos tratados con enzima. 4.-Sueros anti Fya de reactividad moderada o fuerte. 5.-Eritrocitos D y Fya positivos. 6.-Suero AB inerte. 7.-PBS pH 7.3 METODO: 1.- Diluya 1 volumen (0.1 ml) de solución stock de papaína (1%), con 9 volúmenes (0.9 ml) de PBS pH 7.3. 2.- Marque varios tubos con diferentes tiempos de tratamiento enzimático: 5, 10 y 15 minutos. 98 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 3.- Agregue a cada tubo 1 ml de papaína al 0.1% y 0.25 ml de eritrocitos adecuados, concentrados y previamente lavados. 4.- Mezcle e incube a 37ºC el tiempo indicado en el tubo. La incubación es fácilmente controlada si se comienza con el de 15 minutos , luego el de 10 y 5 minutos, de tal forma que todos los tubos cumplen juntos su tiempo. 5.- Inmediatamente centrifugue, elimine el sobrenadante y lave los eritrocitos por 3 veces con cantidad adecuada de PBS. 6.- Resuspenda los eritrocitos al 3% en PBS. 7.- Marque 4 tubos para cada suero a investigar: sin tratar, 5, 10 y 15 minutos. 8.- Agregue a cada tubo 2 gotas del suero correspondiente. (anti-D, etc.) 9.- Agregue a todos los tubos 1 gota de la suspensión de eritrocitos que corresponda. 10.- Mezcle e incube por 15 minutos a 37ºC. 11.- Centrifugue y examine en busca de aglutinación de la forma previamente estandarizada. 12.- Lave las células por 3 o 4 veces con PBS y realice un AGH. INTERPRETACION: Posibles resultados de este test: GR+ENZIMA Sin tratar 37ºC AGH 5 minutos 37ºC AGH 10 minutos 37ºC AGH 15 minutos 37ºC AGH SUERO AB INERTE 0 0 0 0 0 0 0 w+ ANTI-D 0 1+ 1+ 2+ 2+ 2+ 2+ 2+ ANTI-Fya 0 3+ 0 1+ 0 0 0 w+ En este caso el tiempo óptimo de incubación es de 10 minutos. La incubación por 5 minutos no elimina totalmente la actividad Fya, ni incrementa al máximo la expresión del anti-D. La incubación por 15 minutos causa reacciones falsas positivas en AGH con suero AB inerte. Si la incubación de 5 minutos muestra un sobre tratamiento de los eritrocitos, es mejor usar una dilución de la enzima que acortar el tiempo de incubación, ya que es difícil su monitoreo. NOTA: 1.- La estandarización también puede realizarse efectuando diluciones seriadas de los anticuerpos seleccionados (D, E, c, Fya y 2 muestras sin anticuerpos), los que se someten a eritrocitos papainizados por diferentes tiempos de incubación, seleccionando el tiempo de tratamiento en que funciona mejor la enzima. EVALUACION DEL TRATAMIENTO DE LOS ERITROCITOS: Después de haber establecido los tiempos óptimos de incubación para un nuevo lote de enzima, debe evaluarse los eritrocitos antes de ser usados para demostrar que ellos has sido tratados adecuados y no excesivamente. Un tratamiento adecuado produce eritrocitos que son aglutinados por un anticuerpo que se manifiesta solo en AGH con células no tratadas, y no son aglutinadas o agregadas en presencia de suero inerte. 99 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL PROCEDIMIENTO: 1.- Seleccione un Ac. que aglutine solo eritrocitos tratados enzimáticamente, y que de reacción positiva con células no tratadas solo en la fase AGH. 2.- Coloque 2 gotas del suero previamente seleccionado a un tubo marcado "positivo". 3.- Coloque 2 gotas de suero AB inerte en un tubo marcado "negativo". 4.- Agregue a cada tubo 1 gota de la suspensión al 3% de los eritrocitos previamente tratados. 5.- Mezcle e incube durante 15 min. a 37ºC 6.- Centrifugue y observe en busca de aglutinación , según su técnica estandarizada. INTERPRETACION: Debe aparecer aglutinación solo en el tubo marcado "positivo". Si aparece aglutinación en el "negativo", los eritrocitos fueron tratados en forma excesiva. USO DE DTT PARA DIFERENCIAR ANTICUERPOS IgM DE IgG Los anticuerpos IgM, cuya estructura presenta 5 subunidades unidas por enlaces de azufre, llamados enlaces intersubunidades. cada subunidad consta de 2 cadenas livianas y 2 cadenas pesadas que están unidas por puentes disulfuros, llamados intracatenarios. Los reactivos tiol pueden romper enlaces disulfuros, los enlaces intersubunidades son afectados más rápidamente que los intracadenas. Los enlaces intercatenarios de los anticuerpos IgG e IgA, no son escindidos fácilmente por los reactivos tiol. El tratamiento de los anticuerpos IgM por reactivos tiol anula las propiedades de aglutinación y fijación de complemento. El tratamiento con reactivos tiol es útil para determinar la clase de Ig a la que pertenece un anticuerpo presente en el suero. También pueden usarse para anular la actividad de los anticuerpos IgM y permitir la detección de anticuerpos IgG coexistentes. MUESTRA: 2 ml de suero a tratar REACTIVOS: - PBS a pH 8.0 - Ditiotreitol (DTT) 0.01 M, preparado disolviendo 0.154 g de DTT en 100 ml de PBS pH 8.0 . Conservar a 4ºC. PROCEDIMIENTO: 1.- Colocar 1 ml de suero a tratar en 2 tubos de ensayo. 2.- Agregar en uno de los tubos rotulados como control 1 ml de PBS pH 8.0. 3.- Agregar al otro tubo rotulado como test 1 ml de DTT 0.01 M. 4.- Mezclar e incubar a 37ºC durante 30 minutos a 2 horas. Las muestras que se procesen deben investigarse después de 30 minutos y luego a los 60 minutos, para detectar si se ha producido gelificación. Las muestras gelificadas no pueden usarse para estudio de anticuerpos ya que el tratamiento ha denaturado todas las proteínas séricas. 5.- Estudie la actividad de anticuerpo mediante titulación, en paralelo utilizando la muestra tratada y la sin tratar. NOTAS: 1.- Puede usarse 2-mercaptoetanol en vez de DTT para este propósito. 100 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 2.- Los reactivos tiol usados en baja concentración pueden deprimir ciertos antígenos del sistema Kell. 3.- Puede observarse una gelificación del suero o plasma durante el tratamiento con DTT. Esto puede ocurrir si se ha preparado incorrectamente el DTT 0.01M, y debe tener una concentración superior a 0.01M. También puede aparecer por incubaciones prolongadas en presencia de DTT. 4.- Estudie una alícuota de suero tratado con DTT a los 30 minutos de incubación. Si el test muestra que la actividad de IgM ha desaparecido, no es necesario seguir la incubación. INTERPRETACION: Se hace de acuerdo al siguiente esquema. MUESTRA SUERO+DTT (AGH) SUERO+PBS SUERO+DTT SUERO+PBS SUERO+DTT (AGH) SUERO+PBS DILUCION 1/16 1/32 1+ 0 1/2 3+ 1/4 2+ 1/8 2+ INTERPRETACION IgG 3+ 0 2+ 0 2+ 0 1+ 0 0 0 falta de incubación IgM 3+ 2+ 2+ 1+ 2+ 0 1+ 0 0 0 IgG+IgM 3+ 2+ 2+ 1+ 0 TRATAMIENTO DE ERITROCITOS CON DTT El DTT es uno de los agentes reductores más eficientes que se conocen. Puede reducir en forma irreversible los enlaces disulfuro en grupos sulfhidrilos libres, produciéndose la ruptura de la estructura terciaria de la proteína. Sin la estructura terciaria, las proteínas que tienen actividad antigénica, no pueden unirse a su anticuerpo específico, y se elimina por consiguiente la reactividad serológica. Los eritrocitos tratados con DTT no reaccionan con anticuerpos del sistema Kell, ni con antiLW, Yta, Ytb, Doa, Dob y muchos anticuerpos con características de baja avidez y alto título (BATA). Esta técnica puede ser útil en la identificación de alguno de estos anticuerpos, o en determinar si existen conjuntamente otros anticuerpos. MUESTRA: Eritrocitos a tratar REACTIVOS: - PBS - Ditiotreitol (DTT) 0.2 M, pH 8.0 PROCEDIMIENTO: 1.- Lave 1 volumen de células test con PBS. Elimine todo el sobrenadante. También trate células k+ como control, también puede usarse otros Ag. Kell como control. 2.- Agregue 4 volúmenes de DTT 0.2M, pH 8.0. 3.- Incube a 37ºC por 30-45 minutos. 101 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 4.- Lave las células por 4 veces con PBS. Puede aparecer una leve hemólisis, si ella es excesiva utilice eritrocitos frescos y baje la concentración del DTT. 5.- Resuspenda los eritrocitos a una concentración del 3% en PBS. 6.- Estudie los eritrocitos tratados con el suero apropiado, y los eritrocitos control con el suero anti Kell correspondiente. INTERPRETACIÓN: 1.- Las células control deben dar un resultado negativo, si esto no ocurre, no han sido tratadas adecuadamente 2.- Este tratamiento es óptimo para denaturar todos los antígenos de los sistemas Kell, Cartwright, LW y Dombrock, y muchos antígenos BATA. ADSORCION DE ANTICUERPOS Un anticuerpo puede ser removido del suero por medio de la unión con eritrocitos apropiados que contengan el antígeno específico, formándose un complejo antígenoanticuerpo, permitiendo que al separar el suero sobrenadante, lo obtengamos libre del anticuerpo que permanece unido a su antígeno. Las técnicas de adsorción son usadas en diferentes situaciones: - Remoción de autoanticuerpos de forma tal que permita la detección de aloanticuerpos coexistentes en el suero. - Confirmar la presencia de antígenos débiles en los eritrocitos, por medio de su habilidad para remover su anticuerpo específico. - Remoción de un anticuerpo no deseado de un suero clasificador. - En combinación con las técnicas de elución, permítela separación de anticuerpos múltiples presentes en un suero, para una posterior identificación. - Etc. MUESTRA: Sangre sin anticoagulante MATERIAL: - Eritrocitos de fenotipo apropiado (que contengan el antígeno para el anticuerpo que se quiere remover del suero) - PBS - Suero AGH poliespecífico. PROCEDIMIENTO: 1.- Realice un TAD a los eritrocitos seleccionados, el que debe ser negativo. 2.- Lave los eritrocitos seleccionados con abundante PBS por 4 veces. Después del último lavado elimine todo el sobrenadante que sea posible. Se recomienda centrifugar nuevamente y retirar el sobrenadante introduciendo un papel filtro hasta absorber la capa remanente de suero, esto es necesario para evitar la dilución del anticuerpo. 3.- Separe los eritrocitos en 3 alícuotas de 1 ml cada una. 4.- Mezcle volumen a volumen el suero a absorber y los eritrocitos ya seleccionados y previamente marcados como alícuota 1. 5.- Incube a la temperatura óptima para el anticuerpo a absorber durante un mínimo de 60 minutos. La absorción será más efectiva si el área entre los reactantes es mayor, por lo que se recomienda usar tubos de boca ancha y mezclar cada 10 minutos aproximadamente. 102 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 6.- Centrifugue a 3.500 rpm por 10 minutos e idealmente a la misma temperatura que utilizó en el punto 5. 7.- Transfiera el suero sobrenadante a un tubo limpio y previamente marcado para ser estudiado. Si es necesario realizar una segunda o tercera absorción debe utilizar las alícuotas de eritrocitos marcados como 2 y 3. Este sobrenadante es el suero absorbido. 8.- Estudie el suero absorbido para investigar la efectividad de su método. 9.- Guarde los eritrocitos post absorción, si desea utilizar técnicas de elución. ELUCION DE ANTICUERPOS El objetivo de toda elución es interferir con la fuerzas no covalentes que mantienen unido el complejo Ag-Ac. Estas interferencias pueden ser físicas (calor, ultrasonido, congelamiento y descongelamiento, detergentes o solventes orgánicos), o una acción química directa sobre las fuerzas de unión del complejo, usando alteración del Ph o concentraciones de sal. En inmunohematología la elución se utiliza principalmente para remover anticuerpos de la superficie de un eritrocito, que se han unido a él ya sea "in vivo" o "in vitro". El anticuerpo obtenido es estudiado con diferentes fines. El resultado de estos estudios son una parte importante del diagnóstico de laboratorio de la destrucción inmune de eritrocitos, debido a la presencia de autoanticuerpos, aloanticuerpos producidos en respuesta a transfusiones recientes, incompatibilidad materno fetal y fenómenos inducidos por drogas. En combinación con técnicas de absorción, la elución es usada en el laboratorio para purificar anticuerpos de grupo sanguíneo, detectar antígenos débiles, concentrar anticuerpos, o retirar anticuerpos de una mezcla de ellos. En otras circunstancias, la elución se usa para retirar anticuerpos y dejar eritrocitos libres de ellos (TAD -), y así poder estudiar las células no sensibilizadas. Existen múltiples métodos de elución, por lo que no hay uno que sea eficaz en todos los casos. Es importante por lo tanto elegir en forma adecuada la técnica de acuerdo al tipo de anticuerpo que se quiere eluir. ELUCION POR CALOR: Se aplica preferentemente en el estudio de la enfermedad hemolítica del RN por ABO, y en la elución de anticuerpos IgM de los eritrocitos. En cada método la solución salina sobrenadante del último lavado se analiza en paralelo con el eluido, para determinar si la reactividad encontrada en este último representa la recuperación de anticuerpos de la superficie celular, o es el resultado de la contaminación por suero residual , como puede ocurrir si los lavados previos a la elución no fueron realizados correctamente. Sin embargo puede encontrarse reactividad en el sobrenadante del ultimo lavado si el anticuerpo unido a las células es de baja afinidad para su antígeno y se eluye durante el proceso de lavado. MUESTRA: Sangre con anticoagulante. (EDTA, Citrato de Na) 103 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL MATERIAL: - Albúmina de bovino al 6%, preparada diluyendo albúmina al 22-30 - PBS % en PBS. PROCEDIMIENTO: 1.- Lavar 2 ml de eritrocitos concentrados por 6 veces con abundante PBS. 2.- Retirar completamente el sobrenadante cada vez y cuidar de guardar el sobrenadante del último lavado como control negativo, para ser procesado en paralelo con el eluado. Es aconsejable secar bien las paredes con papel absorbente. 3.- Mezclar volúmenes iguales de eritrocitos concentrados lavados y albúmina de bovino al 6% en un tubo previamente marcado. 4.- Colocar el tubo a 56ºC durante 10 minutos. Agitar de vez en cuando durante este período. 5.- Centrifugar el tubo a alta velocidad durante 2 minutos (1.000 g), preferentemente en una centrífuga calentada. 6.- Transferir inmediatamente el sobrenadante a un tubo limpio y analizarlo en paralelo con el sobrenadante del último lavado. ELUCION POR CLOROFORMO: La elución por cloroformo se usa en el estudio de un TAD asociado con anticuerpos reactivos en caliente (IgG), ya sean auto o alo anticuerpos. En conjunto con técnicas de absorción, sirve para separar mezclas de anticuerpos IgG presentes en un suero. MUESTRA: Sangre con anticoagulante MATERIALES: - Cloroformo (debe ser de muy alto grado) - Albúmina de bovino al 6%. - PBS Ph 7.2 - 7.3 PROCEDIMIENTO: 1.- Lavar 2 ml de eritrocitos concentrados por 6 veces con abundante PBS. 2.- Retirar completamente el sobrenadante cada vez y cuidar de guardar el sobrenadante del último lavado como control negativo, para ser procesado en paralelo con el eluado. Es aconsejable secar bien las paredes con papel absorbente. 3.- Prepare una suspensión al 50% en albúmina al 6% de los eritrocitos previamente lavados. 4.- Agregue un volumen igual de cloroformo. 5.- Tape el tubo con un tapón, y muévalo vigorosamente durante 15 a 20 segundos. Posteriormente mezcle por inversión durante 1 minuto. 6.- Retire cuidadosamente el tapón y coloque el tubo en un baño a 56ºC, exactamente por 5 minutos. (no debe exceder los 5 minutos a 56ºC). Mueva vigorosamente el contenido del tubo con una bagueta durante este período. 7.- Centrifugue fuertemente el tubo (1.000 g) durante 5 minutos. 8.- Transfiera el eluado sobrenadante a un tubo limpio, y estúdielo en paralelo con el sobrenadante del último lavado. NOTA El uso de LISS como diluyente de elución y LISS como medio de suspensión de las células del sistema de detección puede facilitar enormemente la detección del anticuerpo eluido. 104 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL ELUCION ACIDA Este método es aplicable en los mismos casos descritos para cloroformo, además se usa en el tratamiento de eritrocitos recubiertos por IgG para realizar posteriormente autoabsorción. MUESTRA: Sangre con anticoagulante MATERIALES: - Solución de elución: Ácido cítrico monohidratado KH2PO4 Salino csp (almacenar a 4ºC) - Solución de neutralización: Na3PO4 H2O destilad csp (almacenar a 4ºC) - PBS 1.3 g 0.65 g 100 ml 13.0 g 100 ml PROCEDIMIENTO: 1.- Lavar 2 ml de eritrocitos concentrados por 6 veces con abundante PBS. 2.- Retirar completamente el sobrenadante cada vez y cuidar de guardar el sobrenadante del último lavado como control negativo, para ser procesado en paralelo con el eluado. Es aconsejable secar bien las paredes con papel absorbente. 3.- Mantenga todos los reactivos en hielo a 4ªC. 4.- Coloque 1 ml de eritrocitos concentrados y previamente lavados en un tubo marcado. 5.- Agregue 1 ml de solución de elución y tome el tiempo. 6.- Tape el tubo y muévalo por inversión exactamente por 90 segundos. 7.- Remueva el tapón y centrifugue rápidamente a alta velocidad (1.000 g) por 45 segundos. 8.- Transfiera el sobrenadante a un tubo limpio y agregue 5 a 6 gotas de la solución de neutralización. Guarde los eritrocitos para absorciones si es necesario. 9.- Controle el pH, ajústelo a pH 7.0 si es necesario, agregando más solución de neutralización. 10.- Centrifugue a igual velocidad que en 7 durante 2-3 minutos, para eliminar los precipitados que se forman después de la neutralización. 11.- Recupere el eluido sobrenadante y analícelo en paralelo con el sobrenadante del último lavado. NOTAS: 1. 2. Los eritrocitos obtenidos en el paso 8 pueden ser usados para estudiar fenotipo si el TAD es negativo, salvo para el sistema Kell, ya que su expresión antigénica se ve disminuida después del tratamiento con ácido cítrico. Los eritrocitos obtenidos por la elución con ácido cítrico pueden ser tratados con proteasas y luego usados en estudios de autoabsorción. ESTUDIO Rh EN CELULAS CON TAD POSITIVO 105 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL Cuando las células están muy sensibilizadas con IgG, el estudio de antígenos que se revelan con AGH o con reactivos de alto contenido proteico es impracticable. Es necesario disociar el complejo Ag-Ac por medio de elución, sin dañar la integridad de la membrana celular o alterar la expresión antigénica. REACTIVOS: - Sueros anti Rh de bajo contenido proteico - Suero control Rh - Suero AB inerte - GR Ag.+ que sirva como control de daño en la reactividad celular. - PBS o salino PROCEDIMIENTO: 1.- Coloque en un tubo 1 volumen de eritrocitos sensibilizados concentrados, previamente lavados y 3 volúmenes de PBS. Haga lo mismo con los GR control. 2.- Incube los tubos a 45ºC por 10-30 minutos, con agitación frecuente. El tiempo de incubación es directamente proporcional a la intensidad de la sensibilización. 3.- Centrifugue para separar los GR del salino. Descarte el sobrenadante. 4.- Realice un TAD a las células obtenidas. Si este TAD continua +, repita los pasos 1 a 3. 5.- Estudie los antígenos Rh en las células test y control, con los antisueros apropiados. NOTA: 1.- Puede hacerse la elución durante 3 minutos a 56ºC, sometiendo los tubos test y control a este procedimiento. AUTOADSORCION DE ANTICUERPOS CALIENTES (ZZAP) Los autoanticuerpos calientes pueden enmascarar la presencia de aloanticuerpos concomitantes de importancia clínica en el suero. Al absorber el suero con GR autólogos, pueden retirarse del suero los autoanticuerpos, permitiendo la detección de aloanticuerpos enmascarados. Sin embargo los GR autólogos circulantes generalmente están recubiertos de autoanticuerpos. La autoabsorción de anticuerpos calientes se hace más efectiva si se retiran primero los autoanticuerpos, y luego se tratan las células con enzimas. Al dejar los sitios antigénicos libres será más fácil unir los autoanticuerpos libres del suero. El tratamiento enzimático favorece el proceso de adsorción. El mejor procedimiento es usar reactivo ZZAP, que es una mezcla de enzima proteolítica y un reactivo tiol. El tratamiento de los Ac. IgG con tiol, aumenta su susceptibilidad a la digestión con proteasas. Cuando se tratan los eritrocitos recubiertos con IgG con el reactivo ZZAP, las moléculas de Igs pierden su integridad y se disocian de la superficie de la célula. Simultáneamente los GR son tratados con enzimas para aumentar su capacidad de absorber anticuerpos. La autoabsorción no debe realizarse si el paciente ha sido recientemente transfundido, ya que los eritrocitos transfundidos circulantes pueden absorber los aloanticuerpos libres MUESTRA: Muestra con y sin anticoagulante (EDTA), con autoanticuerpo 106 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL REACTIVOS: - Papaína al 1% activada con cisteína o Ficina al 1%. Revise el método de preparación de las enzimas. - PBS pH 6.5 y pH 8.0. - DTT 0.2M preparado disolviendo 1 g de DTT en 32.4 ml de PBS pH 8.0. Guarde a -20ºC en alicuotas de 3 ml - GR R1R1, R2R2 y rr PROCEDIMIENTO: 1.- Prepare el reactivo ZZAP mezclando 0.5 ml de papaína al 1% activada, con 2.5 ml de DTT y 2.0 ml de PBS pH 6.5. Alternativamente puede usar 1 ml de ficina al 1%. 2.5 ml de DTT y 1.5 ml de PBS pH 6.5. Controle pH y ajuste a 6.5 si es necesario. 2.- Lave 1 ml de los eritrocitos de prueba por 1 vez con abundante salino. 3.- A los eritrocitos lavados y concentrados, agregue 2 ml de solución de ZZAP. Invierta el tubo varias veces para mezclar. 4.- Incube por 20-30 minutos a 37ºC, mezclando el tubo periódicamente. 5.- Saque los tubos y proceda a lavar las células por 3 veces con gran cantidad de PBS. Elimine lo más posible el sobrenadante del último lavado, para prevenir diluciones del suero. Separe los eritrocitos obtenidos en 3 alicuotas iguales. 6.- A 1 volumen de células tratadas con ZZAP agregue un volumen igual de suero del paciente. 7.- Mezcle e incube a 37ºC por 20-45 minutos, mezcle ocasionalmente. 8.- Centrifugue a alta velocidad (1.000 g) durante 5 minutos y obtenga el suero sobrenadante. 9.- Los puntos 6-8 deben repetirse usando el suero previamente absorvido, y frente a diferentes alicuotas de eritrocitos tratados con ZZAP. INTERPRETACION: Generalmente con 2 absorciones se retiran del suero una cantidad suficiente de autoanticuerpos permitiendo que la reactividad de aloanticuerpos pueda manifestarse. Si todo el panel es positivo, deben hacerse un número mayor de autoabsorciones. NOTAS: 1.- No es necesario lavar las células previo a su tratamiento con ZZAP. 2.- Ocasionalmente el tratamiento de eritrocitos con ZZAP puede ocasionar gelificación, esto puede deberse a un gran contenido de glóbulos blancos. 3.- El tratamiento de los eritrocitos con ZZAP, hace que ellos pierdan los antígenos Kell, MNSs, Duffy, Gerbich; muchos de los antígenos LW, Cartwright y Dombrock, y otro Ag que se destruyen por acción enzimática. ADSORCION DIFERENCIAL EN CALIENTE USANDO ZZAP El tratamiento de los eritrocitos con ZZAP, hace que ellos pierdan los antígenos Kell, MNSs, Duffy, Gerbich; muchos de los antígenos LW, Cartwright y Dombrock, y otro Ag que se destruyen por acción enzimática. La adsorción del suero con GR seleccionados con fenotipo conocido, removerán los autoanticuerpos y dejaran libres anticuerpos para muchos sistemas sanguíneos. La especificidad de los Ac. que quedan en el suero luego de la adsorción, puede ser confirmada con un panel de identificación de anticuerpos. 107 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL Este método se usa para retirar autoAc. del suero de un individuo que presenta autoanticuerpos calientes, para determinar si él presenta además aloanticuerpos de importancia clínica. Este procedimiento se usa si el paciente ha sido recientemente transfundido o no se consiguen suficientes GR autólogos y se desconoce el fenotipo del paciente. MUESTRA: Muestra con y sin anticoagulante (EDTA) REACTIVOS: - Papaína al 1% activada con cisteína o Ficina al 1%. Revise el preparación de las enzimas. - PBS pH 6.5 y pH 8.0. - DTT 0.2M preparado disolviendo 1 g de DTT en 32.4 ml de PBS pH 20ºC en alicuotas de 3 ml - GR R1R1, R2R2 y rr método de 8.0. Guarde a - PROCEDIMIENTO: 1.- Prepare el reactivo ZZAP mezclando 0.5 ml de papaína al 1% activada, con 2.5 ml de DTT y 2.0 ml de PBS pH 6.5 . Alternativamente puede usar 1 ml de ficina al 1%. 2.5 ml de DTT y 1.5 ml de PBS pH 6.5. Controle pH y ajuste a 6.5 si es necesario. 2.- Lave 1 ml de los eritrocitos de prueba por 1 vez con abundante salino. 3.- A cada alícuota de eritrocitos lavados y concentrados, agregue 2 ml de solución de ZZAP. Invierta el tubo varias veces para mezclar. 4.- Incube por 20-30 minutos a 37ºC, mezclando el tubo periódicamente. 5.- Saque los tubos y proceda a lavar las células por 3 veces con gran cantidad de PBS. Elimine lo más posible el sobrenadante del último lavado, para prevenir diluciones del suero. 6.- A 1 volumen de células tratadas con ZZAP agregue un volumen igual de suero del paciente. 7.- Mezcle e incube a 37ºC por 30-60 minutos, mezcle ocasionalmente. 8.- Centrifugue a alta velocidad (1.000 g) durante 5 minutos y obtenga el suero sobrenadante. 9.- estudie el suero absorbido frente a GR de igual fenotipo que los usados para la absorción, si la reacción es positiva, repita los pasos 6 a 9 con una nueva alícuota de GR tratados con ZZAP, hasta que el resultado sea negativo. El suero absorbido, puede ser usado luego para identificación de el o los anticuerpos remanentes o para crossmatching. NOTAS: 1.- Si el autoanticuerpo es muy potente deben prepararse 3 o más alicuotas de células tratadas. 2.- Para facilitar la remoción de anticuerpos puede aumentarse la cantidad de GR tratados en relación al suero. 3.- Los GR. deben estar lo más concentrados posible para evitar la dilución de anticuerpos que queden en el suero. 4.- Agitar la mezcla durante el proceso de absorción para aumentar la superficie de contacto. 108 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL DETERMINACION DE ESPECIFICIDAD DE AUTO ANTICUERPOS FRIOS Puede determinarse la especificidad de un autoanticuerpo frío si este se pone en contacto con una batería de células con antígenos relevantes para este tipo de inmunoglobulinas. REACTIVOS: 1.Suero en estudio. La muestra debe ser colocada a 37ºC para inducir la coagulación. El suero debe ser separado a esa temperatura. 2.Eritrocitos de prueba: a) G.R. adultos grupo O I+, de 2 donantes. b) G.R. del paciente (autólogos). c) G.R. del mismo grupo sanguíneo del paciente, si no es grupo O. Use eritrocitos del mismo subgrupo A, si es A o AB. d) Eritrocitos grupo O I+, tratados con ficina o papaína. e) Eritrocitos de cordón grupo O I(-) PROCEDIMIENTO: 1.- Prepare una serie doble de diluciones del suero en salino. EL rango de dilución debe ir desde 1/2 hasta 1/4096 (12 tubos), y el volumen en cada tubo no debe ser inferior a 1 ml. 2.- Mezcle 3 gotas de cada dilución con 1 gota de una suspensión al 5% en salino de cada tipo de eritrocitos seleccionados. 3.- Incube a temperatura ambiente durante 15 min., centrifugue y examine macroscópicamente en busca de aglutinación. 4.- Transfiera los tubos a 4ºC e incube a esta temperatura durante 1 hora. Centrifugue y examine los eritrocitos en busca de aglutinación. Registre los resultados. INTERPRETACION: En la siguiente tabla se presentan las reacciones de los anticuerpos que comúnmente se encuentran como autoanticuerpos fríos. El anti-I se presenta comúnmente en la enfermedad de aglutininas frías. Las especificidades anti-i y anti-Pr también pueden presentarse. Algunos ejemplos de anti-I muestran preferencia por eritrocitos con fuerte expresión del antígeno H (O Y A2), estos anticuerpos se llaman anti-IH. La reactividad de todos los autoanticuerpos con especificidad relacionada al sistema Ii, se ve incrementada al usar eritrocitos tratados con enzimas. REACCIONES PARA DEMOSTRAR ESPECIFICIDAD DE AUTOANTICUERPOS FRIOS GR ANTI-I ANTI-i ANTI-H ANTI-IH ANTI-Pr Oi adulto Oi cordón A OI trat/enz Autólogo 0/< 0/< = > = > > = > = = =/< < > < < < < > < = = = * = 0 : No reactivo > : Más fuerte que G.R. OI < : Más débil que G.R. OI = : Igual que G.R. OI * : Igual o más débil que G.R. OI 109 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL NOTAS: 1.- Cuando existen autoanticuerpos fríos muy potentes, la especificidad puede no ser aparente cuando se realizan estudios de titulación a 4ºC o ambiente. En tales circunstancias la incubación del test debe ser hecha a 30 - 37ºC, o prolongar los tiempos de incubación y examinar posteriormente los tubos sin centrifugar. 2.- Se puede usar este procedimiento para realizar título y especificidad. DEMOSTRACION DE AUTOAGLUTININAS FRIAS (CRIOAGLUTININAS) DE ALTO TITULO Esta metodología se usa para demostrar un aumento de crioaglutininas con importancia clínica. Se hacen diluciones seriadas del suero para determinar la fuerza de la autoaglutinina fría. la fuerza expresada en título es de utilidad diagnóstica. REACTIVOS: - Plasma en estudio obtenido de una muestra con anticoagulante (EDTA), que se ha dejado por 15 minutos a 37ºC, invirtiéndola periódicamente. - Glóbulos rojos O, I positivos, lavados y suspendidos al 1% en salino. Los eritrocitos deben obtenerse de una muestra tomada con ACD o CPD como anticoagulante y con no más de 7 días de conservación. - PBS, Ph 7,3 PROCEDIMIENTO: 1.- Diluya el plasma en estudio 1/5 en salino. 2.- Prepare dos series de diluciones , en salino, del suero ya diluido. Use volúmenes de 0,5 ml. para hacer estas diluciones. El rango final de diluciones debe estar entre 1/10 y 1/20.480 (12 tubos). 3.- Agregue a cada tubo 0,5 ml de la suspensión al 1% de eritrocitos OI. 4.- Mezcle e incube durante toda la noche a 4ºC. 5.- Examine macroscópicamente los tubos sin centrifugar, en busca de aglutinación. Anote la intensidad de cruces y su puntaje. INTERPRETACION: El título es el valor recíproco de la máxima dilución en que se observa aglutinación macroscópica. Con esta técnica, se consideran elevados los títulos sobre 40. Sin embargo, la AHAI por anticuerpos fríos no se ve normalmente con títulos bajo 640. Los títulos inferiores a 640 pueden obtenerse cuando el autoanticuerpo tiene especificidad anti-i. En esta situación deben usarse eritrocitos I-negativos (i-cord o i-adult) en vez de los OI para la titulación. NOTA: Es importante usar pipetas distintas para preparar cada dilución del suero, ya que si se usa una pipeta única o la misma punta desechable para todas las diluciones, pueden obtenerse resultados falsamente elevados por arrastre del suero de un tubo a otro. Pueden aparecer diferencias como un título aparente de 100.000 usando una pipeta única en lugar del título real de 4000 cuando se usan pipetas separadas. Diluciones más exactas del suero se logran al usar mayores volúmenes en las diluciones (ej.: 0.5 ml). ESTUDIO DE CALIDAD DE UN SUERO ANTIGLOBULINA HUMANA El control de calidad de un reactivo AGH poliespecífico consta de 4 partes: Especificidad, Actividad, Sensibilidad y Potencia. 110 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL I.-ESPECIFICIDAD: Debe controlarse cuidadosamente los niveles de anti-complemento que contienen los sueros AGH, es especial la cantidad de anti-C4d y anti-C3d, ya que pequeñas cantidades de ellos se acumulan en GR normales guardados a 4ºC lo que podría llevar a resultados falsos positivos en pruebas de compatibilidad. Debe controlarse también la presencia de Ac. heteroespecíficos. a.-Determinación de falsos positivos debido a complemento: METODO: 1.- Preparar las siguientes suspensiones celulares: Seleccione 5 bolsas de sangre almacenadas por 20-35 días a 4ºC extraídas con CPD o CPD-A, de los distintos grupos sanguíneos (A,B,AB y O) 2.- Lave una cantidad de eritrocitos obtenidos de la tripa de la bolsa por 4 veces con PBS. 3.- Prepare suspensiones al 3% en PBS y al 1.5% en LISS de cada tipo de eritrocito seleccionado. 4.- Prepare un pool de sueros frescos compatibles con los eritrocitos seleccionados. 5.- Para cada uno de los sueros AGH a evaluar, prepare la siguiente serie de tubos, de acuerdo con este ejemplo: a.Eritrocitos seleccionados: grupo A+ de 28 días de almacenamiento grupo B+ de 20 días de almacenamiento grupo O+ de 35 días de almacenamiento grupo O- de 20 días de almacenamiento grupo A- de 23 días de almacenamiento b.Sueros seleccionados: Grupo AB fresco. SUERO AB AB AB AB AB GR A+ B+ O+ O- A- SERIE I 1 2 3 4 5 SERIE II 1 2 3 4 5 SUSPENSION EN SALINO SUSPENSION EN LISS 6.- Colocar 2 gotas de suero compatible (en el ejemplo AB)a cada uno de los tubos de ambas series. 7.- Agregar 1 gota de los GR correspondientes suspendidos en salino para la serie I y en LISS para la serie II. 8.- Centrifugar de la forma estandarizada para lectura, y observar los tubos en busca de aglutinación y/o hemólisis. 9.- Incube todos los tubos de la serie II durante 15-20 minutos a 37ºC (el tiempo previamente estandarizado para LISS), y la serie I por 45 minutos a 37ºC. 10.- Lave todas las células y realice un test AGH de acuerdo a las indicaciones del fabricante. 11.- Examine en busca de aglutinación macroscópica. Registre los resultados. 12.- Incube todos los tubos por 5 minutos a temperatura ambiente. 13.- Centrifugue los tubos y lea en busca de aglutinación o lisis. 111 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 14.- Controles a usar: Todos los TAD de las células empleadas deben ser negativos previo a la incubación con el suero fresco. Debe hacerse en paralelo con un suero AGH de referencia. INTERPRETACION: Todas las reacciones deben ser macroscópicamente negativas. Eventualmente pueden aparecer pequeños aglutinados al microscopio; si bien ellos no son deseables, son aceptados. II.-EVALUACIÓN DE LA ACTIVIDAD ANTICOMPLEMENTO Se evalúa la actividad anti-C3d, C3b y C4. REACTIVOS: 1.- Solución stock de buffer fosfato para preparar las soluciones A,B,C y D: Solución I: Fosfato dipotásico 1M K2HPO4 -3 H2O 228 g H2O destilada csp 1000 ml Solución II: Fosfato potásico diácido 1M KH2PO4 136.1 g H2O destilada csp 1000 ml 2.- Buffer fosfato pH 6.1: Solución A: Solución II H2O destilada csp Solución B: Solución I H2O destilada csp 5 ml 1000 ml 0.5 ml 100 ml La solución A se coloca en un recipiente de 1000 ml, sobre un agitador magnético donde se pueda medir pH. Se agrega lentamente solución B hasta lograr un pH de 6.1. 3.- Solución sucrosa-fosfato: Sucrosa 92.4 g Buffer fosfato pH 6.1 1000 ml Guardar congelado a -20ºC en alicuotas de 10 ml. 4.- HCl 0.05 N: Diluir 2.5 ml de HCl 1N hasta completar 50 ml con H2O destilada. 5.- Tripsina al 1%: (Sigma Nº Cat. T8253) Tripsina cristalizada HCl 0.05 N csp 0.1 g 10 ml Disolver mezclando suavemente, guardar congelada a -20ºC en alicuotas de 0.1 ml. 6.- Buffer fosfato pH 7.7 0.1 M: Solución C: Solución I H2O destilada csp Solución D: Solución II 112 5 ml 50 ml 1 ml ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL H2O destilada csp 10 ml A la solución C se le agrega la solución D hasta obtener un pH de 7.7. Guardar congelado a -20ºC en alicuotas de 1 ml. 7.- Tripsina al 0.1%: A 0.1 ml de tripsina al 1% agregar 0.9 ml de buffer fosfato 0.1 M pH 7.7 . Mezclar cuidadosamente. Debe prepararse solo previo a su uso. 8.- Na3 EDTA 0.2 M: Solución E: Solución F: Na2 EDTAx2H2O H2O destilada csp Na4 EDTAx4H2O H2O destilada csp 7.45 g 100 ml 9.05 g 100 ml Agregar un volumen de solución E a un volumen de solución F. Guardar a 4ºC. 9.- Sucrosa al 10%: Sucrosa H2O destilada csp 25 g 250 ml Guardar a 4ºC o congelar a -20ºC. 10.- Albúmina al 2%: Diluir albúmina al 20-30% en PBS pH 7.3, almacenar a 4ºC. Preparar solo la cantidad necesaria. Si se va a almacenar por mucho tiempo, agregar azida de sodio al 1%. 11.- PBS pH 7.3: Preparar de la forma habitual. PROCEDIMIENTO: A: PREPARACION DE GR RECUBIERTOS CON C3b - C4b: 1.- Marcar 1 tubo nuevo: C3b y C3d. 2.- Colocar en cada uno de los tubos: Glucosa fosfato 8.5 ml GR O suspendidos al 50% en PBS 1.0 ml Suero Humano fresco compatible 0.5 ml 3.- Mezclar cuidadosamente e incubar por 30 minutos a 37ºC, agitando suavemente cada 10 minutos durante la incubación. 4.- Centrifugar y eliminar el sobrenadante. 5.- Lavar los GR por 4 veces con PBS 6.- Preparar una suspensión al 3% en PBS con los GR del tubo 1. Guardarlas a 4ºC si es necesario. 7.- Los GR del tubo 2 se tratarán con tripsina para obtener C3d-C4d. B: OBTENCION DE GR RECUBIERTOS CON C3d - C4d: 113 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 8.- Agregar 1 ml de tripsina al 0.1%, Recién preparada a 0.5 ml de GR lavados y concentrados, ya recubiertos con C3b-C4b. Corresponde al tubo 2 del procedimiento anterior. 9.- Mezclar cuidadosamente e incubar por 30 minutos a 37ºC. Invertir 3 veces durante la incubación. 10.- Centrifugar y eliminar el sobrenadante 11.- Lavar los GR por 4 veces con PBS. 12.- Preparar una suspensión al 3% en PBS con los GR. Guardarlas a 4ºC si es necesario. C: PREPARACION DE GR RECUBIERTOS CON C4: 1.- Colocar en un tubo de centrífuga nuevo: 10 ml de sucrosa al 10% 0.15 ml de Na3 EDTA 0.2 M 0.5 ml de suero humano fresco compatible 0.5 ml de G.R. concentrados, lavados y frescos. 2.- Mezclar cuidadosamente e incubar por 5 minutos a 37ºC, mover 2 -3 veces durante la incubación. 3.- Centrifugar y eliminar el sobrenadante 4.- Lavar los GR por 4 veces con PBS. 5.- Preparar una suspensión al 3% en PBS con los GR. Guardarlas a 4ºC si es necesario. TEST CON LOS ERITROCITOS PREVIAMENTE PREPARADOS: 1.- Hacer diluciones seriadas de los sueros AGH en estudio (400ul). 2.- Agregar 50ul de las suspensiones celulares a tubos previamente marcados, y 50 ul de los sueros AGH en estudio, de acuerdo al procedimiento del fabricante (las células ya están lavadas). 3.- Preparar en paralelo sueros controles de referencia. 4.- Centrifugar todos los tubos el tiempo estandarizado para lectura. Incubar 15 segundos después de agregar el SAGH. 5.- Leer inmediatamente, rotando suavemente el tubo. 6.- Preparar una serie de diluciones madres, de cada uno de los sueros AGH en estudio. Ellas se enfrentarán a los eritrocitos recubiertos con C3b, C3d y C4 por separado. Se preparan de la siguiente forma: a) Colocar 300 microlitros de albúmina al 2% en PBS a cada uno de los tubos previamente marcados: s/d, 2, 4, 8, 16, 32. b) Agregar igual cantidad de suero AGH en estudio a los tubos marcados sin diluir y 2. c) Mezclar suavemente el contenido del tubo 2 y proseguir de acuerdo a la técnica estándar de titulación. Guardar la alícuota obtenida del último tubo. 7.- Colocar en 3 series de tubos previamente marcados 50 microlitros de dilución del AGH y 50 microlitros de los eritrocitos recubiertos correspondientes. 8.- Centrifugar todos los tubos el tiempo estandarizado para lectura. 9.- Leer inmediatamente, rotando suavemente el tubo. Registrar los resultados. 10.- Hacer una segunda lectura después de 5 min de incubación. NOTA: Se recomienda agregar los GR de cada serie, luego centrifugar y leer para no tener diferencias con respecto al tiempo que permanecen en contacto las células con el suero AGH. 114 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL INTERPRETACION: 1.- Se define el título como el valor recíproco de la máxima dilución del suero en la cual se observa 1+ de aglutinación. 2.- Anti-C3b: título no mayor de 8 ni menor de 2 3.- Anti-C3d: título no mayor de 4 ni menor de 2 4.- Anti-C4: título no superior de 4. 5.- Estos resultados deben ser equivalentes a los obtenidos con los sueros de referencia. III.- POTENCIA Y SENSIBILIDAD DEL SUERO AGH: A: SELECCION DE UN SUERO ANTI-D: (Ac. IgG débil) Es el suero con que se sensibilizarán los eritrocitos de prueba. 1.- El suero sin diluir no debe aglutinar directamente eritrocitos R1r en suspensión al 3%, y debe tener un título de 16-32 en AGH de referencia. 2.- No se recomienda usar anti-D comercial, sino obtenido de una persona sensibilizada. 3.- Es recomendable usar los mismos GR y el mismo suero anti-D cada vez que se realice control de calidad. 4.- Idealmente usar 2 marcas de AGH para definir el título del anti-D PROCEDIMIENTO: 1.- Preparar diluciones madres seriadas del anti-D, usando albúmina al 1% en PBS como diluyente. 2.- Hacer una batería de tubos con 1 volumen (100 microlitros) de dilución y 1 volumen de suspensión de GR R1r, (preparada usando un pool de 4 dadores de ese genotipo). 3.- Mezclar e incubar por 45 minutos a 37ºC 4.- Lavar las células por 4 veces y agregar 2 gotas del suero AGH. 5.- Centrifugar y leer de la forma estandarizada. Registrar los resultados. INTERPRETACION: El suero anti D ideal será el que presente un título de 16-32 en AGH. B.-RECUBRIMIENTO DE LOS GR CON ANTI-D: 1.- Preparar diluciones seriadas hasta 64 con el suero anti-D previamente seleccionado. 2.- Preparar 1 ml de cada dilución de anti-D. 3.- Agregar a cada una de las diluciones de anti-D 1 ml de la suspensión de GR R1r al 3% 4.- Incubar por 45 minutos a 37ºC, con agitación ocasional. 5.- Lavar las células por 4 veces y resuspender hasta lograr una dilución al 3%. Controlar sensibilización. 6.- Hacer un tubo control en paralelo, utilizando PBS en vez de anti-D. NOTA: Debe sensibilizarse GR con anti-D y otros GR con anti-Fya (Título 8-16 con células heterocigotas) para hacer en paralelo 2 tableros de ajedrez. C.-PREPARACION DE LAS DILUCIONES DEL SUERO AGH: 1.- Preparar diluciones seriadas hasta 512 del suero AGH en estudio y del suero de referencia. Usar albúmina al 2% en PBS como diluyente. Trabajar con volúmenes de 2 ml. D.-EVALUACION DE LA POTENCIA Y SENSIBILIDAD DEL AGH: (tablero de ajedrez). 115 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL Preparar un tablero para cada tipo de eritrocitos sensibilizados: anti-D y anti-Fya. 1.- Trabajar de acuerdo al siguiente esquema: GR SENSIBILIZADOS 2 4 8 16 32 64 2 4 DILUCIONES DEL SUERO AGH 8 16 32 64 128 256 1 9 17 25 33 41 2 10 18 26 34 42 3 11 19 27 35 43 7 15 23 31 39 47 8 16 24 32 40 48 4 12 20 28 36 44 5 13 21 29 37 45 6 14 22 30 38 46 2.- Colocar en cada tubo de cada fila una gota de la suspensión de GR sensibilizados Ej.: GR sensibilizados con una dilución 1/2 de anti-D se coloca en los tubos marcados 1, 2,3,4,5,6,7 y 8. Así sucesivamente. 3.- Agregar a cada tubo 2 gotas de la dilución del suero AGH, siguiendo el esquema descrito. 4.- Centrifugar inmediatamente y leer cada fila. 5.- Repetir el procedimiento para cada fila. INTERPRETACION: Un suero AGH se considera adecuado si se obtiene una reacción equivalente a un suero AGH de referencia, por ejemplo. 1.2.- 116 Título de suero AGH: El suero a evaluar debe dar una reacción 1+ en la dilución 1/128 del suero AGH, contra GR sensibilizados con anti-D 1/2 (tubo 7). Sensibilidad: El suero evaluado debe dar al menos 1+ con los eritrocitos sensibilizados con anti-D en dilución 1/32, contra el suero AGH diluido 1/2 (tubo 33). ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL INFORME CONTROL DE CALIDAD SUERO AGH: ACTIVIDAD ANTI-IgG MARCA TIPO Ac. G. ROJOS SD S. A G H LOTE 2 Anti-D 4 8 SD Ac. 16 G. ROJOS 32 SD S. A G H 2 FECHA VENC. 2 4 8 8 16 16 32 32 64 64 128 128 TITULO: 32 SD 4 SENSIBILIDAD: Anti- Fya (anti-K) 2 4 8 16 SENSIBILIDAD: SCORE: TITULO: FECHA: FECHA: T.M. T.M. SCORE: OBSERVACIONES: 117 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL CARACTERISTICAS GENERALES DE METODOS USADOS EN INMUNOHEMATOLOGIA CARACTERISTICA TRADICIONAL GEL FASE SOLIDA REACCION Tubo Aglutinación Tubo Aglutinación MATRIZ DE REACCION Ninguna GR/suero o plasma DETECCIÓN AGH Gel dextranacrilamida inmunológicame nte inerte. AGH SI NO SI NO SI SI SI Cuantitativa 1+ a 4+, CM Cuantitativa 1+ a 4+, CM ESTABILIDAD DE REACCION NO SI 2-3 días Semicuantitativa +fuerte, +, - , no CM SI 2 días Semicuantitativa +fuerte, +, - , no CM SI 7 días C. de CALIDAD + y -; CCC Nº lote tarjeta y diluyente. +y- CC recubiertas de IgG NO SI SI SI NO SI NO LAVADO CENTRIFUGACIO SI N LECTURA EQUIPOS ESP. AUTOMATIZACIO NO N APROB x FDA Microplaca Inmuno adherencia De fase sólida Microplaca de poliestireno, químicamente modificado GR recubiertos por anti-IgG COLUMNA AFINIDAD Inmuno adherencia Gel de sefarosa inmunoreactivo Proteína G y A ERITROCITOS CONGELADOS PARA FINES DE LABORATORIO Los eritrocitos pueden ser guardados usando glicerol, que por medio de aumentar la tonicidad de las células, los protege contra la deshidratación excesiva y contra la formación de cristales de agua durante el congelamiento y descongelamiento. TÉCNICA A REACTIVOS: 1.- Solución de glicerol al 40%, para congelar células: Citrato trisódico 118 60.0 gr ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL Citrato monosódico Citrato disódico Glicerol H2O destilada 6.2 gr 5.6 gr 800 ml 1200 ml El reactivo se prepara de la siguiente forma:Disolver los 60 gr de citrato trisódico en 100 ml de agua destilada precalentada a 56ºC, agregue los otros reactivos y lleve a 1200 ml de agua; disuelva completamente y adicione 800 ml de glicerol tibio (45ºC), guardar a 4ºC. 2.- Soluciones de descongelación: A) Citrato trisódico al 5% : 250 gr citrato trisódico 5 litros de agua destilada B) Solución 12% : A 1760 ml de solución A agregue 240 ml de glicerol y 0.2 gr de azida de sodio. C) Solución 6% : A 1880 ml de solución A agregue 120 ml de glicerol y 0.2 gr de azida de sodio. D) Solución 2% : A 96 ml de solución A agregue 120 ml de glicerol, 0.2 gr de azida de sodio y 1000 ml de agua destilada. PROCEDIMIENTO: 1.- Lavar las células a congelar por 6 veces con salino tamponado. 2.- Mezclar volumen a volumen las células lavadas y concentradas con la solución de glicerol al 40%. 3.- Congelar en alícuotas. 4.- Para descongelar, proceder a colocar las células en soluciones decrecientes de glicerol : 40 - 12 - 6 - 2% , agregando siempre igual volumen del glicerol que corresponde y de células a descongelar. Dejar 5min en cada paso. 5.- Una vez terminado este procedimiento, lavar las células una vez con PBS. 119 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL ESTUDIO INMUNOHEMATOLÓGICO DE UNA MUESTRA CON ANTICUERPOS FRIOS Muestra de sangre con y sin anticoagulante obtenida a 37ºC Eritrocitos Muestra con anticoagulante Realizar Clasificación ABO y Rh TAD Uselos paraRealizar autoabsorción si es necesario Suero o Plasma Realizar Clasificación ABO a 37ºC Detección Ac. Estudio Crioaglutinina Aglutinina fria de bajo rango térmico 120 Aglutinina fria de amplio rango de Tº reacción en diferentes medios PA positiva PA negativa Estudio de Título Rango térmico Especificidad Estudie frente a eritocitos O de adulto y RN Negativo con eritrocitos A,B y AB Estudio del suero luego de autoabsorción o absorción diferencias según antecedentes de Tº Realice Autoabsorción en frio si no ha sido transfundido Probable anti-IH ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL ESTUDIO DE MUESTRAS CON TAD POSITIVO TAD positivo Realizar: Estudio Acs irregulares Identificación de anticuerpos Paciente NO transfundido Autoabsorción para identificar Ac libre enmascarado Usar eritrocitos obtenidos en muestra con anticoagulante Paciente transfundido en los últimos 3 meses Elución Calor (56ºx 1' o 45ºx 1hr) ZZAP Difosfato Cloroquina, eter Fenotipar GR paciente Realizar un TAD diferencial Separar eritrocitos autólogos de homólogos Absorción diferencial Estudio del eluado Fenotipar GR paciente Elución Estudio del suero Estudio del Eluado Detección Acs. Identificación Acs. Paralelo con suero nativo Estudio del eluado Detección Acs. Identificación Acs. Paralelo con suero nativo Prueba de compatibilidad Detección Acs. Identificación Acs. Paralelo con suero nativo Todos los GR (-) Algunos GR + Todos los GR + AHAI por drogas? Aloanticuerpo? Titulación Diferencial Revisar historia clínica del paciente y obtener muestra suficiente para pruebas inmunohematológicas 1.-Auto o AloAc. contra Ag. de alta incidencia 2.-Absorción incompleta Anticuerpos pueden ser eliminados al realizar absorción diferencial 121 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL SANGRE Y COMPONENTES SANGUINEOS 122 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL PREPARACION Y CONSERVACION DE COMPONENTES SANGUINEOS Los anticoagulantes y soluciones preservadoras(ver tabla) que en la actualidad se añaden a la sangre del donante hacen posible su conservación por períodos más prolongados; esto junto al uso de sistemas cerrados de recolección que llevan adosados otras bolsas satélites de forma integral, permite la separación aséptica de los componentes sanguíneos. Las condiciones óptimas de velocidad, tiempo y temperatura requeridos tanto para la preparación como conservación y rendimiento de estos componentes, son diferentes para cada uno y deben estar determinadas para cada centrífuga y cada laboratorio en particular y revisarse periódicamente (ver tabla). CONTENIDO DE LAS SOLUCIONES PRESERVADORAS (g/L) CONTENIDO Citrato trisódico Ácidocítrico Dextrosa Fosfato de Sodio adenina ACD-A 22.00 8.00 24.50 CPD 26.30 3.27 25.50 2.22 CP2D 26.30 3.27 51.10 2.22 CPDA-1 26.30 3.27 31.90 2.22 0.275 CAMBIOS BIOQUIMICOS DE SANGRE CONSERVADA CON CPD Y CPDA-1 VARIABLES CPD SANGRE CPDA-1 ST 0 100 Dias conservación 0 21 % cel. viables a las 24 100 80 horas pH a 37ºC 7.2 6.84 7.6 % ATP (del valor 100 86 100 inicial) 2,3DPG (del valor 100 44 100 inicial) K+ plasma * 3.9 21.0 4.2 Na+ plasma * 168.0 156.0 169.0 Hb plasmática 17.0 191.0 82.0 * = mmol/L ; & =el plasma total de estas unidades es 70 ml. GR 0 100 ST 35 79 GR 35 71 7.55 100 100 6.98 56+/16 <10 6.71 45+/12 <10 5.1 169.0 78.0 27.3 155.0 461.0 78.5 & 111.0 658.0 PREPARACION DE COMPONENTES SANGUINEOS POR CENTRIFUGACIÓN. Centrifugación a "alta velocidad Concentrado de Glóbulos Rojos Concentrado de Plaquetas. Plasma Plasmaféresis Crioprecipitado Centrifugación "suave" Plasma rico en plaquetas estandarizar cada centrifuga Ej.: 5000 x g, 7 minutos estandarizar cada centrifuga Ej.: 2000 x g, 3 minutos. 123 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL METODOS A. CONCENTRADO DE GLOBULOS ROJOS. 1. Extraer sangre en bolsa doble o triple y mantenerla en refrigeración a 4ºC hasta ser procesada. 2. Centrifugar a "alta velocidad" y a 5ºC. 3. Colocar la bolsa principal que contiene la sangre centrifugada en un compresor de plasma y soltar el muelle, dejando que la placa del compresor entre en contacto con la bolsa. 4. Obturar el tubo entre la bolsa primaria y las satélites con una pinza o hacer un nudo flojo. Si hay 2 bolsas satélites, colocar una pinza para que el plasma entre a sólo una de ellas. 5. Marcar las bolsa satélites con la misma identificación que la bolsa principal (Nº donante, fecha de preparación, tipo de componente ) y romper el sello. La eliminación de 225-250 ml de plasma dará lugar a unos hematíes residuales con 70- 80% de Hto. 6.- Volver a pinzar cuando haya entrado en la bolsa satélite la cantidad de plasma deseada. Sellar la tubuladura entre ambas bolsas en dos lugares y cortar en esa zona. 7.- Almacenar los componentes sanguíneos obtenidos a temperatura adecuada para cada uno. Si se extrae sangre en bolsa única: después de dejar la bolsa en el compresor, colocar una pinza en la tubuladura de la bolsa de trasferencia estéril, insertar en condiciones asépticas la cánula de la bolsa transfer en el orificio de salida de la bolsa de sangre, aflojar la pinza y continuar el procedimiento antes señalado. Esta unidad preparada en "circuito abierto" debe ser transfundida dentro de las 24 hrs. B. CONCENTRADO DE GLOBULOS ROJOS POBRE EN LEUCOCITOS (bolsa invertida) 1.- Utilizar sangre con no más de 6 horas de extraída. 2.- Centrifugar la bolsa en forma invertida a "alta velocidad" y 5ºC. 3.- Colgar de un soporte la bolsa primaria que contiene la sangre centrifugada y continuar el procedimiento igual al anterior a partir del punto 4. Traspasar a la bolsa satélite o transfer estéril solo los dos tercios de los glóbulos rojos eliminado así cerca del 75 % de leucocitos. Si se extrae sangre en bolsa única: seguir las indicaciones arriba expuestas. C. PLASMA FRESCO CONGELADO (PFC) 1.- Extraer sangre en bolsa doble o triple, mantenerla en refrigeración a 4ºC y procesarla antes de 6 hrs de extraída. 2.- Proceder igual a método A. 3.- Congelar el plasma a -20ºC o más, de modo tal que éste quede congelado en estado sólido en un plazo de 6 hrs. desde la extracción. 4. Almacenar el PFC a -20ºC . NOTA: el plasma debe estar libre de glóbulos rojos 124 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL D. CRIOPRECIPITADO DE GLOBULINA ANTI HEMOFILICA(AHF) O FACTOR VIII. 1.- Extraer sangre en bolsa doble o triple, mantenerla en refrigeración a 4ºC y procesarla antes de 6 hrs de extraída. 2.- Proceder igual a método A 3.- Congelar el plasma en forma rápida antes de 1 hr, esto se logra con congeladores de aire forzado o congeladores mecánicos capaces de mantener temperaturas de -65ºC o menos, hielo seco o un baño de etanol-hielo seco. 4.- Dejar descongelar el plasma a 1-6ºC colocando la bolsa en un refrigerador a 4ºC. 5.- Centrifugar el plasma a "alta velocidad" y 5ºC una vez descongelado. 6.- Colocar la bolsa en una prensa de plasma y dejar pasar a la bolsa satélite el 90% del plasma sobrenadante sin factor VIII dejando 10 a 15 ml de plasma para resuspender el crioprecipitado al momento de usar. 7.- Pinzar la tubuladura, comprobar que cada bolsa tenga la identificación correcta (Nº donante, fecha elaboración, tipo de componente). Sellar la tubuladura entre ambas bolsas en dos lugares y cortar en esa zona. 8.- Congelar rápidamente el crioprecipitado a -65ºC y almacenar a 20ºC. En estas condiciones dura 12 meses a partir de la fecha de extracción. Almacenar el plasma sin F VIII a - 20ºC o 4ºC E. CONCENTRADO DE PLAQUETAS DE DONANTE AL AZAR: 1.- Extraer sangre en bolsa doble o triple, mantener a temperatura ambiente (22ºC) antes de separar el plasma rico en plaquetas de los hematíes. Procesar dentro de 6 hrs de extracción. 2.- Centrifugar mediante centrifugación "suave" a 20ºC para obtener plasma rico en plaquetas. 3.- Ídem método A, puntos 3 - 4 -5 4.- Traspasar el plasma rico en plaquetas a la bolsa satélite prevista como "Concentrado de Plaquetas" (CP). Evitar la contaminación con glóbulos rojos. Sellar la tubuladura en dos puntos entre la bolsa primaria y bolsa satélite CP y cortar entre ellos. Refrigerar los hematíes a 4ºC. 5.- Centrifugar el plasma rico en plaquetas a 20ºC y "alta velocidad". 6.- Traspasar el plasma sobrenadante pobre en plaquetas a otra bolsa satélite; dejar en el concentrado de plaquetas 50-60ml de plasma. Sellar el tubo en dos puntos ente ambas bolsa y cortar entre ellos. 7.- El concentrado plaquetario debe permanecer quieto a temperatura ambiente por 1 hr; luego colocar en el agitador de plaquetas a 20ºC. El plasma pobre en plaquetas puede congelarse rápidamente y conservar como plasma fresco congelado. 125 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL CARACTERISTICAS DE LOS PRINCIPALES COMPONENTES SANGUINEOS COMPONENTE CONSERVACION VOLUMEN CONTENIDO (DIAS) (ML) GLOBULOS CPD: 21 250 GR: 65-80% ROJOS CPD-A: 35 a PLASMA: CONCENTRAHEPARINA: 2 300 20-35% DOS C.A.: 24 hr ALGUNAS: Tº:2-6ºC plaquetas y GB G.R. POBRES C.C.: igual 175 GR: 80-95% EN LEUCO GR a PLASMA: C.A.: 24 Hr 245 5-20% GB: < 30% Tº:2-6ºC PLAQUETAS Dadores al Azar 3-5 depende del plástico 24 Hrs (C.A.) 50 -65 PLAQUETAS: 5.5 x 1010 PLASMA: 50-65ml GB: Tº:22ºC PLAQUETAS Donante Único 24 Hrs (C.A.) 3 -5 depende del plástico 300 a 500 PLASMA fresco congelado 1 año congelado 6-24 hr líquido 150 a 250 PLAQUETAS: 3.0 x 1011 PLASMA: 300-500 ml GB: * PLASMA: todos los F. de coagulación F.I: 400 mg Tº: -20ºC PLASMA Conservado CRIOPRECIPITADO 5 años congelado líquido: 5 díasmás que sangre Tº: -20ºC Congelado: 1 año Descongelad 6-8 hr En pool: 4 hr tº:-20ºC 126 150 a 250 10-30 PLASMA: Solo F. estables F.VIII C: 80-150 mg F.XIII: 20-30% del nivel st. FIBRINOGENO 150-250 mg F.VW: 40-70% del nivel st. CONTROL DE CALIDAD - Hto: < 80% -Cultivo bacteriano según programa de Con.Cal. -Recuperación: 70-80% GR -Remoción: 70% GB (< 5x108 GB) -Hto:>o= 80% -Recuento: & 5.5x1010 Plaq. -pH: 6.0 o mas al fin de su conservación -Preparación: antes de 6 hrs. de extracción -Volumen: 50-65 ml -Recuento: & 3.0x1011 Plaq. -pH: 6.0 ídem -Preparación: antes de 6 hrs. de extracción -Conservación: < 18ºC - Descongelar: 30-37ºC -Conservación: < 18ºC - 80 UI F.VIII en el 75% de las unidades estudiadas. (1 vez al mes) -Descongelar a 37ºC. ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL C.A.: Circuito abierto, C.C.: Circuito cerrado GR:Glóbulos rojos, GB: Glóbulos blancos &: en el 75% de las unidades estudiadas. CALIBRACION DE CENTRIFUGA PARA OBTENCION DE PLAQUETAS. 1.- Recoger un tubo de sangre del donante con EDTA. Realizar recuento de plaquetas. Si es inferior a 133 X 103/ ul no debe utilizar esta unidad para calibración. 2.- Calcular el Nº de plaquetas en la unidad de sangre total: recuento de plaq/ul X 1000 X ml de sangre = Nº de plaq en la unidad de sangre total. 3.- Centrifugar la unidad de sangre a velocidad y tiempo seleccionado ej.: 1200 rpm, 10 min. 4.- Obturar temporalmente la tubuladura de una bolsa satélite. Traspasar el plasma rico en plaquetas (PRP) según técnica. No retirar el obturador temporal hasta el paso siguiente. 5.- Exprimir la tubuladura varias veces hacia dentro de la bolsa para que contenga una muestra representativa del PRP. 6.- Sellar un segmento del tubo y desconectarlo de manera que la bolsa de PRP siga siendo estéril. 7.- Realizar recuento plaquetario de esta muestra y calcular el Nº de plaquetas en la bolsa de PRP: Recuento plaquetas/ul x 1000 x ml de PRP = Nº de plaquetas en el PRP 8.- Calcular el porcentaje de recuperación: Nº de plaquetas en PRP X 100 = recuperación (%) Nº plaquetas en sangre total 9.- Repetir el procedimiento anterior 3 o 4 veces con distintos donantes, utilizando centrífugas, velocidades y tiempos distintos. Comparar los rendimientos de cada ensayo 10.- Seleccionar el tiempo más corto y velocidad menor que dé el mayor porcentaje de recuperación de plaquetas en PRP con un nivel aceptable de contaminación de rojos. 11.- Proceder a la preparación del concentrado plaquetario(CP) en la forma habitual, dejando un segmento largo de tubuladura conectado al concentrado. 12.- Después de resuspender las plaquetas, exprimir varias veces la tubuladura mezclando bien su contenido con el de la bolsa para obtener una muestra representativa. Sellar un segmento del tubo y desconectarlo de manera que la bolsa de CP siga siendo estéril. 13.- Realizar recuento plaquetario. Calcular el Nº de plaquetas en CP: Recuento plaquetas/ul x 1000 x ml del CP = Nº de plaquetas en CP 14.- Calcular porcentaje de recuperación: Nº de plaquetas en CP Nº plaquetas en PRP X 100 = recuperación (%) 127 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 15.- Repetir los pasos 11 a 14 con distintas centrífugas, velocidades y tiempos distintos. Comparar los rendimientos de cada conjunto de condiciones de centrifugación. 16.- Seleccionar el tiempo más corto y velocidad menor que den mayor porcentaje de recuperación de plaquetas en el concentrado. Una vez calibrada la centrífuga, no es necesario volver a hacerlo a no ser que se presente un problema de funcionamiento o que disminuya el rendimiento de los concentrados. CONTENIDO APROXIMADO DE LEUCOCITOS EN LOS COMPONENTES SANGUINEOS COMPONENTE SANGUINEO Sangre total Concentrado de eritrocitos Eritrocitos lavados GR congelados y desglicerolizados Plaquetas por aféresis Concentrados plaquetarios LEUCOCITOS POR UNIDAD 109 108 107 106 - 107 106 - 108 107 REDUCCION DE LEUCOCITOS EN LOS COMPONENTES SANGUINEOS: DEFINICIONES: Leucocitos/ul: Nº de células en un volumen de 1 ul, se determina por método de conteo microscópico directo. Leucocitos/ml: Para determinar leucocitos por ml, multiplique el Nº de leucocitos/ul por 1000. (1000ul = 1 ml) Contenido residual (efluente): Se define como en Nº total de leucocitos que permanecen en la unidad después de la filtración. También se llama contenido efluente y se puede calcular : Leucocitos/ul X 1000 X volumen de la unidad (ml). Log (logaritmo) de reducción Es la reducción de leucocitos que se logra por filtración, expresada en logaritmo. Log es el poder en que el número 10 debe aumentar en orden de producir un número dado. Ejemplo: log de 1000 = log 103 = 3; log de 10000 = log 104 = 4 FORMULAS: Eficiencia porcentual de reducción de leucocitos: Se ha usado para indicarla fracción o porcentaje de leucocitos que se retiran durante la filtración. Disponiendo de un método de recuento apropiado y seleccionado, la eficiencia porcentual de reducción de leucocitos se calcula: Eficiencia % de reducción = 1 – (leuco efluentes/ul) * (leuco iniciales/ul) 100 de leucocitos EJEMPLO: 1.-Volumen de la unidad: 350 ml 2.-Recuento inicial (antes de la filtración): 1.750.000.000 (1.75x109) leucocitos inicial/unidad o 5.000.000 (5 x 106) leucocitos/ml o 128 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL 5.000 (5 x 103) leucocitos/ul 3.-Recuento residual (efluente): 5 leucocitos/ul 4.-Cálculo: a.-Eficiencia % de reducción de leucocitos: (1 – 5/5000) * 100 = 99.9% b.-Log de reducción: log 10leucocitos iniciales/ul leucocitos residuales/ul log 105000 = 3.00 5 c.-Contenido residual: leucocitos/ul * 1000 * Volumen de la unidad(ml) 5 * 1000 * 350 = 1.75 * 106 leuco/unidad DATOS BIOLOGICOS DE ALGUNOS FACTORES DE COAGULACION FACTOR FIBRINOGENO PROTROMBINA F-V F-X F - VII F - VIII F - IX F - XI F - XIII Von WILLEBRAND CONCENTRA APROX. PLASMA (mg/ml) 2.8 0.13 0.068 0.012 0.0005 0.00024 0.005 0.006 0.029 0.006 VIDA MEDIA (Horas) 99+/-3 73+/-7 12-36 33 5 13+/-3 23+/-2 61 282 20-40 NIVEL RECOMEND PARA CIRUGIA 1mg/ml 40-50% 10-30% 10-40% 10-20% 30-100% 20-60% 20-30% 10% 20-50% FRACCION INTRAVASCULAR RECUPERACION 72% 58% 22% 83% 51% 100% 80-100% 24-54% 100% 50% 73% 129 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL UNIDAD EFECTOS ADVERSOS DE LA TRANSFUSION SANGUINEA 130 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL EFECTOS ADVERSOS DE LA TRANSFUSION SANGUINEA INTRODUCCION: La transfusión de sangre y sus componentes generalmente es una forma segura y eficaz de corregir déficit hematológico, sin embargo no está libre de riesgo debido a diferentes causas: ser un trasplante de un tejido liquido presencia de nuevas enfermedades transmisibles, incompatibilidades no pesquisable, donante en periodo de ventana de una enfermedad transmisible y no detectada por las actuales técnica de laboratorio, falla inherente a toda actividad humana etc. Los efectos adversos que pueden presentarse con la administración de sangre involucran aspecto y problemas más amplios que la común mente llamado " reacciones transfusionales". Alrededor de un 10% de los receptores transfundidos presentan reacciones; algunas son evitables pero otras no. El conocimiento de los efectos adversos a la transfusión es necesario y obligatorio para el Tecnólogo Médico que ejerce en un servicio de sangre, para su prevención, reconocimiento precoz, investigar las causas y adoptar las medidas correctoras correspondientes. A.- REACCIONES TRANSFUNSIONALES INMEDIATAS Las reacciones transfusionales inmediatas generalmente ocurren dentro las dos primeras horas de la transfusión, son de varios tipos y pueden deberse a causas inmunológicas y no inmunológicas. Las causas inmunológicas incluyen incompatibilidad del receptor con los eritrocitos del donante, glóbulos blancos, plaquetas o componentes plasmáticos. En la mayoría de los casos, las reacciones agudas se deben a la presencia de anticuerpos del receptor dirigidos contra antígenos presentes en el producto transfundido. Menos frecuentemente puede ocurrir por anticuerpos incompatibles en el plasma del donante. Las reacciones transfusionales no inmunológicas pueden resultar de sobrecarga circulatoria, contaminación bacteriana, acción de citoquinas liberada en la sangre almacenada etc. La observación del paciente durante la transfusión permitirá pesquisar las reacciones adversas tempranas y tomar las medidas apropiadas para limitar el daño. Pulso, temperatura y presión sanguínea deben registrarse antes de iniciar la transfusión, 15 minutos después y repetir cada 30 minutos. 131 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL REACCION TRANSFUSIONAL HEMOLITICA Es causada por la reacción antígeno - anticuerpo que activa el complemento, los sistemas de coagulación y una respuesta endocrina, provocando un aumento de la destrucción de los eritrocitos. La hemólisis puede ser predominantemente intravascular, debida a anticuerpos IgM que fijan y activan la vía clásica del complemento hasta C9 provocando la ruptura de las células en el torrente sanguíneo y liberación de hemoglobina al plasma. Los anticuerpos IgG que no activan complemento (ej.: anti-Rh) o solo parcialmente hasta la etapa C3 (ej.: anti Kell), causan hemólisis extravascular, mediada por fagocitosis o citotoxicidad de los eritrocitos por las células del sistema retículo endotelial (SRE) en el hígado y bazo. Otras causas de hemólisis son el daño osmótico de eritrocitos por inyección accidental de agua en la circulación,contaminaciónbacteriana, sobrecalentamiento etc. REACCION TRANSFUSIONAL HEMOLITICA AGUDA Es causada por anticuerpos IgM dirigidos contra antígenos eritrocitarios produciendo hemólisis intravascular; generalmente son el resultado de incompatibilidad ABO aunque ocasionalmente otros anticuerpos IgM pueden originarla. Signos y síntomas de una reacción hemolítica Fiebre Calofríos Dolor torácico Hipotensión Nausea Disnea Enrojecimiento facial Hemoglobinuria Shock Hemorragia generalizada Oliguria o anuria Dolor lumbar Dolor en zona de punción Hemoglobinemia TRANSFUSIONES ABO INCOMPATIBLES La incompatibilidad ABO es principalmente el resultado de una incorrecta identificación del receptor, ya sea en la muestra de sangre usada para realizar los exámenes pre transfusionales o en el momento de administrar la transfusión. Los signos clínicos seguidos a una transfusión ABO incompatible se presentan en los primeros minuto; bastan solo 5 a 20 ml de infusión para desencadenar la reacción. Algunos pacientes presentan los signos clásicos y más característicos como son: disnea, dolor precordial, angustia, dolor en la región lumbar. Otros se quejan de 132 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL dolor o malestar en el sitio de punción, enrojecimiento facial o leve alza de la temperatura. En pacientes que se encuentran anestesiados durante la transfusión, dos importantes signos revelan este tipo de reacción: hipotensión a pesar de una adecuada reposición de fluidos, y sangramiento anormal. Los efectos clínicos varían grandemente. Por un lado, menos del 10% de los pacientes con esta incompatibilidad, desarrollan hemólisis intravascular aguda, seguida de falla renal y muerte; mientras en otros, los efectos clínicos no son fácilmente reconocibles. Es difícil establecer la frecuencia exacta con que ocurre este fenómeno; sin embargo es lejos la causa más común de reacción hemolítica aguda y de muerte inmediata después de la transfusión. REACCION FEBRIL NO HEMOLÍTICA A.- Por anticuerpos HLA Es causada por anticuerpos HLA del receptor que reaccionan con el correspondiente antígeno ubicado en los glóbulos blancos del donante. El complejo antígeno - anticuerpo activa complemento y se une a monocitos activado liberando citoquinas con propiedades pirogénicas. Se produce en alrededor de 10 % de las transfusiones sanguíneas, caracterizándose por un estado febril con calofríos. Es más frecuente en multíparas y en pacientes politransfundidos. La reacción febril se produce generalmente dentro de los 60 - 80 minutos de producida la transfusión, no es fatal y generalmente provoca gran malestar al paciente. B.- Por citoquinas Fiebre y calofríos pueden ocurrir por acción de citoquinas tales como IL-1 y TNF presentes en productos sanguíneos conservados. Las citoquinas son producidas por los glóbulos blancos del donante ; su efecto puede prevenirse usando productos depletados de glóbulos blancos antes del almacenamiento. REACCIÓN CAUSADA POR PROTEINAS: Anticuerpos a IgA . Una de las complicaciones más comunes es la urticaria, producida por un alergeno del receptor contra las proteínas plasmáticas del donante, generalmente por anticuerpos Ig E. La reacción anafiláctica severa puede aparecer inmediatamente caracterizada por broncoespasmo, tos, cianosis, inestabilidad muscular, nauseas, shock, pérdida de conciencia; es producida por anticuerpos Ig A. 133 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL TRANSFUSION DE GLOBULOS ROJOS CONTAMINADOS Los glóbulos rojos contaminados con bacterias se reconocen por la presencia de hemólisis y la decoloración de ellos. Los efectos tóxicos inmediatos que produce esta sangre al ser transfundida provocan a veces un daño mayor que las otras reacciones hemolíticas. La contaminación de la sangre no es frecuente, pero ocurre por las siguientes razones: - Bacteremia asintomática en donantes aparentemente sanos con un pequeño número de bacterias, como por ej. Yersinia enterocolítica. - Contaminación de la unidad de sangre durante la recolección con bacterias de la flora normal de la piel del donante (ej.: staphylococcus epidermis, micrococcus o sarcina spp) - solución anticoagulante contaminada - Contaminación de los sellos de las bolsas de crioprecipitado o plasma congelado, al descongelarlos en agua infectada comúnmente con pseudomonas. FALLA PULMONAR AGUDA (TRALI) Esta reacción es poco usual, pero potencialmente fatal. Ocurre inmediatamente después de la transfusión debido a anticuerpos leucocitarios del donante contra leucocitos del receptor o viceversa, produciéndose una leucoaglutinación . El paciente puede presentar síntomas de distress respiratorio, fiebre, calofríos, cianosis hipovolemia y edema pulmonar agudo. HEMOLISIS CAUSADA POR LINFOCITOS PASAJEROS Órganostrasplantados contienen linfocitos que pueden montar una respuesta inmune contra los antígenos del huésped. Algunos receptores de grupo A, B o AB, que reciben un órgano de dadores del grupo O, pueden sufrir hemólisis a la semana del trasplante como resultado de la producción de anti A, o anti B por linfocitos pasajeros del órgano donado, estimulado por los antígenos A o B de receptor. Esta hemólisis se ha observado en pacientes que trasplantados de riñón, corazón, médula ósea y pulmón. han sido En estos casos hay una inesperada baja de la hemoglobina en el post trasplante a pesar de la transfusión sanguínea. 134 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL HEMOLISIS CAUSADA POR UN EFECTO OSMOTICO Inyección accidental de agua en la circulación , conduce a una reacción hemolítica . Esto se presenta generalmente en operados de prostactectomia transuretral. HEMOLISIS CAUSADA POR DAÑO FÍSICO DE LA SANGRE A.- Sobre calentamiento En algunas ocasiones es preciso entibiar la sangre para transfundirla, si la temperatura excede los 37ºC puede producirse hemólisis de la unidad. Aparte de considerar las razones clínicas para entibiar la sangre, es necesario utilizar el equipo apropiado para esta operación, y verificar el control de temperatura de éste. En caso de utilizar un baño María, controlar la temperatura con un termómetro durante todo el proceso. B.- Congelación La unidad de sangre puede congelarse por almacenamiento en refrigerador no diseñado para esta función o dejada en el congelador en forma accidental por desconocimiento de las normas establecidas. C.- Administración a presión Transfundir la sangre y/o glóbulos rojos a presión y/o por una aguja de calibre muy pequeño como las utilizadas para infundir suero, provocan hemólisis de los eritrocitos. B.- REACCIONES TRANSFUSIONALES RETARDADAS Estas se presentan días o meses después de la transfusión y tienen diversas etiologías tanto inmunológicas como no inmunológicas. Se considera también en esta clasificación a las complicaciones infecciosas de la transfusión REACCION TRANSFUSIONAL HEMOLITICA RETARDADA Se debe a la acción de aloanticuerpos IgG clínicamente significativos (ej.: anti-D, anti Jka) presentes en el paciente y que pueden provocar hemólisis extravascular de eritrocitos incompatibles del donante. Existen dos tipos de reacción hemolítica retardada. El primero se produce semanas después de la transfusión como resultado de una aloinmunización primaria. La producción de anticuerpos comienza 7 o 10 días post transfusión y a medida que 135 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL aumenta el título y avidez de éste se produce la hemólisis de los eritrocitos El segundo tipo tiene lugar en sujetos ya inmunizados, pero la concentración de anticuerpos es tan baja que no puede ser detectada por los tests pre transfusionales; o bien se produce una respuesta anamnéstica, elevándose la concentración de anticuerpos 3 días más tarde. Síntomas y signos más comunes de esta reacción Fiebre Ictericia leve Descenso de la Hemoglobina Hemoglobinuria ENFERMEDAD INJERTO VERSUS HUESPED Es una complicación no habitual y tiene lugar en pacientes inmunodeprimidos, en los cuales los linfocitos inmunocompetentes del donante, anidan y se multiplican, reaccionando contra los tejidos “extraños” del huésped. El síndrome clínico puede incluir fiebre, erupción cutánea, diarrea, supresión de la medula ósea. PURPURA POST TRANSFUSIONAL Se presenta casi exclusivamente en mujeres multíparas. Producto de anticuerpos anti plaquetarios, que provocan una caída vertiginosa de plaquetas, dando lugar a un púrpura generalizado aproximadamente una semana después de la transfusión. 136 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL CUADRO RESUMEN DE LOS EFECTOS ADVERSOS DE LA TRANSFUSIÓN SANGUÍNEA EFECTOS INMEDIATOS EFECTOS INMUNOLOGICOSETIOLOGIA HABITUAL Hemólisis sintomática G. Rojo Incompatibles Febril no Hemolítica Granulocitos Donante Anafiláctica Ac Anti Ig A Urticaria Ac Anti Proteínas Plasma Edema Pulmonar no cardiológico Ac. Anti Leucocitos o Activación del C EFECTOS NO INMUNOLOGICOS Alza Febril-Shock Contaminación Bacteriana Insuficiencia Cardiaca Congestiva Sobrecarga de líquidos Hemólisis Sintomática Destrucción física de la sangre 137 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL EFECTOS RETARDADOS EFECTOS INMUNOLOGICOSETIOLOGIA HABITUAL Hemólisis sintomática Ac. Anamnésicos eritrocitarios Reacción injerto / huésped Prolif. Linfocitos funcionales del donante Púrpura post transfusional Aloinmunización contra ag. de eritrocitos Leucocitos, plaquetas, proteínas plasma Anticuerpos anti plaquetarios antígenos Exposición a antígenos del donante EFECTOS NO INMUNOLOGICOS Sobrecarga de hierro Múltiples transfusiones Hepatitis Virus hepatitis B, C Síndrome inmunodeficiencia adquirida VIH - I, VIH-II Infección por protozoos Malaria, Chagas 138 frente ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL INVESTIGACION DE UNA REACCION TRANSFUSIONAL En toda UMT o Banco de Sangre o Servicio de Transfusiones, las reacciones transfusionales adversas se presentan de tiempo en tiempo, porque aunque el donante es compatible, no es posible tener todos los antígenos eritrocitarios, leucocitarios y plaquetarios, idénticos con el receptor. Las reacciones alérgicas y febriles son las más comunes y en muchos casos inevitables, al menos inicialmente. Las reacciones hemolíticas tardías ocurren con cierta frecuencia pero no siempre son fáciles de detectar o prevenir Las pruebas cruzadas solo sirven para reducir considerablemente la posibilidad de que ocurra una reacción hemolítica mayor; pero no para eliminar errores administrativos. Cualquier síntoma o signo físico que se presente durante o inmediatamente después de la transfusión de sangre o productos sanguíneo debe considerarse como una potencial reacción hemolítica hasta que se demuestre lo contrario y deben tomarse las siguientes medidas: A.- Junto al paciente 1. 2. 3. 4. 5. 6. • • • • • Detener la transfusión. Mantener abierta la vía venosa Notificar al médico tratante y a la UMT No eliminar la unidad ni el infusor. No transfundir otras unidades destinadas al paciente Comprobar datos del paciente con etiquetas, formularios, y unidad(s) destinada al paciente: Nombres y apellidos Nº de historia clínica Indicación de transfusión y tipo de producto sanguíneo Sala - Nº cama Grupo sanguíneo ABO y RhD 7. - Tomar muestras de sangre con anticoagulante (EDTA) y sin anticoagulante, evitando la hemólisis mecánica y en lo posible de otra vía venosa . 8. - Recolectar muestra de orina fresca a las 0, 6 y 12 hrs para investigar Hb libre. La presencia de glóbulos rojos intactos en las muestra de orina debido a hematuria del tracto urinario y su posterior hemólisis in vitro , puede falsear el examen. 9. - Enviar al Banco de Sangre la unidad sospechosa, el infusor, las muestras de sangre del paciente y el protocolo de reacción con los datos requeridos B.- En la UMT o Banco de Sangre Registrar fecha y hora de llegada del protocolo de reacción adversa. 139 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL Observar las condiciones de las unidades devueltas y filtro utilizado 1. - Efectuar investigación administrativa comprobando los datos del paciente y de la (s) unidad (es) con: - los registros existentes en el banco de sangre muestra post transfusión muestra pre transfusión unidad (s)transfundida (s) informe de reacción adversa etiquetas de la unidad transfundida resultado de la prueba cruzada Si hay discrepancia en este punto, en especial en la identificación nominal y/o de grupo sanguíneo, avisar inmediatamente al médico tratante y descartar que no estén otros pacientes involucrados, verificando las transfusiones hechas cercanas al caso en cuestión. 4. - Iniciar investigación serológica a) b) Comparar color y aspecto del plasma de la muestra pre y post transfusión para detectar hemólisis. La manipulación y centrifugación de las muestras debe ser cuidadosa, evitando provocar hemólisis mecánica que falsee el resultado. Una coloración rosada o roja solo del plasma post transfusión significa Hb libre. En muestras tomadas 4 a 10 hrs post transfusión, el color amarillo o café proviene de aumento de bilirrubina y productos de degradación de la Hb. Realizar Test Antiglobulina Directa a ambas muestras. Un resultado 1+ débil con campo mixto , se puede encontrar en muestras tomadas en los inicios de la reacción , en especial tratándose de una reacción hemolítica aguda TAD negativo puede producirse por rápida destrucción intravascular de los eritrocitos ej.: incompatibilidad ABO c) Repetir clasificación ABO y Rh y pruebas cruzadas, en pre, post y unidad (s) transfundidas. d) Identificar anticuerpo irregular 5. -Utilizar técnicas de detección más sensibles sí la situación lo amerita como por ejemplo: aumento proporción suero/células 6. -Cultivo microbiológico sí los síntomas del paciente indican bacteriana del producto transfundido 7. - Conocer resultado resiente de uro análisis del paciente y presencia de eritrocitos, hemoglobina o estroma y pos transfusional. 8. - Registre los resultados de cada paso de la investigación y analícelos cuidadosamente. 140 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL ENFERMEDADES DE TRANSMISION SANGUINEA NOTA: En todos los procedimientos de detección de enfermedades de transmisión sanguínea debe seguirse cuidadosamente TODAS las instrucciones del fabricante. A continuación se entregaran algunos ejemplos de kit comerciales usados para estos fines. 141 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL TESTS SEROLOGICOS EN EL DIAGNOSTICO DE HEPATITIS VIRAL AGENTE REACTIVIDAD DEL TEST HBsAg Anti-HBc AntiHBeAg Tot. IgM HBs VIRUS B + +/+/+/- Virus D Virus A Virus E AntiHBe - + - + + + + - + +/- +/- + + - - +/- +/- - + - + - + - - - + - - - + - - - - " + Anti-delta + + " + Anti – VHA Total Anti-HBc + + Vacunado o Recuperado Recuperado ? HD aguda o crónica Recuperado Anti-VHC (Screening) + + + - HA aguda Vacunado o recuperado Ags. Recombinantes C-100-3 5-1-1 C22-3 C33-c + + + + Anti – VHE Total IgM + + + + + + + + - + + - + + - + - + - CAUSAS POSIBLES DE RESULTADOS FALSOS EN TEST ELISA 1.- Dos resultados no coincidentes: PROBLEMAS TECNICOS: Lavado incorrecto Mala preparación del sustrato/conjugado 142 HB aguda antes de síntomas HB aguda Convales. o posible portador crónico Portador Crónico & Recuperado IgM + + Virus C INTERPRETACION HC aguda o crónica Probable HC crónica ¿HC aguda? Falso positivo? HE aguda Recuperado ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL - incubación a temperatura incorrecta Material sucio Mantener los reactivos en forma incorrecta Omisión de la muestra Registros incorrectos Error humano Mantención y calibración adecuada de los equipos 2.- Repetidamente reactivos: Baja de especificidad en el reactivo Presencia de Ac contra HLA-DR (en VIH) Ac. de reacción cruzada con contaminantes del cultivo celular o ¿epitopos virales? Pacientes con niveles elevados de Igs. Acs adquiridos pasivamente Receptores de vacunas 3.- Características de la muestra: Lipemia Hemólisis Contaminación EVALUACION DE PROCEDIMIENTOS DE TAMIZAJE O SCREENING Sensibilidad, especificidad, valor predictivo positivo y negativo Las pruebas de tamizaje utilizadas en Banco de Sangre para detectar en los donantes de sangre enfermedades de transmisión sanguínea, deben cumplir con condiciones básicas de sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo, que nos permiten conocer cuales son sus márgenes de error. Ellos pueden calcularse de acuerdo a los resultados expresados en una tabla cuadricelular: PRUEBA POSITIVA PRUEBA NEGATIVA TOTAL • ENFERMOS SANOS TOTAL A Verdaderos positivos C Falsos negativos A+C Total de enfermos B Falsos positivos D Verdaderos negativos B+D Total de sanos A+B Total de positivos C+D Total de negativos A+B+C+D Total La sensibilidad Es la proporción de enfermos cuya prueba de screening resulta positiva (verdaderos positivos) en relación al total de enfermos (A+C). Corresponde a la relación A/A+C. Define la capacidad de la prueba de identificar a los enfermos. 143 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL • La especificidad Es la capacidad de la prueba de dar un resultado negativo en personas que no presentan la enfermedad en el momento del estudio. Corresponde a la relación del número de verdaderos negativos sobre el total de sanos D/B+D. • La concordancia Es la suma de los verdaderos positivos y los verdaderos negativos en el total de personas estudiadas. Corresponde a A+D/A+B+C+D. • El valor predictivo positivo(VPP) Corresponde a la proporción de enfermos que existen en el total de personas con prueba positiva. Se calcula relacionando A/A+B. • El valor predictivo negativo (VPN) Expresa la proporción de sanos en el conjunto de personas cuyo resultado fue negativo. Se calcula relacionando los verdaderos negativos con el total de negativos, D/C+D. El poder predictivo de una prueba depende de la frecuencia del daño a la salud. Cuando la prevalencia es alta aumenta el VPP y disminuye el VPN y viceversa a medida que baja la prevalencia de la enfermedad. La detección de enfermedades de transmisión sanguínea en dadores en el Banco de Sangre, presenta características especiales por lo que generalmente se privilegia la sensibilidad sobre la especificidad, esto implica necesariamente el uso de métodos de confirmación para las pruebas de screening empleadas. 144 ________________________________________________________________________________INMUNOHEMATOLOGIA Y MEDICINA TRANSFUSIONAL BIBLIOGRAFIA 12.3.4.5.6.7.8.- 9.10.11.12.13.14.15.15.16.17.18.19.20.- Race R. and Sanger "Blood groups in man"6th Ed. Neville J. Bryant "An introduction of immunohematology" 2th Petz L. "Clinical pratice of blood transfusion". Genetet B., Mannon P., "La transfusión" 2ª Ed. Ediciones Toray S.A. Barcelona. 1980. Marletta J. "Hemoterapia e Inmunohematología", Ed. Científico-técnicas americanas. 1981. Linares J. "Inmunohematología y transfusión, principios y procedimientos" Greenwald T.J. "Blood transfusion", 1 Ed, 1988 AABB "Blood groups systems: ABO and Lewis MNSs "Progress in immunohematology" "Transfusion therapy: from donor to patient" Contreras M. "ABC of transfusion". Published by the British Medical Journal. 1990. Technical Manual of the American Association of Blood Banks. . Standards of Blood Banks and Transfusion Services. American Association of Blood Banks. 15th edition 1993. Guidelines for the Blood Transfusion Services in the United Kingdom. UKBTS and NIBSC.1989. Pautas para la organización de un servicio de transfusión de sangre. OMS Ginebra, 1993. Mollison P.L, Engelfriet C.P., Contreras M. Blood Transfusion in Clinical Medicine. Blackwell Scientific Publications. 9th edition 1993 Mollison P.L, Engelfriet C.P., Contreras M. Blood Transfusion in Clinical Medicine. Blackwell Scientific Publications. 11th edition 2005 News Briefs. American Association of Blood Banks. 1993-1994. Acreditation Manual. American Association of Blood Banks. 1993. Manual de procedimientos de Banco de Sangre. Ministerio de Salud de Chile. 1985. " Laboratory Haematology" section Nº 4 . Técnicas en Inmunohematología, serología de grupos sanguíneos. Churchill Livingstones. 1989. Judd W.J. Methods in Immunohematology. Montgomery Scientific Publications, Miami FL. 1988. Medina Lois Ernesto. Métodos epidemiológicos en clínica y en Salud Pública. 2ª edición. Escuela de Salud Pública. Universidad de Chile. 1987. 145