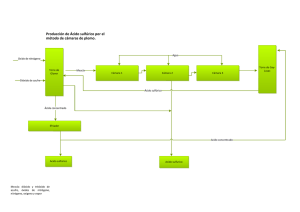
LOS ÓXIDOS De Carbono, Azufre y Nitrógeno. OXIDO DE CARBONO • El monóxido de carbono, también denominado óxido de carbono (II), gas carbonoso y anhídrido carbonoso (los dos últimos cada vez más en desuso), cuya fórmula química es CO, es un gas incoloro y altamente tóxico. Puede causar la muerte cuando se respira en niveles elevados. • ¿Cuáles son los óxidos del carbono? • Los más simples y más comunes de los oxocarbonos son el monóxido de carbono (CO) y el dióxido de carbono (CO2). Se conocen muchos otros óxidos estables o metaestables del carbono, pero son raramente encontrados, tales como el dióxido de tricarbono (C3O2 o O=C=C=C=O) y el anhídrido melítico (C12O9) ¿Cómo se forma el óxido de carbono? El monóxido de carbono se produce de la combustión incompleta del carbón. Es producido tanto por actividades humanas como por fuentes naturales. ... La combustión de madera, los volcanes e incendios forestales liberan monóxido de carbono. ¿Qué características tiene el oxido de carbono? El dióxido de carbono es un gas inodoro, incoloro, ligeramente ácido y no inflamable. Es soluble en agua cuando la presión se mantiene constante, y está formado por una molécula lineal de un átomo de carbono ligado a dos átomos de oxígeno, de la forma O = C = O. • ¿Cuál es la función del dióxido de carbono en el cuerpo humano? • Cuando se digieren los alimentos, el cuerpo genera dióxido de carbono como producto de desecho en forma de gas. La sangre transporta este gas a los pulmones. Exhalamos dióxido de carbono e inhalamos oxígeno miles de veces al día. Normalmente, el dióxido de carbono en el torrente sanguíneo no causa ningún problema • ¿Qué produce el dióxido de carbono y qué consecuencias produce? • El principal efecto que produce el CO2 es la asfixia por desplazamiento del oxígeno, pero esto se produce por concentraciones muy altas capaces de desplazar el oxígeno y reducir su concentración por debajo del 20%. ... Además los niños debido a su metabolismo y actividad producen mucho más CO2 que los adultos. • ¿Cuál es la función del dióxido de carbono? • Se utiliza como agente extintor eliminando el oxígeno encontrado en ese espacio, e impidiendo que se genere una combustión. En la industria alimentaria, se utiliza en bebidas carbonatadas para darles efervescencia. También se puede utilizar como ácido inocuo o poco contaminante • ¿Dónde encontramos los óxidos de carbono? • El dióxido de carbono se encuentra principalmente en el aire, pero también en el agua formando parte del ciclo del carbono. • Fórmula: CO2 • Masa molar: 44.01 g/mol • Densidad: 1,976 kg/m³; 0,001976 g/cm³ • Clasificación: Óxido ácido • Punto de ebullición: 216 K (−57 °C) • Solubilidad en agua: 1,45 kg/m³ • Acidez: 6,35 y 10,33 pKa OXIDO DE AZUFRE • El dióxido de azufre, u óxido de azufre (IV), es un óxido cuya fórmula molecular es SO₂. Es un gas incoloro con un característico olor irritante. Se trata de una sustancia reductora que, con el tiempo, el contacto con el aire y la humedad, se convierte en trióxido de azufre • ¿Qué es el óxido de azufre? • Los óxidos de azufre son un grupo de gases compuestos por trióxido de azufre (SO3) y dióxido de azufre (SO2). El más común es el SO2, ya que el SO3 es solo un intermediario en la formación del ácido sulfúrico (H2SO4). ¿Cómo se forma el oxido de azufre? Al quemar los combustibles fósiles que contienen azufre (como el carbón y los derivados del petróleo) se producen los óxidos de azufre. ... El dióxido de azufre tiende a oxidarse a trióxido de azufre o ácido sulfúrico y a sus sales mediante procesos fotoquímicos o catalíticos en la atmósfera ¿Qué efectos tiene el dióxido de azufre en la salud? Quemaduras en la nariz, la garganta y los pulmones. Dificultad para respirar. Daño al sistema respiratorio. Agravamiento de enfermedades como el asma y el enfisema. • ¿Dónde provienen los óxidos de azufre? • Al quemar los combustibles fósiles que contienen azufre (como el carbón y los derivados del petróleo) se producen los óxidos de azufre. ... El dióxido de azufre tiende a oxidarse a trióxido de azufre o ácido sulfúrico y a sus sales mediante procesos fotoquímicos o catalíticos en la atmósfera. • Fórmula: SO₂ • Denominación de la IUPAC: Sulfur dioxide • Masa molar: 64.066 g/mol • Punto de ebullición: -10 °C • Punto de fusión: -72 °C • Densidad: 2,6288 kg/m³; 0,0026 g/cm³ • Soluble en: Agua OXIDO DE NITRÓGENO • El término se aplica a varios compuestos químicos binarios gaseosos formados por la combinación de oxígeno y nitrógeno. El proceso de formación más habitual de estos compuestos inorgánicos es la combustión a altas temperaturas, proceso en el cual habitualmente el aire es el comburente • ¿Qué son los óxidos de nitrógeno? • Los óxidos de nitrógeno son una mezcla de gases compuestos de nitrógeno y oxígeno. El monóxido de nitrógeno y el dióxido de nitrógeno constituyen dos de los óxidos de nitrógeno más importantes toxicológicamente; ninguno de los dos son inflamables y son incoloros a pardo en apariencia a temperatura ambiente. El monóxido de nitrógeno es un gas de olor dulce penetrante a temperatura ambiente, mientras que el dióxido de nitrógeno tiene un fuerte olor desagradable. El dióxido de nitrógeno es un líquido a temperatura ambiente, pero se transforma en un gas pardo-rojizo a temperaturas sobre 70 F. Los óxidos de nitrógeno son liberados al aire desde el escape de vehículos motorizados, de la combustión del carbón, petróleo, o gas natural, y durante procesos tales como la soldadura al arco, galvanoplastia, grabado de metales y detonación de dinamita. ¿Dónde se encuentra el NO2? El dióxido de nitrógeno (NO2) es un contaminante atmosférico cuyas fuentes fundamentales son el tráfico rodado así como las emisiones de determinadas industrias y de calefacciones de carbón (en desuso actualmente). • Cómo se produce: En la naturaleza se produce por los incendios forestales o las erupciones volcánicas. También se produce de forma natural por la descomposición de nitratos orgánicos. • Fórmula: NO • Denominación de la IUPAC: Nitric oxide • Masa molar: 30.01 g/mol • Punto de ebullición: -152 °C • Densidad: 1.34 kg/m³ • Clasificación: Radical • Soluble en: Agua GRACIAS POR SU ATENCIÓN.