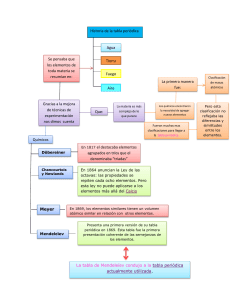
HISTORIA DE LA TABLA PERIÓDICA Primeras clasificaciones de los elementos. En la materia pueden existir , elementos compuestos, y mezclas. Johann Dobereiner un científico alemán que en 1829 encontró tres grupos de elementos que mostraban propiedades similares estos grupos fueron llamados las triadas de Dobereiner el sistema de las triadas no fue util como clasificación de los elementos. John Newlands, 56 elementos descubiertos ordenó los elementos por masa atómica ascendente encontró que en cada grupo de ocho elementos tienen características similares a la anterior por ejemplo, el flúor tenía propiedades similares al hidrógeno o el sodio tiene propiedades similares al litio, el hizo una comparación a las ocho notas musicales su clasificación fue llamada las octavas de neural obtuvo el orden hasta el calcio a partir de ahí los elementos no mostraban propiedades similares posterior nuevos elementos se fueron descubriendo que tampoco eran iguales a la clasificación de Newlands su sistema fracasó, años más tarde en 1869 Dimitri Mendeleyev un químico ruso presentó una nueva tabla periódica el creyó que la masa atómica de un elemento era la propiedad fundamental para su clasificación creó la tabla periódica que contiene 66 elementos y fue conocida como la tabla periódica de Mendeleyev dándole mejoramiento a la tabla periódica descubre la periodicidad de los elementos organizo los elementos en un oreden creciente de masas atomicas en 1913 Henri Mosley un físico inglés descubrió que el número atómico es la propiedad más importante y fundamental de un elemento y no su masa atómica, determina el nuemro de proyones de cada elemento, tambien en este año y con el descubrimeinto surge la ley de las propiedades fisicas y quimicas de los elementos son un afuncion periódica de su número atómico. En el siglo XVII Robert Boyle estableció el concepto de elemento señaló la existencia de sustancias elementales que al combinarlas formaban al resto al cual llamó elementos,en 1790, el Frances Antonio Lavoisier recopilo los 33 elementos químicos conocidos algunos de ellos como el oro, la plata, el carbón y el oxígeno, en 1830 Jacob Berzelius, fue el primero en llamar a los elementos químicos correspondía a su nombre en latin, la primera letra en mayúscula y una segunda en minúscula. A mediados del siglo XIX Stanislao Cannizzaro propone un método para calcular las masas atómicas de los elementos químicos y los ordena de menor a mayor de acuerdo a sus masas atómicas. Actualmente la tabla periódica está diseñada de acuerdo con el número atómico y la configuración electrónica de los elementos químicos, existen 118 elementos químicos, algunos han sido creados artificialmente por el hombre. Propiedades periódicas Energia de ionizacion Se conoce como potencial de ionización Energía que se debe suministrar a un átomo para desprender su electrón más débil. Forma cationes (partículas con carga positiva ) se mide en eV (electrón-volts). Afinidad electrónica energía intercambiada cuando un átomo capta un electrón. Forma aniones (partículas con carga negativa) se mide en kJ/Mol Electronegatividad Se presenta como x (letra ji griega) propiedad de los átomos para atraer electrones, Linus Pauling establece la escala para la electronegatividad asignó el Francio un valor de 0.7 y al Flour 4. Grupos o familias Grupo I A: Metales Alcalinos H, Li, Na, K, Rb, Cs, Fr Grupo II A:Metales Alcalinotérreos Be, Mg, Ca, Sr, Ba, Ra Grupo III A: Térreos B, Al, Ga, In, Tl Grupo IV A: Carbonoideos C, Si, Ge, Sn, Pb Grupo V A:Nitrogenoides N, P, As, Sb, Bi Grupo VI A:Calcógenos (antígenos) O, S, Se, Te, Po Grupo VII A:Halógenos F, Cl, Br, I, At Grupo VIII A:Gases nobles He, Ne, Ar, Kr, Xe, Rn