GUÍA EXPLICATIVA DE COMPOSICIÓN CENTESIMAL, FÓRMULA EMPÍRICA Y MOLECULAR
Anuncio

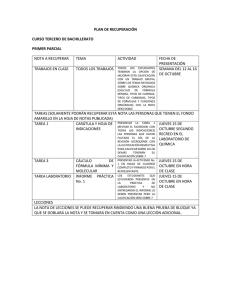
REPÚBLICA BOLIVARIANA DE VENEZUELA MINISTERIO DEL PODER POPULAR PARA LA EDUCACIÓN U.E.P. “COLEGIO SAN JOSÉ DE CATIA LA MAR” QUÍMICA 4to AÑO. MES: FEBRERO 2022 Profesor: Carlos Arrieta CONTENIDO: MASA MOLAR, COMPOSICIÓN CENTESIMAL, FÓRMULA EMPÍRICA Y MOLECULAR. OBJETIVO: Determinar la masa molar, composición centesimal, fórmula empírica y molecular de diferentes sustancias. MASA MOLAR: La masa molar es la masa de un mol de una sustancia, expresada en gramos. Un mol por su parte, es la cantidad de sustancias que contiene tantas entidades elementales (átomos, moléculas, iones, etc.). El valor numérico de la masa molar coincide con el de la masa molecular o peso molecular, pero expresado en g/mol. La masa molecular alude una sola molécula, la masa molar corresponde a un mol de moléculas. Una molécula es un agregado de dos o más átomos, con propiedades químicas determinadas. Si los átomos son iguales representan una molécula de un elemento químico; si son diferentes, la estructura química presente es un compuesto químico. La masa molar se determina sumando cada una de las masas atómicas relativas de los elementos que conforman la fórmula química. Las masas atómicas relativas de cada elemento se calculan multiplicando la masa atómica (peso atómico) por el número de átomos (subíndice) que tiene el elemento en la fórmula. La masa atómica o peso atómico de cada elemento se encuentra en la tabla periódica. Ejemplo: Calcular la masa molar de las siguientes sustancias: 1. K2SO4 Para obtener la masa molar, primero buscamos en la tabla periódica el valor del peso atómico de cada uno de los elementos presentes en la fórmula y se multiplica por el número de átomos y luego se suman los resultados obtenidos. Elemento Peso atómico Potasio (K) Azufre (S) Oxígeno (O) 39 32 16 Número de Átomos 2 1 4 REPÚBLICA BOLIVARIANA DE VENEZUELA MINISTERIO DEL PODER POPULAR PARA LA EDUCACIÓN U.E.P. “COLEGIO SAN JOSÉ DE CATIA LA MAR” K = 39 g * 2 = 78 g S = 32 g * 1 = 32 g O = 16 g * 4 = 64 g ______ 174 Masa molar de K2SO4 = 174 g/mol 2. Ca3(PO4)2 a) Se busca en la tabla periódica el valor del peso atómico de cada uno de los elementos presentes en la fórmula: Ca = 40 g P = 31 g O = 16 g b) En el compuesto dado, el PO4 se encuentra encerrado entre paréntesis y con el subíndice exterior 2, por lo tanto, se multiplican todos los átomos que están dentro del paréntesis por 2, el resultado obtenido es: P=1*2=2 O=4*2=8 c) Se multiplica el peso atómico de cada elemento por el número de átomos presentes en la fórmula y se suman los resultados obtenidos: Elemento Peso atómico Calcio (Ca) Fósforo (P) Oxígeno (O) 40 31 16 Ca = 40 g * 3 = 120 g P = 31 g * 2 = 62 g O = 16 g * 8 = 128 g ______ 310 Masa molar de Ca3(PO4)2 = 310 g/mol Número de Átomos 3 2 8 REPÚBLICA BOLIVARIANA DE VENEZUELA MINISTERIO DEL PODER POPULAR PARA LA EDUCACIÓN U.E.P. “COLEGIO SAN JOSÉ DE CATIA LA MAR” COMPOSICIÓN CENTESIMAL: La composición centesimal expresa los porcentajes de cada uno de los elementos constituyentes dentro de un compuesto químico. Para determinar la composición centesimal de un compuesto se tienen en cuenta los siguientes pasos: a) Se calcula la masa molar. b) Se procede a plantear una regla de tres para cada uno de los elementos constituyentes, partiendo de la masa molar y la masa atómica relativa de cada uno de los elementos, obteniéndose el porcentaje de cada elemento. (Siempre suponemos en 100 gramos del compuesto). Ejemplo 1: Calcular la composición centesimal del N2CO3: Lo primero que tenemos que hacer es calcular la masa molar del compuesto. Na = 23 g * 2 = 46 g C = 12 g * 1 = 12 g O = 16 g * 3 = 48 g ______ 106 Masa molar de Na2CO3 = 106 g/mol Para hallar la composición centesimal de cada elemento, se plantean las siguientes reglas de tres: % Na: 106 g de Na2CO3 100 g de Na2CO3 X = 46 g de Na X g de Na 100 𝑔 𝑑𝑒 𝑁𝑎2𝐶𝑂3 ∗ 46 𝑔 𝑑𝑒 𝑁𝑎 106 𝑔 Na2CO3 X = 43,39 % de Na REPÚBLICA BOLIVARIANA DE VENEZUELA MINISTERIO DEL PODER POPULAR PARA LA EDUCACIÓN U.E.P. “COLEGIO SAN JOSÉ DE CATIA LA MAR” % C: 106 g de Na2CO3 100 g de Na2CO3 X = 12 g de C X g de C 100 𝑔 𝑑𝑒 𝑁𝑎2𝐶𝑂3 ∗ 12 𝑔 𝑑𝑒 𝐶 106 𝑔 Na2CO3 X = 11,32 % de C % O: 106 g de Na2CO3 100 g de Na2CO3 X = 48 g de O X g de O 100 𝑔 𝑑𝑒 𝑁𝑎2𝐶𝑂3 ∗ 48 𝑔 𝑑𝑒 𝑂 106 𝑔 Na2CO3 X = 45,28 % de O La composición centesimal de Na2CO3 es: 43,39 % de Na; 11,32 % de C y 45,28 % de O. Ejemplo 2: Calcular la composición centesimal de la nicotina, cuya fórmula es C5H7N: Calcular la masa molar del compuesto. C = 12 g * 5 = 60 g H=1g*7=7g N = 14 g * 1 = 14 g ______ 81 Masa molar de C5H7N = 81 g/mol Para hallar la composición centesimal de cada elemento, se plantean las siguientes reglas de tres: REPÚBLICA BOLIVARIANA DE VENEZUELA MINISTERIO DEL PODER POPULAR PARA LA EDUCACIÓN U.E.P. “COLEGIO SAN JOSÉ DE CATIA LA MAR” % C: 81 g de C5H7N 100 g de C5H7N 60 g de C X g de C 100 𝑔 𝑑𝑒 𝐶5𝐻7𝑁 ∗ 60 𝑔 𝑑𝑒 𝐶 X = 81 𝑔 𝐶5𝐻7𝑁 X = 74,07 % de C % H: 81 g de C5H7N 100 g de C5H7N X = 7 g de H X g de H 100 𝑔 𝑑𝑒 𝐶5𝐻7𝑁 ∗ 7 𝑔 𝑑𝑒 𝐻 81 𝑔 𝐶5𝐻7𝑁 X = 8,64 % de H % N: 81 g de C5H7N 100 g de C5H7N X = 14 g de N X g de N 100 𝑔 𝑑𝑒 𝐶5𝐻7𝑁 ∗ 14 𝑔 𝑑𝑒 𝑁 81 𝑔 𝐶5𝐻7𝑁 X = 17,28 % de N La composición centesimal de C5H7N es: 74,07 % de C; 8,64 % de H y 17,28 % de N. REPÚBLICA BOLIVARIANA DE VENEZUELA MINISTERIO DEL PODER POPULAR PARA LA EDUCACIÓN U.E.P. “COLEGIO SAN JOSÉ DE CATIA LA MAR” FÓRMULA EMPÍRICA: La fórmula empírica es la fórmula que representa la relación más simple en que se encuentran los átomos de los elementos en un compuesto. Para determinar la fórmula empírica se dividen los porcentajes de cada uno de los elementos entre sus masas atómicas respectivas (pesos atómicos); cada uno de los resultados obtenidos se dividen entre el menor de ellos, obteniéndose números enteros sencillos, los cuales son los subíndices de cada elemento en la fórmula empírica. Los resultados de la última división se redondean, aproximan a un número entero, ya que es imposible que una molécula contenga una fracción de átomo de un elemento. Ejemplo 1: Calcular la fórmula empírica de un compuesto cuya composición centesimal es: C = 79,12%; H = 5,4% y N = 15,38%. a) Se busca en la tabla periódica el valor del peso atómico de cada uno de los elementos: C = 12 g H=1g N = 14 g b) Se dividen los porcentajes entre los pesos atómicos respectivos: C = H = N = 79,12 12 5,4 1 = 6,59 = 5,4 15,38 14 = 1,09 c) Los resultados obtenidos en b) se dividen entre el menor de ellos (1,09): C = H = 6,59 1,09 5,4 1,09 = 6,04 ≈ 6 = 4,95 ≈ 5 REPÚBLICA BOLIVARIANA DE VENEZUELA MINISTERIO DEL PODER POPULAR PARA LA EDUCACIÓN U.E.P. “COLEGIO SAN JOSÉ DE CATIA LA MAR” N = 1,09 =1 1,09 La fórmula empírica es: C6H5N Ejemplo 2: Determinar la fórmula empírica de un compuesto que presenta la siguiente composición centesimal es: Fe = 53,8 % y S = 46,12 %. a) Se busca en la tabla periódica el valor del peso atómico de cada uno de los elementos: Fe = 55,85 g S = 32 g b) Se dividen los porcentajes entre los pesos atómicos respectivos: 53,85 Fe = S = 55,85 46,12 32 = 0.96 = 1,44 c) Los resultados obtenidos en b) se dividen entre el menor de ellos (1,09): Fe = S = 0,96 0,96 1,44 0,96 =1 = 1,5 d) Cuando uno de los coeficientes no es aproximadamente un número entero, se multiplican por un menor número (2,3,…) que los transformen en números enteros; en este caso nos dio 1,5 para el azufre multiplicamos todos por “2” para tener números enteros. Fe = 1 * 2 = 2 S = 1,5 * 2 = 3 La fórmula empírica es: Fe2S3 REPÚBLICA BOLIVARIANA DE VENEZUELA MINISTERIO DEL PODER POPULAR PARA LA EDUCACIÓN U.E.P. “COLEGIO SAN JOSÉ DE CATIA LA MAR” FÓRMULA MOLECULAR: La fórmula molecular es la fórmula real que nos indica el número y el tipo de átomos en una molécula. Para determinar la fórmula molecular se tienen en cuenta los siguientes pasos: a) Se determina la fórmula empírica. b) Se determina la masa molar de la fórmula empírica. c) Se determina un número entero “n”, dividiendo la masa molar de la sustancia dada entre la masa molar de la fórmula empírica. n = masa molar de la sustancia dada masa molar de la fórmula empírica d) Multiplicamos el número entero “n”, por cada uno de los subíndices de la fórmula empírica, obteniéndose la fórmula molecular. Fórmula molecular = n (fórmula empírica) Ejemplo: Un compuesto tiene la siguiente composición centesimal: C = 52,2%; H = 13% y O = 34,8%. Si su masa molar es 92 g/mol, ¿Cuál es su fórmula molecular? (Peso atómico: C = 12 g, H = 1 g y O = 16 g) a) Calculamos la fórmula empírica: C = H = O = 52,2 12 13 1 4,35 = 2,17 = 2 13 = 2,17 = 5,99 ≈ 6 34,8 16 La fórmula empírica es: C2H6O 2,17 = 2,17 = 1 b) Calculamos la masa molar de la fórmula empírica C2H6O: C = 12 g * 2 = 24 g H=1g*6=6g O = 16 g * 1 = 16 g ______ 46 Masa molar de C2H6O = 46 g/mol REPÚBLICA BOLIVARIANA DE VENEZUELA MINISTERIO DEL PODER POPULAR PARA LA EDUCACIÓN U.E.P. “COLEGIO SAN JOSÉ DE CATIA LA MAR” c) Determinamos el número “n”: n= 92 𝑔/𝑚𝑜𝑙 46 𝑔/𝑚𝑜𝑙 =2 d) Determinamos la fórmula molecular: Fórmula molecular = n (fórmula empírica) Fórmula molecular = 2 (C2H6O) La fórmula molecular es: C4H12O2 C4H12O2