docsity-taller-de-balanceo-de-ecuaciones
Anuncio

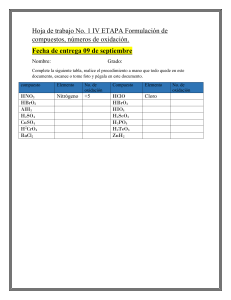
TALLER DE BALANCEO DE ECUACIONES Química Instituto Tecnológico del Putumayo (ITP) 13 pag. Document shared on www.docsity.com Downloaded by: mariana-poveda-pinzon ([email protected]) REACCIONES QUIMICAS ACTIVIDAD N°1 Clasifica las siguientes reacciones y nombra sus productos y reactivos: a) H2SO4(ac) + 2KOH(ac) k2SO4(ac) + H2O Reactivos Productos Doble desplazamiento b) 2Rb + Br2 + calor 2RbBr Productos Reactivos Reacción de combinación c) 2KI + F2 2KF + I2 Productos Reactivos Reacción de desplazamiento d) CaO + SiO2 CaSiO3 Reactivos Productos Reacción de combinación e) S + O2 Reactivos SO2 Productos Reacción de combinación Document shared on www.docsity.com Downloaded by: mariana-poveda-pinzon ([email protected]) f) BaCO3 + calor BaO + CO2 Reactivos Productos Reacción de descomposición g) HgS + O2 Hg + CO2 Reactivos Productos Doble desplazamiento h) HgS + O2 Hg + SO2 Reactivos Productos Doble desplazamiento i) 2HI + H2O2 I2 + 2H2O Productos Reactivos Reacción de desplazamiento j) RbOH + HNO3 Reactivos RbNO3+ H2O Productos Reacción doble desplazamiento Document shared on www.docsity.com Downloaded by: mariana-poveda-pinzon ([email protected]) k) N2O5 + H2O 2HNO3 Productos Reactivos Reacción de combinación l) MgO + H2O + calor Reactivos Mg(OH)2 Productos Reacción de combinación m) PbSO4 + PbS + calor Reactivos 2Pb + 2SO2 Productos Reacción descomposición ACTIVIDAD N°2 Aplicando lo aprendido balance las siguientes ecuaciones por el método de tanteo o inspección: 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 2Al + 3Cl2 2AlCl3 P2O3 + 3H2O 2H3PO3 CaBr2 + 2H2O Ca(OH)2 + 2HBr 2Al + 3S2 2AlS3 Mg2C3 + 4H2O 2Mg(OH)2 + C3H4 CF4 C+ 2F2 N2O5 + H2O 2HNO3 C2H4 + 3O2 2CO2 + 2H2O 2La(OH)3 La2O3 + 3H2O 2HCl + CaO CaCl2 + H2O Pb(NO3)2 + 2NaCl PbCl2 + 2NaNO3 BaCl2 + 2H2O Ba(OH)2 + 2HCl CaCl2 + Na2CO3 CaCO3 + 2NaCl Document shared on www.docsity.com Downloaded by: mariana-poveda-pinzon ([email protected]) 14. Ni(NO3)2 + 2KOH 15. Li3N + 3H2O Ni(OH)2 + 2KNO3 3LiOH + NH3 ACTIVIDAD N°3 Aplicando lo aprendido balance las siguientes ecuaciones por el método de óxido reducción: 1. 3Sn + 4HNO3 + H2O 3H2SnO3 + 4NO 3(Sn0 -4e- Sn+4) Oxidación 4(N+5 +3e- N+2) Reducción 2. 3H2S + 8HNO3 S-2 N+5 3H2SO4 + 8NO + 4H2O S+6 (8) Oxidación N+2 (3) Reducción 3. 1SN + 4HNO3 Sn0 N+5 1SnO2 + 4NO2 + 2H2O Sn+4 (4) Oxidación N+4 (1) Reducción 4. KCl5O3 + 3Na2Sn2O2 Cl4 + 6e3Sn2- 6e- KCl-1 + 3Na2Sn4O3 Cl-1 reducción 3Sn4 oxidación 5. 2Nal5O3 + 5S4O2 + 4H2O 5S4-10e2I5+10e- 5S6 Oxidación 2I0 Reducción 6. 3As + 5HNO3 + 2H2O As0 2NaHS6O4 + 3H2S6O4 + I02 3H3AsO4 + 5NO2 As+5 (5) Oxidación Document shared on www.docsity.com Downloaded by: mariana-poveda-pinzon ([email protected]) N+5 N+2 (3) Reducción 7. I2 + HNO3 I2 + H+ NO3 I2 NO3- HlO3 + NO + H2O H+IO3 + NO + H2O IO3NO I2 2IO3- NO3- NO Oxidación Reducción I2 + 6H2O 3e- + 4H+ NO3- 2IO3- + 12H+ + 10 e- (oxidación) NO + 2H2O (reducción) 3I2 + 18H2O 6IO3- + 36H+ + 30e+ 30e + 40H + 10NO310NO + 20H2O 3I2 + 18H2O 6IO3- + 36H+ + 30e30e- + 40H++ 10NO310NO + 20H2O 3I2 + 10NO3- + 4H+ G3I2 + 10HNO3 6IO3- + 10NO + 2H2O 6HIO3 + 10NO + 2H2O 8. 3AS2S25 + 40HN5O3 + 4H2O 15S-2 -120e40N5+120e- 15S6 40N2 15H2S6O4 + 6H3AsO4 + 40N2O Oxidación Reducción 9. 3P2S-25 + 20KCl5O3 + 24H2O 15S-2 -120e20Cl5 +120e- 15S6 20Cl-1 6H3PO4 + 15H2S6O4 + 20KCl-1 Oxidación Reducción 10. 20P-3H3 + 12KMn7O4 + 24H2SO4 12KHSO4 + 12Mn2SO4 + 5P04 + 48H2O Document shared on www.docsity.com Downloaded by: mariana-poveda-pinzon ([email protected]) 20P-3 -60e12Mn7 +60e- 20P° 12Mn2 Oxidación Reducción ACTIVIDAD N°4 Determinar los estados de oxidación en todas las ecuaciones y balancearlas indicando el método aplicado. BLOQUE 1 Ba0 + H+12SO4 2H+1 + 2eBa0 -2e- Ba2SO4 + H02 2H0 (Reducción) Ba2 (Oxidación) 3H+12S+6O-24 + Ca03(PO4)02 Tanteo 4Al0 + 3O02 4Al0 - 12e6 O0 + 12e- 2Al(NO3)3 + 3H2SO4 3Ca+2S+6O-24 + 2H+13P+5O-24 2Al32O-23 4 Al3 (Oxidación) 6 O-2 (Reducción) 6HNO3 + Al2(SO4)3 Tanteo C-83H8 + 5O02 3C4O-22 + 4H+12O-2 3 C-83 - 20 e10 O0 + 20 e- 3 C4 (Oxidación) 10 O-2 (Reducción) 6C4O-22 + 6H+12O-2 6 C4 + 24 e12 O-2 – 24 e- C06H+112O-26 + 2O06 6 C0 (Reducción) 12 O0 (Oxidación) Document shared on www.docsity.com Downloaded by: mariana-poveda-pinzon ([email protected]) -1Cu0 + 0HN5O3 Cu2+ 2 e2N5 – 2e- -1Cu2(N5O3)2 + 0H2O + 2N6O3 Cu0 (Reducción) 2N6 (Oxidación) 2Fe0 + 6H1Br 2Fe3Br3 + 3H02 6H+1 + 6 e2Fe0 – 6 e- 6 H0 (Reducción) 2 Fe3 (Oxidación) 2Fe0 + 6H+1Cl 2Fe3Cl3 + 3H02 6 H+1 + 6 e2 Fe0 – 6 e- 6 H0 (Reducción) 2 Fe3 (Oxidación) FeCl3 + 3NH+14O-2H Fe(OH)3 + 3NH+14Cl Tanteo 2H02 + O02 4H0 – 4 e2O0 + 4 e- 2H+12O-2 4H+1 (Oxidación) 2O-2 (Reducción) H+12S+6O-24 H+12O-2 + S+6O-23 La ecuación ya esta balanceada 2H+1N+5O-23 N+52O-25 + H+12O-2 Tanteo 2K+1Cl5O-23 2Cl5 + 12e6O-2 – 12e- 2K+1Cl-1 + O02 2Cl-1 (Reducción) 6O0 (Oxidacción) 2K+1Mn+7O-24 + 16H+1Cl-1 2 Mn+7 + 10e10 Cl-1 - 10e- Mg0 + 2H+1Cl-1 2H+1 + 2eMg0 – 2e- 2K+1Cl-1 + 2Mn2Cl-12 + 8H+12O-2 + 5Cl02 2Mn2 (Reducción) 10Cl0 (Oxidación) Mg2Cl2 + H02 2H0 (Reducción) Mg2 (Oxidacción) Document shared on www.docsity.com Downloaded by: mariana-poveda-pinzon ([email protected]) 6Na0 + 2H+13PO-24 2Na+13PO-24 + 3H02 6Na0 – 6e6H1 + 6e- 6Na+1 6H+0 (Oxidación) (Reducción) Na+12S+6O-24 + Ba+2Cl-12 Ba+2S+6O-24 + 2NaCl0 Tanteo 5O02 + Sb+32S-23 3S-2 – 18e 10O0 + 20e 2Sb+3 – 2e Sb42O-24 + 3S4O-22 3S4 (Oxidación) 10O-2 (Reducción) 2Sb4 (Oxidación) BLOQUE 2: 2H02 + O02 2H+12O-2 Tanteo N02 + 3H02 2N3H13 Tanteo 2H+12O + 2Na0 → 2Na+1OH+1 + H02 Tanteo 2K+1Cl5O-23 2K+1Cl-1 + O02 Tanteo BaO2 + 2HCl0 → Ba+2Cl+12 + H+12O-22 Tanteo H2SO4 + 2NaCl → Na2SO4 + 2HCl Tanteo 3FeS2 → Fe3S4 + S2 Tanteo Document shared on www.docsity.com Downloaded by: mariana-poveda-pinzon ([email protected]) 10H+12S+6O-24 + 10C0 → H2O0 + 10S+4O-22 + 10C+4O-22 Tanteo 2S+4O-22 + O02 → 2S+6O-23 Tanteo 4H+1Cl-1 + Mn4O-22 → Mn+22Cl-12 + 2H2O + Cl02 Tanteo K+12C+4O-23 + 2C0 → 3C+2O-2 + 2K0 Tanteo Ag2SO4 + 2NaCl → Na2SO4 + 2AgCl Tanteo Na-1N+5O-23 + KCl0 → NaCl0 + K+1N+5O-23 La ecuación ya esta balanceada Fe+32O-23 + 3C+2O-2 → 3C+4O-22 + 2Fe0 Tanteo Na-12C+4O-23 + H+12O-2 + C+2O-22 → 2NaH+1CO-23 Tanteo Cr+32O-23 + 2Al0 → Al+32O-23 + 2Cr0 Tanteo 3Ag0 + 4H+1N+5O-23 → N+2O-2 + 2H+12O-2 + 3Ag+1N+5O-23 Tanteo Document shared on www.docsity.com Downloaded by: mariana-poveda-pinzon ([email protected]) Cu+2Fe-2S-22 + 3 O02 → 2 S+4O-22 + Cu+2O-2 + Fe+2O-2 Tanteo 2 C2-3H+16 + 7 O02 → 4 C+4O-22 + 6 H+12O-2 Tanteo 4 Fe+2S-12 + 11 O02 → 2 Fe+32O-23 + 8 S+4O-22 Tanteo Zn0 + 2 H+1Cl-1 → Zn+2Cl2 + H20 Tanteo 2 Al0 (s) + 6 H+1Cl-1 → 2 Al+3Cl3 + 3 H20 Tanteo CaC2 + 2 H+12O-2 → C2H2 + Ca(OH)2 Tanteo 3 H+1Cl-1 + Al(OH)3 → Al+3Cl-13 + 3 H+12O-2 Tanteo 4 Fe0+ 3 O02 → 2 Fe+32O-23 Tanteo H+1Br-1 + NaOH → Na+1Br-1 + H+12O-2 Tanteo C06H+112O-26 + 6 O02 → 6 C+4O-22 + 6 H+12O-2 Document shared on www.docsity.com Downloaded by: mariana-poveda-pinzon ([email protected]) Tanteo ACTIVIDAD N°5 investigar, dibujar y expresar mediante ecuaciones químicas diferentes procesos en los cuales se lleven a cabo reacciones de óxido – reducción (los seres vivos, en el medio ambiente, construcción y en la industria en general) Combustible de automóvil La gasolina que le da energía a los automóviles utiliza un proceso de oxidación reducción para convertir la gasolina en energía. El proceso reduce el óxido de nitrógeno a nitrógeno y oxígeno, oxida el monóxido de carbono en dióxido de carbono y oxida los hidrocarburos en dióxido de carbono y agua. El sistema de oxidación reducción ocurre simultáneamente dentro del convertidor catalítico de tu motor, proporcionando una conversión eficiente de combustible a energía. Las versiones más nuevas del convertidor incrementan la eficiencia de este proceso, pero pueden continuar dependiendo del mismo principio en el proceso. Document shared on www.docsity.com Downloaded by: mariana-poveda-pinzon ([email protected]) Fotosíntesis Las plantas usan el proceso de fotosíntesis para convertir el dióxido de carbono y la luz del sol en nutrientes. Este proceso es una oxidación reducción que separa los hidrocarburos que se encuentran en la luz solar, al igual que el dióxido de carbono del aire. El proceso produce carbohidratos a partir de la planta, liberando el exceso de oxígeno de forma natural en el ambiente. Esta forma de oxidación reducción es esencial para el ciclo de vida natural, reabasteciendo el suministro de oxígeno en el aire. Document shared on www.docsity.com Downloaded by: mariana-poveda-pinzon ([email protected]) Respiración La respiración natural es lo opuesto al proceso de fotosíntesis, proporcionando el oxígeno esencial a los animales que respiran. Este proceso utiliza el oxígeno del aire y los carbohidratos de tu propio cuerpo en un proceso de oxidación reducción que suministra a tu cuerpo con oxígeno y libera el dióxido de carbono esencial del que dependen las plantas para su supervivencia. Las reacciones de oxidación–reducción, son muy importantes para nuestra vida cotidiana. La energía que necesitamos para realizar cualquier actividad, la obtenemos de procesos de oxidación–reducción, como el metabolismo de los alimentos, la respiración celular… Además, son responsables de procesos como la corrosión de los metales, el oscurecimiento de una manzana cortada, la acción de los conservantes alimenticios, la combustión, el blanqueado de las lejías. Document shared on www.docsity.com Downloaded by: mariana-poveda-pinzon ([email protected])