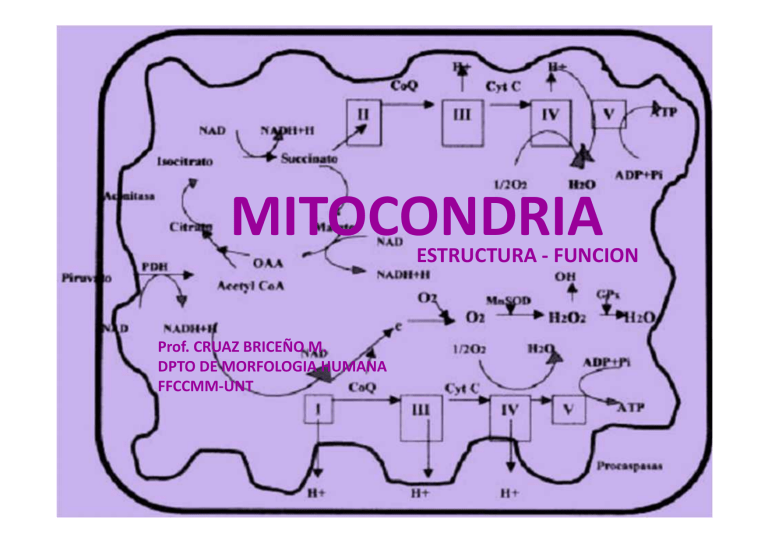
MITOCONDRIA ESTRUCTURA - FUNCION Prof. CRUAZ BRICEÑO M. DPTO DE MORFOLOGIA HUMANA FFCCMM-UNT MITOCONDRIA • Benda 1897 Mitos= hilo o filamento Chondrios=gránulo • Son llamadas “la central de energía de la célula” • Orgánulo citoplasmático de las células eucariotas, de forma ovoidal, formado por una doble membrana que tiene como principal función la producción de energía mediante el consumo de oxígeno, y la producción de dióxido de carbono y agua como productos de la respiración celular. CARACTERÍSTICAS a. TAMAÑO: 0.5-0.1µm x 1µm a 7µ (10µm miocardio) b. FORMAS: Filamentosa, Granulares Bastones, raquetas Plasticidad mitocondrial c. NÚMERO: 200025% vol celular Abundantes: hígado, miocardio, túbulos contorneados distales del riñón Tamaño , número y forma varían de acuerdo a las necesidades del tejido d. DINAMISMO: móviles, se agrupan se separan Fijas e. LOCALIZACION: donde la fuente de energía es mas intensa Entre miofibrillas Neuronas = lugares trasmisión impulso nervioso Agrupadas alrededor del flagelo ESTRUCTURA Grosor de 60-70 A 80% proteínas 2 capa proteína 60% 1 lípido 40% FC, FI, FE cardiolipina 7nm Porina 20% lípidos No colesterol cardiolipina 8 nm Enzimas: 40-70 A ARNt Ribosomas ADN A. MME • • • • Grosor de 60-70 A BICAPA LIPIDICA: 40% lipidos: FC, FI, FE, cardiolipina 60 % proteínas: permeable: iones, agua, sacarosa, proteínas pequeñas . Porina: Transporte de moléculas <5000Da Transportadores de electrones: cit 5 /reductasa de b5, NAD Monoamino oxidasa. Interviene en degradación oxidativa de lípidos Enzima que fosforila nucleótidos Proteína Bcl2 que regula la apoptosis B. ESPACIO INTERMEMBRANOSO Contiene enzimas que utilizan el ATP para la fosforilación de otro nucleótidos: adenilatoquinasa Contenido semejante al citosol C. MMI • 80% proteínas: es muy selectiva • 20% lípidos: Fosfatidilglicerol, No colesterol • cardiolipina- impermeable • Presenta evaginaciones o pliegues A: Mitocondria con pocas crestas transversales y matriz clara en el hígado de rata. X60 000. B: Mitocondria con muchas crestas y matriz densa en el músculo esquelético. X50 000. C: Mitocondrias con pocas crestas finas y arqueadas (flechas) en un adipocito en formación. X10 000. D: Mitocondrias con crestas tubulares (flecha) en la corteza suprarrenal. X30 A C B D El número de crestas es muy variable y, normalmente, está relacionado directamente con las necesidades de producción de energía de la célula MMI Contiene proteínas para. • Complejos de inserción de proteínas en el citosol o en la matriz • Enzimas de oxidación de los ácidos grasos • Cadena de transporte de electrones • Complejos enzimáticos H+ATP sintasa • Proteínas de transporte o transferasas • Proteínas para captación y liberación de Ca++ D. MATRIZ • Material proteínico relativamente denso, El complejo enzimático piruvato deshidrogenasa Las enzimas de la β-oxidación de los ácidos grasos Las enzimas del ciclo de Krebs, excepto la succinato DHasa Las coenzimas A (CoA) y NAD+ La enzima superóxido dismutasa (SOD) transforma radicales libres de oxígeno producidos en la reducción de éste. • Gránulos densos (osmiófilos) de unos 50nm: cationes divalentes (ca++) • Acido nucleicos: Varias copias de una molécula de ADN circular , sin proteínas Trece tipos de RNAm; dos tipos de RNAr, 22 tipos de RNAt • Ribosomas (55 a 60S) sintetizan algunas proteínas subunidades: 25 S: ARNr 12S 35S : ARNr 16S + ARN 4S • Inclusiones lipídicas: en relación con la síntesis de H. esteroideas FUNCIONES • OXIDACION DE METABOLITOS Y PRODUCCIÓN DE ENERGIA CADENA RESPIRATORIA SINTESIS DE ATP • ROLES ESENCIALES EN EL METABOLISMO – – – – – – Regulación buffer Ciclo de urea Biosíntesis de hemo Síntesis de fosfolípidos Regulación del calcio Síntesis de hormonas esteroideas, ETC FUNCIONES 1. OXIDACION DE METABOLITOS PRODUCCION DE ENERGIA a. Obtención de energía: Piruvato Acidos grasos Resumen del metabolismo productor de energía de las mitocondrias Y A. CADENA DE TRANSPORTE DE ELECTRONES GENERALIDADES Los protones son esenciales el transporte de electrones Los electrones se desplazan de un par redox de bajo potencial un par redox de alto potencial NADH/NAD O2/H2 El transporte de electrones fluyen de acuerdo a su potencial redox y libera energía Par redox de potencial mas (-) tendencia fuerte a ceder electrones Par redox de potencial mas (+) tendencia fuerte a aceptar electrones BOMBEO DE PROTONES Paso del electrón a través de la cadena de transporte de electrones En cada paso captar y liberar un protón. Ejm Ttransportador de electrones B capta un protón (H') de un lado de la membrana cuando acepta un electrón (e-) del transportador A, Libera el protón al otro lado de la membrana cuando cede su electrón al transportador C. CADENA DE TRANSPORTE DE ELECTRONES La liberación de energía libre acompañada al flujo de electrones impulsa el bombeo de protones FADH Complejo I 40 cadenas Acepta e- de NADH Presenta centros ferrosulfurados 11 cadenas diferentes actúan como dimeros Acepta e- de ubiquinona dona a cit-c Centro activo cit b, cit c1 y proteina ferrosullforada 13 cadenas Acepta e- de 1 en 1 del cit-c y dona de 4 en 4 a O2 Centros ferrosulfurados Estructura del grupo hemo unido covalentemente a citocromo C Mecanismo de acción de citocromo-oxidasa BASES DEL TRANSPORTE DE ELECTRONES Y BOMBEO DE PROTONES La transferencia de electrones esta mediado por transportadores moviles Ubiquinona Citocromo C La variación del potencial redox a o largo de la cadena cae a través de cada complejo enzimático principal Mecanismo general del bombeo de protones - cambio conformacional es diferentes en cada complejo. B. FOSFORILACIÓN OXIDATIVA El gradiente electroquímico resultante se utiliza para la síntesis de ATP ATP sintasa Está formado por dos componentes: F1: una proteína periférica de membrana: α3 , β3, γ, δ , y ε F0: una proteína integral (poro de H+) (a, b2. c10-14) Rotor: formado por 10-14 subunidades c Estativo: formado por subunidades transmembrana- y subunidades que forman el brazo alargado Brazo: fija el estativo al anillo de subunidades 3α 3β que forman la cabeza Mecanismo de acción de la ATP sintasa Paso de protones por rotor –estativo Desplazamiento rápido de la cabeza F1 Unión de ADP y Pi Formación de ATP Energía mecánica es transformada en enlace químico Bombear protones en contra gradiente electroquímico mediante la hidrólisis del ATP REGULACION DE LA FOSFORILACIO OXIDATIVA 2, 4 DINITROFENOL TERMOGENINA (UCP) Desacoplantes naturales Desacopla el transporte de electrones y síntesis de ATP, Sin bloquear el consumo de oxigeno DISMINUCIÓN DE ATP/ADP La ATP sintasa trabaja a mayor velocidad INHIBIDORES CIANURO. Bloquea el paso de electrones de citocromo a3 al oxigeno OLIGOMICINA: se une a Fo e inbibe la ATPsintasa Consecuencias del desplazamiento de H Transporte de metabolitos impulsado por: Gradiente voltaje o electroquímico Gradiente de pH REOXIDACIÓN DE NADH CITOSÓLICO El NADH no puede atravesar la MMI necesita una ruta indirecta: MECANISMO de LANZADERAS : Malato Aspartato (hígado y corazon) Lanzadera: glicerol-3- fosfato Por cada NADH que se oxida un FAD se reduce FADH cede sus electrones a CoQ 3. Otras funciones a. Síntesis de proteínas mitocondriales (10%) b. Producción de energía calorífica c. Almacenamiento de sustancias d. MITOCONDRIA Y METABOLISMO CELULAR e.Ciclo de la urea: f. Biosíntesis del grupo hemo g. Síntesis de hormona esteroideas: C. Leydi C. Granulosa h. Síntesis de lípidos Fosfatidiletanolamina Fosfatidilglicerol Acido fosfatídico Cardiolipina i. Apoptosis El genoma mitocondrial Mitocondria C. universal 16569 pb 2 RNAr 22 RNAt 13 proteínas, UGA= trip Paro CUA= Leu Leu AUA= Met Ile AGG= paro Arg Mutaciones= gen proteína transporte eNeuropatia óptica de Leber. Origen de las proteínas y de los ARN mitocondriales IMPORTACIÓN DE PROTEÍNAS MITOCONDRIALES Secuencia señal para la importación de Aas + Citocromo oxidasa Los aa + se agrupan en una cara de la hélice Los aa no polares se agrupan en la cara opuesta Aas. No polares Hélice anfipatica Aa polar no cargado Reconocida por receptor Translocadores proteícos en las membranas mitocondriales TOM : translocatorofthe oucer membrane TOM: translocatorofthe inner membrane Función: Receptores Canales TOM: transporte de proteína hasta espacio IM/Transmembrana externa SAM: ayuda al plegamiento TIM 23: transporta proteina solubles hasta la matriz/ proteínas transmembrana TIM 22: media la inserción de tranportadores OXA: media la inserción de proteinas de mmi sintetizadas en la mitocondria Importación de proteínas de la matriz 2 3 1 4 5 La importación de proteínas de matriz Energía para la importación de proteínas hacia la matriz es suministrada por: Hidrólisis del ATP: en dos etapas y un gradiente electroquimico 1° Unión y liberación de HSP70 ATP 2° translocación a través del canal TIM potencial de membrana 3° Paso y liberación de la proteína hacia la matriz hidrolisis ATP HSP70 de matriz / HSP 60 La importación de proteínas de mme Porinas 1° son transportadas hacia el espacio intermembranoso vía TOM 2° unión transitoria a chaperona 3° unión al complejo SAM inserta la porina a la membrana externa y ayuda a plegarse en forma apropiada Importación de proteínas hacia la mmi y espacio intermembrana Importación Via Mia40 • (Mia = mitochondrial intermembrane space assembly Proteínas intercambiadoras de lípidos Los Fosfolípidos fosfatidi-serina, fosfatidil-colina y fosfatidil-insositol son sintetizados en el REL y transferidos a la membrana mitocondrial externa, mediante una proteína de intercambio de transferencia de fosfolípidos que transfiere moléculas individuales de fosfolípidos entre membranas. Desde la membrana externa los FL se desplazan hacia la membrana interna. fosfatidi-serina fosfatidil-colina fosfatidil-insositol CRECIMIENTO Y DIVISIÓN DE LAS MITOCONDRIAS = división Proceso regulado por GTPasa Regulación de morfología = importante para función y diferenciación celular Ruta evolutiva sobre el origen de las mitocondrias Púrpura fotosintética FUENTES CONSULTADAS ALBERTS