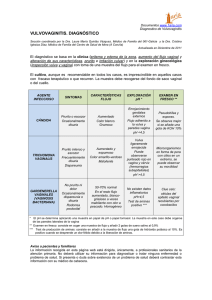
Inervación celular Las fibras nerviosas están en contacto con las células cutáneas. Esta disposición, propia de las células de la pared vascular, de las glándulas sudorales, del pelo y de los músculos piloerectores, es conocida desde hace tiempo. Existen también auténticas conexiones entre las células nerviosas y las células cutáneas o inmunitarias [7] , a través de sus terminaciones de tipo A o C. Las uniones entre las membranas celulares son probablemente zonas de intercambio de diversas sustancias. Dichas estructuras se observan a nivel de las células inmunitarias presentes en la piel (mastocitos, dendrocitos dérmicos, células de Langerhans, linfocitos, polimorfonucleares) y también de numerosos melanocitos e incluso queratinocitos, aunque estas últimas conexiones son menos frecuentes y siempre variables por la plasticidad epidérmica. En realidad se puede hablar de sinapsis. Así, existe un espacio intercelular inferior a 300 nm, un engrosamiento de la membrana plasmática a ambos lados de la sinapsis, gránulos neurosecretores en la terminación nerviosa y una actividad celular importante (mitocondrias, retículo endoplásmico) por parte de las células cutáneas. Los neurotransmisores son liberados en la piel. Estas sinapsis son bastante similares a las llamadas «de paso» (es decir, a lo largo del axón y no sólo en su extremo), que se encuentran en el sistema nervioso central. La inervación celular más elaborada es la de las células de Merkel [3] , células mixtas que representan el 1% de las células epidérmicas. Asociadas a las fibras nerviosas Aβ, forman mecanorreceptores. Son células neuroendocrinas que producen neuromediadores y hormonas y que expresan marcadores como la enolasa neuronal específica (NSE), la proteína S100, la PGP9.5, la cromogranina A o la sinaptofisina. También forman parte de las células epiteliales, ya que expresan las citoqueratinas 8, 18, 19 y 20 o el antígeno de membrana epitelial (EMA) y es posible que tengan el mismo origen celular que los queratinocitos. Predominan en los labios, las palmas y las puntas de los dedos. Función sensitiva La sensibilidad cutánea, que es una función aferente [2 8] está asociada a las fibras C, Aβ y Aδ. Es probable que las propias células epidérmicas tengan un papel importante todavía mal comprendido [9] . Las células neuronales activadas sufren modificaciones en los campos eléctricos de su membrana y producen neuromediadores. La información se transmite primero a los ganglios espinales, después a la médula espinal, a continuación al tálamo y por último al córtex. Se distinguen dos tipos de vías: las lemniscales (sensibilidad epicrítica) y las extralemniscales (sensibilidades protopática y dolorosa). A todos los niveles existe un control «de puerta» mediante interneuronas, así como un autocontrol. En el cerebro, el tratamiento de la información es complejo y en él se producen interacciones entre el tálamo y diferentes zonas corticales, principalmente sensoriales y afectivas. La clasificación de los receptores cutáneos según su función no es equivalente a la clasificación anatómica. Así, una misma terminación puede transmitir varios tipos de información. La clasificación de los receptores sensitivos cutáneos en cuatro tipos funcionales es más adecuada: mecánicos, térmicos, nociceptivos y pruriceptivos. Existen dos tipos de receptores mecánicos: los de acomodación lenta (que responden durante toda la duración de un estímulo) y los de acomodación rápida (que responden al comienzo y al final del estímulo). En la piel lampiña, los receptores de tipo I tienen campos de recepción de pequeño tamaño, bien delimitados, y una velocidad de conducción de 55-60 m/s. Se trata de las células de Merkel y de los corpúsculos de Meissner. Los receptores de tipo II tienen campos de recepción más extensos y peor delimitados, con una velocidad de conducción de 45-50 m/s; corresponden a los corpúsculos de Ruffini y de Pacini. En la piel con vello, los mecanorreceptores están representados por terminaciones libres peripilosas, complejos de Merkel, terminaciones lanceoladas y corpúsculos de Ruffini. El número de mecanorreceptores varía mucho de un territorio a otro. Los receptores térmicos tienen una velocidad de conducción muy lenta (0,5 m/s). Existen dos tipos de receptores bien diferentes: al frío (25-30 °C) y al calor (30-34 °C). Las temperaturas inferiores a los 20 °C o superiores a los 45 °C son percibidas como dolorosas. Los termorreceptores de frío también pueden ser activados por sustancias químicas como el mentol. Los receptores nociceptivos están constituidos por terminaciones libres no mielinizadas, dérmicas, epidérmicas o anexiales. Hay tres tipos descritos: • • las fibras Aδ, sensibles a estímulos mecánicos fuertes (pinchazo, pellizco, corte); • • las fibras C clásicas, sensibles a estímulos mecánicos, térmicos, químicos, así como a numerosos mediadores (neuromediadores, citocinas, eicosanoides, etc.); • • las fibras C «silenciosas», que sólo se activan después de una sensibilización química o bioquímica. Hay que citar un cuarto tipo funcional de receptor cutáneo: los prurirreceptores o receptores específicos del prurito. Se trata de fibras C y a veces Aδ. En la actualidad, se distinguen dos tipos de receptores desde un punto de vista farmacológico: • • los prurirreceptores histaminérgicos; • • los prurirreceptores no histaminérgicos. Dolor El dolor corresponde a un exceso de nocicepción y por lo tanto aparece a partir de un determinado umbral. Desde los nocirreceptores [10] , la información dolorosa sigue las vías habituales. A todos los niveles, existe un equilibrio entre excitación e inhibición. La integración central del dolor [11] (y, por lo tanto, los factores psicológicos, porque las áreas afectivas del cerebro están interconectadas con las áreas sensoriales) juega un papel considerable. Los mecanismos íntimos del dolor distan mucho de ser conocidos. La sustancia P es el mediador del dolor por excelencia, pero parece que existen otros (péptido relacionado con el gen de la calcitonina [CGRP], somatostatina, glutamato, bradicinina, histamina, serotonina, prostaglandinas, interleucina 1, etc.). La serotonina, la noradrenalina y, sobre todo, las endorfinas y las encefalinas poseen una actividad antálgica endógena (control de puerta). En algunos casos, el dolor puede estar relacionado con una desaferenciación, en la que existe una pérdida de los mecanismos normales de control del dolor. Prurito Los mecanismos del prurito 121314 se conocen aún menos que los del dolor, aunque se han realizado enormes progresos durante estos últimos años. El prurito no es un dolor «mínimo». Parece que se pueden definir algunas sensaciones intermedias entre el prurito y el dolor (parestesias u otras), pero el prurito y el dolor son dos sensaciones bien diferentes. El prurito es cutáneo o semimucoso (glande, labios) pero no mucoso, provoca el rascado, se agrava con el calor o los opiáceos, se calma con el frío y puede desencadenarse por estímulos mínimos. El dolor es cutaneomucoso, provoca retracción, se agrava con el frío, se calma con el calor y los opiáceos y sólo se percibe por encima de un umbral bastante elevado. El prurito es específico de la piel, al contrario que el dolor. El prurito parece tener su origen en las terminaciones nerviosas libres epidérmicas o subepidérmicas. Después es transmitido por el impulso nervioso y los neurotransmisores, siguiendo las vías habituales de la sensibilidad. Recorre capas superficiales de la médula espinal (láminas I y II) y su integración cerebral es compleja. Es probable que exista un control de puerta a diferentes niveles. Por otra parte, tanto el prurito senil como el prurito diabético y algunos pruritos neurológicos parecen estar relacionados con una desaferenciación. La histamina no es el único mediador implicado en el prurito, a pesar de la presencia de receptores H1, H2, H3 y H4. Es posible que ni siquiera intervenga en numerosas causas de prurito, lo que explicaría por qué los antihistamínicos no siempre son eficaces. Existe al menos una segunda familia de receptores: los receptores activados por proteasas 2 (PAR-2), activados por serina-proteasas (triptasa, tripsina, papaína, catepsinas, calicreínas). Además de estos dos grandes tipos de receptores, el receptor de potencial transitorio V1 (TRPV1) (activado por la capsaicina y los demás vanilloides) también puede desempeñar un papel, así como neuropéptidos como la sustancia P o el CGRP que también están implicados. Funciones eferentes La función sensorial es una de las principales funciones del sistema nervioso somático, pero dista de ser la única [15] . Las fibras nerviosas también tienen funciones eferentes (transmisión de la información central hacia la periferia) e influyen de manera notable sobre la inmunidad y el trofismo cutáneos, el crecimiento piloso, la excreción sebácea, la reacción a los ultravioletas (fotoprotección e inmunosupresión), la diferenciación y multiplicación de los queratinocitos o de los fibroblastos, etc. También modulan la cicatrización y la inflamación e intervienen en numerosas enfermedades cutáneas. En resumen, la información se transmite de la periferia hacia el centro (función sensorial), pero también en sentido inverso y a través de las mismas neuronas, lo que permite el control de todas las funciones de la piel por el sistema nervioso. El sistema nervioso vegetativo controla la vasodilatación (y por lo tanto la termorregulación), la piloerección o la secreción y excreción sudoral. La vasomotricidad cutánea interviene en la regulación tensional, pero sobre todo participa en la termorregulación. El flujo sanguíneo cutáneo está regulado, de forma permanente, por el sistema nervioso en función de informaciones locales o generales procedentes de termorreceptores localizados en la piel, de barorreceptores arteriales o cardiopulmonares o de quimiorreceptores. El flujo sanguíneo puede variar en proporciones enormes que oscilan entre 0,3 ml/m 2 a 7 l/m 2 por minuto. Estas variaciones pueden ser además muy rápidas. Los principales mediadores implicados en estos mecanismos son secretados por las neuronas o por las células endoteliales. Algunos de ellos son vasodilatadores (CGRP, sustancia P, óxido nítrico, histamina, acetilcolina, etc.), mientras que otros son vasoconstrictores (endotelinas, catecolaminas). La vasodilatación provoca eritema, calor y edema, mientras que la vasoconstricción produce palidez y frialdad. En caso de vasodilatación, el paso de numerosas sustancias aumenta de manera notable. Dichas sustancias pueden tener funciones muy diversas: nutritivas, proinflamatorias, inmunoestimulantes, inmunosupresoras, tóxicas, etc. Los neuromediadores presentes en la piel ( Cuadro 1 ) son los mediadores de las funciones eferentes del sistema nervioso. Proceden sobre todo de las terminaciones nerviosas cutáneas, aunque también pueden ser sintetizados por las células de Merkel y otras células de la piel. Todas las células cutáneas pueden tener receptores para uno u otro neurotransmisor. Así, el sistema nervioso modula las funciones de las células de la piel mediante neuromediadores que se unen a receptores específicos [15] . Cuadro 1 Neuromediadores cutáneos. Neuropéptidos Otros Hormona adrenocorticótropa (ACTH) Péptido relacionado con el gen de la calcitonina (CGRP) Hormona liberadora de corticotropina (CRH) Endorfinas Encefalinas Galanina Hormona liberadora de gastrina (GRH) Hormona estimulante de melanocito (MSH) Neurocinina A Neurocinina B Neuropéptido Y Neurotensina Péptido histidina isoleucina (PHI) Prolactina Hormona paratiroidea (PTH) Somatostatina Sustancia P Acetilcolina Angiotensina DOPA Dopamina Epinefrina (o Histamina Norepinefrina noradrenalina) Óxido Serotonina II adrenalina) (o nítrico Neuropéptidos Hormona liberadora de tirotropina Hormona estimulante del tiroides Péptido vasoactivo intestinal (VIP) Otros (TRH) (TSH) Ver a tamaño completo Aplicaciones fisiopatológicas En las enfermedades cutáneas [15] , sobre todo si existe una inflamación o si la inmunidad juega un papel importante, el equilibrio entre los diferentes neuromediadores está muy alterado. Algunos neuromediadores (o sus receptores) están sobreexpresados, mientras que otros están inhibidos. Todas las células inmunitarias poseen receptores para los neuromediadores. La liberación de determinados neuromediadores, como la sustancia P, amplifica la reacción inflamatoria: es lo que se conoce como inflamación neurógena. La liberación endocrina de corticoides y de catecolaminas también juega un papel importante. Así, es comprensible que el sistema nervioso pueda influir en enfermedades como la psoriasis, la dermatitis atópica, el vitíligo, la alopecia, el herpes o el acné. También se puede entender cómo el estrés puede influir en la evolución de estas enfermedades. Es un error no tener en cuenta la influencia que el sistema nervioso tiene sobre las patologías dermatológicas, puesto que es capital. Se puede tomar como ejemplo la psoriasis, que es una enfermedad relacionada con la inflamación y proliferación excesiva de los queratinocitos después de una activación patológica del sistema inmunitario. Aunque estos aspectos fisiopatológicos son bien conocidos, se olvida con demasiada frecuencia que el papel del sistema nervioso en la persistencia y exacerbación de las placas de psoriasis es de gran importancia. Para demostrarlo, se puede proceder de manera inversa y considerar las observaciones clínicas anecdóticas que describen una remisión total o parcial de las dermatosis inflamatorias y autoinmunes después de una denervación. En el caso concreto de la psoriasis, existe un estudio sistemático muy ilustrativo [16] . En ratones KC-Tie2, que presentan una enfermedad psoriasiforme, la sección quirúrgica de los nervios provoca una regresión del tamaño y de la intensidad de las lesiones a partir del día siguiente. Desde el punto de vista histológico, se observa una disminución de la acantosis, del infiltrado inflamatorio (sobre todo de las células dendríticas CD11c + y de los linfocitos CD4 +) y de la presencia de citocinas como la interleucina-23. Tras la inyección intradérmica de sustancia P, el infiltrado inflamatorio reaparece, pero no se observa ningún efecto sobre la acantosis. Con la inyección de CGRP, se restablece la acantosis y la presencia de linfocitos CD4 +. Cuando no se efectúa ninguna denervación, la inyección de antagonistas de la sustancia P induce los mismos efectos sobre las células CD11c + y CD4 +; la inyección de un antagonista del CGRP induce la inhibición de la acantosis y del infiltrado CD4 +, lo que permite esperar nuevas posibilidades terapéuticas. La inflamación neurógena también tiene consecuencias vasculares, como por ejemplo, el caso de la rosácea. La vasodilatación permanente o paroxística y después la inflamación secundaria están relacionadas con neuropéptidos como el péptido vasoactivo intestinal (VIP) o la adrenalina [17] . En caso de trastornos estéticos, el sistema nervioso también puede tener efectos determinantes [18] . Esto ocurre en concreto con las pieles reactivas, que responden con eritema y picores frente a estímulos variados [19] . Asimismo, el sistema nervioso también puede intervenir en la fisiopatogenia de una caída de cabello, de una piel seca o grasa o de cualquier otra anomalía relacionada con la cosmetología. La pérdida capilar puede estar inducida por el VIP [20] . Neurodermatología Neuropatías observadas en dermatología Pacientes que presentan neuropatías sensitivas [21] pueden acudir a la consulta del dermatólogo por tener sensaciones anormales (prurito, dolor, comezón, escozor, etc.) consideradas de origen cutáneo. Las causas pueden ser múltiples: genéticas (enfermedad de Fabry), compresivas (síndrome del túnel carpiano), autoinmunes (vasculitis, lupus, síndrome de Sjögren, sarcoidosis, infección por el virus de la inmunodeficiencia humana [VIH]), metabólicas (diabetes, carencias vitamínicas), infecciosas (zóster, herpes, lepra, infección por VIH, enfermedad de Lyme), tóxicas (medicamentos), paraneoplásicas (por infiltración de los nervios o por mecanismos complejos), por asociación con una paraproteinemia (amiloidosis, síndrome POEMS [polineuropatía, visceromegalia, endocrinopatía y edema, proteína M, anomalías cutáneas]), etc. Exploración neurodermatológica La base de la exploración neurodermatológica sigue siendo la exploración física, en busca de signos asociados, principalmente dermatológicos y neurológicos (déficit motor, reflejos, hipoestesia, hiperestesia, etc.). Se puede realizar una exploración sensorial simple haciendo que el paciente cuantifique el prurito o el dolor mediante una escala visual analógica (EVA) y valorando la sensibilidad al calor, al frío o al tacto (con un filamento). También se puede evaluar la sudoración mediante la prueba con lugol. También se pueden efectuar biopsias cutáneas, sobre todo si se trata de neuropatías de fibras pequeñas. Las pruebas especializadas (biopsia nerviosa, electromiograma, estudio de la conducción nerviosa, potenciales evocados, estudio cuantitativo de la sensibilidad, etc.) [21] forman parte de un protocolo diagnóstico neurológico. Zoster Igual que los signos cutáneos, los trastornos sensoriales también forman parte del cortejo clínico del herpes zóster [22] . En algunos casos pueden aparecer más tarde, entonces se trata de dolores poszosterianos. Durante la fase aguda, se puede producir una reactivación del virus de la varicela-zóster (VVZ), que sigue las fibras sensitivas hasta la piel, y una desmielinización como secuela que, aunque frecuente, no es sistemática; está favorecida por la gravedad de la afección inicial, la topografía oftálmica, la edad y la ausencia de tratamiento antiviral inicial. Así, el herpes zóster deberá tratarse lo antes posible con un antiviral, mejor durante las primeras 72 horas, y asociar un tratamiento analgésico [23] . La prescripción de analgésicos convencionales dependerá de la evaluación del dolor con una EVA. Sin embargo, como estos últimos tienen una eficacia moderada frente a los dolores neuropáticos, se deben asociar a tratamientos específicos de este tipo de dolores. Se trata principalmente de la gabapentina y de la pregabalina, cuyo efecto se prolonga durante varios días y cuya posología se debe aumentar de manera progresiva. En caso de dolores paroxísticos, se pueden prescribir fármacos anticonvulsivantes (carbamazepina, oxcarbazepina, etc.), como complemento o de forma alternativa. Cuando el dolor es permanente y/o en caso de depresión asociada (lo cual es frecuente), se suelen prescribir antidepresivos tricíclicos o inhibidores de la recaptación de serotonina. Otros tratamientos eficaces y bien tolerados son los parches de uso tópico con lidocaína al 5%, capsaicina al 8% o preparados magistrales con capsaicina. Prurito neuropático En ocasiones poco frecuentes, el prurito [13] puede estar causado por enfermedades del sistema nervioso central, como ocurre en la esclerosis múltiple, en las mielopatías (mielitis transversa, siringomielia) o en caso de tumores, abscesos o accidentes vasculares localizados en el cerebro o en la médula espinal. Con mayor frecuencia, el prurito neuropático se debe a neuropatías periféricas. Estas neuropatías suelen ser localizadas (prurito braquiorradial, notalgia parestésica, neuralgia postherpética, etc.) o se van generalizando poco a poco (neuropatías de fibras pequeñas). También existe un prurito generalizado en el curso de las neuropatías tóxicas, como las debidas al hidroxietilalmidón o en el caso de la ciguatera. La neuralgia de Arnold (cuero cabelludo), la neuralgia trigeminal (rostro) o la neuralgia del pudendo (periné) a veces se manifiestan más por un prurito que por un dolor. Algunas características clínicas deben evocar un prurito de origen neuropático [24] : ausencia de lesión cutánea inicial, carácter localizado, asociación con otros tipos de sensaciones anormales (dolor, parestesias, disestesias). Cuando es posible, el tratamiento etiológico es indispensable. La aplicación tópica de productos a base de capsaicina, lidocaína o mentol es eficaz para los pruritos localizados. En todos los casos, se debe proponer el uso de gabapentina o de pregabalina. En otras ocasiones, los antidepresivos y los anticonvulsivantes resultan útiles. Neuropatías de fibras pequeñas Las neuropatías de fibras pequeñas [25] se definen como neuropatías que afectan a las terminaciones nerviosas, principalmente intraepidérmicas. Numerosos signos clínicos son cutaneomucosos, ya sean disautonómicos (xeroftalmia, xerostomía, trastornos de la sudoración, eritema o, al contrario, palidez) o sensoriales (prurito, dolor, quemazón, hormigueo, irritación, etc.). Generalmente, se localizan en las extremidades y después se van extendiendo a medida que evoluciona la enfermedad [26] . Las causas son múltiples (diabetes, alcoholismo, carencias, lupus, síndrome de Sjögren, sarcoidosis, enfermedad celíaca, infección por VIH, causas hereditarias, etc.), aunque estas neuropatías se consideran idiopáticas en más del 50% de los casos. Por definición, ni el electromiograma ni el estudio de la conducción neuronal muestran ningún tipo de anomalía. El diagnóstico se confirma con análisis cuantitativos de sensibilidad, pero sobre todo mediante la determinación de la densidad intraepidérmica en fibras nerviosas [27] . Esta determinación la realizan equipos entrenados después del marcaje de las fibras con un anticuerpo anti-PGP9.5. Hay que realizar biopsias cutáneas 10 cm por encima del maléolo externo y 20 cm por debajo de la espina ilíaca anterior, y las muestras se fijan inmediatamente después en paraformaldehído al 4%. Tejido subcutáneo (grasa) Debajo de la dermis se encuentra el panículo, con lóbulos de células grasas o lipocitos separados por tabiques fibrosos compuestos de colágeno y grandes vasos sanguíneos ( fig. 1.8 ). El colágeno de los septos es continuo con el colágeno de la dermis. Así como la epidermis y la dermis varían en grosor según el sitio de la piel, también lo hace el tejido subcutáneo. El panículo proporciona flotabilidad y funciona como un depósito de energía y un órgano endocrino. Es un sitio importante de conversión de hormonas, como el de la androstenediona en estrona por la aromatasa. La leptina, una hormona producida en los lipocitos, regula el peso corporal a través del hipotálamo e influye en cómo reaccionamos a los sabores de los alimentos. Varias sustancias pueden afectar la acumulación de lípidos dentro de los lipocitos. La obestatina es un polipéptido que reduce la ingesta de alimento y el aumento de peso en roedores. (-) Ternatin, un heptapéptido cíclico altamente N- metilado que inhibe la acumulación de grasa, producida por el hongo Coriolus versicolor, tiene efectos similares en ratones. El estudio de estas moléculas proporciona información sobre la base molecular del aumento de peso y la obesidad. La distribución anormal de grasa y la resistencia a la insulina se observan en el síndrome de Cushing y como resultado de la terapia antirretroviral. En niños y adolescentes obesos que desarrollan diabetes, la resistencia a la insulina periférica grave se asocia con acumulación de lípidos lipídicos intramiocelulares e intraabdominales. Abrir imagen a tamaño completo Figura 1.8 Los lóbulos de la grasa subcutánea están separados por tabiques fibrosos. H&E × 40. Ciertas dermatosis inflamatorias, conocidas como paniculitis, afectan principalmente a este nivel de la piel, produciendo nódulos subcutáneos. El patrón de la inflamación, específicamente si afecta principalmente a los tabiques o a los lóbulos grasos, sirve para distinguir varias afecciones que pueden ser clínicamente similares.
Anuncio
Documentos relacionados
Descargar
Anuncio
Añadir este documento a la recogida (s)
Puede agregar este documento a su colección de estudio (s)
Iniciar sesión Disponible sólo para usuarios autorizadosAñadir a este documento guardado
Puede agregar este documento a su lista guardada
Iniciar sesión Disponible sólo para usuarios autorizados