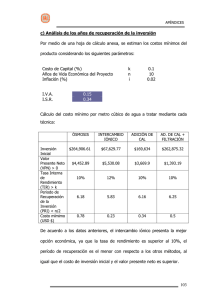
EQUILIBRIO IÓNICO Prof. Petra Salazar QUÍMICA - EQUILIBRIO IÓNICO - PROF. PETRA SALAZAR 1 Unidades de Concentración Unidades físicas de concentración Porcentaje en masa Porcentaje masa/masa % masa = Es la masa de soluto que esta contenida en 100 g de disolución. masa del soluto x 100 masa de disolución QUÍMICA - EQUILIBRIO IÓNICO - PROF. PETRA SALAZAR 2 Porcentaje por volumen % volumen/volumen ( % v/v ) % v/v Es el volumen de soluto que se encuentra en 100 ml de disolución. volumen del soluto = x 100 volumen de disolución Porcentaje masa/ volumen Es la masa de soluto que se encuentra en 100 ml de disolución. (% m/v) % m/v = masa de soluto x 100 volumen disolución QUÍMICA - EQUILIBRIO IÓNICO - PROF. PETRA SALAZAR 3 Unidades químicas de Concentración n = n° moles = masa (g) n = g / MM masa molar M = molaridad = moles de soluto Litros de solución M = molaridad = masa (g) Volumen x masa molecular QUÍMICA - EQUILIBRIO IÓNICO - PROF. PETRA SALAZAR M=n/v M = g v(l) x MM 4 MOLALIDAD (m): es el número de moles de soluto por kilogramo de solvente. m = molalidad = moles de soluto m = n / kg masa de disolvente (kg) NORMALIDAD ( N ) : Se puede entender como una forma de medir la concentración de un soluto en un disolvente. Por lo tanto, la normalidad es el número de equivalentes de soluto por litro de disolución. N = normalidad = n° Eq 1 litro de disolución QUÍMICA - EQUILIBRIO IÓNICO - PROF. PETRA SALAZAR n° Eq = masa mEq 5 Teorías ácido-base Teoría de Arrhenius Teoría de Brønsted-Lowry Teoría de Lewis QUÍMICA - EQUILIBRIO IÓNICO - PROF. PETRA SALAZAR 6 • Químico sueco (1859 1927). • Presentó esta teoría en su tesis doctoral. •Recibió el premio Nobel de Química en 1903. Svante Arrhenius QUÍMICA - EQUILIBRIO IÓNICO - PROF. PETRA SALAZAR 7 Ácido: sustancia que cuando se disuelve en agua, aumenta la concentración de protones. H2O HCl (g) ⎯→ H+ (ac) + Cl- (ac) Base: sustancia que cuando se disuelve en agua, aumenta la concentración de hidróxilos. H2O NaOH(s) ⎯→ OH- (ac) + Na+ (ac) QUÍMICA - EQUILIBRIO IÓNICO - PROF. PETRA SALAZAR 8 ÁCIDO. Sustancias que al disolverse en agua, aumentan la concentración de iones H+. Svante August Arrhenius (1859-1927) QUÍMICA - EQUILIBRIO IÓNICO - PROF. PETRA SALAZAR 9 O Ácido fórmico H OH vinagre Ácido acético Ácido cítrico QUÍMICA - EQUILIBRIO IÓNICO - PROF. PETRA SALAZAR 10 BASE. Las bases son sustancias que al disolverse en agua, aumentan la concentración de iones OH–. Svante August Arrhenius (1859-1927) QUÍMICA - EQUILIBRIO IÓNICO - PROF. PETRA SALAZAR 11 QUÍMICA - EQUILIBRIO IÓNICO - PROF. PETRA SALAZAR 12 Johannes Nicolaus Brønsted (1879-1947) Thomas Martin Lowry (1874-1936) QUÍMICA - EQUILIBRIO IÓNICO - PROF. PETRA SALAZAR 13 Definición Bronsted-Lowry Ácido: sustancia capaz de ceder un ión hidrógeno Ión hidronio QUÍMICA - EQUILIBRIO IÓNICO - PROF. PETRA SALAZAR 14 Definición Bronsted-Lowry Base: sustancia capaz de aceptar un ión hidrógeno. Ión hidroxilo La teoría de Brönsted y Lowry para ácidos y bases incluye a la de Arrhenius y la amplía QUÍMICA - EQUILIBRIO IÓNICO - PROF. PETRA SALAZAR 15 Un ácido Brønsted es un donador de protón (H+) Una base Brønsted es un aceptor de protón (H+) base ácido ácido conjugado QUÍMICA - EQUILIBRIO IÓNICO - PROF. PETRA SALAZAR base conjugada 16 • Siempre que una sustancia se comporta como ácido (dona H+) hay otra que se comporta como base (acepta H+). • Cuando un ácido pierde H+ se convierte en su “base conjugada” y cuando una base acepta H+ se convierte en su “ácido conjugado”. Pierde H+ HNO2 + H2O acido base Prof.Tatiana Zuvic M. NO2 Base conj. - + H 3O + Acido conj. Gana H+ QUÍMICA - EQUILIBRIO IÓNICO - PROF. PETRA SALAZAR 17 Arrhenius publica en 1887 su teoría de “disociación iónica”, en la que afirma que hay sustancias (electrolitos), que en disolución, se disocian en cationes y aniones. Cationes: especie química con carga neta positiva Aniones: especie química con carga neta negativa Electrolitos fuertes y débiles QUÍMICA - EQUILIBRIO IÓNICO - PROF. PETRA SALAZAR 18 Ácido débil Ácido fuerte Antes de la Ionización En el equilibrio Antes de la Ionización QUÍMICA - EQUILIBRIO IÓNICO - PROF. PETRA SALAZAR En el equilibrio 19 Electrólito fuerte: están totalmente disociados H2O NaCl (s) ⇄ Na+ (ac) + Cl- (ac) Electrólito débil: no se disocia por completo CH3COOH ⇄ CH3COO- (ac) + H+ (ac) QUÍMICA - EQUILIBRIO IÓNICO - PROF. PETRA SALAZAR 20 Ácidos débiles son electrólitos débiles HF (ac) + H2O (l) HNO2 (ac) + H2O (l) HSO4- (ac) + H2O (l) H2O (l) + H2O (l) H3O+ (ac) + F- (ac) H3O+ (ac) + NO2- (ac) H3O+ (ac) + SO4 2- (ac) H3O+ (ac) + OH- (ac) Ácidos fuertes son electrólitos fuertes HCl (ac) + H2O (l) H3O+ (ac) + Cl- (ac) HNO3 (ac) + H2O (l) H3O+ (ac) + NO3- (ac) HClO4 (ac) + H2O (l) H3O+ (ac) + ClO4- (ac) H2SO4 (ac) + H2O (l) H3O+ (ac) + HSO4- (ac) QUÍMICA - EQUILIBRIO IÓNICO - PROF. PETRA SALAZAR 21 Bases débiles son electrólitos débiles F- (ac) + H2O (l) OH- (ac) + HF (ac) NO2- (ac) + H2O (l) OH- (ac) + HNO2 (ac) Bases fuertes son electrólitos fuertes NaOH (s) KOH (s) H2O H2O Ba(OH) (s) 2 Na+ (ac) + OH- (ac) K+ (ac) + OH- (ac) H2O Ba2+ (ac) + 2OH- (ac) QUÍMICA - EQUILIBRIO IÓNICO - PROF. PETRA SALAZAR 22 HA (ac) + H2O (l) HA (ac) H3O+ (ac) + A- (ac) H+ (ac) + A- (ac) [H+][A-] Ka = [HA] Ka es la constante de ionización ácida Ka ácido débil fuerza pKa = -log Ka QUÍMICA - EQUILIBRIO IÓNICO - PROF. PETRA SALAZAR 23 Constantes de ionización de algunos ácidos débiles y sus bases conjugadas a 25 ºC QUÍMICA - EQUILIBRIO IÓNICO - PROF. PETRA SALAZAR 24 Antes de la disociación Después de la disociación, en el equilibrio Disociación de un ácido fuerte HCl H++ Cl- QUÍMICA - EQUILIBRIO IÓNICO - PROF. PETRA SALAZAR 25 Antes de la disociación Después de la disociación, en el equilibrio Disociación de un ácido debil AH ⇄ H+ + A- Ka = [H+][A-] / [AH] Constante de disociación ácida QUÍMICA - EQUILIBRIO IÓNICO - PROF. PETRA SALAZAR 26 NH3 (ac) + H2O (l) NH4+ (ac) + OH- (ac) [NH4+][OH-] Kb = [NH3] Kb es la constante de ionización básica Kb fuerza de base débil pKb = -log Kb QUÍMICA - EQUILIBRIO IÓNICO - PROF. PETRA SALAZAR 27 QUÍMICA - EQUILIBRIO IÓNICO - PROF. PETRA SALAZAR 28 Son aquellos que pueden ceder más de un ion H+. El H3PO4 es triprótico. La constantes sucesivas siempre van disminuyendo QUÍMICA - EQUILIBRIO IÓNICO - PROF. PETRA SALAZAR 29 H+ (ac) + OH- (ac) H2O (l) autoionización del agua H O H +H [ O H O H base H2O + H2O ácido H H + + H ] O - ácido conjugado H3O+ + OHbase conjugada QUÍMICA - EQUILIBRIO IÓNICO - PROF. PETRA SALAZAR 30 H2O (l) ⇄ H+ (ac) + OH- (ac) Kc = [H+][OH-] [H2O] [H2O] =constante Kc[H2O] = Kw = [H+][OH-] La constante del producto iónico (Kw) es el producto de las concentraciones molares de los iones H+ y OH- a una temperaturaparticular. A 250C Kw = [H+][OH-] = 1.0 x 10-14 QUÍMICA - EQUILIBRIO IÓNICO - PROF. PETRA SALAZAR 31