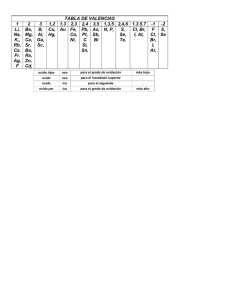
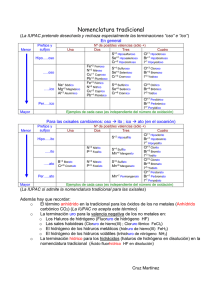
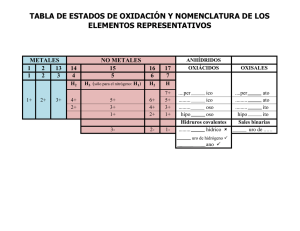
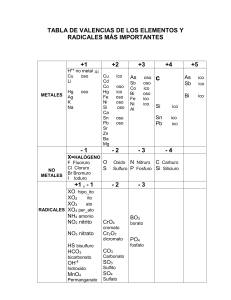
RESUMEN NOMENCLATURA INORGANICA FUNCIONES QUIMICAS ÓXIDOS REACCION QUIMICA FORMULACIÓN NOMENCLATURA TRADICIONAL NOMENCLATURA STOCK NOMENCLATURA SISTEMATICA Óxido de, de, nombre de M (Valencia) Numeral (mono, di, tri, etc) Óxido de, de, numeral (mono, di, tri, etc) nombre de M Óxido de o anhídrido, anhídrido, nombre de M (Valencia) Numeral (mono, di, tri, etc) Óxido de o anhídrido, anhídrido, numeral (mono, di, tri, etc) nombre de M Hidróxido de, de, nombre de M (Valencia) Numeral (mono, di, tri, etc) Hidróxido de, de, numeral (mono, di, tri, etc) nombre de M raíz de Nm (uro) raíz de Nm (uro) de Numeral (mono, di, tri, etc) Hidrógeno A + B -----AB Reacción de Combinación o Síntesis Óxido , nombre de M ÓXIDOS BÁSICOS -2 M + O2 ---- M(O ) -2 M(O ) 1 Valencia terminación ICO 2 Valencias OSO Menor, ICO mayor 3 Valencias HIPO, OSO, ICO 4 Valencias HIPO-OSO, OSO, ICO, PER-ICO Valencia negativa HIDRICO Óxido o Anhídrido, Anhídrido, nombre de M OXIDOS ÁCIDOS O ANHIDRIDOS -2 Nm + O2 ---- Nm(O ) -2 Nm(O ) 1 Valencia terminación ICO 2 Valencias OSO Menor, ICO mayor 3 Valencias HIPO, OSO, ICO 4 Valencias HIPO-OSO, OSO, ICO, PER-ICO Valencia negativa HIDRICO A + B -----AB Reacción de Combinación o Síntesis HIDRÓXIDOS ÁCIDOS ÁCIDOS HIDRÁCIDOS Hidróxido , nombre de M M(O-2) + H2O ---- M(OH)-1 Óxido Básico + Agua ----- Hidróxido o Base A + B -----AB Reacción de Combinación o Síntesis M(OH)n-1 HNm Nm: grupo 16 y 17 H2 + Nm ---- HNm Regla: Nm trabaja con el menor número de oxidación 1 Valencia terminación ICO 2 Valencias OSO Menor, ICO mayor 3 Valencias HIPO, OSO, ICO 4 Valencias HIPO-OSO, OSO, ICO, PER-ICO Valencia negativa HIDRICO Ácido , raíz de Nm (hídrico) FUNCIONES QUIMICAS REACCION QUIMICA FORMULACIÓN +1 NOMENCLATURA TRADICIONAL NOMENCLATURA STOCK NOMENCLATURA SISTEMATICA Ácido , raíz de Nm (ito o ato) (Valencia) de Hidrógeno Numeral (mono, di, tri, etc) OXO, raíz de Nm (ito o ato) numeral (mono, di, tri, etc) de Hidrógeno Hidruro de, nombre de M (Valencia) Numeral (mono, di, tri, etc) Hidruro de, nombre de M +1 -2 H Nm O Regla #E.O del Nm es par el subíndice para el Hidrógeno es 1 y para los Oxígenos: (E.O+1)/2 ÁCIDOS OXÁCIDOS U OXOÁCIDOS #E.O del Nm es impar el subíndice para el Hidrógeno es 2 y para los Oxígenos: (E.O+2)/2 -2 Nm(O ) + H2O ----HNmO Óxido ácido + Agua---- Oxácido Excepciones: Fósforo, Boro y Arsénico donde el #E.O del Nm es impar el subíndice para el Hidrógeno es 3 y para los Oxígenos: (E.O+3)/2 oxo elemento no metal ato elemento metalico El nitrógeno solo forma Ácidos oxácidos con E.O 3 y 5 A + B -----AB Reacción de Combinación o Síntesis MHn HIDRUROS M +H2 ---- MHn Metal + Hidrogeno ---- Hidruro Regla: Hidrógeno trabaja con E.O = -1 Ácido , prefijo (hipo o per) raíz de de Nm sufijo (oso o ico) 1 Valencia terminación ICO 2 Valencias OSO Menor, ICO mayor 3 Valencias HIPO, OSO, ICO 4 Valencias HIPO-OSO, OSO, ICO, PER-ICO Hidruro , raíz de M 1 Valencia terminación ICO 2 Valencias OSO Menor, ICO mayor 3 Valencias HIPO, OSO, ICO 4 Valencias HIPO-OSO, OSO, ICO, PER-ICO FUNCIONES QUIMICAS SALES REACCION QUIMICA AB + CD -----BC + AD Reacción doble sustitución FORMULACIÓN NOMENCLATURA TRADICIONAL NOMENCLATURA STOCK NOMENCLATURA SISTEMATICA MNm MNmO MHNm –MHNmO M(OH)Nm – M(OH)NmO M1M2NmO raíz de Nm terminación URO, nombre de M SALES BINARIAS – HALOIDEAS O HIDRÁCIDAS -1 HNm + M(OH) ---- MNm + H2O A. Hidrácido + Hidróxido ---- Sal + Agua MNm Sal hidrácida Formada por Catión y Anión 1 Valencia terminación ICO 2 Valencias OSO Menor, ICO mayor 3 Valencias HIPO, OSO, ICO 4 Valencias HIPO-OSO, OSO, ICO, PER-ICO raíz de Nm (uro) de nombre de M (valencia) Numeral (mono, di, tri, etc) raíz de Nm terminación URO Numeral (mono, di, tri, etc) de nombre de M Nombre del anión, seguido del nombre del catión SALES OXÁCIDAS, OXOSALES U OXISALES SALES HIDROXISALES o SALES BÁSICAS -1 HNmO + M(OH) ---- MNmO + H2O MNmO A. Oxácido + Hidróxido ---- Sal + Agua Se forman cuando en una reacción de neutralización existe un exceso de hidróxido con respecto al ácido. Son compuestos que poseen algún grupo OH en su estructura. Para formularlas, se escribe primero el catión y luego los aniones en orden alfabético M(OH)Nm – M(OH)NmO Resultan al sustituir los grupos hidroxilos (OH) de las bases por No metales Cambiar las terminaciones OSO del ácido oxácido por ITO e ICO por ATO o nombre del Anión seguido por el nombre del Catión Nombre del ácido terminado en ATO (Valencia) de, nombre del metal (Valencia) Se nombran como las sales neutras intercalando la expresión básico precedida de un prefijo numeral que indique el número de OH - presentes en la sal. Se nombran en orden alfabético aniónhidróxido. La palabra hidróxido lleva antepuesto un prefijo que indica el número de hidróxidos presentes en la sal. Igual que el tradicional …de nombre de M (valencia) Se nombran como las sales neutras con un prefijo numeral que indica el número de OH- presentes en la sal. FUNCIONES QUIMICAS SALES ÁCIDAS REACCION QUIMICA Resultan al sustituir parcialmente los Hidrógenos del Ácido oxácido por Metales FORMULACIÓN MHNm –MHNmO Resultan al sustituir parcialmente los Hidrógenos del Ácido oxácido por Metales NOMENCLATURA TRADICIONAL NOMENCLATURA STOCK Se nombran como las sales neutras intercalando la expresión ácido de a continuación el metal acabado en –ico, o en –oso según su valencia. Se antepone la palabra hidrógeno al nombre de la sal, indicando con prefijos numerales el número de átomos de hidrógenos que quedan sin sustituir. NOMENCLATURA SISTEMATICA Se empieza con prefijo numeral hidrógeno según el número de hidrógenos que tenga y a continuación el nombre de la sal correspondiente. En la actualidad las sales ácidas se nombran utilizando la nomenclatura de STOCK. ÁCIDO + HIDRÓXIDO + HIDRÓXIDO = SAL DOBLE + AGUA SALES DOBLES M1M2NmO Se forman sales dobles o triples cuando se sustituyen los hidrógenos del ácido por dos metales, es decir que pueden presentar más de un catión y anión. Para formularlos y nombrarlos se escriben los metales en orden alfabético y a continuación el radical proveniente del ácido.