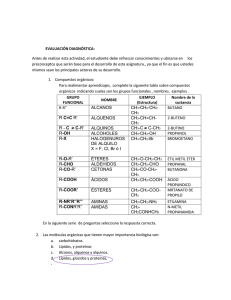
Ejercicios de Alcanos Alquenos Alquinosjanicegorzsm5th Alcanos Conceptos clave Isómeros Constitucionales Datos generales sobre los alcanos Los alcanos están compuestos de átomos de C tetraédricos con hibridación sp3. Hay dos tipos de alcanos: alcanos acíclicos que tienen la fórmula molecular CnH2n + 2 y cicloalcanos que tienen la fórmula molecular CnH2n. Los alcanos solo tienen enlaces C-C no polar y C ̄H y sin grupo funcional, por lo que sufren pocas reacciones. Los alcanos se nombran con el sufijo -ano. Nombres de grupos alquilo (4. 4A) Conformaciones en alcanos acíclicos (4.9, 4.10) • Las conformaciones de alcanos se pueden clasificar como eclipsadas, escalonadas, anti o gauche según la orientación relativa de los grupos en los carbonos adyacentes. Tipos de Deformación • Deformación torsional: aumento de la energía causado por interacciones eclipsantes . • Deformación estérica: un aumento de energía cuando los átomos son forzados a acercarse demasiado entre sí . • Deformación angular: un aumento de energía cuando los ángulos de enlace tetraédrico se desvían de 109,5 ° . Dos tipos de isómeros a. Isómeros constitucionales: isómeros que difieren en la forma en que los átomos están conectados entre sí . Ing. Ricardo Sierra Bravo - Prof. Titular Q. ORGANICA Página 1 Ejercicios de Alcanos Alquenos Alquinosjanicegorzsm5th b. Trabajo para el alumno Busque cuales son los Isómeros constitucionales y escriba un ejemplo de cada uno. c. Estereoisómeros: Son isómeros que difieren solo en la forma en que los átomos están orientados en el espacio (4.13B). Veamos el siguiente caso c.1. El compuesto uno se llama 1,1-Dimetilciclopentano y es un ciclo pentano que tiene dos grupos metilo unidos al carbono que llamamos 1. Todos los átomos los hemos dibujado en el plano c.2. El compuesto (2) dos se llama cis-1,2-Dimetilciclopentano y es un isómero constitucional del compuesto (1) uno; porque la forma en que están unidos todos los átomos es diferente. En el compuesto 2, tengo un metilo unido al carbono que llamamos 1 y otro unido al carbono que llamamos 2 y los metilos salen dela pantalla hacia nosotros. Por ser dos triángulos-cuñas solidas. y Esto significa Cis. c.3. El compuesto (3) se llama trans-1,2-Dimetilciclopentano y es un estereoisómero del compuesto (2) porque la forma en que están unidos todos los átomos es la misma. En 2, tengo un metilo unido al carbono que llamamos 1 y otro unido al carbono que llamamos 2 lo mismo que en el compuesto (3) y los metilos uno salen de la pantalla hacia nosotros por ser dos triángulos-cuña solidas y el otro triángulos-cuña está dibujado con trazos ; lo que nos indica que esta hacia atrás de la pantalla. y Esto significa Trans. EJERCICIOS DEL TEMA 1. Dibuje la estructura de un hidrocarburo que contiene: Dibujar la estructura de un hidrocarburo que contiene: (a) Tres átomos de carbono con hibridación sp3; (b) Un átomo de carbono con hibridación sp3 y dos átomos de carbono con hibridación sp2; (c) Un átomo de carbono con hibridación sp. Y dos átomos de carbono con hibridación sp2; (d) Dos átomos de carbono con hibridación sp3 y dos átomos de carbono con hibridación sp. Ing. Ricardo Sierra Bravo - Prof. Titular Q. ORGANICA Página 2 Ejercicios de Alcanos Alquenos Alquinosjanicegorzsm5th Solución 2. ¿Qué orbitales se utilizan para formar cada enlace en la metilamina, CH3N H2? Solución Cada enlace C — H está formado por la superposición de un orbital sp3 de carbono con el orbital s del hidrógeno (C sp3 —H1s). El enlace C — N está formado por la superposición de un orbital sp3 de carbono con el orbital sp3 de nitrógeno (C sp3— N sp3) y cada enlace N — H está formado por la superposición de un orbital sp3 de nitrógeno con el s orbital de hidrógeno (N sp3—H1s). Cuatro grupos alrededor del carbono con hibridación sp3 Cuatro grupos alrededor del nitrógeno con hibridación sp3 3. Responda la siguiente pregunta para la molécula de acetaldehído: a. Determine la hibridación del oxígeno y los dos átomos de carbono. b. ¿Qué orbitales están involucrados en la formación del doble enlace carbono-oxígeno? c. ¿vínculo? d. Mencione el tipo de orbital en el que residen los pares solitarios. Solución Cuatro grupos alrededor del carbono con hibridación sp3 Tres grupos alrededor del carbono con hibridación sp2 Tres grupos alrededor del oxígeno con hibridación sp2 Ing. Ricardo Sierra Bravo - Prof. Titular Q. ORGANICA Página 3 Ejercicios de Alcanos Alquenos Alquinosjanicegorzsm5th a. El enlace σ está formado por la superposición de un orbital sp2 de carbono con un orbital sp2 de oxígeno y el enlace π está formado por la superposición lado a lado del orbital 2p del carbono con el orbital 2p del oxígeno. (c) Los dos orbitales híbridos sp2 están ocupados por los dos pares solitarios de oxígeno. 4. Para los átomos señalados en los ejemplos siguientes clasifíquelos como 1º, 2º, 3º o 4º, y justifique. Rta: determine a cuántos átomos de carbono está enlazado 1° C = enlazado a otro C. 2° C = enlazado a otros dos C. 3° C = enlazado a otros tres C. 4° C = vinculado a otros cuatro C. 5. Halogenación La halogenación es el reemplazo de uno o más átomos de hidrógeno en un compuesto orgánico por un halógeno (flúor, cloro, bromo o yodo). A diferencia de las transformaciones complejas de la combustión, la halogenación de un alcano parece ser una reacción de sustitución simple en la que se rompe un enlace CH y se forma un nuevo enlace CX. La cloración del metano, que se muestra a continuación, proporciona un ejemplo simple de esta reacción. CH 4 + Cl 2 + energía —— > CH 3 Cl + HCl Ing. Ricardo Sierra Bravo - Prof. Titular Q. ORGANICA Página 4 Ejercicios de Alcanos Alquenos Alquinosjanicegorzsm5th ¿Cual es el mecanismo por el cual tiene lugar esta reacción?. Escriba todas las etapas y explique 1. Selectividad: Cuando se halogenan alcanos mayores que el etano, se forman productos isoméricos. Por tanto, la cloración del propano da tanto 1-cloropropano como 2-cloropropano como productos monoclorados. Son posibles cuatro productos diclorados constitucionalmente isoméricos, y existen cinco isómeros constitucionales para los propanos triclorados. Escriba las fórmulas estructurales para los cuatro isómeros diclorados. La halogenación del propano revela una característica interesante de estas reacciones. Todos los hidrógenos en un alcano complejo no exhiben la misma reactividad. ¿a que se debe o como se explica esto? 2.1. AYUDA: Dado que el átomo de hidrógeno es común a todos los casos citados aquí, podemos atribuir las diferencias en las energías de disociación de enlaces a diferencias en la estabilidad de los radicales alquilo (R 3 C · ) a medida que cambia la sustitución del carbono. Esto nos lleva a la conclusión de que. La estabilidad del radical alquilo aumenta en el orden: Fenilo <primario (1º) <secundario (2º) <terciario (3º) <alilo ≈ bencilo. 7. Dos ejercicios tipos de isómeros Problemas al usar modelos tridimensionales 7.1. Nombrar cada alcano usando el modelo de bola y palo y clasificar cada carbono como 1 °, 2 °, 3 ° o 4 °. 3,3,4,5- Tetrametilheptano 3-Etil-5,5-dimetiloctano 4. Considere el ciclohexano sustituido que se muestra en el modelo de bola y palo. a. Etiquete los sustituyentes en C1, C2 y C4 como axiales o ecuatorial. c. ¿Los sustituyentes de C1 y C2 son cis o trans entre sí? d. ¿Los sustituyentes en C2 y C4 son cis o trans entre sí? e. Dibujar la segunda conformación posible en forma de silla y clasificarla como más estable o menos estable que la conformación que se muestra en el modelo tridimensional. Ing. Ricardo Sierra Bravo - Prof. Titular Q. ORGANICA b. Página 5 Ejercicios de Alcanos Alquenos Alquinosjanicegorzsm5th 5. PROBLEMA 10. Dibujar las conformaciones más estable y menos estable del 2,3-dimetilpentano entre los carbonos C3-C4. 5.1. SOLUCIÓN La conformación más estable de la molécula es una alternada. Dibujamos las tres conformaciones alternadas y buscamos la que tiene menos interacciones gauche. La conformación más inestable de la molécula es una eclipsada. Dibujamos las tres conformaciones eclipsadas y buscamos la que tiene más eclipsamientos. Ing. Ricardo Sierra Bravo - Prof. Titular Q. ORGANICA Página 6 Ejercicios de Alcanos Alquenos Alquinosjanicegorzsm5th 6. 4.6 Los isómeros constitucionales difieren en la forma en que los átomos están unidos entre sí. Para dibujar todos los isómeros constitucionales: [1] Dibuja todos los carbones de la cadena principal. [2] Elimina una C y úsala como sustituyente. (No lo agregue al carbono terminal: esto regenera la cadena anterior). [3] Elimina dos C y úsalas como sustituyentes, etc. Cinco isómeros constitucionales de fórmula molecular C6H14 [1] cadena larga [2] con una C como sustituyente [3] utilizando 2 C como sustituyentes 7. 4.10 dibujar los isómeros constitucionales de fórmula molecular C5H10 que tienen un anillo. Cinco isómeros constitucionales 8. La conformación menos estable del 3-bromo-2-metilpentano, vista a través del enlace C-2 C-3 (es decir, C-2 en el frente, C-3 en la parte posterior) es: Ing. Ricardo Sierra Bravo - Prof. Titular Q. ORGANICA Página 7 Ejercicios de Alcanos Alquenos Alquinosjanicegorzsm5th 8.1. La conformación eclipsada es la menos estable. La repulsión estérica entre las moléculas aumenta la energía de la conformación, lo que hace que la molécula sea menos estable. Por tanto, la opción correcta es (c). 9. P 3.12 Por qué el momento dipolar molecular (μ) para FCH2CH2OH es mucho más grande que el del FCH2CH2F. Utilice un análisis conformacional para explicar. J3S 9.1. S 3.12 El momento dipolar (μ) de F CH2CH2OH es mucho mayor que FCH2CH2F porque un enlace de hidrógeno intramolecular entre F y H altamente electronegativos de (OH) conduce a la estabilización de un confórmero torpe de FCH-2CH2OH, lo que se suma al momento dipolar neto en la misma dirección. Por otro lado, el momento dipolar neto en FCH2CH2F es cero debido a los átomos de F orientados de manera opuesta 10. 4.36 Convierta cada modelo tridimensional en una proyección de Newman alrededor del enlace indicado. Convierta cada estructura en una proyección de Newman alrededor del enlace resaltado en rojo. Isómeros constitucionales 4.37 Dibuje la estructura de todos los compuestos que se ajusten a las siguientes descripciones. a. cinco isómeros constitucionales que tienen la fórmula molecular C4H8 b. nueve isómeros constitucionales que tienen la fórmula molecular C7H16 Ing. Ricardo Sierra Bravo - Prof. Titular Q. ORGANICA Página 8 Ejercicios de Alcanos Alquenos Alquinosjanicegorzsm5th c. doce isómeros constitucionales que tienen la fórmula molecular C6H12 y que contienen un anillo 4.39 Indique la estructura y el nombre IUPAC para cada uno de los nueve isómeros que tienen la fórmula molecular C9H20 que contiene siete carbonos en la cadena más larga y dos grupos metilo como sustituyentes. 4.40 Dibuje la estructura correspondiente a cada nombre IUPAC. a. 3-etil-2-metilhexano b. sec-butilciclopenteno c. 4-isopropil-2,4,5-trimetilundecano d. ciclobutilcicloheptano e. 3-etil-1,1-dimetilciclohexano f. 4-butil-1,1-dietil ciclooctano g. 6-isopropil-2,3-dimetildodecano h. 2,2, 6, 6,7-pentametiloctano i. cis-1-etil-3-metilciclopentano j. trans-1-terc-butil-4-etilciclohexano 4.41 Cada uno de los siguientes nombres IUPAC es incorrecto. Explique por qué es incorrecto y proporcione el nombre correcto de la IUPAC. a. 2,2-dimetil-4-etilheptano- b. 5-etil-2-metilhexano c. 2-metil-2-isopropilheptano d. 1,5-dimetilciclohexano e. 1-etil-2,6-dimetilcicloheptano f. 5,5,6-trimetiloctano g. 3-butil-2,2-Dimetilhexano h. 1,3-dimetilbutano 4.42 Escriba el nombre IUPAC para cada compuesto. Propiedades físicas 4.43 Clasifique los siguientes alcanos según un orden creciente del punto de ebullición. Ing. Ricardo Sierra Bravo - Prof. Titular Q. ORGANICA Página 9 Ejercicios de Alcanos Alquenos Alquinosjanicegorzsm5th 4.44 Los puntos de fusión y de ebullición de dos alcanos isoméricos son los siguientes: CH3 (CH2)6 CH3, p.f = -57 ° C y P.Eb = 126 ° C; (CH3) 3 CC (CH3)3, p.f = 102 ° C y P.Eb = 106 ° C. a. b. (a) Explique por qué un isómero tiene un punto de fusión más bajo pero un punto de ebullición más alto. (b) Explique por qué hay una pequeña diferencia en los puntos de ebullición de los dos compuestos, pero una gran diferencia en sus puntos de fusión. 4.45 ¿Qué confórmero de cada par tiene mayor energía? Dibuje la curva de potencial para cada par 4.42 Dos puntos: • Los enlaces axiales se dirigen hacia arriba o hacia abajo, mientras que los ecuatoriales se dirigen hacia afuera. • Un carbono en la parte superior tiene un enlace axial en la parte superior y un carbono en la parte inferior tiene un enlace axial en la parte inferior. 4.43 Dibuje un segundo confórmero de silla invirtiendo el anillo. • Los carbonos superiores se convierten en carbonos inferiores y los enlaces axiales se convierten en enlaces ecuatoriales. • Los enlaces axiales se vuelven ecuatoriales, pero los enlaces en la parte superior permanecen en la parte superior; es decir, un enlace axial en la parte superior se convierte en un enlace ecuatorial en la parte superior. • El conformador con los grupos más voluminosos en la posición ecuatorial es más estable y está presente en mayor concentración en el equilibrio. 4.43 Dibuje un segundo confórmero de silla invirtiendo el anillo. Ing. Ricardo Sierra Bravo - Prof. Titular Q. ORGANICA Página 10 Ejercicios de Alcanos Alquenos Alquinosjanicegorzsm5th Ing. Ricardo Sierra Bravo - Prof. Titular Q. ORGANICA Página 11 Ejercicios de Alcanos Alquenos Alquinosjanicegorzsm5th P 3.10 Representar lo siguiente como su proyección de Newman: (a) El conformador más estable de 2-ciclopentil-6-metilheptano, mirando hacia abajo el enlace C2 C3. (b) Confórmero Gauche de 1-fenilbutano, mirando hacia abajo el enlace C1 C2. Ing. Ricardo Sierra Bravo - Prof. Titular Q. ORGANICA Página 12 Ejercicios de Alcanos Alquenos Alquinosjanicegorzsm5th P 3.11 Dibuje las proyecciones de Newman de isopentano y trace la gráfica de energía potencial versus rotación alrededor del enlace C2 C3. Identifique el conformador que corresponde al mínimo más alto en la parcela. P 3.12 Por qué el momento dipolar molecular (μ) para FCH2CH2OH es mucho mayor que el de FCH2CH2F. Dibuje los compuestos en la proyección de Newman y dibuje los momentos dipolares si existiesen. Utilice un análisis conformacional para explicar. P 3.13 Cual será la conformación menos estable del 3-bromo-2-metilpentano, vista a través del enlace C-2 C-3 (es decir, C-2 en el frente, C-3 en la parte posterior): 3.4 General P 3.14 ¿Cuántos estereoisómeros cis / trans existen para lo siguiente? (a) diclorociclopentano (b) Difenilciclohexano (c) 2-cloro-4-etil-1-metilciclohexano P 3.15 ¿Cuántos tipos diferentes [es decir, constitucionales y geométricos (cis / trans)] de hidrógenos hay en los siguientes? (a) 1-etil-1-metilciclopropano (b) Alilciclobutano (c) Metilciclobutano (d) Clorociclopentano (e) Vinilciclopentano Ing. Ricardo Sierra Bravo - Prof. Titular Q. ORGANICA Página 13 Ejercicios de Alcanos Alquenos Alquinosjanicegorzsm5th Se tiene los siguientes radicales: vinilo o etenilo: −CH=CH2 alilo: -CH2-CH=CH2 propilo: -CH2-CH2-CH3 y la función alcano que es cíclica Ciclo Butano: un cuadrado P 3.16 ¿Identifica el compuesto bicíclico con la menor tensión? P 3.17 Son posibles tres isómeros estructurales para el metilbiciclo [2.2.1] heptano. Uno de ellos tiene dos formas estereoisoméricas. Dibuja estructuras para los cuatro isómeros. P 3.18 Identificar el número de isómeros estructurales que existen para el metilbiciclo [2.2.2] octano 7-metilbiciclo 1. Cadena principal: biciclo de 7 carbonos (heptano) 2. Numeración: partimos de un cabeza de puente (indiferente) y numeramos primero la cadena de 3 carbonos. Ing. Ricardo Sierra Bravo - Prof. Titular Q. ORGANICA Página 14 Ejercicios de Alcanos Alquenos Alquinosjanicegorzsm5th 3. Sustituyentes: metilo en posición 7 (puente) 4. Nombre: 7-Metilbiciclo[3.1.1]heptano 1. Cadena principal: biciclo de 9 carbonos (nonano) 2. Numeración: partimos del carbono puente numerado como 1, para que el etilo tome el menor localizador. 3. Sustituyentes: etilo en posición 2. 4. Nombre: 2-Etilbiciclo[3.3.2]nonano 1. Cadena principal: biciclo de 10 carbonos (decano) 2. Numeración: partimos del carbono puente numerado como 1, para que el cloro tome el menor localizador. 3. Sustituyentes: cloro en posición 2. 4. Nombre: 2-Clorobiciclo[4.4.0]decano 1. Cadena principal: biciclo de 7 carbonos (heptano) 2. Numeración: partimos de un carbono puente (indistinto) y numeramos primero la cadena de 4 carbonos. 3. Sustituyentes: no tiene. 4. Nombre: Biciclo[4.1.0]heptano 1. Cadena principal: biciclo de 7 carbonos (heptano) 2. Numeración: partimos de un cabeza de puente (indiferente) y numeramos primero la cadena de 3 carbonos. 3. Sustituyentes: metilos en posición 1,5 4. Nombre: trans-1,5-Dimetilbiciclo[3.2.0]heptano 1. Cadena principal: biciclo de 9 carbonos (nonano) 2. Numeración: comenzamos por el carbono cabeza de puente que otorga al metilo el localizador más bajo (2). 3. Sustituyentes: metilo en posición 2. 4. Nombre: 2-Metilbiciclo[4.2.1]nonano. 1. Cadena principal: biciclo de 8 carbonos (octano) 2. Numeración: la numeración parte del carbono cabeza de puente que otorga al metilo el localizador más bajo posible. Ing. Ricardo Sierra Bravo - Prof. Titular Q. ORGANICA Página 15 Ejercicios de Alcanos Alquenos Alquinosjanicegorzsm5th 3. Sustituyentes: metilo en posición 2. 4. Nombre: 2-Metilbiciclo [2.2.2] octano 1. Cadena principal: biciclo de 6 carbonos (hexano) 2. Numeración: partimos del cabeza de puente que al numerar cadena grande, mediana y pequeña, otorga a los sustituyentes los menores localizadores. 3. Sustituyentes: bromo en posición 2 y metilo en posición 5. 4. Nombre: 2-Bromo-5-metilbiciclo [2.1.1] hexano. Ing. Ricardo Sierra Bravo - Prof. Titular Q. ORGANICA Página 16 Ejercicios de Alcanos Alquenos Alquinosjanicegorzsm5th https://www3.uji.es/~mcarda/DOCENCIA/tema8QO.pdf Ing. Ricardo Sierra Bravo - Prof. Titular Q. ORGANICA Página 17