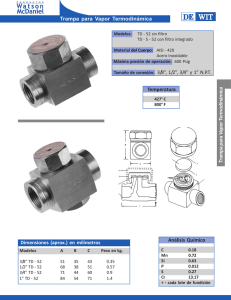
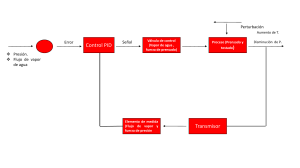
INTRODUCCION El siguiente trabajo trabajo fue hecho por el alumno MARISCAL KÚ MARIO JOSÉ después de terminar el curso que corresponde a TERMODINAMICA 1 impartido por el Ing. SERGIO GONZALEZ ESPINOZA, y con la finalidad que a siguientes generaciones les pueda servir de algún modo, en este trabajo se da un breve resumen de lo que fue el curso completo, aunque nos centraremos a lo que mas nos interesa que es la “solución de problemas”, esto es ya que como estudiantes mismos de la carrera de ingeniería mecánica y habiendo tomado el curso completo nos atrevemos a decir que los problemas no son difíciles pero hay que entenderlos para poder resolverlos correcta y fácilmente. La termodinámica es una teoría de una gran generalidad, aplicable a sistemas de estructura muy elaborada con todas las formas de propiedades mecánicas, eléctricas y térmicas complejas. Puesto que la termodinámica se focaliza en las propiedades térmicas, es conveni convenient ente e ideali idealizar zar y simpli simplific ficar ar las propied propiedades ades mecáni mecánicas cas y eléctr eléctrica icass de los sistem sistemas as que estudi estudiarem aremos. os... .. En nuestr nuestro o estudi estudio o de la termod termodiná inámic mica a ideali idealizare zaremos mos nuestros nuestros sistemas para que sus propiedades propiedades mecánicas y eléctricas eléctricas sean lo más triviales triviales posibles. Antes de empezar empezar con la solución solución de problemas problemas plantearemos plantearemos algunas algunas definicione definicioness para hacer mas fácil la misma solución de dichos problemas, es por esto que nos atrevemos a decir que este es un trabajo completo que ayudara mucho en la materia a quienes quieran utilizarlo; en este mismo libro se anexan tablas que servirán para la solución misma de los problemas. VISION DEL TRABAJO TR ABAJO La visión que se desea desarrollar es sistémica. Con esto queremos decir que ustedes vayan adquiriendo la habilidad de ver sistemas reales y analizarlos desde el punto de vista global. Por ejemplo si analizamos un compresor de aire del que utilizan los llanteros, verlo no solo como un conjunto de partes y piezas, sino también entender las relaciones funcionales entre ellas para comprender su operación. Trataremos Trataremos que al desarrollar desarrollar esta habilidad se vaya aplicando aplicando a sistemas sistemas cada vez más generales. Así, del estudio de sistemas muy simples, pasaremos al estudio de sistemas cada vez más complejos. ¿Pero para que nos servirá todo este conocimiento?...Junto con este trabajo anexamos un disco en donde ay algunas aplicaciones de la termodinámica. Por eso antes de empezar con los verdaderos problemas iniciaremos con lo que todo alumno de ingeniería debe de saber…el porque? (teoría) TERMODINÁMICA Energía calorífica: La suma de la energía potencial y de la energía sintética de un sistema no permanece siempre constante. De una manera general, la energía mecánica total de un sistema disminuye con el frotamiento y los choques. Pero, en todos los fenómenos de esta naturaleza se produce calor. Sí una bala de plomo se dispara contra una placa de acero, se s e puede alcanzar, en el momento del choque, una temperatura superior a su punto de fusión. El calor debe, por consiguiente, considerarse como una forma de energía, hipótesis que se ve corroborada por la posibilidad de producir trabajo mecánico consumiendo calor, por ejemplo, en las maquinas de calor. c alor. Otras formas de energía: eléctrica. La corriente eléctrica es uno de los numerosos fenómenos que pueden producir trabajo mecánico o calor. Un condensador cargado de corriente también energía eléctrica, puesto a descargarse es capaz de producir una corriente, pero esta energía es potencial. Química: Las reacciones químicas tienen lugar con absorción o desprendimiento de calor, segú según n los los caso casos. s. La comb combus ustitión ón,, que que es la comb combin inac ació ión n del del oxíg oxígen eno o del del cuer cuerpo po combustible o con los elementos que lo integran, revelan que una muestra de carbón y oxigeno contiene energía química potencial, que puede utilizarse al iniciar la combustión o la combinación de ambos cuerpos. Las Las expl explos osio iones nes son son un ejemp ejemplo lo de tran transf sform ormac ació ión n de energ energía ía quím químic ica a en traba trabajo jo mecánico. Radiante: La luz se produce de diversas formas, pero la más corriente de éstas consiste en calentar cuerpos a una temperatura bastante elevada (lámpara de gas, Lámpara eléctrica de incandescencia). La incandescencia es precisamente la transformación de energía calorífica en energía radiante. En los fenómenos de luminiscencia, o emisión de luz en frío, interviene otra forma de energía energía que es mecánica mecánica en el caso de la tribolumiscen tribolumiscencia. cia. En la electroluminisc electroluminiscencia, encia, la energía eléctrica se transforma directamente en luz sin que pase por la forma calorífica intermedia. Así acorde en los tubos de gas rarificado como el neón y los vapores de sodio y mercurio. En la quimioluminiscencia, algunas reacciones químicas, como la oxidación lenta del fósforo blanco en contacto del aire, provocan emisión de luz, sin calentamiento apreciable. La energía radiante puede convertirse en cualquiera de las otras cuatro formas de energías que se han considerado. Así, cuando una sustancia absorbe radiaciones, se calienta y este efecto calorífico es particularmente intenso en el caso de las radiaciones infrarrojas. La transformación de energía luminosa en energía eléctrica tiene lugar en la fotoelectricidad al captárselos electrones que emiten algunos metales cuando recibe la luz. Las modificaciones químicas sufridas por los cuerpos bajo la influencia de la luz son numerosas y constituyen el objeto de la ciencia denominada fotoquímica , que estudia la transformación de la energía luminosa en energía química. Las plantas realizan esta transformación gracias a la clorofila, que absorbe las radiaciones solares, y la energía así almacenada se emplea para sintetizar los alimentos hidrocarbonatos. Primera ley de la termodinámica Permítase que un sistema cambie de un estado inicial de equilibrio, a un estado final de equilibrio, en un camino determinado, siendo el calor absorbido por el sistema y el trabajo hecho por el sistema. Después calculamos el valor de A continuación cambiamos el sistema desde el mismo estado hasta el estado final, pero en esta ocasión por u n camino diferente. Esto es, aunque y separadamente dependen del camino tomado, no depende, en lo absoluto, de cómo pasamos el sistema del estado al estado, sino solo de los estados inicial y final (de equilibrio). Del estudio de la mecánica mecánica recordará, que cuando un objeto se mueve de un punto inicial a otro final, en un campo gravitacional en ausencia de fricción, el trabajo hecho depende solo de las posiciones de los puntos y no, en absoluto, de la trayectoria por la que el cuerpo se mueve. De esto concluimos que hay una energía potencial, función de las coordenadas espaciales del cuerpo, cuyo valor final menos su valor inicial, es igual al trabajo hecho al desplazar el cuerpo. Ahora, en la termodinámica, encontramos experimentalmente, que cuando en un sistema ha cambiado su estado al , la cantidad dependen solo de las coordenadas inicial y final y no, en absoluto, del camino tomado entre estos puntos extremos. Concluimos que hay una función de las coordenadas termodinámicas, cuyo valor final, menos su valor inicial es igual al cambio en el proceso. A esta función le llamamos función de la energía interna. Representemos la función de la energía interna por la letra. Entonces la energía interna del sistema en el estado, es solo el cambio de energía interna del sistema, y esta cantidad tiene un valor determinado independientemente de la forma en que el sistema pasa del estado al estado f: Tenemos entonces que: Como sucede para la energía potencial, también para que la energía interna, lo que importa es su cambio. Si se escoge un valor arbitrario para la energía interna en un sistema patrón de referencia, su valor en cualquier otro estado puede recibir un valor determinado. Esta ecuación se conoce como la primera ley de la termodinámica, al aplicarla debemos recordar que se considera positiva cuando el calor entra al sistema y que será positivo cuando el trabajo lo hace el sistema. En realidad, la termodinámica clásica no ofrece una explicación para ella, además que es una función de estado que cambia en una forma predecible. (Por función del estado , queremos decir, que exactamente, que su valor depende solo del estado físico del material: su constitución, presión, temperatura y volumen.) La primera ley de la termodinámica, se convierte entonces en un enunciado de la ley de la conservación de la energía para los sistemas termodinámicos. Podrá parecer extraño que consideremos que sea positiva cuando el calor entra al sistema y que sea positivo cuando la energía sale del sistema como trabajo. Simplemente es una buena forma económica tratar de obtener el máximo trabajo con una maquina de este tipo, y minimizar el calor que debe proporcionársele a un costo importante. Si nuestro sistema sólo sufre un cambio infinitesimal en su estado, se absorbe nada más una cantidad infinitesimal de calor y se hace solo una cantidad infinitesimal de trabajo, de tal manera que el cambio de energía interna también es infinitesimal. Podemos expresar la primera ley en palabras diciendo: Todo sistema termodinámico en un estado de equilibrio, tiene una variable de estado llamada energía interna cuyo cambio en un proceso diferencial está dado por la ecuación antes escrita. La primera ley de la termodinámica se aplica a todo proceso de la naturaleza que parte de un estado de equilibrio y termina en otro. Decimos que si un sistema esta en estado de equilibrio cuando podemos describirlo por medio de un grupo apropiado de parámetros constantes del sistema como presión, el volumen, temperatura, campo magnético y otros la primera ley sigue verificándose si los estados por los que pasa el sistema de un estado inicial (equilibrio), a su estado final (equilibrio), no son ellos mismos estados de equilibrio. Hay algunas preguntas importantes que no puede decir la primera ley. Por ejemplo, aunque nos dice que la energía se conserva en todos los procesos, no nos dice si un proceso en particular puede ocurrir realmente. Esta información nos la da una generalización enteramente diferente, llamada segunda ley de la termodinámica, y gran parte de los temas de la termodinámica dependen de la segunda ley. Segunda ley de la termodinámica. Las primeras máquinas térmicas construidas, fueron dispositivos muy eficientes. Solo una pequeña fracción del calor absorbido de la fuente de la alta temperatura se podía convertir en trabajo útil. Aun al progresar los diseños de la ingeniería, una fracción apreciable del calor absorbido se sigue descargando en el escape de una máquina a baja temperatura, sin que pueda convertirse en energía mecánica. Sigue siendo una esperanza diseñar una maquina que pueda tomar calor de un depósito abundante, como el océano y convertirlo íntegramente en un trabajo útil. Entonces no seria necesario contar con una fuente de calor una temperatura más alta que el medio ambiente quemando combustibles. De la misma manera, podría esperarse, que se diseñara un refrigerador que simplemente transporte calor, desde un cuerpo frío a un cuerpo caliente, sin que tenga que gastarse trabajo exterior. Ninguna de estas aspiraciones ambiciosas viola la primera ley de la termodinámica. La máquina térmica sólo podría convertir energía calorífica completamente en energía mecánica, conservándose la energía total del proceso. En el refrigerador simplemente se transmitiría la energía calorífica de un cuerpo frío a un cuerpo caliente, sin que se perdiera la energía en el proceso. Este enunciado desecha la posibilidad de nuestro ambicioso refrigerador, ya que éste implica que para transmitir calor continuamente de un objeto frío a un objeto caliente, es necesario proporcionar trabajo de un agente exterior. Por nuestra experiencia sabemos que cuando dos cuerpos se encuentran en contacto fluye calor del cuerpo caliente al cuerpo frío. En este caso, la segunda ley elimina la posibilidad de que la energía fluya del cuerpo frío al cuerpo caliente y así determina la dirección de la transmisión del calor. La dirección se puede invertir solamente por medio de gasto de un trabajo. Kelvin (con Planck) enuncio la segunda ley con palabras equivalentes a las siguientes: es completamente imposible realizar una transformación cuyo único resultado final sea el de cambiar en trabajo el calor extraído de una fuente que se encuentre a la misma temperatura. Este enunciado elimina nuestras ambiciones de la máquina térmica, ya que implica que no podemos producir trabajo mecánico sacando calor de un solo depósito, sin devolver ninguna cantidad de calor a un depósito que esté a una temperatura más baja. Podemos usar una máquina ordinaria para extraer calor de un cuerpo caliente, con el objeto de hacer trabajo y devolver parte del calor a un cuerpo frío. Pero conectando nuestro refrigerador “perfecto” al sistema, este calor se regresaría al cuerpo caliente, sin gasto de trabajo, quedando así utilizable de nuevo para su uso en una máquina térmica. Si el enunciado Kelvin-Planck fuera incorrecto, podríamos tener una máquina térmica que sencillamente tome calor de una fuente y lo convierta por completo en trabajo. Conectando esta máquina térmica “perfecta” a un refrigerador ordinario, podemos extraer calor de un cuerpo ordinario, podemos extraer calor de un cuerpo caliente, convertirlo completamente en trabajo, usar este trabajo para mover un refrigerador ordinario, extraer calor de un cuerpo frío, y entregarlo con el trabajo convertido en calor por el refrigerador, al cuerpo caliente. El resultado neto es una transmisión de calor desde un cuerpo frío, a un cuerpo caliente, sin gastar trabajo, lo infringe el enunciado de Clausius. La segunda ley nos dice que muchos procesos son irreversibles. Por ejemplo, el enunciado de Clausius específicamente elimina una inversión simple del proceso de transmisión de calor de un cuerpo caliente, a un cuerpo frío. Algunos procesos, no sólo no Como hemos visto, la expresión matemática de esta ley es: (el producto de la presión por el volumen es constante) Supongamos que tenemos un cierto volumen de gas V 1 que se encuentra a una presión P 1 al comienzo del experimento. Si variamos el volumen de gas hasta un nuevo valor V 2, entonces la presión cambiará a P2, y se cumplirá: que es otra manera de expresar la ley de Boyle. Ejemplo 4.0 L de un gas están a 600.0 mmHg de presión. ¿Cuál será su nuevo volumen si aumentamos la presión hasta 800.0 mmHg? Solución: Sustituimos los valores en la ecuación P 1V1 = P2V2. (600.0 mmHg) (4.0 L) =(800.0 mmHg) (V2) Si despejas V 2 obtendrás un valor para el nuevo volumen de 3L. Ley de Charles En 1787, Jack Charles estudió por primera vez la relación entre el volumen y la temperatura de una muestra de gas a presión constante y observó que cuando se aumentaba la temperatura el volumen del gas también aumentaba y que al enfriar el volumen disminuía. El volumen es directamente proporcional a la temperatura del gas: • Si la temperatura aumenta, el volumen del gas aumenta. • Si la temperatura del gas disminuye, el volumen disminuye. ¿Por qué ocurre esto? Cuando aumentamos la temperatura del gas las moléculas se mueven con más rapidez y tardan menos tiempo en alcanzar las paredes del recipiente. Esto quiere decir que el número de choques por unidad de tiempo será mayor. Es decir se producirá un aumento (por un instante) de la presión en el interior del recipiente y aumentará el volumen (el émbolo se desplazará hacia arriba hasta que la presión se iguale con la exterior).Lo que Charles descubrió es que si la cantidad de gas y la presión permanecen constantes, el cociente entre el volumen y la temperatura siempre tiene el mismo valor. Matemáticamente podemos expresarlo así: (el cociente entre el volumen y la temperatura es constante) Supongamos que tenemos un cierto volumen de gas V1 que se encuentra a una temperatura T1 al comienzo del experimento. Si variamos el volumen de gas hasta un nuevo valor V2, entonces la temperatura cambiará a T 2, y se cumplirá: que es otra manera de expresar la ley de Charles. Esta ley se descubre casi ciento cuarenta años después de la de Boyle debido a que cuando Charles la enunció se encontró con el inconveniente de tener que relacionar el volumen con la temperatura Celsius ya que aún no existía la escala absoluta de temperatura. Ejemplo: Un gas tiene un volumen de 2.5 L a 25 °C. ¿Cuál será su nuevo volumen si bajamos la temperatura a 10 °C? Solución: Primero expresamos la temperatura en kelvin: T1 = (25 + 273) K= 298 K T2 = (10 + 273 ) K= 283 K Ahora sustituimos los datos en la ecuación: 2.5L V2 ----- = ----298 K 283 K Si despejas V 2 obtendrás un valor para el nuevo volumen de 2.37 L. Ley de Gay Lussac Un sistema termodinámico es un sistema macroscópico cuyas características microscópicas (la posición y la velocidad de las partículas en cada instante) es inaccesible y donde sólo son accesibles sus características estadísticas. El estado de un sistema representa la totalidad de las propiedades macroscópicas asociadas con él. Cualquier sistema que muestre un conjunto de variables identificables tiene un estado termodinámico, ya sea que esté o no en equilibrio Tipos de sistemas Un sistema aislado es aquel que no puede intercambiar materia ni energía con su entorno. Un sistema cerrado es aquel que sólo puede intercambiar energía con su entorno, pero no materia. Un sistema abierto es aquel que puede intercambiar materia y energía con su entorno. PROPIEDADES DE SISTEMAS: Los sistemas se caracterizan por tener una serie de propiedades. Estas se clasifican en: Propiedades Extensivas: Son aquellas propiedades que dependen de la masa total del sistema. Por ejemplo, la masa es una propiedad extensiva, como también lo es la cantidad total de energía cinética que tiene, o el momento de inercia. etc. Propiedades Intensivas: Son aquellas que varían de punto a punto del sistema o bien no dependen de la masa total. Por ejemplo, la temperatura es una propiedad intensiva. También podría serlo el voltaje. ESTADO El estado de un sistema queda definido por el conjunto de valores que adquieren aquellas propiedades de sistema que pueden variar. Por ejemplo, el estado de un automóvil queda definido (entre otras variables) por su posición geográfica, velocidad (y dirección), aceleración, potencia que está desarrollando el motor, cantidad de combustible en el estanque, masa total (incluyendo ocupantes y carga), marcha (cambio) que está desarrollando, etc. Equilibrio Térmico El concepto de equilibrio térmico es básico al momento de clasificar las temperatura. Sabemos que si dos cuerpos M1 y M2 que están a temperaturas diferentes entre sí se ponen en contacto, fluirá calor desde el cuerpo más caliente al cuerpo más frío. Después de un tiempo suficiente, ambos estarán en equilibrio térmico entre sí. Es decir estarán a la misma temperatura. Se puede además verificar la siguiente proposición: Cuando un cuerpo A está en equilibrio térmico con otros dos cuerpos B y C, estos estarán igualmente en equilibrio térmico entre sí. Esta proposición se conoce a veces como el Principio Cero de la Termodinámica. Permite de hecho el establecer escalas de temperaturas y hacer termómetros. En efecto, si A es el cuerpo termométrico y lo hemos calibrado poniendolo en equilibrio térmico con una sucesión de cuerpos B1 a Bn que están a diferentes temperaturas T1aTn, entonces podemos usar A para medir temperaturas en ese rango. La energía del sistema depende de su estado de movimiento y posición con respecto al exterior. Si el sistema se encuentra en reposo y en una altura nula con respecto al exterior (termodinámicamente muerto), podría pensarse que la energía total del sistema es nula. Esto se ilustra en la siguiente figura Equilibrio térmico con ambiente Disminución de presión Experiencia de Joule-Kelvin Atendiendo a donde se realiza la expansión del vapor se distinguen dos tipos de turbinas: de acción o de reacción. • En las turbinas de acción la expansión del vapor se realiza en el estator perdiendo presión y aumentando su velocidad hasta pasar al rotor donde la presión se mantendrá constante y se reducirá su velocidad al incidir sobre los álabes. • Por el contrario, en las turbinas de reacción el vapor se expande en el rotor, manteniéndose la presión y velocidad constantes al pasar por el estátor, que en este caso sólo sirve para dirigir y orientar el flujo de vapor. Clasificación Existen turbinas de vapor en una gran variedad de tamaños, desde unidades de 1 hp (0.75 kW) usadas para accionar bombas, compresores y otro equipo accionado por flecha, hasta turbinas de 2,000,000 hp (1,500,000 kW) utilizadas para generar electricidad. Existen diversas clasificaciones para las turbinas de vapor modernas. Abastecimiento de Vapor y Condiciones de Escape Estas categorías incluyen turbinas condensadoras, no condensadoras, de recalentamiento, extracción e inducción. Las turbinas de No condensación o de contrapresión son más ampliamente usadas para aplicaciones de vapor en procesos. La presión de salida es controlada por una válvula reguladora para satisfacer las necesidades de presión en el vapor del proceso. Se encuentran comúnmente en refinerías, plantas de papel y pulpa y en instalaciones de desalinización, donde se dispone de grandes cantidades de vapor de proceso a baja presión. Las turbinas condensadoras se encuentran comúnmente en plantas de potencia eléctrica. Estas turbinas expelen vapor en estado parcialmente saturado, generalmente con calidad mayor al 90%, a una presión bastante inferior a la atmosférica hacia un condensador. Las turbinas de recalentamiento también son usadas casi exclusivamente en plantas de potencia eléctrica. En una turbina de recalentamiento, el flujo de vapor sale de una sección a alta presión de la turbina y es regresado a la caldera donde se le vuelve a sobrecalentar. El vapor entonces regresa a una sección de presión intermedia de la turbina y continúa su expansión. Las turbinas de extracción se encuentran en todo tipo de aplicaciones. En una turbina de extracción, el vapor es liberado en diversas etapas y aprovechado en distintos procesos industriales, también puede ser enviado a calentadores de agua para mejorar la eficiencia del ciclo. Los fluidos extraídos pueden ser controlados mediante una válvula o pueden no controlarse. Las turbinas de inducción introducen vapor a baja presión en una etapa intermedia para producir potencia adicional. Caldera (artefacto) Calderas de gasóleo. Según la ITC-MIE-AP01, caldera es todo aparato a presión en donde el calor procedente de cualquier fuente de energía se transforma en energía utilizable, en forma de calorías, a través de un medio de transporte en fase líquida o vapor. Las calderas pueden ser eléctricas, a gasóleo o combustible diésel, a gas natural, gas butano, etcétera. Las calderas pequeñas, exclusivamente para agua caliente sanitaria, se suelen conocer como calentadores (ej. para emplear en la ducha, en el fregadero de la cocina, etc.). Se conoce como caldera de vapor a aquella unidad en la cual se puede cambiar el estado del fluido de trabajo ( agua) de líquido a vapor de agua, en un proceso a presión constante y controlado, mediante la transferencia de calor de un combustible que es quemado en una cámara conocida como "hogar". En algunos casos se puede llevar hasta un estado de vapor sobrecalentado. V1=2 ft 3 V2=4 ft 3 P1=P2=100 psia R=53.3 para el aire Cp=0.241 para el aire P1=P2=100psia = WRT1 P1V1 T1 = = T1 T2 T2 P1 WR 100 * 144 * 2 53.3 * 2 = 270.16° R = P2V2 = 100 *144 * 4 WR 53.3 * 2 = 540.32° R Wk12 = P(V2 − V1 ) = 100 *144(4 − 2) Wk12 = 37.01BTU Q12 = wCp (T2 − T1 ) = 2 * 0.241(540.32 − 270.16 Dos libras de aire se expanden lentamente Q12 = 130.21BTU dentro de un cilindro de 100 psia hasta 20 psia a una temperatura constante de 70°F. Calcular V1,V2,Q12,Wk12, U(cambio de energía interna). DATOS: W=2lb P1=100 psia P2=20 psia T1=T2=70°F R=53.3 = WRT1 P1V1 = V1 WRT1 P1 2 * 53.3 * 530° R = V1 = 100 *144 3.923 ft 3 P1V1 V2 V2 = P2V2 = P1V1 = 100 *144 * 3.423 P2 20 * 144 = 19.015 ft 3 Q12 = wCp (V2 − V1 ) = 2 * 0.241(19.615 − 3.923) Q12 = 7.56 BTU Wk12 J = T ( P2 − P1 ) J Wk12 = −54.49BTU Una libra de aire se expande isoentrópicamente desde 100 psia con una temperatura T1=200°F hasta 20 psia. Hallar T2, V1, V2, Wk12, Q12. DATOS: w=1lbf P1=100psia T1=200°F P2=20psia “EN LOS PROCESOS ISOENTRÓPICOS NO HAY TRANFERENCIA DE CALOR” P = 2 P1 T2 T1 k −1 P T2 = T1 2 P1 k = 660(0.2) 0.286 = 416.5°R − 460 = WRT1 P1V1 = V1 k −1 = −43.47° F T2 V1 k WRT1 P1 = 1 * 53.3 * 660 100 *144 = 2.44 ft 3 P2V2 k = P1V1k 1 V2 1 P1 k = V1 = 2.44(5)1.4 P2 V2 = Wk12 J 7.70 ft 3 = P1V1 − P2V2 J (k − 1) = (144 * 20)(5 * 2.44 * 7.70) 778(0.4) Wk12 = 41.64 BTU En un ciclo de carnot que emplea una libra de vapor de agua como sustancia de trabajo al inicio del proceso de expansión isotérmico el agua es líquido saturado a una presión de 250 psia, al final de este proceso el agua es vapor de agua saturado. Al final de la expansión isoentrópica en la maquina térmica es de 2 psia . Calcular trabajo del ciclo y eficiencia del ciclo. DATOS: W=1lb de agua = liquidosaturado h2 = vaporsaturado S 2 = S3 = 1.5274 S1 = S 4 = 0.5680 h1 = 376.02 h2 = 1202.1 h1 X X Sg = = X2 = + xh fg h3 = 94.02 + 0.7751(1022.1) h3 = 886.65 h4 = 324.197 − Sf S fg hg = X1 h = hf − hf h fg 1.5274 − 0.17499 1.7448 0.5680 − 0.1744 1.7448 = 0.7751 = 0.2252 = (h2 − h1 ) − (h3 − h4 ) = 0.10 h2 − h1 η ≈ 10% η = h2 − h3 = 1202.1 − 886.65 = 315.449 BTU Wkb = h1 − h4 = 376.02 − 324.197 = 51.823BTU Wk NETO = Wk MT − Wkb = 315.449 − 51.823 = 263.262 BTU Wk MT WkCICLO = Wk NETO Wk MT = 263.626 315.051 = 0.8367 BTU A 7lb de vapor de agua se le agrega calor,el vapor se expansiona manteniendo su temperatura constante y P2=150 psia con una calidad del 90%. Hallar Wk12, Q12 y diagramas P-V y T-S. = S f 1 + XS fg1 = 0.51422 + 0.9(1.0562) S1 = 1.4648 BTU lbf S1 = U f 1 + XU fg1 = 330.24 + 0.9(781.8) U1 = 1033.14 BTU lbf U1 INTERPOLANDO (TABLA 3) T U S U2 = 1115.4 + 3.6 = 1119 .04 350 115.4 1.6191 358.48 ? ? 360 1119.7 1.6259 ∆T : ∆U = ∆T * : ∆U * * U T ( )( ) ∆ ∆ ∆U * = = 3.6 ∆T SE OBTIENE DIRECTAMENTE INTERPOLANDO ∆S * = (∆S )(∆T ∆T ∆S * = 5.7664−3 * ) ∆T = 10 ∆T * = 8.48 S2 S2 = 1.6191 + 5.7664 = 1.62486 Q12 −3 Wk12 J = WT ( S 2 − S1 ) = (7 * 810.48)(1.624 − 1.4648) Q12 = 903.198 BTU = Q12 − W (U − U1 ) J (903.198) − 10(1119.04 − 1033.14) Wk12 = Wk12 = 0.056BTU 778 RESUMEN DE DESPEDIDA Con esto terminamos este resumen semestral, esperando y les pueda servir como material de apoyo para siguientes generaciones. Es por demás recordarse que al final de este resumen se encuentra el diagrama de mollier completo, así como también un disco que les servirá como material de apoyo para la misma solución de problemas termodinámicos ya que al estar en adobe read será de fácil uso, también se agrega el original de este resumen para futuras impresiones a fin de no maltratar el original y con la finalidad de que este resumen sea mas completo se agrega una presentación en diapositivas de PowerPoint con un ejemplo real de un sistema termodinámico, las tablas de vapor utilizadas las podrán encontrar en cualquier libro de termodinámica. Sin mas que decir me despedo de ustedes deseándoles mucha suerte en este curso que resulta muy interesante… ¡¡¡¡¡SUERTE Y A QUEMAR PESTAÑAS SE A DICHO!!!! …MARIO JOSÉ MARISCAL KÚ ALUMNO DEL INSTITUTO TECNOLÓGICO DE LERMA CAMPECHE