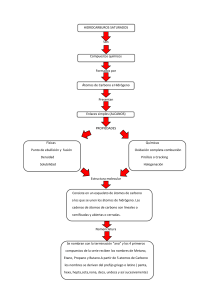
UNIDAD 5 ENLACE QUÍMICO 1. Agrupación de átomos Los átomos se agrupan formando combinaciones más estables que la de los átomos por separado. Las uniones entre los átomos se denominan enlaces. Cuando se unen átomos del mismo número atómico se forman los elementos. Sin embargo, cuando se unen átomos de diferente número atómico se obtienen los compuestos. Los átomos se unen entre sí mediante de dos tipos de agrupaciones: - Moléculas: estructura formada por la unión de una cantidad determinada de átomos que coincide con la fórmula química. - Red cristalina: estructuras formadas por la unión de un número indeterminado de átomos, iones o moléculas que se disponen geométricamente ordenadas. El enlace químico es la unión entre átomos, moléculas o iones de una sustancia para alcanzar la máxima estabilidad. 1.1. Regla del octeto Al poseer una gran estabilidad, los gases nobles tienden a encontrarse aislados en la naturaleza, sin formar agrupaciones. Todos ellos (a excepción del He) tienen 8 electrones en su última capa. Es por esto que se denomina regla del octeto. Los átomos de los elementos tienden a ganar, perder o compartir electrones para llegar a la configuración de gas noble. 2. Tipos de enlaces Existen tres tipos de enlaces que se caracterizan por el mecanismo mediante el cual se enlazan los átomos o iones. Son los enlaces iónico, covalente y metálico. Además, también estudiaremos los enlaces o uniones intermoleculares que se establecen entre moléculas. 2.1.Enlace iónico Cuando se combinan elementos metálicos con elementos no metálicos, se establece un enlace iónico. El metal pierde electrones y da lugar a iones positivos o cationes. El no metal gana electrones para formar iones negativos o aniones. Ambos se unen de manera más estable mediante un elemento iónico en una estructura denominada red cristalina iónica. El enlace iónico es la unión que resulta de las fuerzas de atracción eléctricas entre iones de distinto signo. Ejemplo: NaCl 2.1.1. Propiedades de las sustancias iónicas - Son sólidos cristalinos, es decir, presentan una forma geométrica definida. Son frágiles. Se rompen con facilidad. Cualquier deformación de la red de iones hace que se descompensen las fuerzas eléctricas que la mantienen unidas. Tienen elevados puntos de fusión y de ebullición. Se requiere un gran aporte de energía para que los iones venzan las fuerzas que los unen. Son solubles en agua. Los iones interaccionan con las partículas del disolvente, liberándose de la red iónica. Conducen la corriente eléctrica fundidos o disueltos. 2.2. Enlace covalente Se forma entre átomos de elementos no metálicos. El enlace entre ellos se forma al compartir electrones. No se forman iones. El enlace covalente es la unión de dos átomos que comparten uno o más pares de electrones. Mediante el enlace covalente, los átomos se pueden agrupar formando moléculas (el agua) o redes cristalinas. 2.2.1. Propiedades de las sustancias covalentes - - Moléculas: - A temperatura ambiente (20ºC) pueden encontrarse en los tres estados. - Los puntos de ebullición y fusión son bajos. - No conducen la corriente eléctrica. - La mayoría son solubles en disolventes orgánicos e insolubles en agua. Redes cristalinas: - Son sólidos a temperatura ambiente (20ºC). - Son muy duras. - Tienen unos puntos de ebullición y fusión muy altos. - Son insolubles. - No conducen la corriente eléctrica. 2.2.2. Uniones intermoleculares Este tipo de uniones se establecen entre una molécula y otra. Son mucho más débiles que los enlaces covalentes que unen los átomos que los forman. Se llaman uniones intermoleculares a las interacciones atractivas que existen entre las moléculas de las sustancias covalentes. Pueden ser de dos tipos: - Enlaces de Van-der Waals. Estas interacciones son débiles y de naturaleza eléctrica. Su intensidad aumenta con el tamaño de la molécula. Ejemplos: F₂ (gaseoso), Cl₂ (gaseoso), Br₂ (líquido), I₂ (sólido). - Enlaces de hidrógeno. Son enlaces más intensos que los anteriores. Se presentan entre el H de una molécula y un átomo de F, O ó N de la otra molécula. Ejemplos: H₂ O, NH₃ , HF. 2.3. Enlace metálico Se dá entre elementos metálicos. Los metales pierden electrones y se transforman en cationes. Los electrones procedentes de la formación de los cationes son compartidos por todos los átomos. Se forma una red tridimensional de iones. 2.3.1. Propiedades de las sustancias metálicas - Son sólidos a temperatura ambiente (20ºC). Puntos de fusión y ebullición altos. Son dúctiles y maleables. Son buenos conductores térmicos y eléctricos. Son insolubles en los disolventes habituales 3. Formulación y nomenclatura inorgánica 3.1. Introducción Se utilizan los símbolos de los elementos para poder escribir las fórmulas de los compuestos de una manera sencilla. La IUPAC dicta unas normas para unificar la formulación y nomenclatura en todo el mundo. Una fórmula es una expresión simbólica y numérica que indica la composición de una sustancia. En la fórmula se escriben juntos los símbolos de los átomos y un número a la derecha del símbolo como subíndice, que indica la cantidad de átomos que hay de ese elemento. Si se trata de un ión se escribe primero el número de la carga y a continuación, el signo. El nombre de cada sustancia que la identifica se asigna mediante un conjunto de normas comunes establecidas por la IUPAC. Solo estudiaremos dos sistemas de nomenclatura: - Composición: informa sobre los átomos que componen la sustancia y en qué proporción están. Esta proporción se puede indicar de dos formas distintas: + Prefijos multiplicadores: son los prefijos numerales griegos: 1. mono- 4. tetra7. hepta- 10. deca2. di5. penta8. octa11. undeca3. tri6. hexa9. nano12. dodeca+ Números de oxidación: se escriben entre paréntesis, en números romanos, al lado del nombre del elemento, sin signo y sin dejar espacios. Cuando el elemento tiene un único estado de oxidación, no se indica en el nombre del compuesto. - Sustitución: se utiliza solo en hidruros no metálicos, que se nombran con el sufijo ano. La IUPAC acepta amoniaco y agua. 3.2. Sustancias simples A la hora de nombrar una sustancia simple se utilizan los prefijos acompañados del nombre del elemento. El prefijo -mono se utilizará únicamente cuando el átomo elemental no se encuentre de forma habitual. Ejemplo: 0₂→ dioxígeno oxígeno 3.3. Iones Estudiaremos los iones monoatómicos. Estos iones aparecen con el símbolo del elemento y un superíndice a la derecha con el valor de la carga y a continuación el signo. Ejemplo: Fe²⁺ Diferenciamos entre: O²⁻ - Cationes: se nombra con el nombre del elemento y el número de carga entre paréntesis que no se debe omitir aunque no haya ambigüedad. También se puede nombrar con el número de oxidación. En este caso, el número de oxidación, se escribirá en números romanos y entre paréntesis. Ejemplo: Fe²⁺→ Ion de hierro (2+) - Ion de hierro (II) Aniones: se denominan con el sufijo -uro al final del nombre del átomo del que se elimina la última vocal salvo en el caso del Oxígeno, que se llama óxido. Ejemplo: Cl⁻ → Cloruro (1-) ó cloruro O²⁻→ Óxido (2-) ó óxido H⁻→ hidruro (1-) ó hidruro 3.4. Compuestos binarios 3.4.1. Óxidos Son combinaciones del Oxígeno con otro elemento, metálico o no metálico. En estos compuestos, el número de oxidación del Oxígeno es de 2-, mientras que el otro elemento actúa con número de oxidación positivo.Ejemplo: Au₂ O₃ 1. Prefijos: trióxido de dioro 2. Nº de oxidación: óxido de oro (III) 3. Nº de carga: óxido de oro (3+) Para las combinaciones de Oxígeno con Cl, Br, I, At y F (G.17), el Oxígeno se escribe en la fórmula en primer lugar y solo se utiliza la nomenclatura de prefijos. Ejemplo: Br₂ O₅ → O₅Br₂ 3.4.2. Hidruros 3.4.2.1 Hidruros metálicos Son compuestos formados por Hidrógeno y un elemento metálico. El número de oxidación del Hidrógeno es 1-. Ejemplo: CuH₂ 1. Prefijos: dihidruro de cobre 2. Nº de oxidación: dihidruro de cobre (II) 3. Nº de carga: hidruro de cobre (2+) 3.4.2.2. Hidruros no metálicos (G. 13,14 y 15) Se nombran y se formulan de la misma manera que los hidruros metálicos. Uno de los sistemas de nomenclatura es el de sustitución. Proviene de los hidruros padre o progenitores. Se utiliza para los grupos 13,14,15,16 y 17: Grupo 13 Grupo 14 Grupo 15 Grupo 16 Grupo 17 BH₃ borano CH₃ metano NH₃ amoniaco H₂ O agua HF fluorano AlH₃ alumano SiH₄ silano PH₃ fosfano H₂ S sulfano HCl clorano GaH₃ galano GeH₄ germano AsH₃ arsano H₂ Se selano HBr bromano InH₃ indigano SnH₄ estano SbH₃ estibano H₂ Te telano HI yodano TlH₃ talano PbH₄ plumbano BiH₃ bismutano H₂ Po polano HAt astatano 3.4.2.2. Hidruros no metálicos (G. 16,17) En estos compuestos, el Hidrógeno actúa con número de oxidación de 1+. Los halógenos actuarán con estado de oxidación 1- y los anfígenos con estado de oxidación 2-. Ejemplo:HCl 1. Prefijos: cloruro de hidrógeno 2. Disolución acuosa: ácido clorhídrico 3. Sustitución: clorano 3.5. Sales binarias Son combinaciones de metales y no metales (metal+no metal o dos no metales). El no metal se coloca a la derecha en la fórmula y actúa con estado de oxidación negativo. A la hora de nombrarlo el elemento no metálico lleva la terminación -uro. Ejemplo: CuCl₂ 1. Prefijos: dicloruro de cobre 2. Nº de oxidación: cloruro de cobre (II) 3. Nº de carga: cloruro de cobre (2+) 3.6. Compuestos ternarios 3.6.1. Hidróxidos Son combinaciones en los que el anión hidróxido (OH⁻ ) se unen con metales. Ejemplo: Au(OH₃ ) 1. Prefijos: trihidróxido de oro 2. Nº de oxidación: hidróxido de oro (III) 3. Nº de carga: hidróxido de oro (3+) 3.6.2. Oxoácidos Son ácidos que tienen oxígeno. Tienen como fórmula general El Hidrógeno actúa con número de oxidación 1+ y el Oxígeno con 2-. El átomo central (X) son elementos no metálicos y algunos metales de transición (manganeso o cromo). Solo nombraremos los siguientes y con la nomenclatura tradicional: HNO₂→ ácido nitroso HNO₃→ ácido nítrico H₂SO₃→ ácido sulfuroso H₂SO₄→ ácido sulfúrico H₂CO₃→ ácido carbónico HIO→ ácido hipoyodoso HIO₂→ ácido yodoso HIO₃→ ácido yódico HIO₄→ ácido peryódico HClO→ ácido hipocloroso HClO₂→ ácido cloroso HClO₃→ ácido clórico HClO₄→ ácido perclórico HBrO→ ácido hipobromoso HBrO₂→ ácido bromoso HBrO₃→ ácido brómico HBrO₄→ ácido perbrómico