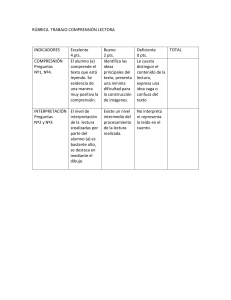
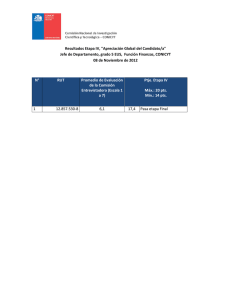
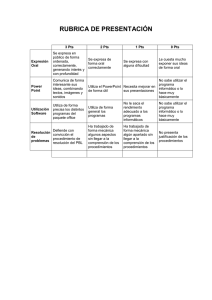
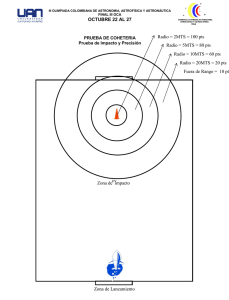
INSTITUTO TECNOLÓGICO “ESCUELA INDUSTRIAL SUPERIOR PEDRO DOMINGO MURILLO” QUÍMICA GENERAL I _____________________________________________________________________________ DOCENTE: Lic. FREDDY MAMANI GUTIERREZ APELLIDO PATERNO APELLIDO MATERNO FECHA: …………/…………/………PUNTAJE: NOMBRES PARALELO SEGUNDO PARCIAL: QCG-100 – FILA”B” 1. (15 pts) En un edificio de acondicionamiento de aire, se absorben desde el exterior 1000 litros de aire, a la temperatura de 11°C, presión de 755 torr y humedad relativa de un 20%. Dicho aire pasa a través de aparatos adecuados, donde la temperatura aumenta a 20°C y la humedad relativa a un 40%. Las presiones de vapor del agua a 11°C y 20°C son respectivamente, 9.8 torr y 17.5 torr. ¿Cuál será el volumen ocupado por dicha masa de aire, si la presión en el edificio es de 725 torr? Solución: Entrada del aire Salida del aire en el interior del edificio V= 1000 L T=20 °C+273=293 T= 11°C+273 Pv*=17.5 torr Pv*=9.8 torr 𝜑 = 40 % P= 755 torr P= 725 torr 𝜑 = 20 % V= ? Hallamos los moles que entran de aire seco: 𝑃𝑔𝑎𝑠ℎ𝑢𝑚𝑒𝑑𝑜 = 𝑃𝑎𝑖𝑟𝑒 + 𝑃𝑣 Con los moles de entrada hallamos el volumen de aire seco: 𝑃𝑔𝑎𝑠ℎ𝑢𝑚𝑒𝑑𝑜 = 𝑃𝑎𝑖𝑟𝑒 + 𝑃𝑣 𝑃𝑎𝑖𝑟𝑒 = 𝑃𝑔𝑎𝑠ℎ𝑢𝑚𝑒𝑑𝑜 − 𝑃𝑣 𝑃𝑎𝑖𝑟𝑒 = 𝑃𝑔𝑎𝑠ℎ𝑢𝑚𝑒𝑑𝑜 − 𝑃𝑣 𝜑= 𝜑= 𝑃𝑉 × 100 𝑃𝑉∗ 𝑃𝑣 = 𝑃𝑣 = 𝜑 × 𝑃𝑉∗ 20 × 9.8𝑡𝑜𝑟𝑟 = = 1.96 𝑡𝑜𝑟𝑟 100 100 𝑃𝑎𝑖𝑟𝑒 = 755 𝑡𝑜𝑟 − 1.96 𝑡𝑜𝑟𝑟 = 753.04 𝑡𝑜𝑟𝑟 𝑃∗𝑉 =𝑛∗𝑅∗𝑇 𝑛𝑎𝑖𝑟𝑒 = 𝑃∗𝑉 753.04 𝑡𝑜𝑟𝑟 × 1000 𝐿 = = 𝑡𝑜𝑟𝑟 ∗ 𝐿 𝑇∗𝑅 284 𝐾 ∗ 62.4 𝐾 ∗ 𝑚𝑜𝑙 𝑛𝑎𝑖𝑟𝑒 = 42.49 𝑚𝑜𝑙 𝑃𝑉 × 100 𝑃𝑉∗ 𝜑 × 𝑃𝑉∗ 40 × 17.5 𝑡𝑜𝑟𝑟 = = 7 𝑡𝑜𝑟𝑟 100 100 𝑃𝑎𝑖𝑟𝑒 = 725 𝑡𝑜𝑟𝑟 − 7 𝑡𝑜𝑟𝑟 = 718 𝑡𝑜𝑟𝑟 𝑃∗𝑉 =𝑛∗𝑅∗𝑇 𝑛∗𝑅∗𝑇 𝑃 𝑡𝑜𝑟𝑟 ∗ 𝐿 42.49 𝑚𝑜𝑙 × 62.4 × 293𝐾 𝐾 ∗ 𝑚𝑜𝑙 = = 718 𝑡𝑜𝑟𝑟 𝑉𝑎𝑖𝑟𝑒 = 𝑉𝑎𝑖𝑟𝑒 = 1082.04 INSTITUTO TECNOLÓGICO “ESCUELA INDUSTRIAL SUPERIOR PEDRO DOMINGO MURILLO” QUÍMICA GENERAL I _____________________________________________________________________________ 2. (15 pts) Hallar la presión absoluta del gas hidrogeno encerrado en el siguiente sistema que se encuentra en la ciudad de La Paz. Las densidades relativas de los líquidos son: gasolina 0.86; agua 1; aceite mineral 2.5 Datos: H = 20 cm = 200 mm Cambiamos de mm de gasolina a ¿? mmHg 𝜌𝑙𝑖𝑞 ∗ 𝐻𝑙𝑖𝑞 = 𝜌𝐻𝑔 ∗ 𝐻𝐻𝑔 𝐻𝐻𝑔 = 𝜌𝑙𝑖𝑞 ∗ 𝐻𝑙𝑖𝑞 0.86𝑔/𝑚𝐿 ∗ 200 𝑚𝑚 = = 𝜌𝐻𝑔 13.6 𝑔/𝑚𝐿 𝐻𝐻𝑔 = 12.647 𝑚𝑚𝐻𝑔 H = 15 cm = 150 mm Cambiamos de mm de agua a ¿? mmHg 𝜌𝑙𝑖𝑞 ∗ 𝐻𝑙𝑖𝑞 = 𝜌𝐻𝑔 ∗ 𝐻𝐻𝑔 𝐻𝐻𝑔 = 𝜌𝑙𝑖𝑞 ∗ 𝐻𝑙𝑖𝑞 1 𝑔/𝑚𝐿 ∗ 150 𝑚𝑚 = = 𝜌𝐻𝑔 13.6 𝑔/𝑚𝐿 𝐻𝐻𝑔 = 11.03 𝑚𝑚𝐻𝑔 H = 10 cm = 100 mm Cambiamos de mm de aceite mineral a ¿? mmHg 𝜌𝑙𝑖𝑞 ∗ 𝐻𝑙𝑖𝑞 = 𝜌𝐻𝑔 ∗ 𝐻𝐻𝑔 𝐻𝐻𝑔 = 𝜌𝑙𝑖𝑞 ∗ 𝐻𝑙𝑖𝑞 2.5 𝑔/𝑚𝐿 ∗ 100 𝑚𝑚 = = 𝜌𝐻𝑔 13.6 𝑔/𝑚𝐿 𝐻𝐻𝑔 = 18.38 𝑚𝑚𝐻𝑔 𝑃𝑔𝑎𝑠 = 𝑃𝑎𝑡𝑚 + 𝐻1 + 𝐻2 + 𝐻3 𝑃𝑔𝑎𝑠 = 495 𝑚𝑚𝐻𝑔 + 12.647𝑚𝑚𝐻𝑔 + 11.03𝑚𝑚𝐻𝑔 + 18.38 𝑚𝑚𝐻𝑔 𝑃𝑔𝑎𝑠 = 537.057 𝑚𝑚𝐻𝑔 INSTITUTO TECNOLÓGICO “ESCUELA INDUSTRIAL SUPERIOR PEDRO DOMINGO MURILLO” QUÍMICA GENERAL I _____________________________________________________________________________ 3. Considere la siguiente figura, en principio los tres gases se encuentran separados. si todo el sistema se estabiliza a 35°C cuando se abren las válvulas. Determine: a) (10 pts) Las presiones de parciales de cada gas b) (5 pts) La presión final del sistema c) (5 pts) La densidad de la mezcla gaseosa 𝑛= 𝑚 8.0 𝑔 = = 0.2 𝑚𝑜𝑙 𝑀 40 𝑔/𝑚𝑜𝑙 𝑛 = 0.5 𝑚𝑜𝑙 𝑃∗𝑉 =𝑛∗𝑅∗𝑇 𝑛𝐻𝑒 = 𝑃∗𝑉 300 𝑡𝑜𝑟𝑟 ∗ 5 𝐿 = = 0.078 𝑚𝑜𝑙 𝑡𝑜𝑟𝑟 ∗ 𝐿 𝑇∗𝑅 308 𝐾 ∗ 62.4 𝐾 ∗ 𝑚𝑜𝑙 𝑛𝐻𝑒 = 0.078 𝑚𝑜𝑙 𝑛 𝑇 = 𝑛𝐴𝑟 + 𝑛𝐶𝑂 + 𝑛𝐻𝑒 = 0.2 + 0.5 + 0.078 = 0.778 𝑚𝑜𝑙 𝑡𝑜𝑟𝑟 ∗ 𝐿 0.778 𝑚𝑜𝑙 ∗ 62.4 ∗ 308 𝐾 𝑛𝑇 ∗ 𝑅 ∗ 𝑇 𝐾 ∗ 𝑚𝑜𝑙 𝑃𝑇 = == = 1246.045 𝑡𝑜𝑟𝑟 𝑉 12 𝐿 𝑛𝐴𝑟 𝑛𝑇 𝑃𝑃𝐶𝑂 = 𝑃𝑃𝐻𝑒 = = 𝑃𝑃𝐴𝑟 𝑃𝑇 → 𝑃𝑃𝐴𝑟 = 𝑃𝑇 ∗𝑛𝐴𝑟 𝑛𝑇 = 1246.045 𝑡𝑜𝑟𝑟∗0.2 𝑚𝑜𝑙 0.778 𝑚𝑜𝑙 = 320.32 𝑡𝑜𝑟𝑟 𝑃𝑇 ∗ 𝑛𝐶𝑂 1246.045 𝑡𝑜𝑟𝑟 ∗ 0.5 𝑚𝑜𝑙 = = 800.8 𝑡𝑜𝑟𝑟 𝑛𝑇 0.778 𝑚𝑜𝑙 𝑃𝑇 ∗ 𝑛𝐻𝑒 1246.045 𝑡𝑜𝑟𝑟 ∗ 0.078 𝑚𝑜𝑙 = = 124.93 𝑡𝑜𝑟𝑟 𝑛𝑇 0.778 𝑚𝑜𝑙 𝑃∗𝑀 =𝜌∗𝑅∗𝑇 ̅ = 𝑀𝐴𝑟 𝑋𝐴𝑟 + 𝑀𝐶𝑂 𝑋𝐶𝑂 + 𝑀𝐻𝑒 𝑋𝐻𝑒 𝑀 ̅ = (40 𝑔/𝑚𝑜𝑙 ∗ 0.257) + (28 𝑔/𝑚𝑜𝑙 ∗ 0.643) + (2 𝑔/𝑚𝑜𝑙 ∗ 0.1003) = 28.69 𝑔/𝑚𝑜𝐿 𝑀 𝜌= ̅𝑡 1246.045 𝑡𝑜𝑟𝑟 ∗ 28.69 𝑔/𝑚𝑜𝑙 𝑃𝑇 ∗ 𝑀 = = 1.86 𝑔/𝐿 𝑡𝑜𝑟𝑟 ∗ 𝐿 𝑅∗𝑇 62.4 ∗ 308 𝐾 𝐾 ∗ 𝑚𝑜𝑙 INSTITUTO TECNOLÓGICO “ESCUELA INDUSTRIAL SUPERIOR PEDRO DOMINGO MURILLO” QUÍMICA GENERAL I _____________________________________________________________________________ 4. Sea la reacción: Cloruro cobaltoso + peróxido de sodio + hidróxido de sodio + agua → hidróxido cobaltico + cloruro de sodio a) (2 pts) Escribir las fórmulas de los reactivos y productos de la reacción b) (10 pts) Igualar por el método de ion electrón c) (2 pts) Indicar la reacción de oxidación d) (2 pts) Indicar la reacción de reducción e) (2 pts) Indicar el agente oxidante f) (2 cobaltoso pts) Indicar+el agente reductor Cloruro peróxido de sodio + hidróxido de sodio + agua → hidróxido cobaltico + cloruro de sodio CoCl2 + Na2O2 + NaOH + H2O → Co(OH)3 + NaCl Co2+→ Co3+ + 1e- // 2 Oxidación 2e- + 2 H2O + O21- → 4 OH- // 1 Reducción 2 Co2+ + 2e- + 2 H2O + O21- → 2 Co3+ + 2e- + 4 OH2 CoCl2 + Na2O2 + 2 NaOH + 2 H2O → 2 Co(OH)3 + 4 NaCl Agente oxidante: Na2O2 Agente reductor: CoCl2 5. (30 pts) Preguntas teóricas (De las exposiciones) a) Explique las reacciones involucradas en la obtención del acido nítrico b) Mencione tres aplicaciones para el uso del bicarbonato de sodio c) Realice el diagrama de producción para el cloruro de potasio d) Mencione tres usos para el almidón e) Cuáles son las principales características del hidróxido de sodio f) Cuales son los usos del peróxido de hidrogeno g) Mencione cinco aplicaciones para el uso del etileno h) Mencione 5 regiones de Bolivia donde se produce el gas propano i) Para que se usa la clorhexidina j) Cuál es la reacción de saponificación en la obtención de jabones