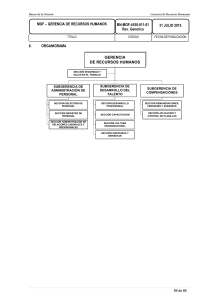
INSTRUCTIVO PARA ADOPCION DE GUIAS DE PRACTICA CLINICA FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación IN- AGC 1.0 1 VERSIÓN 1.0 GUIA DE ADMINISTRACIÓN PARENTERAL DE MEDICAMENTOS VERSION 2.0 San Juan de Pasto 2014 GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 2 GUIAS DE ADMINISTRACIÓN PARENTERAL DE MEDICAMENTOS PASTO SALUD E. S. E. Elaborado por: ALFONSO ANDRES MORENO LONDOÑO Químico Farmacéutico San Juan de Pasto 2014 GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 3 CONTENIDO RESOLUCION No. 0314 del 8 de Agosto de 2014 CONTROL DE CAMBIOS INTRODUCCIÓN 1. OBJETIVOS 1.1 OBJETIVO ETIVO GENERAL 1.2 OBJETIVOS ETIVOS ESPECIFICOS 2. ALCANCE 3. MARCO LEGAL 4. CONTENIDO 4.1 DEFINICIONES 5. INSTRUMENTO DE VERIFICACIÓN DE ADHERENCIA DE LAS GUÍAS DE ADMINISTRACIÓN PARENTERAL DE MEDICAMENTOS BIBLIOGRAFIA ANEXOS 4 6 7 9 9 9 10 11 12 12 15 16 GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 4 GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 5 GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 6 CONTROL DE CAMBIOS E: Elaboración del Documento M: Modificación del Documento X: Eliminación del Documento VERSIÓN 2.0 CONTROL DE CAMBIOS AL DOCUMENTO Aprobación y Adopción de las Guías de Administración de Medicamentos Parenterales para la Empresa Social del Estado Pasto Salud E. S. E. INFORMACIÓN DE CAMBIOS E M X X ACTIVIDADES O JUSTIFICACIÓN Justificación: Actualización de las Guías de Acuerdo a la evidencia soportada en los estudios de Utilización de medicamentos. ELABORÓ /ACTUALIZÓ Alfonso Andrés Moreno Londoño. Químico Farmacéutico ACTO ADMINISTRATIV O DE ADOPCIÓN Resolución 0314 del 8 de Agosto de 2014 GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 7 INTRODUCCIÓN Cuando tenemos la necesidad de administrar un medicamento para lograr una acción farmacológica, inmunológica o metabólica, o de establecer un diagnóstico médico, estamos buscando un efecto concreto (eficacia) sin la aparición de efectos secundarios indeseables (seguridad), es decir, un medicamento de calidad. Además, lo ideal sería que este efecto fuese constante e igual en todas las personas en las que administramos el medicamento medicamento sin embargo esto no es posible ya que interviene tervienen n factores fisiológicos o patológicos propios que influyen de manera decisiva. Las reacciones adversas a medicamentos, son una de las principales causas de ingreso y aumento de la estancia en las iinstituciones nstituciones prestadoras de salud. Desde el periodo comprendido entre 2001 y 2003, Colombia decide implementar una estrategia con el fin de determinar y recopilar información relacionada con las reacciones adversas a medicamentos o cualquier problema relacionado relac con ellos. Cada vez que se presentaba un problema relacionado con medicamentos, había la tendencia de culpar la calidad del medicamento, razón por la cual el Ministerio de Salud del año 2000, decide crear el INVIMA, como ente regulador y delegado del el ministerio para ejercer control sobre la producción, elaboración o fabricación de los medicamentos. Es por esto que se establece toda la normatividad concerniente en que los laboratorios farmacéuticos cumplan con un considerable número de requisitos para para conformar u obtener las Buenas Practica de Manufactura. Estos requisitos garantizan que se elaboren productos farmacéuticos con calidad, lo que entonces la calidad ya no sería un problema o una cuestión en duda a la hora de utilizar los medicamentos. Ell Ministerio de Salud y Protección Social, en sus variantes denominaciones durante el transcurrir de los años, decide poner en marcha y conforma el Programa Nacional de Farmacovigilancia y de igual forma las IPS y EPS, implementen Programas de Farmacovigilancia, Farmacovigilancia, con el fin de recopilar toda la información relacionada con todos los problemas relacionados con los medicamentos, enlazando la información a través de la Red Nacional de Farmacovigilancia. Es así como durante el transcurrir de este decenio de madurez ma de los programas, estos han generado gran cantidad de información a modo de conclusión respecto a los problemas relacionados con los medicamentos. Dentro de las conclusiones más importantes, se encuentra “la Inadecuada Utilización de los Medicamentos”. El análisis de los casos reportados, relacionados con cualquier problema relacionado con medicamentos ha llevado a concluir que existe una inadecuada GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 8 utilización de los medicamentos los que conlleva la presentación de Reacciones Adversas o Eventos Adversos a Medicamentos. La primera vez que se habló de seguridad con los medicamentos fue en 1960, cuando la OMS, genera alertas, relacionadas hacia la vigilancia intensiva de los medicamentos desde su fabricación hasta su comercialización y uso. De aquí nace Farmacovigilancia y todos los términos que esta trae consigo que no son más que una clasificación para definir las razones por las cuales se presenta el daño al paciente. Aunado a este esfuerzo de la OMS, surge el concepto de “la Seguridad del Paciente”, del cual la Farmacovigilancia, Tecnovigilancia y Reactivovigilancia complementan la gestión del riesgo en la prestación de los servicios de salud. De esta forma estas Guías de Administración de Medicamentos Parenterales, son una recopilación de la in información formación obtenida a través del análisis de todos los reportes de problemas relacionados con los diferentes medicamentos, se realizó una revisión bibliográfica de los diferentes medicamentos a través de base de datos de medicamentos, información relevante como estabilidad y aun mas importante la administración de estos medicamentos, dando como resultado estas guías, que le generan a los profesionales de la salud, la información exacta, precisa y confiable acerca de los medicamentos. En ultimas las Guías de Administración de Medicamentos Parenterales, se constituyen con una estrategia en la “Mejora Mejora de la Seguridad de los Medicamentos”. Siempre y cuando se tengan en cuenta todas las recomendaciones en ellas descritas acerca de la administración de los medicamentos. Las Guías, son uno de los aportes que realiza el Servicio Farmacéutico, dentro de la Política de Seguridad del Paciente. GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 9 1. OBJETIVOS 1.1 OBJETIVO GENERAL Estandarizar criterios para la administración parenteral de medicamentos, con el fin de mejorar la seguridad en la utilización de estos. 1.2 OBJETIVOS ESPECÍFICOS Disminuir la incidencia de eventos adversos a medicamentos derivados de una inadecuada utilización. Establecer barreras de seguridad, para minimizar el riesgo en la administración de medicamentos. Brindar la información relevante y de seguridad de cada uno de los medicamentos. Definir actividades ó parámetros a monitorizar durante la administración de medicamentos. GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 10 2. ALCANCE Este documento define los mecanismos, estrategias y barreras a tener en cuenta al momento de la administración parenteral de medicamentos, estas barreras deben tenerlas en cuenta todos los profesionales de la salud, desde el prescriptor hasta el que administra stra los medicamentos. GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 11 3. MARCO LEGAL DECRETO 2200 de 2005, por el cual se reglamenta el Servicio Farmacéutico y se dictan otras disposiciones. Este decreto tiene por objeto regular las actividades y/o procesos propios del Servicio Farmacéutico, entre las que se encuentra: Participar en la creación ación desarrollo de Programas relacionados con medicamentos y dispositivos médicos, especialmente los programas de Farmacovigilancia. DECRETO 1011 de 2006, por el cual se establece el Sistema Obligatorio de Garantía de la Calidad de la Atención en Salud Salud del Sistema General de Seguridad Social en Salud. RESOLUCIÓN 1043 de 2006, por medio de la cual se reglamenta el Sistema Único de Habilitación. RESOLUCIÓN 1403 de 2007, por la cual se adopta el Manual de Condiciones Esenciales y Procedimientos del Servicio Servicio Farmacéutico, dentro de este manual se reglamenta la implementación de Farmacovigilancia. (Cap III, Numeral 5). RESOLUCION 123 DE 2012 Adopta el Manual de Acreditación en salud Ambulatorio y Hospitalario de Colombia RESOLUCION 2003 DE 2014 2014, por ell cual se definen los procedimientos y condiciones que deben cumplir los prestadores de servicios de salud para habilitar los servicios y se dictan otras disposiciones. GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 12 4. CONTENIDO 4.1 DEFINICIONES Formas de administración parenteral: Los preparados para administración parenteral son formulaciones estériles acondicionadas en un envase apropiado y destinadas a ser inyectadas, implantadas o administradas por perfusión en el cuerpo humano. Estas prepara preparaciones ciones pueden ser soluciones y suspensiones en agua u otro vehículo apropiado, emulsiones acuosas u oleosas, polvos secos e implantes. Preparaciones inyectables de pequeño volumen: Son preparaciones de pequeño volumen de principio activo disuelto (solución), emulsionado (emulsión) o disuelto (dispersión) en agua o en un líquido no acuoso apropiado. Preparaciones inyectables para perfusión intravenosa: intravenosa Son soluciones o emulsiones acuosas de gran volumen, exentas de pirógenos, estériles e isotónicas con respecto a la sangre. No se les añade conservante, ya que por su gran volumen requieren gran cantidad de este y resultaría tóxico. Preparaciones para diluir previamente a la administración parenteral: parenteral Soluciones concentradas y estériles destinadas a ser inyectadas o administradas por perfusión tras ser diluidas en un líquido apropiado antes de su administración. Polvo para preparación inyectables extemporáneas: extemporáneas Son sustancias sólidas, estériles, dosificadas y acondicionamientos en recipientes defini definidos tras desecación y que en el momento de su administración deben mezclarse con un volumen definido del vehículo apropiado, dando lugar a soluciones o suspensiones uniformes que cumplan con los requisitos de los inyectables. Reconstitución: aplica para los los Polvos y/o Liofilizados inyectables, y se refiere a la adición de un solvente adecuado para facilitar la administración del medicamento, por lo regular los polvos cuando se reconstituyen disminuyen su estabilidad por lo que es necesario utilizarlo de fforma inmediata. Infusión Intravenosa Continua Continua:: es la administración de un medicamento, por vía intravenosa en un periodo comprendido a 24 horas. Infusión Intravenosa Intermitente: es la administración de un medicamento, por vía intravenosa, en tiempos específicos comprendidos en las 24 horas, es decir cada 6 horas, cada 8 horas, etc. GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 13 Administración Intravenosa Directa: (en bolo), es la administración de un medicamento que se real realiza iza directamente en vena, sin utilizar catéter, se administra el medicamento normalmente diluido en la misma jeringa de 10 ml, y se caracteriza por no demorar o requerir tiempo para la administración normalmente menos de 2 minutos. Estabilidad del Medicamento: Medicam es la propiedad físico--química de los medicamentos de conservar >90% de su efectividad terapéutica, posterior a su reconstitución, apertura y dilución en soluciones de gran volumen. Dilución: es la adición de un medicamento líquido o anteriormen anteriormente reconstituido, a un vehículo adecuado con el fin de disminuir su concentración, para facilitar la administración intravenosa. La dilución se utiliza mucho para disminuir el efecto irritante que poseen algunos medicamentos en su concentración inicial. resentación comercial de Solució Solución n Salina Normal al 0.9%, en Mini bolsas: presentación volúmenes que van desde los 25 ml, 50 ml y 100 ml. Mini Vía Flex: presentación comercial de Solución Salina Normal al 0.9%, en volúmenes de 25 ml, 50 ml y 100 ml, se diferencian de llas as mini bolsas, en que estos se presentan en un material más rígido pero flexible y en forma de botellas. Implantes o pellets: Son pequeños comprimidos estériles de tamaño pequeño y forma cilíndrica, apropiada para su implantación subcutánea. Una vez depositados ositados bajo la piel, se disuelven lentamente, liberando el principio activo de forma continuada durante un periodo de tiempo prolongado. Vías de Administración: Las tres vías principales para administración de preparaciones inyectables son la intraveno intravenosa sa (I.V.), la subcutánea (S.C) y la intramuscular (I.M). Existen otras vías menos utilizadas y que se reservan para patologías especiales o para obtener efectos localizados. Vía Intravenosa: La preparación se inyecta directamente en una vena, así el principio activo que es administrado en el torrente circulatorio no tiene que absorberse, esto permite obtener un efecto terapéutico muy rápido y concentraciones plasmáticas exactas ideal para ssimulaciones imulaciones de emergencia, el inconveniente es que una vez administrado, si hay reacción adversa no puede retirarse. Las venas más idóneas para esta vía son las de la región antecubital (frente al codo) son anchas y superficiales. Los preparados son por lo general de solución acuosa. Vía intramuscular: La preparación se inyecta en el interior de los músculos esqueléticos lo más alejado de los de los nervios y de los vasos sanguíneos. El efecto es menos rápido pero más duradero que la vía intravenosa. El depósito formado del fármaco en el lugar de administr administración ación debe absorberse antes de GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 14 llegar al torrente circulatorio, la velocidad de absorción puede variar. (Solución es más rápida que suspensión o emulsión, acuosa más rápida que oleosa). En adultos se inyecta en el cuadrante superior de la región glútea y en los niños en los músculos del muslo. Vía subcutánea: La inyección se efectúa en el tejido subcutáneo. El efecto es más lento que las dos vías anteriores. La absorción del fármaco es más lenta por estar menos vascularizado este tejido. Se inyecta en el espacio intersticial de los tejidos de la parte superior del brazo, la superficie anterior del muslo y en la porción inferior del abdomen. GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 15 5.. INSTRUMENTO DE VERIFICACIÓN DE ADHERENCIA DE LAS GUÍAS DE ADMINISTRACIÓN PARENTERAL DE MEDICAMENTOS. GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 16 BIBLIOGRAFIA • • • • • • • • • • • • • • • • • • Manual de Tecnología farmacéutica, Lozano Carmen, Córdoba Damián, Córdoba Manuel, Elservier 2012. Trissel LA, ed. Handbook of injectable drugs. 13th ed. Bethesda, MD: American Society of Hospital Pharmacists. 2004 Diccionario de Especialidades Farmacéuticas, Thompson – PLM. Edición 2005 Colombia. http://www.viha.ca/pharmacy/iv_monographs.htm. aminophylline rev. 2005. 2005 Consultada el 25 de Agosto de 2007. Aminofilina intravenosa para el asma grave aguda en niños mayores de dos años que usan broncodilatadores inhalados (Revisión Cochrane traducida) http://www.cochrane.org/reviews/es/ab001276.html. Fecha de consulta octubre 6 http://www.cochrane.org/reviews/es/ab001276.html. de 2007. MedSafe. New Zelanda and Medical Devices Safety. Information for Professional of Health. Aminophylline solution for injection,1 Ocuiber 2006. Consultada el 25 de Agosto de 2007. D. McAuley. Global RPH.com .The Clinicians Ulti Ultimate mate Reference. 2006. Consultada el 25 de Agosto de 2007. Zabalegui Yárnoz A; Mangues Bafalluy I. Administración de Medicamentos y Cálculo de Dosis. Elsevier Masson, 2005 Barcelona – España Diccionario de Especialidades Farmacéuticas, Thomson – PLM. Edición Edició 2004 Colombia. http://www.viha.ca/pharmacy/iv_monographs.htm. Ampicilin rev. 200 2005. Consultada el 14 de Octubre de 2007. D. McAuley. Global RPH.com .The Clinicians Ultim Ultimate ate Reference. 2006. Consultada el 16 de Ocubre de 2007. Phelps S, Hak E. Pediatric Inyectable Drug. The Teddy Bear Book. Eighth Edition. American society of Health – System Pharmacists. 2007. MedLinePlus. Un Servicio de la BIBLIOTECA NACIONALK DE MEDICINA DE EE.UU.Y LOS INSTITUTO NACIONALES DE SALUD. Inyección de Ampicilina sódica. Consultada 16 de Octubre del 2007. Phelps S. Hak E. Pediatric Injectable Drugs. Eighth Edition American Society of Health – System Pharmacists. 2007. Martinez I, Puigvemtós F. Guía de Administración de Medicamentos Vía Parenteral del Hospital de Son Dureta. Revisado Mayo 2003. Administration Guidelines for Parenteral Drug Therapy; Part II: Adult Patients Klaus J; Knodel L.1989. http://www.viha.ca/pharmacy/iv_monographs.htm. diazepam rev. jan 2001. 2001 Consultada 20 de agosto 2007. http://www.juntadeandalucia.es/servicioandaluzdesalud/hrs/enfermeria_2003/publi caciones/medicamentos. Consultada 20 de agosto 2007. Diccionario de Especialidades Farmacéuticas, Thomson – PLM. Edición 2005 Colombia. GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS • • • • • • • • • • • • • • • • • • • • • FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 17 Administración de Medicamentos por Vía Pa Parenteral. renteral. Servicio de Farmacia Hospital Universitario Son Dureta. Enero 2007. http://plm.wyeth.com.mx/prods/36521.htm. consultada 24 de agosto de 2007 http://plm.wyeth.com.mx/prods/36521.htm. GOMÉZ C, Ubier E. Grupo de Farmacovigilancia del Hospital Hospital Universitario San Vicente de Paúl. Guía para el Manejo de Dipirona en el Hospital Universitario San Vicente de Paúl Una Experiencia Exitosa en la racionalización del Uso. Boletín No. 10 de Farmacovigilancia. Octubre – Noviembre 2005. Centro de Información formación de Medicamentos. Universidad Nacional de Colombia Hospital Universitario de la Samaritana CIMUN – 06/07/07. Ficha Técnica del Medicamento. Interguías. www.sefh.es – 07/07/07 RODRÍGUEZ N, et al. Estabilidad y Compatibilidad del Metamizol en Jeringas y en Mezclas Intravenosas. Farmacia Hospitalaria 1999; 23: 103 – 108. Diccionario Guía Básica Farmacoterapéutica, Complejo Hospitario Univerairario Juan Canalejo. 5 Edición 2002. http://www.viha.ca/pharmacy/iv_monographs.htm. Phenytoin rev. 2003. 2003 Consultada el 25 de Agosto de 2007. Martinez I, Puigvemtós F. Guía de Administración de Medicamentos Vía Parenteral del Hospital de Son Dureta. Revisado Mayo 2003. p pág. 8. Administration Guidelines for Parenteral Drug Therapy; Part II: Adult Patients Klaus J; Knodel L.1989. http://www.viha.ca/pharmacy/iv_monographs.htm. metronid metronidazole azole rev. 2003. 2003 Consultada el 31 de Julio de 2007. http://www.viha.ca/pharmacy/iv_monographs.htm. gentamicim rev. 2007. 2007 Consultada el 14 de Octubre de 2007. MedSafe. New ew Zelanda and Medical Devices Safety. Information for Professional of Health. Gentamicin solution for Injection,14 October 2006. Consultada el 14 de Octubre de 2007. D. McAuley. Global RPH.com .The Clinicians Ultimate Reference. 2006. Consultada el 14 de Ocubre de 2007.Phelps S, Hak E. Pediatric Inyectable Drug. The Teddy Bear Book. Eighth Edition. American society of Health – System Pharmacists. 2007. http://www.viha.ca/pharmacy/iv_monographs.htm. Calcium Gluconate. rev.Jan 2002. Consultada el 10 de Junio de 2008. http://www.viha.ca/pharmacy/iv_monographs.htm. metoclopramide rev. 1998. http://www.viha.ca/pharmacy/iv_monographs.htm. Consultada el 3 de agosto de 2007. López Villarejo L., Ramos López E. Guía para la Administración Segura de Medicamentos. Hospital Universitario Reina Sofía. Dirección de Enfermería 2001 Martinez I, Puigvemtós F. Guía Guía de Administración de Medicamentos Vía Parenteral del Hospital de Son Dureta. Revisado Mayo 2003. pág. 8. Guía Básica Farmacoterapéutica, Complejo Hospitario Univerairario Juan Canalejo. 5 Edición 2002. Bennett PN, Brown MJ. Clinical Pharmacology. 9na ed. London: Churchill Livingstone; c2003. Capitulo 21, Cholinergic and antimuscarinic (anticholinergic) mechanisms and drugs; p. 433 433-446. Anatomical Therapeutic Chemical/Defined Daily Dose Index 2013. WHO Collaborating llaborating Centre for Drug Statistics Methodology [Base de datos en Internet]. GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS • • • • • • • • • • • FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 18 Oslo: Norwegian Institute of Public Health. [Fecha desconocida] - [citado 15-072013]. Disponible desde: http://www.whocc.no/atc_ddd_index/. Centro de Información online de Medicamentos de la AEMPS [Internet]. Madrid: Agencia Española de Medicamentos y Productos Sanitarios (ES). [Fecha desconocida] [citado 16-07-2013]. 2013]. Disponible desde: http://www.aemps.gob.es/cima/fichasTecnicas.do?metodo=detalleForm http://www.aemps.gob.es/cima/fichasTecnicas.do?metodo=detalleForm. Administration Guidelines for Parenteral Drug Therapy; Part II: Adult Patients Klaus J; Knodel L.1989. Diccionario de Especialidades Farmacéuticas, Tho Thomson – PLM. Edición 2003. Colombia http://www.viha.ca/pharmacy/iv_monographs.htm. http://www.viha.ca/pharmacy/iv_monographs.htm. Penicillin G sodium, Actaualizada 2007. Consultada el 3 26 de agosto de 2007. López Villarejo L., Ramos López E. Guía para la Administración Segura de Medicamentos. Hospital Universitario Reina Sofía. Dirección de Enfermería 2001 MedlinePlus. Servicio de la Biblioteca Nacional de Medicina de EE.UU y las Instituciones Nacionales de la la Salud. Documento actualizado 01/04/03. Consultada 25 de agosto de 2007. Goodman & Gilman. Las Bases Farmacológicas de la Terapèutica. Novena Edición. McGraw- HillHill Interamericana. Volumen II 1996. http://www.viha.ca/pharmacy/iv_monographs.htm. ranitidine rev. jan 2001. 2001 Consultada el 31 de Julio de 2007. http://www.viha.ca/pharmacy/iv_monographs.htm. viha.ca/pharmacy/iv_monographs.htm. Magnesium sulphate rev.Jan 2002. Consultada el 26 de Agosto de 2007. Duley L, Gülmezoglu AM, Henderson Henderson-Smart DJ. Sulfato de magnesio y otros anticonvulsivos en mujeres con preeclampsia (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, número 2, 2007. Oxford, Update Software Ltd. Disponible en: http://www.update-software.com. http://www.update software.com. (Traducida de The Cochrane Library, 2007 Issue 2. Chichester, UK: John Wiley & Sons, Ltd.). Rodríguez C; Garfias A. Farmacología para Enfermeras. Editorial McGraw-Hill McGraw Interamericana.2007 GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 19 ANEXOS Fichas de Productos GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 20 AMINOFILINA Clasificación Farmacológica Metilxantina Clasificación Terapéutica Broncodilatador Categoría de Riesgo en el Embarazo A Clasificación ATC R03D AO5 Clasificación Intramuscular: No es recomendado, produce dolor intenso a nivel local Intramuscular y necrosis Tisular y su absorción es irregular. NO ES RECOMENDABLE Intravenosa directa Intravenosa (SI NO SE HA TOMADO 48 HORAS ANTES) Infusión Intermitente Administración Infusión Continua Contraindicada en niños. En Adultos: usar 25 mg/mL sin diluir, velocidad máxima de administración 25mg/ minuto. En Pediatría: Administrar una dosis menor o igual de 25 mg/mL en 15 a 30 minutos, no exceder los 0.36 mg/Kg/min o 25 mg/min. La dosis es administrada cada 12 horas en neonatos y cada 4 a 6 horas en infantes y niños. En Adultos: diluir en 50 a 100 mL de solución compatibles compati e infundir sobre 20 a 30 minutos. En Pediatría: 1 – 25 mg/mL en soluciones compatibles. En Adultos: Adicionar 500 mg en 500mL de solución compatible e infundir a la velocidad de prescripción. Broncoconstricción en Adulto Adulto: Dosis de Mantenimiento Paciente Adulto no Fumador Paciente Mayor de 60 años con COR pulmonar Paciente con CHF o Enfermedad Hepática Paciente Joven Fumador (mg/kg/hora) 0.7 0.25 0.25 0.9 Broncoconstricción en Pediatría: Pediatría Dosis de Mantenimiento Paciente de 6 semanas a 6 meses Paciente de 6 meses a 1 año 1 a 9 años 9 a 12 años y jóvenes fumadores Mayor 12 años y no fumadores (mg/kg/hora) 0.5 0.6 - 0.7 1 – 1.2 0.9 0.7 GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 21 AMINOFILINA • Estabilidad Compatibilidad. Reacciones Adversas Parámetros a Monitorizar Precauciones especiales Preparar inmediatamente antes de administrar, no mezclar nunca en la misma jeringa dos medicamentos para su administración y no guardar la cantidad sobrante. • Las ampollas deben conservarse a temperaturas inferiores de 25 °C y protegidas de la luz. • A temperatura temperatura ambiente controlada es estable a 24 horas en Dextrosa en Agua Destilada al 5%, Solución Salina Normal al 0.9%, Lactato de Ringer. Soluciones Dextrosa en Agua Destilada al 5%, Solución Salina Compatibles Normal al 0.9%. Adrenalina, drenalina, amiodarona, acido ascórbico, Fármacos clorpromacina, ciprofloxacina, clindamicina, codeína, incompatibles diltiazem, dimenhidrinato, dobutamina, doxapram, eritromicina, micina, hidralazina, hidroxizina HCl, insulina, No se puede metadona, meticillina sódica, morfina sulfato, adicionar aminofilina noradrenalina acida tartrato, oxitetraciclina HCl, a una solución, pentazocina lactato, petidina HCl, fenitoína sódica, frasco, Buretrol que promazina HCl, prometazina HCl, ondansetron, contenga: tetraciclina HCl, vancomicina HCl, vitaminas del complejo B. • A nivel cardiovascular: cardiovascular: arritmias ventriculares y atriales (asociadas con niveles sanguíneos del medicamentos superiores a 110 mcmol/L mcmol o anormalidades cardiacas preexistentes), hipotensión y muerte (asociada con la administración IV rápida), palpitaciones, taquicardia sinusal, incremento de la velocidad del pulso, constricción periférica. • A nivel del Sistema Nervioso Central Central:: convulsiones convulsio focales o generalizadas (pueden aparecer sin o con otros signos de toxicidad), dolor de cabeza, nerviosismo, insomnio, irritabilidad. • A nivel gastrointestinal: gastrointestinal: anorexia, nauseas, vómito, malestar estomacal. • Debido a la amplia variedad de la respuesta existente entre pacientes la dosis inicial y de mantenimiento, individualizar la dosificación en la obtención de concentraciones séricas y la respuesta clínica. • En los niños con una exacerbación grave del asma añadir aminofilina aminofi intravenosa a los agonistas ß2 y a los glucocorticoides (con o sin anticolinérgicos) mejora la función pulmonar dentro de las seis horas de tratamiento. Sin embargo, no hay disminución manifiesta de los síntomas, el número de nebulizaciones y la duración duración de la estancia hospitalaria. No hay pruebas suficientes para evaluar la repercusión sobre la oxigenación, el ingreso en la UCIP y el uso de asistencia respiratoria mecánica • Utilizar con precaución en paciente ancianos con alteración de la depuración hepática. También vigilar el riesgo de toxicidad debido a enfermedades concomitantes y medicamentos. • En infantes neonatos o prematuros ya que la depuración se encuentra disminuida. • En las siguientes condiciones la depuración hepática hep se encuentra disminuida cirrosis hepática, falla cardiaca congestiva, episodios de febriles agudos, edema pulmonar agudo, enfermedad pulmonar obstructiva crónica, obstrucción pulmonar severa, neumonía. • En pacientes que se sospeche de poseer úlcera p péptica. éptica. GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS • Presentación FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 22 El tratamiento con aminofilina se asocia con un incremento significativo del riesgo de vómitos en niños. Inyecciones de Aminofilina de 240 mg en 10 mL, cada mL 24 mg de aminofilina (equivalente a 20.63 mg de teofilina). GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 23 AMPICILINA Clasificación Farmacológica Antibiótico Clasificación Terapéutica Betalactámico Categoría de Riesgo en el Embarazo B Clasificación ATC J01C A01 Clasificación Intramuscular Sí Intramuscular: ADULTOS: administrar en 3 a 5 minutos, concentración máxima 100 mg/mL, velocidad máxima de administración 100 mg/minuto. Intravenosa directa PEDIATRIA: 100 mg/mL. Dosis menores de 500 mg generalmente se administran en 3 a 5 minutos. No exceder 10 mg/Kg/minuto en infantes y niños. Intravenosa Infusión Intermitente Administración PEDIATRIA: dosis menores o iguales de 30 mg/mL en 10 a 15 minutos. Infusión Continua Estabilidad Compatibilidad. ADULTOS:: Diluir en 50 a 100mL de S.S.N 0.9% (preferiblemente) e infundir en 20 a 30 minutos. Concentración Máxima: 30 mg/mL. Velocidad máxima: 100 mg/ minuto. NO SE RECOMIENDA, ya que no se obtienen concentraciones sanguíneas elevadas. • Una vez preparado el vial administrar inmediatamente ya que el periodo de estabilidad es menor a una (1) hora a temperatura ambiente. • Volumen mínimo: la concentración no debe exceder los 30 mg/mL ya que la estabilidad es dependiente de la concentración. con • La estabilidad en Solución Salina Normal al 0.9% a temperatura ambiente es de 8 horas y menor de 24 horas cuando se conserva en refrigeración, en concentraciones de 30 mg/mL. • La estabilidad en Dextrosa en Agua Destilada al 5% es menor de 2 de horas oras a temperatura ambiente en concentraciones de 30mg/mL. Soluciones Compatibles Lactato de Ringer, Solución Salina Normal al 0.9%. Fármacos incompatibles No mezclar con otros medicamentos GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 24 AMPICILINA Reacciones Adversas Parámetros a Monitorizar Precauciones especiales Presentación Reacción de hipersensibilidad inmediata (anterior a 72 horas, frecuencia: 0,01%, manifestación: Urticaria precoz o anafilaxia) y retardada (frecuencia: 44 8%, manifestación: Rash cutáneo). Toxicidad hematológica: Neutropenia (1(1 4%), fundamentalmente con do dosis sis altas, que revierte al disminuir la dosis o suspender el tratamiento. Toxicidad renal: Nefritis intersticial (1-2%); (1 revierte al suspender el tratamiento. Toxicidad gastrointestinal, con preparados orales (2(2 5%) con dolor, náuseas, vómitos, diarrea. Di Diarrea arrea inespecífica relacionada con Clostridium difficile (1%). Toxicidad neurológica (rara): Convulsiones mioclónicas. Elevación ligera y transitoria de los niveles de fosfatasa alcalina y transaminasas. Flebitis, fiebre. Temperatura, sitio de la infusión, velocidad de administración, aparición de un rash. • Evitar la administración intravenosa rápida ya que puede precipitar convulsiones. • La ampicilina interfiere con la determinación de glucosa en orina (Clinetest, Solución Benedicts, Solución Fehligs). • Obtener una excelente historia clínica de alergias del paciente. • La ampicilina es significativamente más estable en Solución Salina Normal 0.9% que en Dextrosa Agua Destilada al 5%. • El volumen lumen de reconstitución puede variar dependiendo de la marca. • Saque la próxima dosis del refrigerador 1 hora antes de usarla; póngala en una zona limpia y seca y deje que tome temperatura ambiente. • No vuelva a congelar el medicamento una vez descongelado. • AMPICILINA GENFAR® inyectable de 500 mg, caja por 10 frascos, de 1.0 g, caja por 10 frascos. • AMPICILINA MK® Caja por 10 ampollas de 1 g. GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 25 DIAZEPAM Clasificación Farmacológica Benzodiazepina Clasificación Terapéutica Hipnótico, Sedante, Anticonvulsivante, miorrelajante. Categoría de Riesgo en el Embarazo D Clasificación ATC NO5B AO6 Clasificación Intramuscular: SÍ (para casos excepcionales ya que su absorción es errática) Intravenosa directa: Sí Administración Intravenosa: Sí En general la ampolla debe administrarse directamente, sin diluir y muy lentamente. Se recomienda no sobrepasar la velocidad de 5 mg por minuto en adultos; en niños debe administrarse en al menos 3 minutos. En caso de diluir la ampolla debe realizarse en una proporción de 1 ml de Valium y 1 ml de Agua Para Inyección o SF. (Si se diluye en proporciones más altas, ejemplo la ampolla de 2 ml de Valium en 10 ml- 50 ml de SF, se produce precipitación: La jeringa tiene un aspecto turbio y lechoso y no es recomendable administrarla). Infusión Intermitente: NO se recomienda Infusión Continua:: NO se recomienda • Estabilidad • • • Diazepam se une a algunos componentes de los plásticos del material usado en su administración y no es recomendable guardarlo preparado en jeringas. Sí la dilución es requerida, adicionar la solución del diluyente al diazepam, no el diazepam al diluyente. El Diazepam epam debe ser almacenado a temperatura controlada y protegida de la luz. En climas tropicales, la inyección de diazepam esta sujeto a decoloración por degradación debido a mecanismos oxidativos y hidrolíticos. Cuando el diazepam se conserva en jeringas pierde p actividad, se presume esto debido a la adsorción de la superficie de la jeringa. GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 26 DIAZEPAM Soluciones Compatibles Solución Salina Normal 0.9%. Fármacos Incompatibles NO se recomienda mezclar con otros medicamentos Compatibilidad. Reacciones Adversas Parámetros a Monitorizar Precauciones especiales Presentación Dolor en el sitio de la inyección, sensación de quemazón y eritema, somnolencia y sedación excesiva, ataxia, vértigo, dolor de cabeza, depresión, confusión, alteraciones de la memoria, hipotensión y bradicardia, alteraciones cardiacas asociada y depresión respiratoria, obstrucción parcial de las vías respiratorias con la administración intravenosa rápida del Diazepam, trombocitopenia, disfunción sexual en mujeres, pérdida de la audición, reacciones de hipersensibilidad. • Frecuencia respiratoria y cardiaca • Presión sanguínea • Proteger las ampollas de Diazepam de la luz. • Evitar extravasación o administración intraarterial. • Administrar en venas de gran calibre o bien a través del equipo de suero. • En pacientes con Miastenia Gravis la condición puede agravarse. • En pacientes ancianos o muy jóvenes. • En paciente con alteraciones respiratorias, renales o hepáticas Valium – Roche. Ampollas de 10 mg / 2 mL GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 27 DICLOFENACO Clasificación Farmacológica AINE Clasificación Terapéutica Antiartrítico. Categoría de Riesgo en el Embarazo Categoría B Clasificación ATC M01AB05 Clasificación Intramuscular: Sí.. 75 mg / 24 horas durante un período máximo de 2 días. Intravenosa directa Intravenosa Administración NO Infusión Intermitente NO RECOMENDABLE, En caso necesario diluir la dosis prescrita en 100-500 500 ml de SF o SG5%. Ver OBSERVACIONES. Infusión Continua NO RECOMENDABLE, En caso necesario diluir la dosis prescrita en 500 ml de SF ó SG5%. Administrar en 6-12 12 horas. Ver OBSERVACIONES. Observaciones: Dependiendo de la duración de la infusión que se realice, VOLTAREN* Solución inyectable, debe ser diluido en 100 a 500 ml de solución salina isotónica (solución de cloruro de sodio al 0.9%) o Dextrosa en Agua Destilada al 5%, en ambos casos, previamente amortiguada ortiguada con una solución inyectable inyectable de bicarbonato de sodio recién abierta, con un volumen volumen de 0.5 ml si la concentración de bicarbonato de sodio es de 8.4%, con un volumen de 1 ml si la concentración de bicarbonato de sodio es de 4.2% o con el volumen equivalente de acuerdo con una concentración diferente de bicarbonato de sodio. Estabilidad Sólo deben usarse soluciones claras, si se observan cristales o precipitación de la solución, no debe administrarse la infusión. Soluciones Compatibles D.A.D al 5%, S.S.N al 0.9%, Dextrosa en Solución Salina Normal al 0.9%, Solución Ringer, Lactato de Ringer. Fármacos incompatibles Evitar la mezcla con cualquier otro medicamento Compatibilidad. GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 28 DICLOFENACO Reacciones Adversas Parámetros a Monitorizar Precauciones especiales Presentación Dolor epigástrico, náuseas, vómitos, mitos, diarrea, calambres abdominales, dispepsia, flatulencia y anorexia, hemorragias gastrointestinales, gastrointesti estomatitis aftosa, glositis, lesiones esofágicas, estenosis intestinales por formación de “diafragmas”, “dia trastornos intestinales bajos como colitis hemorrágica inespecífica y exacerbación de la colitis ulcerosa o enfermedad de Crohn, estreñimiento y pancreatitis, cefalea, mareo o vértigo, somnolencia, trastornos de la sensibilidad, inclusive parestesias, trastornos de la memoria, desorientación, insomnio, insom irritabilidad, convulsiones, depresión, ansiedad, pesadillas, temblor, reacciones psicóticas, meningitis aséptica, trastornos de la visión (visión borrosa, diplopía), pérdida de la audición, audición, tinnitus, alteraciones del de gusto, eritemas o erupciones cutáneas, urticaria, erupciones bulosas, eccemas, eritema multiforme, síndrome de Stevens-Johnson, Stevens son, síndrome de Lyell (epidermólisis tóxica aguda), eritrodermia eritrodermia (dermatitis exfoliativa), caída del cabello, re reacción de fotosensibilidad; ensibilidad; púrpura, inclusive púrpura alérgica, edema, insuficiencia renal aguda, alteraciones urinarias como hematuria, proteinuria, nefritis intersticial, síndrome nefrótico y necrosis hematuria, papilar, aumento de los valores séricos de aminotransferasas, hepa hepatitis con o sin ictericia,hepatitis fulminante, reacciones de hipersensibilidad como asma, reacciones sistémicas anafilácticas/anafilactoides inclusive hipotensión, vasculitis, neumonitis, palpitación, dolor torácico, hipertensión e insuficiencia cardiaca congestiva, reacciones en el punto de la inyección intramuscular como dolor local y endurecimiento, abscesos locales y necrosis en el punto de la inyección intramuscular. • Es imprescindible una estrecha vigilancia médica en pacientes con síntomas indicativos de trastornos gastrointestinales o con historial que sugiere la presencia de úlcera gástrica o intestinal, pacientes con colitis ulcerosa o enfermedad de Crohn, así como en pacientes con disminución de la función hepática hepática. • Monitoreo hematológico en el tratamiento prolongado con Diclofenaco. • Se precaución del Diclofenaco en pacientes con asma bronquial. • No se recomienda su aplicación en niños • Las infusiones intravenosas deberán realizarse inmediatamente después de preparar las soluciones para la infusión. • No deberán conservarse las soluciones preparadas para infusión Voltaren – Novartis. Ampollas de 3 mL por 75 mg de diclofenaco. Diclofenaco – Gen Far. Ampollas de 75 mg / 3 mL. GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 29 DIPIRONA Clasificación Farmacológica Anti-inflamatorio inflamatorio no esteroideo (AINE) de la familia de las Pirazolonas. Clasificación Terapéutica Analgésico, antipirético y actividad antianti inflamatoria moderada. Categoría de Riesgo en el Embarazo No se recomienda su uso durante el primer y último trimestre de embarazo. Durante el segundo trimestre se utilizará una vez valorado el balance beneficio/riesgo Clasificación ATC N02BB Clasificación • • Administración • • • Estabilidad IV lenta o intramuscular profunda. Diluir 2 gramos en 50 mL. Dextrosa en Agua Destilada al 5 % y pasarlo en 10 minutos. La dosis máxima recomendada para la dipirona es de 1g. Cada 6 horas y la duración del tratamiento hasta por una semana. La dosis máxima a suministrar en niños es de 20 miligramos por kilogramos cada 6 horas. La ampolla de Lisalgil® (dipirona magnésica) tiene que ser calentada a temperatura corporal antes de ser inyectada. En un estudio se encontró que soluciones de dipirona magnésica al 40% (ampollas cargadas directamente en jeringas de polipropileno) y mezclas intravenosas diluidas al 2% y 4% con S.S.N 0.9% en bolsas Viaflex de PVC. Cada una de las soluciones se conservó a 10 y 25° 25°C, C, sin exponerlas a la luz, durante siete (7) días. Soluciones Compatibles Compatibilidad. Reacciones Adversas Fármacos incompatibles D.A.D 5%, S.S.N 0.9 % No mezclar en la jeringa con otros medicamentos, soluciones para nutrición parenteral, correctores del pH. Agranulocitosis (el riesgo de agranulocitosis es directamente proporcional al tiempo de administración y se asocia a 7000 casos documentados por año en el mundo), Anemia hemolítica, Anemia aplásica, Púrpura trombocitopénica, Shock anafiláctico, reacciones cutáneas severas, Hipotensión (con la administración oral y parenteral), Mareo, Cefalea, Náuseas, Vómitos, Irritación gástrica, Xerostomía, Broncoespasmo. GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 30 DIPIRONA • Parámetros a Monitorizar • • • Precauciones especiales • • • • • Presentación La inyección demasiado rápida es la causa más común de un descenso crítico de la tensión arterial y shock (en el caso de la dipirona magnésica) Durante su administración pueden aparecer nauseas, sofoco, palpitaciones, hipotensión, pero parece estar frecue frecuentemente en relación con la velocidad de infusión. El medicamento no debe ser administrado por más de una semana. Debe controlarse la función renal con creatinina al inicio del tratamiento y a la semana después de iniciado su uso. Usar con precaución en el primer trimestre del embarazo. La dipirona está contraindicada en niños menores de 3 meses de edad o 5 kilogramos de peso. Aunque está indicada en niños entre 3-11 11 meses no debe usarse inyectada (El uso en pediatría de los productos que contienen Dipirona está bajo la responsabilidad del especialista). Su uso es bajo estricta fórmula médica. Debe ser segunda elección en casos de dolor o fiebre moderados o severos que no han cedido a otras alternativas farmacológicas y no farmacológicas. Pacientes ancianos, pacientes con problemas cardiovasculares Dipirona ECAR: ECAR: Ampollas de 2 mL y 5 mL. Cada ampolla de contiene 0.5 gramos de dipirona por cada mililitro. Lisalgil: Ampollas de 2 g / 5 mL. Novalgina: Ampollas de 500 mg/2mL, 500 mg/mL. GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 31 FENITOÍNA Clasificación Clasificación Farmacológica Hidantoína Clasificación Terapéutica Anticonvulsivante Categoría de Riesgo en el Embarazo D Clasificación ATC N03A B02 Intramuscular Sí.. Pero no se recomienda por su absorción errática. Intramuscular: Intravenosa directa Administración Intravenosa Infusión Intermitente Infusión Continua Sí Adultos:: Velocidad Máx. 25 mg / minuto. Pediátricos: Velocidad Máx 1 mg / Kg / minuto o 25 mg / minuto. Neonatos: Velocidad Máx 1 mg/kg/min. Sí Adultos: Dosis hasta de 300 mg en 50 mL S.S.N. Dosis hasta de 300 a 1000 mg en 100 mL S.S.N. Dosis mayores de 1 g en 250 mL de S.S.N Concentración Máxima 10 mg / mL Infundir en 30 a 60 minutos Velocidad Máxima: 50 mg / minutos. Velocidad Máxima para pacientes de alto riesgo: 25 mg / minuto. Pediátricos: Velocidad Máxima: 1 mg / Kg / minuto 0 50 mg / min. Neonatos: Directa en 20 minutos. Velocidad Máxima: 1 mg / Kg / minuto. NO. Observaciones: Las dosis de mantenimiento se ajustarán según respuesta clínica del paciente y niveles plasmáticos, debido al estrecho margen terapéutico de este medicamento. GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 32 FENITOÍNA • Estabilidad Compatibilidad. Reacciones Adversas Parámetros a Monitorizar Precauciones especiales Presentación Las ampollas tienen que conservarse a temperatura ambiente controlada y protegidas de la congelación. • La Fenitoína Sódica es estable mientras este libre de bruma y precipitado. • Algunas veces puede aparecer de un color amarillo claro el cual no afe afecta la potencia de la Fenitoína. • La precipitación de la Fenitoína se puede presentar sí entra en contacto con medicamentos de naturaleza ácida o Dextrosa en Agua Destilada al 5% durante la administración. • Es estable en Solución Salina Normal al 0.9%, 0.45% y en Lactato de Ringer en concentraciones entre 1 – 10 mg / mL por cuatro (4) horas. • Preparar la solución en el momento justa antes de usar. Soluciones Solución Salina Normal ormal al 0.9%, Solución de Lactato de Compatibles Ringer. Fármacos Evitar la mezcla en solución con cualquier otro incompatibles medicamento Arritmias, colapso cardiovascular, cardiotoxicidad, cardiotoxicidad, muerte, bradicardia (responde a la disminución de la velocidad de infusión), hipotensión (puede estar relacionada con la administración rápida), somnolencia, nistagmo, vértigo, hiperglicemia, glicosuria, trombicitopenia, leucopenia, agranulocitosis, granulocitopenia, granulocitopenia, anemia megaloblástica, dolor e inflamación en el sitio de la inyección, necrosis tisular con o sin extravasación, rash, fiebre, lipis eritematoso. Monitorizar a través de electrocardiograma, frecuencia respiratoria, niveles de glucosa, medición de células sanguíneas, sitio de infusión, velocidad de administración. • Descartar sí hay precipitados o nubosidad. • Caminar con precaución después de la administración de Fenitoína • Mantener al paciente en condición supina por una hora después de la administración. • En pacientes con hipotensión e insuficiencia cardiaca grave. • Hipoalbuminemia. • En paciente con fallas renal o hepática. Epamin – Pfizer. Líquido parentético ampollas por 5 mL (50 mg / mL). GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 33 FUROSEMIDA Clasificación Clasificación Farmacológica Diurético Clasificación Terapéutica Diurético de Techo Alto Categoría de Riesgo en el C Embarazo Clasificación ATC C03C A01 Intramuscular: Sí, pero dado que el pH de la furosemida es 8 – 9.3 puede causar irritación. SÍ Intravenosa Directa ADULTOS:: 10mg/mL lentamente en 1 – 2 minutos, no exceder los 4 mg/minuto. Dosis mayores de 120 mg administrar por infusión. PEDIATRIA: sobre los 1 - 2 minutos; Velocidad Máxima: 0.5 mg/Kg/minuto. NEONATOS: sobre los 2 – 3 minutos SÍ Infusión Intermitente ADULTOS:: Diluir la dosis en 25 – 100 mL a una velocidad de 4mg/minuto. Administración PEDIATRIA: Administrar por Bomba de Infusión. Intravenosa NEONATOS: Infundir sobre los 20 minutos Sí Infusión Continua ADULTOS:: diluir para 0.2 – 5 mg/mL Sugerido: Adicionar 250 mg (25 mL) a 250 mL de solución compatible para 1 mg/mL. Máxima velocidad de administración 4mg/minuto. PEDIATRIA: 25mg/Kg diluir en 50mL con solución compatible. 1 mL/hora = 0.5 mg/kg/hora. NEONATOS: diluir la dosis en el volumen apropiado GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 34 FUROSEMIDA • Estabilidad Se recomienda proteger de la luz cuando el producto ha sido preparado en una jeringa. No utilizar la solución si presenta una coloración amarilla. Las ampollas deben conservarse a temperatura ambiente y evitando exponerse a la luz. Es estable en enveses de PVC y Viaflex. La refrigeración puede resultar en precipitación o cristalización del producto, oducto, sin embargo la resolución a temperatura ambiente no alteran la estabilidad del producto. • • • • • Soluciones Compatibles Dextrosa en Solución Salina Normal, Lactato de Ringer, Solución Salina Normal. Fármacos incompatibles No mezclar con otros medicamentos Compatibilidad. Cardiovasculares: Reacciones Adversas Parámetros a Monitorizar Precauciones especiales Presentación desequilibrio hidroelectrolítico, por ejemplo hiponatremia, hipocloremia, hipomagnesemia, hipocalcemia. Hipotensión ortostática. Gastrointestinal anorexia, constipación, calambres, diarrea, nauseas, Gastrointestinal: vómito. Sistema Nervioso Central Central: tinnitus pérdida de la audición asociada con la infusión rápida de grandes dosis Dermatológicas: Urticaria, dermatitis exfoliativa y prurito. Otras: Angioedema e hipotensión (rara), hiperglicemia, glucosuria. Peso, los niveles séricos de potasio, sodio, cloruro, calcio, glucosa, ácido úrico, BUN, conteo de plaquetas, audiometría, sitio de infusión, velocidad de administración. • • Proteger de la luz No mezclar con medicamentos de naturaleza ácida (tetraciclinas, epinefrina) o bases de sales básicas (anestésicos locales, meperidina, morfina). No usar en pacientes anúricos. Administrar lentamente para reducir ototóxicidad. • • • Ampollas de Laxis de 20 mg / 2 mL GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 35 GENTAMICINA Clasificación Clasificación Farmacológica Clasificación Terapéutica Categoría de Riesgo en el Embarazo Clasificación ATC Antibiótico Aminoglicósido D DO6A X07 Intramuscular Puede ser administrada por esta vía Intramuscular: Intravenosa directa NO SE RECOMIENDA, los aminoglicósidos se han administrada por vía intravenosa rápida de manera segura (sobre 3 a 5 minutos). Sin embargo la otoxicidad ha sido relacionada por picos de concentraciones séricas elevadas seguidas de administración del medicamento en bolos en adultos. ADULTOS:: Dosis hasta 1.5 mg/kg sin diluir durante 3 a 5 minutos. Intravenosa PEDIATRIA: No hay información nformación disponible. NEONATOS: No hay información disponible Administración ADULTOS:: Diluir en minibolsas de 20 a 100 mL e infundir en 30 minutos. Infusión Intermitente PEDIATRIA: de 10 mg/mL a 40 mg/mL (sin diluir propone el laboratorio) o diluir en un volumen apropiado de solución compatible e infundir en 20 a 30 minutos usando una velocidad de administración constante. NEONATOS: hasta 10 mg/mL e infundir en 30 minutos. Infusión Continua Estabilidad Compatibilidad. NO SE RECOMIENDA, hay mayor posibilidad de toxicidad por este método y su valor en comparación con la administración intermitente no ha sido determinado. Estable en solución a 24 horas en temperatura ambiente controlada. 4 días si se refrigera. Soluciones Compatibles Fármacos incompatibles En Dextrosa en Agua Destilada al 5%, Solución Salina Normal al 0.9%, Dextrosa en Agua Destilada al 5% en Solución Salina, Solución Ringer. La combinación con otros medicamentos debe ser evitada GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 36 GENTAMICINA Reacciones Adversas Parámetros a Monitorizar Precauciones especiales Presentación RENAL:: nefrotoxicidad relacionada con la dosis y el uso prolongado, usualmente reversibles. OTOXICIDAD: daño (auditiva y vestibular) sobre el nervio octavo par OTOXICIDAD: craneal,, asociada asoc ada con altas dosis en falla renal, puede ser reversible. Bloqueo neuromuscular (raro), el calcio puede ayudar a revertir la condición. Otras reacciones adversas descritas incluyen: incluyen: Letargo, confusión, depresión, alteraciones visuales, disminución del apetito, pérdida de peso, hipotensión, hipertensión; Salpullido, prurito, urticaria generalizada de la quema, el edema laríngeo, reacciones anafilactoides, fiebre y dolor de cabeza, náuseas, useas, vómitos, aumento de salivación, y estomatitis; Púrpura, pseudotumor cerebral, síndrome cerebral orgánico agudo, fibrosis pulmonar, alopecia dolor de las articulaciones, los trastornos transitorios hepatomegalia y esplenomegalia. • Monitorizar los niveles séricos de creatinina antes de iniciar la terapia y repetir dos semanas después de iniciada la terapia. • La medición de los niveles séricos de la gentamicina esta indicado. • La medición de la función auditiva y vestibular están indicadas. • En Pacientes ancianos la vida media se prolonga. Extender los tiempos de administración es mucho más conveniente que reducir la dosis. Monitorizar los niveles y la función renal. • Los riesgos relacionados con la toxicidad de los aminoglicósidos aparecen cuando se extiende su uso por más de 7 a 10 días. • En enfermedades neuromusculares, hipocalcemia e hipomagnesemia puede aparecer un efecto de bloqueo neuromuscular. • Los diuréticos del ASA pueden incrementar mentar el efecto de otoxicidad. Medicamentos nefrotóxicos (anfoterecina B, ciclofosfamida, AINEs) pueden incrementar el riesgo de nefrotoxicidad. Los agentes bloqueadores neuromusculares y los anestésicos generales pueden posiblemente prolongar ongar la acción y producir parálisis respiratoria. • La gentamicina es eliminada por hemodiálisis y diálisis peritoneal, por tanto requieren dosificación adicional post-diálisis. post GARAMICINA INYECTABLE® 40 mg, ampollas de 1 ml blister por 3, de 80 mg, ampollas de 2 ml, blister por 3. 120 mg, caja por 1 ampolla de 1,5 ml y de 160 mg, ampollas de 2 ml. GENTAMICINA MK Caja por 1 ampolla por 2 mL de 20 mg. Caja por 1 ampolla por 1 mL de 40 mg. Caja por 1 ampolla por 2 mL de 80 mg. mg Caja por 1 ampolla por 1.5 mL de 120 mg. Caja por 1 ampolla por 2 mL de 160 mg mg. GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 37 GLUCONATO DE CALCIO Clasificación Administración Estabilidad Compatibilidad. Reacciones Adversas Clasificación Farmacológica Electrolito Clasificación Terapéutica Tratamiento de la Hipocalcemia Categoría de Riesgo en el Embarazo C Clasificación ATC A12A A03 Intramuscular: Sí (sólo en adultos), pero no se recomienda que se administrar Intramuscular: por esta vía debido a la posibilidad de necrosis tisular, necrosis, abscesos. Adultos: Lentamente, velocidad máxima 2 mL/minuto. Intravenosa Pediátricos: Muy lentamente, Velocidad Máxima directa 1 mL/minuto Neonatos: sobre 10 minutos Adultos: diluir cada mililitro en al menos 5 mL de Solución Salina Normal al 0.9% o Dextrosa en Agua Destilada tilada al 5% e infundir sobre 10 a 30 minutos. Velocidad máxima 200mg/minuto Infusión Pediátricos: diluir cada mililitro en al menos 5 Intravenosa intermitente mL de Solución Salina Normal al 0.9% o de Dextrosa en Agua Destilada al 5% e infundir sobre 10 a 30 minutos. Velocidad máxima de 240mg/Kg/hora. 40mg/Kg/hora. Neonatos: Infundir sobre los 30 minutos. Adultos: Diluir en 500 a 1000 mL de solución compatible e infundir en la velocidad prescrita. Pediátricos: Diluir cada mililitro en al menos 5 Infusión mL de solución compatible e infundir a la continua velocidad prescrita. Neonatos: Diluir en solución compatible e infundir a la velocidad prescrita. • Las ampollas de Gluconato de Calcio debe ser almacenado a temperatura ambiente controlada. • Las soluciones del Gluconato de Calcio son estables a 24 horas cuando se conservan a temperatura ambiente controlada. • No debe utilizarse sí hay precipitado • La inyección de Gluconato de Calcio es una solución supersaturada que ha sido estabilizada por adición adici de D-sacarato sacarato de calcio. Solución Salina Normal 0.9%, Dextrosa en Soluciones Compatibles Solución Salina Normal 0.9%, Lactato de Ringer, Nutrición Parenteral. EVITAR LA MEZCLA EN SOLUCIÓN CON Fármacos incompatibles CUALQUIER OTRO MEDICAMENTO. MEDICAMENTO Cardiovasculares Vasodilatacion, disminución de la presión arterial, bradicardia, arritmias, síncope y paro cardíaco – se asocian con la inyección rápida del medicamento. Otros. Enrojecimiento, nrojecimiento, nauseas, vómito, somnolencia, sudoración, Extravasación puede causar necrosis y calcificación severa. Administrar a través de una pequeña aguja en una vena grande para evitar demasiado rápido aumento en el calcio sérico y/o extravasación, Sensaciones Sensaciones de hormigueo, una sensación de opresión o las olas de calor, calcio o yeso gusto. GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 38 GLUCONATO DE CALCIO Parámetros a Monitorizar Precauciones especiales Presentación • La dosificación del Gluconato de Calcio debe ser monitorizada por lo niveles de calcio. • El calcio es eliminado por por el riñón; sin embargo, su dosificación está basada en la concentración sérica de calcio, por lo tanto no es necesario realizar ajuste de dosis en la insuficiencia renal. • Sitio de la inyección. • Sí hay aparición de bradicardia sintomática la inyección debe de ser suspendida. • Numerosos reportes indican ocurrencia de irritación tisular y necrosis tras la administración intramuscular o subcutánea o extravasación en la administración intravenosa, especialmente en infantes y niñ niños. • La extravasación puede causar tisular lesión y necrosis. • Debido al riesgo de extravasación e infiltración, la infusión en venas pequeñas debe de ser evitada tanto como sea posible • No debe administrarse a través de catéter arterial por su potencial de vasoespasmos. • En intoxicación digitálica por el riesgo de producir arritmias. • Deshidratación. • Hipercalciuría, cálculos renales de calcio y sarcoidiosis. • Las ampollas de Gluconato de Calcio pueden contener aluminio como contaminante inherente. • Debido a las secuelas serias que se pueden presentar por la infiltración de soluciones que contienen calcio, la infusión por una línea central es preferida. Para infusión periférica, la concentración final debe ser limitada. Ampollas de Gluconato de Calcio en solución inyectable al 10% La dosis esta expresada como miligramos de una solución de gluconato de calcio del 10% (100mg/mL), lo cual provee aproximadamente 0.465 mEq/mL o 9.3 mg/mL de calcio elemental. 1 mEq es equivalente equivalente a 20 mg (calcio elemental). Dosificación HIPOCALCEMIA • Neonatos: 200 mg/Kg a 400 mg/Kg en infusión continua o dividido cada 6 a 8 horas. • Infantes y Niños: 200 a 500 mg/Kg en infusión continua o infusión intermitente cada 6 horas. • Adolescentes y Adultos: 10 – 15 gramos como infusión continua o dividida en cada 6 horas. HIPOCALCEMIA SECUNDARIA A INFUSIÓN DE PRODUCTOS SANGUÍNEOS • Neonatos: 98 mg/100 mL de citrato de sangre • Adultos: 500 mg/100 mL de citrato de sangre TETANIA • Neonatos: 500 mg/Kg cada 6 horas. • Niños: 100 – 140 mg/Kg dados cada 3 a 4 veces al día hasta que la tetania se resuelva. GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 39 METOCLOPRAMIDA Clasificación Farmacológica Clasificación Terapéutica Categoría de Riesgo en el Embarazo Derivado del ácido para paraaminobenzoíco (PABA) Antiemético, Agente procinético B Clasificación Clasificación ATC A03F AO1 Intramuscular: Si, inyección I.M profunda Intravenosa directa:: sin diluir, 10 mg en 1 a 2 minutos. Administración Intravenosa: Sí Infusión Intermitente: diluir la dosis en 50 a 100 ml en solución salina normal o Dextrosa en agua Destilada al 5% e infundir en 15 a 30 minutos. Infusión Continua: diluir en 100 a 500 ml de solución • • Estabilidad • • • • • La inyección de metoclopramida es una solución clara o incolora. Debe ser conservada a temperatura ambiente controlada y protegida de la congelación. El medicamento es estable en un rango de pH de 2 a 9. El medicamento es fotosensible y se recomienda proteger de la luz. La solución del medicamento puede ser almacenada en condiciones normales de luz y utilizarse dentro de las 24 horas. Las soluciones para infusión de metoclopramida han probado ser estables a temperatura ambiente por 48 horas, protegidas de la luz en las siguientes soluciones: uciones: Dextrosa en Agua destilada al 5% y Solución Salina Normal 0.9 %, lactato de Ringer. La infusión continua no es recomendable. Soluciones Compatibles Dextrosa en Agua Destilada al 5% y Solución Salina Normal 0.9 %, Lactato de Ringer Compatibilidad. Fármacos incompatibles Ampicilina, furosemida, gluconato de calcio, cloranfenicol, metotrexate, penicilina, bicarbonato de sodio, dexametazona. GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 40 METOCLOPRAMIDA Reacciones Adversas Parámetros a Monitorizar Inquietud, somnolencia, fatiga, dolor de cabeza, vértigo, ansiedad y agitación cuando se administra rápidamente. Reacciones de extrapiramidismo (especialmente acatisia), galactorrea, ginecomastia, constipación, diarrea, fiebre medica medicamentosa, mentosa, disfunción sexual, torsades de pointes. Reacciones de extrapiramidismo, evaluar la función del SNC, velocidad de administración • Precauciones especiales • • • • Presentación Proteger de la luz durante el almacenamiento y cuando se administra por infusión. Consultar la literatura antes de mezclar con otros medicamentos en la misma solución. Descartar la solución sí hay coloración amarillenta o formación de precipitados. En jóvenes no sobrepasar la dosis 0.5mg/Kg, suele ocurrir distonía aguda. En insuficiencia renal (aclaramiento de creatinina inferior a 40 mL/min), la dosis inicial será la mitad de la dosis habitual. Metoclopramida – Pentaccop Ampollas de 10 mg/2 ml. Plasil – Aventis ampollas de 2 ml con 10 mg de metoclopramida. GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 41 N- Butil Bromuro de Hioscina Clasificación Administración Clasificación Farmacológica Alcaloides semi sintéticos de la belladona Clasificación Terapéutica Antiespasmódicos Categoría de Riesgo en el Embarazo Como medida de precaución, es preferible evitar el uso de este medicamentos durante el embarazo y la lactancia Clasificación ATC A03BB01 Intramuscular: 1 o 2 ampollas (20 (20-40 40 mg) en el glúteo, aplicando la técnica de administración apropiada. Contraindicada en pacientes que están siendo tratados con medicamentos anticoagulantes anticoagulantes. Intravenosa directa: 1 ampolla (20 mg) diluida en 20 mL de solución compatible compatib mediante inyección intravenosa lenta, de 2 a 5 minutos. Esta administración si no se controla la velocidad o es rápida la administración há presentado muchas reacciones adversas. Infusión IV Intermitente: Administrarlo diluido en volúmenes grandes (50 mL. o 100mL.), en tiempos que oscilan entre 15-30minutos. 15 Estabilidad Compatibilidad. Reacciones Adversas Conservar a temperatura ambiente controlada entre 15°C -30°C y proteger de la luz solar directa. No necesita otras condiciones especiales de conservación. Para la infusión en 15-30 15 minutos no necesita protección de la luz. Soluciones Compatibles Se puede diluir con dextrosa 5% o con solución de cloruro de sodio al 0,9%. Fármacos incompatibles Levomepromazina Frecuencia no conocida (no puede estimarse a partir de los datos disponibles): shock anafiláctico (con posible desenlace letal), disnea, disponibles): urticaria, exantema, eritema, prurito. Frecuentes: taquicardia (6, 7), mareos, sequedad de boca (9), Frecuentes: hipotensión, Estreñimiento. GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 42 N- Butil, Bromuro de Hisocina Parámetros a Monitorizar Y Precauciones especiales Presentación Los pacientes a los que se les administre este medicamento deberán mantenerse bajo observación, especialmente, el ritmo cardíaco y presión sanguínea Debe utilizarse con precaución en condiciones caracterizadas por taquicardia, tales como tirotoxicosis e insuficiencia cardíaca donde se puede acelerar aún más el ritmo cardíaco. Debido a la posibilidad de una reducción en la sudoración, debe administrarse con precaución a pacientes pacientes con fiebre (8). No recomendado para niños. En caso de ser estrictamente necesario se debe dosificar al paciente así: 0,3 0,3-0,6 0,6 mg/kg de peso corporal, sin exceder en las 24 horas, 1,5 mg/kg. No debe administrarse de forma continuada o durante periodos period de tiempo largos sin conocer la causa del dolor abdominal 1. Buscapina® ampollas, presentación hospitalaria: caja por 100 ampollas en vidrio tipo A de 1mL cada una. 2. N-butil N butil bromuro de hioscina Vitalis® ampollas, presentación hospitalaria: caja por 100 ampollas ámbar de 1mL cada una. GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 43 PENICILINA G SÓDICA Clasificación Clasificación Farmacológica Betatalactámico Clasificación Terapéutica Antibiótico Categoría de Riesgo en el Embarazo B Clasificación ATC J01C E01 Intramuscular: SÍ,, la concentración a administrar debe ser de 100.000 unidades por mililitros, para evitar malestar en el paciente. Intravenosa directa: Sí Adultos: Diluir en 10 mL en soluciones compatibles. Velocidad máxima de administración 1 millón de unidades / minutos Pediátricos: No hay información disponible Neonatos: No hay información disponible. Infusión Intermitente: Sí Intravenosa: Sí Administración Adultos: Diluir en minibolsas olsas 50 - 100 mL en soluciones compatibles e infundir entre 20 y 60 minutos. Pediátricos: Administrar con bomba de infusión. Neonatos: Infundir en 30 monitos. Infusión Continua: Sí Adultos: Diluir en 500 – 1000 mL de solución compatible e infundir a Velocidad máxima de administración en 24 horas Pediátricos: No hay información disponible Neonatos: No hay información disponible. Observaciones: • Los viales pueden reconstituirse con Agua Estéril para Inyección, Solución Salina Normal 0.9% y Dextrosa en Agua Destilada. Preferiblemente con agua destilada se han presentado precipitaciones o saturación del medio con SSN 0.9% • El volumen de diluyente puede variar dependiendo la marca, observar en el vial el volumen exacto de dilución. • Antes de administrar este te medicamento, mire la solución cuidadosamente. Debe ser de color claro y libre de partículas flotantes. • Estabilidad • • En solución es estable hasta 24 horas a temperatura ambiente controlada o en refrigeración. El vial reconstituido es estable hasta 7 días cuando se conserva en refrigeración.(24 horas en ambientes no esteriles) Agitar hasta completar disolución GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 44 PENICILINA G SÓDICA Soluciones Compatibles Dextrosa en Agua Destilada al 5%, Solución Salina Normal 0.9 %. Fármacos incompatibles Anfotericina B, Bleomicina, cefalotina, clorpromacina, citarabina, heparina sódica, metilprednisolona, cloruro de potasio, prometazina, lincomicina, gentamicina. Compatibilidad. Reacciones Adversas Parámetros a Monitorizar Reacciones de hipersensibilidad (urticaria, anafilaxis), las reacciones hematológicas que se presentan con la Penicilina usualmente son reversibles (eosinofilia, anemia hemolítica, trombicitopenia, neutropenia y agranulocitosis. Puede aparecer hipernatremi hipernatremia a en pacientes que reciben grandes dosis. Nefritis interticial (fiebre, rash, eosinofilia, hematuria, azoemia) se inicia de 5 días a 5 semanas después de iniciada la terapia usualmente es reversible, se considera que se presenta por un fenómeno de hipersensibilidad. hipersensibilidad. Convulsiones, alteración de la conciencia ocurren cuando se administran altas dosis. Tromboflebitis, rash, dolor de cabeza, fiebre, mialgia, escalofríos, artralgias, taquicardia, hipotensión seguida de hipertensión. Temperatura y desarrollo de la infección, plaquetas y recuento células sanguíneas, antecedentes de alergia del paciente, sitio de inyección y velocidad de administración. • Precauciones especiales • • • Presentación En insuficiencia renal (aclaramiento de creatinina inferior a 50 mL/min) realizar ajuste de dosis. La Penicilina G Sódica contiene 1.68 mEq de sodio por cada millón de unidades. Cuando se administran altas dosis por vía intravenosa debe realizarse lentamente ente para evitar el desequilibrio electrolítico por el contenido de sodio. No se recomienda la administración intrarraquidea de ninguna penicilina ya que el antibiótico es un convulsivo potente por esa vía. Unicil 1 Mega – Uni Ltda. Frasco ampolla de 1.000.000 U.I de penicilina G Sódica. Penicilina G Sódica - Farmacológica S.A. Polvo estéril para reconstruir 1.000.000 U.I GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 45 RANITIDINA Clasificación Clasificación Farmacológica Antagonista de los receptores H2 Clasificación Terapéutica Antiulceroso Categoría de Riesgo en el Embarazo B Clasificación ATC Intramuscular: SIN DILUIR AO2B AO2 Intravenosa directa:: usualmente se utilizan 50 mg de ranitidina en 20 ml de solución compatible y administrar en 5 minutos. Administración Intravenosa: Sí Infusión Intermitente: 50 mg en 100 ml de solución compatible e infundir de 15 a 29 minutos. Infusión Continua: diluir 150 mg en 250 ml de solución compatible e infundir a 6.25 mg/hr para 24 horas. Bolos: no exceder los 10 mg por minuto • Estabilidad • • Las ampollas de ranitidina deben ser almacenadas en un rango de temperatura entre 4 °C y 30 °C, °C, protegidas de la luz y el calor excesivo. La solución es clara, su contenido puede adquirir una coloración ligeramente amarillenta que no afecta a la actividad del preparado, pero descartar sí la coloración es marcada. Estable en vidrio y viaflex. Soluciones Compatibles Dextrosa en Agua Destilada al 5%, Solución Salina Normal 0.9%, Dextrosa en Agua Destilada mas S.S.N 0.9%, Hartman. Compatibilidad. Fármacos Incompatibles Anfotericina, cefoxitina, ceftaxidima, cefamandol, clindamicina, diazepam, midazolam, fitomenadiona, atracurio, atracurio ácido etacrínico, norepinefrina, cefazolina, cefuroxima. GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 46 RANITIDINA Reacciones Adversas Malestar, vértigo, insomnio, visión borrosa, leucopenia reversible, pancitopenia, granulocitopenia, trombocitopenia, trombocitopenia, elevación de las enzimas hepáticas, ictericia, anafilaxis; rasquiña en el lugar de la inyección; edema angioneurótico; incremento de la creatinina sérica, bradicardia con la vía intravenosa, hepatotoxicidad, artralgia, hipotensión, taquicardia, pancreatitis, pancreatitis, bloqueo atrioventricular, asístole. • Parámetros a Monitorizar • • Precauciones especiales • • • • • Presentación Estimar el dolor abdominal. Indagar la presencia de sangre en el vómito, heces, aspirado gástrico. Se recomienda vigilar la AST y ALT para tratamiento de más de 5 días. Considerar la modificación de la dosis en pacientes con disfunción renal, hepática y en pacientes ancianos. Monitorizar la función hepática durante la terapia con ranitidina. La seguridad de la Ranitidina durante el embarazo no es está establecida. La respuesta sintomática no puede tomarse como exclusión para malignidad gástrica. Evitar la administración rápida debido a que puede causar bradicardia. No exceder 400mg/día Ranidin – Busie: 50 mg por cada 2 ml. Raniogas – Chalver: 50 mg por cada 2 ml Ranitidina – Gen Far: 50 mg por cada 2 ml. GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 47 SULFATO DE MAGNESIO Clasificación Clasificación Farmacológica Clasificación Terapéutica Categoría de Riesgo en el Embarazo Clasificación ATC Intramuscular : Sí Intravenosa directa Intravenosa Infusión intermitente Administración Infusión continua Estabilidad Electrolito/Mineral Anticonvulsionante Categoría A A06A D04 50 mg/Kg sobre los 10-20 10 minutos durante la resucitación. Puede ser administrado más rápidamente en torsades de pointes. Adultos: Diluir en 50 – 100 mL minibolsa e infundir sobre 5 min – 4 horas Niños y Neonatos Diluir en menos de 200 mg/mL. Infundir sobre 2 – 4 horas. Velocidad máxima 125 mg / Kg / mL o 0.5 mmol/Kg/horas Adultos: Diluir en 100 mL o más de solución compatible e infundir a la velocidad ordenada Niños y Neonatos Diluir en menos de 200 mg / mL e infundir a la velocidad ordenada Observaciones: • Las concentraciones de magnesio para administración IV no deben ser mayores de 20% y a una velocidad no mayor de 150 mg/min (1,5 mL de una concentración a 10% o su equivalente). • Para la administración intramuscular generalmente se usan concentraciones de 25 o 50%. • No usar si la solución esta turbia o contiene precipitado. • Si es posible, la administración de la infusión debe hacerse a través de una bomba; la velocidad máxima de infusión es de 150 mg/minuto • El goteo rápido causa sensación de calor. • El Sulfato de Magnesio es estable en solución compatible por 24 horas a temperatura ambiente controlada. • La refrigeración de las ampollas de sulfato de magnesio pueden precipitación o cristalización. Dextrosa en Agua Destilada al 5%, Solución Salina Normal 0.9%, Dextrosa en Solución Salina Normal Soluciones Compatibles 0.9%, Lactato de Ringer. Compatibilidad. EVITAR LA MEZCLA EN SOLUCIÓN CON CUALQUIER OTRO MEDICAMENTO Dolor en el punto de inyección, vasodilatación con sensación de calor. Hipermagnesemia potencialmente mortal en caso de insuficiencia renal grave o inyección demasiado rápida. Fármacos incompatibles Reacciones Adversas • • GUIA DE ADMINISTRACION PARENTERAL DE MEDICAMENTOS FORMULACION CODIGO VERSION PAG Subgerencia de Salud e Investigación GU-APM APM 1.0 48 SULFATO DE MAGNESIO • • Parámetros a Monitorizar • • • • • • Precauciones especiales • • • • • • • Presentación • Monitorizar los niveles séricos de magnesio y el estado del paciente para evitar sobredosis. Cuando el medicamento es utilizado como un agente tocolítico, requiere monitorización por toxicidad de magnesio y de los fluidos intravenosos para evitar una sobrecarga de circulatoria. Después del del uso en mujeres toxémicas dentro de las 24 horas después de parto, el recién nacido necesita observación de signos de intoxicación por magnesio, incluyendo neuromuscular y depresión respiratoria. Cuando el medicamento es dado en dosis repetidas, realizar la prueba de reflejo de rodilla antes de cada dosis. Sí hay ausencia descontinuar el magnesio, el uso del medicamento bajo estas condiciones tiene el riesgo de producir falla respiratoria. Durante la administración intravenosa monitorizar alteraciones cardiacas, car hipotensión, depresión respiratoria y depresión del sistema nervioso central. El magnesio se ha relacionado con interacciones medicamentosas con depresores del sistema nervioso central, bloqueadores neuromusculares y digoxina. Contraindicado en pacientes con bloqueo cardiaco o con daño cardiaco. Control de la presión arterial durante la inyección intravenosa y la infusión continúa. No administrar simultáneamente con una sal de calcio (por su efecto antagonista). No usar si la solución esta turbia o contiene precipitado. Si es posible, la administración de la infusión a través de una bomba; la velocidad máxima de infusión es de 150 mg/minuto. Administrar con precaución en alteraciones de la función renal y el trabajo de parto 2 horas antes del nacimiento. El bolo IV debe ser lento para evitar el paro cardiaco o respiratorio. Para calcular los gramos de magnesio en el porcentaje de una solución: X% = Xg/100mL (ejemplo: 25% = 25 G / 100 mL = 250 mg/mL). Las sales de calcio (gluconato de calcio) deben estar disponible como antídoto sí ocurre depresión cardiorrespiratoria o bloqueo cardiaco. Ampullec pak – solución inyectable al 20% - Ropsohn Therapeutics.