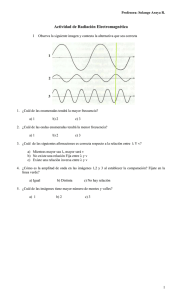
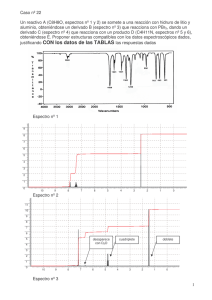
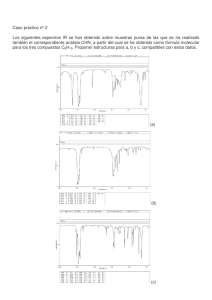
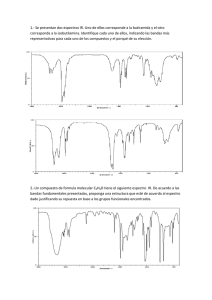
Pre informe Espectros de emisión y absorción El espectro de absorción de una materia muestra la fracción de la radiación electromagnética incidente que un material absorbe dentro de un rango de frecuencias. Es, en cierto sentido, el opuesto de un espectro de emisión. Cada elemento químico posee líneas de absorción en algunas longitudes de onda, hecho que está asociado a las diferencias de energía de sus distintos orbitales atómicos. Cada átomo es capaz de emitir o absorber radiación electromagnética, aunque solamente en algunas frecuencias que son características propias de cada uno de los diferentes elementos químicos. Si, mediante suministro de energía calorífica, se estimula un determinado elemento en su fase gaseosa, sus átomos emiten radiación en ciertas frecuencias del visible, que constituyen su espectro de emisión. Si el mismo elemento, también en estado de gas, recibe radiación electromagnética, absorbe en ciertas frecuencias del visible, precisamente las mismas en las que emite cuando se estimula mediante calor. Este será su espectro de absorción. Con la expresión Espectro Electromagnético, se designan las distintas clases de radiación electromagnética, clasificadas por su frecuencia o longitud de onda en una escala creciente. Diferencias entre el espectro de emisión y absorción-En el espectro de emisión el elemento emite su propia luz dejando un espacio grande en negro dependiendo de cual sea el elemento y su longitud de onda-El espectro de absorción: el elemento absorbe la luz mediante la onda de frecuencia que se acople a el, y las rayas en negro son diferentes longitudes de onda. Espectros de emisión. Espectros continuos. Los espectros continuos son los emitidos por sólidos, líquidos o gases densos que se encuentran a temperaturas elevadas, y están relacionados con la radiación del cuerpo negro. El aspecto cualitativo general de estos espectros es el mismo si las sustancias se encuentran a la misma temperatura, y sólo difieren en su intensidad relativa. Los espectros continuos casi no aportan información sobre la composición química de las sustancias. Espectro continuo Espectros de líneas Los espectros de líneas (figura 5-2) son característicos de la radiación emitida por los átomos de un gas rarificado, cuando se le excita por algún medio. Consisten de líneas brillantes sobre un fondo oscuro. Todos los espectros de líneas son distintos y en ese sentido son como “huellas digitales” atómicas. Si el gas es una combinación de varios tipos de átomos, entonces el espectro contendrá líneas características de cada elemento o tipo de átomo presente. Así el espectro de emisión es de gran importancia en la determinación de la composición química del gas analizado. Espectro de líneas ara hacer que un elemento cuya temperatura de evaporación es muy elevada se ponga en estado incandescente, generalmente se requiere colocarlo en una flama de alta temperatura (puede ser un mechero de Bunsen) o en la región donde se esté produciendo una descarga eléctrica. Los espectros obtenidos de esta manera tienen el aspecto de líneas superpuestas sobre un fondo brillante Espectro de líneas superpuesto a un fondo brillante. Espectros de bandas Los espectros de bandaconsisten en grupos de un gran número de líneas espectrales, las cuales están muy cercanas entre sí. Estos espectros en general están asociados con moléculas Espectro de bandas del hidrógeno molecular Constante de Ridberg Constante de Rydberg RH 10 9.73731568549(83) x 105 m-1 Constante característica de cada elemento en la descripción de las series espectrales. Su valor varía ligeramente con la masa del elemento considerado entre (1,096 7758 ± 0,000 0003) x 10-7m-1 para el hidrógeno y (1,097 3731 ± 0,000 0003) x 10-7 m-1 para los elementos más pesados.