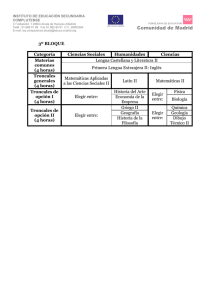
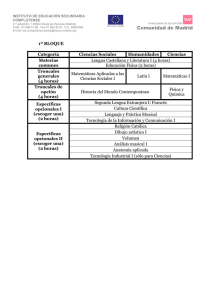
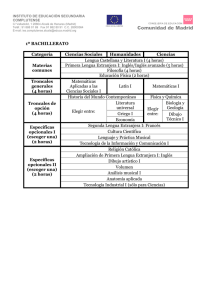
20170302172927 42223 C-B NOM 260 Células troncales y progenitoras-01 (1)
Anuncio

Análisis de impactos y evaluación Beneficio / Costo. Proyecto de Norma Oficial Mexicana NOM-260-SSA1-2015, para la disposición de células troncales y progenitoras con fines terapéuticos y de investigación. 23 de Agosto de 2016. Versión 1 1 Proyecto de Norma Oficial Mexicana NOM-260-SSA1-2015, para la disposición de células troncales y progenitoras con fines terapéuticos y de investigación. Análisis de impactos y evaluación Beneficio / Costo. MIR DE IMPACTO MODERADO. CONTENIDO Pág. I. PRESENTACIÓN. 3 II. OBJETIVO. 5 III. FORMATO DE MIR. Pregunta 8 MIR. ¿La propuesta de regulación contempla esquemas que impacta de manera diferenciada a sectores o agentes económicos? Pregunta 9 MIR. Proporcione la estimación de los costos y beneficios que supone la regulación para cada particular o grupo de particulares. 7 7 Pregunta 10 MIR. Justifique que los beneficios de la regulación son superiores a sus costos. 22 IV. CONCLUSIONES. 23 V. FUENTES DE INFORMACIÓN. 24 2 Proyecto de Norma Oficial Mexicana NOM-260-SSA1-2015, para la disposición de células troncales y progenitoras con fines terapéuticos y de investigación. I. PRESENTACIÓN. La NOM-260-SSA1-2015 busca evitar el uso de células troncales y progenitoras en forma indiscriminada en seres humanos, es necesario prevenir el riesgo sanitario a través de la regulación a los establecimientos autorizados para llevar a cabo las actividades correspondientes a la disposición de células troncales y progenitoras con fines terapéuticos y de investigación, estableciéndoles las condiciones sanitarias y de inocuidad requeridas y necesarias que permitan el control y vigilancia sanitaria de dicha actividad, así como los registros que demuestren la evidencia científica y manifiesta del origen, uso y manufactura de éstas células. Se requiere la regulación específica de los establecimientos autorizados con disposición de células troncales y progenitoras, a fin de proporcionar certeza sobre los requerimientos sanitarios por cumplir, así como llevar el control de procedimientos y verificar el cumplimiento a lo señalado. También se requiere que su uso y aplicación tenga evidencia científica para minimizar los riesgos sanitarios a la población y que se cuente con otro instrumento que transparente la regulación y supervisión de estos establecimientos y dé certeza jurídica. El Artículo 341 Bis párrafo segundo establece que: “La Secretaría de Salud emitirá las disposiciones que regulen tanto la infraestructura con que deberán contar los bancos de sangre que lleven a cabo actos de disposición y distribución de células troncales, como la obtención, procesamiento y distribución de dichas células”. Las células troncales son células no diferenciadas, es decir, no poseen características morfológicas que puedan distinguirlas del resto de las células al que pertenecen, tienen una alta capacidad de auto renovación, que pueden dar origen a uno o más tipos de células especializadas con funciones específicas en el organismo. La importancia de la investigación con células troncales está contribuyendo en la actualidad al desarrollo de nuevos enfoques para el tratamiento de trastornos hematológicos, neurológicos, autoinmunes y metabólicos (terapia celular). Este tipo de células son comúnmente llamadas células madre, son las proveedoras de nuevas células, cuando las células madre se dividen pueden hacer más de sí mismas o más de otros tipos de células. Por ejemplo, las células madre de la piel pueden formar más células madre de piel o pueden formar células diferenciadas de la piel que tienen trabajos específicos como producir el pigmento melanina. Actualmente, se ha generado gran expectativa y controversia alrededor de las células troncales. Cientos de laboratorios de todo el mundo están trabajando en la identificación, purificación, cultivo in 3 Proyecto de Norma Oficial Mexicana NOM-260-SSA1-2015, para la disposición de células troncales y progenitoras con fines terapéuticos y de investigación. vitro y la manipulación genética de células troncales provenientes de distintas fuentes. Muchas compañías biotecnológicas han puesto su atención en estas células. A pesar de la controversia que se ha generado con la investigación de este tipo de células y el desconocimiento que aún se tiene, sobre el alcance de su aplicación terapéutica, muchas empresas dedicadas al manejo e investigación de estas células ofrecen resultados prometedores para el tratamiento a diversas enfermedades como son: Diversos tipos de Leucemia. Síndromes Mielodisplásicos. Linfomas (cáncer en ganglios linfáticos). Diversos tipos de anemias. Trastornos en glóbulos rojos Anomalías plaquetarias hereditarias. Diversos tipos de trastornos Hereditarios del sistema Inmunológico. Trastornos Metabólicos Congénitos. Para el tratamiento de daño en: • Cartílago y hueso. • Células pancreáticas. • Daños vasculares. • Células cardiacas. • Regeneración neuronal. • Células pulmonares. • Enfermedades y lesiones en el sistema locomotor. • Enfermedades autoinmunes e inflamatorias. • Enfermedades cardio-vasculares. • Enfermedades gastrointestinales. • Cáncer (algunos tipos). • Diabetes. • Enfermedad injerto contra huésped postrasplante. 4 Proyecto de Norma Oficial Mexicana NOM-260-SSA1-2015, para la disposición de células troncales y progenitoras con fines terapéuticos y de investigación. • Enfermedades y lesiones neurológicas. • Heridas, quemaduras y úlceras. • Enfermedades de la superficie ocular. • Daño vascular. Es importante mencionar, que aunque la investigación de este tipo de células ha avanzado rápidamente en los últimos años, muchos de los tratamientos que se ofrecen para diversos padecimientos con este tipo de células, sus resultados no han sido comprobados científicamente en su totalidad, es por ello que la normativa mexicana pretende dar certidumbre en la aplicación terapéutica de las células troncales con la emisión de la presente Norma Oficial Mexicana, en la cual se establece que la aplicación terapéutica sólo podrá llevarse a cabo si cumple con un respaldo científico que garantice sus resultados. II. OBJETIVO Esta Norma tiene por objeto uniformar las actividades, criterios, estrategias y técnicas operativas en relación a la disposición de células troncales humanas. Su campo de aplicación se circunscribe al uso terapéutico de células troncales progenitoras hematopoyéticas y a la investigación de células troncales humanas no hematopoyéticas. Es de observancia obligatoria para todos aquellos establecimientos que realicen o participen en la disposición de células troncales humanas, así como a todo el personal profesional, técnico y auxiliar del área de la salud de los sectores públicos, social y privado que intervengan en dichos establecimientos. En la elaboración de la presente Norma participaron las siguientes unidades administrativas e instituciones: Secretaria de Salud. Centro Nacional de Excelencia Tecnológica en Salud. Centro Nacional de la Transfusión Sanguínea. Centro Nacional de Trasplantes. Comisión Coordinadora de los Institutos Nacionales de Salud y Hospitales de Alta Especialidad. Comisión Federal para la Protección contra Riesgos Sanitarios. Comisión Nacional de Protección Social en Salud. Seguro Popular. Dirección General de Educación y Calidad en Salud. 5 Proyecto de Norma Oficial Mexicana NOM-260-SSA1-2015, para la disposición de células troncales y progenitoras con fines terapéuticos y de investigación. Hospital General de México “Eduardo Liceaga”. Hospital Infantil de México “Federico Gómez”. Instituto Nacional de Cancerología. Instituto Nacional de Ciencias Médicas y Nutrición “Salvador Zubirán”. Instituto Nacional de Pediatría. Instituto Nacional de Perinatología. Instituto Nacional de Rehabilitación. Instituto Mexicano del Seguro Social. Banco Central de Sangre, Centro Médico Nacional La Raza. UMAE Hospital de Especialidades, Centro Médico Nacional La Raza. UMAE Hospital de Oncología, Centro Médico Nacional Siglo XXI. Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado. Centro Médico Nacional “20 de Noviembre”. Universidad Nacional Autónoma de México Instituto de Fisiología Celular. Instituto de Investigaciones Jurídicas. Establecimientos privados Abalat, S.A. de C.V., Ciudad de México. Banco de Cordón Umbilical BCU, Estado de México. Clínica Ruíz, Puebla, Puebla. Cordón Vital, Ciudad de México. Cryo-Cell de México, Guadalajara, Jalisco. Instituto de Medicina Regenerativa, Tijuana, Baja California. Sociedad de Beneficencia Española, Hospital Español. Ciudad de México. Store a Cell, Ciudad de México. 6 Proyecto de Norma Oficial Mexicana NOM-260-SSA1-2015, para la disposición de células troncales y progenitoras con fines terapéuticos y de investigación. III. FORMATO DE MIR Pregunta 8 MIR. ¿La propuesta de regulación contempla esquemas que impacta de manera diferenciada a sectores o agentes económicos? El anteproyecto no contempla esquemas que impacten de manera diferenciada a sectores o agentes económicos en los que resulte aplicable dicho anteproyecto, ya que sus disposiciones se aplicarán por igual a todos aquellos establecimientos que realicen o participen en la disposición de células troncales humanas, así como a todo el personal profesional, técnico y auxiliar del área de la salud de los sectores públicos, social y privado que intervengan en dichos establecimientos. Pregunta 9 MIR. Proporcione la estimación de los costos y beneficios que supone la regulación para cada particular o grupo de particulares. COSTOS. Según datos de la Comisión de Autorización Sanitaria de la COFEPRIS, se tienen 98 establecimientos autorizados a nivel nacional que están relacionados con los servicios de colecta y banco de células troncales, la clasificación es la siguiente: Tipo de establecimiento Bancos de Células Troncales y Progenitoras. Establecimientos para la atención médica que colectan sangre placentaria procedente de cordón umbilical. Los Bancos de Sangre que colectan células troncales mediante aféresis. Establecimientos para la atención médica que realicen el uso terapéutico de células troncales y progenitoras humanas, a través de un programa de trasplante. TOTAL Número de establecimientos 13 4 45 36 98 Fuente: Comisión de Autorización Sanitaria, COFEPRIS. 7 Proyecto de Norma Oficial Mexicana NOM-260-SSA1-2015, para la disposición de células troncales y progenitoras con fines terapéuticos y de investigación. Antes de cuantificar y detallar los costos relacionados con la implementación del proyecto de NOM, es conveniente aclarar algunos requisitos o especificaciones que pudieran interpretarse que generan un costo, sin embargo, no se genera. Respecto al requisito de tener licencia sanitaria, este se cumple actualmente, ya que con las modificaciones a los artículos 315 y 341 de la Ley General de Salud, publicadas en el Diario Oficial de la Federación el día 20 de abril de 2015, se decretaron nuevos establecimientos dedicados a la disposición de células troncales y se determinó que requerían una licencia sanitaria para su funcionamiento debido al análisis y manejo de riesgos que implican: Artículo 315. Los establecimientos de salud que requieren de licencia sanitaria son los dedicados a: I. II. III. IV. V. VI. … Los trasplantes de órganos, tejidos y células; Los bancos de órganos, tejidos no hemáticos y células; Los servicios de sangre; La disposición de células troncales, y Los establecimientos de medicina regenerativa. Artículo 341. La disposición de sangre, componentes sanguíneos y células troncales, con fines terapéuticos estará a cargo de los establecimientos siguientes: A) Los servicios de sangre que son: I. Banco de sangre; II. Centro de procesamiento de sangre; III. Centro de colecta; IV. Centro de distribución de sangre y componentes sanguíneos; V. Servicios de transfusión hospitalario, y VI. Centro de calificación biológica. B) Los que hacen disposición de células trocales que son: I. Centro de colecta de células troncales, y II. Banco de células troncales. C) Los establecimientos de medicina regenerativa. El pago respectivo se encuentra en la Ley Federal de Derechos en el artículo 195-A fracción X: Artículo 195-A.- Por las autorizaciones, permisos, solicitudes y registros que implican análisis y manejo de riesgos sanitarios para la salud pública, se pagará el derecho de riesgo sanitario conforme a las siguientes cuotas: I… X. Por la solicitud y, en su caso, expedición de la licencia sanitaria para establecimientos con disposición de órganos, tejidos y células; centros de colecta de células troncales; bancos de órganos, tejidos y células; bancos de células troncales o establecimientos de medicina regenerativa. …...............................................................................$10,239 Para la expedición de licencia sanitaria, la COFEPRIS requiere que los establecimientos tengan el personal, infraestructura, equipo, instrumental e insumos necesarios para la realización de los actos relativos. 8 Proyecto de Norma Oficial Mexicana NOM-260-SSA1-2015, para la disposición de células troncales y progenitoras con fines terapéuticos y de investigación. Es importante mencionar que en el proyecto de NOM existen diversos capítulos en los cuales se establecen criterios, estrategias y técnicas operativas, por lo que no se estima que se genere un costo, ejemplo de estos capítulos son: 8. Selección de donantes. 9. Colecta. 10. Procesamiento. 11. Determinaciones analíticas. De igual forma, hay disposiciones comunes como las establecidas en el “capítulo 7. Información y consentimiento informado” para los donantes y usuarios, las cuales no generan costo. Asimismo, en el capítulo 12 “Identificación de las unidades y de las muestras” se especifica la información que deberán contener las etiquetas de las unidades o muestras, lo que tampoco se considera que genere un costo debido a que actualmente se etiquetan y solo se va a modificar el contenido de la información. Para efectos del análisis no se considera que genere un costo el perfil académico y la experiencia laboral que se solicitan en el capítulo 5 “Responsables sanitarios y personal”, puesto que los requisitos son similares a los que actualmente tienen dichas personas en los establecimientos. Los costos identificados por la implementación del proyecto de NOM son los siguientes: 1) Costo por adecuación de infraestructura de los establecimientos. Actualmente los establecimientos tienen una construcción y ubicación que mantienen la seguridad de las operaciones, evitan la contaminación y garantizan el manejo ordenado de los procedimientos, también cumplen con la definición e identificación de las áreas o zonas de acceso restringido con la independencia necesaria, a fin de mantener la seguridad en la realización de los procedimientos. Como se comentó anteriormente, los establecimientos deben de tener la infraestructura necesaria y adecuada para la autorización de la licencia sanitaria, dichos requisitos son similares a los establecidos en el proyecto, no obstante, para efectos del estudio costo-beneficio se estimará que el 10% de los establecimientos pudieran resultar impactados y deberán realizar algunos gastos debido a las nuevas disposiciones o requisitos establecidos en el anteproyecto, este porcentaje equivale a 10 establecimientos. Se realizará el supuesto que los establecimientos impactados tendrán un gasto mínimo para adecuar las instalaciones, el cual se estima en $150,000. Considerando los 10 establecimientos anteriormente determinados, se estima un costo de $1,500,000 por adecuación de infraestructura. Cuadro 1. Estimación de costo por adecuación de infraestructura de los establecimientos. 9 Proyecto de Norma Oficial Mexicana NOM-260-SSA1-2015, para la disposición de células troncales y progenitoras con fines terapéuticos y de investigación. Número de establecimientos impactados 10 Costo por la adecuación de la infraestructura $150,000 Costo total $1,500,000 Fuente: área administrativa de la Secretaría General, COFEPRIS. 2) Costo por adquisición de mobiliario, equipo y su mantenimiento, reactivos e instrumental. Los establecimientos que actualmente están operando tienen el mobiliario, equipo, reactivos, instrumental e insumos necesarios para los procesos que realizan, sin embargo, debido a las nuevas especificaciones y disposiciones establecidas en el proyecto de NOM pudieran tener que adquirir algunos equipos (como refrigeradores, congeladores o equipos de almacenamiento con sistemas de alarmas) y mobiliario con características diferentes, así como instrumental e insumos diferentes. También se solicita en el proyecto de NOM contar con evidencia documental de la calibración, mantenimiento preventivo, correctivo e incluso predictivo de los equipos acorde con la naturaleza de los procesos que se llevan a cabo. Para efectos del estudio costo-beneficio se estimará que el 10% de los establecimientos, es decir 10, pudieran resultar impactados y realizarán un gasto en algunos equipos y mobiliario con características diferentes, así como instrumental e insumos diferentes a los que tienen actualmente. Se estimará un costo promedio de $1,000,000 por cada establecimiento. Derivado de lo anterior se estima un costo para los establecimientos por posible adquisición de mobiliario, equipo y su mantenimiento, reactivos e instrumental de $10,000,000. Cuadro 2. Estimación de costo por capacitación, actualización y evaluación del personal. Número de establecimientos impactados Costo por adquisición de mobiliario, equipo y su mantenimiento, reactivos e instrumental. Costo total 10 $1,000,000 $10,000,000 Fuente: área administrativa de la Secretaría General, COFEPRIS. 3) Costo por capacitación, actualización y evaluación del personal. En el proyecto se establece que el personal profesional, técnico y auxiliar de los establecimientos deberán contar con adiestramiento, capacitación y actualización en los actos de disposición de células que se realicen. Asimismo, deben tener programas de trabajo y enseñanza para la 10 Proyecto de Norma Oficial Mexicana NOM-260-SSA1-2015, para la disposición de células troncales y progenitoras con fines terapéuticos y de investigación. actualización, entrenamiento y evaluación de personal profesional, técnico y, en su caso administrativo, acorde con las actividades que realicen. Para efectos del estudio costo-beneficio se realizará el supuesto que las actividades de capacitación, actualización y evaluación del personal se realizará de manera anual y se plasmará en el programa de trabajo correspondiente, esto generará un costo promedio estimado de $100,000 y aplicará para el total de establecimientos autorizados, es decir, 98. Dentro de la capacitación que se le impartirá al personal se encuentra lo relativo a los aspectos técnicos, las buenas prácticas y los procedimientos de bioseguridad y aseguramiento de la calidad. Con base en lo anterior, se estima un costo total de $9,800,000 por capacitación, actualización y evaluación del personal de los establecimientos. Cuadro 3. Estimación de costo por capacitación, actualización y evaluación del personal. Número de establecimientos autorizados 98 Costo por capacitación, actualización y evaluación del personal. $100,000 Costo total $9,800,000 Fuente: área administrativa de la Secretaría General, COFEPRIS. 4) Costo por implementación del sistema de gestión de calidad. En el capítulo 21 del proyecto se menciona una disposición de tener implementado un Sistema de Gestión de Calidad acorde a las actividades que realicen los bancos y los establecimientos para la atención médica, el cual estará enfocado a dirigir y controlar la organización en lo relativo a la calidad y su documentación. Se contempla la elaboración de un Manual de Calidad, Procedimientos Normalizados de Operación, guías e instructivos que deberán difundirse a todo el personal, para efectos del estudio costo beneficio se estimará un costo promedio de $30,000 por cada establecimiento y aplicará al número total de unidades, ya que si bien actualmente tienen algún sistema de gestión implementado, no se garantiza que cumpla con todos las disposiciones establecidas en el proyecto. Por lo anterior, se estima un costo de $2,940,000 por implementación de un Sistema de Gestión de la Calidad para los establecimientos. 11 Proyecto de Norma Oficial Mexicana NOM-260-SSA1-2015, para la disposición de células troncales y progenitoras con fines terapéuticos y de investigación. Cuadro 4. Estimación de costo por implementación de un Sistema de Gestión de la Calidad. Número de establecimientos autorizados Costo por implementación del Sistema de Gestión de la Calidad Costo total 98 $30,000 $2,940,000 Fuente: área administrativa de la Secretaría General, COFEPRIS. El personal encargado de implementar el sistema de gestión será el responsable sanitario del establecimiento, por lo que no se prevé un costo adicional por contratación de personal. Respecto a la capacitación que se menciona que debe impartirse al personal para la aplicación de los procedimientos que integran el Sistema de Gestión de la Calidad, dicha capacitación ya se contempla en el costo no. 3 del presente estudio. Resumen de costos. Por lo anteriormente expuesto, para la implementación del Proyecto de Norma Oficial Mexicana NOM-260-SSA1-2015, para la disposición de células troncales y progenitoras con fines terapéuticos y de investigación, los establecimientos incurrirán en costos, los cuales generan un monto total de $24,240,000 y se detallan en el siguiente cuadro. Cuadro 5. Costo total por la implementación del proyecto de NOM-260-SSA1-2015. Concepto Monto 1) Costo por adecuación de infraestructura de los establecimientos. $1,500,000 2) Costo por adquisición de mobiliario, equipo y su mantenimiento, reactivos e instrumental. $10,000,000 3) Costo por capacitación, actualización y evaluación del personal. $9,800,000 4) Costo por implementación del sistema de gestión de calidad. $2,940,000 Costo total $24,240,000 Fuente: área administrativa de la Secretaría General, COFEPRIS. 12 Proyecto de Norma Oficial Mexicana NOM-260-SSA1-2015, para la disposición de células troncales y progenitoras con fines terapéuticos y de investigación. COSTO #1 Descripción: Costo por adecuación de infraestructura de los establecimientos. Grupo afectado: sector público y privado. Evaluación cuantitativa: actualmente los establecimientos tienen una construcción y ubicación que mantienen la seguridad de las operaciones, evitan la contaminación y garantizan el manejo ordenado de los procedimientos, también cumplen con la definición e identificación de las áreas o zonas de acceso restringido con la independencia necesaria, a fin de mantener la seguridad en la realización de los procedimientos. Los establecimientos deben de tener la infraestructura necesaria y adecuada para la autorización de la licencia sanitaria, dichos requisitos son similares a los establecidos en el proyecto, no obstante, para efectos del estudio costo-beneficio se estimará que el 10% de los establecimientos pudieran resultar impactados y deberán realizar algunos gastos debido a las nuevas disposiciones o requisitos establecidos en el anteproyecto, este porcentaje equivale a 10 establecimientos. Se realizará el supuesto que los establecimientos impactados tendrán un gasto mínimo para adecuar las instalaciones, el cual se estima en $150,000. Considerando los 10 establecimientos anteriormente determinados, se estima un costo de $3,450,000 por adecuación de infraestructura. Número de establecimientos impactados 10 Costo: $1,500,000 Costo por la adecuación de la infraestructura $150,000 Rango del costo: límite inferior. $1,350,000 Costo total $1,500,000 Rango del costo: límite superior.$1,650,000 13 Proyecto de Norma Oficial Mexicana NOM-260-SSA1-2015, para la disposición de células troncales y progenitoras con fines terapéuticos y de investigación. COSTO #2 Descripción: Costo por adquisición de mobiliario, equipo y su mantenimiento, reactivos e instrumental. Grupo afectado: sector público y privado. Evaluación cuantitativa: los establecimientos que actualmente están operando tienen el mobiliario, equipo, reactivos, instrumental e insumos necesarios para los procesos que realizan, sin embargo, debido a las nuevas especificaciones y disposiciones establecidas en el proyecto de NOM pudieran tener que adquirir algunos equipos (como refrigeradores, congeladores o equipos de almacenamiento con sistemas de alarmas) y mobiliario con características diferentes, así como instrumental e insumos diferentes. También se solicita en el proyecto de NOM contar con evidencia documental de la calibración, mantenimiento preventivo, correctivo e incluso predictivo de los equipos acorde con la naturaleza de los procesos que se llevan a cabo. Para efectos del estudio costo-beneficio se estimará que el 10% de los establecimientos, es decir 10, pudieran resultar impactados y realizarán un gasto en algunos equipos y mobiliario con características diferentes, así como instrumental e insumos diferentes a los que tienen actualmente. Se estimará un costo promedio de $1,000,000 por cada establecimiento. Derivado de lo anterior se estima un costo para los establecimientos por posible adquisición de mobiliario, equipo y su mantenimiento, reactivos e instrumental de $10,000,000. Número de establecimientos impactados 10 Costo: $10,000,000 Costo por la adecuación de la infraestructura $1,000,000 Rango del costo: límite inferior. $9,000,000 Costo total $10,000,000 Rango del costo: límite superior.$11,000,000 14 Proyecto de Norma Oficial Mexicana NOM-260-SSA1-2015, para la disposición de células troncales y progenitoras con fines terapéuticos y de investigación. COSTO #3 Descripción: Costo por capacitación, actualización y evaluación del personal. Grupo afectado: sector público y privado. Evaluación cuantitativa: en el proyecto se establece que el personal profesional, técnico y auxiliar de los establecimientos deberán contar con adiestramiento, capacitación y actualización en los actos de disposición de células que se realicen. Asimismo, deben tener programas de trabajo y enseñanza para la actualización, entrenamiento y evaluación de personal profesional, técnico y, en su caso administrativo, acorde con las actividades que realicen. Para efectos del estudio costo-beneficio se realizará el supuesto que las actividades de capacitación, actualización y evaluación del personal se realizará de manera anual y se plasmará en el programa de trabajo correspondiente, esto generará un costo promedio estimado de $100,000 y aplicará para el total de establecimientos autorizados, es decir, 98. Dentro de la capacitación que se le impartirá al personal se encuentra lo relativo a los aspectos técnicos, las buenas prácticas y los procedimientos de bioseguridad y aseguramiento de la calidad. Con base en lo anterior, se estima un costo total de $9,800,000 por capacitación, actualización y evaluación del personal de los establecimientos. Número de establecimientos autorizados 98 Costo: $9,800,000 Costo por capacitación, actualización y evaluación del personal. $100,000 Rango del costo: límite inferior. $8,820,000 Costo total $9,800,000 Rango del costo: límite superior.$ 10,780,000 15 Proyecto de Norma Oficial Mexicana NOM-260-SSA1-2015, para la disposición de células troncales y progenitoras con fines terapéuticos y de investigación. COSTO #4 Descripción: Costo por implementación del sistema de gestión de calidad. Grupo afectado: sector público y privado. Evaluación cuantitativa: en el capítulo 21 del proyecto se menciona una disposición de tener implementado un Sistema de Gestión de Calidad acorde a las actividades que realicen los bancos y los establecimientos para la atención médica, el cual estará enfocado a dirigir y controlar la organización en lo relativo a la calidad y su documentación. Se contempla la elaboración de un Manual de Calidad, Procedimientos Normalizados de Operación, guías e instructivos que deberán difundirse a todo el personal, para efectos del estudio costo beneficio se estimará un costo promedio de $30,000 por cada establecimiento y aplicará al número total de unidades, ya que si bien actualmente tienen algún sistema de gestión implementado, no se garantiza que cumpla con todos las disposiciones establecidas en el proyecto. Por lo anterior, se estima un costo de $2,940,000 por implementación de un Sistema de Gestión de la Calidad para los establecimientos. Costo: $2,940,000 Número de establecimientos autorizados Costo por implementación del Sistema de Gestión de la Calidad Costo total 98 $30,000 $2,940,000 Rango del costo: límite inferior. $2,646,000 Rango del costo: límite superior.$3,234,000 16 Proyecto de Norma Oficial Mexicana NOM-260-SSA1-2015, para la disposición de células troncales y progenitoras con fines terapéuticos y de investigación. BENEFICIOS Los grandes avances en la investigación de células troncales, para su aplicación terapéutica en el tratamientos de diversas enfermedades o padecimientos ha despertado la curiosidad no sólo de los investigadores en la materia, sino también de los pacientes con alguna afección en su organismo, ya que el campo de aplicación es muy prometedor para una gran cantidad de padecimientos para los cuales, la medicina convencional no ha tenido buenos resultados, como diversos tipos de leucemia, anemia, cáncer, enfermedades o deficiencias cardiovasculares, entre muchas otras más. Por consiguiente estos pacientes recurren a la aplicación de estos nuevos procedimientos a través del uso terapéutico de las células troncales. Sin embargo, aun cuando los avances en usos terapéutico de estas células es significativo y cada día se generan nuevas expectativas sobre su uso, la efectividad no ha sido comprobada por completo y sólo se reduce a una cantidad reducida de padecimientos como es el caso de algunos tipos de leucemia, en donde su efectividad cuenta con sustento científico suficiente. Es por ello que se tiene la necesidad de regular los procedimientos médicos en la utilización de estas células y que se genere una mayor certidumbre por parte de los usuarios o pacientes al momento de elegir esta nueva alternativa en el combate de algún padecimiento y disminuir la posibilidad que se presenten riesgos para su salud. 1) Ahorro a pacientes por prevenir terapias con células troncales en padecimientos no validados. Actualmente las personas que buscan una opción de curación porque acaban de recibir un diagnóstico grave que afecta considerablemente su estado de salud, suelen encontrarse en Internet con una variada oferta de terapias con células troncales, presentadas como milagrosamente exitosas para adultos y niños con cualquier enfermedad. Sin embargo, no en todos los padecimientos se pueden obtener buenos resultados. Por ahora, mientras la investigación avanza en el mundo, sus aplicaciones clínicas sin riesgos para la salud están limitadas, fundamentalmente, al tratamiento de enfermedades de la sangre, como las leucemias, algunas anemias, los linfomas o las alteraciones congénitas del metabolismo. Hay evidencias de los beneficios para el tratamiento de algunos problemas de la piel, como las quemaduras graves, y de la córnea. Pero para las enfermedades del cerebro, el corazón, el riñón, el páncreas, el hígado, los músculos, el pulmón y otros órganos, todavía no se tienen pruebas contundentes que funcionará el trasplante de células madre en los seres humanos. 17 Proyecto de Norma Oficial Mexicana NOM-260-SSA1-2015, para la disposición de células troncales y progenitoras con fines terapéuticos y de investigación. Dado el aumento de clínicas y médicos que están ofreciendo tratamientos universales para curar enfermedades graves y que no cuentan con respaldo científico suficiente, surge la necesidad de regular los establecimientos dedicados a estas terapias y su investigación, para que la población no se exponga a los riesgos del uso no probado de estas células y solo se apliquen las terapias que cuentan con el consenso científico internacional. Las células madre están emergiendo, algunos de los experimentos que se realizan en animales con células humanas no son aplicables por completo en los seres humanos porque el rechazo inmunológico es muy distinto. En varios países hay terapias que se están comercializando y ni siquiera han sido probadas en animales. Hasta ahora existen muy pocos tratamientos con células madre ampliamente aceptados. Al uniformar las actividades, criterios, estrategias y técnicas operativas en relación a la disposición de células troncales humanas, se esperaría que las personas interesadas en someterse a algún tipo de tratamiento con este tipo de células, cuenten con mayor certidumbre en la toma de su decisión, al saber que la terapia cuenta con respaldo científico y se conocen las ventajas y desventajas de su aplicación. Por otra parte los trasplantes de células troncales son eventos muy costosos y lo son en todo el mundo, no costosos por el hecho de la técnica del procedimiento, sino por todo su entorno, por las pruebas, los medicamentos de alta especialidad que se necesitan y por los equipos altamente complejos que se requieren. De lo anterior se desprendería el beneficio de evitar que pacientes con enfermedades de las cuales no se tiene la certeza que funcione la terapia celular, se sometan a estos tratamientos que además de tener altos costos monetarios pudieran generarles daños a su estado de salud delicado. Con la implementación de la NOM se podría generar un beneficio en forma de ahorro a ciertos pacientes por evitarles que tomen las terapias de células troncales en padecimientos en los que no se tiene la seguridad que funcionará de manera óptima, ya que las clínicas u hospitales no podrán ofrecer dichos tratamientos salvo que cuenten con el respaldo científico e internacional del uso de la terapia para el padecimiento focalizado. Actualmente la oferta de servicios de terapia para padecimientos a tratar es muy amplia, entre los que se encuentran: Diversos tipos de Leucemia. Síndromes Mielodisplásicos. Linfomas (cáncer en ganglios linfáticos). 18 Proyecto de Norma Oficial Mexicana NOM-260-SSA1-2015, para la disposición de células troncales y progenitoras con fines terapéuticos y de investigación. Diversos tipos de anemias. Trastornos en glóbulos rojos Anomalías plaquetarias hereditarias. Diversos tipos de trastornos Hereditarios del sistema Inmunológico. Trastornos Metabólicos Congénitos. Para el tratamiento de daño en: • Cartílago y hueso. • Células pancreáticas. • Daños vasculares. • Células cardiacas. • Regeneración neuronal. • Células pulmonares. • Enfermedades y lesiones en el sistema locomotor. • Enfermedades autoinmunes e inflamatorias. • Enfermedades cardio-vasculares. • Enfermedades gastrointestinales. • Cáncer (algunos tipos). • Diabetes. • Enfermedad injerto contra huésped postrasplante. • Enfermedades y lesiones neurológicas. • Heridas, quemaduras y úlceras. • Enfermedades de la superficie ocular. • Daño vascular. Como se observa, el campo de aplicación de las terapias con células troncales es muy amplio actualmente, lo que propicia que haya muchos pacientes potenciales que quieran someterse a este tipo de terapias aun cuando resultan costosas. Se realizará el supuesto que dentro del universo de pacientes que usan las terapias con células troncales, hay algunos que la utilizan actualmente sin tener la seguridad que les funcionará, ya que tienen padecimientos en los cuales los resultados aún no han sido comprobados y consensados internacionalmente, se estimará que estos pacientes realizan gastos mínimos aproximados de $100,000 por el pago de cada sesión de terapia y al menos se someten a 3 sesiones de acuerdo a las indicaciones que reciben en las clínicas tratantes, lo cual en realidad no les genera ninguna 19 Proyecto de Norma Oficial Mexicana NOM-260-SSA1-2015, para la disposición de células troncales y progenitoras con fines terapéuticos y de investigación. mejoría en su estado de salud e incluso pudieran llegar a presentarse complicaciones médicas después del uso de las terapias y necesitarían una consulta con su médico especialista que les atiende el padecimiento diagnosticado, además de análisis clínicos. Para efectos del estudio costo-beneficio se estima que se les podría evitar al menos a 100 pacientes que tomen este tipo de terapias que no les genera beneficio a su salud y por consecuencia evitarían el gasto en ellas. De acuerdo a la estimación mencionada anteriormente del costo mínimo promedio y el número mínimo de sesiones, equivalente a un gasto de $300,000 se estima que se genere un ahorro de $30,000,000 por prevenir terapias con células troncales en padecimientos no validados. Cuadro 6. Estimación de ahorro a pacientes por prevenir terapias con células troncales en padecimientos no validados. Estimación de pacientes que solicitan terapias con células troncales en padecimientos no validados Costo de 3 terapias de células troncales Estimación de ahorro por terapias de células troncales 100 $300,000 $30,000,000 Fuente: área administrativa de la Secretaría General, COFEPRIS. 20 Proyecto de Norma Oficial Mexicana NOM-260-SSA1-2015, para la disposición de células troncales y progenitoras con fines terapéuticos y de investigación. BENEFICIO CUANTIFICABLE #1 Descripción: Ahorro a pacientes por prevenir terapias con células troncales padecimientos no validados. en Grupo Beneficiado: población en general. Evaluación cuantitativa: con la implementación de la NOM se podría generar un beneficio en forma de ahorro a ciertos pacientes por evitarles que tomen las terapias de células troncales en padecimientos en los que no se tiene la seguridad que funcionará de manera óptima, ya que las clínicas u hospitales no podrán ofrecer dichos tratamientos salvo que cuenten con el respaldo científico e internacional del uso de la terapia para el padecimiento focalizado. Dentro del universo de pacientes que usan las terapias con células troncales, hay algunos que la utilizan actualmente sin tener la seguridad que les funcionará, ya que tienen padecimientos en los cuales los resultados aún no han sido comprobados y consensados internacionalmente, se estimará que estos pacientes realizan gastos mínimos aproximados de $100,000 por el pago de cada sesión de terapia y al menos se someten a 3 sesiones de acuerdo a las indicaciones que reciben en las clínicas tratantes, lo cual en realidad no les genera ninguna mejoría en su estado de salud e incluso pudieran llegar a presentarse complicaciones médicas después del uso de las terapias y necesitarían una consulta con su médico especialista que les atiende el padecimiento diagnosticado, además de análisis clínicos. Para efectos del estudio costo-beneficio se estima que se les podría evitar al menos a 100 pacientes que tomen este tipo de terapias que no les genera beneficio a su salud y por consecuencia evitarían el gasto en ellas. De acuerdo a la estimación mencionada anteriormente del costo mínimo promedio y el número mínimo de sesiones, equivalente a un gasto de $300,000 se estima que se genere un ahorro de $30,000,000 por prevenir terapias con células troncales en padecimientos no validados. Beneficio: $30,000,000 Estimación de pacientes que solicitan terapias con células troncales en padecimientos no validados Costo de 3 terapias de células troncales Estimación de ahorro por terapias de células troncales 100 $300,000 $30,000,000 Rango del beneficio: límite inferior. $ 27,000,000 Rango del beneficio: límite superior.$33,000,000 Importancia: Alta 21 Proyecto de Norma Oficial Mexicana NOM-260-SSA1-2015, para la disposición de células troncales y progenitoras con fines terapéuticos y de investigación. Pregunta 10 MIR. Justifique que los beneficios de la regulación son superiores a sus costos. Los costos estimados por la implementación del presente anteproyecto de norma ascienden a $24,240,000 mientras que el monto de los beneficios cuantificables a $30,000,000 por lo que la razón de beneficios entre costos es de 1.23. $30,000,000 $24,240,000 = 1.23 La diferencia entre los beneficios esperados y los costos es de $5,760,000 que valuado en un horizonte de cinco años a partir del año 2017, usando la tasa de descuento del 10% propuesta por la Secretaría de Hacienda y Crédito Público, produce un Valor Actual Neto del Anteproyecto favorable de $24,018,423. t=n FEt VPN = ∑ (1+r)t t=0 FEt es el flujo de efectivo, en este caso el beneficio esperado, en cada periodo de tiempo “T”. r es la tasa de descuento o el costo de oportunidad del dinero. n es el número de años del horizonte de evaluación menos 1. ∑ es la sumatoria del valor presente de los flujos de efectivos descontados. Cuadro 7. Estimación de beneficio para 5 años a valor presente neto en pesos. Año Ahorro 2017 $5,760,000 2018 $5,236,363 2019 $4,760,330 2020 $4,327,573 2021 $3,934,157 Beneficios a 5 años $24,018,423 Fuente: área administrativa de la Secretaría General, COFEPRIS. 22 Proyecto de Norma Oficial Mexicana NOM-260-SSA1-2015, para la disposición de células troncales y progenitoras con fines terapéuticos y de investigación. IV. CONCLUSIONES. La presente norma tiene por objeto uniformar las actividades, criterios, estrategias y técnicas operativas en relación a la disposición de células troncales humanas. Su campo de aplicación se circunscribe al uso terapéutico de células troncales progenitoras hematopoyéticas y a la investigación de células troncales humanas no hematopoyéticas. Es de observancia obligatoria para todos aquellos establecimientos que realicen o participen en la disposición de células troncales humanas, así como a todo el personal profesional, técnico y auxiliar del área de la salud de los sectores públicos, social y privado que intervengan en dichos establecimientos. Por la implementación del Proyecto de NOM-260-SSA1-2015 los establecimientos incurrirán en un costo total de $24,240,000 el cual está conformado por los siguientes costos: adecuación de infraestructura de los establecimientos; adquisición de mobiliario, equipo y su mantenimiento, reactivos e instrumental; capacitación, actualización y evaluación del personal; implementación del sistema de gestión de calidad. Dado el aumento de clínicas y médicos que están ofreciendo tratamientos universales para curar enfermedades graves y que no cuentan con respaldo científico suficiente, surge la necesidad de regular los establecimientos dedicados a estas terapias y su investigación, para que la población no se exponga a los riesgos del uso no probado de estas células y solo se apliquen las terapias que cuentan con el consenso científico internacional. Hasta ahora existen muy pocos tratamientos con células madre ampliamente aceptados. De lo anterior se desprendería el beneficio de evitar que pacientes con enfermedades de las cuales no se tiene la certeza que funcione la terapia celular, se sometan a estos tratamientos que además de tener altos costos monetarios pudieran generarles daños a su estado de salud delicado, con lo que se generaría un beneficio en forma de ahorro por evitarles que tomen las terapias de células troncales en padecimientos en los que no se tiene la seguridad que funcionará de manera óptima, ya que las clínicas u hospitales no podrán ofrecer dichos tratamientos salvo que cuenten con el respaldo científico e internacional del uso de la terapia para el padecimiento focalizado. Del análisis se estima un beneficio cuantificable en forma de ahorro de $30,000,000 por prevenir terapias con células troncales en padecimientos no validados. La relación de los beneficios entre los costos y beneficios es de 1.23 y el beneficio total estimado a 5 años, con el cálculo del valor presente neto, genera un monto de $24,018,423. 23 Proyecto de Norma Oficial Mexicana NOM-260-SSA1-2015, para la disposición de células troncales y progenitoras con fines terapéuticos y de investigación. Bajo los supuestos mencionados, los beneficios son superiores a los costos por lo que se concluye que el Proyecto de Norma Oficial Mexicana NOM-260-SSA1-2015, para la disposición de células troncales y progenitoras con fines terapéuticos y de investigación, es económica y socialmente rentable. V. FUENTES DE INFORMACIÓN. Centro Nacional de la Transfusión Sanguínea. Comisión de Autorización Sanitaria, COFEPRIS. Comisión de Operación Sanitaria, COFEPRIS. Ley Federal de Derechos. Ley General de Salud. Organización Mundial de la Salud Organización Panamericana de la Salud. Reglamento de la Ley General de Salud en Materia de Investigación para la Salud. 24