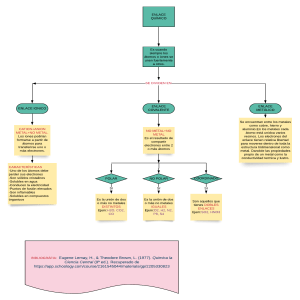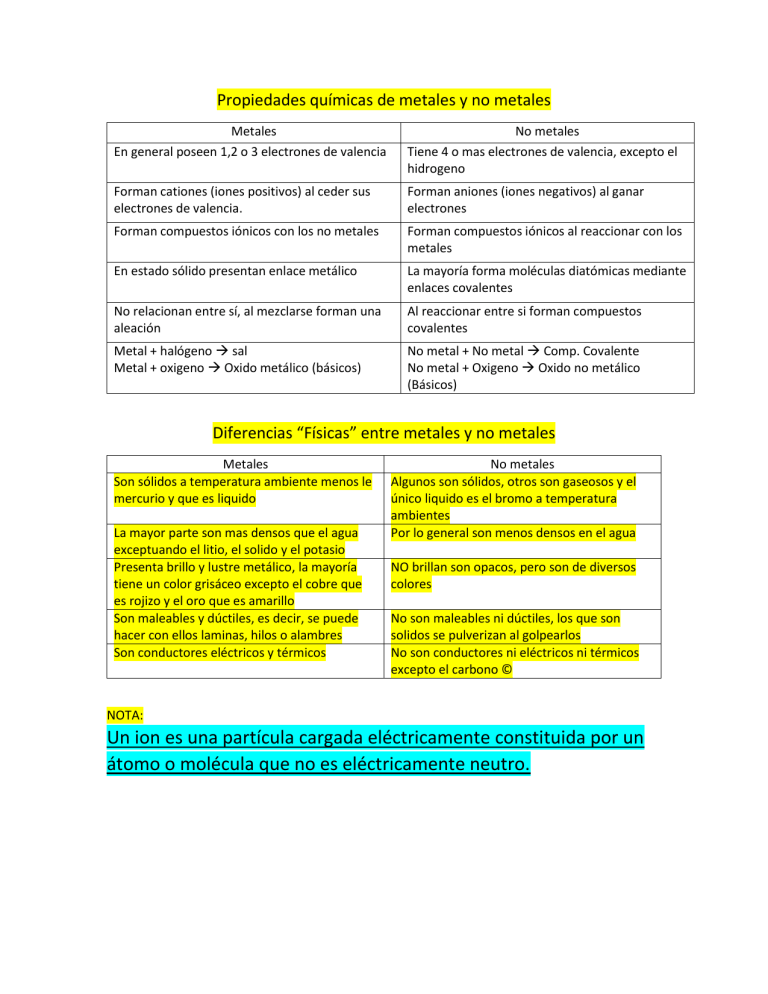
Propiedades químicas de metales y no metales Metales En general poseen 1,2 o 3 electrones de valencia No metales Tiene 4 o mas electrones de valencia, excepto el hidrogeno Forman cationes (iones positivos) al ceder sus electrones de valencia. Forman aniones (iones negativos) al ganar electrones Forman compuestos iónicos con los no metales Forman compuestos iónicos al reaccionar con los metales En estado sólido presentan enlace metálico La mayoría forma moléculas diatómicas mediante enlaces covalentes No relacionan entre sí, al mezclarse forman una aleación Al reaccionar entre si forman compuestos covalentes Metal + halógeno sal Metal + oxigeno Oxido metálico (básicos) No metal + No metal Comp. Covalente No metal + Oxigeno Oxido no metálico (Básicos) Diferencias “Físicas” entre metales y no metales Metales Son sólidos a temperatura ambiente menos le mercurio y que es liquido La mayor parte son mas densos que el agua exceptuando el litio, el solido y el potasio Presenta brillo y lustre metálico, la mayoría tiene un color grisáceo excepto el cobre que es rojizo y el oro que es amarillo Son maleables y dúctiles, es decir, se puede hacer con ellos laminas, hilos o alambres Son conductores eléctricos y térmicos No metales Algunos son sólidos, otros son gaseosos y el único liquido es el bromo a temperatura ambientes Por lo general son menos densos en el agua NO brillan son opacos, pero son de diversos colores No son maleables ni dúctiles, los que son solidos se pulverizan al golpearlos No son conductores ni eléctricos ni térmicos excepto el carbono © NOTA: Un ion es una partícula cargada eléctricamente constituida por un átomo o molécula que no es eléctricamente neutro.