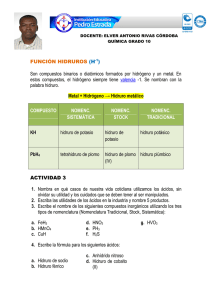
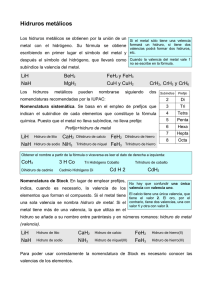
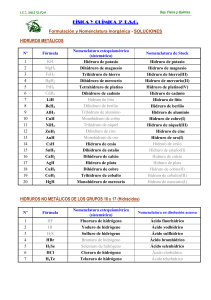
HIDRUROS Los hidruros son compuestos químicos que combinan en su molécula átomos de hidrógeno (cuyo estado de oxidación es, en la mayoría de los casos, -1) y átomos de cualquier otro elemento de la tabla periódica. Por ejemplo: hidruro de sodio, amoniaco, silano. Se reconocen tres categorías de hidruros: Los hidruros metálicos (iónicos): Combinaciones del ión hidruro (H–) con cationes metálicos (Mn+). Para las combinaciones de hidrógeno con elementos de los grupos 1–15 se utilizará la nomenclatura de composición con la denominación hidruro para el hidrógeno con papel de elemento electronegativo y estado de oxidación H(–I). Se indicará la proporción de los elementos bien con los correspondientes prefijos multiplicadores o con el estado de oxidación o el número de carga del elemento más electropositivo, en caso de que éste tenga más de uno. de Composición LiH MgH2 AlH3 SnH2 NaH CaH2 BaH2 MnH3 SrH2 CoH2 de Stock hidruro de litio dihidruro de magnesio trihidruro de aluminio dihidruro de estaño hidruro de sodio dihidruro de calcio dihidruro de bario trihidruro de manganeso dihidruro de estroncio dihidruro de cobalto de sustitución hidruro de litio hidruro de magnesio hidruro de aluminio alumano hidruro de estaño (II) estannano hidruro de sodio hidruro de calcio (II) hidruro de bario hidruro de manganeso (III) hidruro de estroncio hidruro de cobalto (II) Los hidruros no metálicos o volátiles (covalentes): combinaciones del H+ con elementos no metálicos, pero poco electronegativos de los grupos 16 y 17 (excepto el oxígeno): nitrógeno, fósforo, arsénico (As), antimonio (Sb), bismuto, boro, carbono y silicio. Se los puede llamar también hidruros moleculares o covalentes porque presentan enlaces covalentes. Sus disoluciones en agua no presentan carácter ácido. Para las combinaciones con los elementos se nombran poniendo en primer lugar el nombre del elemento más electronegativo con el sufijo ‘uro’ y, a continuación, el del hidrógeno, si es necesario con el correspondiente prefijo multiplicador. Vulgar NH3 PH3 AsH3 SbH3 BiH3 CH4 SiH4 N2H4 amoníaco fosfina arsina estibina metano silano idrazina de Composición trihidruro de nitrógeno trihidruro de fósforo trihidruro de arsénico trihidruro de antimonio trihidruro de bismuto tetrahidruro de carbono tetrahidruro de silicio tetrahidruro de dinitrógeno de Sustitución azano fosfano arsano estibano bismutano metano silano diazano HIDRUROS Ejemplos de nombres de iones derivados de hidruros binarios Fórmula NH4+ NHNH2N3- Nombre aceptado amonio amida imida azida, trinitruro(1–) Fórmula H3O- Nombre aceptado Oxonio (hidrón para H+) OHSH- hidróxido Hidrógeno (sulfuro) (1-) Nombres progenitores de los hidruros mononucleares Fórm. BH3 AlH3 GaH3 InH3 TlH3 Nombre borano alumano galano indigano talano Fórm CH4 SiH4 GeH4 SnH4 PbH4 Nombre metano silano germano estannano plumbano Fórm. NH3 PH3 AsH3 SbH3 BiH3 Nombre azano fosfano arsano estibano bismutano Fórm. H2O H2S H2Se H2Te H2Po Nombre oxidano sulfano selano telano polano Fórm. HF HCl HBr HI HAt Nombre fluorano clorano bromano yodano astatano Los hidruros no metálicos de carácter ácido (covalentes): También llamados simplemente hidrácidos, corresponden a la combinación del hidrógeno con un halógeno (flúor, cloro, bromo o yodo) o con un elemento anfígeno (azufre, selenio, telurio); en este último caso el hidrógeno actúa con su número de oxidación positivo (+1) y el otro elemento es el que funciona con número de oxidación negativo (-1 en los halógenos, -2 en los anfígenos). de Composición HF HCl HBr HI HAt H2O H2S H2Se H2Te fluoruro de hidrógeno cloruro de hidrógeno bromuro de hidrógeno yoduro de hidrógeno astaturo de hidrógeno óxido de dihidrógeno sulfuro de dihidrógeno selenuro de dihidrógeno telanuro de dihidrógeno de Sustitución fluorano clorano bromano yodano astatano oxidano sulfano selano telano hidrácidos HF(ac) HCl(ac) HBr(ac) HI(ac) ácido fluorhídrico ácido clorhídrico ácido bromhídrico ácido yodhídrico H2S(ac) ácido sulfhídrico H2Se(ac) ácido selenhídrico H2Te(ac) ácido telurhídrico Propiedades: Son capaces de conducir energía eléctrica. Son compuestos estequiometricos. Tienen una gran velocidad de difusión del hidróigeno por medio del sólido. Se forman de la combinación del hidrógeno con cualquier elemento