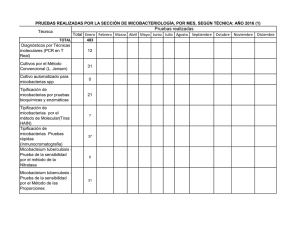
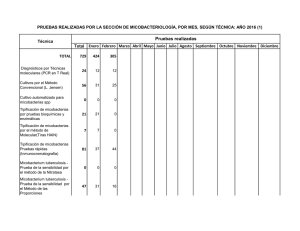
MYCOBACTERIUM 25 235 Mycobacterium 1. ¿Qué propiedades importantes distinguen Mycobacterium de otros géneros de bacilos grampositivos? 2. ¿Por qué se halla infectada por M. tuberculosis una tercera parte de la población mundial? 3. ¿Qué poblaciones se hallan en riesgo de infección por M. avium o M. fortuitum? Las respuestas a estas preguntas están disponibles en www.StudentConsult.es E l género Mycobacterium (tabla 25-1) está formado por bacilos aerobios inmóviles y no esporulados con un tamaño de 0,2 a 0,6 × 1 a 10 !m. En algunos casos, estos bacilos forman filamentos ramificados; sin embargo, éstos pueden romperse con facilidad. La pared celular es rica en lípidos, lo que hace que su superficie sea hidrofóbica y confiere a las micobacterias resistencia frente a muchos desinfectantes y frente a las tinciones habituales de laboratorio. Cuando han sido teñidos, los bacilos tampoco se pueden decolorar con las soluciones ácidas, motivo por el que reciben el nombre de bacilos ácido-alcohol resistentes. La mayoría de las micobacterias se dividen lentamente y los cultivos requieren una incubación de hasta 8 semanas antes de que se detecte crecimiento porque la estructura de la pared celular es compleja y el microorganismo tiene unos requerimientos de crecimiento estrictos. Las micobacterias son una causa muy importante de morbilidad y mortalidad, especialmente en los países con recursos sanitarios limitados. En la actualidad, se han identificado más de 150 especies de micobacterias, muchas de las cuales están asociadas a enfermedad en el ser humano (tabla 25-2). A pesar de la abundancia de especies micobacterianas, los grupos o las especies que se enumeran a continuación causan la mayor parte de las infecciones en el ser humano: M. tuberculosis, M. leprae, complejo M. avium, M. kansasii, M. fortuitum, M. chelonae y M. abscessus. FISIOLOGÍA Y ESTRUCTURA DE LAS MICOBACTERIAS Las bacterias se clasifican en el género Mycobacterium en función de 1) su capacidad de ácido-alcohol resistencia, 2) la presencia de ácidos micólicos con 70 a 90 átomos de carbono y 3) un elevado contenido (61%-71%) de guanina + citosina (G + C) en su ácido desoxirribonucleico (ADN). Aunque otras especies de bacterias pueden ser ácido-alcohol resistentes (p. ej., Nocardia, Rhodococcus, Tsukamurella, Gordonia), se tiñen con menor intensidad (ácido-alcohol resistencia parcial) y las cadenas de sus ácidos micólicos son más cortas. Las micobacterias poseen una pared celular compleja y rica en lípidos (fig. 25-1). Esta pared celular es la responsable de muchas de las propiedades características de las bacterias (p. ej., su ácido-alcohol resistencia, crecimiento lento, resistencia a detergentes, resistencia a los antibióticos antibacterianos frecuentes y la respuesta inmunitaria del hospedador: © 2014. Elsevier España, S.L. Reservados todos los derechos antigenicidad). La estructura básica de la pared celular es característica de las bacterias grampositivas: una membrana citoplásmica interna cubierta con una gruesa capa de peptidoglucanos y carente de membrana externa. No obstante, la estructura de la pared celular micobacteriana es notablemente más compleja que la de cualquier otra bacteria grampositiva. En la membrana plasmática se anclan proteínas, manósido de fosfatidilinositol y lipoarabinomanano (LAM). El LAM presenta una relación funcional con los liposacáridos O antigénicos presentes en otras bacterias. También se detectan otros lípidos, glucolípidos y peptidoglucolípidos. Los componentes lipídicos representan el 60% del peso de la pared celular. A lo largo de las capas de la pared celular se intercalan proteínas transportadoras y porinas, las cuales constituyen el 15% del peso de la misma. Las proteínas constituyen antígenos importantes a nivel biológico ya que estimulan la respuesta inmunitaria celular del paciente. Se usan preparaciones parcialmente purificadas de estos derivados proteicos (derivados proteicos purificados o PPD) como pruebas de reactividad cutánea para determinar la exposición a M. tuberculosis. Se han empleado preparaciones similares de otras micobacterias como reactivos específicos cutáneos. Las características de crecimiento y morfológicas de las colonias se utilizan en la identificación preliminar de las micobacterias. Como se ha expuesto previamente, M. tuberculosis y otras especies relacionadas (conocidas como complejo M. tuberculosis) son bacterias de crecimiento lento. Las colonias de estas bacterias no están pigmentadas o tienen un color beis (fig. 25-2). Las otras micobacterias, que actualmente se denominan «micobacterias no tuberculosas» o MNT, fueron clasificadas inicialmente por Runyon en función de la velocidad de crecimiento y la pigmentación (tabla 25-2). Las micobacterias pigmentadas producen carotenoides intensamente amarillos que se pueden estimular por la exposición a la luz (organismos fotocromógenos; fig. 25-3) o producirse en ausencia de luz (organismos escotocromógenos). La clasificación de Runyon de las MNT está formada por cuatro grupos: fotocromógenos de crecimiento lento (p. ej., M. kansasii, M. marinum); escotocromógenos de crecimiento lento (p. ej., M. gordonae, un microorganismo no patógeno que se aísla con frecuencia); micobacterias no pigmentadas de crecimiento lento (p. ej., M. avium, M. intracellulare), y micobacterias de crecimiento rápido (p. ej., M. fortuitum, M. chelonae, M. abscessus). Los métodos que se emplean en la actualidad para la detección e identificación rápida de las micobacterias han reducido la importancia de este esquema. A pesar de ello, un Mycobacterium pigmentado o de crecimiento rápido no se debería confundir nunca con M. tuberculosis. 235 236 MICROBIOLOGÍA MÉDICA Tabla 25-1 Micobacterias relevantes Tabla 25-2 Clasificación de micobacterias patógenas seleccionadas para el ser humano Microorganismo Origen histórico Mycobacterium myces, hongo; bakterium, pequeña barra (bacilo semejante a un hongo) M. abscessus abscessus, relativo a los abscesos (origina la formación de abscesos) Complejo M. tuberculosis M. tuberculosis Patógeno estricto Frecuente M. avium avis, relativo a las aves (provoca una enfermedad tuberculoide en las aves) M. leprae Patógeno estricto Infrecuente M. chelonae chelone, tortuga M. fortuitum fortuitum, fortuito, accidental (en referencia a su papel como patógeno oportunista) M. haemophilum haema, sangre; philos, amante (amante de la sangre; en referencia a la necesidad de sangre o hemina para su desarrollo in vitro) Complejo M. avium Generalmente patógeno Frecuente M. kansasii Generalmente patógeno Frecuente intra, interior; cella, pequeña habitación (en el interior de las células; en referencia a la localización intracelular de esta micobacteria) M. marinum Generalmente patógeno Infrecuente M. simiae Generalmente patógeno Infrecuente kansasii, oriundo de Kansas (donde se aisló por primera vez el microorganismo) M. szulgai Generalmente patógeno Infrecuente M. genavense Generalmente patógeno Infrecuente M. intracellulare M. kansasii Microorganismo Patogenicidad Frecuencia en EE.UU. M. africanum Patógeno estricto Rara M. bovis Patógeno estricto Rara M. bovis (cepa BCG) Patógeno ocasional Rara Micobacterias no tuberculosas de crecimiento lento M. leprae lepra, relativo a la lepra (causante de lepra) M. haemophilum Generalmente patógeno Infrecuente M. marinum marinum, relativo al mar (bacteria asociada a agua dulce y agua salada contaminadas) M. malmoense Generalmente patógeno Infrecuente M. tuberculosis tuberculum, pequeña tumefacción o tubérculo; osis, caracterizado por (caracterizado por tubérculos; en referencia a la formación de tubérculos en los pulmones de los pacientes infectados) M. ulcerans Generalmente patógeno Infrecuente M. scrofulaceum Patógeno ocasional Infrecuente M. xenopi Patógeno ocasional Infrecuente Micobacterias no tuberculosas de crecimiento rápido M. abscessus Patógeno ocasional Frecuente M. chelonae Patógeno ocasional Frecuente M. fortuitum Patógeno ocasional Frecuente M. mucogenicum Patógeno ocasional Infrecuente Figura 25-1 Estructura de la pared celular micobacteriana. Consta de (A) membrana plásmica, (B) peptidoglucano, (C) arabinogalactano, (D) lipoarabinomanano con cabeza de manosa, (E) proteínas asociadas a la membrana plasmática y a la pared celular, (F) ácidos micólicos y (G) moléculas de glucolípidos de superficie asociados a los ácidos micólicos. (Modificado de Karakousis y cols.: Mycobacterium tuberculosis cell wall lipids and the host immune response, Cell Microbiol 6:105-116, 2004.) MYCOBACTERIUM 237 Figura 25-2 Colonias de Mycobacterium tuberculosis en agar de Löwenstein-Jensen después de 8 semanas de incubación. (De Baron EJ, Peterson LR, Finegold SM: Bailey and Scott's diagnostic microbiology, 9.ª ed., St. Louis, 1994, Mosby.) Figura 25-3 Colonias de Mycobacterium kansasii en agar de Middlebrook; el pigmento se desarrolla después de una breve exposición a la luz. MYCOBACTERIUM TUBERCULOSIS infecciosas alcanzan los alvéolos, donde son digeridas por los macrófagos alveolares. A diferencia de la mayor parte de las bacterias fagocitadas, M. tuberculosis impide la fusión del fagosoma con los lisosomas (al inhibir la molécula de unión específica, el autoantígeno endosómico temprano 1 [EEA1]). El fagosoma es capaz de fusionarse a otras vesículas intracelulares para facilitar el acceso del patógeno a nutrientes y su proceso de replicación intravacuolar. Las bacterias fagocitadas (cuadro 25-1) Patogenia e inmunidad M. tuberculosis es un patógeno intracelular capaz de producir infecciones de por vida. En el período de exposición, M. tuberculosis ingresa en las vías respiratorias y las partículas CUADRO 25-1 © Elsevier. Fotocopiar sin autorización es un delito. Resumen de Mycobacterium tuberculosis Biología, virulencia y enfermedades Diagnóstico Bacilos aerobios, grampositivos débiles y fuertemente ácido-alcohol resistentes Pared celular rica en lípidos, lo que hace al microorganismo resistente a desinfectantes, detergentes, antibióticos antibacterianos frecuentes, la respuesta inmune del hospedador y tinciones tradicionales Capaz de crecimiento intracelular en los macrófagos alveolares inactivados La enfermedad depende fundamentalmente de la respuesta del hospedador frente a la infección La infección primaria es pulmonar La diseminación a otras localizaciones ocurre fundamentalmente en pacientes inmunodeprimidos Epidemiología La prueba cutánea de tuberculina y las pruebas de liberación de IFN-" son indicadores sensibles de la exposición al microorganismo La microscopia y el cultivo son sensibles y específicos La detección directa mediante sondas moleculares es relativamente insensible excepto en las muestras positivas para microorganismos ácido-alcohol resistentes La identificación se basa con mayor frecuencia en la utilización de sondas moleculares específicas de especie Tratamiento, prevención y control Universal; un tercio de la población mundial está infectada por este microorganismo Hay 9 millones de casos nuevos cada año y 2 millones de muertes La enfermedad es más frecuente en el Sudeste Asiático, África Subsahariana y Europa del Este Hubo algo más de 11.000 nuevos casos en EE.UU. en 2010 Las poblaciones con mayor riesgo de padecer la enfermedad son los pacientes inmunodeprimidos (fundamentalmente los infectados por VIH), los alcohólicos y los adictos a drogas, los vagabundos y aquellos que están expuestos a otros individuos infectados El ser humano es el único reservorio natural La transmisión de una persona a otra ocurre a través de aerosoles infectados INH, isonicotinil hidrazina; VIH, virus de la inmunodeficiencia humana. Se necesitan pautas con múltiples fármacos y cursos de tratamiento prolongados para prevenir la aparición de cepas resistentes a fármacos Isoniacida (INH), etambutol, pirazinamida y rifampicina durante 2 meses seguidos de 4 a 6 meses de INH y rifampicina u otras combinaciones alternativas de antimicrobianos La profilaxis de la exposición a la tuberculosis puede incluir INH durante 6-9 meses, rifampicina durante 4 meses; la pirazinamida y el etambutol o el levofloxacino se utilizan durante 6-12 meses después de estar expuesto a M. tuberculosis multirresistente Inmunoprofilaxis con el bacilo de Calmette-Guérin (BCG) en los países endémicos El control de la enfermedad se hace con vigilancia activa, medidas profilácticas y terapéuticas y un control exhaustivo de cada caso 238 MICROBIOLOGÍA MÉDICA Figura 25-4 Incidencia de infecciones por Mycobacterium tuberculosis en EE.UU., 1982-2010. también pueden eludir la destrucción mediada por los macrófagos con la formación de intermediarios reactivos del nitrógeno creados entre el óxido nítrico y los aniones superóxido al catabolizar catalíticamente los oxidantes generados. Los macrófagos secretan interleucina 12 (IL-12) y factor de necrosis tumoral ! (TNF-!) en respuesta a la infección por M. tuberculosis. Estas citocinas aumentan la inflamación localizada al reclutar linfocitos T y células citolíticas espontáneas (NK) hacia las zonas de los macrófagos infectados, incluida la diferenciación de los linfocitos T en linfocitos TH1 (linfocitos T cooperadores) con la consiguiente secreción de interferón " (IFN-"). Cuando existe IFN-", los macrófagos infectados se activan, lo que aumenta la fusión entre los fagosomas y los lisosomas y la destrucción intracelular. El TNF-# estimula la producción de óxido nítrico y los intermediarios reactivos del nitrógeno relacionados, lo que potencia la destrucción intracelular. Los pacientes con una producción disminuida de IFN-" o TNF-# o que sufren defectos en los receptores para estas citocinas tienen un mayor riesgo de sufrir infecciones graves por micobacterias. La eficacia de la eliminación bacteriana depende en parte del tamaño del foco de infección. Los macrófagos alveolares, las células epitelioides y las células gigantes de Langhans (células epitelioides fusionadas) con las micobacterias intracelulares forman el núcleo central de una masa necrótica que se rodea de una pared densa de macrófagos y de linfocitos T CD4, CD8 y NK. Esta estructura, que se llama granuloma, impide la diseminación posterior de las bacterias. Si en el momento en que los macrófagos son estimulados hay una pequeña carga antigénica, el granuloma es pequeño y las bacterias son destruidas con mínimo daño tisular; sin embargo, si hay muchas bacterias, los grandes granulomas necróticos o caseosos se vuelven encapsulados con fibrina que de modo eficaz protegen las bacterias de la destrucción por los macrófagos. Las bacterias pueden permanecer latentes en esta fase o se pueden reactivar algunos años más tarde, cuando disminuye la respuesta inmunitaria del paciente como consecuencia de la edad o por una enfermedad o un tratamiento inmunodepresor. Este es el motivo de que la enfermedad pueda no desarrollarse hasta etapas tardías de la vida en pacientes expuestos a M. tuberculosis. Epidemiología Aunque la tuberculosis se puede producir en primates y en animales de laboratorio como las cobayas, el ser humano constituye el único reservorio natural. La enfermedad se transmite por contacto estrecho de una persona con otra mediante la inhalación de aerosoles infecciosos. Las partículas grandes quedan atrapadas en las superficies mucosas y son eliminadas por la acción de los cilios del árbol respiratorio. Sin embargo, las partículas pequeñas que contienen de uno a tres bacilos tuberculosos pueden llegar hasta los alvéolos y comenzar una infección. La Organización Mundial de la Salud (OMS) estima que una tercera parte de la población mundial presenta una infección por M. tuberculosis. En este momento se producen casi 9 millones de casos nuevos y 2 millones de muertes por M. tuberculosis anualmente (es decir, una muerte cada 20 segundos). Las regiones de máxima incidencia son el África Subsahariana, el Sudeste Asiático y Europa del Este. En EE.UU. la incidencia de tuberculosis ha disminuido de forma progresiva desde 1992 (fig. 25-4). En 2010 se comunicaron algo más de 11.000 casos y casi el 60% de las infecciones afectaron a personas extranjeras. Otros grupos de población con riesgo elevado de enfermedad por M. tuberculosis son las personas «sin techo», los alcohólicos, los drogadictos, los reclusos y los individuos infectados por el virus de la inmunodeficiencia humana (VIH). Puesto que es difícil erradicar la enfermedad en estos pacientes, la diseminación de la infección a otros grupos de población, como los profesionales sanitarios, constituye un importante problema de salud. Esta circunstancia es especialmente cierta en los casos de M. tuberculosis mutirresistente, ya que los pacientes que reciben un tratamiento inadecuado pueden constituir un foco de infección durante períodos de tiempo prolongados.