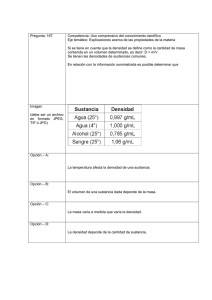
SISTEMA Un sistema se define como una cantidad de materia o una región en el espacio elegida para análisis. La masa o región fuera del sistema se conoce como alrededores. La superficie real o imaginaria que separa al sistema de sus alrededores se llama frontera La frontera de un sistema puede ser fija o móvil. La frontera es la superficie de contacto que comparten sistema y alrededores. En términos matemáticos, la frontera tiene espesor cero y, por lo tanto, no puede contener ninguna masa ni ocupar un volumen en el espacio. SISTEMA ABIERTO, SISTEMA CERRADO Y SISTEMA AISLADO Los sistemas termodinámicos se clasifican en cerrados abiertos, o aislados. El sistema cerrado es aquel donde ninguna masa entra o sale del sistema (consta de una masa fija) pero la energía en forma de calor o trabajo puede cruzar la frontera. El sistema abierto o volumen de control es aquel donde energía y materia pueden entrar o salir del sistema.. El sistema aislado no permite ni la entrada ni la salida de energía o materia. La masa no puede cruzar las fronteras de un sistema cerrado, pero la energía sí. Un sistema abierto con una entrada y una salida de masa y una entrada de trabajo Sistema aislado que no puede intercambiar energía, ni materia (masa) con su entorno. PROPIEDADES DE UN SISTEMA Una propiedad, es una característica de un sistema. Algunas propiedades muy familiares son presión (P), temperatura (T), volumen (V), masa (m), densidad ρ , energía interna (u), entalpia (h), entropía (s). Las propiedades pueden ser intensivas o extensivas. Las propiedades intensivas son aquellas independientes de la masa de un sistema, como temperatura, presión y densidad. Las propiedades extensivas son aquellas cuyos valores dependen del tamaño o extensión del sistema MECANICA DE MEDIOS CONTINUOS La mecánica de medios continuos es una rama de la física (específicamente de la mecánica) que propone un modelo unificado para la mecánica de sólidos deformables, sólidos rígidos y fluidos. Medio continuo. La materia está constituida por átomos que están igualmente espaciados en la fase gas. Sin embargo, es muy conveniente no tomar en cuenta la naturaleza atómica de una sustancia y considerarla como materia continua, homogénea y sin ningún hueco, es decir, un continuo. La idealización de continuo permite tratar a las propiedades como funciones puntuales y suponer que varían en forma continua en el espacio sin saltos discontinuos. Esta idealización es válida siempre y cuando el tamaño del sistema analizado sea grande en relación con el espacio entre moléculas DENSIDAD RELATIVA O GRAVEDAD ESPECIFICA La densidad (𝝆) se define como la masa por unidad de volumen. 𝝆= 𝒎 𝑽 (𝑘𝑔/𝑚3 ) El recíproco de la densidad es el volumen específico (𝒗), que se define como el volumen por unidad de masa. Es decir: 𝒗 = 𝑽/𝒎 = 1/𝝆 (𝑚3 /𝑘𝑔) Para un elemento de volumen diferencial de masa 𝜹𝒎 y volumen 𝜹𝑽 , la densidad se puede expresar como: 𝝆= 𝜹𝒎 𝜹𝑽 La densidad de la mayor parte de los gases es proporcional a la presión e inversamente proporcional a la temperatura. Por otro lado, los líquidos y sólidos son en esencia sustancias no compresibles y la variación de su densidad con la presión es por lo regular insignificante. La densidad de una sustancia también se expresa en comparación con la densidad de otra sustancia que se toma como referencia. Se le llama gravedad específica, o densidad relativa, y se define como el cociente de la densidad de una sustancia entre la densidad de alguna sustancia estándar a una temperatura especificada. Es adimensional, ya que queda definida como el cociente de dos densidades. Para los líquidos y los sólidos, la densidad de referencia habitual es la del agua líquida a la presión de 1 atm y la temperatura de 4 °C. En esas condiciones, la densidad del agua es de 𝟏𝟎𝟎𝟎 𝒌𝒈/𝒎³. 𝜌𝑠 = 𝜌 𝜌𝐻2𝑂 Para los gases, la densidad de referencia habitual es la del aire a la presión de 1 atm y la temperatura de 0 °C. En esas condiciones su densidad es de 𝟏, 𝟐𝟗𝟐𝟖 𝒌𝒈 / 𝒎³. ESTADO Y EQUILIBRIO Estado. Cuando se han especificado las variables necesarias para describir al sistema se dice que se ha particularizado el estado del sistema. Un sistema se encuentra en estado definido cuando todas sus propiedades poseen valores específicos. O sea en estas circunstancias, todas las propiedades se pueden medir o calcular. Si se cambia el valor de una propiedad, el estado cambia a otro diferente. Un sistema en dos estados de equilibrio diferentes ESTADO Y EQUILIBRIO Equilibrio. La palabra equilibrio define un estado de balance. En un estado de equilibrio no hay potenciales desbalanceados (o fuerzas impulsoras) dentro del sistema, y éste no experimenta cambios cuando es aislado de sus alrededores. EQUILIBRIO TERMICO Un sistema está en equilibrio térmico cuando tiene la misma temperatura en todos sus puntos. Es decir, el sistema no implica diferencias de temperatura, que es la fuerza impulsora para el flujo de calor. Un sistema cerrado que alcanza el equilibrio térmico. EQUILIBRIO MECANICO. Un sistema esta en equilibrio mecánico cuando la presión de todos sus puntos no varia con el tiempo. La variación de la presión como resultado de la gravedad en la mayor parte de los sistemas termodinámicos es relativamente pequeña y generalmente se ignora. EQUILIBRIO DE FASE Si en un sistema hay dos fases, se encuentra en la fase de equilibrio cuando la masa de cada fase alcanza un nivel de equilibrio y permanece estable con el tiempo. EQUILIBRIO QUIMICO Un sistema está en equilibrio químico si su composición química no cambia con el tiempo, es decir, si no ocurren reacciones químicas. POSTULADO DE ESTADO El estado de un sistema se describe mediante sus propiedades, pero se sabe por experiencia que no es necesario especificarlas todas con la finalidad de fijarlo. Una vez especificadas suficientes propiedades, el resto asume automáticamente ciertos valores. El estado de un sistema compresible simple se especifica por completo mediante dos propiedades intensivas independientes. Por ejemplo, la temperatura y el volumen específico, la presión y la energía interna PROCESOS Y CICLOS PROCESO. Cualquier cambio de un estado de equilibrio a otro experimentado por un sistema es un proceso, y la serie de estados por los que pasa un sistema durante este proceso es una trayectoria del proceso. Para describir completamente un proceso se deben especificar sus estados inicial y final, así como la trayectoria que sigue y las interacciones con los alrededores. PROCESOS Y CICLOS Un proceso entre los estados 1 y 2 y la trayectoria del proceso Diagrama P-V de un proceso de compresión. PROCESOS Y CICLOS Los diagramas de proceso trazados mediante el empleo de propiedades termodinámicas en forma de coordenadas son muy útiles para tener una representación visual del proceso. Algunas propiedades comunes usadas como coordenadas son temperatura 𝑻, presión 𝑷 y volumen 𝑽 (o volumen específico 𝒗). En la figura anterior se muestra el diagrama 𝑷 − 𝑽 de un proceso de compresión de un gas. El prefijo (iso) se usa con frecuencia para designar un proceso en el que una propiedad particular permanece constante. Por ejemplo, un proceso isotérmico es aquel durante el cual la temperatura 𝑻 permanece constante; un proceso isobárico es en el que la presión 𝑷 se mantiene constante, y un proceso isocórico (o isométrico) es aquel donde el volumen específico 𝒗 permanece constante. CICLO. Se dice que un sistema ha experimentado un ciclo si regresa a su estado inicial al final del proceso, es decir, para un ciclo los estados inicial y final son idénticos. PROCESO ISOTERMICO PROCESO ISOMETRICO PROCESOS Y CICLOS La figura muestra un proceso de calentamiento del agua a presión constante. Conforme se transfiere más calor, la temperatura del vapor empieza a aumentar. En el estado 4 el agua se ha evaporado por completo. PROCESOS Y CICLOS Diagrama T-v para el proceso de calentamiento del agua a presión constante. PROCESO DE FLUJO ESTACIONARIO En un proceso de flujo estacionario, ninguna de sus propiedades dentro del volumen de control cambian con el tiempo, por lo tanto el volumen, la masa y el contenido de energía total del volumen de control permanecen constantes. Las propiedades del fluido pueden cambiar de un punto a otro dentro del volumen de control, pero en algún punto fijo permanecen sin cambio durante todo el proceso. Durante un proceso de flujo estacionario, las propiedades del fluido dentro del volumen de control podrían cambiar con la posición pero no con el tiempo