Historia de la inmunología.
La palabra inmunología deriva del latín immunitas, que era un término con el que se
denominaba a quienes estaban "protegidos" de pagar impuestos. Dicha palabra
sigue vigente en términos sociales y es aplicada, por ejemplo, a los embajadores,
que están exentos de someterse a las leyes que rigen sobre el resto de los
ciudadanos (inmunidad diplomática) o a los legisladores, que no pueden ser
juzgados tan fácilmente al detentar fueros, también llamados "inmunidad".
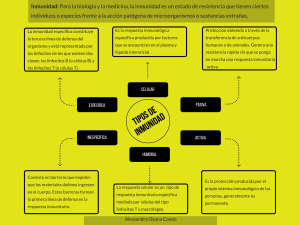
En medicina se define como inmunología a la ciencia que estudia todos los
mecanismos fisiológicos de defensa de la integridad biológica de un organismo. A
su vez, estos sistemas de defensa se dividen en dos grandes grupos: la inmunidad
innata, que defiende al organismo rápidamente y de forma inespecífica, y la
inmunidad adaptativa, que es específica contra los agentes agresores y actúa de
forma mediata.
Como tantas otras ciencias, la inmunología presenta un prolongado período precientífico, de observaciones y aproximaciones meramente empíricas. La resistencia
a posteriores ataques de una enfermedad infecciosa fue ya recogida en escritos de
la antigüedad; el historiador griego Tucídides (464-404 a.C.) narra que, en una
epidemia sucedida durante la guerra del Peloponeso, los enfermos eran atendidos
solo por aquellos que habían sobrevivido previamente a la enfermedad, en la
seguridad de que éstos no volverían a ser contagiados.
Igualmente, en la antigua China se había observado que las personas que en su
niñez habían padecido la viruela no la adquirían más adelante en su vida. Los
mismos chinos, en el siglo XI a. C., fueron los primeros en intentar una aplicación
de estas observaciones que indicaban la inducción de un estado protector por medio
de una forma suave de la enfermedad: la inhalación de polvo de costras de viruela
provocaba un ataque suave que confería resistencia ante infecciones posteriores.
Una modificación fue introducida en Occidente en el siglo XVIII por Pylarini y Timoni,
y fue popularizada en Gran Bretaña por Lady Mary Wortley Montagu, esposa del
embajador inglés en Constantinopla, tras una serie inicial de pruebas sobre
"voluntarios" (prisioneros). Sin embargo, este tipo de prácticas no llegaron a arraigar
ampliamente, ya que no estaban exentas de riesgos, entre los cuales figuraba la
posibilidad de transmisión de otras enfermedades.
El primer acercamiento a la inmunización con criterios racionales fue realizado por
el médico inglés Edward Jenner (1749-1823), tras su constatación de que los
ganaderos que habían adquirido la viruela vacunal (una forma benigna de
enfermedad que sólo producía pústulas en las manos) no eran atacadas por la grave
y deformante viruela humana. En mayo de 1796 inoculó a un niño fluido procedente
de las pústulas vacunales de Sarah Nelmes; semanas después el niño fue inyectado
con pus de una pústula de un enfermo de viruela, comprobando que no quedaba
afectado por la enfermedad. Jenner publicó sus resultados en 1798 ("An enquiry
into the causes and effects of the variolae vaccinae..."), pronosticando que la
aplicación de su método podría llegar a erradicar la viruela. Jenner fue el primero
en recalcar la importancia de realizar estudios clínicos de seguimiento de los
pacientes inmunizados, consciente de la necesidad de contar con controles fiables.
La falta de conocimiento, en aquella época, de las bases microbiológicas de las
enfermedades infecciosas retrasó en casi un siglo la continuación de los estudios
de Jenner, aunque ciertos autores, como Turenne, en su libro "La syphilization"
(1878) lograron articular propuestas teóricas de cierto interés.
El primer abordaje plenamente científico de problemas inmunológicos se debió, a
Louis Pasteur. Estudiando la bacteria responsable del cólera aviar (más tarde
conocida como Pasteurella aviseptica), observó (1880) que la inoculación en
gallinas de cultivos viejos, poco virulentos, las protegía de contraer la enfermedad
cuando posteriormente eran inyectadas con cultivos normales virulentos. De esta
forma se obtuvo la primera vacuna a base de microorganismos atenuados. Fue
precisamente Pasteur quien dio carta de naturaleza al término vacuna, en honor del
trabajo pionero de Jenner. En los años siguientes Pasteur abordó la inmunización
artificial para otras enfermedades; concretamente, estableció de forma clara que
cultivos de Bacillus anthracis atenuados por incubación a 45° C conferían inmunidad
a ovejas expuestas a contagio por carbunco. Una famosa demostración pública de
la bondad del método de Pasteur tuvo lugar en Pouilly le Fort, el 2 de junio de 1881,
cuando ante un gentío expectante se pudo comprobar la muerte del grupo control
de ovejas y vacas no inoculadas, frente a la supervivencia de los animales
vacunados. Años después, abordaría la inmunización contra la rabia, enfermedad
de la que se desconocía el agente causal. Pasteur observó que éste perdía
virulencia cuando se mantenían al aire durante cierto tiempo extractos medulares
de animales infectados, por lo que dichos extractos se podían emplear eficazmente
como vacunas. Realizó la primera vacunación antirrábica en humanos el 6 de julio
de 1885, sobre el niño Joseph Meister, que había sido mordido gravemente por un
perro rabioso. A este caso siguieron otros muchos, lo que valió a Pasteur
reconocimiento universal y supuso el apoyo definitivo a su método de inmunización,
que abría perspectivas prometedoras de profilaxis ante muchas enfermedades.
Estos logros determinaron, en buena medida, la creación del Instituto Pasteur, que
muy pronto reunió a un selecto grupo de científicos, que enfocarían sus esfuerzos
en diversos aspectos de las inmunizaciones y de sus bases biológicas. A su vez,
los norteamericanos Salmon y Smith (1886) perfeccionaron los métodos serológicos
de Pasteur, lo que les permitió producir y conservar más fácilmente sueros
tipificados contra la peste porcina.
A finales del siglo XIX existían dos teorías opuestas sobre los fundamentos
biológicos de las respuestas inmunes. Por un lado, el zoólogo ruso Ilya Ilich
Mechnikov (1845-1916), que había realizado observaciones sobre la fagocitosis en
estrellas de mar y pulgas de agua, estableció, a partir de 1883, su "Teoría de los
fagocitos", tras estudiar fenómenos de englobamiento de partículas extrañas por los
leucocitos de conejo y de humanos. Informó que existían fenómenos de eliminación
de agentes patógenos por medio de "células devoradoras" (fagocitos) que actuaban
en animales vacunados contra el carbunco, y explicó la inmunización como una
"habituación" del hospedador a la fagocitosis. Más tarde, ya integrado en el Instituto
Pasteur, propugnó la idea de que los fagocitos segregan enzimas específicos,
análogos a los "fermentos" digestivos (1900). Esta teoría de los fagocitos constituyó
el núcleo de la teoría de la inmunidad celular, de modo que la fagocitosis se
consideraba como la base principal del sistema de defensa inmune del organismo.
Por otro lado, la escuela alemana de Koch hacía hincapié en la importancia de los
mecanismos humorales (teoría de la inmunidad humoral). Emil von Behring (18541917) y Shibasaburo Kitasato (1856-1931), a resultas de sus trabajos sobre las
toxinas del tétanos y de la difteria, observaron que el cuerpo produce "antitoxinas"
(más tarde conocidas como anticuerpos) que tendían a neutralizar las toxinas de
forma específica, y evidenciaron que el suero que contiene antitoxinas es capaz de
proteger a animales expuestos a una dosis letal de la toxina correspondiente (1890).
La intervención de Ehrlich permitió obtener sueros de caballo con niveles de
anticuerpos suficientemente altos como para conferir una protección eficaz, e
igualmente se pudo disponer de un ensayo para cuantificar la "antitoxina" presente
en suero. Ehrlich dirigió desde 1896 el Instituto Estatal para la Investigación y
Comprobación de Sueros, en Steglitz, cerca de Berlín, y, a partir de 1899, estuvo al
frente del mejor equipado Instituto de Terapia Experimental, en Frankfurt. Durante
este último periodo de su vida, Ehrlich produce una impresionante obra científica,
en la que va ahondando en la comprensión de la inmunidad humoral. En 1900 da a
luz su "Teoría de las cadenas laterales", en la que formula una explicación de la
formación y especificidad de los anticuerpos, estableciendo una base química para
la interacción de éstos con los antígenos. Por su lado, R. Kraus visualiza por primera
vez, en 1897, una reacción antígeno-anticuerpo, al observar el enturbiamento de un
filtrado bacteriano al mezclarlo con un suero inmune específico (antisuero). Durante
cierto tiempo se creyó que el suero posee distintas actividades inmunes humorales,
cada una denominada de forma diferente: antitoxina (neutralización de toxinas),
precipitina (precipitación de toxinas), aglutinina (aglutinación de bacterias) y
bacteriolisina (lisis de bacterias). Hubo que esperara a los años 30 para caer en la
cuenta que todas estas actividades se debían a un único tipo de entidad, que fue
bautizado como anticuerpo.
En 1898 Jules Bordet (1870-1961) descubre otro componente sérico relacionado
con la respuesta inmunitaria, al que bautiza como "alexina", caracterizado, frente al
anticuerpo, por su termolabilidad e inespecificidad. (Más tarde se impondría el
nombre de complemento, propuesto por Ehrlich). El mismo Bordet desarrolló, en
1901, el primer sistema diagnóstico para la detección de anticuerpos, basado en la
fijación del complemento, y que inició una larga andadura, que llega a nuestros días.
La conciliación de las dos teorías (celular y humoral) se inició con los trabajos de
Almorth Wrigth y Stewart R. Douglas, quienes en 1904 descubren las opsoninas,
anticuerpos presentes en los sueros de animales inmunizados y que, tras unirse a
la superficie bacteriana, incrementan la capacidad fagocítica de los leucocitos. En
los años 50 se reconoce que los linfocitos son las células responsables de los dos
componentes, humoral y celular, de la inmunidad.
El área de la inmunopatología inicia su andadura con la descripción del fenómeno
de anafilaxia producido por introducción en un animal de un suero de una especie
distinta (Portier y Richet, 1902; Arthus, 1903), lo que a su vez abriría la posibilidad
de métodos de serodiagnóstico, con aplicaciones múltiples en Medicina, Zoología y
otras ciencias biológicas. En 1905 Pirquet sugiere que la enfermedad del suero (un
fenómeno de hipersensibilidad) tiene relación directa con la producción de
anticuerpos contra el suero inyectado, introduciendo el término de alergia para
referirse a la reactividad inmunológica alterada.
La inmunoquímica cobra un gran impulso en las primeras décadas del siglo XX con
los trabajos de Karl Landsteiner (1868-1943). Su primera contribución de
importancia había sido la descripción, mediante reacciones de aglutinación, del
sistema de antígenos naturales (ABC0) de los eritrocitos humanos (1901-1902),
completada (en colaboración con Von Dungern y Hirzfeld), con las subdivisiones del
grupo A y el estudio de su transmisión hereditaria. Estos trabajos sirvieron de
estímulo para avanzar en el desentrañamiento de la especificidad química de los
antígenos que determinan la formación de anticuerpos. Landsteiner estudió
sistemáticamente las características de inmunogenicidad y especificidad de
reacción de antígenos con anticuerpos, valiéndose de la modificación química de
antígenos, denominando haptenos a aquellos grupos químicos que por sí mismos
no desencadenan formación de anticuerpos, pero sí lo hacen tras ser conjugados a
proteínas portadoras.
La cuestión de las reacciones antígeno-anticuerpo se convirtió en otra polémica
entre escuelas hasta finales de los años 20. Mientras Ehrlich y sus seguidores
mantenían que estas reacciones tienen una base puramente química, Bordet y sus
discípulos las explicaban como fenómenos físicos de reacciones entre coloides. La
resolución del debate debió aguardar hasta finales de los años 30, al incorporarse
avances técnicos como la electroforesis, la cromatografía en papel, la
ultracentrifugación y el microscopio electrónico. Heidelberg y Kendall (1936)
purificaron anticuerpos a partir de sueros por disociación de precipitados. Tiselius
(1939) demostró que los anticuerpos constituyen la fracción gamma-globulínica del
suero. Veinte años después R.R. Porter y G.M. Edelman establecen la estructura
de las inmunoglobulinas. Durante este lapso de tiempo se descubre que la síntesis
de anticuerpos ocurre en las células plasmáticas, aunque éstas no son puestas en
relación aún con los linfocitos; durante muchos años se siguió creyendo que los
linfocitos eran células pasivas, sin función inmune. Por aquella época se describe,
también, la diversidad de inmunoglobulinas, llegándose al establecimiento de una
nomenclatura. Enseguida comienza la era de los múltiples experimentos sobre
timectomía en ratones neonatos y sobre bursectomía en aves, así como los de
reconstitución de animales irradiados, con timocitos y células de la medula ósea, y
que permiten afirmar el papel esencial de los linfocitos, encuadrarlos en tipos
funcionales T y B, y relacionarlos con las respuestas inmunes celular y humoral,
respectivamente.
Una importante faceta de la inmunología de la primera mitad del siglo XX fue la
obtención de vacunas. Se lograron toxoides inmunogénicos a partir de toxinas
bacterianas, en muchos casos por tratamiento con formol: toxoide tetánico (Eisler y
Lowenstein, 1915) y toxoide diftérico (Glenny, 1921). En 1922 se desarrolla la
vacuna BCG contra la tuberculosis, haciendo uso de una cepa atenuada de
Mycobacterium tuberculosis, el bacilo de Calmette-Guérin. La utilización de
coadyuvantes se inicia en 1916, por LeMoignic y Piroy.
La inmunogenética nace cuando Bernstein describe en 1921 el modelo de
transmisión hereditaria de los cuatro grupos sanguíneos principales, basándose en
el análisis estadístico de sus proporciones relativas, y con el descubrimiento por
Landsteiner y Levène (1927) de los nuevos sistemas MN y P. Los experimentos de
transfusiones sanguíneas interespecíficas permitieron distinguir la gran complejidad
de los antígenos sanguíneos, explicables según unos 300 alelos múltiples.
Otra de las grandes controversias de los primeros tiempos de la Inmunología se
refería al tipo de mecanismos postulados para explicar la especificidad de la
reacción antígeno-anticuerpo. Se propusieron dos tipos de teorías: la selectiva y la
instructiva. La primera formulación de tipo instructivo se debió a Paul Ehrlich (teoría
de las cadenas laterales): suponía que las células inmunes expresan en su
superficie una gran variedad de cadenas laterales preformadas; la unión de un
agente patógeno determinado con una cadena lateral adecuada sería análoga a la
complementariedad entre una llave y su cerradura; dicha interacción originaría la
liberación de la cadena lateral, e induciría a la célula a producir y liberar más
cadenas laterales de ese tipo concreto. Como se ve, esta teoría supone que la
selectividad de la cadena lateral está determinada previamente a la exposición al
antígeno, que sólo actúa seleccionando la producción y liberación de la cadena
adecuada.
En cambio, durante los años 30 y 40 se daba más crédito a las teorías instructivas.
En ellas, el antígeno juega un papel central a la hora de determinar la especificidad
del anticuerpo correspondiente. Se sugería que el antígeno serviría como un molde
alrededor del cual se plegaría la molécula del anticuerpo, que de esta forma
adquiriría su especificidad. Estas teorías, popularizadas sobre todo por Linus
Pauling, podían encajar en aquellos tiempos en que aún existían muchas lagunas
de los conocimientos, pero en los años 50, tras los nuevos descubrimientos en
Biología Molecular (ADN, ARN, código genético, etc.), fueron descartadas.
Una contribución esencial a las ideas sobre el mecanismo de formación de los
anticuerpos la realizó el australiano Macfarlane Burnet (1899-1985), al establecer
su teoría de la selección clonal; ésta argumenta que cada linfocito B, previamente
al contacto con el antígeno, sintetiza un único tipo de anticuerpo, específico para
cada antígeno determinante antigénico), de modo que la unión del antígeno causa
la proliferación clonal del linfocito B, con la consecuente síntesis incrementada de
anticuerpos específicos. Esta teoría resucitó las ideas selectivas, y actualmente es
el paradigma aceptado por todos los inmunólogos. Más recientemente Niels Jerne
ha realizado nuevas aportaciones y refinamientos a la teoría de la selección clonal,
proponiendo un modelo de regulación inmune conocido como teoría de las redes
idiotípicas.
Los avances en Inmunología durante los últimos años han sido espectaculares,
consolidando a ésta como ciencia independiente, con su conjunto propio de
paradigmas, ya relativamente escindida de su tronco originario microbiológico. Entre
los hitos recientes hay que citar la técnica de producción de anticuerpos
monoclonales a partir de hibridomas, desarrollada originalmente por Cesar Milstein
y Georges Kohler en 1975, y que presenta una enorme gama de aplicaciones en
biomedicina, o el desentrañamiento de los fenómenos de reorganización genética
responsables de la expresión de los genes de inmunoglobulinas, por Susumu
Tonegawa.
Células y tejidos del sistema inmunitario.
Las células de los sistemas inmunitarios innato y adaptativo están presentes
normalmente en forma de células circulantes en la sangre y en la linfa, en forma de
grupos definidos por criterios anatómicos en órganos linfáticos y en forma de células
dispersas en casi todos los tejidos. La organización anatómica de estas células y su
capacidad para circular e intercambiarse entre la sangre, la linfa y los tejidos tiene
una importancia fundamental para la generación de las respuestas inmunitarias. El
sistema inmunitario se enfrenta a numerosos desafíos con el fin de generar
respuestas protectoras eficaces contra microorganismos infecciosos. En primer
lugar, el sistema debe ser capaz de responder con rapidez a cantidades reducidas
de muchos microbios diferentes que pueden introducirse en cualquier lugar del
cuerpo. En segundo lugar, en la respuesta inmunitaria adaptativa, muy pocos
linfocitos vírgenes específicos reconocen y responden a un antígeno. En tercer
lugar, los mecanismos efectores del sistema inmunitario adaptativo (anticuerpos y
linfocitos T efectores) deben localizar y destruir microbios en lugares alejados de la
zona donde se indujo la respuesta inmunitaria. La capacidad del sistema inmunitario
de enfrentarse a estos desafíos y de realizar de forma óptima sus funciones
protectoras depende de las respuestas notablemente rápidas y variadas de las
células inmunitarias y de la forma en que estas células se organizan en los tejidos
linfáticos y mantienen la capacidad de migrar de un tejido a otro.
Las células que desempeñan funciones especializadas en las respuestas
inmunitarias innatas y adaptativas son los fagocitos, las células dendríticas, los
linfocitos específicos frente al antígeno y otros diversos leucocitos que actúan
eliminando los antígenos.
Fagocitos.
Los fagocitos, entre los que se cuentan los neutrófilos y los macrófagos, son las
células cuya principal función es ingerir y destruir los microbios y deshacerse de los
tejidos dañados. Las respuestas funcionales de los fagocitos en la defensa del
anfitrión consisten en una secuencia de pasos: reclutamiento de las células en las
zonas de infección, reconocimiento de los microbios y activación por ellos, ingestión
de los microbios por el proceso de la fagocitosis y destrucción de los microbios
ingeridos. Además, a través del contacto directo y la secreción de citocinas, los
fagocitos se comunican con otras células en diversas formas que promueven o
regulan las respuestas inmunitarias. Estas funciones de los fagocitos son
importantes en la inmunidad innata, y también en la fase efectora de algunas
respuestas inmunitarias adaptativas.
Neutrófilos.
Los neutrófilos, también llamados leucocitos polimorfonucleares, son la población
más abundante de leucocitos circulantes y median las primeras fases de las
reacciones inflamatorias. Los neutrófilos circulan como células esféricas de unas 12
a 15 um de diámetro con numerosas proyecciones membranarias. El núcleo de un
neutrófilo está segmentado en tres a cinco lóbulos conectados, de aquí el sinónimo
leucocito polimorfonuclear. El citoplasma contiene gránulos de dos tipos. La
mayoría, llamados gránulos específicos, están llenos de enzimas como la lisozima,
la colagenasa y la elastasa. Estos gránulos no se tiñen intensamente con las
tinciones básicas ni ácidas (hematoxilina y eosina, respectivamente), lo que
distingue a los gránulos del neutrófilo de los de otros tipos de granulocitos
circulantes, llamados basófilos y eosinófilos. El resto de los gránulos de los
neutrófilos, llamados gránulos azurófilos, son lisosomas que contienen enzimas y
otras sustancias microbicidas, como las defensinas y las catelicidinas. Los
neutrófilos se producen en la médula ósea y surgen de los precursores que también
originan los fagocitos mononucleares. La producción de neutrófilos es activada por
el factor estimulador de colonias de granulocitos (G-CSF). Un ser humano adulto
produce más de 1x10^11 neutrófilos al día, y cada uno circula en la sangre durante
horas o días. Los neutrófilos pueden migrar a lugares de infección rápidamente tras
la entrada de microbios. Después de entrar en los tejidos, los neutrófilos actúan
durante 1 o 2 días y después mueren.
Los neutrófilos defienden al organismo contra infecciones bacterianas o por hongos.
Usualmente son los primeros en responder a una infección microbiana; su actividad
y muerte en gran número forman el pus. Los neutrófilos se encargan de fagocitar
bacterias y están presentes en grandes cantidades en el pus. Estas células no son
capaces de renovar sus lisosomas (utilizados durante la digestión de microbios) y
mueren después de haber fagocitado unos cuantos patógenos.
Los neutrófilos son el tipo celular más encontrado en las fases tempranas de la
inflamación aguda. Conforman del 60 al 70% de los leucocitos totales en la sangre
del ser humano.
Fagocitos mononucleares.
El sistema fagocítico mononuclear comprende células circulantes llamadas
monocitos y células residentes en los tejidos llamadas macrófagos. Los macrófagos,
que se distribuyen ampliamente en los órganos y el tejido conjuntivo, desempeñan
funciones centrales en las inmunidades innata y adaptativa. Muchos tejidos están
poblados de macrófagos residentes de vida larga derivados de precursores del saco
vitelino o del hígado fetal durante el desarrollo fetal y asumen fenotipos
especializados dependiendo del órgano. Son ejemplos de ellas las células de
Kupffer que recubren las sinusoides en el hígado, los macrófagos sinusoidales en
el bazo, los macrófagos alveolares en el pulmón y las células microgliales en el
encéfalo. En los adultos, las células de línea macrofágica surgen de células
precursoras comprometidas que existen en la médula ósea, dirigidas por una
proteína llamada factor estimulante de colonias de monocitos (o macrófagos) (MCSF). Estos precursores maduran en los monocitos, que entran y circulan en la
sangre y después emigran a los tejidos, especialmente durante las reacciones
inflamatorias, donde se convierten en macrófagos. Los monocitos tienen diámetros
de 10a 15 um y poseen núcleos en forma de riñón y un citoplasma finamente
granular que contiene lisosomas, vacuolas fagocíticas y filamentos del
citoesqueleto. Los monocitos son heterogéneos y consisten en diferentes
subgrupos distinguibles por marcadores de la superficie celular y funciones. En los
seres humanos y en los ratones, los monocitos más numerosos, llamados a veces
monocitos clásicos, producen abundantes mediadores inflamatorios y son
reclutados con rapidez en los lugares de infección o lesión tisular. En los seres
humanos, estos monocitos pueden identificarse por la expresión elevada en su
superficie de CD 14 y la nula expresión de CD 16 (CD14” CD16-), y en los ratones
el subgrupo equivalente puede identificarse como Ly6 alto. Los monocitos no
clásicos, que suponen una minoría de los monocitos sanguíneos, son CD14’ CD16”
en los seres humanos y Ly6 bajo en los ratones. Estas células ayudan a reparar los
tejidos después de la lesión y se sabe que se arrastran por las superficies
endoteliales (lo que se describe como patrullaje). También se ha descrito en
humanos un subgrupo intermedio (CD14” CD16’).
Maduración de los fagocitos mononucleares. Los macrófagos residentes
tisulares, que se diferencian en formas especializadas en órganos particulares,
derivan de precursores presentes en el saco vitelino y el hígado fetal durante la vida
fetal. Los monocitos surgen de una célula precursora de la línea mielocítica en la
médula ósea, circulan en la sangre y son reclutados durante las reacciones
inflamatorias en los tejidos, donde maduran más hasta convertirse en macrófagos.
Hay subgrupos de monocitos sanguíneos que tienen funciones inflamatorias o
reparadoras distintas (no mostrados).
Los macrófagos tisulares realizan varias funciones importantes en las inmunidades
innata y adaptativa.
• Una función importante de los macrófagos en la defensa del anfitrión es ingerir y
matar microbios. Entre los mecanismos de eliminación, que se exponen en el
capítulo 4, están la generación enzimática de especies reactivas del oxígeno y del
nitrógeno, que son tóxicas para los microbios, y la digestión proteolítica.
• Además de ingerir microbios, los macrófagos también ingieren células muertas del
anfitrión, incluidas las células que mueren en los tejidos debido a traumatismos o
interrupciones del aporte sanguíneo y los neutrófilos que se acumulan en los lugares
de infección. Esto forma parte del proceso de limpieza que sigue a la infección o la
lesión tisular estéril. Los macrófagos también reconocen e ingieren células
apoptósicas antes de que estas puedan liberar su contenido e inducir respuestas
inflamatorias. A lo largo del cuerpo y de la vida de un sujeto, las células no deseadas
mueren por apoptosis, como parte de muchos procesos fisiológicos, como el
desarrollo, el crecimiento y la renovación de tejidos sanos, y los macrófagos deben
eliminar las células muertas.
• Los macrófagos activados secretan distintas citocinas que actúan sobre células
endoteliales que recubren los vasos sanguíneos para potenciar el reclutamiento de
más monocitos y otros leucocitos de la sangre hacia las zonas de infecciones, lo
que amplifica la respuesta protectora contra los microbios. Algunas importantes
citocinas derivadas de macrófagos.
• Los macrófagos sirven de APC que presentan antígenos a los linfocitos T y los
activan. Esta función es importante en la fase efectora de las respuestas
inmunitarias mediadas por linfocitos T.
• Los macrófagos promueven la reparación de tejidos dañados al estimular el
crecimiento de nuevos vasos sanguíneos (angiogenia) y la síntesis de matriz
extracelular rica en colágeno (fibrosis). Estas funciones están mediadas por
citocinas secretadas por los macrófagos que actúan sobre varias células tisulares.
Los macrófagos se activan para realizar sus funciones al reconocer muchos tipos
diferentes de moléculas microbicidas, así como moléculas del anfitrión producidas
en respuesta a las infecciones y lesiones. Estas diversas moléculas activadoras se
unen a receptores específicos productores de señales localizados en la superficie
del macrófago o en su interior. Un ejemplo de estos receptores es el receptor de
tipo toll, que tiene una importancia fundamental en la inmunidad innata. Los
macrófagos también se activan cuando receptores presentes en su membrana
plasmática se unen a opsoninas en la superficie de los microbios. Las opsoninas
son sustancias que cubren partículas para la fagocitosis. Ejemplos de receptores de
opsoninas son los receptores para el complemento y los receptores para Ec de los
anticuerpos. En la inmunidad adaptativa, los macrófagos son activados por citocinas
secretadas y proteínas de membrana expresadas por los linfocitos T. Los
macrófagos pueden adquirir capacidades funcionales especiales, dependiendo de
los tipos de estímulos activadores a los que se exponen. El ejemplo más claro de
esto es la respuesta de los macrófagos a diferentes citocinas producidas por
subgrupos de linfocitos T. Algunas de estas citocinas activan a los macrófagos, que
matan a los microbios de forma muy eficiente, lo que se llama activación clásica.
Otras citocinas activan a los macrófagos para que promuevan la reestructuración y
reparación tisulares, lo que se llama activación alternativa. Estas diferentes formas
de activación y las citocinas implicadas. Los macrófagos también pueden asumir
diferentes formas morfológicas después de activarse por medio de estímulos
externos, como los microbios. Algunos desarrollan abundante citoplasma y se
denominan células epitelioides por su parecido a las células epiteliales de la piel.
Los macrófagos activados pueden fusionarse y formar células gigantes
multinucleadas. Los macrófagos suelen responder a los microbios casi con tanta
rapidez como los neutrófilos, pero los macrófagos sobreviven mucho más en las
zonas de inflamación. AI contrario que los neutrófilos, los macrófagos no están
diferenciados en su forma terminal y pueden sufrir divisiones celulares en una zona
inflamatoria. Por tanto, los macrófagos son las células efectoras dominantes en los
estadios finales de la respuesta inmunitaria innata, varios días después del
comienzo de la infección.
Mastocitos, basófilos y eosinófilos.
Los mastocitos, los basófilos y los eosinófilos son tres células adicionales que
participan en las respuestas inmunitarias innatas y adaptativas. Los tres tipos de
células comparten la característica común de tener gránulos citoplásmicos llenos de
varios mediadores inflamatorios y antimicrobianos. Otra característica común de
estas células es su implicación en respuestas inmunitarias que protegen contra
helmintos y reacciones que causan enfermedades alérgicas.
Mastocitos.
Los mastocitos son células derivadas de la médula ósea presentes en la piel y los
epitelios mucosos que contienen abundantes gránulos citoplásmicos llenos de
histamina y otros mediadores. La citocina factor de célula troncal (también llamada
ligando de c-Kit) es esencial para el desarrollo del mastocito. Los mastocitos
maduros no se encuentran normalmente en la circulación, sino que están en los
tejidos, habitualmente junto a vasos sanguíneos pequeños y nervios. Su citoplasma
contiene numerosos gránulos rodeados de membrana que están llenos de
proteoglucanos ácidos que se unen a pigmentos básicos. Los mastocitos expresan
en la membrana receptores de afinidad alta para un tipo de anticuerpo llamado IgE
y suelen estar cubiertos por ellos. Cuando los anticuerpos que están en la superficie
del mastocito se unen al antígeno, se inducen acontecimientos transmisores de
señales que conducen a la liberación del contenido del gránulo citoplásmico hacia
el espacio extracelular. El contenido granular liberado, incluida la histamina,
promueve cambios en los vasos sanguíneos que producen inflamación. Los
mastocitos actúan como centinelas en los tejidos, donde reconocen los productos
microbianos y responden produciendo citocinas y otros mediadores que inducen la
inflamación. Estas células proporcionan una defensa frente a los helmintos y otros
microbios, pero son también responsables de los síntomas de las enfermedades
alérgicas.
Basófilos.
Los basófilos son granulocitos sanguíneos con muchas similitudes estructurales y
funcionales con los mastocitos. Como otros granulocitos, los basófilos derivan de
progenitores de la médula ósea (una línea diferente a la de los mastocitos), maduran
en la médula ósea y circulan en la sangre. Los basófilos constituyen menos del 1 %
de los leucocitos sanguíneos. Aunque normalmente no están presentes en los
tejidos, los basófilos pueden ser reclutados en algunas zonas inflamatorias. Los
basófilos contienen gránulos que se unen a pigmentos básicos y son capaces de
sintetizar muchos de los mismos mediadores que los mastocitos. Como los
mastocitos, los basófilos expresan receptores para la IgE, ligan IgE y pueden
activarse por la unión del antígeno a la IgE. Como el número de basófilos es bajo
en los tejidos, su importancia en la defensa del anfitrión y en las reacciones alérgicas
es incierta.
Los basófilos son principalmente responsables de las respuestas alérgicas ya que
liberan histamina, provocando vasodilatación. Su núcleo es bi- o tri-lobulado, pero
es difícil de detectar ya que se oculta por el gran número de gránulos gruesos, estos
gránulos son característicamente azules bajo la tinción HyE.
Eosinófilos.
Los eosinófilos son granulocitos sanguíneos que expresan gránulos citoplásmicos
que contienen enzimas lesivas para las paredes celulares de los parásitos, pero que
también pueden dañar los tejidos del anfitrión. Los gránulos de los eosinófilos
contienen proteínas básicas que ligan pigmentos ácidos como la eosina. Como los
neutrófilos y los basófilos, los eosinófilos derivan de la médula ósea. Las citocinas
GM-CSF, IL-3 e IL-5 promueven la maduración del eosinófilo a partir de los
precursores mielocíticos. Algunos eosinófilos están presentes normalmente en los
tejidos periféricos, en especial en los recubrimientos mucosos de las vías
respiratoria, digestiva y genitourinaria, y su número puede aumentar por su
reclutamiento de la sangre en el marco de la inflamación.
Los eosinófilos, ante todo, lidian con las infecciones parasitarias. También son las
células inflamatorias predominantes durante una reacción alérgica. Las causas más
importantes de eosinofilia incluyen alergias como: asma, rinitis alérgica y urticaria;
así como infecciones parasitarias. En general, su núcleo es bi-lobulado. El
citoplasma está lleno de gránulos que, con tinción de eosina, asumen un color
rosáceo-anaranjado característico.
Leucocitos fijos.
Algunos leucocitos migran a los tejidos del organismo para residir ahí
permanentemente y no en la circulación sanguínea. A menudo, estas células tienen
nombres específicos dependiendo de en qué tejido se instalen; un ejemplo son los
macrófagos fijos de hígado, conocidos como células de Kupffer. Estas células
siguen jugando un papel importante en el sistema inmune.
Histiocitos.
Un histiocito es un tipo de célula animal, perteneciente al tejido conjuntivo, que
ingiere sustancias extrañas para proteger al cuerpo de posibles infecciones. Su
función es inmunitaria, siendo un macrófago que permanece en un órgano concreto,
sin viajar a través de la sangre. Es una célula grande fagocitaria, que forma parte
del sistema fagocítico mononuclear.
Este tipo de célula se encuentra en gran parte de los órganos de los seres del reino
animal:
Ganglios linfáticos y amígdalas palatinas, bazo, hígado, placenta, tejido mamario y
perimamario, cerebro.
Un número irregular de histiocitos genera la patología llamada histiocitosis.
Células dendríticas (aunque estas suelen migrar a nódulos linfáticos locales al
ingerir antígenos)
Mastocitos.
Microglia.
Las microglías, microgliales o células de Hortega son células neurogliales del tejido
nervioso con capacidad fagocitaria que forman el sistema inmunitario del sistema
nervioso central. Se originan durante el desarrollo a partir de precursores
mesenquimales que, independientemente de la circulación sanguínea, penetran en
el parénquima cerebral. Durante la vida adulta se ha propuesto que se pueden
renovar por división in situ, a partir de precursores de la médula ósea, o desde
monocitos que alcanzan el sistema nervioso a través de la sangre. Sin embargo, la
producción de microglía a partir de precursores de la médula ósea o monocitos
circulantes sólo se ha observado tras irradiar el sistema nervioso central.
Representan el sistema mononuclear fagocítico en el sistema nervioso central.
Células presentadoras de antígenos.
Las células presentadoras de antígenos (APC) son células que capturan antígenos
microbianos y de otros tipos, que los muestran a los linfocitos y producen señales
que estimulan la proliferación y diferenciación de los linfocitos. Por acuerdo, APC
suele referirse a una célula que presenta antígenos a los linfocitos T. El principal
tipo de APC que participa en la iniciación de las respuestas de linfocitos T es la
célula dendrítica. Los macrófagos y los linfocitos B presentan antígenos a los
linfocitos T en las respuestas inmunitarias celulares y humorales, respectivamente.
Un tipo celular especializado llamado célula dendrítica folicular presenta los
antígenos a los linfocitos B durante fases particulares de las respuestas inmunitarias
humorales. Muchas APC, como las células dendríticas y los macrófagos, reconocen
también a los microbios y responden frente a ellos durante las reacciones
inmunitarias innatas y así unen las reacciones inmunitarias innatas a las respuestas
del sistema inmunitario adaptativo.
Células dendríticas.
Las células dendríticas son las APC más importantes que activan a los linfocitos T
vírgenes y pueden desempeñar funciones importantes en las respuestas innatas a
las infecciones y en la alianza entre las respuestas inmunitarias innatas y adaptativas. Tienen proyecciones membranarias largas y capacidad fagocítica, y están
distribuidas ampliamente en los tejidos linfáticos, el epitelio mucoso y el parénquima
de los órganos. La mayor parte de las células dendríticas constituyen la línea
mielocítica de células hematopoyéticas y surgen de un precursor que puede
diferenciarse también en monocitos, pero no en granulocitos. La maduración de las
células dendríticas depende de una citocina llamada ligando de Flt3, que se une al
receptor tirosina cinasa Flt3 situado en las células precursoras. De forma análoga a
los macrófagos, las células dendríticas expresan receptores que reconocen
moléculas producidas habitualmente por microbios y no por células de los
mamíferos, y responden a los microbios secretando citocinas. La mayoría de las
células dendríticas en la piel, las mucosas y el parénquima de los órganos, que se
llaman células dendríticas clásicas (o tradicionales), responden a los microbios
emigrando a los ganglios linfáticos, donde presentan los antígenos proteínicos
microbianos a los linfocitos T. Una subpoblación de células dendríticas, llamadas
células dendríticas plasmocitoides, responde pronto a la infección vírica. Reconocen
ácidos nucleicos de los virus intracelulares y producen proteínas solubles llamadas
interferones del tipo I, que tienen potentes actividades antivíricas. Las poblaciones
de células dendríticas pueden derivar también de precursores embrionarios y,
durante la inflamación, de monocitos.
Maduración de las células dendríticas. Las células dendríticas surgen de una
célula precursora común de la línea mielocítica en la médula ósea que se diferencia
en subgrupos, y los principales son las células dendríticas clásicas y las células
dendríticas plasmocitoides. Las células dendríticas inflamatorias pueden surgir de
los monocitos en los tejidos inflamados, y algunas células dendríticas residentes en
los tejidos, como las células de Langerhans de la piel, pueden surgir de precursores
embrionarios.
Otras células presentadoras de antígenos.
Además de las células dendríticas, los macrófagos y los linfocitos B son importantes
células presentadoras de antígenos para los linfocitos T cooperadores CD4+. Los
macrófagos presentan los antígenos a los linfocitos T cooperadores en los lugares
de la infección, lo que activa al linfocito T cooperador y lleva a la producción de
moléculas que activan aún más a los macrófagos. Este proceso es importante para
la erradicación de microbios ingeridos por los fagocitos que se resisten a ser
eliminados; en estos casos, los linfocitos T cooperadores aumentan mucho las
actividades microbicidas de los macrófagos. Los linfocitos B presentan antígenos a
los linfocitos T cooperadores, lo que es un paso clave en la cooperación de los
linfocitos T cooperadores con los linfocitos B en las respuestas de los anticuerpos
frente a antígenos proteínicos. Estas funciones presentadoras de los macrófagos y
los linfocitos B se expondrán en los capítulos 10 y 12. Los linfocitos T citotóxicos
(CTL) son linfocitos T CD8 + efectores que pueden reconocer antígenos en
cualquier tipo de célula nucleada y que se activan para matarla. Por tanto, todas las
células nucleadas pueden ser APC para los CTL.
Células dendríticas foliculares Las células dendríticas foliculares (FDC) son células
con proyecciones membranarias que se encuentran entremezcladas entre cúmulos
de linfocitos B activados en los folículos de los ganglios linfáticos, el bazo y los
tejidos linfáticos de las mucosas. Las FDC no derivan de precursores de la médula
ósea ni se relacionan con las células dendríticas que presentan antígenos a los
linfocitos T. Las FDC ligan antígenos proteínicos en sus superficies y los muestran
para su reconocimiento por los linfocitos B. Esto es importante para seleccionar
linfocitos B que expresen anticuerpos que se unan a antígenos con elevada afinidad.
Las FDC también contribuyen a la organización estructural de los folículos.
Linfocitos.
Los linfocitos, las células más características de la inmunidad adaptativa, son las
únicas células del cuerpo que expresan receptores para el antígeno distribuidos
deforma clonal, cada uno específico frente a un determinante antigénico diferente.
Cada clon de linfocitos T y B expresa receptores para el antígeno con una sola
especificidad, que es diferente de las especificidades de los receptores de todos los
demás clones. De este modo, los receptores para el antígeno de estos linfocitos
muestran una distribución clonal. Hay millones de clones de linfocito en el cuerpo,
que posibilitan que el organismo reconozca y responda a millones de antígenos
extraños.
La función de los linfocitos como mediadores en la inmunidad adaptativa se
estableció mediante varias líneas de evidencias durante décadas de investigación.
Uno de los primeros indicios vino de la observación de que los seres humanos con
estados de inmunodeficiencia congénita y adquirida tenían un número reducido de
linfocitos en la circulación periférica y en los tejidos linfáticos. Experimentos
realizados sobre todo con ratones mostraron que la inmunidad protectora frente a
los microbios puede transferirse de forma adoptiva desde animales inmunizados a
vírgenes solo con linfocitos o
sus productos secretados. Experimentos de laboratorio establecieron que el
estímulo de los linfocitos con antígenos da lugar a respuestas que muestran muchas
de las características de las respuestas inmunitarias inducidas en condiciones más
fisiológicas en vivo. Tras la identificación de los linfocitos como mediadores de la
inmunidad humoral y celular, se realizaron muchos descubrimientos a gran
velocidad sobre los diferentes tipos de linfocitos, sus orígenes en la médula ósea y
el timo, sus funciones en distintas respuestas inmunitarias y las consecuencias de
su ausencia. Entre los hallazgos más importantes, tenemos que los linfocitos
expresan receptores distribuidos de forma clonal, específicos y muy diversos frente
a los antígenos, los cuales no se encuentran en otros tipos celulares. Durante las
últimas tres décadas se ha acumulado una enorme cantidad de la información sobre
los genes, las proteínas y las funciones del linfocito. Probablemente ahora sabemos
más de los linfocitos que de ninguna otra célula en toda la biología. Una de las
cuestiones más interesantes sobre los linfocitos ha sido cómo se genera el enorme
y diverso repertorio de receptores para el antígeno con diferentes especificidades a
partir del pequeño número de genes para estos receptores que hay en línea
germinal. Ahora sabemos que los genes que codifican los receptores para el
antígeno de los linfocitos se forman por la recombinación de segmentos de ADN
durante la maduración de estas células. Hay un aspecto aleatorio en estas
recombinaciones somáticas que da lugar a la generación de millones de genes de
receptores diferentes y a un repertorio muy diverso de especificidades frente a
antígenos entre los diferentes clones de linfocitos. El número total de linfocitos en
un adulto sano es de 5 X 1011. De ellos, ~2% están en la sangre, ~4 en la piel,
~10% en la médula ósea, ~15% en los tejidos linfáticos mucosos de las vías
digestiva y respiratoria y ~65% en los órganos linfáticos (sobre todo, en el bazo y
los ganglios linfáticos). Describiremos por primera vez las propiedades de estas
células y su organización en varios tejidos linfáticos.
Subgrupos de linfocitos.
Los linfocitos constan de subgrupos distintos que difieren en sus funciones y
productos proteínicos. Todos los linfocitos tienen una forma similar y su aspecto no
refleja su heterogeneidad ni sus diversas funciones. Los linfocitos B, las células que
producen los anticuerpos, se llamaron así porque se ha visto que en las aves
maduran en un órgano llamado bolsa de Fabricio. En los mamíferos no existe ningún
equivalente anatómico de la bolsa y los primeros estadios de maduración del
Iinfocito B se producen en la médula ósea. De este modo, linfocitos B se refiere a
linfocitos derivados de la médula ósea (del inglés bone marrow). Los linfocitos T, los
mediadores de la inmunidad celular, surgen de la médula ósea, migran al timo y
maduran allí; linfocitos T se refiere a linfocitos derivados del timo. Existen subgrupos
de linfocitos B y T con diferentes características fenotípicas y funcionales. Los
principales subgrupos de linfocitos B son los linfocitos B foliculares, los linfocitos B
de la zona marginal y los linfocitos B -1, cada uno de los cuales se encuentra en
diferentes localizaciones anatómicas dentro de los tejidos linfáticos. Los linfocitos B
foliculares expresan tipos de anticuerpos muy diversos con distribución clonal que
sirven de receptores para el antígeno en la superficie celular, así como de moléculas
efectoras secretadas, clave de la inmunidad humoral adaptativa. Por el contrario,
los linfocitos B-l y los de la zona marginal producen anticuerpos con una diversidad
muy limitada.
Los dos principales subgrupos de linfocitos T son los linfocitos T cooperadores
CD4+ y los CTL CD8+, que expresan receptores para el antígeno llamado receptor
aB del linfocito T (TCR, del inglés T cell receptor) y actúan como mediadores de la
inmunidad celular. Los linfocitos T reguladores CD4+ son un tercer subgrupo de
linfocitos T que expresan receptores aB; su función es inhibir las respuestas
inmunitarias. Además, los linfocitos T NK y los linfocitos gamma y delta son dos
subgrupos numéricamente inferiores de linfocitos T que expresan TCR con una
diversidad limitada, como los anticuerpos producidos por los linfocitos B -1. La
expresión de varias proteínas de membrana se utiliza para distinguir las diferentes
poblaciones de linfocitos. Por ejemplo, la mayoría de los linfocitos T cooperadores
expresan una proteína de superficie llamada CD4 y la mayoría de los CTL expresan
una proteína de superficie diferente llamada CD8. A estas y a otras proteínas de
superficie se las llama a menudo marcadores, porque identifican y discriminan
(marcan) poblaciones celulares diferentes. Estos marcadores no solo perfilan
diferentes clases de linfocitos, sino que también tienen muchas funciones en los
tipos celulares o en que se expresan. La forma más frecuente de determinar si se
expresa un marcador fenotípico de superficie en una célula es probar si anticuerpos
específicos frente al marcador se unen a la célula. En este contexto, los
investigadores o los médicos utilizan los anticuerpos como herramientas analíticas.
Hay cientos de preparados puros de diferentes anticuerpos, llamados anticuerpos
monoclonales, cada uno específico frente a una molécula diferente y etiquetado con
sondas que pueden detectarse fácilmente en las superficies celulares mediante el
uso de los instrumentos apropiados. La nomenclatura de grupos de diferenciación
(CD, del inglés cluster of differentiation) es un método adoptado de forma uniforme
para nombrar las moléculas de la superficie celular que son características de una
línea celular en particular o de un estadio de diferenciación, tienen una estructura
definida y son reconocidas por un grupo (cluster) de anticuerpos monoclonales. De
este modo, todas las moléculas de superficie con una estructura bien definida
reciben un número CD (p. ej., CD1, CD2). Aunque diseñados en un principio para
designar subtipos de leucocitos, los marcadores CD se encuentran en todos los
tipos de células del cuerpo.
Maduración de los linfocitos. Los linfocitos se desarrollan a partir de células
troncales de la médula ósea, maduran en los órganos linfáticos generativos (médula
ósea y timo para los linfocitos B y T, respectivamente) y después circulan a través
de la sangre a los órganos linfáticos secundarios (ganglios linfáticos, bazo, tejidos
linfáticos regionales como los tejidos linfáticos asociados a mucosas). Los linfocitos
T maduros dejan el timo, pero los linfocitos B inmaduros abandonan la médula ósea
y completan su maduración en los órganos linfáticos secundarios. Los linfocitos
vírgenes pueden responder a los antígenos extraños en estos tejidos linfáticos
secundarios o volver mediante el drenaje linfático a la sangre y recircular a través
de otros órganos linfáticos secundarios.
Desarrollo de los linfocitos.
Después del nacimiento, los linfocitos, como todas las células sanguíneas, surgen
de las células troncales de la médula ósea. El origen de los linfocitos de progenitores
de la médula ósea se demostró por primera vez mediante experimentos con
quimeras de médula ósea inducidas con radiación. Los linfocitos y sus precursores
son radiosensibles y mueren con dosis altas de radiación gamma. Si se irradia un
ratón de una cepa endogámica y después se le inyectan células de la médula ósea
o un pequeño número de células troncales hematopoyéticas de otra cepa que
puedan distinguirse del anfitrión, todos los linfocitos que se desarrollen después
derivarán de células de la médula ósea o de células troncales hematopoyéticas del
donante. Estos métodos han sido útiles para examinar la maduración de los
linfocitos y de otras células sanguíneas. Todos los linfocitos pasan por estadios
complejos de maduración durante los cuales expresan receptores para el antígeno
y adquieren las características funcionales y fenotípicas de las células maduras .
Las zonas anatómicas donde tienen lugar los principales pasos del desarrollo del
linfocito se denominan órganos linfáticos generadores. Entre ellos están la médula
ósea, donde surgen los precursores de todos los linfocitos y maduran los linfocitos
B, y el timo, donde maduran los linfocitos T. Estos linfocitos B y T maduros se llaman
linfocitos vírgenes. Los linfocitos vírgenes no tienen actividad funcional, pero
después de activarse por el antígeno, proliferan y experimentan cambios
espectaculares en su fenotipo y en su actividad funcional.
Poblaciones de linfocitos que se distinguen por la historia de exposición al
antígeno.
Los linfocitos vírgenes que emergen de la médula ósea o del timo migran a los
órganos linfáticos periféricos, donde los antígenos los activan para que proliferen y
se diferencien en células efectoras y memoria, algunas de las cuales migran a los
tejidos. La activación de los linfocitos sigue una serie de pasos secuenciales que
empiezan con la síntesis de nuevas proteínas, como receptores para citocinas y
citocinas, que son necesarios para muchos de los cambios posteriores. Las células
vírgenes proliferan después, lo que da lugar a un aumento del tamaño de clones
específicos frente al antígeno, un proceso que se llama expansión clonal. En
algunas infecciones, el número de linfocitos T específicos frente a los microbios
puede aumentar más de 50,000 veces, y el número de linfocitos B específicos puede
aumentar hasta 5,000 veces. Esta rápida expansión clonal de linfocitos específicos
frente al microbio es necesaria para mantenerse a la altura de la capacidad de los
microbios de replicarse rápidamente. A la vez que la expansión clonal, los linfocitos
estimulados por el antígeno se diferencian en células efectoras, cuya función es
eliminar el antígeno. Parte de la progenie de linfocitos T y B estimulados por el
antígeno se diferencia en células memoria de vida larga, cuya función es mediar
respuestas rápidas y potenciadas (es decir, secundarias) a exposiciones posteriores
a los antígenos. Siempre hay mezclas (linfocitos vírgenes, efectores y memoria) en
varios lugares por todo el cuerpo, y estas poblaciones pueden distinguirse por
diversos criterios funcionales y fenotípicos.
Linfocitos vírgenes.
Los linfocitos vírgenes son linfocitos T o B maduros que residen en los órganos
linfáticos periféricos y en la circulación, y que nunca se han encontrado con un
antígeno extraño. (El término virgen se refiere a la idea de que estas células carecen
de experiencia inmunitaria porque no han estado en contacto con el antígeno.) Los
linfocitos vírgenes suelen morir 1 a 3 meses después si no reconocen antígenos.
Los linfocitos vírgenes y memoria se denominan linfocitos en reposo, porque no se
dividen activamente ni están realizando ninguna función efectora. Los linfocitos T y
B vírgenes (y memoria) no pueden distinguirse fácilmente por su morfología, y a
ambos se les denomina a menudo linfocitos pequeños cuando se los observa en
extensiones sanguíneas. Un linfocito pequeño tiene 8 a 10 um de diámetro y un
gran nucléolo con heterocromatina densa, y un anillo fino de citoplasma que
contiene algunas mitocondrias, ribosomas y lisosomas, pero ningún orgánulo
especializado visible. Antes del estímulo antigénico, los linfocitos vírgenes están en
un estado de reposo, o en el estadio G0 del ciclo celular. En respuesta a la
estimulación, entran en el estadio Gj del ciclo celular antes de comenzar a dividirse.
Los linfocitos activados son más grandes (10a 12 um de diámetro), tienen más
citoplasma y orgánulos y mayores cantidades de ARN citoplásmico, y se denominan
linfocitos grandes o Iinfoblastos. La supervivencia de los linfocitos vírgenes depende
de o las señales generadas por receptores para el antígeno y por citocinas. Se
propone que el receptor para el antígeno de los linfocitos B vírgenes genera señales
de supervivencia incluso sin el antígeno. Los linfocitos T vírgenes reconocen
débilmente varios antígenos propios, lo suficiente para generar señales de
supervivencia, pero sin desencadenar las fuertes señales necesarias para iniciar la
expansión clonal y su diferenciación en células efectoras. La necesidad de expresar
un receptor para el antígeno con el fin de mantener la reserva de linfocitos vírgenes
en los órganos periféricos se demostró en estudios con ratones en los que se
eliminaron los genes que codifican los receptores para el antígeno de los linfocitos
B o T después de que los linfocitos maduraran. En estos estudios, los linfocitos
vírgenes que pierden sus receptores para el antígeno mueren en 2 o 3 semanas.
Las citocinas son también esenciales para la supervivencia de los linfocitos
vírgenes, y los linfocitos B y T vírgenes expresan receptores para estas citocinas.
Las más importantes de estas citocinas son la interleucina 7 (IL-7), que promueve
la supervivencia y, quizás, el cambio de ciclo de baja intensidad de linfocitos T
vírgenes, y el factor activador del linfocito B (BAEE), una citocina que pertenece a
la familia TNE, que es preciso para la supervivencia de los linfocitos B virgen. En el
estado estable, la reserva de linfocitos vírgenes se mantiene en un número bastante
constante debido a un equilibrio entre la muerte espontánea de estas células y la
generación de células nuevas en los órganos linfáticos generadores. Cualquier
pérdida de linfocitos lleva a una proliferación compensadora de los restantes y a
una mayor producción en los órganos generadores. Una demostración de la
capacidad de la población de linfocitos de rellenar el espacio disponible es el
fenómeno de la proliferación homeostática. Si se transfieren células vírgenes a un
anfitrión que tiene una deficiencia de linfocitos (se dice que es linfopénico), los
linfocitos transferidos empiezan a proliferar y a aumentar en número hasta que
alcanzan aproximadamente las cifras de linfocitos de los animales normales. Este
proceso se produce en la situación clínica del trasplante de células troncales
hematopoyéticas para el tratamiento de ciertas neoplasias malignas y de
enfermedades génicas. La proliferación homeostática parece estar dirigida por las
mismas señales —reconocimiento débil de algunos antígenos propios y de
citocinas, sobre todo de IL-7— necesarias para el mantenimiento de los linfocitos
vírgenes.
Pasos en la activación del linfocito. Los linfocitosT vírgenes que surgen del timo
y los linfocitos B inmaduros que surgen de la médula ósea migran en los órganos
linfáticos secundarios, incluidos los ganglios linfáticos y el bazo. En estas
localizaciones, los linfocitos B completan su maduración; los linfocitos B y T vírgenes
activados por antígenos se diferencian en linfocitos efectores y memoria. Algunos
linfocitos efectores y memoria migran a zonas de infección en tejidos periféricos.
Los anticuerpos secretados por los linfocitos B efectores en el ganglio linfático, el
bazo y la médula ósea (no mostrado) entran en la sangre y llegan a los lugares de
infección.
Linfocitos efectores.
Después de activarse los linfocitos vírgenes, se hacen más grandes y comienzan
a proliferan. Algunas de estas células se diferencian en linfocitos efectores, que
tienen la capacidad de producir moléculas capaces de eliminar antígenos extraños.
Los linfocitos T efectores son los linfocitos cooperadores y los CTL, y los linfocitos
B efectores son células secretoras de anticuerpos, incluidas las células plasmáticas.
Los linfocitos T cooperadores, que suelen ser CD4+, expresan moléculas de
superficie, como el ligando de CD40 (CD154), y secretan o citocinas que se unen a
los receptores en los macrófagos y los linfocitos B, lo que los activa. Los CTL tienen
gránulos cito- plásmicos llenos de proteínas que, cuando se liberan, matan a las
células que los CTL reconocen, que suelen ser células infectadas por virus y
tumorales. Los linfocitos T efectores CD4+ y CD8 + suelen expresar proteínas de
superficie indicativas de una activación reciente, como CD25 (un componente del
receptor para IL-2, el factor de crecimiento del linfocito T) y patrones alterados de
moléculas de adhesión (selectinas e integrinas). La mayoría de los linfocitos T
efectores diferenciados viven poco tiempo y no se autorrenuevan. Muchos linfocitos
B secretores de anticuerpos pueden identificarse en función de su forma como
células plasmáticas. Tienen núcleos característicos colocados de forma excéntrica
en la célula y con la cromatina distribuida alrededor de la membrana nuclear en un
patrón en rueda de carreta, citoplasma abundante con un retículo endoplásmico
rugoso denso, que es el lugar donde se sintetizan anticuerpos (y otras proteínas de
membrana y secretadas), y complejos de Golgi perinucleares diferenciados, donde
las moléculas de anticuerpo se convierten en sus formas finales y se empaquetan
para su secreción. Se calcula que la mitad o más del ARN mensajero de las células
codifican proteínas de anticuerpo y una sola célula plasmática puede secretar miles
de moléculas de anticuerpos por segundo. Las células plasmáticas se desarrollan
en órganos linfáticos y en los lugares de las respuestas inmunitarias, y algunas de
ellas migran a la médula ósea, donde pueden vivir y secretar anticuerpos durante
períodos largos después de la inducción de la respuesta inmunitaria e incluso
después de eliminarse el antígeno. Los plasmoblastos, que son los precursores
circulantes de las células plasmáticas de vida larga, pueden encontrarse en la
sangre en cifras bajas.
Linfocitos memoria.
Los linfocitos memoria pueden sobrevivir en un estado funcional inactivo o de
cambio lento de ciclo durante meses o años sin necesidad de estimulación por el
antígeno y, probablemente, después de que se elimine el antígeno. Pueden
identificarse por su expresión de proteínas de superficie, que los distingue de los
linfocitos efectores vírgenes o recién activados, aunque no está claro cuáles de
estas proteínas de superficie son marcadores definitivos de las poblaciones
memoria. Los linfocitos T memoria, como los linfocitos T vírgenes, pero no los
efectores, expresan cantidades altas del receptor de la IL-7 (CD 127). Los linfocitos
T memoria también expresan moléculas de superficie que promueven su migración
a las zonas de infección en cualquier lugar del cuerpo. En los seres humanos, la
mayoría de los linfocitos vírgenes T expresan una isoforma de 200 kDa de una
molécula de superficie llamada CD45, que contiene un segmento codificado por un
exón designado A y se llama, por lo tanto, CD45RA (por «restringido a A»), Por el
contrario, la mayoría de los linfocitos T activados y memoria expresan una isoforma
de 180 kDa de CD45 en la que se ha eliminado el ARN del exón A; esta isoforma
se llama CD45RO. Sin embargo, esta forma de distinguir los linfocitos T vírgenes
de los de memoria no es perfecta, y se ha registrado la interconversión entre
poblaciones CD45RA+ y CD45RO+. Los linfocitos B memoria pueden expresar
ciertas clases (isotipos) de Ig de membrana (p. ej., IgG, IgE o IgA), como resultado
del cambio de isotipo, mientras que los linfocitos B vírgenes solo expresan IgM e
IgD. En los seres humanos, la expresión de CD27 es un marcador de los linfocitos
B memoria. Las células memoria parecen heterogéneas y hay subgrupos que
difieren, especialmente con respecto a su localización y propiedades migratorias.
Las características que distinguen a los linfocitos vírgenes, efectores y memoria
reflejan diferentes programas de expresión génica que están regulados por factores
de transcripción y por cambios epigénicos estables, como la metilación y acetilación
de histonas y la reestructuración de la cromatina. Por ejemplo, es necesario un
factor de transcripción llamado factor 2 similar a Kruppel (KLF-2) para el
mantenimiento del fenotipo del linfocito T virgen. Los fenotipos de diferentes tipos
funcionales de linfocitos T efectores CD4+, llamados linfocitos Th1, Th2 y Th17,
dependen de los factores de transcripción T- bet, GATA-3 y ROR7 T,
respectivamente, así como de cambios epigénicos en loci de genes de citocinas.
Son necesarios otros factores de transcripción para mantener los fenotipos de los
linfocitos B y T memoria. Nuestro conocimiento de estos determinantes moleculares
del fenotipo del linfocito maduro es todavía incompleto y está evolucionando.
Células linfocíticas innatas.
Las células linfocíticas innatas (ILC, del inglés innate lymphoid cells) comprenden
varios subgrupos de células relacionadas que derivan de la médula ósea, con forma
de linfocito y funciones efectoras similares a las de los linfocitos T, pero que carecen
de receptores para el antígeno del linfocito T. Las principales funciones de las ILC
son proporcionar una defensa temprana contra los microorganismos patógenos
infecciosos, reconocer células estresadas y dañadas del anfitrión y ayudar a
eliminarlas e influir en la naturaleza de la respuesta inmunitaria adaptativa posterior.
Las primeras células linfocíticas innatas y las mejor caracterizadas son los linfocitos
citolíticos espontáneos (NK, del inglés natural killer), que matan a las células
infectadas y dañadas y secretan IFN-7 , una citocina que también produce el
subgrupo ThI de linfocitos T efectores CD4+. Otros subgrupos de células linfocíticas
innatas secretan citocinas que producen también ciertos subgrupos de linfocitos T
cooperadores CD4+, como la LL-5, la IL-13, la IL-17 y la IL-22.
ANATOMÍA Y FUNCIONES DE LOS TEJIDOS LINFÁTICOS.
Para optimizar las interacciones celulares necesarias para el reconocimiento del
antígeno y la activación del linfocito en las respuestas inmunitarias adaptativas, los
linfocitos y las APC se localizan y concentran en tejidos u órganos anatómicos, que
también son los lugares a donde se transportan y en donde se concentran antígenos
extraños. Tal compartimentalización anatómica no es fija, porque muchos linfocitos
recirculan constantemente y cambian entre la circulación y los tejidos. Los tejidos
linfáticos se clasifican en órganos generadores, también llamados órganos linfáticos
primarios o centrales, donde los linfocitos expresan por primera vez receptores para
el antígeno y consiguen la madurez fenotípica y funcional, y en órganos periféricos,
también llamados órganos linfáticos secundarios, donde se inician y desarrollan las
respuestas del linfocito a antígenos extraños. Dentro de los órganos linfáticos
generadores en los mamíferos adultos se encuentran la médula ósea y el timo, los
lugares de maduración para los linfocitos B y los linfocitos T, respectivamente. Los
linfocitos B maduran parcialmente en la médula ósea, entran en la circulación,
pueblan los órganos linfáticos secundarios, incluidos el bazo y los ganglios linfáticos,
y completan su maduración principalmente en el bazo. Los linfocitos T maduran
completamente en el timo, después entran en la circulación y pueblan los órganos
linfáticos periféricos y los tejidos. Dos importantes funciones compartidas por los
órganos generadores son proporcionar factores de crecimiento y otras señales
moleculares necesarias para la maduración del linfocito, y presentar antígenos
propios para el reconocimiento y la selección de linfocitos en proceso de
maduración. Los tejidos linfáticos periféricos son los ganglios linfáticos, el bazo, el
sistema inmunitario cutáneo y el sistema inmunitario mucoso. Además, en tejido
conectivo y en muchos órganos se encuentran agregados de linfocitos poco
definidos. Todos los órganos linfáticos periféricos comparten funciones comunes,
como el transporte de antígenos y de linfocitos vírgenes respondedores en el mismo
lugar, de manera que puedan iniciarse las respuestas inmunitarias adaptativas, y la
organización anatómica que permite que los linfocitos T y B interactúen de forma
conjunta.
Médula ósea.
La médula ósea es el lugar de generación de la mayoría de las células sanguíneas
circulantes maduras, incluidos los eritrocitos, los granulocitos y los monocitos, y el
lugar donde tienen lugar los primeros acontecimientos madurativos del linfocito B.
La generación de todas las células sanguíneas, llamada hematopoyesis, ocurre al
principio, durante el desarrollo fetal, en los islotes sanguíneos del saco vitelino y en
el mesénquima para aórtico, después se desplaza al hígado entre el tercer y cuarto
mes de gestación, y finalmente cambia a la médula ósea. En el nacimiento, la
hematopoyesis tiene lugar, sobre todo, en los huesos de todo el esqueleto, pero
cada vez se restringe más a la médula de los huesos planos, de manera que, en la
pubertad, la hematopoyesis se produce sobre todo en el esternón, las vértebras, los
huesos ilíacos y las costillas. La médula roja que se encuentra en estos huesos
consta de una estructura reticular espongiforme localizada entre trabé- culas óseas
largas. Los espacios en esta estructura contienen una red de sinusoides llenos de
sangre recubiertos de células o endoteliales unidas a una membrana basal
discontinua. Fuera de los sinusoides hay grupos de precursores de células
sanguíneas en varios estadios de desarrollo, así como adipocitos maduros. Los
precursores de las células sanguíneas maduran y migran a través de la membrana
basal sinusoidal y entre las células endoteliales para entrar en la circulación
vascular. Cuando la médula ósea se daña o cuando se produce una demanda
excepcional de producción de células sanguíneas nuevas, el hígado y el bazo se
convierten a veces en zonas de hematopoyesis extramedular. Los eritrocitos, los
granulocitos, los monocitos, las células dendríticas, las plaquetas y los linfocitos B,
T y NK se originan todos de una célula troncal hematopoyética (HSC, del inglés
hematopoietic stem cell) común en la médula ósea. Las HSC son pluripotentes, lo
que significa que una sola HSC puede generar todos los diferentes tipos de células
sanguíneas maduras. Las HSC se autorrenuevan, porque cada vez que se dividen,
al menos una célula hija mantiene las propiedades de la célula troncal, mientras que
la otra puede diferenciarse a lo largo de una línea particular (lo que se llama división
asimétrica). Las HSC pueden identificarse por la presencia de marcadores de
superficie, como las proteínas CD 34 y c-Kit, y la falta de marcadores específicos
de línea que se expresan en las células maduras. Las HSC se mantienen dentro de
nichos anatómicos microscópicos especializados en la médula ósea. En estas
localizaciones, las células estromales no hematopoyéticas proporcionan señales
dependientes del contacto y factores solubles necesarios para el ciclo continuo de
las HSC. Las HSC dan lugar a dos tipos de células progenitoras pluripotentes, uno
que genera células linfocíticas y mielocí- ticas y otro que produce más células
mielocíticas, eritrocitos y plaquetas. El progenitor común mielocítico-linfocítico da
lugar a precursores comprometidos de las líneas celulares del linfocito T, el linfocito
B o la célula linfocítica innata, así como algunas células mielocíticas. Los
progenitores comunes mielocíticos-megacariocíticos-eritrocíticos dan lugar a
precursores comprometidos de las líneas eritrocítica, megacariocítica, granulocítica
y monocítica, que dan lugar, respectivamente, a eritrocitos, plaquetas, granulocitos
(neutrófilos, eosinófilos, basófilos) y monocitos maduros. La mayoría de las células
dendríticas proceden de una rama de la línea monocítica. La proliferación y
maduración de las células precursoras en la médula ósea está estimulada por
citocinas. Muchas de estas citocinas se llaman factores estimuladores de colonias,
porque se detectaron en un principio por su capacidad de estimular el crecimiento y
el desarrollo de varias colonias leucocíticas o eritroides de células medulares. Las
citocinas hematopoyéticas las producen las células estromales y los macrófagos en
la médula ósea, lo que proporciona el ambiente local para la hematopoyesis.
También las producen linfocitos T estimulados por el antígeno y macrófagos
activados por citocinas o microbios, lo que proporciona un mecanismo para el
reabastecimiento de los leucocitos que puedan haberse consumido durante las
reacciones inflamatorias e inmunitarias. Además de las células troncales que se
autorrenuevan y su progenie en proceso de diferenciación, la médula contiene
numerosas células plasmáticas secretoras de anticuerpos de vida larga. Estas
células se generan en los tejidos linfáticos periféricos como consecuencia del
estímulo antigénico de los linfocitos B que después migran a la médula ósea. La
médula también contiene linfocitos B foliculares maduros recirculantes que pueden
responder allí a los microbios vehiculados por la sangre. Además, algunos linfocitos
T memoria de vida larga también migran a la médula ósea y residen allí.
Timo.
El timo es el lugar de maduración del linfocito T. El timo es un órgano bilobulado
situado en la región anterior del mediastino. Cada lóbulo se divide en múltiples
lóbulos por medio de tabiques fibrosos, y cada lóbulo consta de una corteza externa
y una médula interna. La corteza contiene un cúmulo denso de linfocitos T y la
médula que se tiñe de forma más tenue está poblada de forma más escasa por
linfocitos. Los macrófagos y las células dendríticas derivados de la médula ósea se
encuentran casi exclusivamente en la médula. Dispersos a lo largo del timo están
las células epitelioides no linfáticas, que tienen abundante citoplasma. Las células
epiteliales de la corteza tímica producen la IL-7, que es necesaria en fases
tempranas del desarrollo del linfocito T. Un subgrupo diferente de células
epitelioides que se encuentran solo en la médula, llamadas células epitelioides
medulares tímicas (TMEC), desempeñan una función especial en la presentación
de antígenos propios a los linfocitos T en desarrollo y provocan su eliminación. Este
es uno de los mecanismos que aseguran que el sistema inmunitario siga tolerando
lo propio. En la médula hay estructuras llamadas corpúsculos de Hassall, que están
compuestos de espirales muy compactadas de células epiteliales que pueden ser
restos de células en degeneración. El timo tiene un aporte vascular rico y vasos
linfáticos eferentes que drenan en los ganglios linfáticos mediastínicos. El
componente epitelial del timo deriva de invaginaciones del ectodermo en el cuello y
el tórax del embrión, que forma estructuras llamadas bolsas branquiales. Las células
dendríticas, los macrófagos y los precursores de los linfocitos derivan de la médula
ósea. Los seres humanos con síndrome de DiGeorge sufren una deficiencia de
linfocitos T debida a una deleción cromosómica que elimina los genes necesarios
para el desarrollo del timo. En la cepa de ratones desnudos, que se ha usado
ampliamente en la investigación inmunológica, una mutación en el gen que codifica
un factor de transcripción causa un fallo en la diferenciación de ciertos tipos de
células epiteliales que son necesarias para el desarrollo normal del timo y los
folículos pilosos. En consecuencia, estos ratones carecen de linfocitos T y de pelo.
Los linfocitos en el timo, también llamados timocitos, son linfocitos T en varios
estadios de maduración. Las células más inmaduras entran en el timo y su
maduración comienza en la corteza. A medida que los timocitos maduran, migran
hacia la médula, de modo que la médula contiene la mayoría de los linfocitos T
maduros. Solo salen del timo linfocitos T maduros, y entran en la sangre y los tejidos
linfáticos periféricos.
Morfología del Timo.
Sistema linfático.
El sistema linfático consiste en vasos especializados que drenan el líquido de los
tejidos a los ganglios linfáticos y después hacia la sangre. Es esencial para la
homeostasis hídrica y las respuestas inmunitarias. El líquido intersticial se forma de
manera constante en todos los tejidos vascularizados por el movimiento de un
filtrado de plasma que sale de los capilares, y la velocidad de formación local puede
aumentar espectacularmente cuando el tejido se lesiona o infecta. La piel, el epitelio
y los órganos parenquimatosos contienen numerosos capilares linfáticos que
absorben este líquido de los espacios que hay entre las células tisulares. Los
capilares linfáticos son conductos vasculares con un extremo ciego recubiertos de
células endoteliales solapadas sin las uniones intercelulares herméticas ni
membrana basal que son típicas de los vasos sanguíneos. Estos capilares linfáticos
permiten la captación libre de líquido intersticial, y la disposición solapada de las
células endoteliales y las válvulas en una dirección dentro de sus luces impide el
reflujo de líquido. El líquido absorbido, llamado linfa, se bombea hacia vasos
linfáticos cada vez mayores y convergentes por la contracción de células
musculares lisas perilinfáticas y por la presión ejercida por el movimiento de los
tejidos musculoesqueléticos. Estos vasos se funden en linfáticos aferentes que
drenan en los ganglios linfáticos, y la linfa sale de los ganglios a través de los
linfáticos eferentes. Como los ganglios linfáticos están conectados en serie por los
linfáticos, un linfático eferente que sale de un ganglio puede servir de vaso aferente
para otro. El vaso linfático eferente al final de una cadena de ganglios linfáticos se
une a otros vasos linfáticos, lo que finalmente culmina en un gran vaso linfático
llamado conducto torácico. La linfa procedente del conducto torácico se vacía en la
vena cava superior, lo que devuelve el líquido al torrente sanguíneo. Los linfáticos
procedentes de la región superior derecha del tronco, el brazo derecho y el lado
derecho de la cabeza drenan en el conducto linfático derecho, que también drena
en la vena cava superior. A la circulación vuelven cada día 2 litros de linfa
normalmente, y la interrupción del sistema linfático por tumores o algunas
infecciones parasitarias puede provocar una tumefacción tisular grave. El sistema
linfático recoge antígenos microbianos de las puertas de entrada y los transporta a
los ganglios linfáticos, donde pueden estimular respuestas inmunitarias adaptativas.
Los microbios entran en el cuerpo más a menudo a través de la piel y los aparatos
digestivo y respiratorio. Todos estos tejidos están recubiertos de un epitelio que
contiene células dendríticas y todos drenan en los vasos linfáticos. Las células
dendríticas capturan antígenos microbianos y entran en los vasos linfáticos. Otros
microbios y antígenos solubles pueden entrar en los linfáticos independientemente
de las células dendríticas. Además, los mediadores inflamatorios solubles, como las
quimiocinas, que son producidos en los lugares de infección entran en los linfáticos.
Los ganglios linfáticos están interpuestos a lo largo de los vasos linfáticos y actúan
como filtros que muestrean los antígenos solubles y asociados a la célula dendrítica
en la linfa antes de que alcance la sangre. Los antígenos capturados pueden ser
vistos por las células del sistema inmunitario adaptativo.
El sistema linfático. Se ilustran los principales vasos linfáticos, que drenan en la
vena cava inferior (y la vena cava superior, no mostrada), y cúmulos de ganglios
linfáticos. Se capturan antígenos de la zona de infección y se transportan al ganglio
linfático que drena la zona, donde se inicia la respuesta inmunitaria.
Ganglios linfáticos.
Los ganglios linfáticos son órganos linfáticos secundarios vascularizados y
encapsulados con características anatómicas que favorecen el inicio de respuestas
inmunitarias adaptativas frente a antígenos transportados por los vasos linfáticos
desde los tejidos. Los ganglios linfáticos están situados a lo largo de los conductos
linfáticos por todo el cuerpo y, por tanto, tienen acceso a antígenos que se
encuentran en el epitelio y se originan en el líquido intersticial en la mayoría de los
tejidos. En el cuerpo humano hay alrededor de 500 ganglios linfáticos. Un ganglio
linfático está rodeado de una cápsula fibrosa, por debajo de la cual hay un sistema
sinusal recubierto de células reticulares, unidas por fibrillas de colágeno y otras
proteínas de la matriz extracelular, y lleno de linfa, macrófagos, células dendríticas
y otros tipos celulares. Los linfáticos aferentes se vacían en el seno subcapsular
(marginal) y la linfa puede drenar desde allí directamente al seno medular conectado
y después salir del ganglio linfático a través de los linfáticos eferentes. Por debajo
del suelo interno del seno subcapsular está la corteza rica en linfocitos. La corteza
externa contiene agregados de células llamados folículos. Algunos folículos
contienen zonas centrales llamadas centros germinales, que se tiñen ligeramente
con los pigmentos histológicos de uso habitual. Cada centro germinal consiste en
una zona oscura llena de linfocitos B en proliferación llamados centroblastos y en
una zona clara que contiene células llamadas centrocitos que han dejado de
proliferar y están siendo seleccionadas para sobrevivir y diferenciarse más. Los
folículos sin centros germinales se llaman folículos primarios, y los que tienen
centros germinales son los folículos secundarios. La corteza que hay alrededor de
los folículos se llama corteza parafolicular o paracorteza, y se organiza en cordones,
que son regiones con una microanatomía compleja de proteínas de la matriz, fibras,
linfocitos, células dendríticas y fagocitos mononucleares.
Organización anatómica de los linfocitos B y T.
Los linfocitos B y T están secuestrados en regiones diferentes de la corteza de los
ganglios linfáticos, cada una con su propia arquitectura de fibras reticulares y células
estromales. Los folículos son zonas de linfocitos B. Se localizan en la corteza del
ganglio linfático y se organizan alrededor de las FDC, que tienen procesos que se
interdigitan para formar una red densa. Los folículos primarios contienen, sobre
todo, linfocitos vírgenes B maduros. Los centros germinales se desarrollan en
respuesta a una estimulación antigénica. Son lugares con proliferación notable de
linfocitos B, selección de linfocitos B productores de anticuerpos de afinidad alta y
generación de linfocitos B memoria y células plasmáticas de vida larga. Los
linfocitos T se localizan, sobre todo, por debajo y más centrales respecto a los
folículos, en los cordones paracorticales. Estas zonas ricas en linfocitos T, con
frecuencia llamadas paracorteza, contienen una red de células reticulares
fibroblásticas (FRC, del inglés fibroblastic reticular cells), muchos de los cuales
forman la capa externa de estructuras tubulares llamadas conductos de FRC (fig. 214). Los conductos tienen un diámetro de 0.2 a 3 um y contienen series organizadas
de moléculas de la matriz extracelular, incluidos haces paralelos de fibras de
colágeno embebidas en una red de microfibras de fibrilina, todas rodeadas de una
membrana basal producida por un manguito de FRC. Estos conductos comienzan
en el seno subcapsular y se extienden a los vasos linfáticos del seno medular y los
vasos sanguíneos corticales, que se llaman vénulas de endotelio alto (HEV, del
inglés high endotelial venules). Los linfocitos T vírgenes entran en las zonas de
linfocitos T a través de las HEV. Los linfocitos T están muy apretados alrededor de
los conductos en la corteza del ganglio linfático. La mayoría (~70%) de los linfocitos
T corticales son linfocitos T CD4+ cooperadores, entremezclados con una relativa
escasez
de
linfocitos
CD8
+.
Estas
proporciones
pueden
cambiar
espectacularmente durante el curso de una infección. Por ejemplo, durante una
infección vírica, puede haber un aumento acentuado de linfocitos T CD8 +. Las
células dendríticas se concentran también en la paracorteza de los ganglios
linfáticos, muchos de los cuales se asocian estrechamente a los conductos de FRC.
La segregación anatómica de los linfocitos B y T en diferentes zonas del ganglio
depende de citocinas que secretan las células estromales del ganglio linfático en
cada zona y que dirigen la migración de los linfocitos. Los linfocitos B y T vírgenes
llegan al ganglio a través de una arteria y abandonan la circulación y entran en el
estroma del ganglio a través de las HEV, que se localizan en el centro de los
cordones corticales. El tipo de citocinas que determina dónde residen los linfocitos
B y T en el ganglio se llaman quimiocinas (citocinas quimiotácticas), que se unen a
receptores para las quimiocinas situados en los linfocitos. Las quimiocinas son una
gran familia de citocinas de 8 a 10 kDa que participan en una gran variedad de
funciones relacionadas con la motilidad celular e intervienen en el desarrollo, el
mantenimiento de la arquitectura tisular y las respuestas inmunitarias e
inflamatorias. Los linfocitos vírgenes T expresan un receptor llamado CCR7, que se
une a las quimiocinas CCL19 y CCL21 producidas por las células estromales en las
zonas de linfocitos T del ganglio linfático. Estas quimiocinas promueven el
movimiento del linfocito T virgen desde la sangre, a través de la pared de las HEV,
hacia la zona de linfocitos T. Las células dendríticas que son activadas por los
microbios y entran en el ganglio a través de los linfáticos también expresan CCR7,
y esta es la razón por la que migran a la misma zona del ganglio que los linfocitos T
vírgenes. Los linfocitos B vírgenes expresan cantidades bajas de CCR7 y mayores
de otro receptor para quimiodnas, CXCR5, que reconoce una quimiocina, CXCL13,
producida solo en los folículos por las FDC. De este modo, los linfocitos B vírgenes
circulantes también entran en los ganglios linfáticos a través de las HEV y después
son atraídos por los folículos. Otra citocina llamada linfotoxina (que no es una
quimiocina) interviene en la estimulación de la producción de CXCL13,
especialmente en los folículos. Las funciones de las quimiocinas y de otras citocinas
en la regulación del lugar donde se localizan los linfocitos en los órganos linfáticos
y en la formación de estos órganos se han establecido mediante numerosos
estudios realizados en ratones. Por ejemplo, los ratones que carecen de CXCR5 no
tienen folículos con linfocitos B en los ganglios linfáticos y el bazo, y los ratones que
carecen de CCR7 no tienen zonas de linfocitos T. El desarrollo de los ganglios
linfáticos, así como de otros órganos linfáticos periféricos, depende de las células
inductoras del tejido linfático y de las acciones coordinadas de varias citocinas,
quimiocinas y factores de transcripción. Durante la vida fetal, las células inductoras
del tejido linfático, que son un subgrupo de células linfocíticas innatas mencionadas
previamente, estimulan el desarrollo de los ganglios linfáticos y de otros órganos
linfáticos secundarios. Esta función está mediada por varias proteínas expresadas
por las células inductores; las más estudiadas han sido las citocinas Iinfotoxina a
(LTa) y linfotoxina B (LTB). Los ratones que carecen de estas citocinas no tienen
ganglios linfáticos ni tejidos linfáticos secundarios en el intestino. El desarrollo de la
pulpa blanca esplénica también está desorganizado en estos ratones. La LTB
producida por las células inductoras estimula a las células estromales en los
diferentes lugares en que se está desarrollando un órgano linfático secundario para
que secreten quimiocinas que ayuden a organizar la estructura de los órganos
linfáticos. Las FDC son activadas por la LTB para producir la quimiocina CXCL13,
que sirve para reclutar linfocitos B y organizar el folículo en desarrollo. Las FRC se
activan para producir CCL19 y CCL21, que reclutan linfocitos T y células dendríticas
y forman la zona del linfocito T. La segregación anatómica de los linfocitos B y T
asegura que cada población linfocítica esté en estrecho contacto con la APC
apropiada, es decir, los linfocitos T con las células dendríticas y los linfocitos B con
la FDC. Además, debido a esta segregación precisa, las poblaciones de linfocitos B
y T se mantienen aparte hasta que llega el momento de que interaccionen entre sí
de forma funcional. Después de la estimulación con el antígeno, los linfocitos T y B
cambian la expresión de receptores para quimiocinas y empiezan a migrar los unos
hada los otros en respuesta a las señales de las quimiocinas y de otros mediadores.
Los linfocitos T activados migran hacia los folículos para ayudar a los linfocitos B o
salir del ganglio y entrar en la circulación. Los linfocitos B activados migran hacia
los centros germinales y, después de diferenciarse en células plasmáticas, pueden
alojarse en la médula ósea.
Transporte de antígenos a través de los ganglios linfáticos.
Las sustancias transportadas por la linfa que entran en el seno subcapsular del
ganglio linfático se clasifican por su tamaño molecular y se transportan a diferentes
tipos celulares para iniciar varias respuestas inmunitarias. El suelo del seno
subcapsular está construido de forma que permita a las células del seno entrar en
contacto o migrar hacia la corteza subyacente, pero no permite el movimiento libre
de moléculas solubles en la linfa hacia la corteza. Los microbios y antígenos de
masa molecular alta son captados por los macrófagos sinusales y presentados a los
linfocitos B corticales situados justo por debajo del seno. Este es el primer paso en
las respuestas de los anticuerpos frente a estos antígenos. Los antígenos solubles
de masa molecular baja son transportados fuera del seno a través de los conductos
de FRC y pasan a las células dendríticas corticales residentes localizadas junto a
los conductos. Las células dendríticas residentes extienden sus procesos entre las
células que recubren los conductos y hacia el interior de la luz, y capturan y
engloban por pinocitosis los antígenos solubles que hay dentro de los conductos.
La contribución de esta vía de reparto de antígenos puede ser importante para las
respuestas inmunitarias iniciales de los linfocitos T frente a algunos antígenos
microbianos, pero las respuestas de mayor tamaño y mantenidas requieren el
reparto de antígenos al ganglio mediante células dendríticas tisulares. Además de
los antígenos, hay pruebas de que mediadores inflamatorios solubles, como las
quimiocinas y otras citocinas, son transportados en la linfa que fluye a través de los
conductos; algunas de ellas pueden actuar sobre las células dendríticas adyacentes
y otras pueden transportarse hasta las HEV en que drenan los o conductos. Esta es
una posible forma por la que el ganglio linfático puede percibir la inflamación tisular
y así influir en el reclutamiento y activación de los linfocitos en el ganglio.
Bazo.
El bazo es un órgano muy vascularizado, cuyas principales funciones son eliminar
células sanguíneas viejas y dañadas y partículas (como inmunocomplejos y
microbios opsonizados) de la circulación e iniciar respuestas inmunitarias
adaptativas frente a antígenos de transmisión hemática. El bazo pesa unos 150 g
en los adultos y se localiza en el cuadrante superior izquierdo del abdomen. El
parénquima esplénico se divide desde el punto de vista anatómico y funcional en la
pulpa roja, compuesta sobre todo de sinusoides vasculares llenos de sangre, y la
pulpa blanca, rica en linfocitos. La sangre entra en el bazo a través de una sola
arteria esplénica, que atraviesa la cápsula en el hilio y se divide en ramas cada vez
menores que permanecen rodeadas de trabéculas fibrosas protectoras y de apoyo.
Algunas de las ramas arteriolares de la arteria esplénica acaban en sinusoides
vasculares extensos que están llenos de un gran número de eritrocitos y recubiertos
de macrófagos y otras células. Los sinusoides acaban en vénulas que drenan en la
vena esplénica, que extrae la sangre del bazo hacia la circulación portal. Los
macrófagos de la pulpa roja sirven de filtro importante para la sangre, eliminando
microbios, células dañadas, y células y microbios cubiertos de anticuerpos
(opsonizados). Los sujetos que carecen de un bazo tienden a las infecciones
diseminadas por bacterias en- capsuladas, como los neumococos y los
meningococos. Esto se debe a que tales microorganismos se eliminan
habitualmente mediante la opsonización y la fagocitosis, y esta función es
defectuosa cuando falta el bazo. La pulpa blanca contiene las células que median
las respuestas inmunitarias adaptativas a antígenos transportados por la sangre. En
la pulpa blanca hay muchos grupos de linfocitos muy apretados que aparecen como
nodulos blancos contra el fondo de la pulpa roja. La pulpa blanca se organiza
alrededor de arterias centrales, que son ramas de la arteria esplénica diferentes de
las ramas que forman los sinusoides vasculares. Varias ramas pequeñas de cada
arteria central pasan a través de la zona rica en linfocitos y drenan en el seno
marginal. Una región de células especializadas que rodea al seno marginal, llamada
zona marginal, forma el límite entre las pulpas roja y blanca. La arquitectura de la
pulpa blanca es análoga a la organización de los ganglios linfáticos, con zonas de
linfocitos T y B segregadas. En el bazo del ratón, las arterias centrales están
rodeadas de manguitos de linfocitos, la mayoría linfocitos T. Debido a su localización
anatómica, los morfólogos llaman a estas zonas de linfocito T vainas linfáticas
periarteriolares. Los folículos ricos en linfocitos B ocupan el espacio que hay entre
el seno marginal y la vaina periarteriolar. Como en los ganglios linfáticos, las zonas
de linfocitos T en el bazo contienen una red de conductos complejos compuestos
de proteínas de la matriz recubiertos de células análogas a las FRC. La zona
marginal que está justo fuera del seno marginal es una región marcada poblada por
linfocitos B y macrófagos especializados. Los linfocitos B en la zona marginal,
conocidos como linfocitos B de la zona marginal, tienen funciones diferentes de los
linfocitos B foliculares, y tienen un repertorio limitado de especificidades frente a los
antígenos. La arquitectura de la pulpa blanca es más compleja en los seres
humanos que en los ratones, con zonas marginales interna y externa y una zona
perifolicular.
Antígenos y alérgenos.
Un antígeno ("anti", del griego αντι- que significa 'opuesto' o 'con propiedades
contrarias' y "geno", de la raíz griega γεν, generar, producir; que genera o crea
oposición) es una sustancia que desencadena la formación de anticuerpos y puede
causar una respuesta inmunitaria específica.
La definición moderna abarca todas las sustancias que pueden ser reconocidas por
el sistema inmunitario adaptativo, bien sean propias o ajenas.
Un antígeno suele ser una molécula ajena o tóxica para el organismo (por ejemplo,
una proteína derivada de una bacteria) que, una vez dentro del cuerpo, atrae y se
une con alta afinidad a un anticuerpo específico. Cada anticuerpo es capaz de lidiar
específicamente con un único antígeno gracias a la variabilidad que le otorga la
región determinante de complementariedad del anticuerpo dentro de la fracción de
los mismos.
Para que un antígeno sea reconocido por un anticuerpo, estos interactúan por
complementariedad espacial. La zona donde el antígeno se une al anticuerpo recibe
el nombre de epítopo o determinante antigénico, mientras que el área
correspondiente de la molécula del anticuerpo es el parátopo. (Una analogía
habitual para describir estas interacciones es el acoplamiento de una cerradura
[epítopo] con su llave [parátopo]).
Como se mencionó anteriormente, originalmente se consideraba un antígeno a una
molécula que se liga específicamente a un anticuerpo; ahora, un antígeno se define
como cualquier molécula o fragmento molecular que puede ser reconocido por una
gran variedad de receptores antigénicos (receptores de células T o receptores de
células B ) del sistema inmunitario adaptativo. Las células presentan antígenos al
sistema inmunitario a través del complejo mayor de histocompatibilidad o (CHM).
Dependiendo del antígeno presentado y del tipo de molécula de histocompatibilidad,
se pueden activar diferentes tipos de leucocitos. Por ejemplo, para el
reconocimiento por parte de los receptores de células T (TCR), los antígenos
(mayoritariamente proteínas) deben ser procesado a pequeños fragmentos dentro
de la célula (péptidos) y presentados al receptor de células T por el complejo mayor
de histocompatibilidad.
Los antígenos por sí solos no son capaces de provocar una respuesta inmune
protectora sin la ayuda de un adyuvante inmunológico. Los componentes
adyuvantes de las vacunas juegan un papel esencial para la activación del sistema
inmunitario innato. Un inmunógeno es entonces, en analogía al antígeno, una
sustancia (o una combinación de sustancias) capaz de desencadenar una
respuesta inmune protectora cuando éste es introducido al organismo. Un
inmunógeno debe iniciar una respuesta inmune innata, para más adelante continuar
con la activación del sistema inmunitario adaptativo, mientras que un antígeno es
capaz de unirse a los productos immunoreceptores altamente variables (receptores
de células T o receptores de células B ) una vez que estos han sido producidos. Los
conceptos superpuestos de inmunogenicidad y antigenicidad son, por lo tanto,
ligeramente diferentes.
Inmunogenicidad es la habilidad de inducir una respuesta inmune humoral
(producción de anticuerpos) y/o una mediada por células (activación de linfocitos T).
Antigenicidad es la habilidad de unirse específicamente con el producto final de la
respuesta inmune (por ejemplo, los anticuerpos ya formados y/o receptores de
superficie de células T). Todas las moléculas inmunogénicas son también
antigénicas; aun así, no todas las moléculas antigénicas son inmunogénicas.
Los antígenos son usualmente proteínas o polisacáridos. Esto incluye partes de
bacterias (cápsula, pared celular, flagelos, fimbrias, y toxinas), de virus y otros
microorganismos. Los lípidos y ácidos nucleicos son antigénicos únicamente
cuando se combinan con proteínas y/o polisacáridos. Los antígenos no-microbianos
exógenos (ajenos al individuo) pueden incluir polen, clara de huevo, y proteínas de
tejidos y órganos trasplantados, o proteínas en la superficie de glóbulos rojos
transfundidos. Las vacunas son un ejemplo de antígenos en una forma
inmunogénica; estos antígenos son intencionalmente administrados para inducir el
fenómeno de memoria del sistema inmunitario adaptativo hacia los antígenos que
invaden al receptor.
Los antígenos exhiben (o pueden mostrar) una serie de propiedades inmunológicas:
Inmunogenicidad: capacidad de inducir una respuesta inmune específica, humoral
y/o celular. En este sentido, antígeno sería sinónimo de inmunógeno.
Antigenicidad: capacidad de combinarse con anticuerpos y/o con receptores de
células T (TCR).
Si una molécula es inmunogénica, también es antigénica; sin embargo, la inversa
no siempre es verdad: p. ej., los haptenos, que por sí mismos no desencadenan
respuesta inmune, pero que pueden ligarse a Ac (Anticuerpos) preformados.
Alergenicidad: capacidad de inducir algún tipo de respuesta alérgica. Los
alérgenos son inmunógenos que tienden a activar ciertos tipos de respuestas
humorales o celulares que dan síntomas de alergia.
Tolerogenicidad: capacidad de inducir una falta de respuesta específica en la rama
celular o en la humoral.
FACTORES QUE CONDICIONAN LA INMUNOGENICIDAD.
Carácter de no-propia.
Ante todo, la molécula ha de ser reconocida como una molécula extraña, ajena al
individuo. Tenemos pues, que un primer rasgo condicionador de la inmunogenicidad
es el grado de falta de parecido entre el antígeno con respecto a moléculas propias.
En general, moléculas que han divergido ampliamente en los distintos linajes
evolutivos actúan como buenos inmunógenos en especies heterólogas. En cambio,
moléculas evolutivamente conservadas (como el colágeno, el citocromo c) no son
buenas inmunógenas. Por otro lado, ciertas moléculas propias pueden actuar como
autoantígenos, debido a que proceden de órganos inmunológicamente privilegiados
(secuestrados respecto del sistema inmune) en las fases tempranas del desarrollo
(p. ej., del esperma, tejido de la córnea).
Tamaño molecular.
En general, se puede decir que, a mayor tamaño, mayor inmunogenicidad.
Sustancias de unos 100.000 dalton (Da) suelen ser buenos inmunógenos, mientras
que las de menos de 5.000-10.000 Da son malos inmunógenos.
Heterogeneidad en la composición química.
A mayor heterogeneidad de composición química, mejor inmunogenicidad.
Los copolímeros sintéticos repetitivos de un solo aminoácido, o los polisacáridos a
base de un solo azúcar son malos inmunógenos. La poli [glu-lys] requiere tener 3040 kDa de p.m. para ser inmunogénica; pero el poli {[glu-lys]-tyr} sólo requiere 10
kDa; si al anterior copolímero lo volvemos más complejo añadiendo unidades de
phe, ya sólo se necesitan tamaños moleculares de 4 kDa para desencadenar
respuesta inmune.
La complejidad química se expresa también en el hecho de que contribuye la
estructura secundaria, terciaria y cuaternaria de las proteínas.
La naturaleza química de los antígenos son principalmente proteínas. La mayor
cantidad de antígenos son proteínas, seguidos de carbohidratos, glucoproteínas.
Los lípidos puros no son inmunogénicos. La propiedad química es importante para
efectos de antigenicidad o inmunogenicidad, ya que un cambio de un aminoácido
en la estructura de una proteína, cambia la especificidad de éste y la respuesta
inmune que desencadena no es la misma.
Degradabilidad.
Sólo las moléculas degradables por el hospedador son buenas inmunógenas. Como
veremos, ello se debe a que la inmunidad humoral y la celular dependen de la
activación de los linfocitos TH, que a su vez depende de que éste reconozca
antígeno degradado, procesado y presentado por moléculas MHC-II de las células
presentadoras de antígeno (APC).
Las moléculas no degradables no son buenas inmunógenas. Por ejemplo, los
polímeros de D-aminoácidos no pueden ser degradados por los macrófagos (éstos
no tienen enzimas hidrolíticas adecuadas), por lo que no pueden ser procesados y
presentados a los linfocitos TH.
En general, las moléculas grandes e insolubles son mejores inmunógenos, ya que
son mejor fagocitadas y procesadas.
Genotipo del receptor.
La influencia del genotipo del hospedador se puede comprobar en experimentos
usando razas puras de animales de laboratorio. Supongamos que disponemos de
una raza pura A que induce altos niveles de Ac (Anticuerpos) en respuesta a un
determinado Ag (Antígenos), y otra raza B que produce bajos niveles de Ac ante
ese mismo Ag. Los individuos de la F1 procedentes del cruce de AxB exhiben
niveles intermedios de Ac al ser enfrentados con el citado Ag.
Por análisis de retrocruzamiento se comprobó que los genes que controlan la mayor
o menor respuesta se cartografiaban en una zona concreta de un cromosoma,
dentro del llamado complejo principal de histocompatibilidad (MHC).
Las proteínas sintetizadas por dicho complejo MHC funcionan para presentar el Ag
procesado a las células T, y juegan un papel esencial en determinar el grado de
respuesta a cada antígeno.
Aparte de la dotación de alelos del complejo MHC que cada individuo posee, existen
otros genes que también influyen en el grado de respuesta inmune, como los que
codifican el BCR, el TCR y los de citoquinas.
Dosis y ruta de administración del antígeno.
Para cada inmunógeno experimental existe un protocolo de administración más
adecuado, que supone usar una determinada ruta y cierta dosis, lo que condiciona
una respuesta inmune óptima. Determinar estos parámetros reviste un especial
interés a la hora de la administración de las vacunas.
Dosis:
Dosis muy bajas de Ag pueden no estimular a los linfocitos (falta de respuesta);
dosis demasiado altas pueden provocar un estado activo de tolerancia
inmunológica, por el que los linfocitos entran en una situación de no respuesta.
Dosis adecuadas son capaces de estimulación. Un protocolo de dosis repetidas
espaciadas a lo largo de varias semanas es mejor que una dosis única, porque
provoca una mayor proliferación clonal de linfocitos T y B específicos.
Rutas de administración:
Determinan a qué organo linfoide irá a parar el antígeno. Por vía oral se estimula
sobre todo el MALT del tracto digestivo (pero al mismo tiempo se puede inducir
tolerancia sistémica).
Por vía parenteral:
Intravenosa: el antígeno podrá quedar retenido en el bazo.
Intradérmica.
Subcutánea: el antígeno terminará en algún ganglio regional.
Intramuscular.
Intraperitoneal.
Adyuvantes (coadyuvantes).
Los adyuvantes son sustancias que cuando se mezclan con un Ag y se inyectan
con él, mejoran la inmunogenicidad de ese antígeno.
Algunos adyuvantes y sus mecanismos de acción:
Alúmina: Sales insolubles de sulfato alumínico-potásico.
Actúa mediante varios mecanismos:
1. Precipita el antígeno. Al inyectarse va liberando el antígeno lentamente, con lo
que se suministra un estímulo persistente (el Ag dura varios días en el lugar donde
se inoculó).
2. El Ag precipitado tiene mayor tamaño, por lo que puede ser fagocitado más
fácilmente, y por lo tanto es presentado más efectivamente.
3. Inducción de granulomas.
Adyuvantes de Freund: El adyuvante incompleto de Freund consiste en una
solución acuosa con el Ag, junto con un aceite mineral y un agente dispersante (p.
ej., el manoleato). El adyuvante completo de Freund es como el incompleto, pero
incorpora una suspensión de Mycobacterium muertos por calor. Ambas versiones
liberan lentamente el Ag, con lo que se logra un estímulo persistente.
El macrófago aumenta en su superficie el número de moléculas B7, lo que facilita
su interacción con el receptor CD28 del linfocito TH. Como veremos en otro capítulo,
ello suministra la llamada señal coestimulatoria, que potencia la interacción entre
MHC (del macrófago), Ag procesado y TCR (de la célula T).
Además, el completo es más potente porque suministra muramil-dipéptidos de la
pared celular de las micobacterias: ello permite una buena activación de
macrófagos, que liberan la citoquina IL-1, que a su vez activa a los linfocitos TH.
El completo induce igualmente mejor los granulomas. El granuloma es una
infiltración celular, con una masa densa y rica en macrófagos, con lo que se mejora
el procesamiento y presentación del Ag. Se provoca una buena liberación de IL-1
de los macrófagos, que activan a los linfocitos TH.
Polirribonucleótidos sintéticos: Estimulan la proliferación inespecífica de
linfocitos.
Lipopolisacárido bacteriano (LPS): Igual efecto que el anterior.
Recientemente se están ensayando los liposomas: el antígeno se encierra en
liposomas o se une a la bicapa lipídica de este tipo de vesículas membranosas.
EPITOPOS.
Los epitopos o determinantes antigénicos son cada uno de los sitios discretos de
una macromolécula que son reconocidos individualmente por un anticuerpo
específico o por un TCR específico. Son las regiones inmunológicamente activas de
un inmunógeno (las que se unen de hecho a un receptor de linfocitos o a un Ac
libre). Por lo tanto, a partir de ahora habremos de acostumbrarnos a pensar en los
antígenos como estructuras complejas que suelen constar de varios tipos de
epitopos, cada uno de ellos capaz de unirse con un Ac o un TCR específico
diferente. En este sentido, las macromoléculas son antígenos multivalentes, con
muchos tipos de determinantes antigénicos distintos. Si hablamos de Ag proteicos,
esta unión suele implicar varios niveles de la estructura del antígeno, desde la
primaria a la terciaria (y, en su caso) a la cuaternaria. En el caso de los polisacáridos,
las
ramificaciones
debidas
a
distintos
enlaces
glucosídicos
suponen
conformaciones peculiares que son reconocidas de modo específico.
Propiedades de los epitopos de células B.
El tamaño de un epitopo depende del tamaño del sitio de unión que posea la
inmunoglobulina específica respectiva. Cada sitio de unión a un epitopo en una
inmunoglobulina se denomina paratopo. Los epitopos de células B de proteínas
nativas suelen consistir en varios aminoácidos hidrófilos de la superficie de la
proteína, y son los que están más accesibles al Ac libre o al Ac de membrana (del
BCR).
Los epitopos reconocidos por células B pueden ser secuenciales (es decir, una serie
de aminoácidos contiguos) o no secuenciales (también llamados conformacionales).
Los epitopos secuenciales suelen depender de regiones en forma de bucle, situadas
entre cadenas a consecutivas.
Los epitopos conformacionales dependen de la configuración nativa de la proteína.
Si desnaturalizamos una proteína, se perderán los epitopos conformacionales, pero
permanecerán los secuenciales. Los epitopos de B tienden a situarse en regiones
flexibles de la molécula, capaces de "moverse" molecularmente. Parece que ello
tiende a facilitar el encaje con las regiones complementarias (paratopo) del Ac. La
mayor parte de la superficie de una proteína globular es potencialmente antigénica,
y consiste en numerosos epitopos parcialmente superpuestos. Ahora bien, dada
una determinada proteína, no todos los epitopos son igualmente inmunogénicos
para distintos individuos de la misma especie. Para cada individuo y para cada Ag
suele existir un epitopo llamado inmunodominante.
Propiedades de los epitopos reconocidos por células T.
Antes de desarrollar las características de estos epitopos describiremos
sucintamente una serie de estudios clave que señalaron las diferencias esenciales
entre el modo en que las células T reconocen los epitopos respecto a lo visto para
las células B. Estudios de Benacerraf (1959):
Si inmunizamos un animal por primera vez con una proteína nativa, se puede
observar una respuesta celular primaria.
Si inmunizamos al mismo animal una segunda vez con la misma proteína nativa, se
La "sorpresa" (para las expectativas de la época) llega cuando esa segunda
inoculación se hace con la proteína desnaturalizada: también ocurre una respuesta
celular secundaria (algo que no ocurre con la respuesta humoral).
La explicación a este fenómeno no llegó hasta los años 80: fue entonces cuando se
descubrió que los linfocitos T no reconocen Ag soluble, sino Ag procesado, de modo
que los péptidos resultantes son presentados en asociación con MHC. El tamaño
del epitopo de células T queda determinado por el tamaño del surco de unión al Ag
de la molécula de MHC. Las moléculas de MHC-I unen péptidos de entre 8 y 11
aminoácidos. Las moléculas de MHC-II unen péptidos de entre 11 y 17 aminoácidos.
Los péptidos antigénicos reconocidos por células T forman un complejo trimolecular
junto con el TCR del linfocito T y el MHC de la célula presentadora o diana. El
antígeno reconocido por células T tiene dos zonas de unión: una para ligarse al
TCR, denominada epitopo, y otra para engarzar al MHC, denominada agretopo.
Los péptidos antigénicos implicados en el complejo trimolecular proceden del
procesamiento intracelular del inmunógeno proteico original.
Los antígenos reconocidos por las células T presentan péptidos anfipáticos.
Precisamente, quizá la función del procesamiento sea "desplegar" el Ag y exponer
estas regiones internas anfipáticas, de modo que la porción hidrófoba suele actuar
de agretopo, mientras que la porción hidrófila actúa de epitopo propiamente dicho.
Por programas de ordenador es posible predecir en una proteína aquellas regiones
anfipáticas de tamaño adecuado que teóricamente podrían actuar como péptidos
antigénicos. Esto se refleja en el llamado "índice anfipático", y se está aplicando
actualmente al diseño de vacunas sintéticas peptídicas (como en el caso de la
malaria).
También se puede recurrir por ordenador a medir el "índice de protrusión" de
distintas partes de las proteínas: las zonas con menor protrusión son mejores
candidatas a funcionar como péptidos de células T.
Debido a que los Ag reconocidos por células T lo son unidos a las moléculas de
MHC del individuo, y debido a que a su vez existe una gran diversidad de alelos de
MHC en las poblaciones de una especie, los epitopos inmunodominantes en cada
individuo dependen en parte del juego de moléculas MHC de ese individuo (lo cual,
depende de su dotación genética, obviamente). En una proteína sólo una minoría
de zonas peptídicas tienen capacidad para unirse a las moléculas MHC de cada
individuo, y de esas zonas, sólo algunos estimulan de hecho a la célula T.
Tabla de diferencias en el modo de reconocimiento por parte de células B y T:
HAPTENOS.
Se define como hapteno aquel grupo químico definido, de pequeño tamaño, que por
sí mismo es incapaz de desencadenar una respuesta inmune (es decir, no es
inmunógeno), pero que unido covalentemente a una molécula portadora se
comporta como inmunógeno (llegando a constituir el único determinante
inmunodominante del conjugado).
En los años 20 y 30 Karl Landsteiner realizó unos famosos experimentos que
mostraron por primera vez la asombrosa especificidad del sistema inmune.
Como haptenos empleó una serie de derivados del benceno, como el dinotrofenol
(DNP), en configuraciones distintas (orto, meta, para), así como distintos derivados
a base de distintos sustituyentes en determinadas posiciones conocidas.
Como molécula portadora empleó la seroalbúmina bovina (BSA).
Obtenía así distintas versiones de conjugados BSA-DNP.
Inyectaba conjugados BSA-DNP en un animal de laboratorio, esperaba a que se
produjera la respuesta inmune, y tras una sangría, obtenía suero enriquecido en
anticuerpos frente al hapteno (antisuero específico).
Finalmente, ponía en contacto el antisuero con el hapteno original, y en paralelo,
con otros haptenos consistentes en variantes del original (lugar de la localización de
algún radical, naturaleza química del radical).
Las conclusiones que se pueden extraer de estos experimentos son:
Casi más importante que la naturaleza química concreta del hapteno es la
configuración global del mismo (obsérvese que el hapteno equivale a un epitopo
inmunodominante) a la hora de determinar si dicho hapteno puede reaccionar (y en
qué cuantía) con el antisuero (anticuerpos).
En los experimentos se puede comprobar igualmente la existencia de algunas
reacciones cruzadas, sobre todo cuando dos haptenos comparten una
configuración parecida.
Igualmente se puede advertir de estos experimentos la enorme diversidad posible
de anticuerpos: cualquier estructura química definida, natural o artificial, puede dar
origen, si va unida a un portador, a anticuerpos específicos.
TIPO DE ANTÍGENOS.
Antígenos T-independientes.
Son aquellos antígenos que pueden estimular directamente a los linfocitos B para
producir anticuerpos sin requerir de la presencia de los linfocitos T cooperadores.
En general los lipopolisacáridos son antígenos T-independientes. La respuesta a
estos antígenos difiere de la respuesta inducida por otros antígenos.
Propiedades de los antígenos T-independientes:
Estructura polimérica
Estos antígenos se caracterizan por presentar el mismo determinante antigénico
repetido varias veces.
Activación policlonal de las células B
Varios de estos antígenos pueden activar clonas específicas de células B para otros
antígenos (activación policlonal). Los antígenos T-independientes pueden ser
subdivididos en Tipo 1 y Tipo 2, basados en su habilidad para llevar acabo la
activación policlonal. El Tipo 1 es un activador policlonal mientras que el tipo 2 no.
Resistencia a la degradación
Los antígenos timo-independientes son por lo general más resistentes a la
degradación de tal forma que persisten por periodos largos de tiempo estimulando
continuamente al sistema inmune.
Antígenos T-dependientes.
Los antígenos timo-dependientes son aquellos que no pueden estimular
directamente la producción de anticuerpos sin la ayuda de las células T. Las
proteínas son antígenos T-dependientes. Estructuralmente estos antígenos son
caracterizados por la presentar pocas copias de muchos diferentes determinantes
antigénicos.
Antígenos inmunodominantes.
Son los antígenos que dominan (sobre los demás antígenos de un mismo patógeno)
en su habilidad para producir una respuesta inmune. Comúnmente se asume que
las respuestas por parte de las células T son dirigidas hacia sólo unos pocos
epítopos inmunodominantes, aunque en algunos casos dichas respuestas (por
ejemplo la respuesta contra Plasmodium spp.) se dispersan hacia un grupo
relativamente grande de antígenos del parásito.
Exógenos: Son los que vienen de afuera; pueden haber de varios tipos como polen,
polvo, heces de ratas, proteínas de la leche, bacterias, etc. Como producto de éstos
podemos padecer de una enfermedad clínica con sintomatologías, como diarrea,
asma, tifoidea, etc. Los antígenos exógenos son antígenos que han entrado al
cuerpo desde el exterior, por ejemplo mediante inhalación, ingestión o inyección. A
menudo, la respuesta inmune hacia antígenos exógenos es subclínica. Estos
antígenos son tomados en las células presentadoras de antígenos (CPAs) mediante
endocitosis o fagocitosis, y procesadas en fragmentos. Las CPAs entonces
presentarán esos fragmentos a linfocitos T colaboradores (CD4+) con ayuda de
moléculas de histocompatibilidad de clase II en su superficie. Los linfocitos T que
reconocen de manera específica la dupla péptido:CMH son activados y comenzarán
a secretar citocinas. Las citocinas son sustancias que a su vez pueden activar
linfocitos T citotóxicos (CD8+), células productoras de anticuerpos o linfocitos B,
macrófagos, y otras.
Algunos antígenos entran al organismo como antígenos exógenos, para después
pasar a ser antígenos endógenos (por ejemplo, un virus intracelular). Los antígenos
intracelulares pueden ser liberados de nuevo al torrente sanguíneo una vez que la
célula infectada sea destruida.
Endógenos: Los antígenos endógenos son aquellos antígenos que han sido
generados al interior de una célula, como resultado del metabolismo celular normal,
o debido a infecciones virales o bacterianas intracelulares. Los fragmentos de esos
antígenos son presentados sobre la superficie celular en un complejo con moléculas
MHC de clase I. Si son reconocidos por linfocitos T citotóxicos (CD8+) activados,
éstos comenzarán a secretar varias toxinas que causarán la lisis o apoptosis
(muerte celular) de la célula infectada. Para prevenir que las células citotóxicas
destruyan células normales que presenten proteínas propias del organismo, estos
linfocitos T autoreactivos son eliminados del repertorio como resultado de la
tolerancia (también conocida como selección negativa).
Estos se subdividen a su vez en;
Xenógeno o heterólogo: que son aquellos que se encuentran en diferentes
especies animales, incluyendo al hombre. Ej.: antígeno de Forssman que no lo tiene
el hombre pero si otras especies inferiores de animales.
Alógenos u homólogos: estos son antígenos que se encuentran en la misma
especie, pero en diferentes individuos, ej,: antígenos de los grupos sanguíneos; así,
el antígeno A y el antígeno B son aloantígenos.
Autoantígenos.
Un autoantígeno se refiere a una proteína normal o un complejo de proteínas,
algunas veces también ADN o ARN, que son reconocidos por el sistema inmunitario.
Ocurre en pacientes que sufren de alguna enfermedad autoinmune específica.
Estos antígenos no deberían, en condiciones normales, activar el sistema
inmunitario, pero en estos pacientes, debido principalmente a factores genéticos y/o
ambientales, se ha perdido una correcta tolerancia inmunológica.
MITÓGENOS Y SUPERANTÍGENOS.
Mitógenos.
Los mitógenos son agentes capaces de inducir la proliferación de una gran cantidad
de clones de linfocitos T y/o B, de modo inespecífico (por lo que también se
denominan activadores policlonales).
Ejemplos de mitógenos:
Lectinas: conllevan la aglutinación de células (entre ellas linfocitos), pero aquí nos
interesan sobre todo por su capacidad de activación policlonal de células T, B, o de
ambas. Como ejmplos de lectinas tenemos; concanavalina A (conA), que es
mitógeno de células T, <fitohemaglutinina (PHA), que es mitógenos de células T,
mitógeno de fitolaca (PWM), que es mitógeno tanto de T como de B.
Lipopolisacárido (LPS) de bacterias Gram negativas. Su actividad como mitógeno
reside en la porción de lípido A.
Superantígenos.
Los superantígenos son unos potentes activadores policlonales de células T que
expresan secuencias comunes en sus receptores: llegan a activar hasta la quinta
parte del total de estos linfocitos). Esta activación es independiente de la
especificidad hacia una combinación particular de Ag procesado-MHC.
Unen la porción Vb del TCR y lo entrecruzan con la parte externa del MHC, fuera
del surco que normalmente sirve para exponer y presentar el antígeno. De esta
forma, entrecruzan de modo inespecífico las células TH con las APC, de modo que
los linfocitos T se activan sin haber reconocido Ag procesado y presentado en el
surco de MHC-II de las APC. El resultado es que un gran número de clones de
células T segregan grandes niveles de citoquinas, lo que puede llevar a shock y a
muerte.
Ejemplos de superantígenos son ciertas toxinas de Staphylococcus aureus, como
la toxina del síndrome del choque tóxico (TSS-1), o la enterotoxina.
Alérgenos.
Un alérgeno es una sustancia que puede inducir una reacción de hipersensibilidad
(alérgica) en personas susceptibles que han estado en contacto previamente con
él.
Esta reacción de hipersensibilidad involucra el reconocimiento del alérgeno como
sustancia "extraña", ajena al organismo en el primer contacto. En exposiciones
posteriores, el sistema inmunitario reacciona a la exposición de forma excesiva, con
la liberación de sustancias que alteran la homeostasis del organismo, lo que da lugar
a los síntomas propios de la alergia.
Un caso particular son los fármacos, destacando los antibióticos con anillos
betalactámicos o similares en su estructura química, siendo este el caso de las
penicilinas y cefalosporinas.
También existen alergias a algunos metales. La más común, de este tipo, es la
alergia al níquel, que se halla presente en prácticamente todas las aleaciones de
metales no-nobles y a veces en algunas aleaciones de oro bajo.
Tipos de alergia.
Hay dos tipos principales de reacciones alérgicas:
Hipersensibilidad inmediata: esto es a lo que se suele llamar la alergia. Está
mediada por un anticuerpo llamado inmunoglobulina E (IgE), y ocurre en menos de
30-60 min. Este mecanismo está relacionado con trastornos tales como la rinitis o
alergia a los alimentos. En este caso, las pruebas cutáneas para diagnosticar la
alergia se realizan por ensayo de pinchazo, y la lectura se realiza a 10-15 min.
Hipersensibilidad retardada: esta reacción está mediada por algunas células
(células T), y se produce después de varias horas, por lo general 24-48h. Este
mecanismo está relacionado con trastornos tales como el eccema de contacto
(dermatitis alérgica de contacto). En este caso, las pruebas cutáneas para
diagnosticar la alergia se realizan generalmente por las pruebas del parche (pruebas
epicutáneas), y la lectura se realiza después de 2 a 4 días.
Otro concepto que está estrechamente relacionado con la alergia es la atopia. La
atopia es la tendencia de un individuo a desarrollar enfermedades alérgicas tales
como el asma alérgica, dermatitis atópica (eczema) o rinitis alérgica. Por ejemplo,
un niño con asma alérgica a los ácaros del polvo es un niño atópico, y si su padre
también sufre de asma alérgica, se puede decir que este niño tiene antecedentes
familiares de atopia. La atopia es una tendencia heredada a la alergia que está
presente en algunas familias.
Actores de la reacción alérgica.
En la reacción alérgica están involucrados los siguientes elementos:
Alérgenos. Sustancia, generalmente una proteína, capaz de generar una reacción
alérgica.
La inmunoglobulina (IgE). Típico tipo de anticuerpo implicado en las reacciones
alérgicas, que también participa en la defensa contra los parásitos (por ejemplo,
contra los gusanos).
Mastocitos. Células del sistema inmunitario que se pueden encontrar en la mucosa
respiratoria, tracto digestivo y la piel.
La histamina. Una sustancia que se almacena dentro de la célula y es liberada
durante la reacción alérgica. Es capaz de producir la dilatación de los vasos
sanguíneos (vasodilatación), aumento de la permeabilidad de los vasos sanguíneos
(fuga de líquido) y la estimulación nerviosa. Esto conduce al desarrollo de
enrojecimiento (eritema), hinchazón (edema) y picor (prurito).
Fases de la reacción alérgica.
La reacción alérgica se produce en dos fases:
Fase de sensibilización. En esta fase, el sistema inmune comienza a reaccionar
contra el alérgeno. Se producen los anticuerpos contra el alérgeno. En esta etapa,
el paciente no presenta síntomas.
Fase sintomática. En los contactos posteriores del paciente con el alérgeno, el
alérgeno se une a la IgE que está en la superficie de los mastocitos. Las sustancias
que inducen los síntomas típicos de la alergia son liberados. Entre ellos se
encuentra la histamina, más conocido mediador.
Tipos de alergia.
Respiratoria.
Los ácaros del polvo están presentes en todas las casas, causando reacciones
alérgicas a un alto porcentaje de niños asmáticos. El calor y la humedad crea un
ambiente ideal de cultivo de ácaros. No pueden sobrevivir en condiciones
extremadamente secas o frías. Como la mayoría de las criaturas vivientes, los
ácaros requieren calor, alimento y agua. Las camas proporcionan el ambiente
idóneo, ya que en ellas encuentran un alto suministro de células de nuestra piel (su
fuente de alimento), agua del sudor y el aliento espirado, y calor. También
encuentran células de piel y otras proteínas con las que alimentarse en las
alfombras, muebles tapizados, telas y juguetes de peluche.
Los alérgenos de animales son la segunda causa más frecuente de reacciones
alérgicas. El alérgeno que desencadena las respuestas alérgicas a los animales se
encuentra en la saliva, la piel y la orina. El tamaño de la partícula del alérgeno es
muy pequeña y, por lo tanto, se mueve fácilmente en el aire y sin querer, se respira.
Este hecho causa síntomas respiratorios, lloriqueo en los ojos, estornudos e
irritación de la piel.
La alergia a las esporas de moho es muy común. El moho es omnipresente tanto
en interiores como en exteriores y está presente la mayor parte del año. Las esporas
de moho también prefieren ambientes húmedos, más cálidos por lo se encuentran
comúnmente en los baños, las cocinas, el sellado de la puerta del refrigerador, las
cortinas de baño y sobre todo en las casas que tienen manchas de humedad y moho
negro evidentes en los marcos de las ventanas.
Los síntomas de la alergia al moho pueden ser mejor en climas cálidos y secos y
llegar a ser molestos en los días húmedos, nublados y brumosos.
Mientras que éstos alérgenos normalmente no producen anafilaxia, sí pueden
causar síntomas muy molestos que pueden afectar gravemente la salud de una
persona y su calidad de vida.
Las alergias más comunes debido a los aeroalergenos son:
La rinitis alérgica (fiebre del heno), que afecta a la nariz y a los ojos.
El asma, que afecta a los pulmones.
Eczema o urticaria (ronchas), que afectan a la piel.
Sin embargo, no todos los pacientes con estas condiciones, sufren los síntomas de
una reacción alérgica. Por tanto, es importante hablar con un profesional de la salud
para saber si es una alergia la que puede estar contribuyendo a estas condiciones.
¿Cuáles son los síntomas causados por alérgenos respiratorios?
Los alergenos de interior afectan más comúnmente a la nariz, el pecho, la piel y los
ojos:
Picazón y moqueo de la nariz. Congestión y estornudos.
Irritación de las vías respiratorias. Tos, opresión en el pecho, respiración sibilante,
falta de aliento.
Picor, lagrimeo, inflamación de los dos ojos.
Picazón en la piel, erupciones, ronchas.
Fosas nasales congestionadas y dolor de cabeza.
Trastornos del sueño.
Falta de concentración.
Alergias cutáneas.
Son diversas las causas y factores que crean irritación en la piel. Algunos podrían
ser el calor, un trastorno en el sistema inmunológico, medicamentos e infecciones.
Cuando el sistema inmune responde ante la provocación de un alérgeno (algo que
produce alergia), la irritación de la piel podría ser una condición alérgica.
Tipos de alergias de la piel.
Dermatitis (eczema).
Este es el tipo de alergia que se produce cuando la piel contacta de forma directa
con un alérgeno. Un ejemplo de dermatitis de contacto alérgica se daría si alguien
alérgico al níquel en una joyería se prueba algo, incluso con una pequeña cantidad
de níquel, y en la zona de contacto aparecen rojeces en la piel, escamas, bultos,
picazón o hinchazón.
La dermatitis atópica (eczema) es una enfermedad crónica de la piel que aparece
normalmente en la infancia y se debe a una disfunción inmune en las capas de la
piel. Muchas veces suele ligarse al asma, rinitis alérgica (fiebre del heno) o a la
alergia alimentaria. A esta vinculación progresiva se la conoce como marcha
atópica.
Otros ejemplos de dermatitis alérgica serían los causados por el contacto con
plantas, tales como la hiedra, el roble y el zumaque venenosos. Estas plantas están
cubiertas por una capa aceitosa que causa la picazón, erupción y el enrojecimiento
de la piel al tocarlas. El contacto con la ropa, las mascotas o incluso herramientas
de jardinería que hayan estado en contacto con el aceite que cubre algunas plantas
también podrían provocar reacciones alérgicas cutáneas.
Algunas de las personas que sufren dermatitis alérgica sufren, además, intolerancia
o sensibilidad alimentaria, lo que podría provocar un empeoramiento en los
síntomas del eczema.
Urticaria.
La urticaria es una inflamación de la piel que se produce por la liberación de
histamina por parte del sistema inmunológico. Este desencadenante provoca
pequeños derrames en los vasos sanguíneos dando lugar a inflamaciones en la piel.
Se conoce como angiodema el hinchazón que se produce en las capas profundas
de la piel.
Existen dos tipos de colmenas de urticaria: aguda y crónica. La urticaria aguda
puede producirse al comer un alimento en particular o al entrar en contacto con una
sustancia en particular. La urticaria crónica, sin embargo, aparece y puede durar
meses o años.
Hay causas no alérgicas como el calor o el ejercicio que pueden desencadenar la
aparición de urticaria, así como reacciones alérgicas tales como, a los
medicamentos, alimentos o picaduras de insectos.
Pese al aspecto de la urticaria y el eczema y la incomodidad y dolor que generan,
ambos resultan no contagiosos.
Angioedema.
El angioedema es la inflamación que se produce en las capas profundas de la piel,
de aspecto similar algunas veces, a la urticaria (ronchas). El angioedema aparece
de forma más frecuente en los tejidos blandos donde la piel es más fina como los
párpados, la boca o los genitales.
El angioedema agudo es aquel que dura un plazo corto de tiempo, como minutos o
días. Generalmente está causado por una reacción alérgica a algún medicamento
o alimento específico.
El angioedema recurrente crónico es la condición que se mantiene durante un largo
período de tiempo. En muchas ocasiones, no se sabe identificar cuál es su causa.
El angioedema hereditario (AEH) es una enfermedad que se da en raras ocasiones,
pero que tiene unas serias condiciones genéticas, involucrando la inflamación de
varias partes del cuerpo, tales como las manos, pies, cara, pared intestinal y vías
respiratorias.
Alergia alimentaria.
El trabajo del sistema inmunológico del cuerpo es identificar y destruir los gérmenes
(bacterias o virus) que causan enfermedades. Se produce una alergia a los
alimentos cuando el sistema inmunitario por error lucha contra la comida (un
alérgeno) y, como si fuera una amenaza, lo ataca.
A diferencia de otros tipos de trastornos alimenticios, como las intolerancias, las
alergias alimentarias son mediadas por IgE. Esto significa que el sistema inmunitario
produce
cantidades
anormalmente
grandes
de
un
anticuerpo
llamado
inmunoglobulina E (IgE, para abreviar).
Los anticuerpos IgE combaten a los enemigos alérgenos alimentarios mediante la
liberación de histamina y otros químicos, que desencadenan los síntomas de una
reacción alérgica.
Existen más de 120 alimentos que pueden causar alergias. Los alimentos que más
comúnmente causan reacciones alérgicas graves a nivel mundial son la leche, el
huevo, los cacahuetes (maní), los frutos secos, los cereales (principalmente trigo),
soja, pescado y mariscos. La mayoría de reacciones alérgicas en los niños son
debido a un número limitado de alimentos. La alergia al huevo y a la leche suelen
superarse durante los primeros años de vida. Las frutas, verduras, frutos secos y
cacahuetes son responsables de la mayoría de las reacciones alérgicas en adultos.
Las personas con alergia al polen o al látex a menudo pueden experimentar
síntomas alérgicos al comer ciertas frutas, hortalizas o frutos secos. Esta reactividad
cruzada se produce porque el polen y látex contienen proteínas que son similares a
las proteínas en los alimentos, y el sistema inmune puede reaccionar a ambos.
De hecho, hasta un 70% de las alergias alimentarias están relacionados con la
alergia al polen. Como regla general, el tratamiento de un alimento no altera la
capacidad de la comida para inducir síntomas alérgicos. Sin embargo, la mayoría
de las personas con alergia al polen pueden tolerar mejor las comidas de reacción
cruzada cuando han sido cocinados, horneados o asados.
Los síntomas de alergias a los alimentos varían según la persona, aunque una
persona tendrá tendencia a tener las mismas reacciones cada vez que se consume
el mismo alimento alergénico. Los síntomas de las alergias alimentarias van desde
molestias leves a graves y potencialmente mortales reacciones de hipersensibilidad
(anafilaxia) que requieren intervención médica inmediata.
INMUNIDAD INNATA.
La inmunidad innata (también llamada inmunidad natural o nativa) constituye la
primera línea de defensa contra los microbios. Consta de mecanismos de defensa
celulares y bioquímicos que existen antes incluso de la infección y que pueden
responder con rapidez a ella. Estos mecanismos reaccionan con los productos de
los microbios y de las células dañadas, y responden de una forma prácticamente
idéntica a infecciones repetidas.
Mecanismos efectores de la inmunidad innata. Primera línea de defensa;
Barreras epiteliales.
Las superficies epiteliales y su estado integro en conjunto forman una barrera física
que separan el medio del huésped. Existen tres importantes interfaces, que son: la
piel, el epitelio respiratorio y el epitelio digestivo. Estos epitelios además de constituir
una capa protectora, poseen otras características que lo hace inmunológicamente
importante, tales como: la síntesis de péptidos antibióticos, subpoblaciones de
linfocitos intraepiteliales y células dendríticas. Péptidos antibióticos: La piel posee la
capacidad de sintetizar y secretar proteínas con capacidad antibiótica y antimicótica
denominados “Defensinas”. Estos son péptido de 29-34 aminoácidos, que
aumentan sus concentraciones presencia de IL1 y TNF (factor de necrosis tumoral),
ambos secretados por los macrófagos activos. El epitelio intestinal también produce
una proteína con potentes efectos antimicrobianos denominada “Criptocidinas”.
Linfocitos T intraepiteliales: Este tipo de células es una subespecie de linfocitos T y
por lo tanto debería ser considerado como parte de la inmunidad adaptativa. Pero,
este linfocito T, presenta una limitada diversidad de receptor antigénico, además las
cadenas del TCR (receptor de las células T) no son αβ (como el resto de los
linfocitos T), si no γδ. Otra diferencia de gran importancia es el hecho de que estos
Linfocitos T intraepiteliales no reconocen al MHC (complejo mayor de
histocompatibilidad) si no a una proteína similar al MHC, denominada CD1. Debido
a estas notables desigualdades se considera al Linfocito T intraepitelial como parte
de la inmunidad Innata. Una vez activado, el linfocito T intraepitelial, secreta una
variada gama de citoquinas proinflamatorias como: IL1, TNF, Linfotaxinas e INFγ.
Además, poseen una actividad citolítica mediada por “Perforinas” y “Fas-FasL”. Las
Perforinas, son péptidos que se unen a la membrana de la célula blanco, creando
un poro en esta, lo que lleva a la perdida de la homeostacia intracelular y la muerte
de la célula en cuestión. A diferencia de lo que ocurre con las Perforinas, que llevan
a la muerte celular por lisis de la membrana, “Fas-FasL” son proteínas de membrana
que al interactuar una con otra, activan a un complejo enzimático citolítico,
denominado “Caspasas”, que inducen a la célula blanco la apoptosis. Linfocitos B1: Los linfocitos B-1, son células presentes en el epitelio de la cavidad peritoneal y
que también deberían ser considerados como integrantes de la inmunidad
adaptativa, pero su receptor antigénico, posee baja diversidad y su estructura es
similar a la del receptor del linfocito T intraepitelial. Debido a estas características
se considera al linfocito B-1, como parte de la inmunidad innata. Las células B-1
secretan permanentemente IgM específica para antígenos compartidos por una
amplia variedad de bacterias, tales como la “Fosforilcolina” y el “Lipopolisacarido o
LPS”.
Las glándulas sebáceas y el sudor: crean un pH ligeramente ácido muy eficaz contra
los hongos.
La capa córnea superficial de la piel está en un continuo proceso de descamación
que contribuye a eliminar colonias bacterianas que haya podido infiltrarse.
En las mucosas existentes en la boca, nariz, tractos digestivos, respiratorios y
urogenitales que son epitelios humedecidos por mucus que colaboran en la
eliminación de microorganismos.
La saliva y las lágrimas contienen lisozima que es un enzima que destruye la pared
de algunas bacterias.
El pH ácido del estómago y la acción enzimática de los jugos gástricos e intestinales
destruyen muchos microrganismos.
La flora bacteriana autóctona contribuye a la defensa al impedir el asentamiento de
otras bacterias (elaboran sustancias que lo impiden).
La tos, estornudos, lagrimeo son mecanismos de eliminación de microorganismos.
Se pueden clasificar de la siguiente manera:
Barreras Físicas: Piel: solo suele ser atravesada cuando presenta soluciones de
continuidad. Mucus: envuelve a los agentes extraños e impide que ejerzan su
acción. Cilios (ej. tráquea): dificultan el avance del agente, ascensor mucociliar, con
agentes surfactantes. Tos, estornudo, peristaltismo intestinal.
Barreras químicas:
pH ácido (ej. estómago, lágrimas, orina, vagina). Sales biliares, ácidos grasos.
Lisozima (muraminidasa): en lágrimas, saliva, mucus, etc. Espermina: en semen. βlisina: producida por las plaquetas. Lactoperoxidasa: en leche y saliva. Proteínas
secuestradoras del hierro: Lactoferrina: quela el Fe. En leche la Transferrina:
compite con las bacterias por el Fe.
Barreras biológicas:
Microbiota normal:
- Piel: superficie dérmica; glándulas sebáceas.
- Boca: población heterogénea.
- Intestino: en IG 1010 bacterias/ml.
- Vagina.
Segunda línea de defensa.
Componentes del S.I. • Células: Fagocitos y células citotóxicas - Fagocitos: Macrófagos - PMN neutrófilos - Células asesinas naturales: NK - Eosinófilos Linfocitos B-1 y linfocitos T intraepiteliales (γδ).
Neutrófilos o leucocitos polimorfonucleares: son las células blancas más
abundantes en la sangre, correspondiendo entre un 50 y 60% del total de leucocitos.
Los neutrófilos alcanzan el sitio de la infección en pocas horas y son los
responsables de la primer “oleada” de células encargadas de la respuesta del
huésped. Si éste no es “reclutado” en un tiempo no mayor a 6 horas, estos
experimentan la apoptosis. Los neutrófilos presentan en su interior gránulos cuyo
contenido es rico en Lisozima, Colagenasa y Elastasa. Monocitos/Macrófagos: Los
monocitos son células maduras precursoras de los macrófagos, es decir, una vez
que el monocito es activado este experimenta cambios morfológicos que lo adaptan
para sus nuevas funciones como macrófagos.
Los macrófagos son células de mayor tamaño y capacidad fagocítica que los
neutrófilos, además poseen la capacidad de unirse a otros macrófagos y así originar
las “células gigantes”, con una capacidad fagocitica aún mayor. Los Macrófagos
constituyen la segunda “oleada” de células que acuden al sitio de la infección.
Existen, además de los monocitos y macrófagos circulantes, otros macrófagos que
se encuentran como células residentes de cada tejido, por ejemplo: en el hígado
existen las células de Kupffer, en el SNC encontramos a la micróglia y en los
alvéolos pulmonares a los macrófagos alveolares. Como el reconocimiento,
fagocitosis y destrucción del microorganismo por parte de los neutrófilos y los
macrófagos son similares.
Células NK: Las células NK son un tipo de linfocitos, que participan en la inmunidad
frente a virus y a microorganismos intracelulares. La pregunta es: ¿Cómo puede
una célula NK reconocer a microorganismos intracelulares? Este tipo celular posee
moléculas que reconocen al MHC I (debe tenerse en cuenta que el MHC I está
presente en todas las células del cuerpo), de esta manera, si una célula expresa
péptidos antigénicos en su membrana unidos al moléculas del MHC I, las células
NK las reconocerán y serán activadas. Otro mecanismo, consiste en la activación
de las NK, en caso de que no encuentren las moléculas del MHC I en la superficie
de otra célula, este sistema es de gran utilidad, ya que existen virus que inhiben la
síntesis de moléculas de MHC I. Además de estos dos mecanismos, las células NK,
participan de un sistema conocido como “Citotoxicidad mediada por anticuerpos”.
Esto consiste en la activación de las NK, frente a partículas que se encuentren
recubiertas con anticuerpos, (en general son IgG), esto se lleva adelante mediante
un receptor que poseen las NK, capaces de identificar la porción Fc de las IgG. Las
funciones efectoras de las NK son, la destrucción de las células infectadas y la
activación de macrófagos. Las funciones líticas de las NK, son llevadas a cabo
mediante dos proteínas que se encuentran en el interior de gránulos
citoplasmáticos, denominadas, “Perforinas” y “Granzimas”. Cuando las Células NK,
son activadas liberan estos gránulos y de esta manera a las proteínas. Las
Perforinas, crean un poro en la membrana de la célula blanco, mientras que las
Granzimas ingresan por este poro e inducen la apoptosis. Las NK, son capaces de
responder a la IL-12, esta citoquina es producida por los macrófagos. En repuesta
a la IL-12, las células NK liberan INFγ, que como mencionamos con anterioridad, es
la más potente activadora de macrófagos.
Proteínas efectoras:
Sistema del complemento: Este es un grupo de proteínas plasmáticas, cuyas
principales funciones son: La inflamación, opsonización de microorganismos y lisis
bacteriana. El reconocimiento del microorganismo y la activación del sistema del
complemento, se realiza a través de tres posibles rutas: La vía clásica, capas de
reconocer a los microorganismos recubiertos de anticuerpos. La vía alterna, capas
de reconocer a estructuras propias de las bacterias. Y la vía de las lectinas, que
puede reconocer a una proteína plasmática denominada: “Lectina de unión a
manosa”, que reconoce los residuos de manosa en las glucoproteínas y glucolípidos
de la membrana de la bacteria, a los cuales se adhiere y de esta manera puede ser
reconocida por el complemento.
Proteína C reactiva: La proteína C reactiva, pertenece a un grupo de proteínas
denominadas: “Proteínas de la fase aguda”. Porque, sus niveles plasmáticos
aumentan considerablemente durante los estados infecciosos agudos. Esta es una
proteína capas de unirse a los fosfolípidos de las cápsulas bacterianas, actuando
como opsonina. Además, posee la capacidad de activar al complemento por la vía
clásica.
Mecanismos de la respuesta inmune natural.
Endocitosis: ingestión de material soluble (macromoléculas) del fluido extracelular
por medio de invaginación de pequeñas vesículas endocíticas.
- Pinocitosis.
- Endocitosis mediada por receptor.
Formación de lisosomas: digestión y eliminación.
Fagocitosis: unión del agente particulado a la superficie de una célula fagocítica,
emisión de pseudópodos y englobamiento.
Formación de un fagosoma y destrucción:
- Mecanismos dependientes de oxígeno: formación de radicales tóxicos.
- Mecanismos dependientes de óxido nítrico.
- Mecanismos independientes de oxígeno: enzimas hidrolíticas.
Respuesta inflamatoria.
Cuando se produce una rotura de la piel o de las mucosas, los microorganismos
pueden pasar del medio externo al interno. Como reacción y en un intento de
localizar al agente invasor, se produce una reacción en el tejido conectivo
vascularizado que se denomina inflamación. Este complejo proceso produce el
acúmulo de fluidos y leucocitos en el espacio extravascular. La inflamación puede
ser originada por factores endógenos (necrosis tisular o rotura ósea) o factores
exógenos como lesiones por agentes mecánicos (corte, etc.), físicos (quemaduras),
químicos (corrosivos), biológicos (microorganismos) e inmunológicos (reacciones
de hipersensibilidad). Aunque en algunos casos, como la hipersensibilidad, la
inflamación puede tener consecuencias nocivas, por lo general es una respuesta
protectora que trata de restaurar los tejidos lesionados. La respuesta consiste en un
desplazamiento de leucocitos y moléculas plasmáticas hacia regiones de infección
o de lesión tisular. Sus principales efectos son el aumento del flujo sanguíneo hacia
la región, el aumento de la permeabilidad vascular frente a las moléculas séricas de
gran tamaño y la migración de leucocitos a través del endotelio vascular local en
dirección a la zona inflamada.
Las características fundamentales de la reacción inflamatoria:
la acumulación de
líquido.
Una reacción inflamatoria tiene lugar, por ejemplo, cuando la organización de la piel
se rompe a causa de una herida cutánea y es preciso restablecer su integridad
física. El resultado inmediatamente visible de una lesión en la piel es la pérdida de
sangre que si la herida no es muy profunda cesa, gracias a la actuación de la
"cascada" de los factores de coagulación que provoca la oclusión de las roturas
vasculares. Uno de los factores dela coagulación sanguínea el factor XII es activado
por contacto directo con un componente del tejido conectivo: el colágeno, en el lugar
de la lesión. El factor XIl activa una cascada (conjunto de compuestos que van
actuando escalonadamente) llamada de las quininas que va a desencadenar el
proceso inflamatorio a partir de componentes inactivos presentes en la sangre. La
cascada de las quininas provoca una intensa dilatación de los vasos sanguíneos
dando lugar a los primeros síntomas de dolor, contracción de fibras musculares, etc.
El mecanismo que lleva adelante la inmunidad innata, es la inflamación. Este es un
complejo proceso en el cual existe, un aumento de la permeabilidad capilar y
migración de los leucocitos desde la sangre, hacia la zona afectada. Esto se logra
a través de cambios estructurales en los capilares sanguíneos, que permiten el paso
de los leucocitos desde la sangre al tejido. Además, el reclutamiento celular se lleva
a cabo por las citoquinas, especialmente el TNF y las quimioquinas, encargadas de
activar y guiar a los fogositos hacia la zona afectada. Durante las primeras fases de
la inflamación, son los neutrófilos los que actúan, luego acuden los macrófagos y
finalmente los linfocitos. El fin de la inflamación es localizar a la infección a un solo
sitio, impidiendo que esta se propague y afecte a otros tejidos, esto es posible
mediante las proteínas de la coagulación que “amurallan” a la zona afectada.
Además, proporcionan el lugar para que los leucocitos se encuentren con los
microorganismos, y puedan ejercer su función. Durante la inflamación se liberan
muchas otras citoquinas que estimulan a la inmunidad adaptativa, para poder
finalmente erradicar al patógeno, debido a que, en ausencia de este mecanismo de
defensa, la inmunidad innata no puede controlar completamente a la infección.
Complemento.
Se denomina complemento a un complejo sistema multiproteico con más de 30
componentes, en su mayoría proteínas plasmáticas, cuyas funciones principales
son
• Lisis del microorganismo o célula diana.
• Opsonización. (Se marca el patógeno para su ingestión)
• Anafilotoxinas en el control de la respuesta inflamatoria.
• Amplificación de la respuesta humoral específica.
• Eliminación de los inmunocomplejos.
El complemento es uno de los mecanismos efectores más importantes de la
respuesta inmune natural. El resultado de su activación y posterior amplificación es
que se depositan grandes cantidades de algunos componentes del complemento
sobre las partículas responsables de la activación, lo que determina su destrucción
(lisis)al producir poros en la membrana, si se trata de un organismo celular, y/o su
eliminación por las células del sistema fagocítico. El complemento puede ser
activado de dos maneras:
• Dependiente dela presencia de anticuerpos: Vía clásica.
• Independiente de la existencia de anticuerpos: Vía alternativa y vía de las
lectinas.
El complemento normalmente está inactivado. El activador del complemento en la
vía alternativa es una sustancia presente en la sangre (generalmente inactiva)
llamada C3b que se activa en caso de inflamación. El activador del complemento
(activa cinco factores), determina la liberación de anafilatoxinas. Las anafilatoxinas
se fijan sobre la superficie de los mastocitos o células cebadas (que tienen en su
superficie numerosos receptores), lo que provoca su desgranulación (liberan el
contenido de los gránulos que tienen en su citoplasma). Una de las sustancias que
liberan los mastocitos es la histamina, que provoca la dilatación de los capilares con
la aparición de hinchazón y edema. Otras sustancias elaboradas por los mastocitos
como los leucotrienos y las prostaglandinas, entre otras funciones, atraen a los
fagocitos para eliminar a los agentes patógenos. Los basófilos acuden a los tejidos
durante el proceso inflamatorio y suponen un refuerzo en la liberación de
mediadores químicos. Los fibroblastos del tejido conectivo van colonizando la herida
desde los bordes al centro, los capilares vascularizan y la herida va cerrándose. Las
células en contacto con los microorganismos liberan también sustancias
piretógenas que vía sanguínea estimulan al centro regulador de la temperatura
corporal, localizado en el hipotálamo. La elevación de la temperatura corporal por
encima de lo normal facilita la movilidad de los fagocitos y dificulta el desarrollo de
los microorganismos, al alejarse la temperatura de la óptima para su crecimiento.
INMUNIDAD ADAPTATIVA.
La Inmunidad adaptativa o inmunidad específica, es un mecanismo de defensa
mucho más evolucionado, que es estimulada luego de la exposición a agentes
infecciosos, y cuya capacidad e intensidad defensiva aumenta después de cada
exposición subsiguiente a un determinado microorganismo. Existen dos tipos de
inmunidad adaptativa, la inmunidad celular y la inmunidad humoral. Ambas actúan
en conjunto, con el fin de eliminar a los microorganismos, pero se las divide de esta
manera para poder estudiarlas detalladamente.
Principales características de la respuesta adaptativa:
Diversidad: Es lo que permite al sistema inmunitario responder a una gran variedad
de antígenos extraños. Se estima que el sistema inmunitario puede distinguir entre
109 y 1011 determinantes antigénicos diferentes. Los mecanismos moleculares que
producen esta amplia diversidad son tratados junto con los capítulos y trabajos
referidos a los Linfocitos B.
Especificidad: Da a lugar a que cada microorganismo genere respuestas especificas
en su contra.
Memoria: La exposición del sistema inmunitario a un agente extraño mejora su
capacidad para responder de nuevo a este, ante una reexposición. Es por esto que
las respuestas inmunitarias adaptativas, son más rápidas y más eficientes.
Especialización: Genera respuestas óptimas para la defensa frente a los
microorganismos. Así, la inmunidad celular y la inmunidad humoral son estimuladas
por diferentes microorganismos.
Autolimitación: Permite al sistema inmunitario disminuir de intensidad frente a un
antígeno, a medida que esta va siendo eliminado. Devolviendo al sistema inmune a
su estado basal.
Ausencia de autoreactividad: Es una de las propiedades más importantes del
sistema inmune, que brinda la capacidad de reconocer lo propio de lo extraño, y no
reaccionar frente las sustancias antigénicas propias. Esta propiedad es compartida
con la inmunidad innata.
Inmunidad celular.
La inmunidad celular recibe este nombre debido a que sus mediadores son células,
a diferencia de la inmunidad humoral cuyos mediadores son moléculas. Las células
T o linfocitos T, son los principales efectores de la inmunidad celular. Estos se
encargan básicamente de erradicar a los microorganismos intracelulares. Existen
dos subpoblaciones de linfocitos T, los T colaboradores o helper (CD4+) y los T
citolíticos o citotóxicos (CD8+). A su vez los LTh (linfocitos T helper), se subdividen
en TH1 y TH2. Este tipo celular reconoce a los péptidos antigénicos de los
microorganismos intracelulares, cuando se expresan en la superficie de la célula
huésped asociados a moléculas del MHC I o MHC II, de acuerdo a quien sea el
Linfocito T efector, CD4+ o CD8+ respectivamente. En este trabajo se analizará de
manera superficial los mecanismos de reconocimiento y activación de las células T,
dejando los mecanismos íntimos a los capítulos y trabajos sobre Linfocitos T
exclusivamente. Luego se analizarán los mecanismos efectores de la respuesta
celular y su interacción con los diferentes tipos celulares.
Reconocimiento del antígeno por los Linfocitos T.
Para que la respuesta celular se lleve a cabo, los linfocitos T inactivos o “naive”
deben madurar a células efectoras. Ese paso se produce cuando las células T
reconocen a los antígenos. Los linfocitos T por si solos no son capaces de identificar
a los antígenos extraños, necesitan que estos les sean “presentados”. Para cumplir
esta función de gran importancia el sistema inmunológico consta de un grupo de
células denominadas “Células presentadoras de antígenos” o APC (Antigenpresenting cells), dentro de las cuales se incluyen a los: Macrófagos, Linfocitos B,
Células dendríticas y células de Langherans. Estas células comparten la
particularidad de que todas expresan en sus membranas moléculas del MHC II, a
las cuales se les asocia el péptido extraño, y de esta manera se los pueden
“presentar” a las células T. El reconocimiento de los antígenos por los Linfocitos T
se hace en los órganos linfoides, en la mayoría de los casos en los ganglios
linfáticos. En estos sitios anatómicos residen las células T naive, y es aquí donde
se transforman en células efectoras que luego de la expansión clonal y
diferenciación, migran del ganglio linfático para entrar en la circulación y dirigirse
hacia el sitio de la infección.
Además de la presentación del péptido extraño asociado a la molécula del MHC I o
MHC II, los linfocitos T necesitan “coestimulación”. La coestimulación consiste en el
reconocimiento de ciertas proteínas asociadas a las moléculas del MHC
denominadas justamente “Coestimuladores”. Esta interacción genera una cascada
de señalización intracelular, que lleva a la expresión de ciertos genes codificadores
de proteínas de membrana las cuales son receptores para citoquinas. Este
mecanismo prepara a los linfocitos T para recibir a su segunda coestimulación, las
citoquinas. La citoquina más importante en la etapa de expansión clonal es la IL-2,
esta es producida por los linfocitos T helper, ya sea para estimular a los CD8+ o a
sí mismos.
Mecanismos efectores de la inmunidad celular.
Linfocitos T Helper (TH1 y TH2). La principal función de las células T CD4+, es como
su nombre lo indica “colaborar” en la activación y actividad de otros tipos celulares
mediante la secreción de diversas citoquinas, que además participan en el
desarrollo de cada subespecie. Los linfocitos TH1 secretan principalmente INFγ,
citoquina importante en la activación de macrófagos. Esta citoquina también
estimula la diferenciación de CD4+ naive, a Linfocitos TH1, mientras que inhibe la
diferenciación a TH2. A su vez, los TH2, secretan en primer lugar IL-4, IL-5 e IL-13,
cuya principal función es la maduración y activación de mastocitos y eosinofilos,
mientras que inhibe la activación del macrófago. Además, estimula la diferenciación
celular de los CD4+ naive, a Linfocitos TH2 e inhiben la diferenciación hacia TH1.
Se puede apreciar que los efectos de las citoquinas secretadas por cada
subespecie, antagoniza las funciones de la otra, este sistema busca que la
respuesta iniciada por un antígeno especifico sólo se desarrolle en el sentido más
apropiado para su eliminación. La principal función de los TH1 es participar en la
defensa mediada por fagocitos, es decir, frente a microorganismos que hayan
podido ser fagocitados, esto se logra a través de los siguientes eventos: Luego de
haber llegado al sitio de la infección los TH1 actúan en conjunto con los CD8+
estimulando la migración de los monocitos de la sangre hacia ellos, una vez
realizado esto, se lleva adelante la interacción entre macrófagos y TH1 en la cual
ambos generan estímulos para su expansión,
el macrófago estimula al TH1
secretando IL-12 y este, en respuesta, secreta INFγ para activarlo. El macrófago
activado, mejora su capacidad fagocítica, aumenta la secreción de citoquinas y la
expresión de moléculas del MHC II junto con sus coestimuladores. En tanto los TH2
son los responsables de la defensa frente a helmintos artrópodos y reacciones
alérgicas, debido a que sus citoquinas activan a esosinofilos y mastociots, a su vez,
la IL-4, IL-5 e IL-13 también estimulan la producción de IgE por las células
plasmáticas. Estas dos funciones de aparente discordancia, son complementarias,
ya que los esosinofilos y mastocitos reconocen a los helmintos que se encuentren
recubiertos por IgE.
Linfocitos T citolíticos:
Este tipo celular recibe este nombre por su capacidad de lisar a las células
infectadas con microorganismos intracelulares, los cuales no pueden ser eliminados
por los fagocitos. El primer paso es reconocer a las células infectadas. Los CD8+
reconocen a los péptidos presentados por las moléculas de clase I del MHC, las
cuales pueden ser expresadas por todos los tipos celulares nucleados. Una vez que
el linfocito T citolítico interactúa con el MHC I y sus coestimuladores, es activado y
esto lleva a la exocitosis de sus gránulos. Los gránulos de lo CD8+ contienen las
proteínas Perforinas y Granzimas, cuyos mecanismos de acción ya han sido
expuestos. Los T citolíticos también expresan FasL, que interactúa con Fas en la
membrana de las células blanco e inducen la apoptosis.
Inmunidad humoral.
La inmunidad humoral recibe este nombre, debido a que sus mediadores son los
anticuerpos y las proteínas del complemento. Debido a que muchas de las funciones
de la inmunidad humoral son mediadas por los anticuerpos.
Los anticuerpos o inmunoglobulinas (Ig), son una familia de glucoproteinas
producidas por los linfocitos B en dos formas: unidos a membrana y de secreción,
estos últimos son los que actúan en la inmunidad humoral. Todas las Ig poseen una
estructura básica similar, compuesta por dos cadenas pesadas (H) idénticas unidas
entre sí por enlaces covalentes y dos cadenas ligeras (L) unidas a las anteriores.
Tanto la cadena pesada como la de la ligera de las Ig se componen de regiones
variables (V) Nterminal y regiones constantes (C) carboxiterminal. Cada una de
estas regiones V contiene tres regiones de hipervariabilidad independientes, que se
ensamblan espacialmente para formar el sitio de unión al antígeno. Los anticuerpos
se clasifican en diferentes isotipos dependiendo de las diferencias de sus regiones
C de las cadenas pesadas, las distintas clases se denominan IgM, IgG, IgD, IgE e
IgA. La mayoría de las funciones efectoras de los anticuerpos secretados son
llevadas a cabo por la por las porciones Fc de las regiones C de las cadenas
pesadas.
Los anticuerpos de utilidad para la defensa del huésped se encuentran en la sangre,
pero son producidos por los linfocitos B o las células plasmáticas en los ganglios
linfáticos. Incluso algunos anticuerpos pueden proceder de antiguas células de
memoria. El sistema del complemento es otro de los grandes efectores de la
inmunidad humoral, en este trabajo e mencionaran las generalidades de sus
mecanismos efectores, dejando su estudio detallado a los trabajos específicos
sobre el tema. Se ha hecho hincapié en la importancia de los anticuerpos en la
inmunidad humoral y su origen en los linfocitos B. por lo tanto consideramos
conveniente describir los mecanismos de activación de una célula B primero y luego
los mecanismos efectores de los anticuerpos.
Activación de los Linfocitos B.
Mecanismo de activación por Ag T dependientes Los Ag proteicos no pueden inducir
por si solos la activación de los Linfocitos B, si no que requieren la estimulación de
los Linfocitos CD4+ (LTh).
Las células B específicas para el Ag, lo unen a su receptor, lo internalizan y lo
procesan en vesículas endosomicas. Estas proteínas endocitadas son degradadas
por enzimas presentes en los endosomas y lisosomas para generar pequeños
péptido (10 a 30 AA) que podrán unirse a las moléculas del MHCII. Estas son
sintetizadas en el Retículo endoplásmico rugoso y luego son transportadas al
endosoma donde se unen a los péptido. Luego este complejo péptido MHCII se
expresa en la membrana y junto con estos se expresan otras proteínas llamadas
“coestimuladores”. Finalmente, en la membrana de Linfocito B se encuentran el
péptido unido a la molécula del MHCII y sus coestimuladores, cuyo fin es poder
“presentar” el Ag a los LTh. Por esta función a las células B se las incluye dentro del
grupo de “células presentadoras de Ag” (APC). Los LTH presentan en su membrana
receptores para el MHCII y ligándos para los coestimuladores, que cuando
interactúan con estos activan a los LTh. Una vez activados estos secretan citoquinas
para estimular la proliferación y diferenciación del Linfocito B. Las citoquinas no son
específicas para cada Ag, aunque hayan sido secretadas por la activación de un
LTh especifico. Las citoquinas desempeñas dos funciones principales: 1) Estimulan
la proliferación y diferenciación de los Linfocitos B. 2) Determinan que tipo de Ig se
producirá por la activación de las células B. Mecanismo de activación por Ag T
independientes. Si bien a la mayoría de los Ag a los que nos vemos sometidos son
Ag proteicos, existe otro tipo que pueden ser: polisacáridos, glucopeptidos y ácidos
nucleicos. Estos Ag no son internalizados, si no que ejercen su acción por
señalizaciones intracelulares producidas por el receptor del Linfocito B.
Generalmente la respuesta producida por este tipo de Ag, se compone de Ac de
escasa afinidad y un repertorio de células de memoria bajo. La importancia práctica
de este tipo de reacción, es que muchos Ag de las paredes bacterianas son
polisacáridos y este es el mecanismo principal de la activación de los Linfocitos B
en la inmunidad frente a las infecciones bacterianas.
Cooperación celular.
Los receptores para el antígeno de los linfocitos B son inmunoglobulinas IgM o IgD
unidas a la membrana. Asociadas a cada receptor se encuentran dos cadenas,
denominadas Iga e Igb, que constituyen el módulo de señalización propiamente
dicho del receptor para el antígeno. Aunadas a estas señales, se combinan aquellas
generadas por moléculas co-receptoras tales como CR2 (receptor de complemento,
CD21), CD19 y CD81. El reconocimiento simultáneo de un antígeno (opsonizado
por complemento) por el co-receptor CR2 y por las inmunoglobulinas de superficie
de un linfocito B intensifica mucho la magnitud del estímulo.
Los antígenos reconocidos por los anticuerpos pueden ser tan diversos como
polisacáridos, lípidos, péptidos, ácidos nucleicos y pequeñas sustancias químicas.
Los anticuerpos pueden reconocer epítopes lineares o bien determinantes
conformacionales, resultantes del plegamiento de las cadenas polipeptídicas. El
reconocimiento antigénico induce la endocitosis del antígeno, y su procesamiento
para ser presentado por el linfocito B mediante moléculas MHC II.
Los receptores de linfocitos B que no han tenido contacto con antígenos (células
vírgenes), son del isotipo IgM e IgD.
Estas células B vírgenes circulan
continuamente por los diversos tejidos linfoides hasta encontrar el antígeno
específico de su receptor. En el momento en que esto sucede, los linfocitos B dejan
de migrar, y como resultado de una secuencia de eventos moleculares se
transforman en células plasmáticas productoras de anticuerpos dentro de los
ganglios linfáticos o tejidos linfoides asociados a mucosas (amígdalas, apéndice,
placas de Peyer etc.). Dependiendo de las características del antígeno, los linfocitos
B pueden activarse con o sin ayuda de linfocitos T CD4+ (ayudadores). Aquellas
macromoléculas que contienen antígenos polivalentes, es decir que constan de
múltiples epítopes idénticos como es el caso de polisacáridos y glicolípidos de las
cápsulas de algunas bacterias (Haemophilus influenzae, pneumococo y
meningococo), pueden unirse simultáneamente a varios receptores IgM, lo cual
lleva al entrecruzamiento de los receptores y a la activación del linfocito B. Sin
embargo, cuando las características del antígeno no inducen el entrecruzamiento
de varias moléculas de inmunoglobulinas, sino que solo comprometen a un receptor
IgM, el linfocito B requiere de la ayuda de linfocitos TCD4+ para su activación. En
este caso, los antígenos proteícos unidos a un receptor IgM son endocitados,
procesados y expuestos de nueva cuenta en la superficie celular por las moléculas
MHC II del linfocito B.
Este proceso permite iniciar lo que se conoce como
“cooperación entre linfocitos T y B”, proceso mediante el cual un linfocito T CD4+
cuyo TCR es específico para ese antígeno, reconoce al antígeno y genera una serie
de señales intracelulares que ultimadamente van activar al linfocito B.
Esta conversación molecular entre linfocitos T y B depende de la presencia
simultánea de linfocitos B y T con receptores que reconocen determinantes
antigénicos de un mismo microorganismo en los mismos órganos linfoides. Gracias
a la migración constante de ambos grupos de linfocitos por el sistema linfoide, esto
es posible. Actualmente se piensa que un linfocito T específico contra un antígeno
microbiano determinado es activado previamente, y de manera independiente, por
CPAs que capturaron, procesaron y presentaron determinantes antigénicos del
microorganismo a ese linfocito T en los ganglios linfáticos.
El determinante
antigénico del microorganismo reconocido por los receptores de los linfocitos B
puede ser totalmente distinto a los que le presente la célula B a los linfocitos T, y sin
embargo la ayuda proporcionada por el linfocito T, favorece la producción de
anticuerpos dirigidos contra el determinante antigénico inicial. En otras palabras,
los anticuerpos que produce el linfocito B activado reconocerán el mismo
determinante antigénico que fue reconocido inicialmente por los anticuerpos que
constituyen el receptor para el antígeno del linfocito B.
Las señales intracelulares generadas cuando los receptores para el antígeno
reconocen a su antígeno no son suficientes para la activación adecuada del linfocito
B y se requiere la participación de moléculas co-receptoras tanto de células B como
T. Las moléculas co-receptoras expresadas por el linfocito B incluyen B7-1 (CD80)
y B7-2 (CD86) cuyo ligando en células T es CD28. El linfocito T CD4+ a su vez
expresa la molécula co-estimuladora CD40L cuyo ligando en la célula B es CD40 .
Esta co-estimulación, o segunda señal, es indispensable para la activación mutua,
ya que sin ella los linfocitos entran en un estado de anergia. Adicionalmente, la IL2 secretada por el linfocito T CD4+ induce la activación y proliferación del linfocito
B, transformándolo en célula plasmática productora de anticuerpos.
Uno de los eventos que ocurren en el linfocito B estimulado, es la activación del gen
que codifica para la enzima TdT (desoxinucleotidil transferasa terminal),
responsable de generar mayor polimorfismo en la región variable de los anticuerpos
producidos por los linfocitos B. Mediante la inserción de nuevos nucleótidos en los
segmentos génicos que codifican para la región variable de las inmunoglobulinas,
las células pueden producir anticuerpos con distinta afinidad para el antígeno. La
maduración de la afinidad permite generar un polimorfismo adicional al generado
durante la recombinación genética de los receptores de linfocitos B, incrementando
aún más (hasta109) el número de posibles diferentes anticuerpos de muy alta
afinidad. Aquellos linfocitos B que expresan receptores de mayor afinidad para el
determinante antigénico son seleccionados para seguir su desarrollo hacia células
plasmáticas productoras de anticuerpos de mayor afinidad que los receptores
originales de membrana de los linfocitos B, mientras que los linfocitos B cuyos
receptores tienen menos afinidad por el antígeno, mueren por apoptosis.
En
general, los anticuerpos que se unen al antígeno durante la fase de reconocimiento
antigénico son de menor afinidad y de otro isotipo que los que llevan a cabo la fase
efectora de la respuesta humoral.
Mediante los cambios de isotipos de los anticuerpos se generan anticuerpos con
una misma especificidad antigénica (determinada por su fracción Fab), pero que
tienen distintas regiones Fc. El isotipo es determinado por el tipo de citocinas
secretadas por los linfocitos T CD4+: IL-4 favorece la producción de IgE, mientras
que Il-5 y TGF-b inducen IgA e IFN-g favorece la diferenciación hacia las subclases
IgG1 e IgG3. Esto es importante, ya que distintos isotipos de anticuerpos llevan a
cabo distintas funciones efectoras, a traves de los distintos tipos de receptores para
Fc expresados por diferentes células linfoides.
Las células plasmáticas pueden salir de los ganglios linfáticos donde sufrieron su
estimulación, proliferación y expansión clonal y migar a distintos sitios del sistema
inmune (ganglios o médula ósea) y secretar anticuerpos mientras persista el reto
antigénico o bien, transformarse en células de memoria, con capacidad de producir
anticuerpos de alta afinidad muy rápidamente, en caso de la reaparición del reto
antigénico. Mientras que la respuesta primaria tarda de 7 a 10 días para llegar a su
máxima expresión, la respuesta inmune secundaria generada por linfocitos B de
memoria, tarda entre 3 y 4 días.
Los anticuerpos circulan por la sangre y
dependiendo de su isotipo, se asocian preferentemente a distintos tejidos o células
efectoras, siendo que IgA se encuentra asociada a mucosas, mientras que IgE se
une a receptores FceRI de alta afinidad en células cebadas y basófilos.
El
entrecruzamiento de los receptores IgE en estas células lleva a la liberación
instantánea de las substancias vasoactivas de sus gránulos.
Macrófagos.
Una vez que el macrófago reconoce la partícula extraña, la fagocita, entra a formar
parte de un fagosoma, posteriormente al actuar los lisosomas en una vacuola
digestiva en donde la partícula es digerida por los enzimas hidrolíticos. Un
fragmento del antígeno se fija posteriormente a las glucoproteínas MHC de la case
II del fagocito. De esta forma es presentado a otros componentes del sistema
inmunitario como los linfocitos TCD4 y al mismotiempo elaboran una sustancia
mensajera llamada interleucina I (citoquina).
Linfocitos B.
La superficie de los linfocitos B se encuentra recubierta por receptores específicos
de los diferentes antígenos (inmunoglobulinas de superficie) existiendo tantas cepas
de linfocitos B como antígenos pueden ser reconocidos. Los receptores proteicos
son dela misma naturaleza que los antecuerpos que son capaces de reconocer.
Los linfocitos B pueden tomar contacto con un antígeno:
1. Porque le es presentado por un macrófago
2. Se encuentra con él libre en el medio interno Una vez que el linfocito ha
reconocido al antígeno, lo internaliza y lo procesa, presentando alguno de los
péptidos del antígeno junto a MHC de la clase II.
El linfocito B presenta el antígeno a un TCD4 específico formando un complejo BTCD4. El linfocito TCD4 elabora citoquinas (interleucinas) y mensajeros de
inmunidad (BCGF y BCDF) que son recepcionados por los linfocitos B. Todo esto al
mismo tiempo produce la activación de los linfocitos B de forma que: Parte de los
nuevos linfocitos se diferencian en células plasmáticas que elaboran anticuerpos
específicos contra el antígeno reconocido. Otra parte de los linfocitos y células
plasmáticas permanecen como células de memoria.
Linfocitos T.
Al igual que los linfocitos B, las células T necesitan el puenteo de su receptor
antigénico para la modificación de su fisiología y con ello la ganancia de ciertas
funciones que antes no tenía, tales como secreción de citoquinas, expresión en
membrana de moléculas de activación, etc. El receptor de linfocitos T (TCR), es una
molécula
de
reconocimiento
específica
para
cada
antígeno,
como
las
inmunoglobulinas, pero sólo está presente en la membrana y noes liberado al medio
extracelular en respuesta al antígeno, es decir, no existe como forma soluble y no
reconoce, tal y como lo hacen los linfocitos B, una enorme variedad de estructuras
moleculares (incluyendo hidratos de carbono) sino que está sesgado para el
reconocimiento de moléculas del complejo principal de histocompatibilidad (MHC)
debido a un proceso de selección que tiene lugar en el timo.
Las moléculas codificadas en el MHC son capaces de alojar péptidos en una
hendidura que aparece en su estructura cuaternaria. El receptor de linfocito T sólo
es capaz de unirse a complejos péptido MHC, interaccionando los aminoácidos de
las cadenas que forman el receptor de linfocito T tanto con aminoácidos del péptido
como de la molécula MHC en la que éste se encuentra alojado. Estos péptidos se
generan por la proteólisis de proteínas generadas en el interior de la célula (por
ejemplo, proteínas virales) o de aquellas captadas del medio externo tras su
endocitosis o pinocitosis (proteínas bacterianas). Este proceso se denomina
presentación antigénica. Los linfocitos T son aquellos cuyas células precursoras
proceden de la médula ósea roja, pero que han madurado en el timo. Tres tipos:
TCD4, TH, T4 o auxiliadoras que son activadas cuando toman contacto
simultáneamente con un antígeno unido a glucoproteínas MHC de la clase II que le
presentan las APC (células presentadoras de antígeno) y al mismo tiempo por
citoquinas como las interleucinas I producidas por los APC que han tomado contacto
con el antígeno Los linfocitos TCD8, T8, citotóxicos o citolíticos se activan al tomar
contacto con antígenos asociados a glucoproteínas MHC de la clase I y al mismo
tiempo las citoquinas como la interleucina 2 elaboradas por los linfocitos TCD4 Ts
o supresores que detienen la respuesta inmunitaria.
Anticuerpos.
Los anticuerpos son proteínas circulantes que se producen en los vertebrados en
respuesta a la exposición a estructuras extrañas conocidas como antígenos. Los
anticuerpos son increíblemente diversos y específicos en su capacidad para
reconocer estructuras moleculares extrañas, y son los mediadores de la inmunidad
humoral contra todas las clases de microbios. Como estas proteínas se
descubrieron como moléculas séricas que proporcionaban protección contra la
toxina diftérica, al principio se las llamó antitoxinas. Cuando se vio que podían
generarse proteínas similares contra muchas sustancias, no solo toxinas
microbianas, estas proteínas recibieron el nombre general de anticuerpos. Las
sustancias que generan o son reconocidas por anticuerpos se llamaron entonces
antígenos.
Los
anticuerpos,
las
moléculas
de
complejo
principal
de
histocompatibilidad (MHC) y los receptores del linfocito T para el antígeno, son las
tres clases de moléculas que utiliza el sistema inmunitario adaptativo para unirse a
los antígenos. De estos tres, los anticuerpos fueron los primeros en ser
descubiertos, reconocen el espectro más amplio de estructuras antigénicas, tienen
la mayor capacidad de discriminar entre diferentes antígenos y se unen a los
antígenos con mayor fuerza.
Los anticuerpos solo son sintetizados por células de la estirpe de los linfocitos B y
existen en dos formas: los anticuerpos unidos a la membrana en la superficie de los
linfocitos B actúan como receptores para el antígeno y los anticuerpos secretados
neutralizan las toxinas, impiden la entrada y propagación de los microorganismos
patógenos y eliminan los microbios. El reconocimiento del antígeno por los
anticuerpos unidos a la membrana de los linfocitos B vírgenes activa a estos
linfocitos e inicia una respuesta inmunitaria humoral. Los linfocitos B activados se
diferencian en células plasmáticas que secretan anticuerpos de la misma
especificidad que el receptor para el antígeno. Las formas secretadas de los
anticuerpos están en el plasma (la porción líquida de la sangre), en las secreciones
mucosas y en el líquido intersticial de los tejidos. En la fase efectora de la inmunidad
humoral, estos anticuerpos secretados se unen a los antígenos y desencadenan
varios mecanismos efectores que eliminan los antígenos. La eliminación del
antígeno requiere, a menudo, la interacción del anticuerpo con otros componentes
del sistema inmunitario, como moléculas del tipo de las proteínas del complemento,
y células, como los fagocitos y los eosinófilos. Entre las funciones efectoras
mediadas por los anticuerpos están la neutralización de microbios o productos
microbianos tóxicos; la activación del sistema del complemento; la opsonización de
microorganismos patógenos para potenciar su fagocitosis; la citotoxicidad celular
dependiente de anticuerpos, por la que los anticuerpos hacen que el sistema
inmunitario innato provoque la Iisis de las células infectadas; y la activación del
mastocito mediada por anticuerpos para expulsar a parásitos helmintos. Cuando la
sangre o el plasma forman un coágulo, los anticuerpos permanecen en el líquido
residual llamado suero. El suero carece de factores de la coagulación (que se
consumen durante la formación del coágulo), pero contiene, en cambio, todas las
proteínas del plasma. Cualquier muestra de suero que contenga moléculas de
anticuerpo detectables que se unan a un antígeno particular recibe el nombre de
antisuero. El estudio de los anticuerpos y de sus reacciones con los antígenos se
llama, por tanto, serología. La concentración de moléculas de anticuerpo en un
suero específico frente a un antígeno particular se calcula, a menudo, determinando
cuántas diluciones seriadas del suero pueden hacerse antes de que ya no pueda
observarse la unión; de los sueros con una concentración alta de moléculas de
anticuerpo específicos frente a un antígeno particular se dice que tienen un título
alto.
Un ser humano adulto sano de 70 kg produce unos 2 a 3 g de anticuerpos al día.
Casi dos tercios son un anticuerpo llamado IgA, que producen los linfocitos B
activados y las células plasmáticas en las paredes de los aparatos digestivo y
respiratorio, que las células epiteliales transportan activamente a las luces de estos
tubos. La mayor cantidad de IgA producida refleja la mayor área superficial de estos
órganos.
El anticuerpo típico está constituido por 2 unidades estructurales básicas, cada una
de ellas con dos grandes cadenas pesadas y dos cadenas ligeras de menor tamaño,
que forman, por ejemplo, monómeros con una unidad, dímeros con dos unidades o
pentámeros con cinco unidades. Los anticuerpos son sintetizados por un tipo de
leucocito denominado linfocito B. Existen distintas modalidades de anticuerpo,
isotipos, basadas en la forma de cadena pesada que posean. Se conocen cinco
clases diferentes de isotipos en mamíferos que desempeñan funciones diferentes,
contribuyendo a dirigir la respuesta inmune adecuada para cada distinto tipo de
cuerpo extraño que encuentran.
Características.
Proteínas de estructura globular sintetizadas por células del sistema inmune
(Linfocitos B y células plasmáticas derivadas de ellos.
¾ Presentes en la sangre (plasma) y otros fluidos biológicos (saliva, lágrimas,
secreción mucosa intestinal, líquido sinovial, líquido intersticial etc.)
¾ En el plasma se detectan dentro de la fracción de las γ globulinas.
¾ Capaces de reconocer a otras moléculas (antígenos) de manera muy específica,
y formar complejos estables con ellos (inmunocomplejos).
¾ Su aparición en plasma forma parte de la respuesta inmunológica adaptativa, en
lo que se conoce como respuesta humoral específica.
¾ Los anticuerpos tienen una vida media en el organismo relativamente larga
(varias semanas).
¾ Constituyen una defensa muy eficaz contra agentes patógenos.
Tipos de anticuerpos.
Las clases de inmunoglobulinas que aparecen en la especie humana son: G, M, A,
D y E. La clasificación en un tipo u otro depende de la cadena pesada que posean.
Inmunoglobulina G: es la que se encuentra en mayor proporción (80% del total de
inmunoglobulinas). Se encuentra en gran proporción en la respuesta inmune
secundaria. Se une rápidamente con macrófagos y neutrófilos, provocando la
destrucción del microorganismo. Es la inmunoglobulina responsable de la
inmunidad del feto y del recién nacido, ya que puede atravesar la placenta y se
secreta en la leche materna. La presencia de la misma indica que el proceso de
infección es antiguo. Tiene la estructura tipo explicada en forma de Y. Se crean en
gran cantidad al entrar en contacto, por segunda vez, con el antígeno. Están
formadas por dos cadenas L y dos cadenas H de tipo gamma a las que se unen
moléculas de oligosacáridos.
Inmunoglobulina M: supone un 6% del total. En los linfocitos B aparece unida a su
membrana plasmática. Actúa en la respuesta inmune primaria activando al sistema
del complemento. Está formada por 5 unidades de IgG dispuestas en forma de
pentámero.
Inmunoglobulina A: representa un 13% del total. Se encuentra en las secreciones
tanto serosas como mucosas, de la saliva, moco, leche o lágrimas. Actúa como
barrera protectora de la superficie corporal y los conductos secretores. Se produce,
junto con la inmunoglobulina G. Genera inmunidad al recién nacido, al encontrarse
en la leche. Está formada por dos IgG unidas mediante la pieza secretora que evita
la degradación en ciertas zonas como el intestino donde hay proteasas.
Inmunoglobulina D: aparece en muy baja concentración (1%). Su estructura es
semejante a la de la inmunoglobulina G, pero se diferencia en la posición de los
restos glucocídicos de las cadenas proteicas. Son las primeras inmunoglobulinas
sintetizadas por los linfocitos B. Su función puede estar relacionada con la activación
de estas células.
Inmunoglobulina E: se encuentra en concentraciones mínimas (0.002%) en el suero
y secreciones que se liberan al exterior. Se une a receptores de mastocitos y
basófilos haciendo que estos segreguen histamina. Está íntimamente relacionada
con los procesos alérgicos. Tiene la misma estructura que la IgG.
Estructura.
Son proteínas globulares de gran peso molecular, formadas por 4 cadenas
polipeptídicas, dos pesadas, llamadas H (heavy), y dos ligeras, denominadas L
(light). Estas cadenas se unen mediante puentes disulfuro, uno entre las cadenas L
y H, y dos entre las cadenas H. Estas cadenas proteicas presentan radicales
glucídicos.
Existen dos tipos de cadenas L (l y k) y cinco tipos de cadenas H (a, d, e, g y m),
que dan lugar a los cinco isótopos de inmunoglobulina existentes (A, D, E, G y M).
Las cadenas H y L presentan dos regiones, o dominios, diferenciados: el dominio
variable, V, y el dominio constante, C. El dominio variable es el responsable de
reconocer al antígeno y unirse a él, ya que ahí se encuentra el paratopo. El dominio
constante se une a las células del sistema inmune para activarlas.
En las cadenas H aparece una zona denominada región bisagra. Esta región posee
la característica de ser muy flexible, permitiendo adquirir distintos ángulos entre las
regiones V y C, y entre los brazos de la inmunoglobulina.
Linfocitos T.
Los linfocitos T o células-T son linfocitos producidos en la médula ósea y que luego
maduran en el timo, cuyas funciones son parte importante del sistema inmunitario
adaptativo. La célula inmadura se denomina timocito, el cual durante el proceso de
maduración en el timo se diferencia en linfocito T cooperador (CD4+) o bien en
linfocito T citotóxico (CD8+). Los linfocitos así desarrollados circulan posteriormente
por la sangre y el sistema linfático hasta que son activados al contactar con un
antígeno específico, el cual interactúa con el receptor de linfocitos T que hay en su
superficie. Estos antígenos les deben ser presentados a los linfocitos T por células
presentadoras de antígenos, tales como las células dendríticas o los macrófagos
mediante moléculas del complejo mayor de histocompatibilidad. De esta forma, los
linfocitos T pueden responder en forma específica contra patógenos y células
tumorales.1
Los linfocitos T así activados son los responsables de la inmunidad celular
destruyendo células infectadas o activando macrófagos, linfocitos B u otros
linfocitos T mediante citocinas y otras proteínas coestimulatorias que se encuentran
en su membrana celular. Este tipo de inmunidad requiere un contacto directo y
estrecho con otras células.
Existen varios tipos de linfocitos T dependiendo de las moléculas de superficie que
presenta, de las sustancias que secreta y de su función principal.
Se diferencian de los linfocitos B y de las células NK (o célula Natural Killer, en
español «asesina natural») por poseer un receptor especial en la superficie de la
membrana, el receptor de linfocitos T (también llamado TCR, por su denominación
en inglés T cell receptor). Sin embargo, en un frotis microscópico de sangre no es
posible distinguir uno de otro a simple vista.
La denominación de estos linfocitos como T se debe a que su maduración tiene
lugar en el timo (órgano linfoide que constituye uno de los controles centrales del
sistema inmunitario del organismo). El número de leucocitos en sangre periférica en
un humano promedio es de 4 a 11 x 10^9 por litro, del cual, normalmente, un 20 %
son linfocitos.
Los linfocitos T de un individuo concreto presentan una propiedad denominada
restricción CMH: solo pueden detectar un antígeno si este viene presentado por una
molécula del complejo mayor de histocompatibilidad (CMH) del mismo individuo.
Esto se debe a que cada linfocito T tiene una especificidad dual: el receptor del
linfocito T (TCR) reconoce algunos residuos del péptido y simultáneamente algunos
residuos de la molécula CMH que lo presenta. Esta propiedad es muy importante
en el trasplante de órganos, e implica que, durante su desarrollo, los linfocitos T
deben aprender a reconocer las moléculas CMH propias del individuo, un proceso
complejo que tiene lugar en el timo. Puesto que las moléculas CMH solo pueden
presentar péptidos, esto implica que los linfocitos T, dado que solo pueden
reconocer un antígeno si viene asociado a una molécula CMH, solo pueden
reaccionar ante antígenos de origen proteico (procedentes de microorganismos) y
no a otro tipo de compuestos químicos (ni lípidos, ni ácidos nucleicos, ni azúcares).
Las moléculas CMH adquieren el péptido que presentan en el exterior de la
membrana celular durante su propia biosíntesis, en el interior celular. Por tanto, los
péptidos que presentan las moléculas CMH provienen de microorganismos que
están en el interior celular, y esta es la razón por la cual los linfocitos T solo detectan
microorganismos asociados a células y desencadenan una respuesta inmune
contra microorganismos intracelulares.
Tipos.
Se han descrito varios subtipos de células T, cada uno de ellos con una función
distintiva.
Linfocitos T citotóxicos (CTL, por sus siglas en inglés) o linfocitos CD8+
encargados de las funciones efectoras de la inmunidad celular, mediante la
interacción con un complejo "péptido-CMH-I"; los CTL reconocen las células
infectadas por el patógeno parao células tumorales, y las destruyen segregando una
serie de moléculas (perforina, granzimas, FasL) que activan la apoptosis de la célula
diana.
Los virus han evolucionado para utilizar varias moléculas de la superficie celular con
el fin de acceder a las células del anfitrión y utilizar su maquinaria génica y sintética
de proteínas y así replicarse y diseminarse de una célula a otra. Los virus pueden
infectar y sobrevivir en una amplia variedad de células. Los virus no pueden
destruirse si las células infectadas carecen de mecanismos microbicidas intrínsecos
o si los virus están en el citosol donde son inaccesibles para estos mecanismos. En
estas situaciones, la única forma de erradicar la infección establecida es matar a las
células infectadas, sacar al virus de su hogar e incapacitarle para sobrevivir y
replicarse. Esta función de matar a las células con virus en su citosol está mediada
por los linfocitos T citotóxicos CD8+ (CTL, del inglés cytotoxic T lymphocyte), los
linfocitos efectores de la línea CD8 +. Las citocinas producidas por los linfocitos T
CD8 + efectores también contribuyen a la eliminación de varios microbios
intracelulares. Además de su papel en la defensa contra los microbios, la segunda
función importante de los CTL CD8 + es erradicar muchos tumores. Estas células
también desempeñan funciones cruciales en el rechazo agudo de aloinjertos.
La activación de los linfocitos T CD8 + vírgenes requiere el reconocimiento del
antígeno y segundas señales, y procede en pasos igual que otras respuestas de los
linfocitos T. Sin embargo, la activación de los linfocitos T CD8 + vírgenes depende
de una vía específica de presentación del antígeno en un subgrupo especializado
de células dendríticas y puede precisar también la ayuda del linfocito T CD4+. La
diferenciación de los linfocitos T CD8+ en CTL efectores implica la adquisición de la
maquinaria necesaria para matar a las células diana. La célula infectada o tumoral
que muere por la acción del CTL suele llamarse célula diana. Los linfocitos CD8 +
vírgenes reconocen antígenos, pero necesitan proliferar y diferenciarse para
generar un grupo suficientemente grande de CTL que destruya la fuente del
antígeno. Dentro del citoplasma de los CTL diferenciados hay numerosos lisosomas
modificados (llamados gránulos) que contienen proteínas, incluidas la perforina y
las granzimas, cuya función es matar a otras células (que se describirán después).
Además, los CTL diferenciados son capaces de secretar citocinas, sobre todo IFN7 , que activan a los fagocitos.
La activación de los linfocito T CD8+ vírgenes, como la de todos los linfocitos T
vírgenes, empieza mejor si los antígenos los presentan las células dendríticas. Este
requisito plantea el problema de que los antígenos reconocidos por los linfocitos T
CD8+ pueden ser virus que infecten a muchos tipos de células, incluidas células
diferentes a las células dendríticas, o pueden ser antígenos de tumores que también
derivan de varios tipos celulares. La vía de la clase I del MHC de presentación del
antígeno a los linfocitos T CD8 + exige que los antígenos proteínicos estén
presentes en el citosol de las células infectadas de modo que estas proteínas
puedan degradarse en los proteasomas y puedan entrar en el retículo endoplásmico
a través del transportador TAP. Las proteínas procedentes de un virus que infecta
a un tipo de célula específico como los hepatocitos pueden acceder al citosol y a los
proteasomas de estas células, pero no a los de la mayoría de las células
presentadoras de antígenos (APC), dado que estas APC no están infectadas por el
virus y no sintetizan en su interior el antígeno vírico. El sistema inmunitario se
enfrenta a este problema mediante el proceso de la presentación cruzada. En este
proceso, células dendríticas especializadas ingieren células infectadas, células
tumorales o proteínas expresadas por ellas, transfieren los antígenos proteínicos al
citosol y procesan los antígenos para que entren en la vía de presentación del
antígeno de la clase I del MHC para su reconocimiento por los linfocitos T CD8 +.
Solo algunos subgrupos de células dendríticas realizan la presentación cruzada de
forma eficiente y, por lo tanto, estos subgrupos de células dendríticas son cruciales
para la activación del linfocito T CD8 + virgen. Los resultados obtenidos en
experimentos realizados en ratones indican que las APC más eficientes en la
presentación cruzada son las células dendríticas del tejido linfático que expresan el
CD8 o el subgrupo tisular periférico que expresa la integrina CD103. Las células
dendríticas correspondientes especializadas en la presentación cruzada en los
tejidos humanos expresan cantidades aftas del CDI4I, también conocido como
BDCA-3. Además, las células dendríticas plasmocitoides pueden presentar también
de forma cruzada proteínas derivadas de virus sanguíneos a los linfocitos T CD8+
vírgenes en el bazo. Además de presentar antígenos en forma de complejos
péptido-MHC, las células dendríticas proporcionan también probablemente una
coestimulación a través de las moléculas B7 u otras.
Función de los linfocitos T cooperadores.
La activación completa de los linfocitos T CD8+ vírgenes y su diferenciación en CTL
funcionales y linfocitos memoria pueden requerir la participación de los linfocitos T
cooperadores CD4+. En otras palabras, los linfocitos T cooperadores pueden
proporcionar segundas señales a los linfocitos T CD8+. Los linfocitos T
cooperadores son activados por el antígeno presentado en las moléculas de la clase
II del MHC y los coestimuladores B7 expresados en las células dendríticas. El
requisito de linfocitos cooperadores puede variar en función del tipo de exposición
al antígeno. En el marco de una respuesta inmunitaria innata fuerte frente a un
microbio, o si las APC han sido infectadas directamente por el microbio, la ayuda
del linfocito T CD4+ puede no ser crucial. Los linfocitos T cooperadores CD4+
pueden ser necesarios para las respuestas del linfocito T CD8 + frente a infecciones
víricas latentes, trasplantes de órganos y tumores, todos los cuales tienden a
desencadenar
reacciones
inmunitarias
innatas
relativamente
débiles.
La
importancia variable de los linfocitos T CD4+ en el desarrollo de las respuestas de
CTL la ilustran estudios realizados en ratones que carecen de linfocitos T
cooperadores. En estos ratones, algunas infecciones víricas no generan CTL
eficaces ni linfocitos CD8 + memoria y no son erradicadas, mientras que otros virus
estimulan respuestas de CTL eficaces. La falta de la función cooperadora del
linfocito T CD4+ es la explicación aceptada de los defectos en la generación de CTL
en los sujetos infectados por el VIH, que infecta y elimina solo a los linfocitos T
CD4+. También hay pruebas de que los o linfocitos CD4+ cooperadores son más
importantes para la generación de linfocitos T CD8 + memoria que para la
diferenciación de los linfocitos T CD8 + vírgenes en CTL efectores. Los linfocitos T
cooperadores pueden promover la activación del linfocito T CD8 + por varios
mecanismos.
• Los linfocitos T cooperadores pueden secretar citocinas que estimulan la
diferenciación de los linfocitos T CD8 +. La naturaleza de estas citocinas se
expondrá en la siguiente sección.
• Los linfocitos T cooperadores activados expresan el ligando del CD40 (CD40L),
que puede unirse al CD40 en las células dendríticas cargadas con el antígeno. Esta
interacción activa a las APC para que sean más eficientes estimulando la
diferenciación de los linfocitos T CD8 +, induciendo en parte la expresión de
coestimuladores. Este proceso se ha denominado concesión de licencia a las APC.
Linfocitos T CD4+ o cooperadores.
Las funciones de los linfocitos T efectores CD4+ son reclutar y activar a los
fagocitos (macrófagos y neutrófilos) y otros leucocitos para que destruyan a los
microbios intracelulares y a algunos extracelulares, y ayudar a los linfocitos B a
producir anticuerpos. Los linfocitos T CD4+ son cruciales para eliminar los microbios
por medio de los fagocitos, mientras que los linfocitos efectores CD8 + son
responsables de la erradicación de los microbios, habitualmente virus, que infectan
y se replican dentro de todas las células, incluidas las células no fagocíticas . Por
razones históricas, la inmunidad celular se refiere al proceso de lisis de los microbios
mediado por los fagocitos y estimulado por los linfocitos T CD4+. Algunos linfocitos
T CD4+ activan a otras células diferentes a los fagocitos, como los eosinófilos, para
que destruyan tipos particulares de microbios. Aunque estas reacciones no estaban
incluidas en la definición original de inmunidad celular, son funciones importantes
de los linfocitos T efectores. En este capítulo describiremos las funciones de los
linfocitos T CD4+ en la eliminación de los microbios. Al final expondremos algunas
de las numerosas poblaciones de linfocitos T cuyas principales funciones están
mediadas por citocinas secretadas. La secuencia de acontecimientos en las
respuestas de los linfocitos T CD4+ es la activación inicial de estas células en los
órganos linfáticos para generar linfocitos efectores y memoria, la migración de los
linfocitos efectores a los lugares de infección y la eliminación de microorganismos
patógenos infecciosos en estos lugares.
Los linfocitos T CD4+ efectores se generan por el reconocimiento del antígeno en
los órganos linfáticos secundarios, pero la mayoría de ellos abandonan estos
órganos y migran a las zonas periféricas de infección donde eliminan a los
microbios. Esta migración de los linfocitos T efectores (y memoria) a los lugares de
infección depende de moléculas de adhesión endoteliales y de quimiocinas
expresadas en estos lugares. Aunque la migración es en gran medida independiente
del antígeno, los linfocitos T que reconocen el antígeno en los tejidos
extravasculares pueden retenerse de forma preferente en esos lugares. Una vez en
los tejidos, los linfocitos T encuentran a los antígenos microbianos presentados por
los macrófagos y otras células presentadoras de antígenos (APC). Los linfocitos T
que reconocen antígenos específicos reciben señales a través de los receptores
para el antígeno que incrementan la afinidad de las integrinas por sus ligandos. Dos
de estas integrinas, VLA-4 y VLA-5, se unen a la fibronectina presente en las
matrices extracelulares, y una tercera molécula de adhesión, CD44, que también se
expresa en grandes cantidades en los linfocitos T activados, se une al hialuronano.
Como resultado de ello, los linfocitos T efectores y memoria específicos frente al
antígeno que se encuentran con el antígeno son retenidos de forma preferente en
la zona extravascular. Los linfocitos T que no son específicos frente al antígeno y
migran a la zona de la inflamación pueden morir en el tejido o volver a través de los
vasos linfáticos hasta la circulación. Algunos linfocitos T CD4+ que se activan en los
órganos linfáticos secundarios no salen de estos órganos, sino que mi- gran a los
folículos linfáticos que están dentro de ellos, donde ayudan a los linfocitos B a
producir anticuerpos de afinidad alta de diferentes isotipos. Los mejor definidos de
estos linfocitos T cooperadores se llaman linfocitos T cooperadores foliculares.
En las respuestas inmunitarias celulares contra los microbios fagocitados, los
linfocitos T reconocen específicamente a los antígenos microbianos, pero son los
fagocitos los que destruyen realmente a los microorganismos patógenos. De este
modo, los linfocitos T efectores de la línea CD4+ ligan el reconocimiento específico
de los microbios con el reclutamiento y activación de otros leucocitos que destruyen
a los microbios. Este concepto fundamental procede de estudios realizados sobre
la inmunidad celular frente a la bacteria intracelular Listeria monocytogenes. En la
década de los cincuenta se demostró que ratones previamente infectados con una
dosis baja de Listeria estaban protegidos de la provocación con dosis mayores que
eran mortales en animales previamente no infectados. La protección podía
transferirse a los animales vírgenes con linfocitos (que después se demostró que
eran linfocitos T) procedentes de ratones infectados, pero no con el suero, la
fracción líquida de la sangre coagulada que contiene los anticuerpos. En el
laboratorio, las bacterias no eran lisadas por los linfocitos T de los animales
inmunizados, sino por los macrófagos activados, lo que subraya el papel central de
los macrófagos en la ejecución de la función efectora.
Linfocitos T cooperadores o linfocitos CD4+ o helper T cells: se encargan de iniciar
la cascada de la respuesta inmune coordinada mediante la interacción con un
complejo "péptido-CMH-II". Cuando se activan, los linfocitos CD4+ se especializan,
diferenciándose a su vez en linfocitos efectores, que se distinguen por el tipo de
citoquinas que producen:
Th1, que migran a los tejidos infectados y colaboran en la activación de los
macrófagos, ya que los Th1 segregan fundamentalmente interferón γ; los Th1 son
importantes en la defensa frente a los microbios intracelulares y la inflamación;
Th2, que permanecen sobre todo en los tejidos linfoides y colaboran en la activación
de los linfocitos B; segregan principalmente IL-4 (que estimula la secreción de Ig-E,
que a su vez activa los mastocitos) e IL-5 (que activa los eosinófilos); los Th2 son
importantes en las reacciones alérgicas y en la defensa frente a parásitos;
Th17, denominados así porque segregan IL-17, además de IL-22; son los
principales mediadores en algunas reacciones alérgicas, y parecen estar implicados
en el desarrollo de enfermedades como la esclerosis múltiple, la artritis reumatoide
y la enfermedad inflamatoria intestinal.
La diferenciación en Th1, Th2 o Th17 no es al azar, sino que depende de los
estímulos que reciba el linfocito T4 virgen cuando contacte un antígeno extraño.
Linfocitos T de memoria.
Son células que se generan después de la activación de los linfocitos T, por
exposición a un antígeno extraño (un patógeno). Tienen vida larga, son
funcionalmente inactivos, y pueden circular durante meses o años, preparados para
responder a nuevas exposiciones al mismo microbio. El objetivo de las vacunas es
precisamente generar linfocitos de memoria (T y B) mediante la exposición a un
patógeno atenuado, de manera que el organismo responda de manera rápida y
eficaz frente al patógeno activo.
Linfocitos T reguladores (células Treg).
Anteriormente conocidos como células T supresoras. Su función principal es
eliminar la inmunidad mediada por células al final de la reacción inmune y eliminar
células T auto-reactivas que escaparon al proceso de selección negativa en el timo.
El interés en los Linfocitos T reguladores ha aumentado gracias a modelos
experimentales en ratones que demuestran como el potencial inmunosupresor de
estas células podría aprovecharse para mejorar la tolerancia de trasplantes, en
tratamientos contra enfermedades autoinmunes o en su eliminación específica para
potenciar inmunoterapias contra cáncer.
Citocinas.
Las citocinas (también denominadas citoquinas) son proteínas que regulan la
función de las células que las producen sobre otros tipos celulares. Son los agentes
responsables de la comunicación intercelular, inducen la activación de receptores
específicos de membrana, funciones de proliferación y diferenciación celular,
quimiotaxis, crecimiento y modulación de la secreción de inmunoglobulinas. Son
producidas fundamentalmente por los linfocitos y los macrófagos activados, aunque
también pueden ser producidas por leucocitos polimorfonucleares (PMN), células
endoteliales, epiteliales, adipocitos, del tejido muscular (miocitos) y del tejido
conjuntivo. Las citocinas secretadas por linfocitos se llaman linfocinas, aquellas
producidas por macrófagos (Mf) son monocinas, etc. (dependiendo del tipo de
célula). Su acción fundamental consiste en la regulación del mecanismo de la
inflamación.
Linfocina.
Las linfocinas son una familia de moléculas del tipo de las citocinas o mensajeros
químicos, que son producidas y liberadas por las células llamadas linfocitos T.
Su función es atraer a las células macrófagos al lugar en que se ha producido una
infección o inflamación, además de prepararlos para el ataque a los posibles
invasores extraños que estén produciendo dicha infección.
Ejemplos de linfocinas son: el factor inhibidor del macrófago, el factor mitogenético
y la linfotoxina.
FUNCIONES DE OTROS SUBGRUPOS DE LINFOCITOS T.
Además de los linfocitos T CD4+ y CD8 +, hay poblaciones menores de linfocitos T
que tienen características distintivas y probablemente realizan funciones
especializadas en la defensa del anfitrión. Los subgrupos mejor definidos son los
linfocitos T gamma/delta y los linfocitos NKT. Ambos subgrupos tienen
características comunes que les distinguen de los linfocitos T CD4+ y CD8 +.
• Los linfocitos T gamma/delta y los linfocitos NKT reconocen una amplia variedad
de antígenos, muchos de los cuales no son péptidos, y que no se muestran en las
moléculas del MHC de las clases I y II en las APC.
• Los receptores para el antígeno de muchos linfocitos T gamma/delta y de los
linfocitos NKT tienen una diversidad limitada, lo que lleva a pensar que los dos tipos
de células pueden haber evolucionado para reconocer un pequeño grupo de
antígenos microbianos. Debido a esta característica, de estos linfocitos T se dice a
menudo que están en el cruce entre las inmunidades innata y adaptativa.
• Los dos tipos de células abundan en los tejidos epiteliales, como el tubo digestivo.
Debido a estas propiedades inusuales, se ha propuesto que los linfocitos T
gamma/delta y los linfocitos NKT realizan funciones especiales en la defensa del
anfitrión, similares a las funciones de las células linfocíticas innatas. Sus funciones
comunes pueden ser las siguientes:
• La defensa temprana contra los microbios encontrados en los epitelios, antes de
que se hayan desarrollado las respuestas inmunitarias adaptativas.
• La vigilancia contra las células estresadas, como las células que han sufrido una
lesión en el ADN o están infectadas, y la eliminación de estas células.
• La producción de citocinas que influyen en respuestas inmunitarias adaptativas
posteriores.
Células T gamma/delta.
Son un pequeño grupo de células T que poseen un TCR específico en su superficie.
La mayor parte de los linfocitos tienen un TCR compuesto por dos cadenas
glucoproteicas denominadas α y β. Sin embargo, en las células γδ, el TCR está
formado por una cadena γ y una cadena δ. Este grupo de linfocitos es muy poco
frecuente (5% del total), pero son abundantes en la mucosa del intestino, formando
parte de una población de linfocitos denominada linfocitos intraepiteliales. Los
antígenos que activan estos linfocitos eran desconocidos, se ha descubierto una
presentación de glucoproteinas como antigenos, en vez de péptidos. Sin embargo,
los linfocitos γδ no presentan restricción CMH, y parece que reconocen proteínas
completas en lugar de péptidos, aunque algunos reconocen moléculas CMH-IB.
Células T natural killers (NK).
Son un tipo especial de linfocitos, situados entre la respuesta inmune adaptativa
(mediada por linfocitos), y la respuesta inmune innata (la inflamación). Las células
NK provienen del mismo precursor hematopoyético que el resto de los linfocitos T,
pero no expresan el TCR. Sin embargo, estas células pueden recibir dos tipos de
señales
• activadoras: - las células NK expresan las moléculas Fas-L o TRAIL, capaces de
detectar la presencia de Fas o TRAIL-R en la célula diana, relacionadas con la
apoptosis; - la ausencia de moléculas CMH-I en la superficie de la célula diana, bien
por infección viral o desarrollo tumoral (que ha bloqueado la producción de
moléculas CMH-I), bien porque se trata de una célula exógena, en el caso de un
transplante
• inhibidoras: mediada por los receptores específicos para las moléculas CMH-I,
denominados KIR, por killer-cells immunoglobulin receptor. Estos receptores
pertenecen a una familia de multigenes similares a las inmunoglobulinas, que han
evolucionado recientemente; son los receptores principales tanto para moléculas
CMH-I clásicas (HLA-A, HLA-B, HLA-C) y para la molécula CMH-I no clásica HLAG en primates. Algunos KIR son específicos para ciertos subtipos HLA. Durante su
desarrollo, es necesario que la célula NK reconozca con sus receptores inhibidores
el CMH-I para convertirse en célula asesina. La expresión de los receptores
inhibidores es al azar, de manera que se expresan en ausencia de ligando. Además,
las células NK son "anérgicas": no son funcionales, en ausencia de activación. Una
vez activadas, estas células pueden realizar funciones relacionadas tanto con los
linfocitos T4 (cooperadores) como con los T8 (citotóxicos): producción de citoquinas
y liberación de moléculas citolíticas, capaces de destruir la célula objetivo. Las
células NK, por tanto, van a destruir todas aquellas células que carezcan de
moléculas CMH-I, ya que éstas son células que se identifican como potencialmente
dañinas: infectadas o tumorales. En el caso de las células transplantadas
(exógenas), es una situación no fisiológica, y la activación de las células NK
constituye una de las principales barreras al transplante. En general, la tolerancia
de las células NK hacia las células propias está asegurada porque un único receptor
CMH-I activado es suficiente para asegurar la inhibición, ya que la señalización
inhibidora es dominante frente a la activadora.
Las células NK se activan por interferones, los cuales son producidos por las células
infectadas por virus (es un proceso feed-back). También se activan por otras
citocinas: las interleucinas-2, las cuales se forman en los linfocitos T activados. 2
Una vez que el sistema inmunitario específico se ha activado, los anticuerpos tienen
un papel de activación de las células NK, pues éstas también tienen función
citotóxica (tóxicas para la célula). Las células NK poseen receptores específicos
para la región Fc de la inmunoglobulina G (FcγRIII). Cuando una célula está
infectada por virus, los antígenos de éstos, se presentan en la superficie de la célula
infectada y los anticuerpos unidos a la NK, a su vez se unen a la célula infectada.
A las células NK activadas por interleucinas-2 en laboratorio, se las denomina
células LAK.
HIPERSENSIBILIDAD.
La hipersensibilidad clásicamente se refiere a una reacción inmunitaria exacerbada
que produce un cuadro patológico causando trastornos, incomodidad y a veces, la
muerte súbita. Tiene muchos puntos en común con la autoinmunidad, donde los
antígenos son propios. Las reacciones de hipersensibilidad requieren que el
individuo haya sido previamente sensibilizado, es decir, que haya sido expuesto al
menos una vez a los antígenos en cuestión. La clasificación en cuatro grupos
distintos fue propuesta por P. H. G. Gell y Robin Coombs en 1963.1 En la década
de 1930 Coombs sistematizó estas reacciones de acuerdo al tiempo que demoraba
la aparición de los síntomas y la dosis de desafío. Esta clasificación no solamente
apuntaba a la cinética de las reacciones, sino también a los mecanismos
involucrados, y ha sido fundamental para orientar la terapia y conocer los
mecanismos.
Clasificación de Gells y Coombs.
• La hipersensibilidad inmediata (hipersensibilidad del tipo I) causada por
anticuerpos IgE específicos frente a antígenos ambientales es el tipo más frecuente
de enfermedad por hipersensibilidad. Las enfermedades por hipersensibilidad
inmediata, llamadas con frecuencia trastornos alérgicos o atópicos, son los
prototipos de las enfermedades causadas por la activación linfocitos T
cooperadores productores de IL-4, IL-5 e IL-13, clásicamente los linfocitos TH2, en
las que los linfocitos T estimulan la producción de anticuerpos IgE y la inflamación.
La hipersensibilidad tipo 1 es una reacción alérgica provocada por re-exposición a
un tipo específico de antígeno referido como un alérgeno. La exposición puede
haber sido por ingestión, inyección o por contacto directo. La diferencia entre una
respuesta inmunitaria normal y una hipersensibilidad de tipo 1 es que las células
plasmáticas secretan IgE de una forma descontrolada, superando ampliamente las
100 U/I establecidas como el conteo estándar de este tipo de Ig. Esta clase de
anticuerpos se unen a los receptores para la porción constante (Fc) del anticuerpo
sobre la superficie de los mastocitos tisulares y basófilos circulantes. Al cubrirse
estas células con IgE son sensibilizadas al momento de la aparición inicial del
alergeno. Con subsecuentes exposiciones al mismo alergeno, hace que las IgE se
entrecrucen en la superficie celular de células sensitizadas, resultando en una
desgranulación y secreción de mediadores farmacológicamente activos, tales como
la histamina, leucotrieno y prostaglandina. Los principales efectos de estos
productos son la vasodilatación y la contracción del músculo liso.
Este tipo de reacción puede ser localizada o sistémica. Los síntomas varían de una
irritación leve a la muerte súbita por anafilaxia. El tratamiento generalmente
involucra el uso de epinefrina, antihistamínicos y corticosteroides.
• Hipersensibilidad tipo II.
Los anticuerpos IgG e IgM pueden provocar lesiones tisulares al activar el sistema
del complemento, reclutar células inflamatorias e interferir con las funciones
celulares normales. Algunos de estos anticuerpos son específicos frente a
antígenos de células particulares o de la matriz extracelular, y se encuentran unidos
a estas células o a los tejidos o en forma de anticuerpos libres en la circulación; las
enfermedades inducidas por tales anticuerpos se llaman trastornos por
hipersensibilidad del tipo II. En la hipersensibilidad tipo 2, los anticuerpos producidos
por el sistema inmunitario se unen a antígenos en la superficie misma de las células
del paciente. Los antígenos así reconocidos pueden ser de naturaleza intrínseca
(son parte innata de la célula del paciente) o extrínseca (absorbidas a la célula
durante la exposición a un antígeno extraño, posiblemente una infección por algún
patógeno). Estas células son reconocidas por macrófagos o células dendríticas que
actúan como células presentadoras de antígeno, lo que causa que los linfocitos B
respondan produciendo anticuerpos en contra del susodicho antígeno. Un ejemplo
es la reacción a la penicilina, en el que la droga se une a los eritrocitos causando
que éstas sean reconocidas como extrañas para el cuerpo. Ello hará proliferar los
linfocitos B junto con la secreción de anticuerpos en contra del medicamento. Los
anticuerpos de tipo IgG e IgM se unen a estos antígenos formando complejos que
activan la vía clásica del complemento iniciando una secuencia que terminará con
la eliminación de las células que presentan los antígenos extraños, causando lisis y
muerte celular. Ese es el proceso regular de eliminación de patógenos, volviéndose
peligroso para el hospedador si el proceso se activa en contra de sus propias
células. La reacción puede durar horas o días en completarse.
Otro tipo de hipersensibilidad de tipo 2 es la llamada citotoxicidad celular
dependiente de anticuerpos (CMCDA o CCDA). En este caso, las células que
exhiben los antígenos extraños son marcados con anticuerpos (IgG o IgM), los
cuales son luego reconocidos por células asesinas naturales y macrófagos
(reconocidos vía IgG unido a la superficie del receptor, CD16 y FcγRIII), los cuales
terminan liquidando a la célula así marcada.
Algunos ejemplos:
Anemia autoinmune hemolítica
Síndrome de Goodpasture
Eritroblastosis fetal
Pénfigo
Anemia perniciosa autoinmune
Trombocitopenia inmune
Reacciones de transfusión
Tiroiditis de Hashimoto
Enfermedad de Graves
Miastenia gravis
Fiebre reumática
Hipersensibilidad tipo III.
Otros anticuerpos pueden formar inmunocomplejos en la circulación y los complejos
depositarse después en los tejidos, particularmente en las paredes de los vasos
sanguíneos, y producir lesiones. Las enfermedades por inmunocomplejos también
se llaman trastornos por hipersensibilidad del tipo III. En la hipersensibilidad tipo 3,
se forman en la sangre complejos inmunes solubles, es decir, agregados de
anticuerpos IgG e IgM, que son depositados en varios tejidos (típicamente la piel,
los vasos sanguíneos, riñón y las articulaciones) donde disparan una respuesta
inmunitaria fundamentado en la vía clásica de la activación del complemento y
causan vasculitis, glomerulonefrítis y artritis. Hay dos etapas relacionadas al
desarrollo de complejos inmunes, primero el complejo se forma cuando los
anticuerpos IgG e IgM se unen al antígeno, luego de lo cual, los complejos se tornan
de mayor tamaño los que pueden ser eliminados del cuerpo. Es en la primera etapa
de esta formación que no es posible eliminar estos complejos antígeno: anticuerpo
del organismo, por lo que son esparcidos y depositados en los tejidos mencionados.
La reacción puede tardar desde varias horas hasta días para desarrollarse.
Algunos ejemplos:
Glomerulonefritis por complejos inmunes
Artritis reumatoide
Enfermedad del suero
Endocarditis bacteriana subaguda
Algunos de los síntomas del paludismo
Lupus eritematoso sistémico
Reacción de Arthus (Pulmón del granjero)
• Hipersensibilidad tipo IV.
La lesión tisular puede deberse a linfocitos T que inducen inflamación o matan
directamente a las células diana; tales trastornos se llaman trastornos por
hipersensibilidad del tipo IV. Se deben sobre todo a la activación de linfocitos T
cooperadores CD4+, que secretan atocinas que promueven la inflamación y activan
a los leucocitos, sobre todo los neutrófilos y los macrófagos. Los linfocitos T
cooperadores también estimulan la producción de anticuerpos que dañan los tejidos
e inducen inflamación. Los CTL pueden contribuir también a la lesión tisular en
algunas enfermedades.
La hipersensibilidad tipo 4 es frecuentemente llamada tardía, pues la reacción tarda
2 o 3 días en instaurarse. A diferencia de los otros tipos, no es mediada por
anticuerpos, sino por células inmunitarias.
Los linfocitos T CD8 y CD4 cooperadores reconocen los antígenos en un complejo
con el complejo mayor de histocompatibilidad tipo I y II. Las células presentadoras
de antígeno en este caso son los macrófagos que secretan IL-12, el cual estimula
la proliferación de más linfocitos T. Los CD4+ secretan también IL-2 e interferón
gamma, estimulando aún más la liberación de citocinas, de ese modo mediando la
respuesta inmunitaria. Las células CD8 destruyen las células diana al entrar en
contacto con ellas mientras que los macrófagos activados producen enzimas
hidrolíticas y, ante ciertos patógenos intracelulares, se transforman en células
gigantes multinucleadas.
Algunos ejemplos:
Arteritis temporal
Algunos síntomas de la lepra
Algunos síntomas de tuberculosis
Rechazo de trasplantes
Enfermedad celíaca. Dermatitis alérgica.
Hipersensibilidad tipo V.
Roitt incluyó un tipo de hipersensibilidad mediado por anticuerpos que no encajan
exactamente en ninguno al cual llamó hipersensibilidad estimuladora (o de tipo V).
Esta forma de hipersensibilidad se refiere a la sobre estimulación de la célula
secretora cuando esta interacciona con anticuerpos dirigidos contra componentes
de su superficie (enfermedad de graves o boci exoftalmico).
Se refiere a la excesiva o inadecuada respuesta inmunitaria frente a antígenos
ambientales, habitualmente no patógenos, que causan inflamación tisular y
malfuncionamiento orgánico. La hipersensibilidad estimuladora mediada por
anticuerpos antirreceptor, que en lugar de destruir la célula produce su estimulación.
En cada uno de los tipos de hipersensibilidad participan de forma secuencial
diferentes tipos de células y mediadores solubles.
Algunos Ac pueden actuar sobre receptores de las membranas celulares dando
lugar a un estímulo para que se produzca de forma incontrolada alguna sustancia
que la célula produce normalmente.
Esta esta mediada por anticuerpos dirigidos frente a receptores de hormonas que,
tras su unión a los receptores, induce el mismo efecto que las hormonas o inhiben
a recepción de los agonistas, provocando efectos nocivos como la inflamación.
Cuando la hormona estimulante de tiroides (TSH) se une a su receptor tiroideo de
las células epiteliales, la adenilciclasa es activada y el 2do mensajero cAMP
generado activa para estimular la producción de la hormona tiroidea. Una vez que
se producen concentraciones suficientes de las hormonas el circuito de
retroalimentación negativa interrumpe la producción de TSH. Los anticuerpos
tiroideos estimulantes presentes en pacientes con enfermedad de Graves están
dirigidos contra el receptor TSH y mimetizan el efecto de TSH, excepto que en este
caso la secreción continua de autoanticuerpos por los plasmocitos lleva a la
estimulación constante de la glándula tiroides que conduce al hipertiroidismo.
En pacientes con preeclampsia y con hipertensión se describieron autoanticuerpos
agonistas que estimulan el receptor AT1 para angiotensina II.
Desarrollo del sistema inmune.
El sistema inmune comienza a desarrollarse antes de que un niño nazca. Una
combinación de resistencia innata a ciertas enfermedades, de los anticuerpos
maternos adquiridos y de la exposición activa a gérmenes, ayuda a desarrollar el
sistema inmune del niño a medida que crece hasta llegar a ser adulto. Las vacunas
pueden protegerlo contra las enfermedades que pudieran perjudicar su desarrollo
en caso de contraerlas, al no ser lo suficientemente fuerte como para luchar por su
cuenta.
El sistema inmune varía de persona a persona, ya que algunas son más fuertes y
otras más débiles. Este sistema protege al cuerpo de enfermedades e infecciones,
encargándose de atacar a los gérmenes peligrosos que penetran en el cuerpo y
luchando contra ellos. A esto se denomina respuesta inmune y existen tres tipos de
respuestas: innata, adaptativa y pasiva.
Todos nacemos con una inmunidad innata o natural ante ciertas enfermedades. Por
ejemplo, podemos contagiarnos de ciertas enfermedades que padecen los
animales. Nuestra piel y membranas mucosas, como las que se encuentran en
nuestras narices, bocas e intestinos también forman parte de nuestro sistema
inmune natural, ya que son barreras que custodian al cuerpo contra infecciones.
La inmunidad activa o adaptativa se desarrolla a medida que crecemos. Entre más
edad tengamos, nos volvemos inmunes a una mayor cantidad de gérmenes al haber
estado expuestos a ellos. También podemos inmunizarnos contra las enfermedades
a través de vacunas con antígenos.
La inmunidad pasiva proviene de una fuente diferente; por ejemplo, un niño recibe
anticuerpos a través de la leche materna. La inmunidad pasiva no dura mucho.
Podemos recibir lo que se llama inoculación "pasiva" si ya hemos sido infectados
con una enfermedad en particular o expuestos a ella. Este tipo de inoculación nos
ayudará a combatir la enfermedad que ya tenemos, en vez de prevenirnos de
contagiarnos en primer lugar. Por lo general se hace con un suero que contiene
anticuerpos de personas (con frecuencia gamma globulina), o de animales inmunes.
El sistema inmune comienza a desarrollarse a partir de las células madre cuando el
embrión tiene alrededor de cinco semanas. Cuando un bebé nace, su sistema
inmune es estimulado por los nuevos gérmenes a los que se está expuesto y
comienza a producir anticuerpos aproximadamente seis días después de su
nacimiento. El recién nacido es temporalmente inmune a algunas enfermedades
gracias a que su madre le ha transmitido inmunidad pasiva mientras estuvo en el
útero. Si el niño toma leche materna, también recibe anticuerpos a través de esta.
Este tipo de inmunidad pasiva, llamada inmunidad materna, irá disminuyendo
lentamente alrededor de los seis u ocho meses. Su propio sistema inmune se irá
fortaleciendo y cuando tenga un año de edad, contará ya con una inmunidad a nivel
de adulto para algunas enfermedades. Sin embargo, el niño estará constantemente
expuesto a nuevos gérmenes. Si los gérmenes de un resfriado están en el ambiente,
el sistema inmune de un adulto puede haber aprendido cómo combatirlo, mientras
que el mismo resfriado podría tener a un bebé resoplando y estornudando al ser la
primera vez que se encuentra con este germen.
Vacunas.
Las vacunas funcionan introduciendo antígenos dentro del cuerpo del niño sin
enfermarlo. Los linfocitos B del cuerpo, que son las células de la médula ósea que
protegen el cuerpo contra las enfermedades, producen anticuerpos que se adhieren
a los antígenos e impiden que causen daño. Estos anticuerpos permanecen en el
cuerpo de manera que, si el niño entra en contacto de nuevo con esos antígenos en
particular, los anticuerpos están listos para desactivarlos.
Tradicionalmente, a un niño se le aplican una serie de vacunas a intervalos
regulares después de nacer, que incluyen hepatitis B, una combinación de
difteria/tétano/tosferina,
polio,
rotavirus
y
una
combinación
de
sarampión/paperas/rubéola. Estas inyecciones de inmunización ayudan a proteger
a un bebé o un niño de contraer enfermedades que pueden ser demasiado fuertes
para que un sistema inmune inmaduro pueda evitarlas, y que, si enferma, puedan
afectar negativamente su crecimiento y desarrollo. También protegen a la sociedad,
ya que entre más niños estén vacunados contra la enfermedad, menos
probabilidades hay de que la enfermedad entre a una comunidad y afecte a los niños
que no han sido vacunados.
Algunos padres eligen no vacunar a sus hijos debido a preocupaciones acerca del
conservante usado en las vacunas de sarampión/paperas/rubéola, que ha sido
anecdóticamente relacionado con el autismo. (Gracias a esto, tenemos de nuevo
casos de Sarampión en México.)
Inmunosupresión.
La inmunosupresión se define como la inhibición de uno o más componentes del
sistema inmunitario adaptativo o innato (la inflamación), que puede producirse como
resultado de una enfermedad subyacente o de forma intencional mediante el uso de
medicamentos (llamados inmunosupresores) u otros tratamientos, como radiación
o cirugía (ablación del bazo), con el propósito de prevenir o tratar el rechazo de un
trasplante o una enfermedad autoinmune.
Tratamiento.
Cuando una persona está bajo tratamiento inmunosupresor, o cuyo sistema inmune
está debilitado por otro motivo (por ejemplo, quimioterapia, radioterapia, sida o
Lupus), se dice que está inmunodeprimida.
Después de un trasplante de órganos, el cuerpo casi siempre rechazará el nuevo
órgano porque el envoltorio proteico de sus células difiere del órgano original. Como
consecuencia de esto, el sistema inmunitario detecta el nuevo tejido como "hostil",
e intenta eliminarlo atacándole con leucocitos, causando la muerte del tejido. Los
inmunosupresores se aplican para bloquear esta respuesta. El tratamiento
inmunosupresor más eficaz en el caso de trasplantes es la ciclosporina, que
funciona bloqueando la activación de los linfocitos T. La utilización de ciclosporina
como tratamiento abrió la vía a la medicina de trasplantes, permitiendo el desarrollo
de las técnicas de trasplante de corazón, hígado y pulmones. En la actualidad se
usan muchos otros medicamentos conjuntamente o en lugar de la ciclosporina.
Los tratamientos inmunosupresores tienen el problema de ser poco específicos:
inhiben no sólo la respuesta concreta que se desea bloquear, sino que producen
una reducción general de la respuesta inmune. Por esta razón, los pacientes
inmunodeprimidos devienen susceptibles a las infecciones, particularmente frente a
microbios intracelulares (que son las dianas de los linfocitos T) y presentan una
mayor incidencia de cáncer, sobre todo tumores causados por virus oncogénicos.
TOLERANCIA INMUNITARIA.
La tolerancia inmunitaria se define como una falta de respuesta a un antígeno
inducida por la exposición anterior a ese antígeno. El término procede de la
observación experimental de que los animales que se han encontrado con un
antígeno en condiciones particulares no responden, o toleran, exposiciones
posteriores al mismo antígeno. Cuando los linfocitos específicos se encuentran con
sus antígenos pueden activarse, lo que conduce a las respuestas inmunitarias, o
pueden inactivarse o eliminarse, lo que lleva a la tolerancia. Diferentes formas del
mismo antígeno pueden inducir una respuesta o tolerancia inmunitaria. Los
antígenos que inducen tolerancia se llaman tolerógenos o antígenos tolerogénicos,
para distinguirlos de los inmunógenos, que generan inmunidad. Un solo antígeno
puede ser un inmunógeno o un tolerógeno, dependiendo de las condiciones en las
que se muestre a los linfocitos específicos (p. ej., en presencia o no,
respectivamente, de inflamación y de respuestas inmunitarias innatas). La
tolerancia a los antígenos propios, también llamada tolerancia frente a lo propio, es
una propiedad fundamental del sistema inmunitario normal, y no tolerar lo propio da
lugar a reacciones inmunitarias contra antígenos propios (autógenos). Tales
reacciones se llaman autoinmunidad, y las enfermedades que causan se llaman
enfermedades autoinmunes. La importancia de la auto tolerancia para la salud de
los sujetos se supo desde los primeros días de la inmunología.
La tolerancia tiene varias características en las poblaciones de linfocitos T y B. Es
importante conocer los principios generales antes de exponer los mecanismos
específicos de la tolerancia en estos linfocitos.
• Los sujetos normales toleran sus propios antígenos porque los linfocitos que
reconocen los antígenos propios mueren o son inactivados o porque la especificidad
de estos linfocitos cambia. Todos los sujetos heredan prácticamente los mismos
segmentos génicos del receptor para el antígeno y se recombinan y expresan en
los linfocitos a medida que la célula surge de las células precursoras. Las
especificidades de los receptores codificados por los genes recombinados son
aleatorias y no están influidas por lo que es propio o extraño en ningún sujeto. No
es sorprendente que durante este proceso de generación de un repertorio grande y
diverso, algunos linfocitos T y B en desarrollo de cualquier individuo puedan
expresar receptores capaces de reconocer moléculas normales en ese individuo (es
decir, antígenos propios). Por tanto, existe un riesgo de que los linfocitos reaccionen
contra las células y tejidos de ese individuo y provoquen una enfermedad. Los
mecanismos de tolerancia inmunitaria pretenden impedir tales reacciones.
• La tolerancia se debe al reconocimiento de antígenos por linfocitos específicos. En
otras palabras, la tolerancia, por definición, es específica del antígeno. Esto
contrasta con la inmunosupresión terapéutica, que afecta a los linfocitos T de
muchas especificidades. Los avances clave que permitieron a los inmunólogos
estudiar la tolerancia fueron la inducción de este fenómeno en los animales
mediante la exposición a antígenos definidos bajo varias condiciones y el análisis
de las funciones de los linfocitos que se encuentran con los antígenos. Peter
Medawar et al. en los años cincuenta del siglo xx mostraron que los ratones recién
nacidos de una cepa expuestos a células de otras cepas no reaccionan a los injertos
cutáneos posteriores procedentes de la cepa donante. Estudios posteriores
demostraron que la tolerancia podía inducirse no solo frente a células extrañas sino
también a proteínas y otros antígenos.
• La tolerancia frente a lo propio puede inducirse en linfocitos autorreactivos
inmaduros en los órganos linfáticos generadores (tolerancia central) o en linfocitos
maduros en zonas periféricas (tolerancia periférica). La tolerancia central asegura
que el repertorio de linfocitos B maduros sea incapaz de responder a antígenos
propios expresados en los órganos linfáticos generadores (el timo para los linfocitos
T y la médula ósea para los linfocitos B, también llamados órganos linfáticos
centrales). No obstante, la tolerancia central no es perfecta, y algunos linfocitos
autorreactivos completas su maduración. Por tanto, son necesarios los mecanismos
de la tolerancia periférica para impedir la activación de estos linfocitos
potencialmente lesivos.
• La tolerancia central se produce durante una fase de la maduración de los linfocitos
en la que el encuentro con el antígeno puede llevar a la muerte celular o a la
sustitución del receptor para el antígeno autorreactivo por uno que no sea
autorreactivo. Los órganos linfáticos generadores contienen, sobre todo, antígenos
propios y no antígenos extraños, porque los antígenos extraños (p. ej., microbianos)
que entran desde el ambiente externo suelen capturarlos los órganos linfáticos
periféricos, como los ganglios linfáticos, el bazo y los tejidos linfáticos mucosos, y
no se concentran en el timo ni la médula ósea. Los antígenos que se presentan
normalmente en el timo y en la médula ósea abarcan antígenos propios ubicuos o
muy diseminados, incluidos los que transporta la sangre. Además, muchos
antígenos específicos de tejidos periféricos se expresan en células en el timo
mediante mecanismos que se describen más adelante. Por tanto, en los órganos
linfáticos generadores, los linfocitos inmaduros que reconocen específicamente
antígenos suelen ser células específicas frente a antígenos propios y no extraños.
Los destinos de los linfocitos inmaduros que reconocen antígenos propios con
elevada afinidad se describirán más tarde.
• La tolerancia periférica se induce cuando los linfocitos maduros reconocen
antígenos propios y mueren por apoptosis, o se hacen incapaces de activarse tras
exponerse a ese antígeno. La tolerancia periférica es importante para mantener la
falta de respuesta a los antígenos propios que se expresan en los tejidos periféricos
y no en los órganos linfáticos generadores, y para la tolerancia a los antígenos
propios que se expresan solo en la vida adulta, después de que se hayan generado
los linfocitos maduros específicos para esos antígenos. Como ya se ha mencionado,
los mecanismos periféricos también pueden servir de apoyo a los mecanismos
centrales, que no eliminan todos los linfocitos autorreactivos.
• La tolerancia periférica también la mantienen linfocitos T reguladores (Treg) que
suprimen activamente a los linfocitos específicos frente a antígenos propios. La
supresión por los Treg se produce en los órganos linfáticos secundarios y en los
tejidos extralinfáticos.
• Algunos antígenos propios son secuestrados por el sistema inmunitario y otros
pueden ser ignorados. Los antígenos pueden estar separados del sistema
inmunitario por barreras anatómicas, como en los testículos y en los ojos, y así no
pueden unirse a los receptores para el antígeno. En modelos experimentales,
algunos antígenos propios están disponibles para ser reconocidos por los linfocitos,
pero, por razones desconocidas, no desencadenan ninguna respuesta y son
ignorados. No se ha establecido la importancia de este fenómeno de ignorancia en
el mantenimiento de la autotolerancia.
• Los antígenos extraños sin señales coestimuladoras pueden inhibir las respuestas
inmunitarias al inducir tolerancia en linfocitos específicos. Muchos de los
mecanismos de tolerancia a los antígenos extraños son similares a los de la
tolerancia frente a lo propio en los linfocitos maduros (tolerancia periférica). Algunos
microbios y tumores también pueden evadirse del ataque inmunitario induciendo la
falta de respuesta en los linfocitos específicos.
• La inducción de tolerancia inmunitaria se ha explotado como un método
terapéutico para evitar respuestas inmunitarias lesivas. Se está dedicando un gran
esfuerzo al desarrollo de estrategias para inducir tolerancia con el fin de tratar
enfermedades autoinmunes y alérgicas y evitar el rechazo de órganos
trasplantados. La inducción de tolerancia también puede ser útil para evitar
reacciones inmunitarias a los productos de genes recién expresados en los
protocolos de genoterapia, para evitar reacciones a proteínas inyectadas en
pacientes con deficiencias de estas proteínas (p. ej., hemofílicos tratados con factor
VHI) y para promover la aceptación de trasplantes de células troncales. Los
métodos experimentales, especialmente la creación de ratones con modificaciones
génicas, han ofrecido métodos valiosos para analizar la tolerancia frente a lo propio
y muchas de nuestras ideas actuales se basan en los estudios de tales modelos.
Además, al identificar genes que puedan asociarse a la autoinmunidad en ratones
y seres humanos, ha sido posible deducir algunos de los mecanismos
fundamentales de la tolerancia frente a lo propio. No obstante, desconocemos qué
antígenos propios inducen las tolerancias central
o periférica (o son ignorados). Y lo que es más importante, tampoco se sabe qué
mecanismos de tolerancia podrían fracasar en las enfermedades autoinmunes
humanas frecuentes, y esto sigue siendo un desafío importante para entender la
autoinmunidad. En los apartados que siguen expondremos las tolerancias central y
periférica, en primer lugar, en los linfocitos T y después en los linfocitos B, pero
muchos aspectos de los procesos son comunes a las dos líneas.
Inmunodeficiencia.
La inmunodeficiencia es un estado patológico en el que el sistema inmunitario no
cumple con el papel de protección que le corresponde dejando al organismo
vulnerable a la infección. Las inmunodeficiencias causan a las personas afectadas
una gran susceptibilidad a padecer infecciones y una mayor prevalencia de cáncer.
Las personas con inmunodeficiencia normalmente se tratan con la inmunidad pasiva
para superar infecciones.
Tipos.
Las inmunodeficiencias pueden ser primarias (o congénitas) y secundarias (o
adquiridas).
Primarias o congénitas.
Las primarias se manifiestan, salvo algunas excepciones, desde la infancia, y se
deben a defectos congénitos que impiden el correcto funcionamiento del sistema
inmunitario.
Por ejemplo, en la agammaglobulinemia en el síndrome de Di George.
Secundarias o adquiridas.
Las secundarias, en cambio, son el resultado de la acción de factores externos,
como desnutrición, cáncer o diversos tipos de infecciones. Un ejemplo de
inmunodeficiencia adquirida por una infección viral es el SIDA. También se debe a
una carga hormonosupresora que se adhiere a las moléculas del ADN produciendo
una sobre carga pulmonar en el riñón.
Causas.
La inmunodeficiencia (debilidad del sistema inmunitario) puede tener gran variedad
de causantes, incluidas las enfermedades de la médula ósea, problemas de riñón y
el virus de inmunodeficiencia humana (VIH o sida).
Clasificación.
La clasificación de las inmunodeficiencias propuesta por la OMS en 1978 las
clasifica según el efector de la respuesta inmunitaria afectado:
Carencia de los linfocitos B.
Carencia de los linfocitos T.
Carencia combinada de linfocitos B y T.
Disfunciones de los fagocitos.
Carencia en el sistema del complemento.
Inmunología clásica.
La inmunología clásica está incluida dentro de los campos de la epidemiología.
Estudia la relación entre los sistemas corporales, patógenos e inmunidad. El escrito
más antiguo que menciona la inmunidad se considera el referente a la plaga de
Atenas en el 430 a. C. Tucídides notó que la gente que se había recobrado de un
ataque previo de la enfermedad podía cuidar a los enfermos sin contraer la
enfermedad por segunda vez. Muchas otras sociedades antiguas tienen referencias
de este fenómeno, pero no fue hasta los siglos XIX y XX donde el concepto fue
llevado a la teoría científica.
El estudio de los componentes celulares y moleculares que comprende el sistema
inmunitario, incluyendo sus funciones e interacciones, es el tema central de la
inmunología. El sistema inmunitario ha sido dividido en un más primitivo sistema
inmunitario innato, y un sistema inmunitario adaptativo o adquirido de los
vertebrados; este último a su vez está dividido en sus componentes humorales y
celulares.
La respuesta humoral (anticuerpos) es definida como la interacción entre los
anticuerpos y los antígenos. Los anticuerpos son proteínas específicas liberadas de
cierta clase de células inmunitarias (linfocitos B). Los antígenos son definidos como
elementos que promueven la generación de anticuerpos. La inmunología trata de
comprender las propiedades de estas dos entidades biológicas. Sin embargo,
igualmente importante es la respuesta celular, que puede no solamente matar a las
células infectadas, sino que también es crucial en el control de la respuesta de los
anticuerpos. Se observa entonces que ambos sistemas son altamente
interdependientes.
En el siglo XXI, la inmunología ha ampliado sus horizontes con las investigaciones
desarrolladas en los nichos más especializados de la inmunología. Esto incluye la
función inmunitaria de las células, órganos y sistemas normalmente no asociados
con el sistema inmunitario, así como la función del sistema inmunitario fuera de los
modelos clásicos de inmunidad.
Inmunología clínica.
La inmunología clínica es el estudio de las enfermedades causadas por los
trastornos del sistema inmunitario (fallo, acción anormal y crecimiento maligno de
los elementos celulares del sistema). También involucra enfermedades de otros
sistemas, donde las reacciones inmunitarias juegan un papel en los rasgos clínicos
y patológicos.
Las enfermedades causadas por los trastornos del sistema inmunitario se dividen
en dos amplias categorías:
Inmunodeficiencia, en la cual partes del sistema inmunitario fallan en proveer una
respuesta adecuada (p. ej. en el sida).
Autoinmunidad, en la cual el sistema inmunitario ataca las células del propio
organismo (p. ej. lupus eritematoso sistémico, artritis reumatoide, (Púrpura
Trombocitopénica Idiopática de origen autoinmune), enfermedad de Hashimoto y
miastenia gravis).
Otros desórdenes del sistema inmunitario incluyen diferentes grados de
hipersensibilidad, en los que el sistema responde inapropiadamente a componentes
inofensivos (asma y otras alergias) o responde con excesiva intensidad.
La enfermedad más conocida que afecta al sistema inmunitario es el sida, causado
por el VIH. El sida es una inmunodeficiencia caracterizada por la pérdida de células
T CD4+ ("helper") y macrófagos, que son destruidos por el VIH.
Los inmunólogos clínicos también estudian las formas de prevenir el rechazo a
trasplantes, en el cual el sistema inmunitario destruye los alógenos o exógenos.
Inmunoterapia.
El uso de los componentes del sistema inmunitario en el tratamiento a una
enfermedad o trastornos conocido como inmunoterapia. La inmunoterapia se usa
en el contexto del tratamiento de los cánceres junto con la quimioterapia (drogas) y
la radioterapia (radiación). Sin embargo, la inmunoterapia se usa frecuentemente
en los pacientes inmunosuprimidos (como los enfermos de sida) y las personas que
sufren otras deficiencias inmunitarias y enfermedades autoinmunitarias.
Inmunología diagnóstica[editar]
INMUNOLOGÍA DIÁGNOSTICA.
La especificidad del enlace entre antígeno y anticuerpo ha creado una herramienta
excelente en la detección de las sustancias en una variedad de técnicas
diagnósticas. Los anticuerpos específicos para determinado antígeno pueden ser
conjugados con un radio-marcador, marcador fluorescente, o una enzima
reveladora (por escala de color) y son usados como pruebas para detectarlo.
De una manera un poco simplista, podemos hablar de subdivisiones de la
inmunología, como inmunidad, serología, inmunoquímica e inmunobiología.
Durante los primeros años de esta ciencia, inmunología e inmunidad eran
prácticamente sinónimos y se enfocaba en forma casi exclusiva a la prevención de
las enfermedades infecciosas mediante vacunación, y aunque actualmente se
destina gran parte de los esfuerzos de investigación a la mejora de vacunas y de
las técnicas de inmunización, las diferencias entre ambas son tangibles. La
serología como tal se convirtió en un elemento con fines meramente diagnósticos,
actualmente no sólo se busca descubrir nuevas pruebas en serología especificas
para cada enfermedad, sino también mejorar y sobre todo, automatizar las técnicas
existentes. Por otro lado, la inmunoquímica y la inmunobiología se han dedicado al
estudio del conocimiento de la estructura de los antígenos, inmunoglobulinas, la
química del complemento y otros componentes del sistema inmune, así como al
estudio de las bases biológicas, genéticas y moleculares de la respuesta inmune.
Dado que las líneas divisorias entre estas áreas de la inmunología son poco claras,
un laboratorio de inmunología diagnóstica moderno, deberá involucrar técnicas que
permitan evaluar la respuesta inmune. Actualmente podemos clasificar las técnicas
diagnósticas en: a) cuantificación y detección de anticuerpos o antígenos
específicos mediante interacciones antígeno-anticuerpo, b) detección, enumeración
y fraccionamiento de celulas inmunocompetentes, c) ensayos de inmunidad celular,
d) evaluación de los componentes del complemento y su función y e) inmunología
de transplantes.
La cuantificación y detección de anticuerpos o antígenos específicos mediante
interacciones antígeno-anticuerpo, es definitivamente el área más importante dentro
de un laboratorio de inmunología, ya que la mayoría de los análisis son IgG e IgM
específicos contra agentes infecciosos, determinación de inmunoglobulinas totales
(IgA, IgG e IgM) y las subclases de IgG, determinación de autoanticuerpos, e IgE
alergenos específicos, determinación de marcadores de infección como la Proteína
C Reactiva, marcadores tumorales y la cuantificación de linfoquinas.
La detección, enumeración y fraccionamiento de celulas inmunocompetentes
prácticamente se realizan en forma exclusiva mediente citometría de flujo, lo que
hace imprescindible una relación estrecha entre el laboratorio de inmunología y el
laboratorio de citometría de flujo.
La evaluación de la respuesta celular en un paciente involucra desde pruebas muy
sencillas y prácticamente rutinarias como son las intradermoreacciones, hasta
pruebas sumamente específicas como la evaluación de la función fagocítica y de la
capacidad microbicida de los fagocitos (NBT) así, como pruebas de estimulación
linfocítica a mitógenos y a antígenos específicos. Evaluar los componentes del
complemento y su función, pretende determinar la concentración de los
componentes individuales del complemento (C3, C4, C1q, inhibidor de Cl), y
determinar su capacidad funcional. (CH50 o CHl00).
La inmunología de transplantes ha tomado mucha importancia en los últimos años
dentro de los laboratorios de inmunología, la determinación de los antígenos de
HLA, tanto clase I como clase II, así como las pruebas cruzadas son casi
imprescindibles tanto en los transplantes de órganos sólidos como en los de medula
ósea Lo ideal sería poder identificar los antígenos de HLA por técnicas moleculares
aplicando Ia tecnología de la reacción en cadena de Ia polimerasa (PCR), pero si
no es posible, se deberá aplicarse al menos en los transplantes de médula ósea, Ia
determinación de HLA clase I por técnicas serológicas de micro-citotoxicidad y Ia
determinación de HLA clase H por PCR. En aquellos transplantes de órganos
sólidos, en los cuales Ia compatibilidad de HLA entre receptor y donador no sea tan
relevante, se recomienda realizar las pruebas cruzadas, y el conocimiento del HLA
(clase I y II) le ayudaría al médico a estimar el grado de rechazo y la sobrevida del
órgano transplantado.
Las técnicas utilizadas en el laboratorio de inmunología diagnóstica varían a gran
velocidad, cada día son más las técnicas moleculares y genéticas que están a
disposición y es por ello, que el personal profesional y técnico debe estar
actualizado constantemente; sin embargo, la incorporación de algunas de estas
novedosas técnicas resulta costoso, no sólo desde el punto de vista de adquisición
de los reactivos, sino también en cuanto a infraestructura necesaria; pero hay que
reconocer que nuestro país cuenta con el equipo humano capaz de trabajar
cualquiera de estas técnicas modernas. Las autoridades en Salud deben impulsar
el uso rutinario de estas técnicas no solamente con fines diagnósticos, sino también
promoviendo la investigación para el desarrollo de las diferentes áreas de la
inmunología diagnóstica
Conceptos/técnicas: fluctuación, aglutinación, precipitación, neutralización y
dermorreacción.
Fluctuación.
La palabra fluctuación proviene de raíces latinas, de la voz “fluctuatĭo”. El diccionario
de la real academia española describe el término como la acción y el efecto de
fluctuar; y fluctuar puede definirse como la experimentación de una variación de una
medida o valor. Fluctuación es una entrada que puede encontrarse en diferentes
ámbitos y contextos, pero que alude al incremento y reducción de algo en particular
y de manera alternada, es decir es la variación, alteración o transformación en el
valor, cualidad o intensidad de algo. En el ámbito empresarial fluctuación es cuando
ocurren oscilaciones a la baja y al alza que pueden sufrir las cotizaciones de los
valores objeto de negociación en ciertos mercados financieros; generalmente son
variaciones que sufren debido a una variable o magnitud entre el valor en cierto
momento y su valor medio.
Aglutinación.
Se denomina aglutinación a la interacción secundaria in vitro de un antígeno
“particulado” con su anticuerpo específico. Si el antígeno (proteína, hidrato de
carbono, etc.) se encuentra presente en la superficie de células, bacterias u otras
partículas naturales el fenómeno se denomina aglutinación directa. Cuando el
antígeno con el que interacciona el anticuerpo específico no forma parte de la
estructura nativa de la partícula, sino que se incluye artificialmente en su superficie,
la aglutinación que tiene lugar se denomina genéricamente aglutinación pasiva o
indirecta. Las partículas utilizadas como soportes pueden ser inertes (partículas de
látex) o bien glóbulos rojos, en cuyo caso el método recibe el nombre de
hemoaglutinación pasiva o indirecta.
Precipitación.
En este caso el antígeno es una molécula soluble y al ponerse una solución del
mismo, en contacto con los anticuerpos que originó, se forman complejos Ag-Ac
que, al insolubilizarse en su mayor parte, dan una reacción de precipitación.
Esto se da en 2 etapas, la primera se desarrolla rápidamente formándose los
complejos Ag-Ac, esta etapa es influenciada muy poco por la temperatura, la
concentración de electrólitos y la agitación.
En la 2º etapa los complejos se agregan formando micelas o redes que al alcanzar
determinado tamaño precipitan. Esta etapa se acelera con el aumento de la Tº (se
la lleva a cabo normalmente a 37ºC) y es además dependiente de la concentración
de electrolito (se usa generalmente ClNa 0,15M). Es mucho más lenta que la
anterior.
La formación de estas redes está dada por la bivalencia del Ac. y la polivalencia del
Ag., esta polivalencia se debe, como ya mencionamos, a la presencia de distintos
determinantes antigénicos.
Los sueros inmunes obtenidos de animales inoculados con este tipo de Ag. poseen
una mezcla de Ac. cada uno de los cuales interacciona con un epitópe distinto
(antisuero policlonal). Con Ac. monoclonales en general no se produce
precipitación, esto es porque en la mayoría de los casos están dirigidos contra un
único epitope de manera que para el caso el Ag. será monovalente, y solo se
evidencia el fenómeno cuando se trata de Ag. con epitopes muy repetidos.
Con haptenos monovalentes o Ag. que posean un solo determinante antigénico, o
cuando los Ac. son funcionalmente monovalentes como es el caso de los
anticuerpos asimétricos tampoco se formará precipitado.
Como se dijo anteriormente, la aparición de precipitado se produce cuando las redes
de complejos Ag. Ac. alcanzan un determinado tamaño.
Neutralización.
Mediante anticuerpos específicos se pueden neutralizar toxinas, virus o enzimas,
Los anticuerpos neutralizantes requieren un solo tipo de combinación con el
antígeno para poder actuar y así pueden ser univalentes, aunque anticuerpos
bivalentes o multivalentes pueden neutralizar también. Un antisuero que contiene
anticuerpos neutralizantes contra una toxina se denomina "antitoxina".
Dermorracción.
Pruebas cutáneas.
• Prick test (test por punción), de lectura inmediata y con diferencia la más usada,
reproduce reacciones alérgicas por hipersensibilidad tipo I.
• Intradermorreacción, usada en dos variantes, una de lectura rápida para el estudio
de reacciones de tipo I y III (por ejemplo, neumonitis por hipersensibilidad) y otra de
lectura retardada para el estudio de reacciones de tipo IV (respuesta celular tardía)
característica frente a patógenos intracelulares (micobacterias, hongos y parásitos).
• Patch test (test de parche), también llamadas pruebas epicutáneas, son de lectura
retardada (48-72 horas) y se aplican en el diagnóstico del eccema de contacto.
Complemento.
Además de las reacciones antígeno-anticuerpo ya descritas, existen otros tipos de
reacciones de gran importancia en inmunidad donde participa el Complemento.
El complemento actúa junto con los anticuerpos específicos para llevar a cabo
varios tipos de reacciones antígeno-anticuerpo que de otra manera no podrían
ocurrir, tales como: lisis de células bacterianas, muerte de células bacterianas,
hemólisis, etc.
El complemento no es un anticuerpo (por lo tanto, no aumenta con la inmunización),
sino una serie de enzimas que se encuentran en el suero normal y que atacan a las
células bacterianas u otros agentes extraños. Estas enzimas, que se encuentran
aún en individuos no inmunizados, son normalmente inactivas, pero se activan
cuando ocurre una reacción antígeno-anticuerpo.Una de las principales funciones
del anticuerpo es reconocer las células invasoras
y activar el sistema del
complemento para que actúe. Ciertos componentes del complemento son muy
termolábiles, se destruyen por calentamiento a 56°C por 30 minutos, por otra parte,
los anticuerpos son termoestables.
Acciones del complemento.
Entre las principales acciones del complemento tenemos:
Lisis de los glóbulos rojos (hemólisis)
Si un antisuero contra glóbulos rojos se mezcla con una suspensión de glóbulos
rojos y se le añade suero normal como fuente de complemento ocurre la lisis a los
30 minutos de incubación a 37°C. La hemólisis se usa a menudo como prueba de
la presencia de complemento en sueros desconocidos o para medir la fijación de
complemento.
Lisis bacteriana
Especialmente de bacterias Gram negativas, cuando los anticuerpos específicos se
combinan con el antígeno de la superficie bacteriana en presencia de complemento.
Muerte microbiana
En ausencia de lisis ocurre la muerte microbiana cuando los anticuerpos específicos
se combinan con los antígenos de la superficie bacteriana en presencia de
complemento.
Promoción de la acción fagocitaria:
Cuando se combinan bacterias capsuladas con el anticuerpo específico en
presencia de complemento se promueve la acción fagocitaria. Este proceso en el
cual los anticuerpos específicos más complemento hacen una célula susceptible a
la fagocitosis se llama opsonización.
Prueba de fijación de Complemento.
Una propiedad importante del sistema del complemento es que sus componentes
son enzimáticamente alterados durante la reacción, de modo que no reaccionarán
en una nueva secuencia de reacciones, es decir si el complemento es consumido
durante las reacciones antígeno-anticuerpo esto es llamado fijación de
complemento y ocurre cuando un anticuerpo de tipo IgG o IgM reacciona con el
antígeno en presencia de complemento, aun cuando éste no sea requerido en la
reacción.
La prueba de fijación de complemento se lleva a cabo en dos fases. En la fase
primera se mezclan el suero del paciente (previamente calentado a 56°C) y el
antígeno en presencia de una cantidad determinada de complemento; esta mezcla
es generalmente incubada durante 30 minutos a 37°C. Si se forman los complejos
antígeno-anticuerpo, el complemento es fijado. En la segunda fase se añade el
sistema indicador que consiste en glóbulos rojos de carnero y anticuerpos contra
glóbulos rojos de carnero. La ocurrencia de hemólisis indica que el complemento no
fue utilizado, por lo tanto, en la fase 1 no se ha producido una reacción Ag-Ac
específica. En cambio, la ausencia de hemólisis, indica que el complemento ha sido
fijado y por lo tanto que en la fase 1 se ha producido una reacción Ag-Ac, en este
caso se considera una reacción de fijación del complemento positiva, mientras que
en el primer caso se considera negativa la reacción de fijación de complemento.
Utilizando un antígeno conocido, esta técnica puede ser empleada para detectar y
medir anticuerpos presentes en sueros. Al ocurrir la reacción del antígeno con los
anticuerpos del suero, ésta reacción Ag-Ac se puede poner de manifiesto mediante
una prueba de fijación de complemento.
DETERMINACIÓN DE GRUPO SANGUÍNEO.
La determinación del grupo sanguíneo es un método para indicar cuál es el tipo de
sangre que el individuo en cuestión posee. La determinación del grupo sanguíneo
se realiza para que el individuo pueda donar sangre o recibir una transfusión de
sangre de manera segura. También se realiza para ver si el individuo posee una
sustancia llamada factor Rh en la superficie de sus glóbulos rojos.
El tipo de sangre que se tenga depende de si hay o no ciertas proteínas, llamadas
antígenos, en los glóbulos rojos. Estas proteínas se llaman antígenos. El tipo de
sangre (o grupo sanguíneo) depende de qué tipos de sangre se heredó de los
padres.
Factor Rh.
El factor Rh es una proteína integral de la membrana de los glóbulos rojos. Los Rh
positivos son aquellas personas que presentan dicha proteína en sus eritrocitos y
Rh negativa quienes no presenten la proteína. Un 85 % de la población tiene en esa
proteína una estructura dominante, que corresponde a una determinada secuencia
de aminoácidos que en lenguaje común son denominados habitualmente Rh+.
Alrededor de la sexta semana de gestación, el antígeno Rh comienza a ser
expresado en los glóbulos rojos humanos.
Tener Rh– significa que se tiene la misma proteína pero con modificaciones en
ciertos aminoácidos que determinan diferencias significativas en la superficie de los
glóbulos rojos, y hacen a los humanos Rh– disponer de anticuerpos (aglutininas) en
el plasma que reaccionan contra los glóbulos rojos Rh+.1
El principal antígeno Rh es el D y el anticuerpo presente en quienes carecen de
antígeno D es el anti-D. Si el antígeno D está presente el fenotipo es Rh positivo y
si D está ausente (situación representada como "d") es Rh negativo. Se han
identificado más de 45 antígenos del sistema Rh, pero de todos ellos apenas cinco
son frecuentes, estos son: D, C, E, c, e. Los anticuerpos a los distintos antígenos
Rh aparecen después de exponerse un individuo Rh negativo a eritrocitos de sangre
Rh positivo. La herencia de los antígenos Rh es determinada por un complejo de
dos genes, de los cuales uno codifica la proteína transportadora de antígeno D y
otro codifica la proteína transportadora de antígeno «C» o «c», o de «E» y «e». Las
personas Rh positivas poseen genes RHD, que codifica la proteína transportadora
de antígeno D y RHCE, que codifica la especificidad de la proteína transportadora
de C y E. Mientras las Rh negativas tienen únicamente el gen RHCE.
Mutaciones en el gen RHCE dan lugar al síndrome del Rh nulo y cursa con anemia
hemolítica. Variantes no codificantes (intrónicas) del mismo gen se han asociado a
la velocidad de sedimentación globular (VSG) en un estudio realizado E la población
de Cerdeña, donde los valores de la VSG eran mayores en los individuos que
presentaban Rh positivo.2 Los autores sugieren un posible efecto causal del
polimorfismo, a pesar de no estar localizado en una región del gen codificante para
proteína.3
El 45 % de los individuos Rh positivos es homocigoto al factor D, y el 55 % restante
es heterocigoto por haber heredado un factor D positivo y otro negativo de sus
progenitores.
La transfusión de sangre de un Rh+ a un Rh– que no tiene dicho aglutinógeno
induce la formación de anticuerpos, que en sucesivas donaciones puede aglutinar
la sangre (formar coágulos).4 De ahí que en las donaciones de sangre y órganos
se tenga en cuenta dicho factor. El factor Rh (Rhesus) fue descubierto por Karl
Landsteiner y Wiener en 1940.
La sangre a menudo se clasifica de acuerdo con el sistema de tipificación ABO. Los
cuatro tipos de sangre principales son:
Tipo A
Tipo B
Tipo AB
Tipo O.
Nombres alternativos
Pruebas cruzadas; Determinación del Rh; Determinación del grupo sanguíneo ABO
(hemoclasificación); Grupo sanguíneo; Anemia - tipo de sangre hemolítica
inmunitaria; tipo de sangre ABO; Tipo de sangre A; Tipo de sangre AB; Tipo de
sangre O.
Forma en que se realiza el examen.
Se necesita una muestra de sangre. El examen para determinar el grupo sanguíneo
se denomina tipificación ABO. La sangre se mezcla con anticuerpos contra sangre
tipo A y tipo B. Entonces, la muestra se revisa para ver si los glóbulos sanguíneos
se aglutinan. Si los glóbulos se aglutinan, eso significa que la sangre reaccionó con
uno de los anticuerpos.
El segundo paso se llama prueba inversa. La parte líquida de la sangre sin células
(suero) se mezcla con sangre que se sabe que pertenece al tipo A o al tipo B. Las
personas con sangre tipo A tienen anticuerpos anti-B. Las personas que tienen
sangre tipo B tienen anticuerpos anti-A. El tipo de sangre O contiene ambos tipos
de anticuerpos.
Estos dos pasos pueden determinar con precisión el tipo de sangre.
La determinación del Rh usa un método similar a la determinación del grupo
sanguíneo. Cuando se realiza la determinación del tipo de sangre para ver si la
persona posee el factor Rh en la superficie de sus glóbulos rojos, los resultados
serán uno de estos:
Rh+ (positivo), si tiene esta sustancia
Rh- (negativo), si no tiene esta sustancia.
Razones por las que se realiza el grupo sanguíneo.
Este examen se hace para determinar el tipo de sangre de una persona. Los
médicos necesitarán conocer su tipo de sangre cuando le vayan a hacer una
transfusión de sangre o un trasplante, debido a que no todos los tipos de sangre
son compatibles entre sí.
Por ejemplo:
Si usted tiene sangre tipo A, únicamente puede recibir sangre tipo A y tipo O.
Si usted tiene sangre tipo B, únicamente puede recibir sangre tipo B y tipo O.
Si usted tiene sangre tipo AB, puede recibir sangre tipo A, B, AB y O.
Si usted tiene sangre tipo O, únicamente puede recibir sangre tipo O.
La sangre tipo O se le puede dar a alguien con cualquier tipo de sangre, razón por
la cual las personas con este tipo de personas son llamadas donantes de sangre
universales.
La determinación del grupo sanguíneo es especialmente importante durante el
embarazo. Si se detecta que la madre tiene sangre Rh negativa, entonces el padre
también debe ser evaluado. Si el padre tiene sangre Rh positiva, entonces la madre
necesita recibir un tratamiento para ayudar a prevenir el desarrollo de sustancias
que le pueden hacer daño al feto. Ver: incompatibilidad Rh
Si usted es Rh+, puede recibir sangre Rh+ o Rh-, pero si es Rh-, únicamente puede
recibir sangre Rh-.
Si la sangre se aglutina únicamente cuando se agregan células B a la muestra,
usted tiene sangre tipo A.
Si la sangre se aglutina únicamente cuando se agregan células A a la muestra,
usted tiene sangre tipo B.
Si la sangre se aglutina cuando se agregan cualquiera de los tipos de células a la
muestra, usted tiene sangre tipo O.
La falta de aglutinación de los glóbulos sanguíneos cuando la muestra se mezcla
con ambos tipos de sangre indica que usted tiene sangre tipo AB.
Tipificación del Rh:
Si los glóbulos sanguíneos se pegan o aglutinan al mezclarlos con suero anti-Rh,
usted tiene sangre de tipo Rh positivo.
Si la sangre no coagula al mezclarse con suero anti-Rh, usted tiene sangre de tipo
Rh negativo.
Existen muchos antígenos además de los mayores (A, B y Rh). Muchos antígenos
menores no se detectan rutinariamente durante la determinación del grupo
sanguíneo. Si no se detectan, usted puede aún experimentar una reacción al recibir
ciertos tipos de sangre, incluso si los antígenos A, B y Rh son compatibles.
Un proceso llamado pruebas cruzadas, seguido de una prueba de Coombs, puede
ayudar a detectar estos antígenos menores y se realiza de manera rutinaria antes
de las transfusiones, excepto en situaciones de emergencia.
Artículo de interés.
Una prueba para averiguar el grupo sanguíneo en 30 segundos.
Joana Oliveira. El País.
Madrid 15 MAR 2017 - 19:00 CET
Un simple análisis de sangre puede salvar vidas y en zonas de guerra, todavía más.
Médicos Sin Fronteras denunció en 2013 que personas que sobrevivían a
bombardeos en Siria morían en los hospitales después de recibir una transfusión,
porque los centros de salud locales no tienen los materiales necesarios para
analizar y determinar el grupo sanguíneo de los pacientes. Para solventar
problemas como ese, un grupo de científicos chinos acaba de crear un análisis de
sangre basado en papel que puede llevarse a cabo, sin la necesidad de equipo
especializado, en zonas de conflicto, áreas remotas con pocos recursos o en
situaciones de emergencia.
La prueba, desarrollada por el biólogo Hong Zhang y su equipo, consiste en dos
pasos: primero, los investigadores aplicaron una pequeña muestra de sangre en
una tira de papel con extremidades A y B que contenía anticuerpos que reconocen
diferentes marcadores de tipos sanguíneos (antígenos); después, aplicaron
bromocresol (una solución de color verde). Los resultados aparecieron como
cambios de color en las extremidades de la tira —verde si un antígeno de
determinado grupo sanguíneo estaba presente en la muestra y marrón si no—.
Después de analizar 3.500 muestras, la prueba demostró un 99,9% de precisión,
según los resultados publicados este miércoles en la revista Science Translational
Medicine, y las únicas inconsistencias ocurrieron en ensayos con tipos sanguíneos
muy poco frecuentes. Esa tecnología clasificó las muestras en los sistemas
comunes ABO y Rh (los dos más importantes) en menos de 30 segundos y fue
capaz de identificar múltiples tipos de sangre rara en menos de dos minutos. “Los
enfoques tradicionales para el agrupamiento de la sangre no permiten realizar las
dos pruebas a la vez sin el uso de una centrifugadora. Nuestro diseño es novedoso
porque elimina ese paso”, explica Zhang.
Los investigadores también incorporaron una membrana de separación para aislar
el plasma de la sangre entera, lo que les permitió identificar simultáneamente
antígenos específicos de células sanguíneas y detectar anticuerpos en el plasma,
basándose en la forma en que las células se agruparon. “Ese enfoque y el tiempo
de respuesta rápida proporcionan una estrategia más rentable para los análisis de
agrupamiento de la sangre”, escriben los científicos.
Diagnósticos en un trozo de papel
Esta no es la primera vez que se utiliza papel para llevar a cabo análisis biológicos.
En 2014, un equipo de la Universidad de Harvard creó un sistema para diagnosticar
el ébola que implica imprimir cadenas de ADN sobre papel, y secar las muestras
mediante frío extremo, utilizando un marcador genético que solo se activa ante la
presencia de moléculas específicas asociadas a un virus concreto. La prueba
reacciona en media hora, cambiando de color si detecta algún virus conocido.
Fabricar un sensor de papel de este tipo lleva unas 12 horas y cuesta cerca de 21
dólares (20 euros, aproximadamente).
Un año antes, Scott Phillips, jefe del departamento de Química de la Universidad de
Pensilvania, presentó un aparato de papel del tamaño de una lámina de chicle capaz
de medir el nivel de determinadas proteínas en la sangre y de detectar enzimas
relacionadas con problemas en los huesos y en el hígado. En 2016, investigadores
de la Universidad de Ohio desarrollaron un sistema para diagnosticar la malaria, el
cáncer y otras enfermedades en una tira de papel, que cuesta 50 céntimos y detecta
los anticuerpos presentes en una gota de sangre.
Bibliografía, Referencias y Cibergrafía.
Abul K. Abbas, Andrew H. Lichtman, Shiv Pillai. “Cellular and Mollecular
Inmunology.” “Inmunología celular y molecular.” Elsevier. 2015. España.
Peter J. Delves, Seamus J. Martin, Dennis R. Burton, Ivan M. Raitt. “ROITT'S
ESSENTIAL
IMMUNOLOGY”
“Roitt
Inmunología:
Fundamentos.”
Panamericana. 2014. México.
Enrique Lañez Pareja. 1999. “Curso de Inmunología general.” España:
Departamento de Microbiología. Universidad de Granada.
https://www.ugr.es/~eianez/inmuno/cap_01.htm
Gene Mayer. 2017. “IMMUNOLOGY - CHAPTER THREE ANTIGENS.” USA:
University of South Carolina of Medicine.
www.microbiologybook.org/mayer/antigens2000.htm
Consultadas el día 17 de marzo del 2018 12:30PM.
“Curso de Inmunología 2009-10.” 2009. España: Universidad Complutense
Madrid.
http://webs.ucm.es/info/saniani/troncales/inmunologia/documentostemas/TE
MA%204.pdf
Consultada el día 18 de marzo del 2018 9:30AM.
Brandan, Nora, Aquino Esperanza, José, Codutti, Alexis. “Respuesta
inmunitaria.” 2007. Cátedra de Bioquímica. Argentina: Universidad Nacional
del Nordeste.
“Las inmunoglobulinas. Estructura, propiedades y funciones biológicas.”
España: Universidad de Valencia.
https://www.uv.es/jcastell/2_Anticuerpos.pdf
“Estructura y clases de anticuerpos.”
http://educativa.catedu.es/44700165/aula/archivos/repositorio//3250/3413/html/21_es
tructura_y_clases_de_anticuerpos.html
Consultadas el día 18 de marzo del 2018 1:00PM.
Cano,
AA.
“ANTICUERPOS
TERAPEUTICOS:
EL
CASO
DE
LOS
ANTIVENENOS.” Sociedad Mexicana de Bioquímica. 2008. México.
Janeway, CA; Staff, VV. Traducción de Eva Sanz (2003). “Inmunobiología: el
sistema inmunitario en condiciones de salud y enfermedad.” Elsevier España.
“Linfocito T.” Creative Commons Attribution-Share Alike 3.0 Unported
www.uaz.edu.mx/histo/Biologia/Wiki/LinfocitoT.pdf
Adriana Ibañez. 2014. “Hipersensibilidad tipo V.” Prezi.
https://prezi.com/-ysga4ktilxe/hipersensibilidad-tipo-v/
Consultadas el día 18 de marzo del 2018 5:30-7:00PM
“Inmunología.” Gobierno de España: Proyecto biosfera.
http://recursos.cnice.mec.es/biosfera/alumno/2bachillerato/inmune/contenid
os11.htm
José Seijo Ramil. “Inmunología.”
www.tirsoferrol.org/ciencias/pdf/a21_inmunologia.pdf
Yvonne Rosenstein , Eric Garcia-Garcia e Ingeborg Becker. “MECANISMOS
CELULARES Y MOLECULARES DE LA RESPUESTA INMUNE ADQUIRIDA.”
México: Universidad Nacional Autónoma de México.
www.ibt.unam.mx/computo/pdfs/cursosviejos/bcelularII02/bcelular/capitulo%
20Mc%20Graww%20.pdf
Wilbert Alfaro Bourrouet. “El laboratorio en la inmunología diagnóstica.” Rev.
costarric. cienc. méd vol.21 n.1-2 San José Jun. 2000.
www.scielo.sa.cr/scielo.php?script=sci_arttext&pid=S025329482000000100001
Rocío Vanessa Calderón Pascacio. “Inmunología.” 2007. Instituto de
Biotecnología. México: Universidad Nacional Autónoma de México.
www.ibt.unam.mx/computo/pdfs/met/inmunoquimica.pdf
Consultadas el día 19 de marzo del 2018 7:39AM
Tortora G. J., B. R. Funke and Ch. L. Case 2007. “Introducción a la
Microbiología 9na Edición.” Editorial Médica Panamericana.
J Torres Borrego, M Fontán Domínguez. “PRUEBAS DIAGNÓSTICAS EN
ALERGOLOGÍA PEDIÁTRICA.” 2013. Unidad de Alergología y Neumología
Pediátricas. UGC de Pediatría y sus Especialidades. Hospital Universitario
Infantil Reina Sofía. Córdoba.
www.aeped.es/sites/default/files/documentos/15-diagnostico_0.pdf
Clínica DAM. “Determinación del grupo sanguíneo.” 2018. España.
https://www.clinicadam.com/salud/5/003345.html
Consultadas el día 19 de marzo del 2018 8:10PM.