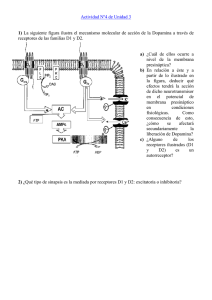
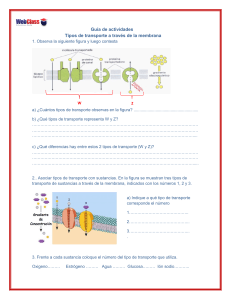
Uchitel, Osvaldo El lenguaje de las neuronas - 1a ed. 1a reimp. - Buenos Aires : Eudeba, 2007. 120 p. ; 20x14 cm. (Ciencia Joven) ISBN 978-950-23-1462-4 1. Neurobiología. I. Título CDD 612.8 Eudeba Universidad de Buenos Aires 1ª edición, 1ª reimpresión: agosto de 2007 © 2007, Editorial Universitaria de Buenos Aires Sociedad de Economía Mixta Av. Rivadavia 1571/73 (1033) Ciudad de Buenos Aires Tel.: 4383-8025 / Fax: 4383-2202 www.eudeba.com.ar Diseño de tapa: Silvina Simondet Corrección y diagramación general: Eudeba Impreso en la Argentina Hecho el depósito que establece la ley 11.723 No se permite la reproducción total o parcial de este libro, ni su almacenamiento en un sistema informático, ni su transmisión en cualquier forma o por cualquier medio, electrónico, mecánico, fotocopias u otros métodos, sin el permiso previo del Editor. Agradecimientos El 8 de octubre de 1894, en un puerto entrerriano, desembarcó mi bisabuelo paterno acompañado por sus ocho hijos. Entre ellos estaba mi abuelo que en ese entonces tenía 2 años. Formaban parte de uno de los contingentes que dieron origen a los gauchos judíos que poblaron las colonias fundadas por el barón Moisés de Hirsch. Agradezco a este hombre haber salvado y dignificado la vida de mis antepasados. Instalados como colonos, con enormes sacrificios a veces retribuidos con una buena cosecha y, otras veces, castigados con la langosta, mis abuelos pusieron todo su esfuerzo en la educación de mi padre quien, gracias a la educación pública y gratuita, pudo graduarse como médico en la Universidad de Buenos Aires. Le agradezco a la Argentina y a todos los promotores y defensores de la Universidad pública y gratuita haberle dado a mi padre y, luego a mi mismo, la oportunidad de estudiar y elegir libremente nuestro camino. Mi agradecimiento a los que me enseñaron los primeros pasos en la investigación científica, los doctores Raúl Carrea y Horacio García en el Hospital de Niños y el doctor Enrico Stefani en la Facultad de Medicina de la UBA. La dictadura militar y mis deseos de perfeccionamiento se combinaron para llevarme al Department of Biophysics del University College London donde el Profesor Ricardo Miledi me enseñó el arte de experimentar. Mi agradecimiento a él y a todos con los que compartí esos años de exilio. A mi regreso al país, en 1982, tuve la oportunidad de recrear el laboratorio de electrofisiología en el entonces Instituto de Anatomía General y Embriología dirigido por el Dr. Eduardo D. P. De Robertis a quien le guardo un cariño especial por todo el apoyo y aliento recibido en los difíciles años de la reinserción. Pronto el laboratorio se pobló de estudiantes de Medicina y de Biología deseosos de conocer y experimentar. Ellos me impulsaron a tomar a mi cargo la asignatura Fisiología del Sistema Nervioso en la Facultad de Ciencias Exactas y Naturales. En sus aulas, durante los últimos 15 años, enseñé y, por sobre todo, aprendí los conceptos que pretendo explicar en este libro. 5 Durante toda esta travesía tuve el continuo apoyo de mi familia y de mi mujer, Sarita, a quien le debo un agradecimiento sin límite. Mi reconocimiento por la ayuda recibida a Dana Felman y a Rafael Pagani. 6 Sensibles, pero potentes amplificadores, los canales iónicos perciben el sonido de la música de cámara, guían el pincel del artista y generan las potentes descargas que produce la anguila eléctrica. Son ellos los que le dicen al Paramecium que debe retroceder después de chocar con un obstáculo y son ellos los responsables de que las hojas de la Mimosa se cierren. (B. Hille, 1984) 7 8 1. Introducción Hace ya más de dos milenios, filósofos griegos como Hipócrates y Platón apreciaban algo especial en el cerebro, al que responsabilizaban del comportamiento humano y animal. Por el contrario, Aristóteles, en Historia de los animales, describía al cerebro como un órgano blando, caliente, de una contextura parecida a la de los excrementos y consideraba imposible que fuera el sustrato de una función tan noble como el pensamiento humano. Hoy aceptamos sin cuestionamiento que el cerebro somos nosotros mismos y que el resto del cuerpo sirve para mantenerlo y transportarlo. El cerebro es responsable de los movimientos voluntarios de nuestro cuerpo y, asimismo, de nuestros sentimientos, aspiraciones y pensamientos. El cerebro puede ser estudiado desde diversas disciplinas. Los bioquímicos y biólogos moleculares investigan las propiedades de las moléculas que cumplen funciones en el cerebro. Los fisiólogos estudian las características de las células individuales o de grupos celulares y cómo se relacionan entre ellas. Los psicólogos comportamentales analizan los patrones de comportamiento en animales y humanos. Los neurocientíficos computacionales intentan generar modelos del funcionamiento del cerebro, tomando la información aportada por los estudios celulares y moleculares. Entender el cerebro es uno de los más grandes desafíos del hombre. No es la intención de este libro resolver tamaño problema. Lo que conocemos hoy del cerebro puede ser homologado a un juego de cartas, en el que sólo hemos podido reconocer algunas figuras y establecer algunas de las complicadas reglas de juego. Una de las cartas de este “juego cerebral” son las señales que utiliza el sistema nervioso para que sus componentes dialoguen entre sí o generen una acción. Aquí sólo nos ocuparemos de cómo las neuronas generan y transfieren esas señales. En los vertebrados, el cerebro elabora una orden para generar un movimiento. Dicha orden es el resultado de un proceso de integración y filtrado de una enorme cantidad de señales que provienen de los sentidos y de la propia actividad cerebral. En consecuencia, la orden es emitida hacia los ejecutores, los músculos. Una vez que los músculos realizan un primer 9 movimiento, el cerebro comienza a recibir información de la actividad realizada y, normalmente, la utiliza para corregir el rumbo del movimiento hacia el blanco elegido. Todo este proceso involucra la comunicación de millones de neuronas conectadas entre sí en forma lineal, en circuitos convergentes o divergentes, en los que la actividad se concentra o distribuye a otros grupos de neuronas, en circuitos que se retroalimentan, o en otros altamente complejos. Esta diversidad de circuitos neuronales forma el sistema nervioso que en los vertebrados ocupa el cráneo y la columna vertebral y se conoce como el sistema nervioso central (SNC). Sus prolongaciones, formadas por nervios y ganglios, se distribuyen por todo el cuerpo formando el sistema nervioso periférico (SNP). Tanto el sistema nervioso central como el periférico están formados por neuronas y células de la neuroglía. Las neuronas tienen a su cargo la función de captar y transmitir los impulsos nerviosos dentro del sistema, mientras que las células de la neuroglía o glía tienen a su cargo las funciones de sostén, defensa, protección y aporte de material para el metabolismo de las neuronas. Las neuronas se caracterizan por sus intrincadas ramificaciones, que irradian desde el cuerpo celular o soma (Fig. 1A, B). Existen dos tipos de prolongaciones, las dendritas y los axones. Las dendritas se caracterizan por ser muy numerosas y por extenderse –en la mayoría de los casos– a distancias cortas del soma; conducen los impulsos nerviosos hacia el cuerpo celular. Por su parte, los axones se caracterizan por ser únicos, es decir, hay uno para cada neurona y, en algunos casos, son muy largos. Conducen los impulsos nerviosos desde el cuerpo celular a otras regiones. En algunas neuronas, el axón se recubre de una vaina de mielina constituida por la membrana de una célula de la glía. A lo largo del axón, la mielina suele presentar constricciones a intervalos regulares, que se denominan nódulos de Ranvier. La vaina de mielina y los nódulos de Ranvier son de gran importancia para la conducción a alta velocidad de los impulsos nerviosos. 10 A B C Terminal presináptico Espina dendrítica postsinapsis Figura 1: A. Dibujo de Santiago Ramón y Cajal que muestra la corteza cerebral teñida con la técnica de Golgi. B. Ilustración de dos neuronas. C. Contactos sinápticos de las neuronas. La neurona es una célula altamente especializada. Puede ser excitada, es decir, ante un estímulo responde con una respuesta eléctrica, razón por la cual se la considera, al igual que a la célula muscular, una célula excitable. El cambio eléctrico que genera se propaga, en la mayoría de los casos, a lo largo de sus prolongaciones. Las neuronas se clasifican en sensitivas, motoras o de asociación, de acuerdo con la función que desempeñen. Las primeras transportan información de los receptores sensoriales hacia el sistema nervioso central. Las motoras la llevan del sistema nervioso central a los órganos efectores, músculos o glándulas. Las interneuronas o neuronas de asociación son intermediarias, es decir, conectan las neuronas entre sí. Las neuronas forman cadenas y redes, a lo largo de las cuales viajan los impulsos nerviosos. Aquellos puntos, en los que una neurona se relaciona con otra, de manera anatómica y funcional, reciben el nombre de sinapsis (Fig. 1C). Entre otras cosas, las sinapsis determinan la dirección de los impulsos nerviosos y permiten la integración de señales excitatorias e inhibitorias, por eso son de gran importancia funcional. Ejemplos sencillos de un conjunto de neuronas organizadas para cumplir una función se pueden observar en el arco reflejo, que experimentamos al retirar la mano frente a un estímulo de dolor en un dedo, o en el reflejo rotuliano, provocado por el médico durante un examen clínico. Consiste en el 11 estiramiento brusco del tendón del músculo cuádriceps generado por un golpe seco debajo de la rodilla. Como reacción, el músculo cuádriceps se contrae y extiende la pierna. Esta respuesta se complementa con la relajación de los músculos flexores ubicados en la parte posterior del muslo. Estos reflejos son mecanismos funcionales simples del sistema nervioso. En ellos no hay participación de la voluntad, en otras palabras, no hay intervención del cerebro. En la Fig. 2 se esquematizan las estructuras que se necesitan para que haya un arco reflejo Estas estructuras son las prolongaciones de las neuronas sensitivas que pueden localizarse en la piel, los músculos, las articulaciones o las vísceras. Las neuronas sensitivas o aferentes se ubican en los ganglios sensitivos del SNP, desde donde parten los axones que entran en el SNC y establecen contactos sinápticos con las neuronas intercalares. Estas, a su vez, establecen contactos sinápticos con neuronas motoras o eferentes, cuyos axones emergen del SNC y establecen sinapsis con células musculares o con otros órganos efectores. Para realizar esta tarea el sistema nervioso utiliza señales eléctricas y señales químicas. Estos dos tipos de señales son universales y son la base del funcionamiento del sistema nervioso de vertebrados e invertebrados. Se hallan en todos los niveles del sistema nervioso y en todas las especies que posean un sistema nervioso, aun cuando este sea rudimentario o primitivo. Las señales eléctricas, también conocidas como impulsos nerviosos o potenciales de acción, permiten generar un código basado en el número, frecuencia y distribución de las señales individuales. Los impulsos se propagan fielmente por decenas de metros y a velocidades de hasta 100 metros por segundo (360 km por hora), a lo largo de una prolongación neuronal. Como en el SNC las distancias son de milímetros o centímetros, las señales eléctricas llegan de un punto a otro de la neurona en milésimas de segundos. Las señales químicas, por el contrario, son más lentas, locales y están dirigidas –fundamentalmente– a comunicar las neuronas entre sí en el nivel de la sinapsis. Si bien el sistema nervioso de un ser humano está formado por miles de millones de neuronas que se comunican entre sí por numerosos contactos sinápticos, los fenómenos básicos de comunicación neuronal se pueden analizar tomando un modelo mucho más sencillo, como el representado en la Fig. 2. 12 Médula espinal 1 Neurona sensorial 2 Asta dorsal 3 Receptores cutáneos Neurona intercalar 4 Asta ventral Neurona motora 5 6 Músculo 7 Figura 2: Esquema de un arco reflejo simple. Los números impares indican que, en ese punto del arco, la información se expresa como una señal eléctrica, mientras que los pares indican que se expresa como una señal química. En el circuito del esquema, un estímulo térmico o mecánico genera un fenómeno eléctrico en una de las prolongaciones de la neurona. Esta señal eléctrica (1) se propaga a lo largo de toda la neurona y, en el extremo opuesto, libera una sustancia química o neurotransmisor (2). Por su parte, las neuronas receptoras de neurotransmisor generan una señal eléctrica (3) que también se propaga a lo largo de las ramificaciones y se contacta con las neuronas motoras, enviándoles señales químicas excitatorias o inhibitorias (4). Estas se traducen en señales eléctricas en la neurona motora (5), cuyo axón sale del SNC y, junto con los axones de otras neuronas, forman un nervio periférico. Los axones motores del nervio periférico se ramifican dentro del músculo; cada uno de ellos establece una sinapsis neuromuscular similar a las sinapsis entre neuronas, pero mucho más grande (6). En ella, al igual que en las anteriores, se libera una sustancia química. El estímulo químico que recibe el músculo desencadena en cada fibra muscular una nueva señal eléctrica (7) que, luego de propagarse a lo largo de la misma 13 induce la contracción muscular. En este último paso del arco reflejo, la energía química se traduce en energía mecánica. Este mismo circuito podría hacerse infinitamente más complejo, si agregáramos millones de neuronas en el camino. Básicamente, deberíamos multiplicar las neuronas que generan señales eléctricas, que dan origen a señales químicas que, a su vez, originan señales eléctricas; y así, sucesivamente. En un final aparente de este ciclo, una señal eléctrica genera una señal química que excita al músculo y así se produce una actividad mecánica. Sin embargo, el ciclo no termina, ya que la propia contracción muscular genera nuevas señales que vuelven al circuito. Por lo tanto, el comienzo y el fin de este proceso son puntos arbitrarios, que establecemos artificialmente a fin de dividirlo y hacerlo asequible, tanto desde lo experimental como desde lo didáctico. En los capítulos que siguen, analizaremos la génesis de las señales eléctricas y químicas desde un punto de vista cualitativo. Asimismo, incluiremos en los recuadros información complementaria, que explique ciertos conceptos del texto principal o los relacione con la historia de las investigaciones neurobiológicas. La presente obra tiene como objetivo, por tanto, aclarar los mecanismos involucrados en la comunicación neuronal y neuromuscular; de ninguna manera pretende ser un exhaustivo y completo texto de neurobiología molecular y celular. Recuadro 1: De la teoría neuronal de Golgi y Ramón y Cajal a De Robertis La teoría celular, desarrollada a mediados del siglo XIX, establece que todos los organismos están compuestos por estructuras individuales, las células. Sin embargo, las dificultades para estudiar las propiedades microscópicas del sistema nervioso impidieron aplicar esta teoría a la neurona. Hacia 1880, el científico italiano Camilo Golgi (1843-1926) postuló que los axones de una neurona se fusionaban con otros axones y formaban un retículo ininterrumpido. Por su parte, Santiago Ramón y Cajal (1852-1934), fundador de la neurociencia contemporánea, utilizó las técnicas histológicas desarrolladas por Golgi pero concluyó lo opuesto. Desafió la concepción reticular y presentó la doctrina neuronal, que aplica la teoría celular al sistema nervioso y establece que cada neurona es una entidad individual que se contacta pero no se fusiona con 14 las otras. Ramón y Cajal propuso que entre las neuronas existe contacto pero no continuidad. El debate entre ambas teorías se extendió por varias décadas y enemistó fuertemente a sus respectivos defensores, aunque ambos recibieron el Premio Nobel en 1906. En suma, las pruebas a favor de la doctrina neuronal se fueron acumulando pero el tema se resolvió recién en los años cincuenta del siglo pasado, con el desarrollo de la microscopía electrónica, que permite ver como separados objetos que sólo se distancian en una fracción de micrón. Esta técnica fue la utilizada por el neurocientífico rioplatense Eduardo De Robertis (1913-1988) para confirmar que, en la mayoría de las sinapsis, las neuronas se contactan pero no se fusionan, confirmando de esta manera los postulados de Ramón y Cajal. 15 2. Las células, pequeñas baterías eléctricas El lenguaje singular del sistema nervioso está basado en la electricidad generada por las células. Este fenómeno, conocido como bioelectricidad, fue reconocido hace aproximadamente 200 años, luego de una histórica disputa científica entre Luigi Galvani (1737-1798) y Alessandro Volta (1745-1827). La controversia se desarrolló en torno al estudio de la contracción de los músculos de la pata de la rana que generó las bases para la invención de la pila eléctrica (recuadro 2). Cada célula está separada de su medio ambiente por una película muy fina, la membrana plasmática. Esta membrana, de aproximadamente 0,000001 centímetros de espesor, está formada por gran cantidad de moléculas de lípidos dispuestas en una doble capa (bicapa), en la cual navegan o están ancladas las proteínas (Fig. 1). Molécula proteica Carbohidrato Exterior celular Molécula proteica Bicapa de lípidos Proteína canal BICAPA LIPIDICA Interior celular Figura 1: Esquema de una membrana celular, formada por una bicapa de lípidos con proteínas. Algunas proteínas atraviesan la capa lipídica y son canales iónicos. 16 La bicapa de lípidos es permeable a ciertos gases y a ciertas moléculas pequeñas no cargadas. Es ligeramente permeable al agua y esencialmente impermeable a la mayoría de moléculas solubles en agua, como los azúcares e iones, como el sodio (Na+), potasio (K+) o cloro (Cl-). Por lo tanto, la membrana plasmática retiene dentro de la célula componentes vitales tales como aminoácidos, azúcares e iones. Por la misma razón que evita la salida de estas moléculas, también impide el ingreso de ellas al citoplasma celular. Dadas estas propiedades, es necesario que exista una vía de comunicación del interior celular al medio externo, así como vías de comunicación entre todos los compartimentos internos de la célula separados por membranas bilipídicas. Estas vías de comunicación están establecidas por las proteínas contenidas en la membrana plasmática. Estas forman complejos transportadores que permiten que algunas sustancias atraviesen la membrana, sin interaccionar directamente con los lípidos. Las proteínas de las membranas transportadoras son en general de tres tipos (Fig. 2): las bombas, que atrapan una molécula y la trasladan gastando energía (ATP); los transportadores, que al igual que las bombas trasladan moléculas, pero sin gasto de energía, ya que la molécula transportada tiene energía potencial para su traslado (gradiente de concentración) y los canales iónicos, que como su nombre lo indica, son proteínas que generan un canal acuoso por donde difunden los iones. Iones Difusión simple con canal abierto transporte pasivo -sin gasto de energía- transporte activo -con gasto de energía- Figura 2. Distintos tipos de mecanismos de transporte de iones a través de la membrana celular. Fuente: Alberts y col.: Molecular Biology of the Cell, Nueva York, Garland Publishing, 1994. (modificada). Existe un gran número de procesos fisiológicos celulares basados en la difusión pasiva de los iones, desde la conducción nerviosa hasta la fertilización del huevo por el espermatozoide. 17 Los canales iónicos transportan agua y tipos específicos de iones a favor de su gradiente de concentración; de esta forma, permiten el movimiento de numerosas moléculas a gran velocidad. Por tanto, los canales iónicos juegan un papel fundamental en el funcionamiento de las células excitables y en la transmisión de impulsos nerviosos. Debido al desigual reparto de cargas eléctricas entre su superficie interior y exterior, la membrana plasmática está polarizada. La desigualdad de cargas es mínima, si se compara con el total de iones cargados que existe en el interior celular: es del orden de 1 por millón. Sin embargo, esta pequeña diferencia de cargas crea una diferencia de potencial que en el exterior es positivo con respecto al interior. Este potencial se encuentra presente en todo tipo de células, pero ha sido estudiado con mayor detalle en células excitables, como las fibras musculares y las neuronas, donde adquieren una importancia fisiológica comprobada. Como dijimos, la polarización de la membrana tiene su origen en una distribución desigual de iones entre el interior y exterior celular, que surge, a su vez, de la existencia de moléculas cargadas dentro de la célula que son impermeables. En el líquido intersticial exterior, el anión (ion con carga eléctrica negativa) más abundante es el de Cl-. En el interior de la célula, el citoplasma, los aniones más abundantes son las proteínas, que son impermeables y que al pH celular se ionizan negativamente (A-). El catión (ion con carga eléctrica positiva) más abundante en el líquido intersticial es el Na+ y, en el citoplasma, el K+ (Fig. 3). El desequilibrio iónico que produce la polarización de la membrana se debe a los distintos grados de permeabilidad que ofrece la membrana a cada uno de los iones. El ion de potasio atraviesa la membrana fácilmente; la permeabilidad para el sodio es menor y, además, es expulsado por medio de un transportador con gasto de energía, la bomba de Na+/K+. Esta dinámica establece una diferencia de potencial que, en las células nerviosas y musculares en condiciones de reposo, es de unos –60 a –90 mV. Todas las células poseen un potencial de membrana, ya sean del reino animal o vegetal, pero este resulta, en general, mucho más bajo que el registrado en las células excitables: es del orden de los –20 mV. 18 Medio extracelular Na+ 120 mM. K+ 4 mM . Cl- 120 mM. Citoplasma Na+ 10 Mm. K+ 140 mM. Cl- 3.5 mM. Proteínas A+ + - - -70 mV + Figura 3: Concentración iónica en el interior y exterior de una neurona o una fibra muscular. 2.1 Potencial de membrana A fin de comprender de qué manera los iones generan el potencial de membrana, debemos definir claramente las fuerzas que mueven los iones a través de ella. La velocidad y extensión del transporte iónico a través de las membranas resulta influida por: 1. la concentración de iones a ambos lados de la membrana; 2. el potencial eléctrico que existe a través de la membrana; 3. la permeabilidad o conductancia de la membrana al ion en estudio. Estas dos fuerzas, la química o gradiente de concentración, y la eléctrica o gradiente de potencial, pueden actuar en la misma dirección y, por lo tanto, sumarse, o actuar en dirección opuesta y, en ocasiones, cancelarse mutuamente (Fig. 4A, B). 19 A - - ClN a B + + ClN a + GRADIENTE DE CONCENTRACIÓN GRADIENTE ELÉCTRICO DIFUSIÓN NETA + ClN a - ClN a - GRADIENTE DE CONCENTRACIÓN GRADIENTE ELÉCTRICO DIFUSIÓN NETA EN EQUILIBRIO Figura 4: Difusión del ion Na+ por gradiente electroquímico. Membrana permeable al Na+. A. La batería genera un gradiente eléctrico, diferencia de potencial entre las placas, que se suma al gradiente de concentración. B. La batería con la polaridad invertida genera un gradiente eléctrico que contrarresta el gradiente de concentración. Así, en casi todas las células, la concentración citosólica de K+ es mucho más alta que la de Na+. Por ejemplo, la concentración de K+ es 2040 veces menor en sangre que en el interior celular. Por otro lado, la concentración de Ca2+ es mucho menor en el interior celular que en el medio extracelular (Fig. 7). Las bombas iónicas, fundamentalmente la de Na+/K+, son las que generan y mantienen este gradiente de concentración iónica consumiendo ATP (recuadro 3). La membrana plasmática contiene canales proteicos que permiten a los principales iones celulares (Na+, K+, Ca2+ y Cl-) cruzar la membrana a favor de sus respectivos gradientes. Podríamos preguntarnos si existe alguna relación entre la diferencia de concentración de iones y la existencia de un potencial de membrana. Tal relación existe, y encontramos la demostración en los trabajos científicos de la década de 1950. En ellos se tomaron como muestras músculos de rana: después de disecarlos –sin hacerles daño– se los sumergió en una solución con iones, similar a la del medio extracelular. Recordemos que, como los 20 iones siempre están acompañados de su contra-ion correspondiente, tanto en la solución intracelular como en la extracelular se mantiene la electroneutralidad. En esas condiciones se midieron los potenciales de membrana y se registraron valores normales de -70 a -90 mV (Fig. 5 y recuadro 4). -90 mV. MICROELECTRODO + ELECTRODO DE REFERENCIA Na 10 mM. + K 140 mM. Cl 3.5 mM. Proteínas + Na 120 mM. + K 4 mM. Cl 124 mM. Figura 5: Medición del potencial de membrana con microelectrodos intracelulares. El siguiente paso experimental consistió en cambiar la solución externa normal por una con alto contenido de K+, similar a la concentración intracelular. Para ello se reemplazó el ClNa por ClK. El potencial de membrana observado resultó cercano a 0 mV. Siguiendo con la misma línea experimental de modificar las concentraciones iónicas, se inhibieron las bombas enfriando el músculo a 4 °C. Después de varias horas, la célula se llenó de Na+ y se vació de K+. En estas condiciones, si la solución de incubación es la fisiológica, que tiene una alta concentración de Na+ y baja de K+, también se registra un potencial de membrana cercano a 0 mV, ya que no hay diferencia de concentración de iones. Otros experimentos mostraron que es el cambio en la concentración del ion K+ el que regula fisiológicamente el potencial de membrana. Los cambios en la concentración del ion Na+, sin modificar el K+, no generan importantes variaciones en el potencial de membrana. Esto se explica por la baja permeabilidad que tiene la membrana para el Na+ y la alta que tiene para el K+, en condiciones de reposo. Representemos el sistema de gradiente de concentración por medio de un sistema hidráulico, por ejemplo, dos tanques de agua comunicados por un tubo con una exclusa. Si los dos tanques están llenos de agua hasta la misma altura y tienen la grifería abierta, no intercambian agua. Pero si levantamos la altura de uno de ellos, este comenzará a vaciarse y el otro a llenarse, siempre y cuando la grifería permanezca abierta. Es decir que para que se movilicen los iones a 21 través de la membrana necesito una gradiente (más concentración de iones en un lado que en el otro) y un camino para que circulen –canales abiertos– o lo que llamamos fenomenológicamente permeabilidad o conductancia. Al trasladar este concepto a las células, podemos entender por qué es posible agregar o quitar el ion Na+ de la solución extracelular sin que se modifique en gran manera el potencial de membrana. Es porque variamos enormemente la concentración del ion Na+ y, –por lo tanto, el gradiente químico– pero su permeabilidad es muy baja: por lo tanto, influye muy poco en el potencial final. ¿Cómo influye un potencial eléctrico en la difusión de los iones? Imaginemos un ion con carga positiva pasando a lo largo de un canal que está sometido a un campo eléctrico (positivo de un lado de la membrana y negativo del otro). El lado positivo ejercerá una fuerza de repulsión que disminuirá, anulará o invertirá el sentido del movimiento del ion. Si, en cambio, esta fuerza es negativa, la fuerza eléctrica se sumará a la del gradiente de concentración. Veamos ahora cómo surge el potencial eléctrico de la membrana. Supongamos dos compartimentos separados por una membrana con una distribución iónica de K+, Na+ y Cl-, similar al interior celular por un lado y similar a su ambiente extracelular por el otro. Como dijimos, tanto en la solución intracelular como en la extracelular se mantiene la electroneutralidad. Cuando se genera una diferencia de potencial, las cargas “separadas” son mínimas y están distribuidas en la superficie de la membrana. Consideremos tres modelos experimentales representados en la Fig. 6. I II III 0 mV. A-B=- 59 A-B= 59 mV. MODELO Na+ 100 mM. K+ 10 mM. Cl- 110 mM. A Na+ 10 mM. K+ 100 mM. Cl- 110 mM. B IMPERMEABLE Na+ 100 mM. K+ 10 mM. Cl- 110 mM. A Na+ 10 mM. K+ 100 mM. Cl- 110 mM. B PERMEABLE AL Na+ Na+ 100 mM. K+ 10 mM. Cl- 110 mM. A Na+ 10 mM. K+ 100 mM. Cl- 110 mM. B PERMEABLE AL K+ Figura 6: Tres situaciones experimentales que ilustran la generación de un potencial por difusión de los iones, a través de una membrana con diferentes permeabilidades. 22 Modelo experimental I: la membrana es impermeable a todos los iones. No hay flujo de iones, por lo tanto, a pesar de existir una diferencia de concentración, no se genera diferencia de potencial a lo largo de la membrana. Modelo experimental II: la membrana contiene canales de Na+ (es permeable a él) pero no de Cl-. En este caso, los iones Na+ se mueven a favor de su gradiente de concentración, pero los de Cl- no. Se produce entonces un exceso de iones cloruro Cl- a un lado de la membrana (A) y de Na+ del otro (B), quedando estos iones próximos a la superficie de la membrana. Por tanto, se crea una separación de cargas a lo largo de la membrana que se puede medir por medio de un potenciómetro como potencial eléctrico o voltaje. La diferencia de carga aumenta hasta que el movimiento de Na+ es inhibido por el exceso de cargas positivas acumuladas al lado derecho de la membrana y por la atracción de los iones Cl- que se sitúan a la izquierda. En definitiva, el propio Na+, al difundir a favor de su gradiente, genera una diferencia de carga que lo frena y establece el equilibrio. En esa situación, no habrá movimiento neto de Na+ y la membrana actuará guardando esa carga, como un condensador. La magnitud en voltios del potencial de equilibrio del Na+ es de -59 mV, cuando la diferencia de concentración es de 10 veces. Este valor se calcula tomando como base las ecuaciones que se detallan en el recuadro 5. Modelo experimental III: es igual al modelo anterior, pero se reemplazan los canales de Na+ por los de K+. En este caso, los iones K+ se mueven a favor de su gradiente de concentración, del compartimiento de mayor concentración al de menor concentración. Dado que la concentración de K+ es mayor en el compartimiento contrario al del Na+, el potencial de membrana generado es igual, pero de signo contrario, al del experimento II. El potencial de equilibrio resultante es de 59 mV. Hemos dicho que el potencial de membrana es negativo en el interior celular, respecto del exterior. Esto surge, fundamentalmente, a partir de dos fenómenos: a) la cantidad de canales de K+ abiertos en forma permanente que tienen las membranas, muy superior a los de Na+ o Ca2+, y b) la distribución desigual de iones que surge de la existencia de aniones impermeables en el interior de la célula. Estos dos factores provocan un movimiento de iones K+ a través de la membrana, desde dentro hacia afuera, que genera un exceso de cargas negativas en el interior y un exceso de positivas en el exterior. Esta circunstancia determina un potencial de membrana negativo del interior cercano al punto de equilibrio, en el que la fuerza de difusión es contrarrestada por el potencial generado. Este 23 potencial de membrana es relativamente estable y contrasta con los cambios repentinos que ocurren en las células excitables durante su actividad, por ello se le llama potencial de reposo. En las neuronas y en las fibras musculares, el potencial de equilibrio para el K+ es mucho más negativo (-75 a -90 mV) que en los ejemplos experimentales mencionados más arriba (-59 mV). Esto se debe a que la diferencia de concentración para el ion K+ elegida en los ejemplos era de 10 veces, mientras que, en las condiciones fisiológicas la diferencia resulta de aproximadamente 17 veces. Dado que la permeabilidad de la membrana al K+ es muy alta y muy baja para el Na+, el potencial de membrana está muy cerca del valor de equilibrio para el K+ (Fig. 7). Por lo tanto, es muy poco el K+ que se pierde hacia el exterior celular y muy poco el Na+ que se gana en el interior celular. Estas pérdidas son compensadas por la bomba de Na+ y K+, que con su constante bombeo mantiene la diferencia de concentraciones. En definitiva, la presencia de aniones impermeables y la de las bombas de Na/K permite generar y mantener una diferencia en la concentración iónica. Cada ion tenderá, entonces, a imponer su potencial de equilibrio como potencial de membrana. La dominancia de un ion respecto del otro dependerá de la permeabilidad relativa de los mismos (recuadro 5). 24 Músculo esquelético ENa = + 64.8 mV Na+ 120 mM. 4 mM. 10 mM. 140 mM. 0.0002 mM Ca++ K+ 2 mM 3.5 mM. Cl- EK = - 92.6 mV Vm = -72 mV 120 mM. ECa= < +120 mV ECl = - 88.6 mV Gradiente eléctrico Gradiente de concentración Figura 7: Distribución iónica y potencial de equilibrio para distintos iones en músculo esquelético. Se indican las diferentes concentraciones para el Na+, K+, Cl- y Ca2+ y sus respectivos potenciales de equilibrio ENa, EK, ECl y ECa. La permeabilidad al Ca2+ es extremadamente baja y no contribuye a generar el potencial de membrana. El potencial de membrana resultante se calcula sobre la base de una relación de permeabilidad al K+ 30 veces mayor que la del Na+. Recuadro 2. La bioelectricidad: de la contracción del músculo de la rana a la pila eléctrica Luigi Galvani y Alessandro Volta fueron dos importantes físicos italianos de fines del siglo XVIII que contribuyeron de manera significativa al entendimiento de los fenómenos eléctricos. Galvani mostró que la electricidad producida por una máquina eléctrica estimulaba los músculos de la pata de la rana. Además, observó que los músculos también se 25 contraían, sin estímulo externo, cuando se los colgaba de un gancho de bronce de la reja de hierro de su jardín. Estas observaciones lo llevaron a postular que los tejidos musculares tenían capacidad de almacenar cargas eléctricas y que respondían a las mismas. En la vereda opuesta, Volta desestimaba las ideas de Galvani y planteaba que todos los fenómenos observados podrían ser explicados como resultado de la energía eléctrica generada entre dos metales disímiles, como los utilizados en el trabajo experimental de Galvani. Para Volta, el origen de la electricidad estaba en la unión de los metales, es decir, en el gancho de bronce sujeto al hierro, así supuso que cada metal posee una cantidad característica de electricidad y concluyó que, si un material orgánico humedecido se pone en contacto entre dos metales diferentes, al cerrar el circuito fluirá una corriente eléctrica que estimulará el músculo enganchado entre ambos metales. Este principio básico es el que Volta utilizó para crear la pila, que consistía en una torre de discos de cobre y zinc separados entre sí por telas humedecidas con una solución salina. Los discos de cada extremo de la serie se conectaban a sendos alambres, que permitían la circulación ininterrumpida de la corriente eléctrica. La historia de la disputa entre Galvani y Volta es una muestra ejemplar de cómo una investigación básica, irrelevante en apariencia, puede dar origen a uno de los avances tecnológicos más importantes en la historia de la humanidad. Aunque Volta resultó inicialmente triunfador, años más tarde se comprobó que ambos tenían razón. Los músculos se contraen por la aplicación de una corriente eléctrica externa que actúa sobre la bioelectricidad intrínseca del nervio y el músculo. Recuadro 3: Mantenimiento del gradiente iónico En el texto principal hemos desarrollado la idea de la existencia de gradientes de concentración. Estos gradientes químicos no están perfectamente compensados por las diferencias eléctricas. Por lo tanto, el sistema no está en equilibrio y lentamente los gradientes se disipan. Las bombas, en particular la de Na+ y K+, tienen la función de restituir con gasto de energía las pérdidas del K+ y la ganancia de Na+ de las células. Otras bombas transportan el Ca2+ o intercambian el Ca2+ por Na+ y, finalmente, este último es intercambiado por K+. Las bombas son proteínas de membrana con actividad enzimática, formadas por 10 segmentos intramembranales y largas asas de proteína en 26 el interior celular. Hidrolizan el ATP y utilizan la energía liberada para trasladar los iones Na+ pegados a la molécula hacia el interior y los de K+ unidos, hacia el exterior. Por otro lado, la relación no es simétrica, ya que se mostró que existen tres sitios para el Na+ y dos para el K+. Por lo tanto, la bomba genera una pequeña diferencia de potencial al mover acoplados 2 iones K+ al interior y sacar 3 de Na+ al exterior. Estas bombas se denominan electrogénitas: su función fundamental es mantener el gradiente iónico que, al difundir, genera el potencial de membrana. Recuadro 4: Medición del potencial eléctrico de membrana Para medir el potencial entre dos puntos, basta con conectarlos a un voltímetro mediante un elemento conductor de la electricidad. Lo podríamos hacer con un “tester digital”, fácil de conseguir. Para comenzar, se sumerge uno de los polos en el medio extracelular y el otro en el intracelular. Para este último paso, se requiere un electrodo muy fino o microelectrodo, que se construye calentando y estirando un tubo de vidrio hasta obtener una punta menor de 1 micrón de diámetro con un orificio. Seguidamente, se llena el interior del microelectrodo con cloruro de potasio (ClK) altamente concentrado, que convierte al microelectrodo en un elemento conductor, y este se conecta al voltímetro mediante un cable eléctrico que se introduce en la parte gruesa de la micropipeta. Cuando ambos electrodos se encuentran en el medio extracelular, se registra una diferencia de potencial originada por el contacto entre metales disímiles, que se cancela llevando el voltímetro a 0 mV. Mediante delicados manipuladores, se inserta la punta del microelectrodo atravesando –es decir, dañando– la membrana plasmática, con lo que se establece una continuidad eléctrica entre el interior celular, el ClK de la micropipeta y el voltímetro. El voltímetro marcará la diferencia de potencial en relación al electrodo externo. Recuadro 5: Ecuación de Nernst Si se conoce la carga eléctrica del ion y la diferencia de concentración a través de la membrana, es posible calcular el valor exacto del potencial de 27 equilibrio, usando una ecuación derivada de las leyes de la fisicoquímica conocida como ecuación de Nernst. Esta ecuación toma en consideración la carga del ion, la temperatura y la relación entre las concentraciones iónicas, tal que: E ion = 2.3 RT (ion)o log zF (ion)i En la ecuación, E (ion) es el potencial de equilibrio para un ion determinado, R la constante de los gases, T la temperatura absoluta, z la carga del ion, F la constante de Faraday, log. el logaritmo en base 10, [ion]o concentración externa e [ion]i la concentración interna del ion. ¿Qué significa esta ecuación? Establece una relación entre la fuerza de difusión a la derecha y la eléctrica a la izquierda. Cuando la temperatura (T) aumenta, el movimiento molecular es más intenso y aumenta la fuerza de difusión, por lo tanto, se necesita más potencial para compensarla. Por ello, T es proporcional a E (ion). Si aumentáramos la carga del ion que difunde, necesitaríamos menos potencial para compensar la difusión, por lo que z resulta inversamente proporcional a E (ion). R y F son constantes que no se modifican. A temperatura ambiente (23 oC) la ecuación de Nernst para el Na+, K+, Clo Ca2+ se escribe EK = E Na = E Cl = E Ca = ( K )o ( K )i ( Na )o 58mV log ( Na )i (Cl )o − 58mV log (Cl )i (Ca )o 29mV log (Ca )i 58mV log Con sólo conocer las relaciones de concentraciones, podemos obtener el valor de potencial de equilibrio. Si consideramos la relación entre [K+]o /[K+]i de 1/20, el logaritmo de 1/20 es -1.3, por lo tanto E K = 58 x -1.3= -75.4mV 28 Nótese que no hay en la ecuación ningún término referido a la permeabilidad o conductancia iónica del ion involucrado. Si ahora consideramos a los iones en su conjunto debemos asignarle a cada uno una permeabilidad o conductancia. No es necesario un valor absoluto de permeabilidad sólo basta con darle un valor relativo respecto de la permeabilidad de los otros iones. Por ejemplo la permeabilidad al K+ (Pk) es 30 veces mayor que la del Na+(Pna). En este caso el potencial de membrana esta dado por la ecuación de Goldman que es una derivación de la ecuación de Nernst. Potencial de membrana Vm= 58mV log Pk ( K )o + Pna ( Na )o Pk ( K )i + Pna ( Na )i Vm= 58mV log 30(4) + 1(120) 30(140) + 1(10) Vm= 58mV log 240 = -72.2 mV. 4210 29 3. Generación y propagación de señales en las células excitables. El potencial de acción Las células excitables, como las neuronas y las fibras musculares, son así denominadas por ser eléctricamente activas. Sufren cambios repentinos por la permeabilidad de la membrana a algún ion: esto altera el potencial de membrana, alejándolo de forma momentánea del valor del potencial de reposo. A esta rápida alteración del potencial de membrana se la denomina potencial de acción o impulso nervioso. Su forma, duración y amplitud varía de neurona en neurona, como se muestra en la Fig. 1: 20 mV 2 mseg. 50 mseg. 200 mseg. Figura 1: De izquierda a derecha se muestran ejemplos de potenciales de acción del axón gigante de calamar, de la neurona talámica y de la neurona de Purkinje, del cerebelo. Una neurona con un potencial estable cercano a los –70 mV indica que está en reposo. El potencial de acción es una explosión de actividad eléctrica; por unos pocos milisegundos, el potencial de membrana pasa de su valor negativo a un valor positivo de aproximadamente +40 mV. Para que esto se produzca, el estímulo que desencadene este cambio debe afectar el potencial de reposo. 30 POTENCIAL DE ACCIÓN 0 mV. mV. -55 -70 UMBRAL POTENCIAL DE REPOSO CORRIENTE INYECTADA a b c Figura 2: Registro de la actividad eléctrica pasiva y activa en una neurona. El microelectrodo de la izquierda inyecta corriente y el de la derecha registra el cambio de voltaje. La corriente inyectada en a y b sólo produce cambios subumbrales. La corriente inyectada en c lleva pasivamente la membrana al valor umbral, a partir del cual se genera el fenómeno activo del potencial de acción. En la Fig. 2 se muestra un experimento, en el que el cambio inicial del potencial de membrana es generado de manera artificial, al inyectar una corriente eléctrica desde una batería o estimulador externo. Si la corriente es negativa, la neurona se hiperpolariza (Fig. 2 a); si es positiva, se despolariza (Fig. 2 b, c). Cuando la despolarización alcanza cerca de -55 mV, la neurona bruscamente lanza un potencial de acción (Fig. 2 c). Si la neurona no alcanza este umbral crítico, no se producirá el potencial de acción. Una vez que la despolarización lleve el potencial de membrana al valor umbral, se generará un potencial de acción que siempre alcanzará en el mismo valor positivo. En una misma neurona, todos los potenciales de acción son muy similares en amplitud. Por lo tanto, la neurona o no alcanza el umbral, en cuyo caso la despolarización subumbral desaparece, o se produce un potencial de acción completo. En el descubrimiento y estudio de la naturaleza del potencial de acción, los axones gigantes del calamar han jugado un papel histórico, ya que por su considerable tamaño (diámetro 0.2-1 mm.; 5-10 cm. largo) permiten insertar electrodos con facilidad en el interior celular y modificar con gran facilidad el medio intracelular. En la Fig. 3 se observa el esquema de un experimento, en el que con simpleza se muestra que, para generar un potencial de acción, sólo se necesita 31 una adecuada distribución de iones y la membrana excitable que los separa. Baker y col. utilizaron un delicado rodillo para exprimir todo el contenido citoplasmático del axón y reemplazarlo por una solución que sólo contenía iones correspondientes al medio intracelular. Todos los elementos del citoplasma (organelas, microtúbulos, proteínas libres, etc.) fueron eliminados. A pesar de ello, la amplitud y forma del potencial de acción registrado antes y después fue sorprendentemente similar. ANTES CITOPLASMA ELIMINADO REEMPLAZADO POR SOLUCION SALINA DESPUES Figura 3: Registro del potencial de acción en un axón de calamar, antes y después de remover el axoplasma y reemplazarlo por una solución iónica intracelular. Baker, Hodgkin and Shaw. J.: Physiology 164:355, 1962 (modificado); Nicholls, J. y col.: From neuron to brain, Sunderland (Mass.), Sinauer, 2001. El potencial de acción tiene su origen en el intercambio de iones a través de la membrana celular. Alan Hodgkin (1914-1998) y Andrew Huxley (1917-) fueron los científicos que demostraron que el potencial de acción se debe a cambios grandes pero transitorios de la permeabilidad de la membrana del axón respecto a los iones Na+ y K+. Mediante el estudio del cambio de permeabilidad de la membrana respecto de estos iones, establecieron la existencia de dos tipos de conductos o canales que, en reposo, están cerrados, pero, cuando la célula se despolariza, se abren como consecuencia del cambio de entorno eléctrico. Es por ello que esos canales recibieron el nombre de canales iónicos dependientes de voltaje. Tomando como base la idea de los canales activados por la despolarización, el esquema de generación del potencial de acción se inicia con una señal eléctrica o química que lleva el potencial de membrana a un 32 valor más despolarizado, el potencial umbral, lo que inicia un ciclo de retroalimentación positiva (ciclo superior de la Fig. 4): + 40mV APERTURA DE LOS CANALES DE SODIO AUMENTA LA CORRIENTE DE SODIO CICLO POSITIVO RÁPIDO DESPOLARIZACIÓN HIPERPOLARIZACIÓN CICLO NEGATIVO LENTO AUMENTA LA CORRIENTE DE POTASIO APERTURA DE LOS CANALES DE POTASIO POTENCIAL DE REPOSO - 70mV INICIO ACTIVACIÓN DE LOS CANALES DE Kr ESTÍMULO DEPOLARIZANTE ACTIVA CANALES DE Na ACTIVACIÓN TOTAL DE LOS CANALES DE Kr CIERRE DE LOS DE LOS CANALES DE Kr INICIO ACTIVACIÓN REGENERATIVA DE LOS CANALES DE Na Tiempo en milisegundos Figura 4: Izquierda: representación de los ciclos de retroalimentación positiva y negativa que subyacen a la generación del potencial de acción. Derecha: distintas fases del potencial de acción y los mecanismos que las generan. 1 La despolarización inicial generada por un agente estimulante cambia la conductancia de la membrana para el Na+ y activa canales para el Na+. 2 Los iones Na+ fluyen a través de la membrana al interior celular, a favor de un fuerte gradiente electroquímico. Esta entrada de iones Na+ despolariza más la membrana y se abren más canales para Na+. 3 Se repiten los pasos 1 y 2; dan como resultado un cambio muy rápido del potencial de membrana desde -55, el valor umbral, a +40 mV en 1 milisegundo. 4 La despolarización de la membrana también activa, pero más lentamente, canales de K+. Dada la lentitud de su activación, se los conoce como canales de K+ retardados. Se genera aquí una retroalimentación negativa (ciclo inferior de la Fig. 4). Los iones K+ fluyen al exterior y en 2 mseg. el potencial de membrana vuelve a tener un valor negativo, -75 mV. Este potencial negativo cierra los canales de K+. En pocos milisegundos, se restablece el potencial de reposo. 33 5 La despolarización de la membrana también se ve favorecida por el cierre espontáneo de los canales de Na+, fenómeno llamado inactivación (ver capítulo 3, Fig. 2). El proceso recién descrito comienza en el potencial umbral. En este potencial, la despolarización de la membrana ha activado suficientes canales de Na+ como para que la corriente de Na+ despolarizante sea levemente mayor que la corriente de K+ que fluye por los canales para este ion en la célula en reposo y que tienden a mantener a la célula en el potencial de reposo. Durante todo este proceso, sólo una pequeña proporción de iones Na+ y + K fluye a través de la membrana. Por lo tanto, el potencial de acción es una forma muy eficaz para enviar señales a grandes distancias con un mínimo de consumo del gradiente iónico existente. Una demostración de este proceso es que, con la bomba de Na+ y K+ bloqueada, es posible estimular un axón gigante de calamar miles de veces hasta observar un cambio en la concentración iónica. Durante 30 años, los electrofisiólogos midieron cambios de permeabilidad, conductancias y corrientes de iones e infirieron, a partir de estos registros, la existencia de canales y su comportamiento. Finalmente, las predicciones postuladas inicialmente por Hodgkin y Huxley –Premios Nobel 1952–, fueron avaladas por Erwin Neher (1944-) y Bert Sakmann (1942-), Premios Nobel 1991, quienes registraron la actividad eléctrica de un solo canal aislado mediante una técnica conocida como patch clamp, que revolucionó la fisiología y la biofísica de los últimos 20 años. 34 4. Los canales iónicos y su modulación por el voltaje Los canales iónicos son proteínas estructurales de las membranas biológicas que están ampliamente distribuidas en el mundo biológico y se encuentran en todas las membranas celulares. Son las puertas de comunicación entre el medio intracelular y el extracelular. Los más relevantes para la generación de señales en el sistema nervioso son los canales con selectividad, pero no exclusividad, para el paso de un tipo de ion, como los de Na+, K+, Ca2+, etc. Los canales de K+ del nervio, por ejemplo, dejan pasar el ion K+ de una manera cien veces más eficiente que el ion Na+, propiedad que se conoce como selectividad iónica. Sin embargo, no debemos considerar a los canales como simples poros acuosos selectivos y estáticos que transportan iones a enormes velocidades (100 millones de iones por segundo): algunos se abren y cierran continuamente en forma aleatoria; otros se abren o cierran por la acción de estímulos específicos como el voltaje. De ellos hemos hablado en este capítulo y, en el capítulo VII, nos referiremos a los canales que se activan por la unión de ligandos o neurotransmisores. Los canales iónicos capaces de captar estímulos del medio ambiente se encuentran cerrados la mayor parte del tiempo y, por lo tanto, impermeables a los iones. Cuando el estímulo se hace presente, la proteína sufre un cambio estructural que da como resultado un aumento en la probabilidad del canal de pasar al estado abierto, estado que permite el pasaje de los iones. La probabilidad de apertura de los canales puede incrementarse de manera sustancial debido a: 1 cambios en el potencial de membrana (denominados canales iónicos sensibles a voltaje); 2 unión de moléculas (neurotransmisores) a sitios específicos (denominados canales activados por ligandos); 3 estímulos físicos como la presión o la temperatura (denominados mecano o termo receptores). 35 Cuando un canal iónico se abre, los iones permeantes son capaces de moverse a través de él, impulsados por la suma del gradiente químico y el campo eléctrico que experimenta el ion, el gradiente electroquímico. 4.1 Registro de canales únicos en parches de membrana (patch clamp) La mayor parte de nuestro conocimiento actual sobre el funcionamiento de los canales iónicos procede del desarrollo de la técnica de pinzamiento o fijación del voltaje en parches de membrana –en inglés, patch-clamp–, introducida en 1976 por Neher y Sakmann (recuadro 7). Esta técnica permite el registro de las corrientes iónicas a través de zonas minúsculas de membranas celulares. La técnica consiste, esencialmente, en presionar la punta de una micropipeta de vidrio contra la superficie de la membrana con ayuda de un microscopio y un micromanipulador, hasta que se forme un contacto muy estrecho entre el vidrio y la membrana plasmática. El estrecho contacto impide que la corriente de iones que fluye por un canal se escape por fuera de la pipeta. El interior de la pipeta está conectado con un amplificador que registra los cambios en la corriente de iones que surgen de la apertura y cierre de los canales. Es decir, nos permite ver la expresión funcional del movimiento de una proteína (Fig. 1). 36 ELECTRODO PIPETA VIDRIO A B CANAL IONICO MEMBRANA CELULAR C MEMBRANA CELULAR DESGARRADA CORRIENTE Im [pA] CERRADO 0 -1 -2 -3 ABIERTO -4 0 20 40 60 80 100 120 Tiempo Figura 1: Esquema de la técnica de patch clamp. A: aplicada a una célula entera, B: aplicada a un parche de membrana separada de la célula. La cara interior de la membrana está expuesta al baño, C: Registro de la corriente que fluye por el canal, cuando este pasa del estado cerrado al abierto. Nótese que la duración del estado abierto varía, pero la amplitud no. 4.2 Canales iónicos sensibles a voltaje y excitabilidad celular Los canales sensibles a voltaje pueden asumir tres estados conformacionales, que son: abierto o activo, inactivo y cerrado (Fig. 2A). En el estado activo, el canal se abre y cierra repetidamente mientras dure el estimulo que lo activó, en este caso la despolarización de la membrana. El estado inactivado es el de un canal que se activó por el cambio de potencial de la membrana y que, aún en presencia del estímulo deja de pasar corriente dado que una compuerta se introduce en el canal y lo bloquea (inactiva). Hay evidencias de que un segmento intracelular de la misma proteína es la que bloquea el canal. Para que el canal pueda ser activado nuevamente, debe primero cerrarse. Para ello, la membrana debe volver a su potencial original. 37 La activación e inactivación de los canales de Na+ y la activación de los canales de K+ son la base del potencial de acción. A B DESPOLARIZACIÓN DESPOLARIZACIÓN a POTENCIAL DE MEMBRANA b EXTERIOR c INTERIOR CERRADO ABIERTO INACTIVO CERRADO Y ACTIVABLE Figura 2: A. Esquema del funcionamiento del canal Na+. Nótese que el canal tiene dos compuertas. Una es la responsable de la apertura y cierre del canal. La otra, de la inactivación. B. Registros unitarios y ensamble de la corriente de Na+. En (a) se muestra la aplicación del estímulo despolarizante. En (b) aparecen diez registros de canal único, obtenidos por sucesivas estimulaciones. En (c) se muestra la sumatoria de la actividad registrada en (b). Puede notarse que el canal se activa inmediatamente después de que se aplica la despolarización pero sólo se activa una vez, pues pasa rápidamente al estado inactivo. B: Modificado de Benzanilla and Correa, 1995. Veamos ahora cómo se comporta un canal aislado de Na+ o de K+, analizado mediante la técnica de patch clamp. Podremos luego multiplicar este comportamiento por el número de canales que tiene la membrana en estudio y reconstruir la corriente iónica total de la membrana. Finalmente, podremos estudiar las poblaciones de canales funcionando en conjunto y, de allí, derivar los cambios de potencial de la célula. Este análisis debe permitirnos reconstruir el potencial de acción. 38 Tomemos una membrana plasmática neuronal con un solo canal de Na+ en el área de registro de una pipeta de patch clamp. El potencial de membrana es establecido en su valor de reposo por un sistema electrónico, por lo tanto, no se observan corrientes ionicas en el registro. Si mediante un sistema electrónico se despolariza la membrana, se registran en forma inmediata corrientes iónicas correspondientes a la apertura y cierre del canal. En la Fig. 2B, este procedimiento se repite diez veces. Se puede observar que el canal se abre y cierra con gran frecuencia durante los primeros milisegundos y, luego, su actividad cesa, a pesar de que la membrana se mantiene despolarizada. Es decir que el canal es sensible al voltaje, pero se inactiva rápidamente. El registro inferior de la Fig. 2B muestra la sumatoria de todas estas corrientes unitarias, equivalentes a la activación de diez canales. La corriente se activa en forma transitoria y luego se inactiva. A B DESPOLARIZACIÓN DESPOLARIZACIÓN a POTENCIAL DE MEMBRANA EXTERIOR b INTERIOR CERRADO ABIERTO CERRADO c Figura 3: A. Esquema del funcionamiento del canal K+. Nótese que el canal no tiene compuerta de inactivación. B. Registros unitarios y ensamble de la corriente de K+. En (a) se muestra la aplicación del estimulo despolarizante. En (b) aparecen nueve registros de canal único, obtenidos por sucesivas estimulaciones. En (c) se muestra la sumatoria de la actividad registrada en (b). Puede notarse que el canal tarda en activarse después de la despolarización. B: Modificado de Augustine and Benzanilla, en Hille 1992. 39 Si realizamos el mismo experimento, pero con un parche de membrana en el que se encuentre un canal de K+, observaremos que la despolarización genera corrientes que van en sentido inverso –recordemos la diferente distribución iónica del ion K+. Un detalle muy importante es que los canales no se abren inmediatamente. Hay un retardo entre el estímulo y la respuesta. El otro detalle diferencial, respecto de los canales de Na+, es que no se inactivan, sino que se abren y cierran todo el tiempo, siempre que la membrana esté despolarizada (Fig. 3A, B). Cuando la membrana se repolariza, se cierran. Los canales que tomamos como ejemplo tienen un comportamiento similar a los del axón gigante de calamar. 4.3 Reconstrucción del potencial de acción Apoyándonos en las propiedades emergentes del estudio de los canales únicos, podemos reconstruir el potencial de acción. Una despolarización inicial, que puede provenir de un fenómeno sináptico, de canales mecanoreceptores o de un estímulo eléctrico que logra llevar el potencial de membrana a un valor más despolarizado, activa canales de Na+ que permiten el influjo de Na+ y, a la vez, una mayor despolarización. Este fenómeno explosivo se autoregenera y aumenta el influjo de Na+ y la despolarización. Al mismo tiempo, los canales de Na+ comienzan a inactivarse y, mientras esto sucede, entran en juego los canales de K+ dependientes del voltaje y de activación retardada (Kr). El aumento del eflujo de K+ y la inactivación de los canales de Na+ repolarizan a la membrana en su valor de reposo. 40 mV. +40 POTENCIAL DE ACCIÓN PERMEABILIDAD RELATIVA AL Na+ (entrada) 0 PERMEABILIDAD RELATIVA AL K+ (salida) -40 -80 HIPERPOLARIZACIÓN Artefacto 1 Estímulo aplicado 2 3 4 TIEMPO (mseg) PERÍODO REFRACTARIO Figura 4: Esquema del potencial de acción y las conductancias relativas que subyacen al cambio de potencial. Se indica el período refractario. El bloqueo producido por la inactivación del canal de Na+ desaparece, pero no en forma inmediata. Esto implica que, durante unos milisegundos, los canales de Na+, aun en una membrana repolarizada, no son activables. Por tanto, después de un potencial de acción, se necesita un período de milisegundos para poder generar uno nuevo. Ese tiempo es conocido como período refractario. Esta propiedad de los canales de Na+ es muy importante, ya que impide que se vuelva a generar en forma inmediata un potencial de acción, en la misma área de membrana. Luego de un potencial de acción, los canales de Na+ están inactivos por unos milisegundos, aun cuando sean despolarizados. Como consecuencia de ello, el potencial de acción no puede regresar sobre su paso y avanza en una sola dirección. 41 4.4 Estructura molecular de los canales iónicos De lo visto hasta aquí, es posible notar que han sido biofísicos y electrofisiólogos los que han dominado el campo de la generación de las señales en el sistema nervioso. No obstante, más recientemente, fueron bioquímicos y biólogos moleculares quienes han trabajado para entender las estructuras moleculares subyacentes a estas funciones. Una herramienta importante para el estudio bioquímico de los canales fue el descubrimiento y la purificación de toxinas que se unen específicamente a determinados canales (recuadro 10). Las toxinas constituyen una herramienta biológica importante que utilizan ciertos animales con el objetivo de atrapar a la presa, mediante la inyección de una sustancia que las paraliza muy rápidamente. La velocidad de acción de estos venenos generó la sospecha de que alguno de sus principios activos podría actuar sobre los canales iónicos. A partir de esa hipótesis, se investigó la presencia de sustancias activas en los venenos de serpientes, arácnidos y en animales cuya ingesta se reconoce como altamente peligrosa. Es así que fue reconocida la tetrodotoxina (recuadro 8), molécula que se une al canal de Na+ y lo bloquea de una manera muy eficiente. Si se utiliza la tetrodotoxina unida a una molécula radioactiva –que actúa como un localizador del canal– se puede purificar el canal de Na+ y, a partir de allí, conocer la secuencia de aminoácidos y armar un modelo de su conformación tridimensional en la membrana celular. 42 B A Dominio I EXTRACELULAR II III IV II III I IV COOH NH2 S4 SUBUNIDAD ALFA INTRACELULAR SUBUNIDAD BETA Figura 5: Estructura molecular del canal de Na+. A. La subunidad alfa, con sus cuatro dominios, forma el canal. Las subunidades beta son auxiliares. B. Esquema de la estructura de la subunidad alfa desplegada: muestra cada uno de sus dominios formado por seis segmentos transmembranales. Pueden verse los sitios con carga positiva, segmento 4 (S4), que indican los sensores de voltaje. De acuerdo con la estructura molecular, los canales iónicos son complejos formados por la asociación de varias proteínas llamadas subunidades. La subunidad principal, alfa, forma el canal y en ella residen las propiedades fundamentales como la selectividad y la sensibilidad al voltaje. La subunidad beta es accesoria y modula la actividad de la alfa (Fig. 5). La subunidad alfa está formada por cuatro dominios que forman el poro y el filtro de selectividad. Los dominios tienen una estructura molecular similar, formada por seis segmentos hidrofóbicos (S1-S6) embebidos en la membrana plasmática. Uno de ellos, el segmento transmembranal (S4) contiene cargas positivas que censan el voltaje de la membrana, ya que se movilizan con los cambios de potencial e inducen la activación del canal. Existen cientos de canales distintos con propiedades diversas, capaces de generar corrientes iónicas de variadas cinéticas y amplitudes. Aquí hemos descrito el canal de Na+. Los canales de K+ y Ca2+ son sus familiares directos, si bien el canal de K+ es el más primitivo. Este conjunto de canales, ubicados en forma estratégica en las células neuronales o musculares, permiten la generación de una multiplicidad de señales eléctricas que participan en la comunicación e integración de la información del sistema nervioso. 43 4.5 Canalopatías De manera simultánea con los avances realizados en el conocimiento de la estructura y función de las proteínas que forman los canales, la lista de enfermedades genéticas asociadas con ellos ha crecido rápidamente. Hoy en día, se ha descrito un número considerable de enfermedades hereditarias que resultan del funcionamiento defectuoso de los canales iónicos. Son conocidas en su conjunto como canalopatías. Un ejemplo de ellas lo tenemos en ciertos síndromes febriles de los niños, acompañados de convulsiones o pérdidas de conocimiento. Estos síndromes deben su origen a la lentificación de la inactivación del canal de Na+, que se traduce en una mayor excitabilidad de las neuronas. Alteraciones en los canales de K+ producen parálisis musculares en animales y hombres. La lista de canalopatías se extiende día a día e incluye formas de epilepsia y migraña. Recuadro 6: Hodking, Huxley y las corrientes iónicas en el axón gigante de calamar El hecho de que los cambios en la permeabilidad al Na+ generen modificaciones en el potencial de membrana y que, a su vez, este modifique su propia permeabilidad, representó un obstáculo en el estudio del mecanismo de generación del potencial de acción. Sin embargo, fue resuelto entre 1940 y 1950, con el desarrollo de una técnica que permitió mantener constante el voltaje de la membrana. La técnica –denominada fijación o pinzamiento de voltaje– consiste en la inyección de una corriente igual y de sentido contrario a la generada por la célula en estudio. Fue aplicada con éxito al estudio del potencial de acción del axón gigante de calamar. Mucho de lo que sabemos actualmente acerca de la transmisión del impulso nervioso, se lo debemos a los trabajos realizados por Alan Hodking y Andrew Huxley en Inglaterra. Estos investigadores, trabajando justo antes y después de la Segunda Guerra Mundial, utilizaron el calamar para sus experimentos. La gran ventaja de usar este animal es que posee algunas neuronas de gran tamaño, que tienen axones gigantes, visibles a simple vista (esto es, cientos de veces el tamaño de un axón de mamífero). 44 El axón aislado fue montado por el grupo inglés en una cámara con una solución acuosa extracelular. Dos electrodos fueron introducidos dentro del axón: uno para medir el potencial de membrana y otro para inyectar corriente. El electrodo que mide el potencial se conectó a un amplificador que compara el potencial de membrana con el potencial deseado, impuesto por el experimentador. Cuando estos dos potenciales son diferentes, el sistema inyecta corriente por el electrodo de corriente, hasta que el potencial de membrana y el potencial comando se equiparan. El sistema electrónico permite medir la corriente inyectada que se necesita para mantener el voltaje constante a cualquier potencial (figura del recuadro). Si se acepta que la conductancia –en este caso, sinónimo de permeabilidad– de la membrana obedece a la ley de Ohm, que determina que el voltaje es igual al producto de la corriente por la resistencia de la membrana (inversa de la conductancia), se puede considerar que la corriente iónica que fluye durante el aumento de conductancia por la apertura de los canales de Na+ está dada por la siguiente ecuación: Corriente ionica I ion = g ion (Vm- Eion) Un estudio detallado de estas corrientes permitió a Hodking y Huxley calcular cómo varían en el tiempo y a diferentes potenciales las conductancias al Na+ y K+. Por medio de esos datos, pudieron reconstruir matemáticamente el potencial de acción, como se esquematiza en la Fig. 4. En la figura de este recuadro se muestra un ejemplo de la corriente de Na+ y K+, medida cuando el potencial de membrana es llevado por el comando de -70 mV a 0 mV. Es posible notar que la corriente es muy similar a la suma de las corrientes de las figuras 2 y 3, obtenida por el ensamble de muchos canales a través de la técnica de patch clamp. Esta técnica utiliza el mismo principio de fijación del voltaje pero en un área muy restringida, lo que permite estudiar los canales de manera individual. (ver recuadro 7) 45 Figura del recuadro: Sistema electrónico para medir corrientes iónicas con la técnica de pinzamiento del voltaje, en el axón gigante de calamar. A la izquierda, el axón con dos electrodos conectados al sistema electrónico. El amplificador A registra el voltaje, el B compara el voltaje de A con el potencial “comando”, que impone el experimentador, y el C registra la corriente inyectada por B. A la derecha, se muestra un registro de la corriente inicial de Na+ y la corriente más tardía de K+, que se generan cuando el potencial de membrana del axón es llevado a un valor cercano a 0mV. Recuadro 7: Registro de los canales unitarios - Patch clamp Por los años setenta, se buscaba una prueba directa de la existencia de los canales voltaje dependientes en la membrana. Para ello fue concebido un método que permite el análisis de canales iónicos en forma individual. Este método revolucionario fue desarrollado en 1976 por Erwin Neher y Bert Sakmann. En reconocimiento por su labor, en 1991 recibieron el Premio Nobel de Medicina y Fisiología. El método de patch clamp o pinzamiento de voltaje en parches de membrana, ya explicado en el capítulo 3, permite el registro de la corriente iónica que fluye por un solo canal. Al acercar la pipeta de vidrio con suma delicadeza a la superficie de una neurona y succionar de manera tal que parte de la membrana de la neurona se adhiera al vidrio, se establece un sello de resistencia eléctrica muy elevada (109 ohms). Este sello impide la pérdida de corriente y no deja a los iones otro camino que el de atravesar la membrana por el canal iónico que allí se encuentre y cerrar el circuito eléctrico a través del amplificador conectado a la pipeta (Fig. 1A). 46 Si el electrodo es retirado de la célula, el parche de membrana se desgarra y la superficie interna de la membrana se expone a la solución del baño (Fig. 1B). Esta configuración es muy conveniente pues se puede manipular la solución a ambos lados de la membrana y se puede imponer un potencial de membrana a voluntad del experimentador utilizando las baterías del amplificador. Así, se pueden registrar las corrientes que fluyen a través de un canal único. Dado que se conoce el voltaje que se impone a la membrana y se registra la corriente que fluye por el canal, es posible aplicar la ley de Ohm para conocer su conductancia. El tiempo durante el cual circula la corriente es reflejo directo del tiempo en el que el canal está abierto. Los registros de patch clamp revelan que la mayoría de los canales varían entre dos estados que pueden interpretarse como abiertos y cerrados. El tiempo que se mantienen abiertos cambia, pero la conductancia de un canal único es la misma y permite el pasaje de más de 1 millón de iones por segundo. Recuadro 8: Toxinas y canales Dada la importancia que tienen los canales de Na+ y K+ para la excitación neuronal, no es sorprendente que un número de organismos vivos haya desarrollado toxinas específicas para los canales, como mecanismos de defensa o para capturar a la presa. Una rica colección de toxinas naturales hace blanco selectivo en los canales iónicos de neuronas y otras células. Esas toxinas tienen gran valor para la supervivencia de quienes las producen y son, además, extremadamente útiles para estudiar la función de los canales iónicos celulares. Una toxina muy conocida es la tetrodotoxina producida por el pez globo. Bloquea en forma potente y específica los canales de Na+ responsables de la generación de los potenciales de acción, paralizando a los animales que la han ingerido. La intoxicación con tetrodotoxina es un problema de salud pública importante en Japón, donde el fugu es una exquisitez tradicional. En general, se prepara y se vende en restaurantes especiales, en los que individuos entrenados y con licencia desprenden cuidadosamente las vísceras para reducir el peligro de intoxicación. La saxitoxina, un homólogo químico de la tetrodotoxina producido por dinoflagelados, tiene una acción similar sobre los canales de Na+. Los efectos potencialmente letales de la ingesta de bivalvos, que a su vez han 47 ingerido estos dinoflagelados, como puede ocurrir en la llamada “marea roja”, se debe a la potente acción de la toxina sobre las neuronas. Los escorpiones, por ejemplo, paralizan a su presa al inyectarles una mezcla potente de toxinas peptídicas. Algunas, como la caribdotoxina, bloquean específicamente canales de K+ que se activan por el voltaje y el ion Ca2+. Al estudiar el efecto de las toxinas, se distinguieron diversos tipos de canales de Ca2+ que fueron purificados y su estructura molecular, determinada. En el veneno del caracol marino conus geographus se identificaron decenas de péptidos que bloquean específicamente canales de Na+, Ca2+ y receptores a la acetilcolina. Uno de ellos, la conotoxina GVIA, bloquea los canales de Ca2+ de tipo N que se encuentran en el soma de las neuronas del ganglio de la raíz dorsal (ver Introducción, Fig. 2). Puesto que esta es la primera neurona de la vía del dolor, la toxina es utilizada en forma terapéutica, para calmar dolores intratables. Un péptido purificado del veneno de una araña americana denominado agatoxina IVA bloquea específicamente los canales de Ca2+ de tipo P que están involucrados en la transmisión sináptica de la placa neuromuscular y del SNC. 48 5. Propagación de las señales eléctricas El potencial de membrana de las neuronas fluctúa continuamente, debido a la apertura y cierre de numerosos y diferentes tipos de canales distribuidos en sus dendritas y en el cuerpo neuronal. Canales de K+ y de Ca2+ voltaje dependientes, que se activan cerca del potencial de membrana, son responsables de la generación de potenciales de acción en forma rítmica, similar a la que se observa en el músculo cardíaco. Por otro lado, en los miles de contactos sinápticos que reciben las neuronas, se liberan neurotransmisores que activan canales y generan corrientes iónicas locales. Todo ello contribuye a modificar el potencial de membrana, a conducirlo o alejarlo del valor umbral que desencadena el potencial de acción. Asimismo, debemos considerar que los cambios de potencial se propagan a lo largo de las membranas por medio de dos mecanismos: la propagación pasiva electrotónica de los fenómenos subumbrales y la activación o propagación del potencial de acción. La propagación electrotónica es un fenómeno local que se produce sin regenerarse. Al igual que cuando tiramos una piedra a una laguna, la perturbación del potencial de membrana se transmite hacia lo ancho y largo de la membrana y, a medida que se aleja del punto inicial, pierde fuerza. Este fenómeno pasivo de alteración del potencial es similar a la conducción pasiva de la electricidad a través de un cable eléctrico metálico o a la transmisión del calor de un extremo al otro que genera una barra de hierro, cuando se pone al fuego uno de los extremos. 49 ESTIMULACIÓN POR INYECCIÓN DE CORRIENTE AXÓN Reg. Reg. Reg. Reg. Reg. UMBRAL 55 mV. 65 mV. Figura 1: Propagación electrotónica. Nótese cómo la señal subumbral, generada por la inyección de corriente, decae en un punto y se vuelve lenta, en la medida en que se aleja de su sitio de origen. Si aplicamos un cambio de potencial subumbral (que no desencadena un potencial de acción) en el extremo de un axón y registramos el potencial a lo largo de todo el axón, como se ilustra en la Fig. 1, veremos que la señal original se va disipando. Cuanto más lejos esté del lugar inicial, la onda será menos encrespada y de menor amplitud. Estos cambios se deben a que la membrana va distribuyendo la carga eléctrica en su superficie. Por lo tanto, si el axón es de muy pequeño diámetro, la señal llegará más lejos, puesto que la superficie de membrana es menor. Por el contrario, si un axón es de gran diámetro, en pocos micrones la señal será disipada (ver en capítulo 7, Fig. 3 el decaimiento electrotónico de la señal sináptica). Otra particularidad de los fenómenos subumbrales es que se suman y restan, como lo hacen las ondas generadas por piedras que agitan la laguna, desde diferentes lugares y tiempos. La conducción electrotónica ofrece la ventaja de permitir la suma de los fenómenos pero, dada su gran disipación, no permite que la señal originada en un punto llegue sin distorsión a otra parte de la neurona. En cambio, la conducción sin distorsión está a cargo del potencial de acción. Su propagación se asemeja a la de la explosión de una fila de barriles de pólvora, en la que el estallido del primer barril genera la explosión del adyacente y así, sucesivamente. 50 5.1 Propagación del potencial de acción En la Fig. 2 se puede ver de qué manera el potencial de acción, que fue generado en un sitio distante, se propaga sin perder sus características ni su grado de amplitud, igual en el terminal axónico que en el sitio de iniciación. ESTIMULACIÓN POR INYECCIÓN DE CORRIENTE Reg. Reg. Reg. Reg. Reg. +40 mV. UMBRAL - 65 mV. Figura 2: Propagación del potencial de acción. Nótese cómo el potencial de acción, generado en el punto de inyección de la corriente, conserva su forma y amplitud a lo largo del axón. El potencial de acción se genera en cada punto, a lo largo del axón. Hemos visto que, durante el potencial de acción, se genera un flujo de iones Na+ hacia el interior de la célula; esto produce una despolarización local de la membrana, cercana al sitio donde se produjo el influjo de Na+. Supongamos que, por conducción electrotónica, una zona adyacente a la que generó el potencial de acción se despolariza de forma tal que se activan algunos canales de Na+. Si la corriente de Na+ es suficiente para contraponerse a la corriente de K+ generada por los canales de K+, que normalmente están abiertos en reposo, la célula comienza un ciclo de regeneración positiva que origina un nuevo potencial de acción (Fig. 3). El ciclo se repite: un potencial de acción genera la despolarización necesaria para llevar el potencial de membrana al valor umbral en un área vecina y así generar un nuevo potencial de acción. 51 DIRECCIÓN DEL POTENCIAL DE ACCIÓN FLUJO DE CORRIENTE QUE DESPOLARIZA LA MEMBRANA FLUJO DE CORRIENTE SITIO ACTIVO DE GENERACIÓN DEL POTENCIAL DE ACCIÓN Figura 3: El flujo de corriente desde el sitio de inicio del potencial de acción despolariza las zonas vecinas. Hacia la derecha, los canales de Na+ están activables; hacia la izquierda, han sido activados en forma reciente y se encuentran todavía en el estado inactivable. La despolarización de la zona inactivable no es efectiva para generar un potencial de acción. Se ha demostrado que, en las neuronas, el sitio de umbral más bajo está ubicado al comienzo del axón o donde el axón presenta una rama colateral. En ese sitio, la concentración de canales de Na+ es muy alta y, por lo tanto, una despolarización menor será suficiente para generar una corriente de Na+ capaz de desencadenar el fenómeno regenerativo (Fig. 4). 52 SINAPSIS EXCITATORIA A AXÓN DENDRITAS B CONO AXÓNICO SITIO DE INICIACIÓN DEL POTENCIAL DE ACCIÓN CORRIENTE DESPOLARIZANTE DENDRITAS CONO AXÓNICO SITIO DE INICIACIÓN DEL POTENCIAL DE ACCIÓN Figura 4: A. Sitio de iniciación del potencial de acción. B. Puede notarse la propagación del potencial de acción hacia el axón y hacia “atrás”, al cuerpo y las dendritas. A partir del sitio de iniciación, el potencial de acción se propaga en todas las direcciones, hacia delante por el axón hasta el terminal sináptico y hacia atrás, atravesando el soma e invadiendo las dendritas. La invasión del potencial de acción a las dendritas ha sido demostrada recientemente e interpretada como un mecanismo de información retrógrado de la actividad de la neurona. La sinapsis que originó la actividad en primera instancia recibe información sobre el resultado de su actividad. A su vez, el potencial de acción retrógrado despolariza la membrana de todas las dendritas y modifica el funcionamiento de los receptores postsinápticos (ver capítulo 8, receptores al NMDA). Dado este mecanismo de regeneración para la propagación, cabe preguntarse por qué el potencial de acción, una vez que llega al extremo de la neurona –por ejemplo al músculo de la pierna, a un metro de distancia del soma ubicado en la medula espinal–, no genera una nueva señal que se propague hacia su origen. Esto puede suceder de forma patológica, pero en condiciones fisiológicas normales la inactivación de los canales de Na+ 53 impone un cierto tiempo, durante el cual la membrana debe estar hiperpolarizada para poder volver a activarse. El tiempo en que el axón permanece refractario impide que el potencial de acción se propague de manera repetitiva. El proceso descrito es la forma de propagación del potencial de acción que se observa en los nervios amielínicos y en las fibras musculares (Fig. 3). La velocidad de conducción en estos nervios es de 0,5 a 10 metros por segundo. Un aumento en el diámetro del axón facilita el flujo de corriente por su interior y aumenta la velocidad de conducción, pero como contraparte, al aumentar el diámetro, aumenta la superficie de la membrana a cargar en cada punto del axón. Esta circunstancia pone un límite a la posibilidad de aumentar la velocidad de propagación en base al tamaño del axón. Sin embargo, esta limitación es superada cuando el nervio está mielinizado (Fig. 5). En ese caso, el potencial de acción se conduce a alta velocidad debido a que sectores muy largos del axón se encuentran cubiertos por membranas de otra célula, enrollada alrededor del axón como una cinta aisladora sobre un cable eléctrico. Esta estructura llamada mielina cumple la función de aislar la membrana del axón del contacto con el medio extracelular. La capa de aislante se interrumpe a intervalos, dejando sitios donde la membrana axónica entra en contacto con el líquido extracelular. En estos sitios, descritos por Louis A. Ranvier, la membrana del axón tiene una concentración muy alta de canales de Na+ (12 000 /um2). Gracias a la estructura aislante de la mielina, la despolarización en un nodo de Ranvier se conduce electrotónicamente con muy poco decaimiento al siguiente nodo. Esto permite que el potencial de acción sólo se genere en los nodos de Ranvier y es suficiente para que, saltando de nodo en nodo, la señal llegue al otro extremo del axón a una velocidad de más de 100 m/seg. 54 ESTIMULACIÓN POR INYECCIÓN DE CORRIENTE NODO DE RANVIER MIELINA Reg. Reg. Reg. +40 mV. UMBRAL - 65 mV. Figura 5: A. Flujo de corriente en un nervio mielínico. La activación de los canales de Na+ se realiza exclusivamente en los nodos de Ranvier. La corriente de Na+ fluye por los canales de Na+ de un nodo, emerge y depolariza el nodo vecino. El potencial de acción, por lo tanto, sólo se genera en los nodos de Ranvier. Los nervios amielínicos aumentan su velocidad con el diámetro. El calamar posee un axón gigante en su circuito reflejo de escape, pero en los mamíferos esta estrategia no sería aplicable, ya que la masa cerebral resultaría enorme. La solución a esta limitación es la mielinización, proceso muy importante en el desarrollo del sistema nervioso. Gran parte de los signos madurativos de los bebés humanos, durante el primer año de vida, se deben a la mielinización de los axones, que permite enviar la información de manera más veloz y, por ejemplo, mejorar la coordinación del movimiento y el equilibrio necesarios para caminar. Por otra parte, la alteración de la mielina produce patologías que disminuyen las capacidades sensoriales y motoras (recuadro 9). Recuadro 9: Esclerosis múltiple, una enfermedad desmielinizante La importancia crítica de la mielina para la transferencia de información en el sistema nervioso humano se pone de manifiesto en una enfermedad neurológica conocida como Esclerosis Múltiple (EM). 55 Los afectados por EM sufren de debilidad, falta de coordinación y alteraciones en la visión y en el habla. La enfermedad es caprichosa, generalmente marcada por remisiones y ataques recurrentes que se van sucediendo a través de los años. Las alteraciones sensitivas y motoras son consecuencia del ataque que sufre la vaina de mielina de los axones del cerebro, columna vertebral y nervios ópticos. La pérdida de mielina resulta en la disminución e incluso el bloqueo de la conducción nerviosa. Otra enfermedad desmielinizante es el síndrome de Guillain-Barré, que ataca a la mielina de los nervios periféricos que inervan el músculo y la piel. Esta enfermedad puede aparecer después de infecciones menores y vacunaciones, y parecería ser el resultado de una respuesta inmunológica anómala contra la propia mielina. Los síntomas son un resultado directo de la lentificación y/o falla de la conducción del potencial de acción por los axones que inervan los músculos. El déficit de conducción puede ser demostrado clínicamente, si se estimulan eléctricamente los nervios periféricos a través de la piel y se mide el tiempo que lleva producir una respuesta. También es posible medir la velocidad de conducción en la vía óptica, estimulando la retina de un ojo y registrando los cambios de potencial eléctrico en la corteza cerebral correspondiente. El tiempo entre la presentación del estímulo y la respuesta es indicativo de la velocidad de conducción del impulso nervioso. En la EM y en el síndrome de Guillain-Barré se observa una marcada lentificación del tiempo de respuesta, debido a que la conducción saltatoria está interrumpida. 56 6. Estructura y función de la sinapsis El cerebro contiene miles de millones de neuronas que establecen contactos sinápticos. La cantidad de contactos sinápticos entre células es muy variable; se pueden identificar miles de contactos que provienen de cientos de neuronas diferentes sobre las dendritas y el soma de una neurona motora de la médula espinal, o un solo contacto entre el axón de la neurona motora y la fibra muscular esquelética, al formar la placa neuromuscular (PNM) (Fig. 1). A B NEURONA CÉLULAS MUSCULARES Figura 1: A. La neurona recibe múltiples contactos sinápticos. B. Las fibras musculares reciben sólo un contacto sináptico de la motoneurona, que inerva un grupo de fibras musculares. La sinapsis es el punto de contacto funcional entre una neurona y otra (o célula muscular o glandular). Las células se aproximan, sin que exista continuidad entre sus membranas plasmáticas. Allí se da la transferencia de información entre la célula que emite la información (presináptica) y la que la recibe (postsináptica). De acuerdo con el mecanismo de transferencia de la información, las sinapsis pueden dividirse en eléctricas y químicas. En la sinapsis eléctrica, el impulso nervioso de la primera neurona estimula directamente a la siguiente. En la sinapsis química, la comunicación se establece por medio de la secreción de una sustancia (neurotransmisor), liberada por una neurona que actúa sobre la siguiente. 57 6.1 Sinapsis eléctricas Las sinapsis eléctricas están presentes en todos los sistemas nerviosos, incluido el humano, sin embargo, existen en menor número que las sinapsis químicas. B A - UNION ESTRECHA C NEURONA PRESINÁPTICA NEURONA POSTSINÁPTICA MEMBRANA PRESINÁPTICA MEMBRANA POSTSINÁPTICA CONEXONES Figura 2: A. Esquema de sinapsis eléctrica. B. Flujo de corriente que pasa de la pre a la postsinapsis en una sinapsis eléctrica. C. Canales intercelulares que comunican las neuronas y permiten el pasaje de la corriente iónica. La estructura de la sinapsis eléctrica, vista por medio de un microscopio electrónico, muestra un grado extremo de acercamiento entre la membrana pre- y postsináptica (Fig. 2). En uniones estrechas, las membranas están prácticamente en contacto, pero sin fusionarse. Allí se ven puentes que resultan de la interacción de seis subunidades proteicas de una y otra neurona, las conexinas, que se ensamblan formando los conexones. Los canales de los conexones son mucho más grandes que los canales iónicos. Permiten el paso de una de una gran variedad de moléculas, como el ATP, segundos mensajeros y metabolitos intracelulares de una célula a otra. 58 Asimismo, la sinapsis eléctrica permite el pasaje de la corriente iónica generada por el potencial de acción presináptico a través de los conexones. Esta corriente eléctrica genera, sin mayor retardo, un potencial de acción en la neurona postsináptica. Una característica distintiva de este tipo de sinapsis es que la transmisión resulta extremadamente rápida, ya que el pasaje de corriente de una célula a otra es prácticamente instantáneo. Otra característica es que la comunicación puede ser bidireccional, pues depende de cuál de las células en contacto reciba el potencial de acción inicial. En el sistema nervioso de los invertebrados, este tipo de sinapsis se encuentra entre las neuronas sensitivas y las motoras, que forman parte de reflejos de escape frente a situaciones de peligro. En el SNC de los mamíferos adultos, las sinapsis eléctricas son comunes entre neuronas vecinas, que deben activarse con un alto grado de sincronía. La comunicación eléctrica que se produce a través de las uniones estrechas también se las encuentra en tejidos adultos no nerviosos, como células epiteliales, músculo cardíaco y células glandulares. Por otra parte, se ha observado con mayor frecuencia la coexistencia de sinapsis eléctricas y químicas durante el desarrollo del sistema nervioso. Esto sugiere que las sinapsis eléctricas tienen un papel importante en la coordinación del crecimiento y la maduración del sistema nervioso. 6.2 Sinapsis químicas La intervención de sustancias químicas en el proceso de transmisión de mensajes de una neurona a otra da origen al nombre de este tipo de sinapsis, cuyo esquema puede verse en las Figs. 3 y 4. Se puede observar que la separación entre las membranas de las células presináptica y postsináptica es mucho mayor que en la sinapsis eléctrica y deja un espacio o hendidura sináptica. 59 B A - NEURONA PRESINÁPTICA NEURONA POSTSINÁPTICA C MEMBRANA PRESINÁPTICA HENDIDURA SINÁPTICA VESICULAS SINÁPTICAS LIBERANDO NEUROTRANSMISOR MEMBRANA POSTSINÁPTICA RECEPTORES POSTSINÁPTICOS IONES Figura 3: A. Esquema de sinapsis química, Las neuronas pre y postsinápticas están separadas por la hendidura sináptica. B. Las corrientes iónicas del potencial de acción presináptico no afectan a la postsinapsis. C. La secreción de neurotransmisor activa los receptores postsinápticos. En la sinapsis química, la parte distal del axón presináptico se ensancha y forma un botón que contiene mitocondrias para la generación de energía y pequeñas vesículas, las vesículas sinápticas, que a su vez tienen moléculas de neurotransmisor. En la porción postsináptica se encuentra una membrana celular engrosada que contiene las proteínas receptoras para el neurotransmisor almacenado en las vesículas sinápticas. El sitio de contacto sináptico puede ser una dendrita, el soma y, en algunos casos, el axón de una neurona, la superficie de la fibra muscular o una célula glandular. Desde hace más de cien años se conoce que la estimulación del nervio provoca respuestas en el músculo liso (el de los vasos y vísceras), en el cardíaco y en las glándulas. Estas respuestas surgen por la liberación de neurotransmisores químicos específicos, que actúan sobre receptores postsinápticos específicos. El 60 descubrimiento de la transmisión química revolucionó profundamente nuestra concepción acerca del funcionamiento del cerebro y estableció las bases para la comprensión de los mecanismos íntimos de la acción de los neurofármacos. 6.3 Liberación cuántica de neurotransmisor El proceso de transmisión sináptica en la sinapsis química se inicia con la llegada del potencial de acción al compartimiento presináptico. Allí se produce la conversión de la señal eléctrica en señal química. Cuando el potencial de acción llega a la sinapsis (Fig. 4), el terminal presináptico se despolariza: este cambio de potencial activa canales de calcio ubicados en sitios específicos de la membrana, cercanos al lugar donde una cantidad de vesículas sinápticas se agrupan. La activación de los canales de calcio permite la entrada de este ion al interior celular. Debe recordarse que la concentración de Ca2+ en el exterior celular es de 2 mM, mientras que la concentración en el interior se mantiene en niveles por debajo del de 0.0002 mM. Es decir que la diferencia de concentración para el ion Ca2+ es de por lo menos 10.000 veces. Por este motivo, la activación de los canales de Ca2+ permite un flujo muy importante de este ion hacia el interior del terminal nervioso, generando un cambio de concentración muy abrupto cerca de la boca interna del canal. La elevada concentración de Ca2+ dispara una serie de movimientos moleculares de proteínas asociadas a las vesículas sinápticas y a la membrana presináptica, que hace que las vesículas se fusionen con la membrana celular y liberen su contenido a la hendidura sináptica. Este proceso se conoce como exocitosis. El neurotransmisor liberado difunde por el espacio sináptico y estimula o inhibe –según qué neurotransmisor se libere– a la célula postsináptica. 61 K 1 2 Na 3 4 5 6 V SNARE T SNARE Ca 2+ ACTIVACIÓN DE LOS CANALES DE CALCIO Figura 4: Esquema de la liberación cuántica de neurotransmisor por estimulación. La llegada del potencial de acción al terminal sináptico despolariza la membrana y activa los canales de Ca2+ ubicados en los sitios activos. El Ca2+ entrante activa las proteínas del complejo SNARE e induce la fusión de la vesícula sináptica. El neurotransmisor contenido en la vesícula se difunde libremente por la hendidura sináptica. (1) Síntesis del neurotransmisor. (2) Transporte y acumulación del neurotransmisor en la vesícula sináptica. (3) La vesícula formada se acerca al sitio activo, se ubica en el sitio activo (4) donde el v-SNARE interactúa con la t-SNARE (ver recuadro 10), se fusiona (5) y se colapsa en la membrana (6). Mucho de lo que conocemos hoy acerca de la estructura y funcionamiento de la sinapsis surgió del estudio detallado de la placa neuromuscular (PNM). Es el sitio donde el nervio hace contacto con el músculo y establece una comunicación que utiliza como neurotransmisor la acetilcolina (Ac) (Figs. 1 y 5). La placa neuromuscular ha sido un modelo de estudio en los años 1950 y 1960, liderado por Sir Bernard Katz y Ricardo Miledi en Londres. Los experimentos por ellos realizados en la placa neuromuscular sentaron las bases para comprender los mecanismos moleculares de la transmisión 62 química. Los principios demostrados en la placa neuromuscular se aplican para las sinapsis del SNC. AXÓN SITIOS ACTIVOS CÉLULA DE SCHWANN VESICULAS SINÁPTICAS PRESINAPSIS HENDIDURA SINÁPTICA MEMBRANA PRESINÁPTICA FIBRA MUSCULAR MIOFIBRILLA ACETILCOLINESTERASA MEMBRANA POSTSINÁPTICA Figura 5: Ultraestructura de la placa neuromuscular de la rana. La colinesterasa se aloja en una trama de tejido conectivo que ocupa la hendidura sináptica. En la presinapsis se encuentran las vesículas sinápticas, ubicadas como ramilletes cerca de los sitios activos. Un experimento clave para la comprensión de este fenómeno surgió de observar la actividad eléctrica en la fibra muscular, justo en la zona donde se establece la sinapsis. Mediante un microelectrodo intracelular, se pudo observar que se producen, en forma aleatoria, pequeñas despolarizaciones de la fibra muscular de una amplitud cercana al 1 mV (Fig. 6A). Si en las mismas condiciones se estimula el nervio, se genera un cambio de potencial postsináptico de 20 a 40 mV de amplitud, que desencadena un potencial de acción en la fibra muscular (Fig. 6B). A la despolarización evocada por la estimulación del nervio se la denominó potencial de placa (PP) o potencial de placa evocado y a las pequeñas despolarizaciones se las denominó potenciales espontáneos miniatura (PMin). 63 A POTENCIALES MINIATURA 1 mV. 10 mseg. PLACA NEUROMUSCULAR B ESTIMULACIÓN POTENCIAL DE ACCIÓN 30 mV. POTENCIAL SINÁPTICO 5 mseg. Figura 6: Registros intracelulares de la actividad sináptica de la placa neuromuscular. A: Registros de potenciales miniatura espontáneos. B: Registro de potencial de placa evocado por la estimulación del nervio, que desencadena un potencial de acción. Katz y sus colaboradores observaron que ambas despolarizaciones, la evocada y la espontánea, se generan en aproximadamente 1 mseg y se repolarizan más lentamente; su diferencia fundamental es la amplitud. Además, ambos tipos de potenciales, los miniaturas y los evocados, son afectados por el curare, sustancia utilizada por los indios amazónicos para embadurnar la punta de las flechas, cuya acción reside en bloquear los receptores a la acetilcolina. Fundamentándose en esta información, Katz y colaboradores postularon que ambas despolarizaciones provenían de un mecanismo común. Para confirmarlo, registraron los potenciales de placa evocados por la estimulación del nervio (PP) y los potenciales espontáneos miniatura (PMin) mediante un microelectrodo inserto en la fibra muscular cercana a la PNM. Los experimentos fueron realizados sumergiendo el nervio-músculo en una solución externa de bajo contenido en Ca2+ y alto Mg2+ (este catión compite con el Ca2+ e impide que fluya por el canal). En estas condiciones, la estimulación del nervio despolariza el terminal 64 sináptico, activa los canales de Ca2+. Sin embargo, el influjo de Ca2+ está muy disminuido y, en consecuencia, se libera menos neurotransmisor y la despolarización postsináptica es de reducida amplitud. Así fue posible observar, en forma aleatoria, que la estimulación del nervio produce fallas en la generación de PP (amplitud 0 mV) y, otras veces, un PP de amplitud similar a la de los PMin (Fig. 7). Una observación importante es que los PP evocados nunca son menores en amplitud a los PMin, y que los de mayor amplitud siempre fueron un múltiplo de la amplitud de los PMin. Esta observación, seguida de un análisis estadístico minucioso, les permitió a Katz y colaboradores postular que los neurotransmisores se liberan en paquetes, cuyo tamaño mínimo o cuanta está representado por el PMin. POTENCIALES EVOCADOS MÚLTIPLES POTENCIALES EVOCADOS UNITARIOS POTENCIALES MINIATURA NÚMERO DE EVENTOS 0 1 2 3 4 5 6 mV. AMPLITUD DE LOS POTENCIALES EVOCADOS FALLAS INCUBADO EN SOLUCIÓN CON BAJA CONCENTRACIÓN DE Ca2+ Figura 7: Arriba a la izquierda, se muestran varios registros superpuestos de potenciales sinápticos evocados en un medio extracelular con bajo contenido de Ca2+ para generar respuestas de bajo contenido cuántico. La liberación está disminuida y permite ver fallas, liberaciones de 1, 2 y 3 cuantos aproximadamente. El potencial miniatura tiene una amplitud de aproximadamente 1 mV. A la derecha, un histograma de varios cientos de estímulos, donde se puede observar que los eventos tienden a ser múltiplos del evento unitario. Abajo, esquema del experimento. 65 La teoría cuántica establece que los potenciales evocados son el resultado de la liberación simultánea de cuantos o unidades como los PMin. El modelo está basado en que cada evento unitario, PMin, tiene una probabilidad de aparecer que es independiente de los demás eventos. El influjo de Ca2+ aumenta enormemente esta probabilidad, pues sincroniza los eventos individuales. Por lo tanto, el potencial de placa tendrá distintas amplitudes dadas por la suma de probabilidades de cada evento unitario, pero sus amplitudes serán necesariamente 0, 1, 2, 3, etc. veces la amplitud del evento unitario. La liberación es muy rápida; se ha calculado que el tiempo que transcurre entre el influjo de Ca2+ y la exocitosis es de sólo 200 microsegundos Para ello es importante considerar que el aumento de la concentración de Ca2+ se realiza en un espacio limitado, vecino a la boca del canal. Este tipo de liberación es característica de las sinapsis rápidas, que transmiten información fidedigna a alta frecuencia. 6.4 Vesículas sinápticas y reciclado vesicular El avance de la microscopia electrónica, que se dio en forma simultánea con los estudios electrofisiológicos, permitió descubrir las vesículas sinápticas. En ello tuvo un papel importante el Dr. Eduardo De Robertis, quien describió las vesículas sinápticas y estableció un vínculo entre estas y los fenómenos fisiológicos demostrados por Katz. De Robertis postuló que las vesículas sinápticas son el paquete de neurotransmisor responsable del evento unitario. Surge así la hipótesis, todavía no totalmente demostrada, de que la liberación de una vesícula sináptica genera un PMin. En síntesis, el potencial de acción presináptico produce un PP postsináptico, puesto que sincroniza la liberación de múltiples cuantas o vesículas sinápticas llenas de neurotransmisor. Estudios bioquímicos posteriores demostraron que las vesículas contienen el neurotransmisor. En el caso de la placa neuromuscular, cada vesícula contendría unas 10.000 moléculas de acetilcolina, número suficiente para despolarizar la membrana imitando a un PMin. Para validar la teoría cuántica vesicular, fue necesario demostrar que las vesículas sinápticas se fusionan y se reforman. El experimento que permitió proponer el primer modelo de reciclado vesicular consistió en agregarle a la solución externa que baña la preparación nervio-músculo una sustancia capaz ser reconocida al microscopio electrónico. Se utilizó la enzima peroxidasa extraída del rábano, que mediante una reacción química forma un 66 precipitado denso fácilmente distinguible con el microscopio electrónico. Hoy en día se realizan experimentos similares con sustancias fluorescentes visibles con microscopio óptico. Básicamente, la idea es poner el marcador en el medio extracelular y estimular el nervio durante varios minutos con el fin de producir la fusión de un gran número de vesículas. La sustancia marcadora es captada durante la reformación de las vesículas por un proceso inverso a la exocitosis llamado endocitosis, en el que la membrana plasmática se invagina. La porción invaginada se separa, formando una vesícula rodeada de una proteína denominada clatrina. Esta vesícula se carga de neurotransmisor para terminar como una vesícula sináptica de reserva o dispuesta a ser liberada nuevamente, si se ubica en el sitio activo. A ESTIMULACIÓN A ALTA FREQUENCIA C ESTIMULACIÓN A ALTA FREQUENCIA CAPTACIÓN POR ENDOCITOSIS PEROXIDASA B RETÍCULO ENDOPLASMICO CON PEROXIDASA VESICULA SINÁPTICA CON NEUROTRANSMISOR Y PEROXIDASA - Figura 8: Esquema representativo de la imagen al microscopio electrónico de una sinápsis neuromuscular incubada y estimulada en presencia de la peroxidasa del rábano. A. La enzima es captada por endocitosis y se ubica en los precursores de las vesículas sinápticas. B. La enzima es lavada del medio extracelular con la sinapsis en reposo. Vista a través del microscopio electrónico, la enzima sólo se localiza en las vesículas sinápticas y sus precursores. C. La sinapsis neuromuscular es nuevamente estimulada, la enzima es liberada y las vesículas y otros compartimientos internos quedan vacíos de peroxidasa del rábano. 67 Si cambiamos la solución externa por una sin marcador, sólo encontraremos el marcador que quedó atrapado en las vesículas y en los compartimientos internos de la presinapsis que participan en la reformación vesicular. Una segunda verificación de la hipótesis se obtiene si volvemos a estimular el nervio en ausencia del marcador en el medio extracelular. En este caso, el marcador vuelve al medio extracelular durante la exocitosis de la vesícula y desaparece del interior de las vesículas (Fig. 8). El reciclado vesicular en la PNM sólo se da en el terminal presináptico. Tomando en cuenta que no se han encontrado vesículas sinápticas que migren a lo largo del axón y que, con el axón separado del cuerpo de la neurona, la sinapsis puede seguir liberando neurotransmisor por horas y aún días, es posible inferir que las vesículas sinápticas se fusionan y se reforman localmente. Estudios bioquímicos demostraron que en los terminales sinápticos se encuentra toda la maquinaria para sintetizar neurotransmisores, como acetilcolina, glutamato y ácido gama amino butírico (GABA), entre otros. Sin embargo, esto no se aplica para los péptidos neurotransmisores que se sintetizan en el soma o cuerpo neuronal y que son transportados hasta el terminal sináptico. Junto con el neurotransmisor se liberan otras sustancias proteicas, que también contribuyen a los efectos postsinápticos, pero su acción es lenta y duradera y está relacionada con el trofismo, mantenimiento, sobrevivencia y desarrollo de la célula postsináptica. 6.5 El compartimiento postsináptico Cuando el neurotransmisor liberado por la presinapsis alcanza la membrana postsináptica, se combina con receptores específicos allí localizados. La unión del neurotransmisor al receptor puede: a) aumentar la permeabilidad a cationes (usualmente al Na+ y a veces Ca2+), lo que produce una despolarización llamada potencial postsináptico excitatorio (PPSE) o, en el caso del músculo esquelético, PP; b) aumentar la permeabilidad de la membrana a aniones (moléculas cargadas negativamente como el Cl-), lo que produce una estabilización del potencial de membrana o incluso una hiperpolarización, es decir, un potencial postsináptico inhibitorio (PPSI) y c) aumentar selectivamente la permeabilidad a iones de K+, lo que también resulta en una hiperpolarización o estabilización de la membrana, que en su potencial de equilibrio se comporta como un PPSI. 68 Como vemos, los efectos netos producidos por un neurotransmisor se deben a flujos iónicos pasivos, generados por el aumento de conductancia, de acuerdo con los gradientes de concentración de los iones involucrados. Los cambios de la permeabilidad de los canales a través de los cuales estos iones se desplazan están regulados por receptores especializados que se localizan en la membrana postsináptica. Los receptores son cadenas de aminoácidos que forman enlaces entre sí y crean cavidades y protuberancias que pueden alojar a sustancias que tengan la forma y carga correspondiente. El neurotransmisor funciona como una llave en una cerradura: si la llave es adecuada, entrará bien en la cerradura y podrá activarla; pero si esta llave entra sólo un poco, impedirá que otra llave entre y actuará como un antagonista. RECEPTOR IONOTRÓPICO RECEPTOR METABOTRÓPICO PROTEÍNA G Figura 9: A. Esquema del funcionamiento de receptores ionotrópicos. El neurotransmisor actúa sobre una proteína que incluye el sitio de unión y el canal. B. Esquema del funcionamiento de receptores metabotrópicos. El receptor no incluye al canal, pero incluye una proteína G que hace de segundo mensajero y actúa sobre un canal vecino. Estos receptores se conocen como receptores ionotrópicos, porque son moléculas que cumplen las funciones de receptor y canal. Existen otros receptores que se llaman metabotrópicos, porque su activación genera productos que actúan sobre otras moléculas o canales desde el interior celular (Fig. 9). La ocupación de estos receptores da lugar, en muchos casos, a la movilización del Ca2+ de reservorios intracelulares. Este Ca2+ activará diversas enzimas. Los receptores ionotrópicos se organizan en familias de proteínas con semejanzas estructurales y pequeñas diferencias que les permiten interactuar con diferentes transmisores. En esta familia encontramos los receptores a acetilcolina, GABA y glicina, entre otros. 69 Recuadro 10: Las vesículas sinápticas, preparadas para la fusión La clave para una rápida transmisión sináptica es que las vesículas llenas de neurotransmisor se posicionen en el lugar adecuado de la membrana presináptica, que permita su fusión. Esta se da cuando un potencial de acción activa los canales de Ca2+ ubicados cerca de las vesículas. El influjo de Ca2+ genera, en un espacio reducido del citoplasma, una alta concentración de Ca2+ que desencadena la fusión de las vesículas a la membrana plasmática. La unión y fusión específicas de membranas depende de la familia SNARE de proteínas, que fueron encontradas por primera vez en las levaduras. Cada péptido SNARE tiene una parte muy lipofílica que se funde en la membrana y una cola más larga que se proyecta dentro del citoplasma. Estas proteínas están tanto en la membrana del terminal presináptico como en la membrana de las vesículas sinápticas y se denominan respectivamente t-SNAREs y v-SNAREs. Las terminaciones cistoplasmáticas de estos dos tipos de SNAREs complementarios se unen fuertemente entre sí, permitiendo que una vesícula se estacione muy cerca de la membrana presináptica y en ningún otro lugar (Fig. 4). Si bien los complejos SNARE-SNARE forman la principal conexión entre la vesícula y la membrana a la que se ha de fusionar, existe un gran número de proteínas que se asocian al complejo. Las funciones de la mayoría de ellas es aún desconocida. Una de ellas, la sinaptotagmina, ha sido postulada como el sensor de Ca2+ responsable de disparar la fusión de la vesícula con la consiguiente liberación del neurotransmisor. Los canales de Ca2+ ubicados en la membrana presináptica pueden formar parte del complejo de anclaje de las vesículas. De esta manera, los canales quedan ubicados muy cerca de las vesículas, de modo que el Ca2+ entrante desencadena la liberación de transmisor en menos de 200 microsegundos. Las proteínas del SNARE pueden ser destruidas en forma selectiva por la toxina botulínica, una potente enzima que penetra en los terminales nerviosos de la placa neuromuscular. Esto produce parálisis de los músculos y muerte por falla respiratoria. Hoy en día, la toxina botulínica se aplica localmente en tratamientos de plástica facial, para eliminar las arrugas, porque paraliza la actividad de los pequeños músculos de la piel. 70 VESÍCULA SINÁPTICA SINAPTOTAGMINA V-SNARE T-SNARE CANAL DE CALCIO Ca 2+ Figura del recuadro 10. Las vesículas sinápticas poseen proteínas v-snares que al interactuar con otras proteínas ubicadas en la membrana presináptica anclan las vesículas al sitio activo donde también se encuentran canales de Ca2+. El influjo de Ca2+ actúa sobre la sinaptotagmina y esta modifica los snares tal que se induce la fusión de las vesículas a la membrana presináptica. Recuadro 11: ¿Cómo actúa el Ca2+ en la transmisión sináptica? Ya en el siglo XIX se conocía, por los trabajos de Sidney Ringer, la importancia de agregar Ca2+ a la solución externa para mantener la contracción muscular, cuando se estimula el nervio. En la gran mayoría de las sinapsis, la remoción del Ca2+ extracelular previene la liberación de neurotransmisor. Estos estudios fueron realizados en la PNM de la rana. En esta preparación, el terminal presináptico es muy pequeño y ofrece limitaciones experimentales. Katz y Miledi superaron esta dificultad al trabajar en la sinapsis gigante del ganglio estrellado del calamar. Dado el tamaño del elemento presináptico, fue posible inyectar Ca2+ dentro del terminal y observar que esto producía liberación del neurotransmisor. También fue posible modificar el potencial de membrana del terminal presináptico, despolarizándolo a un valor cercano al potencial de equilibrio para el Ca2+. En este caso no se produjo liberación, ya que si bien los canales se activaron, no existía fuerza impulsora. 71 Una variante de este experimento fue reestablecer el potencial de membrana en forma casi instantánea. Como los canales de Ca2+ se cierran mucho más lentamente que lo que el sistema electrónico tarda en reestablecer el potencial de membrana, se genera durante unos milisegundos una situación en la que los canales de Ca2+ están abiertos y una gran fuerza electroquímica impulsa al Ca2+ al interior del terminal, produciendo una rápida y masiva liberación de neurotransmisor. (Figura del recuadro). POTENCIAL DE MEMBRANA PRESINÁPTICO CORRIENTE DE CALCIO PRESINÁPTICA 0 mV +50 mV CORRIENTE DE COLA POTENCIAL POSTSINÁPTICO Figura del recuadro 11. A la derecha se observa el cambio de potencial de la presinapsis que activa las corriente de Ca2+ y estas la liberacion de neurotransmisor . A la izquierda una depolarización más intensa lleva el potencial al valor de equilibrio para el Ca2+ . No hay corrientes de Ca2+. Durante esta despolarización no hay corrientes de Ca2+ y tampoco hay liberación. Al repolarizase la membrana el influjo de Ca2+ es muy rápido y breve. En fracción de milisegundo se produce la liberación de neurotransmisor y la generación del potencial postsináptico. Modificado de Augustine et al. J of Physiology 369: 163, 1985 Esta misma preparación biológica fue utilizada para inyectar en el terminal presináptico una sustancia que se modifica su fluorescecia frente al Ca2+. Con esta técnica fue posible visualizar un aumento muy localizado de Ca2+ en la zona del sitio de liberación, cuando se estimula eléctricamente el axón (Figura del recuadro). Los experimentos descritos demostraron que el Ca2+ actúa intracelularmente y en un sitio cercano al canal y a las vesículas sinápticas. 72 POSTSINÁPSIS PRESINÁPSIS EN REPOSO PRESINÁPSIS CARGADA CON UN FURA-2 Ca 2+ alto Ca 2+ bajo PRESINÁPSIS ESTIMULADA Figura del recuadro 11. El axón de la sinapsis gigante del calamar fue cargado con una substancia cuya fluorescencia es sensible a los cambios de la concentración de Ca 2+. La estimulación del axón se acompaña con cambios de fluorescencia en el citoplasma cercano a la membrana presináptica. Modificado de Smith and Augustine, Trends in Neuroscience 11:458, 1988. Mantener una elevada concentración basal de Ca2+ en el terminal o remover lentamente el Ca2+ ingresado, permitiendo su acumulación por estímulos sucesivos, posibilita modular la fuerza de la transmisión sináptica. 73 7. Los neurotransmisores y su ciclo En el sistema nervioso, las neuronas se comunican entre sí por medio de la liberación de sustancias químicas que son llamadas neurotransmisores. Estos son capaces de estimular o inhibir el funcionamiento de otra célula de manera rápida o lenta (desde milésimas de segundo hasta horas o días), por medio de la ocupación de receptores específicos. Pueden actuar localmente o difundirse por la sangre, como una hormona, o por los tejidos, como un gas. Una misma sustancia puede tener efectos diferentes sobre las estructuras postsinápticas. El efecto depende del tipo de receptor postsináptico presente: por ejemplo, la acetilcolina excita la PNM, pero inhibe al corazón. Los neurotransmisores cumplen un ciclo: 1 son sintetizados y empaquetados en vesículas en las células presinápticas; 2 son liberados de la célula presináptica y se unen a receptores de una o más células postsinápticas; 3 son removidos o degradados rápidamente. La cantidad y diversidad de neurotransmisores supera el centenar. Pueden ser pequeñas moléculas neurotransmisoras que median respuestas rápidas o péptidos, cuyas respuestas son más lentas. La alteración en la actividad de los neurotransmisores es la base de muchas enfermedades neurológicas y psiquiátricas, y su manipulación farmacológica es una de las principales herramientas terapéuticas. 7.1 Identificación del neurotransmisor La hipótesis de que la información eléctrica puede ser transferida de una neurona a la siguiente mediante una señal química fue intensamente estudiada y debatida en las primeras décadas del siglo XX. En ese entonces se estudiaban las acciones de ciertos jugos o sustancias sobre el sistema nervioso. El médico británico Sir Henry Dale (1875-1968) descubrió una sustancia, hoy conocida como acetilcolina, que cuando es aplicada sobre las neuronas del sistema nervioso autónomo tiene un efecto inhibitorio sobre el corazón. 74 La idea de la transformación de la información eléctrica en química surgió de un experimento realizado en 1921 por el alemán Otto Loewi (18731971). El experimento consistió en aislar en diferentes cámaras dos corazones de rana, incubarlos en una solución salina similar y contar el número de latidos por minuto de cada uno (Fig. 1). Una vez establecido el valor de frecuencia de latidos por minuto, Loewi estimuló eléctricamente el nervio vago, que inerva uno de los corazones. Dicha estimulación produjo una lentificación de la frecuencia cardíaca. Otto Loewi incubó el segundo corazón no estimulado con el líquido del primer corazón y observó nuevamente una lentificación de la frecuencia del segundo corazón. Dedujo que la estimulación eléctrica había liberado alguna sustancia que denominó Vagusstoff. Años más tarde, el científico mostró que se trataba de la acetilcolina (Ac). Esta molécula es uno de los neurotransmisores más estudiados, que además de actuar sobre el corazón, lo hace sobre una variedad de blancos en el SNC y en la PNM. ESTIMULACIÓN DEL NERVIO VAGO FREQUENCIA CARDÍACA CORANZÓN 1 CORAZÓN 2 FREQUENCIA CARDÍACA Figura 1: Esquema experimental utilizado por Otto Loewi en 1921. El corazón 1 es estimulado a través del nervio vago. La estimulación del nervio del corazón 1 genera bradicardia en ambos corazones. 75 A lo largo del siglo XX se descubrieron e identificaron numerosos neurotransmisores. Dada la dificultad en establecer cuándo una sustancia es neurotransmisora, se definieron criterios a cumplimentar que, aun hoy en día, no son fáciles de demostrar en cada uno de los candidatos a neurotransmisor. Criterios que definen un neurotransmisor: A) Se debe demostrar la presencia del transmisor en los terminales presinápticos y en las neuronas de donde estos terminales provienen. Con la sección o lesión de una vía o núcleo neuronal, el transmisor debe desaparecer del sitio donde se encuentran sus terminales. B) Se tienen que identificar los componentes necesarios para la fabricación (enzimas, precursores, metabolitos, etc.), transporte (si es que se producen en el soma neuronal para ser liberados en el nivel de los terminales) y eliminación, una vez liberados. Sin embargo, esta identificación no es suficiente, pues neurotransmisores como el glutamato y la glicina son utilizados para otras funciones celulares y, por lo tanto, podrían cumplir este requisito pero no ser liberados para transferir información. C) El transmisor debe liberarse del terminal presináptico por despolarización y de una manera dependiente del Ca2+ extracelular. Esto implica que la liberación de neurotransmisor por el terminal presináptico, en respuesta a la estimulación eléctrica, requiere la activación de canales de Ca2+ y el influjo de este ion al terminal presináptico. D) En la célula postsináptica deben estar presentes receptores específicos a la sustancia candidata a neurotransmisor. Una forma de establecer la existencia de receptores específicos es mostrar que, cuando la molécula propuesta es aplicada por el experimentador, tiene un efecto similar a la liberada por la estimulación nerviosa. Un ejemplo de identificación de un transmisor lo constituye la acetilcolina en la PNM. La estimulación del nervio motor libera acetilcolina. Existen mecanismos para la síntesis, almacenamiento y recaptación de sus metabolitos en el nivel presináptico; el músculo contiene receptores específicos para la acetilcolina. Los efectos de la estimulación nerviosa o los de la aplicación externa de esta sustancia dan lugar a los mismos cambios iónicos en el nivel de la fibra muscular y, además, existen las enzimas necesarias para su metabolismo. En el caso del SNC, el problema se complica por la gran densidad de neuronas y, sobre todo, de terminales. Estudios recientes indican que un terminal puede contener varios tipos de transmisores, los cuales pueden liberarse, lo que depende de la frecuencia de estimulación presináptica. Otros 76 estudios han postulado que distintos neurotransmisores comparten las mismas vesículas sinápticas. En los años 1950, los neurotransmisores reconocidos eran, además de la acetilcolina, la epinefrina, la dopamina y la serotonina. Luego se confirmaron como neurotransmisores los aminoácidos glutamato, aspartato, GABA y glicina y, más tarde, la norepinefrina y la histamina. Hoy en día se consideran neurotransmisores el ATP y sus derivados, como la adenosina y el AMP. A partir de los años 1970, se reconocieron como neurotransmisores un gran número de polipéptidos y sustancias gaseosas, como se puede ver en el siguiente cuadro: Moléculas pequeñas acetilcolina dopamina norepinefrina histamina serotonina ATP otros Aminoácidos Péptidos ácido gamma-amino butírico (GABA) glicina glutamato aspartato bradiquinina colecistoquinina enkefalina sustancia P calcitonina neuropéptido Y otros Gases óxido nítrico monóxido de carbono 7.2 Síntesis, almacenamiento, liberación y remoción del neurotransmisor Una transmisión sináptica efectiva requiere del control de la concentración de neurotransmisor que actúa sobre la célula postsináptica. Por lo tanto, las neuronas tienen mecanismos altamente regulados para la síntesis, empaquetamiento, liberación y degradación de los neurotransmisores. Estos procesos requieren de numerosas enzimas que se encuentran, específicamente, en las neuronas que utilizan ese neurotransmisor en sus sinapsis. En general, la síntesis de los neurotransmisores molecularmente pequeños se realiza en los terminales presinápticos. Las enzimas para este proceso son sintetizadas en el cuerpo neuronal y transportadas por el axón hacia el terminal. Las enzimas sintetizadoras generan un reservorio de neurotransmisores en el citoplasma del terminal. Finalmente, un mecanismo de transporte toma el neurotransmisor del citoplasma y lo incorpora a la vesícula sináptica. 77 En contraste con este mecanismo, la síntesis y empaquetamiento de los neuropéptidos se realiza en el cuerpo neuronal como polipéptidos más largos, que son procesados por el aparato de Golgi y finalmente empaquetados en vesículas. Estas son transportadas por un sistema rápido que utiliza la energía y las proteínas del citoesqueleto, que hace las veces de vías de ferrocarril (Fig. 2). CUERPO NEURONAL BOTÓN SINÁPTICO AXÓN VESÍCULAS CLARAS APARATO DE GOLGI NEUROPÉPTIDOS Figura 2: Los neuropéptidos se sintetizan en el aparato de Golgi, en el soma neuronal, y son transportados a los terminales sinápticos. Las vesículas claras se forman en el terminal sináptico. Asimismo, los neurotransmisores son empaquetados en vesículas que se acumulan en los terminales sinápticos. Los neurotransmisores pequeños lo hacen en vesículas de 60 nanómetros de diámetro, que con el microscopio electrónico se las ve claras. Los neuropéptidos están empaquetados en vesículas de 250 nanómetros de diámetro, con un centro que se ve electrodenso en el microscopio electrónico. Las vesículas que contienen aminas son en general densas, pero de tamaño más dispar, puesto que dependen de la neurona. La liberación del neurotransmisor se da por fusión de la membrana de la vesícula sináptica con la membrana plasmática. Las vesículas claras generalmente están ubicadas en los denominados sitios activos, que son aquellos donde se concentran los canales de calcio que intervienen en este proceso, sumados a otras proteínas presinápticas, destinadas a ensamblarse con las proteínas específicas de las vesículas. La liberación es muy rápida: se 78 calcula que el tiempo que transcurre entre el influjo de Ca2+ y la exocitosis es de sólo 200 microsegundos (ver capítulo 5, recuadro 10). Las vesículas densas se encuentran dispersas por el terminal y, por lo general, no tienen un sitio claramente definido para su liberación. El proceso de liberación es lento; se necesita una ráfaga de impulsos nerviosos que active durante un tiempo considerable los canales de Ca2+, con el objeto de producir un aumento global de la concentración de Ca2+ intracelular e inducir la fusión de las vesículas. Luego de ser liberado al espacio sináptico, el neurotransmisor se difunde por él y se une al receptor postsináptico, generando la señal en la célula postsináptica. Con el fin de limitar su acción, el neurotransmisor debe ser removido del espacio sináptico. Para ello existen mecanismos específicos, al que se les suma la difusión de la sustancia al espacio extrasináptico. En algunos casos, una enzima destruye el neurotransmisor y, en otros, un transportador lo incorpora al interior de la neurona presináptica o a la célula de la glía que forma parte de la estructura sináptica. La combinatoria de estos mecanismos asegura que en pocos milisegundos el neurotransmisor desaparezca de la hendidura sináptica y así permita restablecer el ciclo de liberación. A continuación, describimos el ciclo de tres neurotransmisores: la acetilcolina, el glutamato y el GABA, porque consideramos que son representativos y que están involucrados en el arco reflejo que hemos planteado como marco en este libro. 7.3 La acetilcolina (Ac) y la sinapsis colinérgica Ya hemos visto el papel que tuvo la acetilcolina en la transmisión neurohumoral (recordemos los experimentos de Loewi en la década de 1920). En la actualidad, está bien establecido que la acetilcolina es el transmisor en el nivel de la unión neuromuscular y en muchas áreas del SNP y el SNC. La acetilcolina se elabora a partir de la colina (Fig. 3), cuyo origen habitualmente es la dieta y la acetil-coenzima A, que proviene del metabolismo de la glucosa. La enzima que une estas dos moléculas para producir acetilcolina es la colina-acetiltransferasa. La presencia de colina-acetiltransferasa en una neurona es un fuerte indicio de que es una neurona colinérgica. A diferencia de otros neurotransmisores, la actividad de la acetilcolina no es modulada por al recaptación de la molécula. Una poderosa enzima, la acetilcolinesterasa (Acasa), destruye la acetilcolina a gran velocidad. Se ha calculado que una molécula de Acasa es capaz de hidrolizar a colina y acetato 5.000 moléculas de Ac por 79 segundo. En la placa neuromuscular, la Acasa está anclada en la hendidura sináptica y actúa degradando la acetilcolina liberada por el terminal presináptico en muy pocos milisegundos. Los nervios colinérgicos tienen, en la presinapsis, transportadores de colina muy eficientes, lo que permite mantener una producción constante y alta de Ac. Muchos insecticidas y algunos gases utilizados en situaciones de guerra deben sus acciones a los efectos antagónicos irreversibles sobre la Acasa. + COLINA ACETILCOLINA + RECEPTOR MUSCARÍNICO AcCoA MITOCONDRIA Ca2+ COLINA + ACETATO ACETILCOLINA ACETILCOLINESTERASA RECEPTOR NICOTÍNICO Figura 3: Esquema de una sinapsis colinérgica. 7.4 Aminoácidos excitatorios e inhibitorios El sistema nervioso contiene gran cantidad de aminoácidos extremadamente activos para lograr el funcionamiento neuronal. Durante muchos años no se sabía si estas sustancias eran activas en sí o sólo representaban precursores de proteínas (recordemos que todas las proteínas están hechas de aminoácidos). Ahora sabemos que estas pequeñas moléculas son las principales responsables de la transmisión nerviosa rápida en el sistema nervioso. 80 El glutamato es el neurotransmisor excitatorio más importante del SNC. Se estima que el 50% de las sinapsis excitatorias son glutamatérgicas. El glutamato se sintetiza a partir de la glutamina, que es liberada por las células de la glía (Fig. 4). Esta llega al terminal presináptico y es metabolizada a glutamato por la enzima glutaminasa. Luego de su incorporación a las vesículas sinápticas mediante transportadores específicos, el glutamato se libera a la hendidura sináptica, es captado por las células de la glía y recaptado por el terminal presináptico, culminando así el ciclo glutamina-glutamato. GLUTAMINA GLUTAMINASA GG GLUTAMATO RECEPTOR METABOTRÓPICO Ca2+ GLÍA GLUTAMATO RECEPTOR METABOTRÓPICO RECEPTOR AMPA RECEPTOR NMDA Figura 4: Esquema de una sinapsis glutamatérgica. Está demostrado que la concentración excesiva del glutamato en el espacio sináptico provoca la muerte de las neuronas. Por lo tanto, eliminar su acción mediante antagonistas es una forma de proteger las neuronas de su efecto tóxico. La mayoría de las neuronas inhibidoras del cerebro y la médula espinal utilizan el GABA o la glicina como neurotransmisores. El GABA se forma a partir del glutamato (Fig. 5); la enzima que hace esta conversión es la 81 glutamato-descarboxilasa, que necesita de vitamina B6 para su funcionamiento. El GABA es recaptado por el propio terminal o simplemente se difunde por la hendidura sináptica y se diluye en el espacio extracelular. GLUTAMATO- DESCARBOXILASA GG GABA MITOCONDRIA RECEPTOR GABA B Ca2+ GABA RECEPTOR GABA B RECEPTOR GABA A Cl- Cl- Figura 5: Esquema de una sinapsis gabaérgica. Puede notarse que activa canales de Cl-. El otro neurotransmisor inhibidor de importancia, particularmente en el tallo cerebral y la médula espinal, es la glicina. Su efecto es similar al del GABA. Esta inhibición puede ser antagonizada por la estricnina, que es una sustancia convulsivante. El GABA y la glicina son removidos del espacio sináptico por mecanismos similares al del glutamato, que involucran a transportadores en la células de la glía y en la neurona presináptica. 82 8. Los receptores y la generación de potenciales sinápticos en la placa neuromuscular Al unirse a las proteínas llamadas receptores, los neurotransmisores evocan respuestas eléctricas en la célula postsináptica. Los receptores modulan la apertura o cierre de canales iónicos y generan señales eléctricas que regulan la actividad neuronal. La acción excitatoria o inhibitoria de estos receptores está determinada por el tipo de canal iónico activado. Por lo tanto, los receptores en la sinapsis son los intermediarios en la transferencia de información química a eléctrica. Como dijimos, los receptores son proteínas que se encuentran en la membrana postsináptica; su estructura se extiende de una cara de la membrana a la otra y, por lo tanto, asoman a la hendidura sináptica. La parte de la molécula que mira a la hendidura sináptica posee el sitio de unión para los neurotransmisores. Hay dos tipos de receptores para neurotransmisores (ver capítulo 5, Fig. 9). En un caso, el receptor es un canal iónico y, en otro, el receptor está separado del canal iónico. Los del primer tipo son los receptores ionotrópicos y dan origen a cambios postsinápticos rápidos y de corta duración. Los segundos corresponden a la familia de los receptores metabotrópicos: afectan a los canales iónicos en forma indirecta, por la activación de una molécula intermediaria llamada proteína G, que libera péptidos que se difunden por el interior celular o por el plano de la membrana plasmática y se unen a los canales, regulando su actividad. Para analizar el mecanismo de generación de la señal eléctrica a partir de la interacción del neurotransmisor con su receptor, tomamos como modelo la placa neuromuscular, en la que la acetilcolina liberada por el terminal presináptico actúa sobre los receptores a la acetilcolina (RAc) de la membrana postsináptica. Los RAc se encuentran densamente compactados en la membrana postsináptica, enfrentando los sitios activos de la membrana presináptica. Los RAc son ionotrópicos sensibles a la nicotina. 83 Asimismo, existen los RAc metabotrópicos, llamados muscarínicos, que son bloqueados por la atropina. Estos receptores se expresan en los músculos internos del ojo, donde la aplicación de unas gotas de atropina produce la dilatación de la pupila, práctica común en la oftalmología. En un experimento clásico realizado en los años 1950 en la PNM del músculo de la rana, se utilizó una micropipeta para aplicar una cantidad muy pequeña de Ac en distintos sitios, a lo largo de la membrana de la fibra muscular (Fig. 1). Dado que la fibra muscular de la rana puede tener varios centímetros de longitud, es posible aplicar la acetilcolina localmente sobre la sinapsis o en zonas alejadas de la misma. Asimismo, es posible registrar simultáneamente los cambios de potencial generados por esta aplicación, si se usa un microelectrodo inserto en la fibra muscular ubicada cerca del sitio de aplicación de la Ac. Cuando la Ac fue aplicada sobre la zona sináptica, se observó una despolarización de la fibra muscular que, dependiendo de su amplitud, podía o no generar un potencial de acción. Cuando la aplicación se realizó lejos de la zona sináptica, no se observó respuesta, lo que indica que no hay receptores a la Ac en las zonas extrasinápticas de la fibra muscular. NERVIO APLICACIÓN DE ACETILCOLINA 2 mV. ZONA SINÁPTICA ZONA EXTRASINÁPTICA Figura 1: La aplicación de acetilcolina mediante un pulso de corriente sólo genera una respuesta en la zona sináptica que indica la ubicación de los receptores. 84 En los siguientes experimentos, con el objetivo de evitar que el registro del potencial de acción tape el registro de los fenómenos sinápticos se eliminó el primero mediante el agregado de tetrodotoxina que bloquea de canales de Na+ voltaje dependientes. En la Fig. 2 se observa un clásico experimento, en el que la pipeta de aplicación de Ac se ubica a pocos micrones de distancia de la membrana postsináptica. La despolarización es muy rápida y de decaimiento lento; remeda un potencial de placa evocado por la estimulación del nervio que indica que la aplicación de Ac con una pipeta es equivalente a la liberación de Ac por la estimulación del nervio. ESTIMULACIÓN APLICACIÓN DE ACETILCOLINA 2 mseg. 2 mV. ESTIMULACIÓN DEL NERVIO APLICACIÓN DE ACETILCOLINA Figura 2: Comparación de la respuesta por estimulación nerviosa y por aplicación de acetilcolina a través de la micropipeta. Nótese que es posible obtener respuestas similares en tiempo y amplitud. ¿Dónde se origina la respuesta eléctrica? Al cambiar de lugar el microelectrodo de registro, se puede comprobar en qué zona de la membrana se origina la respuesta a la Ac. Cuando se inserta el microelectrodo de registro lejos de la zona sináptica, la despolarización es de menor amplitud y su curso temporal más lento (Fig. 3). Esto es lo que se espera de una señal generada que se propaga electrónicamente decayendo a medida que se aleja 85 de su fuente de origen, como las ondas sobre la superficie del agua, a las que ya nos hemos referido (capítulo 4, Fig. 1). TETRODOTOXINA EN EL BAÑO c b a 2 mV. c b a DECAIMIENTO ELECTROTÓNICO DE LA RESPUESTA SINÁPTICA Figura 3: Registro del potencial sináptico a distancias crecientes (a –c), evocado por la estimulación del nervio o por la aplicación de acetilcolina. Puede notarse que la señal disminuye de tamaño y se lentifica, a partir de la distancia del sitio de origen. La unión de la Ac con los receptores postsinápticos activa los canales iónicos. Esto puede ser estudiado con detalle usando la técnica de patch clamp, que permite ver en tiempo real la corriente iónica que atraviesa uno de los canales iónicos activados (Fig. 4). Esta corriente es el resultado de la continua apertura y cierre del canal. 86 REGISTRO DE PATCH CLAMP ACETILCOLINA PIPETA DE VIDRIO ACTIVACIÓN POR ACETILCOLINA RECEPTOR A LA ACETILCOLINA 5 mseg. Figura 4: Esquema de un registro de la actividad unitaria del RAc, mediante la técnica de patch clamp. Nótese que, para tener acceso al receptor, la acetilcolina está en la solución interior de la pipeta. Fisiológicamente, en la PNM la liberación de Ac es de muy breve duración. Los potenciales espontáneos miniatura tienen una duración de pocos milisegundos y una amplitud cercana a un mV. Se acepta que un PMin se genera a partir de la Ac liberada por la fusión espontánea de una vesícula sináptica con la membrana presináptica. Las moléculas neurotransmisoras activan los receptores por una fracción de milisegundo; luego de la activación, la Ac es degradada o se difunde fuera de la hendidura sináptica. Este fenómeno se multiplica varias decenas de veces para la generación del potencial de placa (ver capítulo 5, Figs. 6, 7 y 8). El potencial de acción que llega al terminal presináptico produce en forma sincrónica la fusión de decenas de vesículas y, por lo tanto, libera en forma simultánea decenas de miles de moléculas de Ac que activan miles de receptores. La activación está muy bien sincronizada y por eso se produce una despolarización muy rápida de la membrana postsináptica, que llega a su máximo en un milisegundo. La repolarización es más lenta, dura de 5 a 10 mseg. Esta fase es más lenta debido al cierre de los canales, a la remoción rápida de la Ac por la hidrólisis de la Acasa y por difusión hacia fuera de la hendidura sináptica. A principios de 1950, los esposos Takeuchi, una pareja de investigadores japoneses, estudiaron las respuestas sinápticas a distintas concentraciones de Na+, K+ y Cl- en el medio extracelular. Observaron que las respuestas variaban significativamente cuando se reemplazaba el ion Na+ por una molécula inerte. También notaron que los cambios en la concentración de K+, 87 pero no de Cl-, afectaban los potencial sinápticos. En consecuencia, ellos postularon que la aplicación de Ac aumenta la permeabilidad al Na+ y al K+ y es este aumento de permeabilidad el fenómeno subyacente a la despolarización que se observa cuando se estimula el nervio. En la Figura 5 se registra el potencial sináptico evocado por la estimulación del nervio; simultáneamente, se modifica el potencial de membrana de la fibra muscular. Se observó que la respuesta sináptica se revertía, cuando el potencial de membrana de la fibra muscular era llevado a valores cercanos a 0mV. Si recordamos el principio de potencial de equilibrio para un ion, encontramos una aparente discrepancia, ya que ningún ion tiene un potencial de equilibrio cercano a 0mV. En años más recientes, se repitieron estos experimentos registrando la actividad de un RAc aislado con la técnica de patch clamp. Se pudo observar que, cerca del potencial de reposo, son los iones de Na+ los que fluyen por el canal del RAc pero, a medida que nos alejamos del potencial de reposo y, por lo tanto, del potencial de equilibrio del K+, este último ion también fluye por el RAc pero en sentido contrario, de tal manera que a 0 mV ambas corrientes son iguales y de sentido contrario. Si bien el canal activado por la Ac es permeables al Na+ y al K+, el potencial de placa es generado mayoritariamente por una corriente de Na+, pues el potencial de reposo está muy alejado del potencial de equilibrio para el ion Na+ y, por lo tanto, tiene fuerza química y eléctrica que lo impulsa. Contrariamente, el ion K+, por estar cerca de su potencial de equilibrio, no tiene una fuerza impulsora significativa (Fig. 5B). 88 A B CORRIENTES DE Na K+ +55 mV 0 mV -30 mV -90 mV Figura 5: A. Registro de potenciales sinápticos evocados por la estimulación del nervio a distintos potenciales de membrana de la fibra muscular. Nótese que el potencial sináptico es nulo, cercano al 0mV, y tiene una polaridad invertida a valores positivos de potencial de membrana. B. Registros esquematizados de patch clamp. Las corrientes unitarias también se revierten cerca de 0mV. Las flechas indican la participación de las corrientes iónicas de Na+ y K+ en cada potencial de membrana. Un estudio detallado de las corrientes generadas en distintos potenciales permitió estimar que, en condiciones fisiológicas, el RAc activado es permeable al Na+ y al ion K+ en una proporción 1/0.8. Por lo tanto, el potencial de equilibrio de la respuesta a la Ac –0mV– puede estimarse en base a la corrientes iónicas de K+ con un potencial de equilibro de –80 mV y de la corriente iónica de Na+, con un potencial de equilibrio de + 40 mV, ponderado por la permeabilidad relativa del canal para cada ion. Por otro lado, estos experimentos son extensibles a sinapsis tanto excitatorias como inhibitorias. Un principio general que surge de ellos es que la unión de neurotransmisores con los receptores postsinápticos produce cambios en el flujo de iones y esto cambia el potencial de membrana. El 89 sentido y la amplitud de esos flujos dependen de los iones involucrados. Veremos que la activación de receptores inhibitorios responde a la activación de canales de K+ o de Cl-, cuyo potencial de equilibrio es generalmente más negativo que el potencial de membrana, lo que produce un potencial sináptico hiperpolarizante. El potencial de placa o potencial sináptico en la PNM es considerado excitatorio, puesto que activa canales iónicos que despolarizan el potencial de membrana. En condiciones fisiológicas, el potencial evocado despolariza la membrana postsináptica en 30 a 40 mV y lleva el potencial de membrana a valores suficientemente despolarizados como para activar los canales de Na+ voltaje dependiente y así disparar el potencial de acción; éste, a su vez, impulsa la contracción muscular (ver capítulo 5, Fig. 6). La alfabungarotoxina, una toxina extraída de una serpiente de Malasia, fue uno de los primeros péptidos que se descubrió que se unen al RAc y lo bloquean con alta especificidad. La serpiente utiliza la toxina para paralizar rápidamente a su presa. Por su parte, los científicos la utilizaron para purificar y estudiar la estructura molecular del RAc. La alfabungarotoxina fue purificada y luego bioquímicamente unida a una molécula de iodo radioactivo. La bungarotoxina marcada, que se une en forma irreversible al RAc, sirvió para identificar al RAc durante las fases de purificación. Como fuente para purificar al RAc, se utilizó un órgano eléctrico que se encuentra en peces y anguilas eléctricas. El nervio que activa ese órgano libera acetilcolina, que estimula las células musculares modificadas (no contráctiles) que conservan en su membrana una altísima concentración de receptores. Hoy conocemos que el RAc nicotínico está formado por cinco subunidades que se asocian en la membrana para formar un canal (Fig. 6). Cada subunidad está formada por una proteína que atraviesa cuatro veces la membrana con el objeto de construir la pared del canal iónico y una larga porción extracelular que forma el sitio de unión de la Ac. Las subunidades no son idénticas, pero todas tienen la misma estructura general. El pentámero está formado por dos subunidades α idénticas, que contienen cada una un sitio de unión para la Ac, y por las subunidades β, γ y ε. Algunas de estas subunidades se modifican desde la edad fetal a la adulta y cambian las propiedades del canal. En la Fig. 6 se puede apreciar la íntima ligazón entre el sitio de unión o receptor y el canal iónico. La ligazón es, sin duda, importante para la rapidez de la respuesta. En las neuronas del SNC, el RAc también es un pentámero, pero sólo comparte con la PMN algunas subunidades. 90 ACETILCOLINA RECEPTOR A ACETILCOLINA CERRADO ABIERTO Figura 6: Esquema de la estructura pentamérica del RAc. Es necesario que dos moléculas de acetilcolina se unan a los sitios específicos para que el canal pase al estado abierto. El RAc nicotínico que aquí se describe sirvió como molde para el estudio de otros receptores o canales iónicos sensibles a ligandos. Se pudo determinar que los receptores de las sinapsis rápidas, tales como el receptor al glutamato, GABA y glicina, son estructuras pentaméricas similares a la descripta. La purificación y reconocimiento molecular del Rac sirvió para entender los mecanismos de algunas patologías neuromusculares, como la miastenia gravis (recuadro 12). Recuadro 12: El factor de seguridad y la miastenia gravis Un concepto importante para comprender la base de las alteraciones en la transmisión neuromuscular es el factor de seguridad en la transmisión neuromuscular. Este factor se define como la relación entre la amplitud de potencial de placa generado por la activación de los receptores colinérgicos y la despolarización necesaria para generar un potencial de acción en la fibra muscular. Si el potencial de placa lleva el potencial de membrana al umbral, se generará un potencial de acción y luego vendrá la contracción. En este caso, no existirá manifestación clínica de debilidad. En el caso de que el potencial de placa no despolarice la membrana lo suficiente como para llevar el potencial de membrana al valor umbral y 91 activar los canales de Na+ que generan el potencial de acción, este no se desencadena y no se desarrolla actividad mecánica. El factor de seguridad depende principalmente de la cantidad de Ca2+ que ingresa al terminal presináptico, el número de vesículas que se fusionan, la cantidad de Ac que liberan, la actividad de la acetilcolinesterasa y la densidad de receptores postsinápticos. Los enfermos de miastenia gravis (MG) presentan fundamentalmente debilidad muscular, que puede llevarlos a la dificultad respiratoria y al peligro de muerte. La MG es causada por auto-anticuerpos dirigidos contra el RAc de la membrana postsináptica de la fibra muscular. Estos anticuerpos determinan la pérdida de RAc funcionales, porque su unión con el receptor induce a la célula a degradarlo más rápidamente. Como consecuencia de ello, el potencial de placa se reduce en amplitud, no despolariza la membrana al potencial umbral y la transmisión neuromuscular falla, generando debilidad. El uso de drogas que bloquean la actividad de la enzima colinesterasa permite incrementar la cantidad y el tiempo de permanencia de la Ac en la hendidura sináptica y activar varias veces los escasos receptores. Con ello, se logra aumentar el potencial de placa y restaurar la transmisión sináptica. Esta es la terapia más común que se aplica a estos pacientes. La intoxicación con curare, veneno del que se habló anteriormente, produce un bloqueo temporario de los RAc que puede llevar a la parálisis y muerte por falla respiratoria. Drogas similares al curare se utilizan para la relajación muscular necesaria en una cirugía. 92 9. Potenciales excitatorios e inhibitorios. Integración neuronal de la actividad sináptica El estudio de la transmisión sináptica en una neurona del SNC brinda la posibilidad de comprender la diversidad de mecanismos que, en conjunto, permiten modular la actividad neuronal. En particular, nos permite comprender de qué manera los mecanismos de señalización básicos del sistema nervioso, como el potencial de acción y los potenciales sinápticos, se integran en el nivel celular. En términos generales, se puede decir que los potenciales postsinápticos alteran la probabilidad de que un potencial de acción pueda generarse en la célula postsináptica. Si el potencial postsináptico aumenta dicha probabilidad, se lo denomina potencial postsináptico excitatorio (PPSE), si la disminuye, el potencial postsináptico es inhibitorio (PPSI). En la mayoría de los casos, la despolarización es insuficiente para generar un potencial de acción, pero la suma de varios estímulos excitatorios lo puede hacer posible. En el caso de un PPSE por glutamato, la despolarización resulta, al igual que en el caso del RAc, de corrientes de Na+ y K+. 9.1 Sinapsis excitatorias En la PNM de los vertebrados, el potencial de placa generado por la liberación de Ac es de amplitud suficiente como para desencadenar un potencial de acción en la fibra muscular (recuadro 12). En el SNC, la mayoría de las sinapsis excitatorias son glutamatérgicas y generan PPSE de amplitud muy diversa. En algunas sinapsis donde se requiere transmitir señales de alta frecuencia en forma confiable, el PPSE es de gran amplitud, como en el caso de la vía auditiva. Sin embargo, en la mayoría de los casos los PPSE son de un par de milivoltios de amplitud. El glutamato genera el PPSE actuando sobre cuatro tipos de receptores. Tres de ellos son ionotrópicos. Se los conoce por el nombre químico de las moléculas (neurotransmisores) que los activan específicamente. Estas son los 93 receptores al ácido kaínico, los receptores al ácido α amino 3-hidrxi-5-metilisoxazol-propiónico (AMPA), que tienen muchas similitudes entre sí, y el Nmetil-D-aspartato (NMDA) que funcionalmente presenta diferencias importantes relacionadas con procesos de memoria celular. El cuarto grupo lo forman los receptores metabotrópicos, que modulan los canales postsinápticos mediante la activación de la proteína G. Estos receptores también se encuentran en la membrana del terminal presináptico y sirven como un sistema de autocontrol (ver capítulo 6, Fig. 4). GLUTAMATO A RECEPTOR AMPA Na+ Na+ K+ K B Na+ Ca 2+ Na+ Mg2+ + Ca 2+ Na+ Ca 2+ RECEPTOR NMDA Mg2+ DESPOLARIZACIÓN K+ K+ K+ Mg2+ Figura 1: Esquema de la activación y duración del PPSE mediado por receptores AMPA y por receptores NMDA. A. El glutamato se une al receptor AMPA, activa un canal permeable al Na+ y al K+ y genera una breve despolarización. B. El glutamato se une al receptor NMDA, pero el canal no permite el pasaje de los iones debido a que está bloqueado por el ion Mg2+. La despolarización de la membrana elimina el bloqueo y el canal permeable al Na+, K+ y Ca2+ genera una despolarización más prolongada que en A. El receptor AMPA/kainato es el responsable de las respuestas más rápidas producidas por el glutamato (Fig. 1A). Al igual que los otros canales ligando dependientes, está formado por cinco subunidades que se ensamblan en la 94 membrana y forman el receptor que incluye al canal. Puesto que existe una variedad de subunidades, la combinatoria de ellas genera receptores AMPA con pequeñas diferencias en sus propiedades pero, en todos los casos, su activación aumenta la conductancia al Na+ y K+. Los receptores NMDA también están formados por cinco subunidades que forman un canal que permite el paso de los cationes Na+, K+ y Ca2+ (Fig. 1B). La permeabilidad al Ca2+ relaciona este tipo de receptor con otros procesos celulares que se inducen a través del aumento del Ca2+ intra-citoplasmático, tales como las reacciones bioquímicas en cadena, que incluyen la fosforilación de las proteínas e la inducción de la expresión de genes (Fig. 2). FOSFORILACIÓN DE PROTEÍNAS 2+ C Ca2 K INCORPORACIÓN DE RECEPTORES AMPA + AMPA NMDA Mg MENSAJERO RETRÓGRADO 2+ Na+ Ca2+ VESÍCULA CON CANALES AMPA Ca- CALMODULINA Figura 2: Mecanismos de potenciación sináptica. La sinapsis glutamatérgica es estimulada intensamente. La activación de los receptores AMPA despolariza la espina dendrítica, permitiendo la activación de los receptores NMDA. El influjo de Ca2+ activa una serie de reacciones enzimáticas que culminan con la incorporación de nuevos receptores AMPA en la membrana postsináptica y la producción de óxido nítrico o monóxido de carbono, que aumenta la liberación de neurotransmisor y actúa a nivel presináptico. 95 La particularidad del receptor a NMDA es que, en condiciones de potencial de membrana de reposo (valores negativos), el canal está bloqueado por una molécula de ion Mg2+ (Fig. 1B). Esto significa que, aunque el sitio receptor al glutamato esté ocupado por el glutamato, el flujo de iones por el canal será nulo, ya que está bloqueado por el Mg2+. Para que los iones puedan fluir por el canal, es necesario que por algún mecanismo, ya sea por la activación de canales de Na+, como en el potencial de acción, o la activación de otros canales de glutamato de tipo AMPA, la membrana donde se encuentre el receptor NMDA se despolarice. En esas condiciones, el canal se desbloquea y permite el paso de los cationes. Al receptor NMDA se lo denomina un receptor de coincidencias, es decir, deben coincidir dos fenómenos para que este se active, la unión de glutamato con el sitio receptor y la despolarización de la membrana. Fisiológicamente, se comporta como un canal con doble modulación, por voltaje y por el neurotransmisor. Las corrientes iónicas generadas por la activación del receptor NMDA son más lentas que las del AMPA. Sus propiedades de receptor de coincidencia y la alta conductancia al Ca2+ permiten integrar los fenómenos eléctricos con los metabólicos. Tienen un rol muy importante en la potenciación de la fuerza sináptica, el aumento de la amplitud del PPSE, que se observa en relación con el aprendizaje y la memoria. Un ejemplo de ello lo tenemos representado en la Fig. 2. Una intensa actividad de la neurona presináptica determina la liberación y acumulación de glutamato en la hendidura sináptica, la activación de numerosos receptores AMPA que despolarizan la membrana postsináptica, el desbloqueo de los receptores NMDA, el influjo de Ca2+ y la activación del la enzima Ca-calmodulina, que induce la incorporación de nuevos receptores AMPA a la membrana postsináptica a partir de un reservorio intracelular de receptores. Tal incorporación aumenta la amplitud del PPSE por varias horas o en forma permanente. De esta manera, se genera una marca (aumento de la amplitud del PPSE) de algo que ha ocurrido en el circuito sináptico (alta actividad presináptica). Otros mecanismos de señalización actúan aumentando la liberación de neurotransmisor debido a la acción presináptica de un mensajero retrógrado. 96 9.2 Sinapsis inhibitorias Los potenciales postsinápticos inhibitorios (PPSI) pueden ser analizados en las sinapsis que utilizan el GABA como neurotransmisor, al activar receptores ionotrópicos GABA A y metabotrópicos GABA B. La activación de los receptores GABA A genera señales inhibitorias, ya que su canal asociado es selectivamente permeable al anión Cl-. (ver capítulo 6, Fig. 5). Los receptores GABA A tienen una estructura pentamérica similar a los RAc, AMPA y NMDA. Otro receptor inhibitorio es el receptor a la glicina, cuya estructura molecular también es muy similar a la de los anteriores y es también selectivamente permeable al Cl-. Por lo tanto, cuando los receptores a GABA A o a Glicina estén abiertos, el anión Cl-, cargado negativamente, circulará a favor de su gradiente electroquímico. Si se utiliza la ecuación de Nernst y se acepta una concentración de Cl- de 3.5 mM en el interior celular y de 120 mM en el exterior, el potencial de equilibrio para el Cl- resulta cercano a los –90 mV. En una neurona cuyo potencial de reposo es de –70 mV, la activación de los GABA A genera una corriente de Cl- que ingresa a la neurona postsináptica; el potencial de reposo tenderá a hiperpolarizarse, reduciendo la probabilidad de generación del potencial de acción. Se han observado importantes variaciones en la concentración intracelular de Cl- . Puede ocurrir que el potencial de equilibrio del Cl- coincida con el del potencial de membrana, en cuyo caso la activación de los receptores de GABA no produce cambio de potencial. Asimismo, se puede dar el caso en el que el potencial de equilibrio esté en valores más despolarizados que el potencial de membrana, por ejemplo –65 mV. La activación de los receptores GABA producirá entonces un potencial sináptico despolarizante. Sin embargo, la acción sería inhibitoria, pues el potencial de membrana tendería a fijarse en -55 mV y este potencial de membrana no sería suficiente para desencadenar un potencial de acción. En resumen, una forma simple de distinguir si una respuesta postsináptica es excitatoria o inhibitoria es determinar el potencial de equilibrio del potencial sináptico y cuál es el potencial umbral para desencadenar un potencial de acción. El PPSE tiene su potencial de equilibrio a valores más positivos que el umbral, mientras que el PPSI lo tiene a valores más negativos. Los receptores ionotrópicos GABA A son blanco de drogas importantes, desde el punto de vista clínico. Drogas tranquilizantes como las benzodiazepinas, los barbitúricos y el alcohol actúan sobre distintas subunidades de este receptor, potenciando su actividad. 97 En consecuencia, los receptores metabotrópicos tienen efectos más lentos. Se diferencian de los ionotrópicos en que afectan canales iónicos por intermedio de la activación de proteínas G. Se conocen muchas decenas de receptores metabotrópicos a diferentes neurotransmisores como glutamato, acetilcolina, dopamina, etc. Los receptores metabotrópicos forman una gran familia que comparte una estructura molecular similar. A diferencia de los receptores ionotrópicos, que están formados por múltiples subunidades, los metabotrópicos están formados por una sola proteína que atraviesa la membrana siete veces con sitios extracelulares, para la unión del neurotransmisor, y sitios interiores, donde se une la proteína G. Por su parte, las proteínas G son una familia de proteínas acopladas a los receptores que se unen a nucleótidos de guanina como el GDP o el GTP. Poseen tres tipos de subunidades (α, β y γ); de cada una de ellas existen múltiples subtipos, lo que confiere al sistema gran diversidad. Un ejemplo de receptor metabotrópico lo tenemos en las neuronas y en células musculares del corazón, en las que la Ac actúa sobre los receptores muscarínicos. La activación de este receptor libera los componentes β y γ de la proteína G que activa canales de K+. Esto hiperpolariza la célula e inhibe su actividad. En el caso del corazón, se traduce en una disminución de la frecuencia cardíaca como el efecto observado por Otto Loewi (ver capítulo 6, Fig. 1). Aun cuando la interacción directa de las proteínas G y los canales iónicos genere cambios de conductancia en la membrana, estos efectos tardan decenas de milisegundos en aparecer y varios segundos o minutos en desaparecer. Estos procesos son aún más lentos, si la interacción del receptor con el canal está mediada por alguna enzima como la adenilatociclasa o fosfolipasa. Los receptores metabotrópicos tienen acción lenta debido a que se requieren múltiples proteínas que se unen en forma secuencial para producir la respuesta fisiológica. Una ventaja relativa del sistema es que permite amplificar en gran medida la señal: en cada paso una molécula activa muchas otras. Finalmente, la activación de un receptor metabotrópico puede resultar en la modulación de cientos de canales. Una de las particularidades de este sistema de señales mediadas por receptores metabotrópicos es que pueden activar factores que modulan la expresión de genes, conectando de este modo la actividad sináptica con la expresión de proteínas y, por lo tanto, las modificaciones plásticas del sistema nervioso. 98 9.3 Integración de las señales En el SNC, los PPSE e inhibitorios son, por lo general, muy pequeños, comparados con los potenciales de la PNM. Sin embargo, a diferencia de esta, donde un solo axón contacta a una fibra muscular, las neuronas del SNC reciben cientos o miles de axones excitatorios e inhibitorios. Es la sumatoria de las actividades de cada una de estas sinapsis la que determina si la despolarización del potencial de membrana sobrepasa el valor umbral que genera un potencial de acción. Esta suma algebraica de corrientes despolarizantes e hiperpolarizantes se da en el espacio y en el tiempo. Supongamos que una neurona recibe tres aferencias, dos excitatorias y una inhibitoria; las excitatorias son subumbrales. En el esquema de la Fig. 3A, podemos ver que la estimulación de la aferencia E1 o la E2 en forma individual genera un PPSEs que no lleva el potencial de membrana al umbral, pero la suma de ambos estímulos sí lo hace. Por otro lado, la combinación simultánea de los tres estímulos deriva también en una señal final subumbral, ya que se le resta a la anterior el efecto de la aferencia inhibitoria. A E1 E1 E2 E1+2 E2 E1 I E1+In In E2 B E1 I E1+E2+In Figura 3: Integración de los potenciales sinápticos. A. La estimulación de E1 y E2 por separado es subumbral. La estimulación simultanea de E1 y E2 genera un potencial umbral por la suma espacial de los potenciales sinápticos. B. La estimulación repetida de E1 genera un potencial umbral por la suma temporal de los potenciales sinápticos. La estimulación del axón inhibitorio es efectiva, si ocurre sincrónica con la estimulación excitatoria. 99 En este ejemplo sólo hemos considerado la estimulación sincrónica de las vías. Supongamos que la vía E1 es ahora estimulada dos veces en rápida sucesión (Fig. 3B). Como el potencial sináptico tiene una duración mayor que el potencial de acción presináptico que libera al neurotransmisor, los estímulos se suman y se desencadena el potencial de acción. Igualmente, si las vías E1 y E2 son estimuladas con una pequeña diferencia de tiempo, sus efectos se suman. Si la aferencia inhibitoria es estimulada varios milisegundos antes o después de la excitatoria, su actividad será inefectiva. Solamente tendrá influencia sobre la actividad de la célula, contrarrestando la actividad excitatoria, si se producen con cierta sincronía. La capacidad de modulación de la actividad neuronal depende, entre otras cosas, de la ubicación de las sinapsis respecto del sitio de inicio del potencial de acción. Dado que los potenciales sinápticos se propagan electrotónicamente, una sinapsis ubicada en una dendrita lejana del soma neuronal tendrá un influencia mucho menor que otra de iguales características ubicada cerca del mismo. Muchos otros factores contribuyen a la excitabilidad neuronal. Por ejemplo, variaciones del potencial de reposo de la neurona debido a la activación o inhibición de canales de K+ mediados por receptores metabotrópicos se suman a la actividad sináptica y contribuyen a determinar la actividad final de la neurona, medida como número y distribución en el tiempo de potenciales de acción. 100 10. La contracción muscular En los capítulos anteriores, hemos visto cómo el estímulo inicial del arco reflejo genera una señal eléctrica que, en sucesivos pasos, se transforma en química y nuevamente en eléctrica. Finalmente, se genera un potencial de acción en la fibra muscular que induce la contracción de la misma (Fig. 1). REGISTRO DE LA CONTRACCIÓN MUSCULAR POTENCIAL DE ACCIÓN ESTIMULACIÓN 30 mV. 5 gramos 5 mseg. Figura 1: Esquema del diseño experimental. A la derecha, la fibra muscular es estimulada a través del nervio mientras se registra la actividad eléctrica y mecánica. A la izquierda, un registro de potencial de acción y de la contracción que este desencadena. Puede notarse que la contracción se inicia más tardíamente y es mucho más prolongada en el tiempo. Los músculos son órganos activos, capaces de producir movimientos organizados. Existen básicamente tres tipos de músculo: esquelético, visceral y cardíaco; tomaremos el primero como modelo de estudio. El músculo esquelético está formado por células multinucleadas, extremadamente alargadas, rodeadas por tejido conectivo. Estas fibras musculares tienen un diámetro entre 10 y 100 micras y pueden alcanzar más de 35 cm. de longitud. Por su extrema longitud, se las llama fibras. Las fibras musculares son células excitables altamente especializadas y caracterizadas por tener el citoplasma lleno de fibras proteicas, estructuralmente muy organizadas (Fig. 2). Es necesario entender la ultraestructura de la fibra muscular para comprender el mecanismo de contracción muscular. 101 Figura 2: Ultraestructura de la fibra muscular. A la izquierda, un esquema de bajo aumento donde se muestran las miofibrillas formadas por miofilamentos y dispuestas en forma ordenada a lo largo de la fibra muscular. El corte de las miofibrillas permite observar la disposición regular de los miofilamentos. Entre las miofibrillas, el mioplasma contiene mitocondrias y núcleos. Rodeando las miofibrillas, se encuentra el retículo sarcoplásmico, con sus dos porciones: la cisterna terminal y la porción longitudinal. Nótese la estrecha relación entre el túbulo T y la cisterna terminal del retículo sarcoplásmico. A la derecha, una imagen al microscopio electrónico y un esquema de una miofibrilla en corte longitudinal. El esquema muestra la disposición de los filamentos que generan las bandas A e I. 10.1 Ultraestructura de la fibra muscular Dentro de la fibra muscular, encontramos densos paquetes de proteínas muy organizadas denominadas miofibrillas, que están dispuestas en forma paralela entre sí y al eje mayor de la célula. Las miofibrillas son pequeñas unidades estructurales y funcionales de la fibra muscular. Están compuestas por un elevado número de miofilamentos, cuya disposición determina la aparición de bandas o estrías transversales. En una sección longitudinal, se puede apreciar una serie de bandas transversales al eje mayor de la célula muscular, con alternancia de zonas claras o bandas I y zonas oscuras o bandas A. Las miofibrillas no presentan 102 envolturas y los espacios entre ellas están ocupados por el citoplasma de la fibra muscular, llamado sarcoplasma o mioplasma, que contiene núcleos y mitocondrias y a través del cual se esparce una red de túbulos y sacos denominada en su conjunto retículo sarcoplásmico. De la membrana plasmática salen numerosas invaginaciones perpendiculares a la superficie celular. Estas invaginaciones, denominadas túbulos transversos o T, están en continuidad con el medio extracelular. Tienen como fin permitir que el potencial de acción que se propaga por la membrana plasmática también se propague a la parte profunda de la fibra muscular y permita una contracción sincrónica de todas las miofibrillas superficiales y profundas de la fibra muscular. El túbulo T está en estrecho contacto con el retículo sarcoplásmico (Fig. 2). En las miofibrillas se distinguen zonas diferenciadas en bandas A e I. En el centro de las bandas I, existe una línea oscura llamada línea Z. Se llama sarcómero al espacio comprendido entre dos líneas Z contiguas. Es la unidad funcional del músculo. Longitudinalmente, en el sarcómero se pueden distinguir miofilamentos gruesos de miosina y miofilamentos finos de actina. La miosina y la actina son las proteínas contráctiles. Estos miofilamentos se desplazan unos sobre otros durante los movimientos de relajación y contracción. La miosina está formada por dos componentes: la H meromiosina, de alto peso molecular, que tiene propiedades de enzima pues degrada el ATP liberando energía. El otro componente es la L meromiosina, de bajo peso molecular. El componente L adopta una posición longitudinal y fibrilar, en tanto las moléculas L se unen entre sí para formar una estructura muy rígida, que es sobre la que se va a ejercer la fuerza. Este es el punto de apoyo sobre el que se desarrolla el movimiento para producir el acortamiento del sarcómero. Por el contrario, el componente de forma globular H se dispone transversalmente y forma los puentes de unión entre la actina y miosina (Fig. 3A). 103 Figura 3: A. La cadenas de L meromiosina interaccionan formando el filamento grueso; la H meromiosina queda con su parte globular perpendicular al eje del filamento. B. La actina filamentosa formada por la polimerización de la actina globular está tiene asociada la tropomiosina y la troponina. C. la interacción de las cabezas de la miosina con la actina genera un impulso de fuerza orientado al centro del sarcómero. D. Los sarcómeros se acortan aproximadamente un micrón cada uno por el deslizamiento de los filamentos finos. Este acortamiento se suma al de los otros sarcómeros en serie y producen el acortamiento general del músculo. El filamento fino está constituido por tres componentes diferentes: actina, tropomiosina y troponina (Fig. 3B). La columna vertebral del filamento de actina es una molécula fibrilar de cadena doble. Un extremo de la molécula fibrilar de actina se halla fuertemente encajado en los discos Z, mientras sus otros extremos se sitúan entre los filamentos de miosina (Figs. 2 y 3C). Cada cadena de actina fibrilar está formada por moléculas polimerizadas de actina globular, que son los sitios activos de los filamentos de actina, allí donde los 104 puentes cruzados de los filamentos de miosina intervienen para generar la contracción muscular. La tropomiosina es una molécula que se une laxamente con la actina fibrilar. En estado de reposo, la tropomiosina tapa los sitios activos de forma que estos no pueden reaccionar con los filamentos de miosina para desencadenar una contracción. Cada molécula de tropomiosina bloquea siete de estos sitios activos. Unida a uno de los extremos de la molécula de tropomiosina, se halla un complejo de proteínas llamadas troponina, una de las cuales, la troponina C, tiene alta afinidad por el Ca2+. Por medio de un ensayo experimental, en el que las proteínas contráctiles estén disueltas en una solución iónica similar al medio intracelular que incluye ATP, pero totalmente libre de Ca2+, se puede demostrar que la actina y la miosina se unen fuertemente. Si al filamento de actina se le añade el complejo de troponina-tropomiosina, la unión actina-miosina no se produce. Si en estas condiciones se agrega Ca2+ a la solución, el complejo actinamiosina sí se produce. Estos resultados concuerdan con la idea de que, cuando los iones Ca2+ se combinan con troponina C, quedan al descubierto los sitios activos del filamento de actina y permiten la interacción con las cabezas de los puentes de miosina. Se ha postulado que la unión de la cabeza de miosina con el sitio activo causa, de manera simultánea, profundos cambios en las fuerzas intramoleculares entre la cabeza y el brazo. La nueva alineación de las fuerzas determina que la cabeza se incline hacia el brazo arrastrando con ella al filamento de actina, fenómeno denominado impulso de fuerza (Fig. 3C). Inmediatamente después de la inclinación, la cabeza se separa del sitio activo y regresa a su posición perpendicular normal. En esta posición se combina con el nuevo sitio que la enfrenta. Entonces se produce una nueva inclinación, similar a la anterior, con el objetivo de producir otro impulso de fuerza, y el filamento de actina de desplaza una vez más. De esta forma, los puentes cruzados tiran del filamento de actina hasta el centro del de miosina (Fig. 3D). 105 LINEA Z BANDA A BANDA I FILAMENTO GRUESO MIOSINA FILAMENTO FINO ACTINA, TROPONINA Y TROPOMIOSINA Figura 4: A. La interdigitación de los filamentos finos y gruesos, de acuerdo con la teoría del deslizamiento. Lo que se acaba de describir es la teoría del deslizamiento de los filamentos, que fue elaborada en los años 1950 (Fig. 4). Fundamentándose en ella, se postuló que, a mayor número de puentes o interacciones actina miosina, mayor es la fuerza de contracción. Esto es así, ya que si el músculo está muy estirado o muy relajado, el número de puentes que se pueden establecer es menor y la fuerza no es óptima. La fuerza óptima se alcanza cuando el sarcómero mide 2,3 micrones de longitud. Es la que tienen los músculos cuando están levemente estirados como el bíceps, cuando el brazo esta en semi-flexión. 10.2 Acoplamiento excitación-contracción Se entiende por acoplamiento excitación-contracción el mecanismo por el cual la señal despolarizante (potencial de acción) genera la contracción muscular. Las fibras musculares mantienen muy baja su concentración de Ca2+ en el mioplasma. Sin embargo, tienen una considerable cantidad de Ca2+ 106 acumulado en las cisternas del retículo sarcoplásmico, el que liberado al mioplasma desencadena la contracción muscular. Cuando se genera un potencial de acción en la fibra muscular, este se propaga activamente por toda la membrana superficial y por el sistema tubular T. El túbulo T está en contacto con una parte ensanchada del retículo sarcoplásmico, conocida como cisterna terminal. Asimismo, el túbulo T y las cisternas están extremadamente cerca y, además, existen unos puentes proteicos que los unen. Estudios moleculares identificaron estos puentes como canales de calcio modificados que no permean Ca2+ pero que se alteran con los cambios de voltaje, como los producidos por el potencial de acción. Los cambios de conformación de las proteínas de los puentes son transmitidos a los canales de calcio que abundan en las cisternas del retículo sarcoplásmico. Esta interacción mecánica directa entre el sensor de voltaje en el túbulo T y el canal de calcio del retículo es específica para el acoplamiento excitatorio contráctil (Fig. 5). TÚBULO T Ca 2+ SENSOR DEL VOLTAJE Ca 2+ Ca 2+ RETICULO SARCOPLÁSMICO CANAL DE Ca2+ Figura 5: Acoplamiento excitación-contracción. El potencial de acción invade los túbulos T, activando los canales de Ca2+ del retículo sarcoplásmico. El Ca2+ liberado actúa sobre la maquinaria contráctil y es recaptado por la porción longitudinal del retículo. 107 Cuando se produce un PA, la cantidad de Ca2+ liberada es suficiente para aumentar la concentración mioplasmática de Ca2+ de 10-8 a 10-5 M. El Ca2+ liberado es sólo una pequeña fracción del Ca2+ en reserva. Un nuevo potencial de acción producirá una nueva liberación que puede sumarse a la anterior y así aumentar la fuerza contráctil. A fin de que el músculo se relaje, es necesario remover el Ca2+ del mioplasma y así tapar el sitio de interacción de la miosina con la actina. La encargada de recuperar el Ca2+ liberado es la porción longitudinal del retículo sarcoplásmico, que por medio de un mecanismo activo introduce nuevamente el Ca2+ dentro del sistema de membrana; también por un mecanismo activo, ese Ca2+ vuelve a ser concentrado en la cisterna. 108 11. Comentario final La generación de un movimiento mediante la contracción del músculo completa el ciclo iniciado por el estímulo doloroso en la piel o por el estiramiento del tendón de la rótula. La señal inicial adoptó distintos tipos de energía y viajó a través de distintos tipos celulares. En todos los casos, el juego de los iones, atravesando la membrana, se concatenó con sustancias químicas que actuaron sobre receptores específicos. La información que fluye por los circuitos neuronales es también esencial para que las neuronas se desarrollen y adquieran su propia identidad. Las neuronas surgen de células madres que se van diferenciando de acuerdo a un programa genético que determina algunas de las propiedades que les permiten comunicarse con el medio ambiente y con las otras neuronas que la rodean. Las neuronas en su crecimiento emiten prolongaciones que son guiadas para que establezcan las conexiones adecuadas. Las neuronas encuentran señales que, como postas en el camino, atraen al axón en crecimiento o lo rechazan, lo hacen girar o cruzar la línea media. Muchas de estas señales están determinadas en el programa genético pero esto no es suficiente. Es necesaria la actividad de las neuronas, es decir la generación de impulsos nerviosos que desencadenan la comunicación química y eléctrica, para el arreglo fino de las conexiones sinápticas. Un clásico ejemplo se encuentra en la sinapsis neuromuscular de los mamíferos que al momento del nacimiento esta inervada por 3 a 5 axones provenientes de diferentes motoneuronas de la medula espinal. La actividad muscular mediada por los arcos reflejos generan una competencia que hace que todos menos un axón sean eliminados. Un proceso similar se da en la corteza visual donde al momento del nacimiento no existen zonas especificas relacionadas con el ojo derecho o el izquierdo. La actividad visual dirige una remodelación de los contactos sinápticos tal que a las pocas semanas existen neuronas corticales que sólo responden a la estimulación del ojo izquierdo y otras al derecho. Todos estos cambios “plásticos” fueron descriptos inicialmente en el sistema nervioso en desarrollo. Hoy sabemos que el SNC del adulto no es una 109 maraña de cables rígidos con conexiones inalterables. El cerebro adulto también esta en continuo movimiento Los contactos sinápticos, en fracción de segundos, cambian de tamaño, de número de receptores y por lo tanto cambia su grado de influencia sobre la actividad de la neurona inervada. Fenómenos relacionados con la memoria y el aprendizaje se explican en base a modificaciones de la actividad sináptica de las neuronas de la corteza cerebral, en particular el hipocampo. En los últimos años se ha demostrado que el SNC del adulto también tiene capacidad de generar nuevas neuronas a partir de células precursoras que se mantuvieron “congeladas” Se sabe que al despertar estas neuronas migran, se ramifican y establecen nuevos contactos integrándose al circuiterío de la corteza cerebral. Todavía no se sabe cuales son sus implicancias fisiológicas. El estudio dinámico a nivel celular del SNC y su relación con el comportamiento es una de las batallas científicas del momento. El desarrollo tecnológico de cámaras digitales de alta sensibilidad y de substancias fluorescentes capaces de incorporarse a las células y cambiar sus propiedades con los cambio de voltaje o con la concentración de Ca2+ permite visualizar y seguir las modificaciones plásticas en una gran variedad de preparaciones biológicas tales como la corteza cerebral en un animal entero. Es mi intención que en estas líneas finales el lector advierta el dinamismo que existe en los fenómenos básicos descriptos en este libro y que tome conciencia de que solo hemos analizado algunas de las cartas que el sistema nervioso utiliza en el misterioso juego que nos permite movernos, comunicarnos, pensar, sentir y tener conciencia de que existimos. 110 12. Bibliografía recomendada Hille, B.: Ionic channels of excitable membranes, Sunderland (Mass.), Sinauer, 2001. Nicholls, J. G., Martin, A. R., Wallace, B. G. and Fuchs, P. A.: From Neuron to Brain, Sunderland (Mass.), Sinauer, 2001. Shepherd, G.: Neurobiology, New York, Oxford University Press, 1994. Purves, D. et al.: Neuroscience, Sunderland (Mass.), Sinauer, 1997. 111 112 Sobre el autor El doctor Osvaldo Daniel Uchitel es doctor en Medicina, Profesor Titular Ordinario del Departamento Fisiología y Biología Molecular y Celular de la Facultad de Ciencias Exactas y Naturales de la Universidad de Buenos Aires. Además es Investigador Superior del Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET), Director Interino del Instituto de Fisiología, Biología Molecular y Neurociencias. IFIBYNE– CONICET y Director Adjunto del Departamento Fisiología y Biología Molecular y Celular de la Facultad de Ciencias Exactas y Naturales de la Universidad de Buenos Aires. Asimismo, es revisor de publicaciones científicas internacionales. Posee numerosos trabajos científicos, en revistas de difusión nacional e internacional. Ha recibido varias becas de instituciones científicas nacionales e internacionales. 113 114 Índice Agradecimientos .................................................................................5 1. Introducción ....................................................................................9 2. Las células, pequeñas baterías eléctricas generan el potencial de membrana. ..............................................................16 2.1 Potencial de membrana .......................................................19 3. Generación y propagación de señales en las células excitables. El potencial de acción. ...................................................30 4. Los canales iónicos y su modulación por el voltaje ....................35 4.1 Registro de canales únicos en parches de membrana (patch clamp) ......................................................36 4.2 Canales iónicos sensibles a voltaje y excitabilidad celular ..37 4.3 Reconstrucción del potencial de acción ...............................40 4.4 Estructura molecular de los canales iónicos .........................42 4.5 Canalopatías .........................................................................44 5. Propagación de las señales eléctricas ..........................................49 5.1 Propagación del potencial de acción ....................................51 6. Estructura y función de la sinapsis .............................................57 6.1 Sinapsis eléctricas ................................................................58 6.2 Sinapsis químicas .................................................................59 6.3 Liberación cuántica de neurotransmisor ..............................61 6.4 Vesículas sinápticas y reciclado vesicular............................66 6.5 El comportamiento postsináptico .........................................68 7. Los neurotransmisores y su ciclo.................................................74 7.1 Identificación del neurotransmisor .......................................74 7.2 Síntesis, almacenamiento, liberación y remoción del neurotransmisor ....................................................................77 7.3 La acetilcolina (Ac) y la sinapsis colinérgica.......................79 7.4 Aminoácidos excitatorios e inhibitorios...............................80 115 8. Los receptores y la generación de potenciales sinápticos en la placa neuromuscular ...............................................................83 9. Potenciales excitatorios e inhibitorios. Integración neuronal de la actividad sináptica. .................................................................93 9.1 Sinapsis excitatorias .............................................................93 9.2 Sinapsis inhibitorias .............................................................97 9.3 Integración de las señales .....................................................99 10. La contracción muscular..........................................................101 10.1 Ultraestructura de la fibra muscular .................................102 10.2 Acoplamiento excitación-contracción ..............................106 11. Comentario final .......................................................................109 12. Bibliografía recomendada........................................................111 Sobre el autor ..................................................................................113 116 Colección Ciencia joven 1 Una expedición al mundo subatómico. Átomos, núcleos y partículas elementales Daniel de Florian 2 Números combinatorios y probabilidades Ricardo Miró 3 Las plantas, entre el suelo y el cielo Jorge Casal 4 Introducción a la geología. El planeta de los dragones de piedra Andrés Folguera, Víctor A. Ramos y Mauro Spagnuolo (coords.) 5 Biomateriales. Una mejor calidad de vida Gustavo S. Duffó 6 Reproducción humana Marta Tesone 7 La física y la edad de la información Marcelo J. Rozenberg 8 Biodiversidad y ecosistemas. La naturaleza en funcionamiento Claudio M. Ghersa 9 100 años de relatividad Diego Harari y Diego Mazzitelli 10 Entre el calamar y el camello. O del control del medio interno Carlos Amorena y Alejandra Goldman 117 11 Por los senderos de la noche. Guía de viaje para mochileros del Universo Pedro Saizar 12 La física de los instrumentos musicales Javier Luzuriaga y Raúl O. Pérez 13 La intimidad de las moléculas de la vida. De los genes a las proteínas Martín Vázquez 14 El lenguaje de las neuronas Osvaldo Uchitel 15 Biología marina Pablo E. Penchaszadeh y Martín I. Brögger 16 El universo de las radiaciones Jorge Fernández Niello 17 Construyendo con átomos y moléculas Índigo 18 Evolución y selección natural Esteban Hasson 19 El aire y el agua en nuestro planeta Inés Camilloni y Carolina Vera 20 Respuesta inmune. Anticuerpos, alergias, vacunas y reproducción humana Ana Cauerhff, Guillermo Horacio Docena, Carlos Alberto Fossati y Fernando Alberto Goldbaum 21 Contaminación y medio ambiente Daniel Cicerone 118