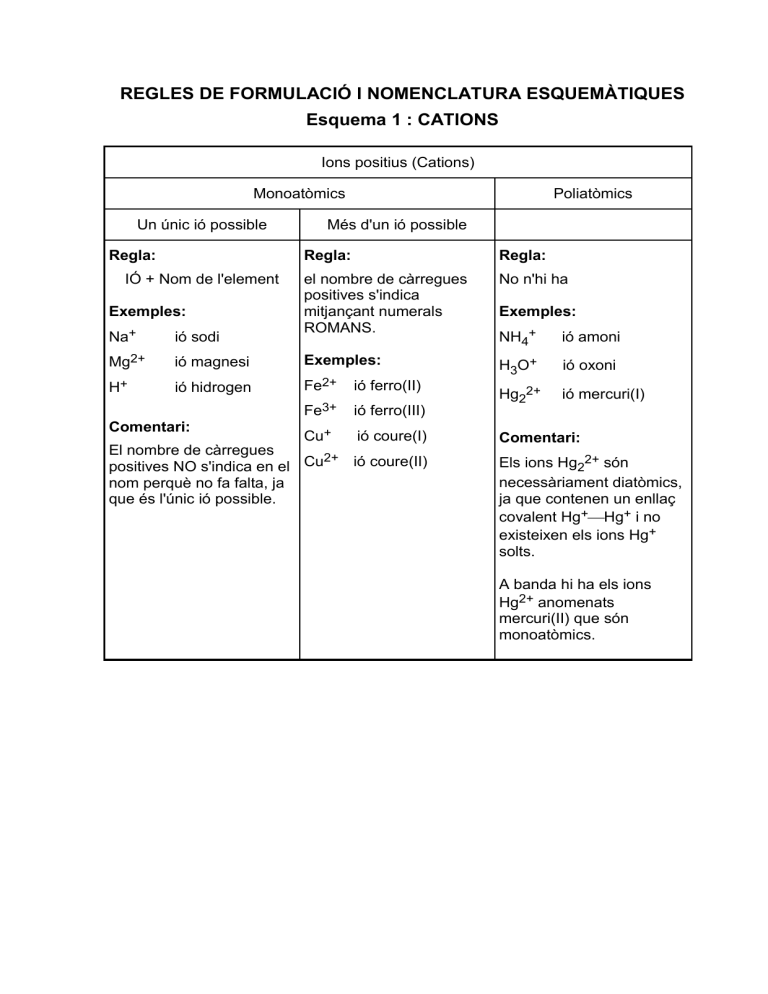
REGLES DE FORMULACIÓ I NOMENCLATURA ESQUEMÀTIQUES Esquema 1 : CATIONS Ions positius (Cations) Monoatòmics Un únic ió possible Regla: IÓ + Nom de l'element Exemples: Poliatòmics Més d'un ió possible Regla: Regla: el nombre de càrregues positives s'indica mitjançant numerals ROMANS. No n'hi ha NH4+ ió amoni H3O+ ió oxoni Hg22+ ió mercuri(I) Na+ ió sodi Mg2+ ió magnesi Exemples: ió hidrogen Fe2+ ió ferro(II) Fe3+ ió ferro(III) H+ Comentari: Cu+ ió coure(I) El nombre de càrregues 2+ ió coure(II) positives NO s'indica en el Cu nom perquè no fa falta, ja que és l'únic ió possible. Exemples: Comentari: Els ions Hg22+ són necessàriament diatòmics, ja que contenen un enllaç covalent Hg+Hg+ i no existeixen els ions Hg+ solts. A banda hi ha els ions Hg2+ anomenats mercuri(II) que són monoatòmics. Esquema 2 : ANIONS Ions negatius (Anions) Monoatòmics Regla: Oxoanions (Contenen oxigen) Regla: Arrel del nom + UR Mínim O : Menys O : Exemples: Més O : Màxim O : Hió hidrur hipo--it --it --at per--at Altres i Excepcions Regla: Regla: No hi ha regla, cal memoritzar els exemples més importants. H-oxoanió: HIDROGEN+nom de l'oxoanió F- ió fluorur Exemples: N3- ió nitrur ClO- ió hipoclorit OH- C4- ió carbur ClO2- ió clorit CN- ió cianur ClO3- ió clorat O22- ió peròxid ClO4- 2ió perclorat MnO4 ió manganat SO32- ió sulfit MnO4- SO42- ió sulfat CrO42- Excepció: O2- ió ÒXID Comentari: Exemples: ió hidròxid ió cromat Cr2O72- ió dicromat PO43- prefix+OXO+ nom+AT+(valència) Exemples: SO42ió tetraoxosulfat(VI) SO32ió trioxosulfat(IV) H2-oxoanió: DIHIDROGEN+ nom de l'oxoanió Exemples: HCO3ió hidrogencarbonat HSO4ió ió permanganat hidrogensulfat ió fosfat Els halògens (llevat del F) formen els C2H3O2- ió acetat quatre ions. Quan només es formen C2O42- ió oxalat dos ions s'anomenen -it i -at i quan només se'n forma un -at. Nova regla: Oxoanions que, a més, contenen hidrogen HPO42ió hidrogenfosfat H2PO4ió dihidrogenfosfat Esquema 3 : COMPOSTOS COMPOSTOS IÒNICS (Anió + Catió) Metall + H = HIDRURS COMPOSTOS AMB HIDROGEN H + No-metall = HIDRÀCIDS Regla: Regla 1a: Nom de l'anió+DE+nom del catió (en absència d'aigua): Nom-UR D'HIDROGEN Exemples: Exemples: NaCl Clorur de sodi Clorur d'hidrogen MgCl2 Clorur de magnesi HF Fluorur d'hidrogen Fe3N2 Nitrur de ferro(II) H2S Sulfur d'hidrogen Na2CO3 Carbonat de sodi Regla 2a: KOH Hidròxid de potassi (en un medi aquós): ÀCID Nom-HÍDRIC Hidròxid de bari Exemples: Hidrur de sodi HCl(aq) Àcid clorhídric Hidrur de calci HF(aq) Àcid fluorhídric Ba(OH)2 NaH CaH2 H + Oxoanions = OXOÀCIDS Regla: HCl Àcid sulfhídric COVALENTS (No-metall + No-metall) Regles: ÀCID ÀCID ÀCID ÀCID HIPO--ÓS --ÓS --IC PER--IC a. Anomenem primer l'element més electronegatiu, que a la fórmula apareix en 2n lloc. b. Indiquem les proporcions numèriques amb prefixos. segons l'anió d'on procedeixen c. El prefix MONO s'omet de la segona paraula. Exemples: Prefixos grecs: HClO Àcid hipoclorós 1 = mono ; 2 = di ; 3 = tri HClO2 Àcid clorós 4 = tetra ; 5 = penta ; 6 = hexa 7 = hepta ; 8 = octo ; 9 = nona HClO3 Àcid clòric 10 = deca Exemples: HClO4 Àcid perclòric N2O4 Tetraòxid de dinitrogen HNO Àcid nitrós 2 HNO3 Àcid nítric CO Monòxid de carboni H2SO3 Àcid sulfurós CO2 Diòxid de carboni Comentari: H2S(aq) El nom no indica el nombre de cations i anions, perquè només hi ha una possibilitat de combinar els ions per a formar el compost. Comentaris: H2SO4 Àcid sulfúric NO2 Diòxid de nitrogen a. Aquests compostos amb H s'anomenen com si foren iònics. H3PO4 Àcid fosfòric N2O Monòxid de dinitrogen b. L'expressió (aq) es pot ometre quan s'entén pel context. Convé memoritzar els àcids més importants. Comentaris: Comentaris: Alguns compostos d'hidrogen tenen noms tradicionals que cal memoritzar: aigua (H2O), amoníac (NH3), fosfina (PH3), metà (CH4), etc.