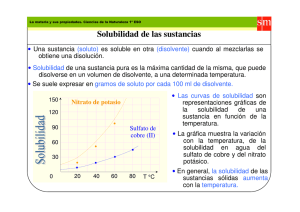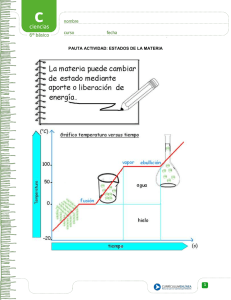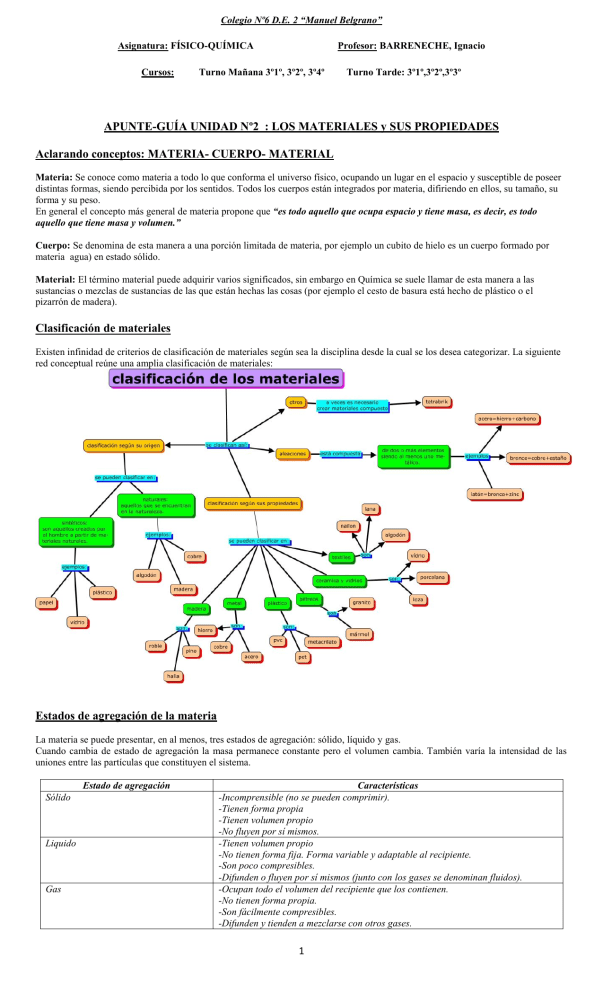
Colegio Nº6 D.E. 2 “Manuel Belgrano” Asignatura: FÍSICO-QUÍMICA Cursos: Profesor: BARRENECHE, Ignacio Turno Mañana 3º1º, 3º2º, 3º4º Turno Tarde: 3º1º,3º2º,3º3º APUNTE-GUÍA UNIDAD Nº2 : LOS MATERIALES y SUS PROPIEDADES Aclarando conceptos: MATERIA- CUERPO- MATERIAL Materia: Se conoce como materia a todo lo que conforma el universo físico, ocupando un lugar en el espacio y susceptible de poseer distintas formas, siendo percibida por los sentidos. Todos los cuerpos están integrados por materia, difiriendo en ellos, su tamaño, su forma y su peso. En general el concepto más general de materia propone que “es todo aquello que ocupa espacio y tiene masa, es decir, es todo aquello que tiene masa y volumen.” Cuerpo: Se denomina de esta manera a una porción limitada de materia, por ejemplo un cubito de hielo es un cuerpo formado por materia agua) en estado sólido. Material: El término material puede adquirir varios significados, sin embargo en Química se suele llamar de esta manera a las sustancias o mezclas de sustancias de las que están hechas las cosas (por ejemplo el cesto de basura está hecho de plástico o el pizarrón de madera). Clasificación de materiales Existen infinidad de criterios de clasificación de materiales según sea la disciplina desde la cual se los desea categorizar. La siguiente red conceptual reúne una amplia clasificación de materiales: Estados de agregación de la materia La materia se puede presentar, en al menos, tres estados de agregación: sólido, líquido y gas. Cuando cambia de estado de agregación la masa permanece constante pero el volumen cambia. También varía la intensidad de las uniones entre las partículas que constituyen el sistema. Estado de agregación Sólido Liquido Gas Características -Incomprensible (no se pueden comprimir). -Tienen forma propia -Tienen volumen propio -No fluyen por sí mismos. -Tienen volumen propio -No tienen forma fija. Forma variable y adaptable al recipiente. -Son poco compresibles. -Difunden o fluyen por sí mismos (junto con los gases se denominan fluidos). -Ocupan todo el volumen del recipiente que los contienen. -No tienen forma propia. -Son fácilmente compresibles. -Difunden y tienden a mezclarse con otros gases. 1 Colegio Nº6 D.E. 2 “Manuel Belgrano” Asignatura: FÍSICO-QUÍMICA Cursos: Profesor: BARRENECHE, Ignacio Turno Mañana 3º1º, 3º2º, 3º4º Turno Tarde: 3º1º,3º2º,3º3º Teoría Cinético – Molecular Para explicar el comportamiento de los gases, los físicos J. Clausius, J. Maxwell y L. Boltzman desarrollaron la denominada La Teoría Cinético – Molecular. Las hipótesis de dicha teoría son: Todos los gases están constituidos por un gran número de partículas. Son tan pequeñas que no pueden ser detectadas al microscopio. Estas partículas ocupan un volumen muy pequeño comparado con el volumen del recipiente. Entre partícula y partícula no hay nada, solo espacio vacío. Las partículas están en continuo movimiento, un movimiento caótico. Las partículas chocan entre sí y con las paredes del recipiente que contiene el gas. En estos choques no hay pérdida de energía. El movimiento queda determinado por dos tipos de fuerzas: Fuerzas atractivas o de cohesión. Tienden a mantener unidas las partículas. Fuerzas destructivas o de dispersión. Tienden a alejar las partículas. El modelo cinético – molecular es aplicable también a líquidos y sólidos pero adaptándola. Estado de agregación Sólido Liquido Gas Estructura -Las partículas están muy próximas, aunque hay huecos entre ellas. -Partículas fuertemente unidas. (Fuerzas de cohesión muy fuertes). -Ocupando posiciones fijas (sólo pueden vibrar alrededor de estas posiciones). -Partículas fuertemente unidas pero menos que en estado sólido. (Las distancias entre ellas son mayores que en estado sólido y menores que en estado gaseoso). -Fuerzas de cohesión más débiles que en estado sólido pero mayores que en estado gaseoso. -Mayor movilidad que en estado sólido pero menos que en estado gas. -Partículas prácticamente independientes (fuerzas de unión muy débiles) y se mueven continuamente y con desorden. Modelo sub-microscópico de partículas… Si bien los estados Sólido, líquido y gaseoso son los más comúnmente se describen y definen, en Física y Química desde hace ya unos años se comenzó a estudiar otro posible estado de agregación de la materia: el PLASMA. Características del Plasma El Plasma es un estado que adoptan los gases cuando se calientan a elevadas temperaturas del orden de 10.000 °C: las moléculas adquieren tanta energía cinética, que los frecuentes choques provocan la ruptura de las moléculas e incluso de los átomos, lo que origina una mezcla de iones positivos y electrones deslocalizados, donde el número de cargas, además de los átomos y las moléculas, es prácticamente el mismo. En el universo la mayoría de materia se encuentra en este estado debido a las altas temperaturas que poseen las estrellas. Extraído de:https://www.balticnet-plasmatec.org 2 Colegio Nº6 D.E. 2 “Manuel Belgrano” Asignatura: FÍSICO-QUÍMICA Cursos: Profesor: BARRENECHE, Ignacio Turno Mañana 3º1º, 3º2º, 3º4º Turno Tarde: 3º1º,3º2º,3º3º A modo de síntesis,,, Cambios de Estado El balance entre las fuerzas atractivas y repulsivas entre las partículas que componen una sustancia determina que la sustancia se encuentre en uno u otro estado. Modificando convenientemente la presión y la temperatura se puede conseguir que una sustancia pase de un estado de agregación a otro. Fusión: es el paso de una sustancia desde el estado sólido al estado líquido. El proceso inverso, es decir, el paso de una sustancia desde el estado líquido al estado sólido recibe el nombre de Solidificación. Vaporización: es el paso de una sustancia desde el estado líquido al estado gas. Esto puede ocurrir de dos formas posibles: evaporación y ebullición. -La evaporación: es una vaporización lenta que ocurre solo en la superficie libre de los líquidos y a cualquier temperatura. Ejemplo: en un charco a temperatura ambiente. -La ebullición: es una vaporización tumultuosa que se realiza en toda la masa del líquido. Para una presión determinada, cada líquido tiene una temperatura de ebullición. El proceso inverso, es decir, el paso de una sustancia desde el estado gas al estado líquido recibe el nombre de Licuación o condensación. Se realiza desprendimiento de energía mediante calor. Sublimación: es el paso de una sustancia desde el estado sólido al estado gas. El proceso inverso, es decir, el paso de una sustancia desde el estado gas al estado sólido recibe el nombre de Sublimación regresiva. 3 Colegio Nº6 D.E. 2 “Manuel Belgrano” Asignatura: FÍSICO-QUÍMICA Cursos: Profesor: BARRENECHE, Ignacio Turno Mañana 3º1º, 3º2º, 3º4º Turno Tarde: 3º1º,3º2º,3º3º Si pensamos en los cambios de estado a nivel sub-microscópico….. Los cambios de estado según el Modelo Cinético de Partículas Teoría Cinética y Temperatura Los gases son fáciles de describir desde el punto de vista de la teoría Cinética. En un recipiente sus partículas se mueven en línea recta hasta que chocan con otras partículas o con las paredes del recipiente, lo que hace que las partículas se muevan en zig-zag. Este movimiento recibe el nombre de movimiento térmico. Si se da energía al gas, aumenta la velocidad media de las partículas, aumenta la energía cinética media de las partículas y por lo tanto aumenta la temperatura. La temperatura de un sistema material es proporcional a la energía cinética media de las partículas del sistema. Al aumentar la temperatura de un sistema, aumenta la energía cinética media de las partículas y su movilidad, con lo que se favorecen los cambios de estado progresivos: Sólido Líquido Gas Al aumentar la presión, aumentan las fuerzas de cohesión y se favorecen los cambios regresivos: Gas Líquido Solido ACTIVIDAD Nº1 Complete su carpeta un análisis, desde el modelo cinético de partículas, de lo que sucede: a) Durante la fusión de un sólido. b) Durante la condensación del vapor de agua. Curvas de calentamiento y enfriamiento Los siguientes gráficos representan curvas de calentamiento o enfriamiento de determinada sustancia, como podrán ver lo que se intenta mostrar es de qué manera evoluciona el sistema a medida que aumenta la temperatura en función del tiempo. Curva de Calentamiento 4 Colegio Nº6 D.E. 2 “Manuel Belgrano” Asignatura: FÍSICO-QUÍMICA Cursos: Profesor: BARRENECHE, Ignacio Turno Mañana 3º1º, 3º2º, 3º4º Turno Tarde: 3º1º,3º2º,3º3º Curva de enfriamiento ACTIVIDAD Nº2 1- Observando la curva de calentamiento y de enfriamiento, responder a las siguientes cuestiones: a- ¿Por qué en las gráficas se observan mesetas? ¿Qué está sucediendo en esas transiciones? b-¿Qué sucede, a nivel de las partículas, durante el calentamiento de una sustancia? ¿Cómo lo podemos advertir en la curva?. c-¿Qué sucede, a nivel de las partículas, durante el enfriamiento de una sustancia? ¿Cómo lo podemos advertir en la curva?. 2- La gráfica de la figura corresponde a la curva de calentamiento de una sustancia pura: a) ¿Qué cambios de estado tienen lugar? ¿Qué nombre reciben estos cambios de estado? b) ¿Cuál es el punto de ebullición de esta sustancia? c) ¿Por qué se mantiene constante la temperatura durante cada uno de los cambios de estado? d) ¿Es lo mismo ebullición que evaporación? e) Indica el estado de agregación a -10ºC, 30ºC y 120ºC 5 Colegio Nº6 D.E. 2 “Manuel Belgrano” Asignatura: FÍSICO-QUÍMICA Cursos: Profesor: BARRENECHE, Ignacio Turno Mañana 3º1º, 3º2º, 3º4º Turno Tarde: 3º1º,3º2º,3º3º Propiedades de la materia Las propiedades de la materia pueden ser: Propiedades Extensivas: son las que presenta cualquier clase de materia y sus valores son independientes del estado físico pero dependientes de la cantidad de materia que constituya a ese cuerpo. Por esto no sirven para identificar una sustancia. Entre estas propiedades podemos encontrar a: la masa, el peso y el volumen. Propiedades Intensivas: Las propiedades específicas o intensivas de la materia son aquellas propiedades cuyo valor es característico de cada sustancia y nos permiten diferenciarlas de otros dados que no dependen de la cantidad de materia que forma al cuerpo en cuestión. Entre estas propiedades podemos encontrar a: la densidad, el color, el brillo, la conductividad térmica y eléctrica, la solubilidad y el punto de fusión y de ebullición. Propiedades Físicas: Son aquellas propiedades que impresionan nuestros sentidos sin alterar su composición interna o molecular. Propiedades Químicas: son aquellas propiedades que se manifiestan al alterar su estructura interna o molecular, cuando interactúan con otras sustancias. ACTIVIDAD Nº3 En este cuadro se mencionan una serie de propiedades de la materia, completá en tu carpeta el significado de las siguientes: PUNTO DE FUSIÓN- PUNTO DE EBULLICIÒN-DUREZA-SOLUBILIDAD-MASA-VOLUMEN-PESO Una propiedad interesante: LA DENSIDAD La densidad (δ) es una propiedad física intensiva, o intrínseca, que como tal no depende de la cantidad de materia; por lo tanto es característica de cada mezcla, sustancia o cuerpo. Se la puede definir como la relación entre la masa que ocupa un cuerpo por unidad de volumen; por ello es que matemáticamente se la calcula a través del cociente entre MASA (m) y VOLUMEN (v) δ=m/v Si la unidad de masa es el kg y la de volumen el m3, la unidad de densidad será: kg/m3. Sin embargo es muy frecuente que las unidades de medición de la densidad sean: [𝛿] = (𝑚) (𝑣) [𝛿] = = g/ cm3 (𝑚) (𝑣) = g/ ml Una consideración importante a tener en cuenta es la DIFERENCIA entre las magnitudes PESO y MASA. El PESO es un fuerza y como tal se mide en unidades específicas, entre ellas el Newton (en el sistema M.K.S) ; Dyn ( en el sistema C.G.S) o Kilogramo-fuerza ( en el sistema Técnico). El vínculo entre Peso y Masa viene dado por la segunda Ley de Newton (Ley de Masa) según la cual: “El peso de un cuerpo es directamente proporcional al producto entre la masa y la aceleración de la gravedad”. 𝑷 = 𝒎. 𝒈 Tanto el peso como la aceleración de la gravedad son magnitudes vectoriales; mientras la masa es una magnitud escalar. El valor de la aceleración de la gravedad en la Tierra es: 9,8 m/s2. Ejemplo: Según la balanza de la farmacia maso 70 kg. ¿Cuánto peso? P= m. g → P= 70 kg. 9,8 m/s2 → P= 686 kg.m/s2 = 686 N pues 1 kg.m/s2 = 1 N SI BIEN MI MASA ES DE 70 KG; PESO 686 N EN LA TIERRA 6 Colegio Nº6 D.E. 2 “Manuel Belgrano” Asignatura: FÍSICO-QUÍMICA Cursos: Profesor: BARRENECHE, Ignacio Turno Mañana 3º1º, 3º2º, 3º4º Turno Tarde: 3º1º,3º2º,3º3º EJERCITACIÓN PROPUESTA…RESOLVER EN LA CARPETA 1- Las siguientes propiedades fueron determinadas para un trozo de Fe. Indicar cuáles son intensivas y cuáles son extensivas: “Masa: 40 g, = 7,8 g/cm3, Color: grisáceo, Punto de fusión: 1535 C, Volumen: 5,13 cm3, Se oxida en presencia de aire húmedo, Es insoluble en agua” 2- Señale, entre las propiedades que se enumeran, cuáles son extensivas y cuáles intensivas: peso -olor - peso específico sabor - calor de vaporización- superficie- punto de ebullición- dureza - calor de fusión - forma cristalina. Investigue el significado de las propiedades que no conozca… 3- Indicar la diferencia entre material y cuerpo, una vez definidos los conceptos entonces indique cuáles corresponden a cada caso: Agua ; Arena; Clavos de hierro; Cubo de hielo; Barra de azufre; Sal de mesa; Mármol 4- Una sustancia funde a - 38°C y su punto de ebullición normal es 137°C. Se necesita realizar una experiencia con esa sustancia en estado líquido. ¿A cuál/es de estas temperaturas se puede realizar la experiencia? A) – 40°C; B) 130°C; C) 140°C; D) -20°C. Justifique su respuesta 5- Juana y Martín deber determinar la densidad de un cierto material. Juana empleará una masa de 200 g y Martín una masa de 150 g. ¿Cuál de los dos hará la determinación correcta? Justifique su respuesta. 6- Investigue qué se entiende por sustancia (simple y compuesta) y por mezcla, y a partir de ello decida en cada caso a qué concepto responde cada uno de los siguientes materiales: Vino; Metano (gas que empleamos para cocinar en casa); Helio (se emplea para inflar globos); Tinta; Aluminio; Dióxido de carbono; Leche; Plata (no dinero, sino el metal). 7- Teniendo en cuenta los valores de densidad que figuran en el siguiente cuadro indique qué volumen, expresado en litros, ocupan 5 kg de cada una de las sustancias. Sustancia Densidad ( g/cm3) Oro 19,30 Plomo 11,30 Hierro 7,80 Agua 1,00 Alcohol 0,79 Oxígeno 0,0014 MEZCLAS HOMOGÉNEAS y HETEROGÉNEAS: SISTEMAS MATERIALES y SUSTANCIAS Sistemas materiales Un sistema material es la porción del universo que se aísla real o imaginariamente para su estudio. Pueden ser de dos tipos: homogéneos o heterogéneos. Si al analizar las propiedades intensivas de un sistema encontramos que tienen valores constantes en cualquier zona de éste decimos que el sistema es homogéneo. Ej. agua salada, alcohol. Sistema homogéneo es aquel que en todos los puntos de su masa posee iguales propiedades intensivas. Si en cambio encontramos variación en los valores de las propiedades intensivas en por lo menos dos zonas del sistema, decimos que el sistema es heterogéneo. Ej.: agua con hielo, aceite y vinagre. Sistema heterogéneo es aquel que en distintos puntos de su masa posee diferentes propiedades intensivas. En estos sistemas encontramos distintas porciones en las cuales los valores de las propiedades intensivas son constantes, se trata de las distintas fases del sistema heterogéneo. Por ejemplo un sistema formado por agua y hierro en polvo está formado por dos fases; en una botella con soda (abierta, sin tapa y llena hasta el tope) se diferencian tres fases: la sólida del vidrio o plástico de la botella, la líquida de la soda y la gaseosa de las burbujas del dióxido de carbono. Las tres fases tienen límites claros definidos que pueden notarse a simple vista o mediante instrumentos adecuados (lupa, microscopio). A estos límites o superficies de discontinuidad los llamamos interfases. 7 Colegio Nº6 D.E. 2 “Manuel Belgrano” Asignatura: FÍSICO-QUÍMICA Cursos: Profesor: BARRENECHE, Ignacio Turno Mañana 3º1º, 3º2º, 3º4º Turno Tarde: 3º1º,3º2º,3º3º Mezclas y Sustancias Al clasificar a la materia se distinguen dos grandes grupos: las sustancias puras y las mezclas. El siguiente esquema muestra las diferencias entre ambos conceptos: MATERIA Sustancias puras Mezclas Sistema homogéneo de un solo componente Composición fija no pueden separarse por medios físicos temperatura constante durante cambios de estado Ejemplos: agua, hierro, dióxido de carbono Sistema homogéneo o heterogéneo, formado por dos o más componentes composición variable pueden separarse por métodos físicos temperatura variable durante los cambios de estado Ejemplos: agua y arena, aire (mezcla de gases). Cada uno de estos dos grupos se clasifica de la siguiente manera: Las sustancias cuyas moléculas están formadas por uno o varios átomos iguales entre sí no se pueden descomponer y se llaman sustancias puras simples. Ej.: O2, N2,Fe. Las sustancias cuyas moléculas están formadas por dos o más átomos diferentes se pueden descomponer y se denominan sustancias puras compuestas. Ej.: H2O, CO2. Materia aparece en la naturaleza en forma Heterogénea Homogénea como como Mezclas Homogéneas Sustancias Puras Mezclas Heterogéneas especialmente que son como Mezclas Gaseosas Agua y Aceite Compuestos Elementos como ejemplos como Dióxido de carbono, CO2 Aire (N2, O2) Agua, H2O Carbono, C Hidrógeno, H Oxígeno, O Sistemas homo y heterogéneos: Mètodos de Separación y Fraccionamiento Como ya vimos, las mezclas pueden ser homogéneas o heterogéneas. Podemos utilizar las diferencias en las propiedades de los sistemas materiales para lograr la separación de sus componentes. Así en un sistema formado por más de una fase (heterogéneo) éstas pueden separarse por métodos mecánicos. Cada una de las fases separadas puede estar formada por uno o varios componentes. En este caso los métodos de fraccionamiento permitirán separar cada uno de ellos. El siguiente cuadro resume los métodos de separación más frecuentes… 8 Colegio Nº6 D.E. 2 “Manuel Belgrano” Asignatura: FÍSICO-QUÍMICA Cursos: Profesor: BARRENECHE, Ignacio Turno Mañana 3º1º, 3º2º, 3º4º Turno Tarde: 3º1º,3º2º,3º3º ACTIVIDAD Nº4: Realice un esquema de un equipo de Destilación simple, indique sus partes y explique el fundamento del proceso de separación de los componentes de la mezcla. Para ir resumiendo lo visto acerca de las MEZCLAS…. EJERCITACIÓN PROPUESTA… 1- Indica si las siguientes afirmaciones son verdadera o falsas. Justifica a) Un sistema formado por un componente puede ser heterogéneo. b) Un sistema homogéneo puede estar formado por más de un componente. c) Un sistema con dos componentes líquidos debe ser homogéneo. d) Un sistema que tiene las mismas propiedades intensivas en toda su extensión es homogéneo. 2-Elige la opción correcta: “Un sistema formado por agua, sal totalmente disuelta, aceite y arena es…. a) homogéneo de 3 fases y 4 componentes b) heterogéneo de 3 fases y 4 componentes c) heterogéneo de 4 fases y 3 componentes d) ninguna de las respuestas anteriores es correcta 3- Analice los siguientes sistemas materiales indicando para cada uno de ellos: Clasificación, número de fases y componentes, composición centesimal y métodos de separación y/o fraccionamiento. a) 25 g azúcar + 100 g agua b) 3 g de limaduras de hierro+ 12 g azufre en polvo + 10 g de sal + 200 g de agua c) 10 g de virutas de cobre + 20 g corcho + 70 g alcohol de farmacia d) 80g de agua + 15g de azúcar + 5 g de piedras para peceras + 20 g talco e) 20 g agua + 5 g alcohol f) 0,3 kg de agua + 40 g de trozos de corcho + 70 dg de sal + 5 dag de arena 4- Nombrar un sistema heterogéneo formado por: a) Una fase líquida y una sólida. b) Dos fases sólidas. c) Dos fases sólidas y una líquida. d) Dos fases líquidas. El aire como mezcla: Composición y Propiedades ACTIVIDAD EN EQUIPOS (obligatoria) En grupos de no más de 4 personas deberán investigar y elaborar una INFOGRAFÍA* que haga referencia a: -Composición química del aire. -¿Cuáles son las “capas” de la atmósfera? -¿Qué es la presión atmosférica? ¿Cómo se mide? ¿Con qué instrumento? -Cuál es el papel de la atmósfera en el efecto invernadero y el cambio climático (*) Sería interesante que pudieran abordar la tarea con el docente de Tecnología de la Información. Puede ser en formato digital impresa o en papel hecha a mano 9 Colegio Nº6 D.E. 2 “Manuel Belgrano” Asignatura: FÍSICO-QUÍMICA Cursos: Profesor: BARRENECHE, Ignacio Turno Mañana 3º1º, 3º2º, 3º4º Turno Tarde: 3º1º,3º2º,3º3º SOLUCIONES ¿A qué llamamos SOLUCIÓN? Una solución es una mezcla homogénea, formada por dos o más componentes (soluto y solvente). Es una mezcla ya que las cantidades de los componentes no son fijas y no hay reacción química entre ellos. El soluto es el componente que cambia de fase cuando se produce la disolución, la sustancia que se disuelve, mientras que el solvente es el que disuelve. El soluto puede ser un sólido, un líquido o un gas y el disolvente también puede ser un sólido, un líquido o un gas. En las disoluciones entre un sólido y un líquido es fácil identificar el soluto y el disolvente; pero si se trata de dos o más líquidos o gases, la distinción entre soluto y disolvente es arbitraria aunque se suele considerar soluto al componente que está en menor proporción y solvente al que está en mayor proporción. Para que una sustancia pueda disolverse en otra, las partículas que la forman tienen que poder separarse entre sí y distribuirse entre las partículas del disolvente. Por lo tanto, tiene que haber fuerzas de atracción entre las partículas del soluto y las del disolvente. De los tres estados generales de la materia, por lo menos, teóricamente cada uno puede ser soluto o solvente en una solución, existe nueve tipo de soluciones con base en su estado físico. En la siguiente tabla se presenta esta clasificación y algunos ejemplos: Estado del soluto Estado del solvente Estados de la solución Ejemplos Gas Gas Gas Gas Liquido Liquido Agua mineral (CO2 y H2O) Gas Sólido Sólido Hidrogeno en paladio Liquido Liquido Liquido Bebidas alcohólicas Liquido Sólido Sólido Amalgamas (mercurio y oro) Sólido Liquido Liquido Azúcar o sal en agua Sólido Sólido Sólido Aleaciones cobre o zinc, forman el bronce Aire (O2 y N2) Solubilidad Es la cantidad máxima de un soluto que puede disolverse en una cantidad determinada de solvente a una temperatura previamente establecida. Generalmente, la solubilidad de una sustancia se expresa en gramos de soluto por cada 100 gramos de solvente, por ejemplo: A 20°C la máxima cantidad de cloruro de sodio que se puede disolver en 100g de agua son 36g. 10 Colegio Nº6 D.E. 2 “Manuel Belgrano” Asignatura: FÍSICO-QUÍMICA Cursos: Profesor: BARRENECHE, Ignacio Turno Mañana 3º1º, 3º2º, 3º4º Turno Tarde: 3º1º,3º2º,3º3º Factores que afectan la solubilidad: Un factor determinante de la solubilidad es la naturaleza del soluto y del solvente. Además de la naturaleza de sus compuestos, la temperatura y la presión también influyen en la solubilidad de una sustancia. SOLUBILIDAD depende de Tamaño de las partículas Naturaleza de Soluto Solvente Temperatura Presión generalmente nte importante en Al aumentar la temperatura Gases aumenta aumenta La solubilidad La solubilidad Según la cantidad de soluto las soluciones pueden ser: Solución saturada: Cuando una solución a una temperatura determinada en una cantidad dada de solvente se tiene disuelta la máxima cantidad de soluto que se pueda disolver. Por ejemplo, una solución de KBr que tenga disueltos 116g de KBr en 100g de agua a 50°C es una solución saturada, cualquier exceso de KBR se deposita en el fondo del recipiente. Solución insaturada: Cuando en una temperatura determinada en una cantidad dada de solvente se tiene disuelto menos soluto del que se puede disolver en ese solvente. En el caso de KBr una cantidad menor a los 116g de este compuesto en 100g de agua. Soluciones sobresaturadas: A pesar de que la concentración de una solución está limitada por la solubilidad máxima del soluto, es posible preparar soluciones que contengan disueltas una mayor cantidad se soluto a una temperatura establecida. La sobresaturación de una solución es un proceso muy cuidadoso; generalmente se realiza por calentamiento. Estas soluciones precipitan soluto al agitarlas. En las siguientes gráficas se ilustra una solución insaturada, una saturada y una sobresaturada respectivamente: A continuación se muestran unos valores de solubilidad de algunas sustancias en gramos de soluto en 100g de H 2O a 20°C y a 60°C. Soluto 20°C 60°C NaCl 36 37.3 KBr 67 85.5 KMnO4 64 22.2 AgNO3 225 525 0.00024 0.00036 BaSO4 En a. b. c. d. Solubilidad ACTIVIDAD: base en la tabla menciono si las siguientes soluciones son saturadas o insaturadas: 0.1g de KMnO4 en 100g de agua a 20°C. 22g de KMnO4 en 100g de agua a 20°C. 20g de KMnO4 en 100g de agua a 20°C. 1g de KMnO4 en 100g de agua a 20°C. 11 Colegio Nº6 D.E. 2 “Manuel Belgrano” Asignatura: FÍSICO-QUÍMICA Cursos: Profesor: BARRENECHE, Ignacio Turno Mañana 3º1º, 3º2º, 3º4º Turno Tarde: 3º1º,3º2º,3º3º ANÁLISIS DE CURVAS DE SOLUBILIDAD 1. Se mezclan 600 g de nitrato de potasio en 1 litro de agua a 50 oC y posteriormente se deja enfriar hasta temperatura ambiente (aproximadamente 20 oC) (H2O=1,0 g/cm3) a-Clasificar el sistema a 20 oC y calcular la masa de sólido excedente, en caso que lo hubiera b-Clasificar el sistema a 50 oC c-Indicar a qué temperatura el sistema es homogéneo y la solución es saturada d- Si se mezclan 100 g de nitrato de potasio en 200 g de agua, ¿a qué temperatura se satura la solución? 2. Los siguientes datos corresponden a la solubilidad del carbonato de litio agua: en Temperatura (oC) 10 20 30 40 50 Solubilidad (g st/100 g sv) 1,43 1,33 1,25 1,17 1,08 Utilizarlos para resolver las siguientes consignas: a-Graficar la solubilidad del carbonato de litio en función de la temperatura. Comentar el gráfico obtenido b-Si se mezclan 2,4 g de soluto en 200 g de agua, a 20 oC, ¿se obtiene una solución o un sistema heterogéneo? Justificar la respuesta mediante cálculos c-Para obtener una solución saturada con los datos del problema anterior, ¿es necesario aumentar o disminuir la temperatura? Justificar la respuesta 3 d-¿A qué temperatura se obtiene una solución saturada cuando se mezclan 6,25 g de soluto en medio litro de agua? 2O=1,0 g/cm ) 3-La salmuera se utiliza, entre otras cosas para la preparación y conservación de alimentos. Se puede considerar a la salmuera como una solución saturada de sal de mesa en agua. Teniendo en cuenta que la solubilidad del cloruro de sodio (sal de mesa) a 25 oC es 36 g st/100 g sv, calcular qué masa de sal se necesita para preparar 1 kg de solución. 4- A la vista de la tabla siguiente: Solubilidad (g de soluto / 100 g de agua) T(ºC) Nitrato de plata Cloruro De sodio Bromuro de potasio 0 122 37,5 55 20 222 36 65 40 376 36,6 75 60 525 37,3 85 80 669 38,4 95 100 952 39,8 105 12 Colegio Nº6 D.E. 2 “Manuel Belgrano” Asignatura: FÍSICO-QUÍMICA Cursos: Profesor: BARRENECHE, Ignacio Turno Mañana 3º1º, 3º2º, 3º4º Turno Tarde: 3º1º,3º2º,3º3º a. Indica de qué sustancia se trata. Solubilidad (g soluto / 100 g de agua) b. A la temperatura de 80ºC, echamos en 240 ml (o 240 cm3) de agua 315 g de soluto. ¿Qué cantidad quedará sin disolver en el fondo del vaso? 110 c. Filtramos para separar el sólido sin disolver… ¿Cómo estará la disolución a 80ºC? 100 d. ¿Qué ocurrirá si enfriamos hasta 20ºC? e. Calcula la cantidad de sólido que precipitará a 20ºC. 90 20 40 60 80 T(ºC) 5- La gráfica muestra las curvas de solubilidad de distintas sustancias en agua: a) Indique las solubilidades siguientes: 1) Cloruro de potasio, KCl, a 80 ºC. 2) Nitrato de sodio, NaNO3, a 50 ºC. 3) Amoníaco, NH3, a 40 ºC. b) ¿A qué temperatura tienen la misma solubilidad el nitrato de potasio, KNO 3, y el nitrato de sodio, NaNO3? c) ¿Qué sustancia es más soluble a 10ºC, el clorato de potasio, KClO3, o el sulfato de cerio (III), Ce2(SO4)3? d) ¿Se podrán disolver 15 g de cloruro de potasio en 30 ml de agua a 50 ºC? 13 Colegio Nº6 D.E. 2 “Manuel Belgrano” Asignatura: FÍSICO-QUÍMICA Cursos: Profesor: BARRENECHE, Ignacio Turno Mañana 3º1º, 3º2º, 3º4º Turno Tarde: 3º1º,3º2º,3º3º EL AGUA COMO SUSTANCIA y COMO RECURSO Actividad propuesta En base a la lectura del capítulo: “Agua, Ríos de vida, mares de penas” y a la investigación de profundización que creas necesaria respondé a las siguientes cuestiones para luego discutir en clase. 1-¿Cuáles son las razones por las cuales podríamos afirmar que el agua es una sustancia indispensable para la vida en nuestro planeta? 2-Confeccioná una red conceptual o un mapa semántico en el que se pongan de manifiesto las sorprendentes propiedades del agua. Explicá cada una de ellas 3-¿Por qué razón el hielo flota en agua líquida? 4- ¿Por qué podríamos afirmar que el agua es buen conductor del calor y de la electricidad si a temperatura ambiente es líquida? 5- En un mapa señala y nombrá todos los mares que hay en el planeta Tierra. Investigá por qué en el Mar Muerto si intentamos sumergirnos flotamos. ¿A qué se debe? 6-¿Por qué no podríamos consumir agua de mar? 7- Confeccioná un esquema en el que se ponga de manifiesto el ciclo del agua y explicalo. 8- ¿Cuáles son los principales contaminantes biológicos, químicos e industriales del agua? 9-¿Por qué decimos que el agua que consumimos no es “sólo agua”? ¿Qué es el agua mineral, el agua mineralizada y el agua destilada? 10- Leyendo el apartado “Aguas Negras” ¿Podrías explicar a qué se debe el desagradable olor de nuestro Riachuelo? Tomando como referencias las respuestas que has dado en este cuestionario, en grupos de 4 personas, deberás elaborar una Infografía y entregar como actividad calificable. Aquí te acerco una como ejemplo que he extraído de internet… 14