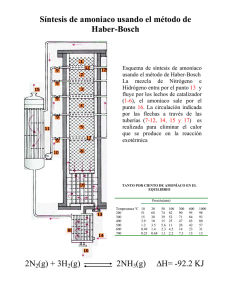
U.P.E.A. – INGENIERÍA DE GAS Y PETROQUÍMICA PETROQUÍMICA I – SEMESTRE I/2020 NOMBRE: UNIV. NELY ABIRARI LIMACO DOCENTE: ING. FREDDY FELIX GOMEZ CHOQUE FECHA: 21/05/20 PRODUCCIÓN DE AMONIACO Y UREA La urea (NH 2 CONH 2) es de gran importancia para la industria agrícola como fertilizante rico en nitrógeno. En Kapuni, Petrochem fabricación de amoniaco y luego convertir la mayoría de ella en urea. El resto se vende para uso industrial. SÍNTESIS DE AMONIACO El amoníaco se sintetiza a partir de hidrógeno (a partir de gas natural) y de nitrógeno (desde el aire). El gas natural contiene algunos compuestos sulfurosos que dañan los catalizadores utilizados en este proceso. Estos se eliminan por la reacción de ellos con óxido de zinc, por ejemplo. ZnO + H 2 S → ZnS + H 2 O El metano del gas natural se convierte a hidrógeno: CH 4 + H 2 O 3H 2 + CO CH 4 + 2H 2 O 4H 2 + CO 2 CO + H 2 O H 2 + CO 2 Aire es mezclado en con el gas corriente para dar un hidrógeno: nitrógeno relación de 3: 1. Agua, bono monóxido y de carbono dióxido de (todos de que el veneno del hierro catalizador utilizado en el amoníaco síntesis) se eliminan. El monóxido de carbono se convierte en dióxido de carbono para su uso en la producción de urea, y el dióxido de carbono se elimina: CO + H 2 O CO 2 + H 2 Las trazas restantes de CO y CO 2 se convierten en metano y luego los gases se enfrían hasta que el agua se vuelve líquida y se puede eliminar fácilmente. El nitrógeno y el hidrógeno son entonces reaccionar a alta temperatura y presión usando un hierro catalizador para formar amoníaco: N 2 + 3H 2 2NH 3 SÍNTESIS DE UREA La urea está hecha de amoníaco y dióxido de carbono. El amoníaco y de carbono dióxido se alimentan en el reactor a alta presión y temperatura, y la urea se forman en una o en dos pasos de reacción 2NH 3 + CO 2 NH 2 COONH 4 (carbamato de amonio) NH 2 COONH 4 H 2 O + NH 2 CONH 2 (urea) La urea contiene NH 3 y CO 2 sin reaccionar y carbamato de amonio. A medida que se reduce la presión y se aplica calor, el NH 2 COONH 4 se descompone en NH 3 y CO 2. El amoníaco y el dióxido de carbono se reciclan. La solución de urea se concentra luego para dar un 99,6% p/p de urea fundida, y se granula para su uso como fertilizante y materia prima química. La urea contiene NH 3 y CO 2 sin reaccionar y carbamato de amonio. A medida que se reduce la presión y se aplica calor, el NH 2 COONH 4 se descompone en NH 3 y CO 2. El amoníaco y el dióxido de carbono se reciclan. La solución de urea se concentra luego para dar un 99,6% p / p de urea fundida, y se granula para su uso como fertilizante y materia prima química. INTRODUCCIÓN El amoníaco y la urea son dos productos químicos que son muy importantes para la economía de Nueva Zelanda. Este artículo ERS es un proceso utilizado por Petrochem en Kapuni, South Taranaki, a sintetizan amoniaco a partir de gas natural y aire, a continuación, sintetizan urea de este amoníaco y de carbono dióxido. Anualmente 105 000 toneladas de puro amoniaco (día 300 T -1) se producen en Kapuni, y más de esto se convierten a urea. Actualmente 182 000 toneladas de urea granulada se producen cada año (530 días T -1), pero esto es muy pronto espera que aumente a 274 000 toneladas. Usos de amoníaco y urea. Tal y como ha sido indicado anteriormente, la mayor parte del amoníaco se utiliza en sitio en la producción de urea. El resto se vende en el país para su uso en sistemas de refrigeración industrial y otras aplicaciones que requieren amoníaco anhidro. La urea se utiliza como un rico en nitrógeno de fertilizantes, y como tal es de gran importancia en la agricultura, uno de Nueva de Zelanda principales industrias. Se está también utilizarse como un componente en la fabricación de resinas para madera de procesamiento y en la levadura fabricación. EL PROCESO DE FABRICACIÓN DE AMONIACO El amoníaco se produce en un proceso conocido como el Haber proceso, en el que el nitrógeno y el hidrógeno reaccionan en la presencia de un hierro catalizador de forma de amoníaco. El hidrógeno se forma por reacción de gas natural y vapor a altas temperaturas y el nitrógeno es Supplied desde el aire 1. Otros gases (tales como agua y carbono dióxido) se eliminan desde el gas corriente y el nitrógeno y el hidrógeno pasan sobre un hierro catalizador a alta temperatura y presión para formar el amoníaco. El proceso se muestra esquemáticamente en la Figura 1. Paso 1 - Producción de hidrógeno El hidrógeno se produce por la reacción de metano con agua. Sin embargo, antes de esta puede ser llevada a cabo, todos sulfurosos compuestos deben ser removidos del gas natural para evitar catalizador envenenamiento. Estos se eliminan por calentamiento del gas a 400º C y la reacción que con el óxido de zinc: ZnO + H 2 S → ZnS + H 2 O Después de este, el gas se envió a la primaria reformador para vapor de reformado, donde sobrecalentado vapor se alimenta en el reformador con el metano. La mezcla de gas calentado con gas natural y purga de gas t o 770 o C en la presencia de un níquel catalizador. A esta temperatura, las siguientes reacciones de equilibrio se dirigen hacia la derecha, convirtiendo el metano en hidrógeno, dióxido de carbono y pequeñas cantidades de monóxido de carbono: CH 4 + H 2 O 3H 2 + CO C H 4 + 2H 2 O 4H 2 + CO 2 CO + H 2 O H 2 + CO 2 Esta mezcla gaseosa se conoce como gas de síntesis. Paso 2: adición de nitrógeno La síntesis de gas se enfría ligeramente a 735 o C. Es entonces fluye a la secundaria reformador donde está mezclado una calculada cantidad de aire. Es altamente exotérmica reacción entre el oxígeno y metano produce más hidrógeno. Las reacciones importantes son: CO + H 2 O CO 2 + H 2 O 2 + 2CH 4 2CO + 4H 2 Figura 1 - Esquema representación del amoníaco síntesis proceso 2O 2 + CH 4 2H 2 O + CO En adición, la necesaria nitrógeno se añadió en la secundaria reformador. Como el catalizador que se utiliza para formar el amoníaco es puro hierro, agua, carbono dióxido y de carbono monóxido deben ser removidos del gas residual para prevenir la oxidación de la plancha. Esto se lleva a cabo en los siguientes tres pasos. Paso 3 - Eliminación de monóxido de carbono Aquí el monóxido de carbono se convierte en dióxido de carbono (que se usa más adelante en la síntesis de urea) en una reacción conocida como la reacción de cambio de gas de agua: CO + H 2 O CO 2 + H 2 Esto se logra en dos pasos. Primero, la corriente de gas se pasa sobre un catalizador de Cr / Fe 3 O 4 a 360 o C y luego sobre un catalizador de Cu / ZnO / Cr a 210 o C. La misma reacción ocurre en ambos pasos, pero el uso de los dos pasos maximiza la conversión. Paso 4 - Eliminación de agua l La mezcla de gases se además se enfrió a 40 o C, en el que la temperatura del agua se condensa a cabo y se retiró. Paso 5 - Eliminación de óxidos de carbono. Los gases son luego bombeados hasta a través de una contracorriente de UCARSOL® solución (una Solución MDEA, ver artículo). Carbon dióxido es altamente soluble en UCARSOL®, y más de 99,9% de la CO 2 en la mezcla se disuelve en ella. El restante CO 2 (así como cualquier CO que no sea convertida a CO 2 en el Paso 3) se convirtieron a metano (metanización) usando un Ni / Al 2 O 3 catalizador en 32 5 o C: 2 CO + 3H 2 CH 4 + H 2 O CO 2 + 4H 2 CH 4 + 2H 2 O El agua que se produce en estas reacciones se elimina por condensación a 40ºC como anteriormente. El carbono dióxido está despojado de la UCARSOL® y utilizado en la fabricación de urea. El UCARSOL se enfría y se reutiliza para eliminar el dióxido de carbono. Paso 6 - Síntesis de amoníaco La mezcla de gases de ahora se enfría, comprimido y alimentado en el amoníaco síntesis bucle (ver Figura 1). Una mezcla de amoníaco y que no han reaccionado los gases que han ya sido alrededor del bucle se mezcló con el entrante de gas corriente y se enfrió a 5 o C. El amoníaco presente se retira y los que no han reaccionado los gases calentó a 400ºC a una presión o Fº330 barg y pasó sobre un catalizador de hierro. Bajo estas condiciones de 26% de la de hidrógeno y nitrógeno se convierte a amoníaco. El gas de salida desde el amoníaco convertidor se enfría de 220 o C a 30 o C. Este enfriamiento del proceso se condensa más de la mitad del Amoniaco. que está a continuación, separa hacia fuera. El restante gas se mezcla con más enfriado, comprimido entrante gas. La reacción que ocurre en el convertidor de amoníaco es: N 2 + 3H 2 2NH 3 El amoniaco se descomprime rápidamente a 24 barg. En esta presión, como impurezas tales como metano y de hidrógeno convertido en gases. La mezcla de gases por encima del amoníaco líquido (que también contiene niveles significativos de amoníaco) se retira y se envía a la unidad de recuperación de amoníaco. Este es un sistema absorbente-separador que usa agua como solvente. El restante de gas (purga gas) se usa como combustible para la calefacción de la primaria reformador. El amoniaco puro restante se mezcla con el amoniaco puro de la condensación inicial anterior y está listo para su uso en la producción de urea, para el almacenamiento o para la venta directa. Los iones específicos del producto de amoníaco se dan en la Tabla 2. Tabla 1 - Composición de la corriente de gas después de cada paso del proceso Gas Paso 1 Paso 2 Paso 3 * Paso 5 de alimentación Ideal N2 2.9 ‡ 0.8 21,7 19,9 24,7 25 H2 - 68,3 56,5 60,1 74 75 CO - 6.2 8,9 0.1 - - CO 2 4.1 14,5 11,8 18,9 - - CH 4 83,4 10,2 0.7 0.7 1.0 - Arkansas - - 0,3 0,3 0,3 - otro hidrocarburos 9.6 - - - - - El agua es no aparece entre los gases de efecto considerados debido a sus niveles son altamente variables. Toda el agua se elimina después del paso 4. Todas las cifras se dan en% en moles (es decir, el porcentaje de la total del número de moles de gas presentes que son debido a este gas). La composición gaseosa después de la etapa 4 es la misma como que después de la Etapa 3 como Paso 4 es simplemente la eliminación de agua. Tabla 2 - Especificaciones de amoníaco Componente Composición Amoníaco 98% mínimo Humedad 1500 g T -1 máximo Petróleo 85 g T -1 máximo Hierro 1.0 g T -1 máximo