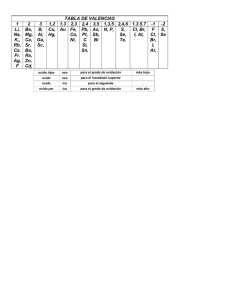
NOMENCLATURA QUIMICA INORGANICA Química de decimo GRADO : décimo NOMBRE ESTUDIANTE : Docentes : https://www.youtube.com/watch?v=0rpgzU6To0I Establece un conjunto de reglas que permiten determinar el nombre apropiado a los compuestos químicos. Estas reglas son dadas por una organización llamado IUPAC (Unión Internacional de Química Pura y Aplicada). Anteriormente se daban nombres arbitrarios, y en algunos casos aún se usan como agua, gas carbónico, cal viva, amoniaco, soda cáustica, etc., sin regla alguna. Para escribir la fórmula correcta de los compuestos es necesario conocer: Símbolo Su número de oxidación o valencia Y la ubicación en la tabla Los compuestos se agrupan en familias o función química que se caracterizan porque tienen un grupo funcional, determinado, que no es más que una agrupación de átomos que le dan propiedades similares a las sustancias. Ej: FUNCION GRUPO FUNCIONAL Alcohol OH Ej: Oxido O FUNCIONES QUIMICAS INORGANICAS 1. HIDRURO H2 + METAL NO METAL + H2 HIDRACIDO + O2 + O2 OXIDO METALICO OXIDO NO METALICO + H2 O HIDROXIDO + H2 O + SAL NEITRA OXACIDO + HALOIDEA FUNCION HIDRURO: https://www.youtube.com/watch?v=9J2TPSa5j2k https://www.youtube.com/watch?v=B1GZY4SQrkI&list=PLlRLQaWvQm6YcIdU1jhcp9tEsm7xoMfb_&index=7 Es cuando se combina él hidrogeno con un metal de los grupos I y II y forma compuestos binarios — el H presenta estado de oxidación es –1 METAL + H2 (HIDRURO) MH 2Na + H2 2Na+1 H-1 SODIO + HIDROGENO HIDRURO DE SODIO METAL Reacciona HIDROGENO Forma HIDRURO Nomenclatura: Se debe anteponer la palabra HIDRURO y seguido EL NOMBRE DEL METAL así. Li+1 H-1 — Hidruro de Litio K+1 H-1 — Hidruro de Potasio Ca+2 H-1 2 — Hidruro de Calcio TALLER 1 A. Nombrar: Rb H Ba H2 Be H2 Fr H B. Representar Hidruro de magnesio, hidruro de cesio, hidruro de rubidio, hidruro de estroncio FUNCION OXIDO Son combinaciones del oxígeno con otro elemento. existen dos clases de óxidos: 1. Los óxidos básicos o metálicos. 1. Los óxidos ácidos o no metálicos 1. Oxidos básicos o metálicos: Son combinaciones entre el oxígeno con un elemento metálico. Ej: M + O2 OXIDO BASICO 2Ba + O2 2Ba+2 O-2 BARIO + OXIGENO OXIDO DEBARIO 2. Oxidos ácidos o no metálicos o anhídridos: Son combinaciones entre un elemento no metálico y el oxígeno Ej: No-metal + O2 OXIDO ACIDO C + O2 C+4 O-22 CARBONO + OXIGENO DIOXIDO DE CARBONO NO-METAL METAL OXIGENO Forma Forma OXIDOS ACIDOS OXIDOS BASICOS COMO NOMBRAR OXIDOS https://www.youtube.com/watch?v=4SYH0Am8WzM https://www.youtube.com/watch?v=4FdLXk1Jv3E&list=PLlRLQaWvQm6YcIdU1jhcp9tEsm7xoMfb_&index=2 https://www.youtube.com/watch?v=PG-fJrkOH44 https://www.youtube.com/watch?v=V9ejTpXxw8w https://www.youtube.com/watch?v=_Rma6Y0bsP4 https://www.youtube.com/watch?v=lBCHQugsl2E I. Cuando los óxidos tienen un solo número de oxidación (principalmente los óxidos básicos). Se escribe la palabra ÓXIDO, luego DE y seguido el NOMBRE DEL METAL así: -2 Li+1 2 OOXIDO DE LITIO Li + O2 LITIO + OXIGENO 2Be + O2 BERILIO + OXIGENO Be +2 O-2 2 Be +2 O-2 OXIDO DE BERILIO TALLER 2 A. Formar los siguientes óxidos Na + O2 Ca + O2 Al + O2 B. Nombrar Ag2O ZnO Fr2O C. Representar: Oxido de galio Oxido de rubidio Oxido de cesio II. Cuando tienen dos números de oxidación: SE UTILIZAN LOS SIGUIENTES SISTEMAS 1. NOMENCLATURA TRADICIONAL, se utiliza: tabla siguiente PREJIJO HIPO SUFIJO OSO OSO 2 # ICO Tabla 1 3# 4# PER ICO Se escribe la palabra OXIDO seguido de LA RAIZ DEL METAL o NO METAL y de la terminación o sufijo O SO o ICO de acuerdo al número de oxidación. Raíces de elementos poco comunes: Elemento Cu Pb Fe Au nombre en latín cuprum Plumbum Ferrum Aurum Raíz cupr plumb Ferr aur Los demás trabajan con su nombre Ej Fe + O2 1. Fe 2. 1. 2. . OXIDO OXIDO Ej Hg FERR FERR + O2 Fe +O2 Fe+2 O-2 +O2 Fe+3 2 O-23 OSO para menor número de oxidación ICO para mayor número de oxidación 1. Hg 2. 1. OXIDO MERCURI OSO 2. . OXIDO MERCURICO Hg + + O2 Hg+1 2 O-2 O2 Hg+2 O-2 para menor número de oxidación para mayor número de oxidación Para representar: OXIDO CARBONICO para mayor número de oxidación OXIDO CUPROSO para menor número de oxidación a. TALLER 3. Formar los siguientes óxidos Co + O2 Pb + O2 Au + O2 C+4 O-22 Cu+1 2O-2 c. nombrar SnO Fe2O3 PtO2 b. Representar: Oxido carbonoso Oxido Plumbico Oxido Niqueloso c. En todos los ejemplos debe decir si son metales o no-metales y la reacción de donde viene 2. METODO STOCK Se nombra la palabra OXIDO, seguido de DE y el NOMBRE DEL METAL O NO METAL y en un paréntesis el NUMERO DE OXIDACIÓN EN ROMANO, del metal o no metal. Ej: C+4O-22 OXIDO DE CARBONO (II) Fe+3 2O-23 OXIDO DE HIERRO ( III) Representar: OXIDO DE MERCURIO (I) Hg2O1 Hg2O 3. NOMENCLATURA IUPAC (preferiblemente para óxidos ácidos) Se emplea un prefijo que me indica la cantidad de oxígenos presentes en el compuesto; estos son: 1- MONO 2- DI 3- TRI 4- TETRA 5- PENTA 6- HEXA 7- HEPTA 8- OCTA Se escribe el PREFIJO NUMÉRICO la palabra OXIDO seguido de DE el PREFIJO NUMÉRICO para el otro elemento (que son los mismos que en los oxígenos) y el nombre del elemento Ej: C+4O-22 Sn+2O-2 DIOXIDO DE CARBONO MONOXIDO DE ESTAÑO Representar PENTOXIDO DE DIARSENICO As2O5 EJEMPLO DE LAS TRES NOMENCLATURAS COMPUESTO Cl+12O-2 S+6O-23 NOMENC. SISTEM. monóxido de dicloro trióxido de azufre NOMENC. STOCK óxido de cloro (I) NOMENC. TRADICIONAL óxido de azufre (VI) anhídrido sulfúrico anhídrido hipocloroso TALLER 4 Pasar a todos los sistemas posibles del taller 3 III. Cuando tienen tres o más números de oxidación (PARA EL SISTEMA IUPAC Y METODO STOCK CONTINUO IGUAL, PARA EL ANTIGUO SETRABAJA con la tabla ya vista. Se trabaja igual que cuando tiene dos números solo se tiene en cuenta cuando se aplica cada prefijo y/o sufijo. Ej El cloro tiene 4 # de oxidación +1, +3, +5, +7 y forma los siguientes óxidos. Cl+12O-2 Cl+32O-23 Cl+52O-25 OXIDO HIPO CLOROSO OXIDO CLOROSO OXIDO CLORICO Cl+72O-27 OXIDO PER CLORICO TALLER 5 2. Hacer los óxidos posibles de los halógenos y de donde se forman, nombrarlos 3. Hacer los óxidos posibles de los del grupo V de donde se forman, nombrarlos. 4. Todos se deben nombrar en todos los sistemas. REPRESENTAR: - DIOXIDO DE AZUFRE - MONOXIDO DE DINITROGENO - HEPTOXIDO DE DICLORO - OXIDO DE SELENIO (IV) - OXIDO TELUROSO - OXIDO HIPO SULFUROSO - OXIDO FOSFORICO - OXIDO DE YODO (VII) - OXIDO DE FOSFORO (III) FUNCION HIDROXIDO https://www.youtube.com/watch?v=YZQkQ2xDIq0 https://www.youtube.com/watch?v=2AMIVzzqtPQ&list=PLlRLQaWvQm6YcIdU1jhcp9tEsm7xoMfb_&index=3 https://www.youtube.com/watch?v=b2Ao2ZShR68 Se conocen como hidróxidos los compuestos iónicos formados por un ion metálico y el ion hidroxi (OH )-1 = (O-2H+1)-1 Se forman de óxido metálico MO + H2O Ca+2 O-2 + H+12O-2 Oxido de calcio M(OH) Ca+2 (O-2H+1)2 + agua = hidróxido de calcio NOMENCLATURA DE HIDROXIDOS Se escribe la palabra HIDROXIDO el DE el Nombre del METAL (para los que tienen un solo número de oxidación) Para los que tienen dos números de oxidación se usa nomenclatura tradicional o stock Ejemplo Ag (OH) la plata solo tiene un número de oxidación el +1 y se nombra HIDRÓXIDO DE PLATA (porque solo hay un hidróxido de plata) Cu (OH)2 El cobre tiene dos números de oxidación el +1, +2 en este compuesto está trabajando con +2 y por ser mayor número de oxidación terminaría en ico HIDROXIDO CUPRICO o HIDROXIDO DE COBRE (II). EJEMPLO DE LAS TRES NOMENCLATURAS COMPUESTO Pb+2 (OH)2 NOMEN. SISTEMÁTICA dihidróxido de plomo NOMEN. STOCK NOMEN. TRADICIONAL hidróxido de plomo (II) hidróxido plumboso TALLER 6 Formar los siguientes hidróxidos Zn, Fe, Al, Hg, Ba, Nombrar K(OH) Cs(OH) Pb(OH)4 Co(OH)2 Representar Hidróxido de cobalto (II) Hidróxido de francio Hidróxido de berilio Hidróxido ferroso Hidróxido niquelos FUNCION ÁCIDOS (H+1). Los ácidos son compuestos que se originan por combinación del agua con un anhídrido u óxido ácido, o bien por disolución de ciertos hidruros no metálicos en agua. En el primer caso se denominan oxácidos y en el segundo, hidrácidos. Ácido, también es toda sustancia que en solución acuosa se ioniza, liberando cationes hidrógeno. HIDRÁCIDOS. Los hidrácidos Se nombran con la palabra ácido, como nombre genérico, y como nombre específico se escribe el nombre del no metal y se le agrega el sufijo –hídrico. Al igual que en estado gaseoso el nombre genérico es nombrado por el elemento más electropositivo. https://www.youtube.com/watch?v=D79s_RH7Hvo https://www.youtube.com/watch?v=4te-QUgFnug https://www.youtube.com/watch?v=T5ehBeGHbAs https://www.youtube.com/watch?v=EG3iGIRo3fU https://www.youtube.com/watch?v=PNRihu8L1BE COMPUESTO EN ESTADO PURO EN DISOLUCIÓN H+1 Cl-1 cloruro de hidrógeno ácido clorhídrico H+1 2Se-2 seleniuro de hidrógeno ácido selenhídrico OXÁCIDOS También llamados oxoácidos y oxiácidos, son compuestos originados de la combinación del agua con un anhídrido u óxido ácido Oxido no metálico o anhidrido + Agua → oxácido COMPUESTO NOM. TRADICIONAL H+1 Cl+7 O-2 4 ácido perclórico H+1 2S+2 O-2 2 ácido hiposulfuroso Como se describe previamente los oxácidos están formados por un anhídrido (no metal + oxígeno) y el hidrógeno, pero como se indica en la secciones de anhídridos y óxidos básicos algunos metales, también pueden formar anhídridos, y por esta razón, también pueden formar oxácidos. COMPUESTO NOM. TRADICIONAL H+12Cr+7 O-2 4 ácido crómico H+12Mn+6 O-2 4 ácido mangánico Taller 7 a. b. c. d. e. f. Nombra en qué casos de nuestra vida cotidiana utilizamos los ácidos, sin olvidar su utilidad y los cuidados que se deben tener al ser manipulados. Escriba las utilidades de los ácidos en la industria y nombre 5 productos. Escribe el nombre de los siguientes compuestos inorgánicos utilizando los tres tipos de nomenclatura (Nomenclatura Tradicional, Sistemático HMnO4 HNO3 PH3 H2S HPO2 H2SO4 g. HBr a. b. c. d. e. f. g. h. Escribe la fórmula para los siguientes ácidos: acido nitroso Ácido perclórico Ácido Yódico (III) Ácido crómico Ácido sulfúrico Ácido carbónico Ácido selénhidrico Acido yodhídrico SALES (METAL-NO METAL). https://www.youtube.com/watch?v=lonv1Zlkq1I https://www.youtube.com/watch?v=-IVQiZW8Sps https://www.youtube.com/watch?v=wrlw3qKpj2Y https://www.youtube.com/watch?v=xRSkwbvtW8c&t=2s Las sales son compuestos que resultan de la combinación de sustancias ácidas con sustancias básicas, hay distintos tipos o formas de clasificarlas que son: sales neutras, sales haloideas, sales ácidas y sales básicas. Para nombrar las sales, simplemente se cambia el sufijo del ácido que las origina, de la siguiente forma: HIDRICO ----- URO SALES HALOIDEA: Ca+2 Cl-12 Hidrácido + Hidróxido → Agua + Sal neutra H+1Cl-1 + Ca+2(OH)-1 2 H+12O-2 + Ca+2Cl-12 Ácido clorhídrico más hidróxido de calcio produce agua más cloruro de calcio son compuestos formados por la reacción de un ácido con un hidróxido formando también agua. Para nombrarlos en el sistema tradicional, stock y sistemático se aplican las reglas generales usando el nombre del no metal con el sufijo –uro como nombre genérico y el nombre del metal como nombre especifico. Las sales neutras COMPUESTO NOM. SISTEMÁTICA NOM. STOCK fluoruro calcio o cálcico Ca+2F-12 Co+2S-2 NOM. TRADICIONAL monosulfuro de cobalto sulfuro de cobalto (II) sulfuro cobaltoso SALES NEUTRA Oxácido + Hidróxido → Agua + Sal neutra H+1Cl+5O-23 + Ca+2 (OH)-12 H+12O-2 + Ca+2(Cl+5O-23)2 (+2) + ((+5)+(-6)) = 0 2 (+2) + (+10)+ (-12) = 0 COMPUESTO NOM. TRADICIONAL Na3PO4 fosfato de sodio CaSO4 sulfato de calcio Taller 8 a. b. c. d. e. f. g. Nombra en qué casos de nuestra vida cotidiana utilizamos las sales, sin olvidar su utilidad y los Escriba las utilidades de las sales en la industria y nombre 5 productos. Escribe el nombre de los siguientes compuestos inorgánicos utilizando los tres tipos de nomenclatura (Nomenclatura Tradicional, Stock, Sistemática cuidados que se deben tener al ser manipulados. CoS NaF2 Fe2(CO3)3 NaNO3 Cu(NO2)2 AlP CuBr 1. Escribe la fórmula para los siguientes sales: Selenito de plomo (II) Yoduro de Berilio Sulfuro de cobalto (III) clorito de Ferroso Clorato de hierro(III) Nitrito de potasio Hipoclorito de litio Per yodato de litio Nitrito de niqueloso Cloruro de estaño (IV) Bromuro de cobalto (III) Sulfuro de plomo (II)