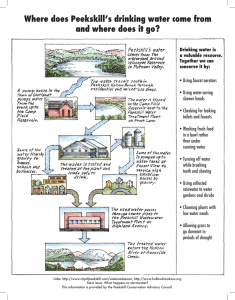
Reversed-Phase Chromatography PRINCIPLE Reversed-phase chromatography is the term used to describe the state in which the stationary phase is less polar than the mobile phase. Chemically bonded octadecylsilane (ODS), an nalkane with 18 carbon atoms, is the most frequently used stationary phase. C8 and shorter alkyl chains and also cyclohexyl and phenyl groups provide other alternatives. Phenyl groups are more polar than alkyl groups. Water is often described as the strongest elution medium for chromatography, but in fact this is only true for adsorption processes. Water may interact strongly with the active centres in silica and alumina, so that adsorption of sample molecules becomes highly restricted and they are rapidly eluted as a result. Exactly the opposite applies in reversed-phase systems: water cannot wet the nonpolar (hydrophobic¼water repellent) alkyl groups and does not interact with them in any way. Hence it is the weakest mobile phase of all and gives the slowest sample elution rate. The greater the amount of water in the eluent, the longer is the retention time. The chromatogram depicted in Figure 10.1 demonstrates this point. Benzene (2), chlorobenzene (3), o-dichlorobenzene (4) and iodobenzene (5) were eluted on a reversedphase column by various methanol–water mixtures (1 being the refractive index peak of the solvent used for sample dissolution). Sample compounds are better retained by the reversed-phase surface the less water soluble (i.e. the more nonpolar) they are. The retention decreases in the following order: aliphatics>induced dipoles (e.g. CCl4)>permanent dipoles (e.g. CHCl3)>weak Lewis bases1 (ethers, aldehydes, ketones)>strong Lewis bases (amines)>weak Lewis acids (alcohols, phenols)>strong Lewis acids (carboxylic acids). Also, the retention time increases as the number of carbon atoms increases, as shown in Figure 10.2 for the separation of dec-1-ene (1), undec-1-ene (2), dodec-1-ene (3), tridec-1-ene (4) and tetradec-1-ene (5) on an ODS column. As a general rule the retention increases with increasing contact area between sample molecule and stationary phase, i.e. with increasing number of water molecules which are released during the ‘adsorption’ of a compound. Branched-chain compounds are eluted more rapidly than their corresponding normal isomers. Yet the retention mechanisms on reversed-phase are complex and not easy to understand.2 Cromatografía de fase inversa PRINCIPIO La cromatografía de fase inversa es el término utilizado para describir el estado en el que la fase estacionaria es menos polar que la fase móvil. El octadecilsilano químicamente unido (ODS), un n-alcano con 18 átomos de carbono, es la fase estacionaria más utilizada. Las cadenas de alquilo C8 y más cortas y también los grupos ciclohexilo y fenilo proporcionan otras alternativas. Los grupos fenilo son más polares que los grupos alquilo. El agua a menudo se describe como el medio de elución más fuerte para la cromatografía, pero de hecho esto solo es cierto para los procesos de adsorción. El agua puede interactuar fuertemente con los centros activos en sílice y alúmina, por lo que la adsorción de las moléculas de muestra se vuelve altamente restringida y como resultado se eluyen rápidamente. Exactamente lo contrario se aplica en los sistemas de fase inversa: el agua no puede humedecer los grupos alquilo no polares (hidrófobos = repelentes al agua) y no interactúa con ellos de ninguna manera. Por lo tanto, es la fase móvil más débil de todas y proporciona la tasa de elución de muestra más lenta. Cuanto mayor es la cantidad de agua en el eluyente, mayor es el tiempo de retención. El cromatograma representado en la figura 10.1 demuestra este punto. El benceno (2), el clorobenceno (3), el o-diclorobenceno (4) y el yodobenceno (5) se eluyeron en una columna de fase inversa mediante varias mezclas de metanol y agua (1 es el pico del índice de refracción del disolvente utilizado para la disolución de la muestra) . Los compuestos de muestra quedan mejor retenidos por la superficie de fase inversa cuanto menos solubles en agua (es decir, más no polares) son. La retención disminuye en el siguiente orden: alifáticos> dipolos inducidos (por ejemplo, CCl4)> dipolos permanentes (por ejemplo, CHCl3)> bases de Lewis débiles1 (éteres, aldehídos, cetonas)> bases de Lewis fuertes (aminas)> ácidos de Lewis débiles (alcoholes, fenoles) > ácidos de Lewis fuertes (ácidos carboxílicos). Además, el tiempo de retención aumenta a medida que aumenta el número de átomos de carbono, como se muestra en la Figura 10.2 para la separación de dec-1-eno (1), undec-1-eno (2), dodec-1-eno (3), tridec-1-eno (4) y tetradec-1-eno (5) en una columna ODS. Como regla general, la retención aumenta al aumentar el área de contacto entre la molécula de muestra y la fase estacionaria, es decir, al aumentar el número de moléculas de agua que se liberan durante la "adsorción" de un compuesto. Los compuestos de cadena ramificada se eluyen más rápidamente que sus isómeros normales correspondientes. Sin embargo, los mecanismos de retención en la fase inversa son complejos y no fáciles de entender. 10.2 MOBILE PHASES IN REVERSED-PHASE CHROMATOGRAPHY The mobile phase generally consist of mixtures of water or aqueous buffer solutions with various water-miscible solvents, e.g.: methanol acetonitrile ethanol isopropanol dimethylformamide propan-1-ol dioxane tetrahydrofuran decreasing polarity increasing elution power However, nonaqueous eluents are needed for the reversed-phase chromatography of highly nonpolar analytes. As gradients are often involved in reversed-phase chromatography, the solvents used must be extremely pure3 (see Figure 18.6). A chromatographic test for the purity of both water and organic eluents has been described,4 consisting of a well-defined series of rising and falling gradients which can be used to establish the purity levels of mobile phase components. The mixtures of water with organic solvents often have a markedly higher viscosity than the pure compounds. The situation with the frequently used compositions of methanol–water, tetrahydrofuran–water and acetonitrile–water is presented in Figure 10.3. The viscosity maximum for methanol is obtained with 40% B in water and reaches 1.62 mPa s (25 OC), which is almost the threefold value of methanol or the double value of water. The pressure drop over the column is proportional to the viscosity; therefore it is not constant during a gradient run. High-viscosity maxima are also found with 80% acetic acid in water (2.7 mPa s at 20 OC) and 40% ethanol in water (2.8 mPa s at 20 OC). Water for HPLC is, unfortunately, not free as it must be specially purified. Ion exchange water is generally not of sufficient purity and double distillation stills may even increase the content of organics. It is best either to purchase HPLC grade water or to use water which is produced by a multiple-stage purification system. Sterile water is obtained by filtration through a 0.2 mm filter. Methanol has the disadvantage of producing a relatively highly viscous mixture with water (see above), giving rise to much higher pressures than other mobile phases. If methanol–water mixtures are prepared manually then both components must be weighed or each one volumetrically determined separately. The considerable volume contraction that occurs produces a solution with a methanol content in excess of 50% by volume from an initial 500 ml of water topped up to 1000 ml with methanol. For the same reason the retention times are not identical if a water–methanol elutent is premixed manually or prepared by a high-pressure gradient system; in the latter case the total flow rate will be lower than requested. Methanol is favourable if buffer salts or ion-pair reagents need to be added to the eluent because such additives have better solubility in methanol than in acetonitrile or tetrahydrofuran. Acetonitrile is very expensive, the highly pure ‘far UV’ quality being especially so. Viscosity properties cause no problems. Note the azeotrope formed with water as a result of regeneration by distillation: it boils at 76.7 OC and contains 84% acetonitrile. Tetrahydrofuran can be a very interesting solvent with regard to separation selectivity. Its UV cutoff of 220 nm is relatively high. Column re-equilibration after a gradient run with THF is slower compared to gradients with methanol or acetonitrile. Once a bottle of HPLC grade THF is opened, peroxides are rapidly formed; they can react with analytes and are a safety risk. In many cases it cannot be recommended to use mobile phases with less than 10% organic solvent in water. Under such conditions many brush-type stationary phases with e.g. C18 alkyl chains are in an ill defined conformation and equilibration takes a long time. (Even for gradients it is usually not necessary to start them at 0% B, 10% B is a weak enough eluent.) In an environment with more than 10% organic solvent the chains are more or less expanded straightly whereas they collapse when too much water is present. The conformation is, however, again well defined in a totally aqueous eluent without organic modifier. Under such conditions the chains are totally folded but it takes time to bring them into the straight conformation when organic solvent is added. Specially designed reversed phases which are suitable for eluents with high water content are commercially available from many manufacturers. 10.2 FASES MÓVILES EN FASE INVERSA CROMATOGRAFIA La fase móvil generalmente consiste en mezclas de agua o soluciones tampón acuosas con varios solventes miscibles con agua, por ejemplo: metanol acetonitrilo etanol isopropanol dimetilformamida propan-1-ol dioxano tetrahidrofurano polaridad decreciente potencia de elución creciente Sin embargo, se necesitan eluyentes no acuosos para la cromatografía de fase inversa de analitos altamente no polares. Como los gradientes a menudo están involucrados en la cromatografía de fase inversa, los solventes utilizados deben ser extremadamente puros3 (ver Figura 18.6). Se ha descrito una prueba cromatográfica para la pureza del agua y de los eluyentes orgánicos, 4 que consiste en una serie bien definida de gradientes ascendentes y descendentes que se pueden usar para establecer los niveles de pureza de los componentes de la fase móvil. Las mezclas de agua con solventes orgánicos a menudo tienen una viscosidad marcadamente más alta que los compuestos puros. La situación con las composiciones de metanol – agua, tetrahidrofurano – agua y acetonitrilo – agua utilizadas con frecuencia se presenta en la Figura 10.3. La viscosidad máxima para metanol se obtiene con 40% de B en agua y alcanza 1.62 mPa s (25 OC), que es casi el triple del metanol o el doble del agua. La caída de presión sobre la columna es proporcional a la viscosidad; por lo tanto, no es constante durante una carrera de gradiente. Los máximos de alta viscosidad también se encuentran con ácido acético al 80% en agua (2.7 mPa s a 20 OC) y etanol al 40% en agua (2.8 mPa s a 20 OC). Desafortunadamente, el agua para HPLC no es gratuita, ya que debe estar especialmente purificada. El agua de intercambio iónico generalmente no es de suficiente pureza y los destiladores de doble destilación pueden incluso aumentar el contenido de compuestos orgánicos. Es mejor comprar agua de grado HPLC o usar agua producida por un sistema de purificación de etapas múltiples. El agua estéril se obtiene por filtración a través de un filtro de 0,2 mm. El metanol tiene la desventaja de producir una mezcla relativamente altamente viscosa con agua (ver arriba), dando lugar a presiones mucho más altas que otras fases móviles. Si las mezclas de metanol y agua se preparan manualmente, ambos componentes deben pesarse o cada uno debe determinarse volumétricamente por separado. La considerable contracción de volumen que se produce produce una solución con un contenido de metanol superior al 50% en volumen de 500 ml iniciales de agua hasta 1000 ml de metanol. Por la misma razón, los tiempos de retención no son idénticos si un eluyente de agua-metanol se premezcla manualmente o se prepara mediante un sistema de gradiente de alta presión; en este último caso, el caudal total será inferior al solicitado. El metanol es favorable si es necesario agregar sales de tampón o reactivos de pares de iones al eluyente porque dichos aditivos tienen una mejor solubilidad en metanol que en acetonitrilo o tetrahidrofurano. El acetonitrilo es muy costoso, especialmente la calidad altamente pura de "ultravioleta lejano". Las propiedades de viscosidad no causan problemas. Obsérvese el azeótropo formado con agua como resultado de la regeneración por destilación: hierve a 76.7 OC y contiene 84% de acetonitrilo. El tetrahidrofurano puede ser un disolvente muy interesante con respecto a la selectividad de separación. Su corte UV de 220 nm es relativamente alto. El reequilibrio de la columna después de una carrera de gradiente con THF es más lento en comparación con los gradientes con metanol o acetonitrilo. Una vez que se abre una botella de THF de grado HPLC, se forman rápidamente peróxidos; Pueden reaccionar con analitos y son un riesgo para la seguridad. En muchos casos, no se puede recomendar el uso de fases móviles con menos del 10% de solvente orgánico en agua. En tales condiciones, muchas fases estacionarias tipo cepillo con, p. Las cadenas de alquilo C18 están en una conformación mal definida y el equilibrio lleva mucho tiempo. (Incluso para los gradientes, generalmente no es necesario comenzarlos con 0% de B, 10% de B es un eluyente lo suficientemente débil). En un entorno con más del 10% de solvente orgánico, las cadenas se expanden más o menos directamente mientras que colapsan cuando también Hay mucha agua presente. Sin embargo, la conformación está nuevamente bien definida en un eluyente totalmente acuoso sin modificador orgánico. En tales condiciones, las cadenas están totalmente plegadas, pero lleva tiempo colocarlas en la conformación recta cuando se agrega solvente orgánico. Muchos fabricantes ofrecen comercialmente fases invertidas especialmente diseñadas para eluyentes con alto contenido de agua. 10.3 SOLVENT SELECTIVITY AND STRENGTH8 The selectivity triangle with numerous solvents is discussed in Section 5.2. Eluent selectivity in reversed-phase separations is directly related to this triangle because localization effects, important in adsorption chromatography, play no role. A look at Figure 5.1 shows that the three solvents methanol, acetonitrile and tetrahydrofuran are a good choice for the optimization of selectivity. Figure 10.4 represents a triangle with these three solvents only. The usual A solvent in reversed-phase chromatography is water or aqueous buffer. The strength of binary mixtures is not a well defined function of %B but depends on analyte and stationary phase properties.9 Nevertheless, it is possible to give numerical data which allowto obtain a good approximation of mobile phase composition when it is necessary to try more than one solvent in order to find the best selectivity. The following equation can be used: where F is the volume fraction of a certain solvent and P0 is its reversed-phase polarity. Different numbers have been proposed as P0 values (with the exception of water whose polarity is always 0); the following data set is by Snyder et al. Alternatively, a nomogram can be used. It is based on numerous experimental data determined with small organic molecules. As a matter of fact, each of these analytes would give a different nomogram; Figure 10.5 shows a mean graphical representation (which may be less valid for large molecules) 10.3 SELECTIVIDAD Y FUERZA SOLVENTES8 El triángulo de selectividad con numerosos solventes se discute en la Sección 5.2. La selectividad del eluyente en las separaciones de fase inversa está directamente relacionada con este triángulo porque los efectos de localización, importantes en la cromatografía de adsorción, no juegan ningún papel. Un vistazo a la Figura 5.1 muestra que los tres solventes metanol, acetonitrilo y tetrahidrofurano son una buena opción para la optimización de la selectividad. La figura 10.4 representa un triángulo con estos tres solventes solamente. El disolvente A habitual en la cromatografía de fase inversa es agua o tampón acuoso. La fuerza de las mezclas binarias no es una función bien definida del% B, sino que depende de las propiedades analíticas y de fase estacionaria.9 Sin embargo, es posible proporcionar datos numéricos que permitan obtener una buena aproximación de la composición de la fase móvil cuando sea necesario intentar más. de un solvente para encontrar la mejor selectividad. Se puede usar la siguiente ecuación: donde F es la fracción de volumen de cierto solvente y P0 es su polaridad de fase inversa. Se han propuesto diferentes números como valores P0 (con la excepción del agua cuya polaridad es siempre 0); El siguiente conjunto de datos es de Snyder et al. Alternativamente, se puede usar un nomograma. Se basa en numerosos datos experimentales determinados con pequeñas moléculas orgánicas. De hecho, cada uno de estos analitos daría un nomograma diferente; La figura 10.5 muestra una representación gráfica media (que puede ser menos válida para moléculas grandes) 10.4 STATIONARY PHASES Reversed-phase stationary phases are more or less hydrophobic, and the degree of this property is characterized by their hydrophobicity H. As a general rule, retention times are longer the more C atoms the bonded stationary phase contains. (The reason is that the volume taken up by the bonded nonpolar groups, i.e. that required by the actual stationary phase, is greater with long chains than it is with shorter chains; retention is directly proportional to the volume ratio between the stationary and mobile phases; see Section 2.3.) Figure 10.7 demonstrates this effect. This means that retention is stronger the longer is the alkyl moiety (C18 is more retentive than C8), the higher is the bonding density of the alkyl chains (in groups per nm2 of the surface), the higher is the degree of end-capping, the thicker is the organic stationary phase (polymeric layers are more retentive than monomeric ones), or, as a summary, the higher is the carbon content of the material, determined by elemental analysis. Strong retention means that the analysis takes a longer time or that a higher percentage of B solvent is necessary. A highly retentive stationary phase can be advantageous for polar analytes which are not retained enough on a low-carbon phase even with a high percentage of water. For nonpolar analytes it can be advantageous to use a stationary phase with low carbon content because retention times will be shorter and less organic solvent will be necessary for elution. Another reversed-phase feature is their silanol activity. As mentioned in Section 7.5, it is not possible to derivatize all the silanol groups of the silica surface for sterical reasons. The remaining silanols can be end-capped by a second derivatization reaction or shielded sterically. The various reversed phases which are commercially available differ markedly in their silanol activity because not all of them are end-capped. Although for most separations active silanols are unwanted (especially for the separation of basic compounds) a stationary phase with a distinct silanol activity can be advantageous for the separation of strongly hydrophilic (polar) analytes. Silanol activity has two features: Nonionized silanols (in acidic mobile phase) can act as hydrogen bond donors with a certain degree of acidity A. In contrast, ionized silanols (in neutral or basic mobile phase) possess cation exchange activity C. Other properties of a reversed phase are its ability to act as a hydrogen bond acceptor, expressed as its basicity B (maybe due to sorbed water) and its steric resistance S towards bulky analytes. Every reversed phase available on the marked has its own measurable set of characteristic parameters H, A, B, C, and S. They can be quantified, listed and compared. These parameters help to identify similar or very different columns compared to a given one. The ‘distance’ FS between two phases is calculated by the column matching factor: Two phases 1 and 2 are similar (and can replace each other) if FS is low, i.e. ≤ 3. They are different (and column 2 can be tried if column 1 does not give the needed separation) if FS is high. The C term is tabulated differently when the column is used with an acidic mobile phase (pH 2.8) or under neutral conditions (pH 7.0). If a sample does not contain acids and/or ionized bases, the B and C terms are irrelevant and are not included in the calculation of FS. 10.4 FASES ESTACIONARIAS Las fases estacionarias de fase inversa son más o menos hidrofóbicas, y el grado de esta propiedad se caracteriza por su hidrofobicidad H. Como regla general, los tiempos de retención son más largos cuanto más átomos de C contiene la fase estacionaria unida. (La razón es que el volumen ocupado por los grupos no polares unidos, es decir, el requerido por la fase estacionaria real, es mayor con cadenas largas que con cadenas más cortas; la retención es directamente proporcional a la relación de volumen entre las fases estacionarias y móviles ; vea la Sección 2.3.) La Figura 10.7 demuestra este efecto. Esto significa que la retención es más fuerte cuanto más largo es el resto alquilo (C18 es más retentivo que C8), mayor es la densidad de unión de las cadenas de alquilo (en grupos por nm2 de la superficie), mayor es el grado de terminación , cuanto más gruesa es la fase orgánica estacionaria (las capas poliméricas son más retentivas que las monoméricas) o, como resumen, mayor es el contenido de carbono del material, determinado por análisis elemental. Una fuerte retención significa que el análisis lleva más tiempo o que se necesita un mayor porcentaje de disolvente B. Una fase estacionaria altamente retentiva puede ser ventajosa para analitos polares que no se retienen lo suficiente en una fase baja en carbono, incluso con un alto porcentaje de agua. Para los analitos no polares puede ser ventajoso usar una fase estacionaria con bajo contenido de carbono porque los tiempos de retención serán más cortos y se necesitará menos disolvente orgánico para la elución. Otra característica de la fase inversa es su actividad de silanol. Como se mencionó en la Sección 7.5, no es posible derivatizar todos los grupos de silanol de la superficie de sílice por razones estéricas. Los silanoles restantes se pueden tapar por una segunda reacción de derivatización o protegerse estéricamente. Las diversas fases invertidas que están disponibles comercialmente difieren notablemente en su actividad de silanol porque no todas ellas tienen un límite final. Aunque para la mayoría de las separaciones los silanoles activos no son deseados (especialmente para la separación de compuestos básicos), una fase estacionaria con una actividad de silanol distinta puede ser ventajosa para la separación de analitos fuertemente hidrofílicos (polares). La actividad de silanol tiene dos características: los silanoles no ionizados (en fase móvil ácida) pueden actuar como donantes de enlaces de hidrógeno con un cierto grado de acidez A. En contraste, los silanoles ionizados (en fase móvil neutra o básica) poseen actividad de intercambio catiónico C. Otras propiedades de una fase inversa son su capacidad para actuar como un aceptor de enlace de hidrógeno, expresado como su basicidad B (tal vez debido al agua sorbida) y su resistencia estérica S hacia analitos voluminosos. Cada fase inversa disponible en el marcado tiene su propio conjunto medible de parámetros característicos H, A, B, C y S. Se pueden cuantificar, enumerar y comparar. Estos parámetros ayudan a identificar columnas similares o muy diferentes en comparación con una determinada. La "distancia" FS entre dos fases se calcula mediante el factor de coincidencia de columna: Dos fases 1 y 2 son similares (y pueden reemplazarse entre sí) si la FS es baja, es decir, ≤ 3. Son diferentes (y la columna 2 puede probarse si la columna 1 no proporciona la separación necesaria) si la FS es alta. El término C se tabula de manera diferente cuando la columna se usa con una fase móvil ácida (pH 2.8) o en condiciones neutras (pH 7.0). Si una muestra no contiene ácidos y / o bases ionizadas, los términos B y C son irrelevantes y no se incluyen en el cálculo de FS. 9 Adsorption Chromatography: Normal-Phase Chromatography This method is explained with silica, the most important chromatographic adsorbent. 9.1 WHAT IS ADSORPTION?1 As already mentioned in Section 7.4, the silica structure is saturated with silanol groups at the ends. These OH groups are statistically distributed over the whole of the surface (Figure 9.1). The silanol groups represent the active sites in the stationary phase (in alumina, the Al3+ centres are the most prominent, followed by the linking O2- moieties). They form a weak type of ‘bond’ with any molecule in the vicinity when any of the following interactions are present: Dipole-induced dipole;2 Dipole-dipole; Hydrogen bonding; p-complex bonding. These situations arise when the molecule has one or several atoms with lone electron pairs or a double bond (for p-complex interaction), in other words, when it is unsaturated or carries a so-called functional group. On the other hand, alkanes cannot interact, as they are saturated and consist solely of C and H atoms which carry no lone pairs. The adsorption strengths and hence k values (elution series) increase in the following order: saturated hydrocarbons < olefins < aromatics organic halogen compounds < sulphides < ethers < nitro compounds < esters aldehydes ketones < alcohols amines < sulphones < sulphoxides < amides < carboxylic acids. If a molecule has several functional groups, then the most polar one (the last one in the above series) determines the retention properties. This weak ‘bond formation’ is called adsorption and its dissolution which is just as rapid is known as desorption. Three conclusions can be drawn from this concept: (a) The silica gel in the chromatographic bed is surrounded on all sides by mobile phase. The solvent occupies all active sites more or less strongly. A sample molecule can only be adsorbed if it interacts more strongly than the solvent with the adsorbent. (b) All sample molecules (and also those of the solvent) are arranged on the silica surface so that their functional group or double bond is close to the silanol groups (Figure 9.2). Any possible hydrocarbon ‘tails’ are diverted from the silica. Hence the adsorbent cannot distinguish between molecules that are identical apart from their aliphatic moiety. A mixture of hexanol, heptanol and octanol cannot be separated very satisfactorily by adsorption chromatography. (c) The strength of interaction depends not only on the functional groups in the sample molecule but also on steric factors. Molecules with a different steric structure, i.e. isomers, are eminently suitable for separation by adsorption chromatography. 9 Cromatografía de adsorción: cromatografía de fase normal Este método se explica con sílice, el adsorbente cromatográfico más importante. 9.1 ¿QUÉ ES LA ADSORCIÓN? 1 Como ya se mencionó en la Sección 7.4, la estructura de sílice está saturada con grupos silanol en los extremos. Estos grupos OH están distribuidos estadísticamente en toda la superficie (Figura 9.1). Los grupos silanol representan los sitios activos en la fase estacionaria (en alúmina, los centros Al3 + son los más prominentes, seguidos de los restos O2- de enlace). Forman un tipo débil de "enlace" con cualquier molécula cercana cuando se presenta alguna de las siguientes interacciones: Dipolo inducido por dipolo; 2 Dipolo-dipolo; Enlaces de hidrógeno; enlace complejo . Estas situaciones surgen cuando la molécula tiene uno o varios átomos con pares de electrones solitarios o un doble enlace (para la interacción del complejo p), en otras palabras, cuando está insaturada o lleva un llamado grupo funcional. Por otro lado, los alcanos no pueden interactuar, ya que están saturados y consisten únicamente en átomos de C y H que no llevan pares solitarios. Las fuerzas de adsorción y, por lo tanto, los valores de k (serie de elución) aumentan en el siguiente orden: hidrocarburos saturados <olefinas <compuestos aromáticos compuestos halógenos orgánicos <sulfuros <éteres <compuestos nitro <ésteres aldehídos cetonas <alcoholes aminas <sulfonas <sulfóxidos <amidas <ácidos carboxílicos. Si una molécula tiene varios grupos funcionales, entonces el más polar (el último en la serie anterior) determina las propiedades de retención. Esta débil "formación de enlaces" se llama adsorción y su disolución, que es tan rápida, se conoce como desorción. Se pueden sacar tres conclusiones de este concepto: (a) El gel de sílice en el lecho cromatográfico está rodeado por todos lados por la fase móvil. El solvente ocupa todos los sitios activos más o menos fuertemente. Una molécula de muestra solo puede adsorberse si interactúa más fuertemente que el solvente con el adsorbente. (b) Todas las moléculas de muestra (y también las del disolvente) están dispuestas en la superficie de sílice de modo que su grupo funcional o doble enlace esté cerca de los grupos de silanol (Figura 9.2). Cualquier posible "cola" de hidrocarburo se desvía de la sílice. Por lo tanto, el adsorbente no puede distinguir entre moléculas que son idénticas aparte de su resto alifático. Una mezcla de hexanol, heptanol y octanol no puede separarse muy satisfactoriamente por cromatografía de adsorción. (c) La fuerza de la interacción depende no solo de los grupos funcionales en la molécula de muestra sino también de factores estéricos. Las moléculas con una estructura estérica diferente, es decir, isómeros, son eminentemente adecuadas para la separación por cromatografía de adsorción. 9.2 THE ELUOTROPIC SERIES It is clear from the above that not every solvent elutes sample molecules at the same speed. If an aliphatic hydrocarbon constitutes the mobile phase, it becomes very difficult to displace the sample molecules from the active adsorbent sites and the solvent is classified as weak. Tetrahydrofuran, on the other hand, competes strongly for the active sites, leaving less time for sample molecules to be adsorbed and hence they are rapidly eluted. This type of solvent is comparatively strong. The influence of mobile phase strength on the separation is shown in Figure 9.3. Hexane is too weak a solvent for the analysis of this test mixture and the separation needs an unnecessarily long time. tert-Butylmethyl ether is much too strong. A suitable eluent is the mixture hexane-tert-butylmethyl ether (9 : 1) (volume parts). The elution force or strength of the various solvents is determined empirically and recorded numerically, being represented by the symbol Ɛ0. The series of weak, medium strength and strong solvents thus derived is referred to as the eluotropic series. The eluotropic series of various solvents is given in Section 5.1. It is possible to obtain a desired elution strength by mixing two solvents. A choice of binary mixtures is hown in Figure 9.4. If, for example, a solvent strength of Ɛ0=0.4 is needed, this can be obtained by the following binary eluents: approximately 60% of tert-butylmethyl ether in hexane; 45% of tetrahydrofuran in hexane; 50% of ethyl acetate in hexane; 15% of isopropanol in hexane; 20% of tert-butylmethyl ether in dichloromethane; 45% of tetrahydrofuran in dichloromethane; 50% of ethyl acetate in dichloromethane: or 20% of isopropanol in dichloromethane: Unfortunately the calculation of the strength of a solvent mixture is tedious and cannot be made without computer aid 9.2 LA SERIE ELUOTROPICA Está claro por lo anterior que no todos los solventes eluyen las moléculas de muestra a la misma velocidad. Si un hidrocarburo alifático constituye la fase móvil, se hace muy difícil desplazar las moléculas de muestra de los sitios adsorbentes activos y el disolvente se clasifica como débil. El tetrahidrofurano, por otro lado, compite fuertemente por los sitios activos, dejando menos tiempo para que las moléculas de muestra sean adsorbidas y, por lo tanto, se eluyan rápidamente. Este tipo de solvente es comparativamente fuerte. La influencia de la fuerza de la fase móvil en la separación se muestra en la Figura 9.3. El hexano es un solvente demasiado débil para el análisis de esta mezcla de prueba y la separación necesita un tiempo innecesariamente largo. el terc-butilmetil éter es demasiado fuerte. Un eluyente adecuado es la mezcla hexano-terc-butilmetil éter (9: 1) (partes en volumen). La fuerza o fuerza de elución de los diversos solventes se determina empíricamente y se registra numéricamente, y se representa con el símbolo Ɛ0. La serie de disolventes débiles, de resistencia media y fuertes así derivados se denomina serie eluotrópica. La serie eluotrópica de varios solventes se da en la Sección 5.1. Es posible obtener una fuerza de elución deseada mezclando dos solventes. En la figura 9.4 se muestra una selección de mezclas binarias. Si, por ejemplo, se necesita una resistencia del solvente de =0 = 0.4, esto se puede obtener mediante los siguientes eluyentes binarios: aproximadamente 60% de terc-butilmetil éter en hexano; 45% de tetrahidrofurano en hexano; 50% de acetato de etilo en hexano; 15% de isopropanol en hexano; 20% de terc-butilmetil éter en diclorometano; 45% de tetrahidrofurano en diclorometano; 50% de acetato de etilo en diclorometano: o 20% de isopropanol en diclorometano: Desafortunadamente, el cálculo de la resistencia de una mezcla solvente es tedioso y no se puede hacer sin ayuda de computadora Separation of a test mixture on silica with eluents of different strength. Top: tert-butylmethyl ether, Ɛ0 =0.48; middle: hexane-tert-butylmethyl ether (9 : 1), « Ɛ0=0.29; bottom: hexane, Ɛ0=0. The attenuation of the hexane chromatogram is only half as much as of the other two. Conditions: column, 25 cm 3.2mm i.d.; stationary phase, LiChrosorbSI 60 5 mm; flowrate, 1 ml/min;UVdetector,254nm. Peaks: 1=p-xylene; 2=nitrobenzene; 3=acetophenone; 4=2,6-dinitrotoluene.