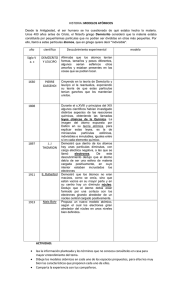
Grado 7 Ciencias naturales TEMA: ¿EXISTE ALGÚN MATERIAL QUE NO ESTÉ CON CONSTITUIDO POR ÁTOMOS? Clase: Nombre: ¿De qué está hecho todo lo que nos rodea? INTRODUCCIÓN. ¿Existe algún material que no esté consttuido por átomos? A diario observamos diferentes clases de materia, en la naturaleza, en nuestra vida diaria, cada ser vivo, cada componente del medio natural, tiene unas características especiales. Es bueno preguntarnos ¿Existe algún material que no esté constituido por átomos? Vamos a analizar las imágenes que aparecen a continuación y a elaborar conclusiones relacionadas con el contenido de cada una. 1 2 3 Participamos en la reflexión oral sustentando las conclusiones de la pre clase y del análisis de las imágenes anteriores, de esta manera, nos apropiamos de los aprendizajes básicos que nos van a permitir garantizar una buena comprensión del tema en estudio. ACTIVIDAD 1. El átomo como constituyente básico de la materia Somos curiosos por naturaleza y a través de la historia de la humanidad nos hemos hecho diversas preguntas y las respuestas que hemos dado han estado acordes con el nivel de desarrollo de las distintas épocas. Cuando observamos el firmamento, el sol, el agua en sus diferentes estados, el suelo, el aire, la atmósfera, los diferentes ecosistemas, los fenómenos naturales, la diversidad de los seres vivos, etc., comprendemos que todo lo que nos rodea está hecho de materia y que toda la materia que nos rodea está constituida por átomos. ACTIVIDAD 1.1 EVOLUCIÓN DE LA TEORÍA ATÓMICA Para mejorar nuestra comprensión sobre el tema, con la ayuda de la tabla 1 “Evolución de la Teoría Atómica”, vamos a analizar los aportes que desde los filósofos de la época antigua hasta los científicos de la actualidad se han ido dando para profundizar en el conocimiento del átomo como constituyente básico de la materia y en la formulación de la Teoría Atómica Actual. Para este fin, organizaremos nuestro proceso de aprendizaje de una forma interesante, con la participación de los diferentes grupos de estudiantes, teniendo en cuenta las orientaciones de la Actividad 1.2. “Encuentro de científicos en el tiempo”. 4 ÉPOCA TIEMPO 384 a 322 a.C. EVENTOS Teoría de los 4 elementos CIENTÍFICOS DESCRIPCIÓN Aristóteles Filósofo griego que creía que todas las cosas que nos rodean están hechas de cuatro elementos: agua, aire, tierra y fuego. Demócrito y Leucipo Filósofos griegos que postularon que toda la materia está constituida por partículas indivisibles, llamadas átomos, sin nada entre ellas, excepto espacio vacío. Químico inglés quién postuló que los elementos están formados por cuerpos simples (átomos), que no están hechos de otros cuerpos y cuando se mezclan forman compuestos. Antes de Cristo 460 a 370 a.C.. Teoría Atomística 460 a 370 a.C.. Definición de Elemento Robert Boyle (Inglés) 1690 Invención de la bomba de vacío Otto Von Guericke Siglo XVIII Teoría del Flogisto Ernesto Stahl Médico Iatroquímico al servicio del Rey de Prusia, suponía que todas las sustancias combustibles y los metales, contenían un principio inflamable, el “flogisto”, el cual se desprende durante los procesos de clacinación y combustión, pasando de unos cuerpos a otros. Ernesto Stahl Médico al servicio del Rey de Prusia, suponía que todas las sustancias combustibles y los metales, contenían un principio inflamable, el “flogisto”, el cual se desprende durante los procesos de calcinación y combustión, pasando de unos cuerpos a otros. 1661 – 1766 Siglo XVIII 1766 Teoría del Flogisto Descubrimiento del Hidrógeno y obtención del agua. 5 Inventó la bomba de vacío. Cavendish Químico inglés, aisló y caracterizó el aire inflamable, hoy conocido como Hidrógeno y realizó la obtención del agua. 1774 1785 1774 – 1789 1786 1787 1789 1800 - 1808 1800 Descubrimiento del Oxígeno Ley de Conservación de la Masa Descubrimiento de la electricidad animal Scheele J. Priestley Scheele, farmacéutico sueco y Priestley, químico inglés, descubrieron el Oxígeno, al cual le dio el nombre de aire desflogisticado. Lavoisier Químico francés, considerado el Padre de la Química, formuló que “ Nada se crea en las operaciones del arte ni en la naturaleza y puede establecerse como principio que en toda operación hay una cantidad igual de materia antes y después de la operación…Sobre este principio se funda todo el arte de hacer experimentos en química” Luigi Galvani Observó cómo se contraían los músculos de un rana muerta y colgada cuando entraba en contacto con dos metales diferentes. Método de Nomenclatura Química Definieron los elementos como las sustancias más simples que no se pueden descomponer. Le asignaron nombre a 33 elementos, Lavoisier, Berthollet, Guyton teniendo en cuenta la propiedad más importante y Fourcroy de cada uno.; luego asignaron nombres a los compuestos a partir de los nombres de los elementos Definición de Elemento Anton Van Lavoisier Químico francés, considerado el Padre de la Química, concibe los elementos como aquellas sustancias. Explicó el proceso de combustión y refutó la teoría del flogisto. Electrólisis Nicholson y Carlislie Descomposición de una sustancia por medio de la electricidad 6 1800 - 1808 1800 Nicholson y Carlislie Electrólisis 1800 Primera bacteria 1800 Descubrimiento de seis elementos químicos 1803 1808 Ley de las proporciones múltiples Alessandro Volta (Italiano) Humprey Davy Jhon Dalton (inglés) Teoría Atómica Moderna 7 Jhon Dalton (Inglés) Descomposición de una sustancia por medio de la electricidad Desarrolló la primera batería, generando corriente eléctrica a partir de una reacción química, utilizando dos monedas de diferentes metales. Utilizando la electrólisis, descubrió los elementos: sodio, potasio, magnesio, calcio, bario y estroncio. Formuló su teoría atómica y la utilizó para explicar por qué los átomos reaccionan en proporciones simples de números enteros, formulando la Ley de las proporciones múltiples. Tuvo en cuenta la teoría atomística de los griegos. Postuló su teoría atómica: 1. Toda la materia está constituida por átomos que son pequeñas partículas de un elemento que no pueden crearse ni destruirse. 2. Los átomos de un elemento no pueden transformarse en los átomos de otro elemento. En las reacciones químicas las sustancias originales se separan en átomos, que se recombinan para formar diferentes sustancias. 3. Los átomos de un elemento son idénticos en masa y otras propiedades y son diferentes de los átomos de cualquier otro elemento. 4. Los compuestos resultan de la combinación química de una proporción específica de átomos de diferentes elementos. 1800 - 1808 1808 1811 1811 – 1838 1814 1819 1830 1838 Proporción atómica del agua Joseph GayLussac (Francés) Midió los volúmenes del gas Hidrógeno y del gas Oxígeno que se combinaban para formar vapor de agua, encontrando que 2 Litros de Hidrógeno se combinaban con 1 Litro de Oxígeno, lo cual implicaba que la molécula de agua estaba formada por 2 átomos de Hidrógeno y 1 átomo de Oxígeno, su fórmula molecular es H2O. Hipótesis de Avogadro Propuso dos explicaciones a los resultados obtenidos por Gay-Lussac: 1.Tanto el Hidrógeno como el Oxígeno, se componen de una molécula formada por dos átomos. Son las moléculas, no Amadeo Avogadro los átomos los que se dividen (Italiano) y los átomos separados se recombinan para formar moléculas de vapor de agua. 2. Volúmenes iguales de un gas contienen el mismo número de partículas, bajo condiciones idénticas. Simbología química Estableció masas atómicas relativas teniendo en cuenta calores específicos de las sustancias y propuso los símbolos de dos letras para los elementos químicos. J.J. Berzelius (sueco) Masas atómicas Leyes de la Electrólisis Tubos de descarga 8 Establecieron masas atómicas P. dulong y A. Petit a partir del calor específico de (franceses) las sustancias. Michael Faraday Realizó diversos experimentos sobre electrólisis y formuló las leyes de la electrólisis y sentó las bases de la teoría moderna de la electricidad. Michael Faraday Hizo pasar una corriente a través de un tubo de vidrio con aire enrarecido, vio un arco de luz extraña que salía del cátodo hacia el ánodo. Faraday descubrió un espacio oscuro justo en frente del cátodo. 1811 – 1838 Rayos Catódics Julius Plucker (Alemán) Joseph GayLussac (Francés) Inspirado en los trabajos de Faraday, agregó dos electrodos al Tubo de Geissler, observó unas radiaciones emitidas desde el terminal negativo o cátodo, razón por la cual se llamaron Rayos Catódicos. 1857 Tubo de Geissler Heinrich Geissler (Alemán) Tubos similares a los signos de Neón de hoy. No produce rayos catódicos. Hay mucho aire en el tubo. El resplandor se produce cuando los electrones golpean los átomos de gas, los electrones del gas se desplazan a niveles de energía más altos, liberando la energía en forma de luz, este fenómeno se denomina fluorescencia. 1859 Espectro de los elementos Robert Bunsen y Gustav Kirchoff (alemanes) Demostraron que cada elemento tiene un espectro característico. Pierre Jansen (francés) Este astrónomo observó una línea nueva en el espectro solar, la cual atribuyó a un nuevo elemento. La mayoría de los científicos no le creyeron. Sir Joseph Lockyer (inglés) dio al elemento el nombre de helio. 1868 Descubrió el Helio 1857 – 1874 Tabla periódica Publicó un libro de texto que incluía su Tabla Periódica. Dimitri Predijo las propiedades de Mendeleyev(ruso) elementos que aún no se habían descubierto dejando en su tabla los espacios para ellos. 1869 Descubrimiento de los rayos catódicos Johann Hittorf (Alemán) Utilizando una bomba de vacío que contenía en sus extremos electrodos, cátodo y ánodo y aplicando un voltaje, observó unos rayos que provenían del cátodo. 1874 Posibilidad de existencia del electrón George Johnstone Stoney Postula la existencia del electrón. 1869 9 Es un tubo de vidrio en el cual se hace vacío mediante una bomba. En su extremo izquierdo hay un electrodo (Cátodo) unido a un potencial negativo, en el extremo opuesto hay un electrodo (Ánodo) unido a un potencial positivo. Cuando la diferencia de potencial es suficientemente alta se Crookes (británico) percibe una fluorescencia. Crookes descubrió que mientras bombeaba más aire de los tubos, el espacio oscuro de Faraday se extendió por el tubo desde el cátodo al ánodo, hasta que el tubo quedó totalmente oscuro, pero que en el extremo del ánodo del tubo, el vidrio del tubo empezó a brillar. 1875 Tubo de Vacío 1876 Denominación de Rayos Catódicos 1875 – 1895 Eugen Goldstein Por su procedencia del cátodo, los denominó Rayos Catódicos. 1885 Longitudes de onda J.J. Balmer (suizo) Desarrolló una ecuación matemática sencilla para calcular las longitudes de onda de las líneas del espectro del hidrógeno. 1886 Descubrimiento de los protons Eugen Goldstein Observó rayos canales “protones” en un tubo de Crookes modificado. Descubrimiento de los Rayos X Al colocar un objeto metálico en la trayectoria de los rayos catódicos, observó, que un papel impregnado con reactivo fosforescente, que Whilhelm se encontraba fuera del tubo, Conrad Roentgen brillaba misteriosamente, (Alemán) los llamó Rayos X. Roentgen entregó un informe de u descubrimiento con una radiografía de la mano de su esposa. La radiografía es de gran utilidad en la medicina. 1895 10 1896 1896 – 1900 1897 Descubrimiento de la Radiactividad Descubrimiento del electron Henri Becquerel (francés) Estudiaba algunas sustancias que emiten luz después de exponerlas a la luz solar, fenómeno de fosforescencia. Decidió investigar si estas sustancias también emitían rayos como los X. Debido al clima lluvioso, dejó en un cajón durante varios días, la sustancia de uranio con la que trabajaba y unas placas fotográficas envueltas en papel negro, días después se sorprendió de ver la imagen del material de uranio en las placas fotográficas sin haber sido expuestos a la luz solar. De esta manera descubrió accidentalmente la radiactividad. J.J. Thomson (Inglés) Usó un tubo de vacío, al cual le colocó después del ánodo, una zona donde se pueden insertar campos eléctricos y magnéticos perpendiculares a la radiación, con el fin de comprobar su carga eléctrica. Así comprobó que los Rayos Catódicos tenían carga negativa y estableció su relación carga/masa= 1,7588 x 1011C/Kg 1898 Marie Curie (polaca) y su esposo Pierre Curie (francés) 1900 Max Planck (alemán) 1900 Teoría cuántica Descubrieron el polonio y el radio, aislándolos de la pechblenda (un mineral de uranio) mediante procesos químicos. Explica que un átomo excitado emite luz en unidades discretas llamadas cuantos o fotones. Rutherford mediante sus experimentos clasificó las emisiones radiactivas en: • Rayos Alfa: consisten en Ernest Rutherford iones del elemento Helio, He2+ (partículas alfa), se mueven a la décima parte de la velocidad de la luz y no poseen electrones. Tipos de emisiones radioactivas 11 1896 – 1900 1900 1903 1903 – 1909 1904 1905 Tipos de emisiones radioactivas Su grado de penetración es limitado, se pueden detener con una hoja de papel o con la ropa. •Rayos Beta: son haces de electrones emitidos a grandes velocidades, cercanas a las de la luz. Tienen mayor energía cinética que los electrones de los rayos catódicos. Sólo se detiene con láminas metálicas delgadas. •Rayos Gamma: son una forma Ernest Rutherford de radiación electromagnética similar a los Rayos X, pero con mayor poder de energía y penetración. La radiación electromagnética, viaja a través del espacio vacío, a la velocidad de la luz, no tiene masa y no tiene carga eléctrica. Se requiere una capa gruesa de concreto o de plomo para detenerlas. Recibió el Premio Nobel de Química en 1908. Definición de Radiactividad Junto con Becquerel y su esposo Pierre Curie, recibieron el Premio Nobel de Física, por el descubrimiento de Marie Curie, la radiactividad y de los Becquerel y Pierre elementos polonio, radio y Curie. radón. Marie Curie definió la radiactividad como la emisión espontánea de partículas por parte de los núcleos de una sustancia radioactiva. Modelo atómico “budín de pasas” Propiedades de los Rayos Catódicos J. J. Thomson (inglés) Philipp Lenard 12 Propuso un modelo en el cual plantea que el átomo está formado por electrones incrustados en un mar de cargas positivas. Contribuyó a la Teoría de rayos catódicos y definió sus propiedades. Estos rayos se producen porque tocan la cubierta o gas residual del tubo, emitiendo una luz, viajan en línea recta y pueden ser desviados por campos 1905 1905 Propiedades de los Rayos Catódicos Efecto fotoeléctrico 1903 – 1909 1909 Atomo Nuclear 13 Philipp Lenard magnéticos o eléctricos y son idénticos sin importar el material del cual esté hecho el cátodo. Albert Einstein (Alemán) Concilió las dos hipótesis consideradas incompatibles: •La ondulatoria que plantea que la radiación luminosa es solo una perturbación que se desplaza en e espacio. •La corpuscular, la cual plantea que la luz está formada por corpúsculos materiales, capaces de interaccionar con la materia. Einstein concluyó que la luz y por consiguiente las ondas electromagnéticas, se comportan como corpúsculo y como onda, por estar formadas por partículas sin masa y sin carga llamadas fotones, que se propagan en forma de ondas, intercambiando energía con el entorno. Einstein publicó un artículo en el que relacionaba la masa con la energía. Utilizó partículas alfa emitidas por una sustancia radioactiva (radio o polonio) colocados dentro de una caja de concreto, de manera que sólo podían salir por un pequeño oriicio para bombardear láminas delgadas de oro, platino y cobre. Colocó Ernest Rutherford alrededor de la placa metálica (Inglés) ua pantalla fluorescente para detectar las partículas alfa después de haber interactuado con la placa metálica. Observó que la mayoría de partículas alfa pasaban en línea recta, algunas se desviaban en pequeños ángulos, algunas pocas se desviaban en grandes ángulos. 1903 – 1909 1909 Determinación del valor de la carga del electrón Robert Millikan (Americano) Le dio el nombre de electrones a las partículas que formaban los Rayos Catódicos. Observó el movimiento de pequeñas gotas de aceite de alto grado para reloj, en un aparato cargado eléctricamente, con un fuente de Rayos X, después de varias mediciones, definió la carga del electrón igual a 1,602 x 10-19coulomb. 1910 Rayos Canales o positivos. Joseph John Thomson Estudió las propiedades de los rayos canales, que se producen en el ánodo de los tubos de descarga y se dirigen hacia el cátodo a gran velocidad. Se ven afectados por campos eléctricos y magnéticos interpuestos en su trayectoria, demostrando que están contituidos por partículas con masa y con carga positiva. 1912 Isótopos no radiactivos J. J. Thomson Separó los isótopos no radiactivos neón-20 y neón22 Henry Moseley Basándose en los experimentos de dispersión de las partículas alfa por los núcleos de los átomos, dedujo que el número de cargas unitarias del núcleo coincide con el número de orden correspondiente a cada elemento en el sistema periódico, quedando ambos representados por una cantidad a la que llamó Número Atómico. 1910 – 1925 1913 1913 1920 Descubrimiento del Número Atómico Empleó la fórmula de Balmer para demostrar que los electrones de los átomos de Niveles de energía Niels Böhr (danés) hidrógeno existen sólo en órbitas (niveles de energía) esféricas. Descubrimiento de los protones 14 Identificó los protones Ernest Rutherford bombardeando Nitrógeno con (Inglés) partículas alfa provenientes de núcleos de Helio. 1924 Teoría de la Dualidad de la Materia Louis De Broglie (Francés) En un estudio especulativo comparó las propiedades del fotón y del electrón, planteó que el electrón se comporta unas veces como partícula y otras veces como onda. 1925 Principio de Exclusión Wolfanf Pauli (alemán) En cada orbital solo pueden ir dos electrones con spin contrario. 1910 – 1925 1926 1927 Describió el movimiento de los electrones en los átomos mediante una ecuación matemática que combinaba Erwin Schrödinger Ecuación de onda la naturaleza de partícula de (austríaco) un electrón, sus propiedades ondulatorias y las restricciones cuánticas en una relación de probabilidad. Principio de incertidumbre 1910 – 1925 1927 1927 Regla de Hund Werner Heisenberg (alemán) No es posible conocer la trayectoria de un electrón, es decir, su posición exacta y su momento. Frederick Hund (alemán) Dice que los electrones en los subniveles presentan desapareamiento máximo, y los electrones no apareados tienen el mismo espin. Clinton Davinson (Estadounidense) Validación Lester Germer Experimental de (Estadounidense) la teoría Dual de la George Thomson Materia (Inglés)ta Determinaron el valor de la longitud de onda de De Broglie, según las predicciones dadas en su teoría de la dualidad de la materia, la cual concibe al electrón (onda – partícula). 1932 Descubrimiento del Neutrón James Chadwick (Inglés) Al bombardear Berilio con partículas alfa, observó la emisión de unas partículas de masa aproximada a la del protón pero sin carga eléctrica, porque no se desviaban en campos eléctricos. 1934 Descubrimiento del Deuterio Harold Urey (estadounidense) Descubrió el isótopo hidrógeno pesado o deuterio 1970 Fotografía del átomo de torio Albert Crewe (estadounidense) Mediante un microscopio electrónico fotografió átomos individuales de torio. 1932 – 1985 15 1979 Identificación de átomos individuales Samuel Hurst (estadounidense Utilizó una técnica basada en láser para detectar e identificar átomos individuales de todos los elementos menos cuatro. Gerd Binning (alemán) Elaboró un mapa de la superficie del grafito con un microscopio de fuerza atómica (AFM) hecho a partir de un microscopio de barrido de efecto túnel (STM). 1932 – 1985 1985 Grafito 1.2 ENCUENTRO DE CIENTÍFICOS EN EL TIEMPO La actividad tiene como finalidad propiciar una forma creativa, activa, dinámica y significativa de desarrollar las distintas inteligencias mientras aprendemos acerca de la Evolución de la Teoría Atómica. A partir del análisis de la tabla anterior sobre la Evolución de la Teoría Atómica, vamos a organizar por pequeños grupos de 5 estudiantes, una dramatización teniendo en cuenta las siguientes orientaciones: •Cada grupo de estudiantes elige 5 científicos que hayan existido en épocas distantes. Se recomienda tener cuidado de no repetir científicos entre los grupos. •Cada estudiante va a asumir la identidad de un científico de los que eligió su grupo de trabajo. •Con base en la información inicial que obtienen de la línea de tiempo, cada grupo de estudiantes va a profundizar la consulta en torno a las vidas y obras de los científicos que eligieron, teniendo en cuenta: • Elegir y describir las características de un lugar y tiempo de encuentro de los 5 científicos. • Crear a manera de dramatización, un diálogo histórico entre estos 5 personajes de la ciencia. • Generar un espacio en este diálogo, para que los científicos compartan con los demás las características geográficas de la región donde desarrollaron su vida y aspectos de su vida personal y familiar. • Incluir en la dramatización una muestra de la música y el baile predominante en la época histórica. • Incluir en la dramatización diálogos acerca de los problemas, eventos históricos o culturales más importantes en la época en que existieron los científicos. • Crear posters, carteleras, presentaciones, etc. para que cada científico explique a los demás su principal aporte científico. • De ser posible, si no representa riesgo, reproducir el experimento que consideran fue el más importante de cada científico y si no es posible buscar la forma adecuada de explicar su principal aporte. 16 • Realizar la caracterización de los científicos, utilizando el vestuario adecuado el día del Encuentro, en lo posible utilizando materiales reciclables, fáciles de encontrar y de bajo costo. • Organizar un stand sobre los 5 científicos para mostrar y sustentar la presentación de todo el trabajo realizado a los demás grupos de estudiantes y visitantes el día asignado para el Encuentro. • Elegir un día importante para la ciencia como día en que se va a realizar la socialización de trabajos en el Encuentro. • Socializar su trabajo a sus compañeros y visitantes. • Grabar un video sobre su trabajo y compartirlo con sus compañeros y docentes. • Posterior a la realización del Encuentro, realizar un análisis de los aprendizajes, fortalezas y aspectos por mejorar en la organización y desarrollo del Encuentro. • Seleccionar los mejores trabajos y compartirlos, realizando retroalimentación de la actividad, con el fin de que sirva para otros grupos de estudiantes y docentes. ACTIVIDAD 1.3. MODELO ACTUAL DEL ATOMO Sabemos que la materia comprende mezclas y sustancias puras que pueden ser elementos o compuestos. Vamos a emprender un viaje al interior de la materia, a partir del aire que respiramos, para ir conociendo acerca de la composición, propiedades, estructura y comportamiento de la materia. 1.3.1 MEZCLA El aire fresco que respiramos, figura 1, es una mezcla de gases y vapor de agua, cuya proporción podemos apreciar en la tabla 2. Figura 1. El aire. Sustancia Proporción (%) Oxígeno 20,95 Nitrógeno 78,08 Gases raros 0,9340 Gas carbónico 0,004 Vapor de agua Variable Tabla 2. Composición del aire. 17 1.3.2 COMPUESTO Un compuesto es una sustancia pura formada por la unión de dos o más elementos diferentes unidos químicamente en proporciones o cantidades fijas, el agua es una sustancia pura, un compuesto formado por los elementos hidrógeno y oxígeno. Figura 2. Agua. Joseph Gay-Lussac (Francés), en 1808, estableció la proporción atómica del agua, figura 2, encontrando que 2 Litros de Hidrógeno se combinaban con 1 Litro de Oxígeno, lo cual implicaba que la molécula de agua estaba formada por 2 átomos de Hidrógeno y 1 átomo de Oxígeno, en cantidades fijas, 11,2% de Hidrógeno y 88,8% de oxígeno El agua tiene como fórmula molecular H2O, cada átomo de Hidrógeno se une con el átomo de oxígeno compartiendo un par de electrones, mediante la formación de un enlace covalente simple, como se muestra en la imagen siguiente: El enlace que se forma es covalente porque los átomos de hidrógeno y oxígeno comparten electrones para adquirir la estructura del gas noble que les queda más cerca en el sistema periódico, para el hidrógeno el helio y para el oxígeno el neón. La fórmula que muestra cómo se organizan los electrones de valencia para formar los enlaces se denomina Fórmula de Lewis. 18 En la imagen se aprecian los dos enlaces covalentes simples de la molécula de agua. En la molécula de agua, el átomo de oxígeno atrae los electrones compartidos con mayor fuerza que el átomo de hidrógeno, generando una carga parcial negativa hacia el oxígeno y positiva hacia el hidrógeno, lo cual nos permite comprender que la molécula de agua es dipolar; las moléculas dipolares de agua se disponen de tal manera que forman puentes o enlaces de hidrógeno entre ellas, por su estructura, el agua es fundamental para los seres vivos y para la naturaleza en general, presenta propiedades como las siguientes: • Es incolora, inodora e insípida. • Posee una densidad de 1 g/cc a una temperatura de 4°Centígrados. • Su punto de congelación es de 0°Centígrados, su punto de ebullición es de 100°Centígrados. • Posee gran cohesión o atracción entre sus moléculas, lo que le confiere una gran fuerza de tensión superficial, propiedad que se aprecia cuando algunos insectos pueden caminar sobre la superficie del agua • Es resistente a los cambios de temperatura, por lo que actúa como termorregulador de la temperatura de la superficie terrestre. • Su capacidad calorífica, calor de vaporización y calor de fusión son altos. • Se adhiere a las superficies favoreciendo la capilaridad. • Las moléculas que se disuelven en el agua se llaman hidrofílicas y las que no se disuelven en el agua se llaman hidrofóbicas. • La molécula de agua presenta una ligera tendencia a ionizarse, separándose en iones hidronio (H3O+) y (OH-) hidroxilo. Estos iones están en equilibrio en el agua pura. • Casi todas las reacciones químicas de los seres vivos ocurren en soluciones de pH neutro. 19 1.3.3 ELEMENTO El agua es un compuesto formado por la combinación de los elementos hidrógeno y oxígeno; ahora abordamos como ejemplo de elementos, el Hidrógeno, en la tabla 3 observamos algunas de sus propiedades. Símbolo Proporción (%) Número Atómico 1 Electrones de valencia 1 Estado de Oxidación +1 Electronegatividad 2,1 Masa atómica 1,00797 Densidad (g/cc) a 0°C y 1 atm. 0,071 Punto de ebullición -252,7 Punto de fusión -259,2 El Hidrógeno, primer elemento del sistema periódico, su número atómico Z es 1, presenta propiedades como las siguientes: es un no metal, no tiene lustre y es mal conductor del calor y de la electricidad; en condiciones normales es un gas incoloro, inodoro e insípido; se encuentra en forma molecular como H2; es uno de los constituyentes principales del agua y forma parte de toda la materia orgánica; se encuentra en la Tierra y en el Universo; es la sustancia más inflamable de todas las que se conocen, en la figura 3, observamos la bomba de hidrógeno; presenta mejor solubilidad en solventes orgánicos que en el agua; a temperatura ordinaria es poco reactivo, a temperaturas Figura 3. Bomba de hidrógeno elevadas es muy reactivo. En su forma atómica es un agente reductor poderoso, aún a temperatura ordinaria. Cuando reacciona con Oxígeno para formar agua a temperatura ambiente, la reacción es extremadamente lenta, si se le adiciona un catalizador como el platino o una chispa eléctrica, se torna violenta. La mayoría de los elementos existen en la naturaleza en forma de átomos individuales, pero algunos como el Hidrógeno existen en forma molecular. Una molécula es una unidad estructural independiente formada por dos o más átomos unidos químicamente entre sí. La molécula de Hidrógeno H2 se forma como se explica en la figura 4. 20 En el paso A, No interacción, la distancia entre los átomos de Hidrógeno es grande y no se afectan uno a otro, al disminuir la distancia, paso B, Atracción inicial, cada núcleo comienza a atraer el electrón de valencia del otro átomo, luego se forma el enlace covalente, paso C, cuando los dos núcleos atraen a los dos electrones de valencia a una distancia óptima; la molécula de Hidrógeno, H2 formada, paso D, es más estable que los átomos de hidrógeno individuales, porque las fuerzas de atracción entre cada núcleo y los dos electrones compartidos, representadas por las flechas negras, son mayores que las fuerzas de repulsión entre los electrones y entre los núcleos, representadas por las flechas rojas. Figura 4. Formación del enlace covalente en la molécula de hidrógeno. El Hidrógeno presenta tres isótopos, protio, deuterio y tritio. El protio es un isótopo del hidrógeno formado por un único protón y ningún neutrón, el deuterio posee un neutrón y el tritio tiene dos neutrones. El protio es el isótopo más abundante del hidrógeno, se identifica como 1H. Es el combustible común en las reacciones de fusión nuclear que ocurren en estrellas como nuestro sol para formar helio. El deuterio se llama también hidrógeno pesado, se identifica como 2H o como D, es útil en los procesos de fisión nuclear junto con el tritio. El tritio es un isotopo radiactivo del hidrógeno, su símbolo es 3H, se produce naturalmente por la acción de los rayos cósmicos sobre los gases atmosféricos. Un elemento como el hidrógeno, es una sustancia pura con propiedades físicas y químicas únicas, formada por la misma clase de átomos, vamos a continuar nuestro viaje adentrándonos en el interior del átomo. 1.3.4 ATOMO Un átomo es la mínima porción de un elemento que conserva sus propiedades. Como se aprecia en la figura 5, el átomo se concibe como esférico, compuesto por un núcleo central, muy denso, en el que se encuentran los neutrones (partículas sin carga eléctrica) y se concentran los protones (partículas con carga positiva), del núcleo depende el 99,97% de la masa del átomo y ocupa una diez billonésima parte del volumen atómico, está rodeado por uno o más electrones que poseen carga negativa y se mueven alrededor del núcleo. 21 Figura 5. El átomo. En lla 4 se comparan las propiedades de las partículas protón, neutrón y electrón., observamos que la carga del electrón y del protón es igual en magnitud pero de signo contrario, la del protón es positiva y la del electrón es negativa; el número de protones presentes en el núcleo del átomo es igual al número de electrones que rodean el núcleo, siendo el átomo eléctricamente neutro; notamos que la masa del protón y del neutrón es muy parecida, la masa del átomo depende del núcleo atómico; podemos apreciar que la masa del electrón es muy pequeña. Carga Nombre Masa Localización (Símbolo) Relativa Protón (p+ ) 1+ Absoluta (Coulomb ) en el átomo Relativa (uma) Relativa (uma) 1,00727 1,67262 X 10 + 1,602 X 10 -19 Núcleo -24 Neutrón (n0 ) 0 0 1,00866 1,67493 X 10 Núcleo -24 Electrón (e- ) 1- - 1,602 X 10 -19 0,00054858 Tabla 4. Propiedades de las partículas subatómicas. 22 9,10939 X Fuera del 10-28 núcleo 1.3.4.1 Número atómico y Numero masa El número atómico Z, es el número de protones que posee un átomo en su núcleo. Todos los átomos de un mismo elemento tienen el mismo número atómico y cada elemento tiene un número atómico que lo diferencia de los demás. El número masa A, corresponde a la suma de protones y neutrones que un átomo posee en su núcleo. Cada átomo tiene un símbolo atómico, el cual se representa como se ilustra en la imagen siguiente: A partir del símbolo atómico se deduce: Z = 6, lo cual significa que el átomo de Carbono posee 6 protones en su núcleo. A = 12, lo cual significa que la suma de protones más neutrones para el átomo de Carbono es 12. N = A – Z = 12 – 6 = 6 lo cual significa que el átomo de Carbono tiene 6 neutrones en su núcleo. Sabemos que el número de protones es igual al número de electrones para que el átomo sea eléctricamente neutro, entonces, el átomo de Carbono posee 6 electrones. 1.3.4.2 Isótopos Isótopos son átomos de un mismo elemento que poseen el mismo número atómico Z, pero diferente número de neutrones, por lo cual tienen diferente número masa A, lo que hace que tengan las mismas propiedades químicas pero diferentes propiedades nucleares y de masa atómica. En la imagen se representa un isótopo del Uranio. 23 1.3.4.3 Isobaros Isobaros son átomos de distintos elementos que tienen diferente Z, pero que poseen el mismo valor en el número másico A. 1.3.4.4 Clasificación periódica de los elementos Recordemos que finalizando el siglo XVII, Lavoisier (Padre de la Química), organizó una lista de los 23 elementos que se conocían hasta entonces, hacia 1870 se conocían 65 elementos, hacia 1925 se conocía 88 elementos, en la actualidad hay más de 112. Sabemos que en 1871, el químico ruso Dimitri Mendeleev, publicó su clasificación periódica, organizando los elementos en orden creciente de masas atómicas. En 1913, Henry Moseley descubrió el número atómico Z y desde entonces los elementos se ordenan en la Tabla Periódica Moderna en orden creciente de números atómicos. Tengamos presente que la Tabla Periódica Moderna, figura 6, está organizada de la siguiente manera: Figura 6. Tabla Periódica. • Cada elemento ocupa un cuadro, en el que aparece su número atómico y su masa atómica. Los cuadros están ordenados de izquierda a derecha. • Las filas horizontales se llaman períodos, están numeradas del 1 al 7. • Las columnas verticales se llaman grupos, están numerados del 1 al 18. Hay 8 grupos A, dos a la izquierda y seis a la derecha, en ellos se encuentran los elementos representativos. Los grupos B corresponden a los grupos del 3 a 12, contienen los elementos de transición. Los elementos de transición interna, lantánidos y actínidos, se incorporan dentro de los grupos IIIB (3) y IVB (4), generalmente ocupan la parte inferior de la tabla periódica. 24 • La línea en forma de escalera desde la parte superior del grupo IIIA (13) hasta la parte inferior del grupo VIA (16), separa los elementos metálicos que se ubican a la izquierda, de los elementos no metálicos que aparecen a la derecha y de los metaloides que se ubican a lado y lado de la escalera. • Los metales ocupan la mayor parte de la tabla periódica, son sólidos brillantes a temperatura ambiente, el mercurio es un metal líquido, son buenos conductores del calor y de la electricidad, se dejan moldear en láminas (maleabilidad) o en hilos (ductilidad). • Los no metales ocupan la parte superior derecha de la tabla periódica, generalmente son gases o sólidos opacos a temperatura ambiente, el bromo es no metal líquido, son malos conductores del calor y de la electricidad. • A lado y lado de la escalera están los metaloides o semimetales, presentan propiedades intermedias entre los metales y no metales, son muy importantes en la electrónica moderna. Continuando nuestro viaje al interior del átomo, nos disponemos a aprender ahora acerca de la estructura del átomo, estudiando la Teoría Atómica. 1.3.5 ESTRUCTURA DEL ATOMO Figura 7. Aristóteles. Los filósofos griegos del siglo IV a.C., incluyendo a Aristóteles, figura 7, creían que siendo la materia continua, se podía dividir en partes más pequeñas indefinidamente. Leucipo, por intuición, pensó que tenía que existir un límite en esta subdivisión de la materia hasta unas partículas que ya no se pudieran dividir más. Demócrito, discípulo de Leucipo, denominó a estas partículas propuestas por Leucipo átomos (del griego: a, “no” + tomos, “cortar”), que significa que no se pueden dividir o cortar más. Este es el origen y el significado de la palabra átomo. La teoría atomística griega y descubrimientos importantes que sucedieron en los siglos XVIII y XIX, contribuyeron para la formulación de la Teoría Atómica por parte del científico inglés Jhon Dalton en el año 1803. El descubrimiento del oxígeno o “aire perfecto” por parte de Joseph Priestley en 1774, le permitió comprender y explicar a Antoine Lavoisier, figura 8, el proceso de la combustión, explicando que las sustancias se combinan con el oxígeno del aire cuando se queman y que en este proceso una sustancia actúa como combustible es la que arde (madera) y la otra actúa como comburente, siendo la que hace arder (oxígeno). 25 Figura 8. Lavoisier y su esposa María Paulze. Lavoisier encontró que la respiración y la combustión eran procesos similares, en los cuáles, las sustancias reaccionan con oxígeno para producir dióxido de carbono y agua y que la masa de las sustancias que reaccionan es igual a la masa de las sustancias que se liberan como productos, definiendo de esta forma la Ley de conservación de la masa. Lavoisier es considerado el Padre de la Química. En 1783, Henry Cavendish, observó que se producía agua cuando se quemaba hidrógeno dentro de oxígeno, siendo Lavoisier quién explicó correctamente este experimento. Hacia 1800, dos químicos ingleses pasaron corriente eléctrica a través de agua descomponiéndola en hidrógeno y oxígeno. Al proceso de descomposición de un compuesto químico por medio de la corriente eléctrica se le denominó electrólisis. En 1799, Joseph Louis Proust concluyó que un compuesto siempre contenía sus elementos constituyentes en proporciones definidas, enunciado que se conoce como Ley de las proporciones definidas o de la composición constante. En 1800, Nicholson y Carlislie, descubrieron el proceso de electrólisis, logrando la descomposición de una sustancia por medio de la electricidad. Para esta misma época, Humprey Davy, utilizando la electrólisis, descubrió seis elementos químicos: sodio, potasio, magnesio, calcio, bario y estroncio. Davy propuso que esos elementos se mantienen juntos en los compuestos por atracciones de naturaleza eléctrica. 1.3.5.1 TEORIA ATOMICA DE DALTON Figura 9. Jhon Dalton. En 1803, Jhon Dalton, figura 9, formuló su teoría atómica, procurando explicar las Leyes de conservación de la masa y de las proporciones definidas, formulando por su parte la Ley de las proporciones múltiples. 1. Todos los elementos están formados por partículas diminutas e indivisibles llamadas átomos, los cuáles ni se crean ni se destruyen durante las reacciones químicas. Actualmente sabemos que los átomos son divisibles, que contienen partículas subatómicas como protones, neutrones y electrones. 2. Los átomos de un elemento no pueden convertirse en átomos de otro elemento en una reacción química. Actualmente sabemos que en las reacciones nucleares, con frecuencia, los átomos de un elemento se transforman en otro, pero esto no ocurre en un cambio químico. 26 3. Todos los átomos de un elemento tienen el mismo número de protones y electrones que determinan el comportamiento químico del elemento. Actualmente sabemos que existen los isotopos, átomos del mismo elemento con diferente masa atómica. 4. Todos los átomos de un elemento determinado son idénticos, pero difieren de los átomos de los demás elementos. Por ejemplo, el elemento Oxígeno está formado por átomos de oxígeno, no los podemos ver ni pesar por lo que son tan pequeños, todos los átomos de oxígeno presentan las mismas propiedades, pero difieren de las propiedades de los átomos de otros elementos. 5. Los átomos de distintos elementos forman compuestos combinándose en proporciones fijas. 6. Cuando dos elementos se combinan en más de una proporción para formar más de un compuesto, la masa de uno de ellos permanece fija mientras que la del otro varía guardando una relación de números enteros sencillos. “Ley de las proporciones múltiples” En la imagen observamos que la masa del cloro permanece fija y la del oxígeno varía guardando una relación de números enteros sencillos. Una teoría es un modelo que explica en forma congruente las observaciones y datos experimentales acerca de un fenómeno, proceso u objeto de estudio. Su importancia reviste en que cada modelo que se propone se confronta, es decir, se pone a prueba con los nuevos resultados experimentales, si permite explicarlos continúa teniendo validez científica, de lo contrario, los científicos buscan una nueva y mejor representación, un nuevo modelo que explique de mejor forma los resultados experimentales o que mejore el que está vigente. 27 La teoría atómica de Dalton ayudaba a responder unas preguntas, pero los científicos se preguntaban si los átomos se podrían descomponer en otras partículas, transcurrió un siglo para que la ciencia pudiera confirmar experimentalmente la existencia de partículas subatómicas. En un lapso de 35 años, comprendidos de 1897 a 1832, se descubrieron tres partículas subatómicas: protones, electrones y neutrones. 1.3.5.2 ELECTRÓN Seguramente que hombres de todos los tiempos han tenido contacto con la electricidad, sobre todo con la electricidad estática, como nos sucede cuando nos peinamos o nos quitamos la ropa, o con fenómenos eléctricos como los rayos cuando hay tormenta. El estudio de la electricidad fue un paso fundamental en el avance de la Teoría Atómica. 1.3.5.2.1 Electricidad Figura 10. Michael Faraday. Hacia 1830, Michael Faraday, figura 10, realizó diversos experimentos sobre electrólisis química, en la cual los compuestos se descomponen por electricidad. Faraday estudió la relación entre la cantidad de electricidad usada y la cantidad de compuesto descompuesto y formuló las leyes de la electrólisis química, sentando las bases de la teoría moderna de la electricidad. En 1838, el alemán Julius Plucker, inspirado en los trabajos de Faraday, agregó dos electrodos al Tubo de Geissler (tubo vacío), observó unas radiaciones emitidas desde el terminal negativo o cátodo, razón por la cual se llamaron Rayos Catódicos. Los científicos se preguntaron, si los rayos catódicos estaban formados por partículas con carga eléctrica o eran simplemente un haz de luz. En 1874, George Johnstone Stoney, postula la posibilidad de la existencia del electrón, manifestando que las unidades de carga eléctrica están asociadas con los átomos. 1.3.5.2.2 Tubos de descarga Figura 11. William Crookes. En 1875, el británico William Crookes, figura 11, ideó los tubos de descarga, el cual, es un tubo de vidrio en el cual se hace vacío mediante una bomba; en su extremo izquierdo hay un electrodo (Cátodo) unido a un potencial negativo, en el extremo opuesto hay un electrodo (Ánodo) unido a un potencial positivo. Cuando la diferencia de potencial es suficientemente alta se percibe una fluorescencia. Crookes, colocó un imán cerca del tubo y observó que el haz era desviado. 28 Se sometieron los rayos catódicos a la acción de campos eléctricos y se observó que también se desviaban, se concluyó que los rayos catódicos estaban formados por partículas de carga negativa. En 1891, Stoney sugirió que las unidades de carga eléctrica se llamaran electrones.. 1.3.5.2.3 Rayos x Figura 12. Roentgen. Whilhelm Conrad Roentgen, figura 12, trabajaba con tubos de rayos catódicos como se aprecia en la figura 13. Para observarlos mejor solía trabajar en completa oscuridad. El 8 de noviembre de 1895, cando colocó un objeto metálico en la trayectoria de los rayos, observó que, fuera del tubo, un papel impregnado con un reactivo fosforescente brillaba misteriosamente. Este efecto no podía ser causado por los rayos catódicos que estaban confinados en el tubo de descarga, tenía que tratarse de unos nuevos rayos, los llamó Rayos X. Accidentalmente Roentgen interpuso su mano en la trayectoria de los rayos y observó sobre la pantalla la sombra de los huesos de su mano; ensayó con diferentes objetos y se dio cuenta que algunos como el plomo eran radiopacos. Figura 13. Tubo de rayos X. Cuando chocan los rayos catódicos con el ánodo, se desaceleran produciendo los rayos X. El 28 de diciembre de 1895, entregó un manuscrito con el informe de sus resultados, que incluía una radiografía de la mano de su esposa. Así apareció la radiografía comercial, de gran utilidad sobre todo en la medicina. En 1901, recibió el Premio Nobel de Física por su descubrimiento. Actualmente sabemos que los Rayos X no están constituidos por partículas materiales, sino que son una forma de radiación electromagnética de alta energía. 29 1.3.5.2.4 Radiactividad Figura 14. Becquerel. Unos meses después, en 1896, Henri Becquerel, figura 14, supo de la existencia de los rayos X, comenzó a investigar si eran emitidos por las sustancias fluorescentes (aquellas que emiten luz y luego la emiten en la oscuridad). Comenzó a trabajar con sales de uranio que exponía al sol para que absorbiera las radiaciones, colocándolas luego sobre películas fotográficas vírgenes y cubriéndolas con papel negro para protegerlas de la luz, encontró cuando reveló las placas la imagen del mineral de uranio en la película, inicialmente pensó que la fosforescencia del mineral emitía rayos X. En un día no soleado guardo las sales de uranio y la película fotográfica virgen en un mismo cajón de su escritorio, cuando fue a reanudar los experimentos, encontró que la película contenía la imagen del mineral de uranio sin haber sido expuesta al sol, situación que lo llevó a concluir que el uranio emitía algún tipo de radiación desconocida. Figura 15. Marie Curie. Después de muchos experimentos, Marie Curie, figura 15, dedujo que la radiación provenía del uranio mismo y que no tenía nada que ver con la fosforescencia. Marie Curie concluyó que la radiación emitida por el uranio, era un nuevo fenómeno al que le dio el nombre de radiactividad. Encontró que todos los materiales que contenían uranio presentan radiactividad. Junto con su esposo Pierre Curie, descubrieron el polonio y el radio, dos elementos con gran poder radiactivo, capaz de matar células, que se o en la base para el tratamiento del cáncer mediante terapia radiológica. Marie Curie es la única mujer que ha recibido dos premios nobel en 1903 con su esposo Pierre y en 1911 por sus aportes al conocimiento de la radiactividad y el descubrimiento de elementos radiactivos. Actualmente sabemos que la radiactividad es una emisión espontánea de radiación proveniente de los núcleos de los átomos. 30 1.3.5.2.5 Caracterización de las emisiones radiactivas Figura 16. Ernest Rutherford. En 1899, Ernest Rutherfod, figura 16, demostró que las sustancias radiactivas producen tres tipos de radiaciones: Radiación alfa: Consiste en iones del elemento helio, He2+ que se mueven a gran velocidad, 1/10 de la velocidad de la luz y no poseen electrones. Tienen una penetración limitada en la materia, se pueden detener con un pedazo de papel o con la ropa. Radiación beta: Consiste en electrones emitidos a grandes velocidades, cercanas a las de la luz. Debido a su alta velocidad tienen mayor energía cinética que los electrones de los rayos catódicos. La radiación beta solo se puede detener con placas metálicas delgadas. Radiación gamma: Forma de radiación electromagnética similar a los rayos X, pero todavía con mayor energía. Toda radiación electromagnética, viaja a través del espacio vacío a la velocidad de la luz, no tiene masa y no tiene carga eléctrica. La radiación gamma es más penetrante, se requiere una capa gruesa de plomo o de concreto para detenerlas. Rutherford recibió el Premio Nobel de Química en 1908 por sus trabajos sobre radiactividad. 1.3.5.2.6 Relación carga/masa del electrón Figura 17. J.J. Thomson. Entre 1893 a 1897, el científico inglés Joseph John Thomson, figura 17, ideó como determinar la naturaleza de los rayos catódicos. Construyó un tubo de Geissler colocando una pantalla fluorescente al final del tubo, de tal manera que cuando los rayos la golpearan brillara; cuando los rayos no estaban sometidos a ninguna interacción, viajaban en línea recta y el brillo en la pantalla fluorescente se producía en el centro de la misma. Thomson, colocó también un campo magnético en el interior del tubo, el cual hacía que los rayos se desviaran hacia otro punto de la pantalla; insertó también un campo eléctrico, utilizando dos láminas metálicas cargadas, una positiva (ánodo) y otra negativa (cátodo), en la disposición que se muestra en la figura 18. 31 Figura 18. Experimento de Thomson, a) placas cargadas, b) con el imán. Esta igualación de fuerzas, le permitió a Thomson estudiar cuidadosamente las desviaciones de los rayos catódicos, demostrar que los rayos catódicos estaban formados por partículas cargadas negativamente a las que llamó electrones y después de experimentar con electrodos formados por distintos metales y con diferentes gases dentro del tubo, determinar la relación carga/masa del electrón: e/m = -1,7588 x 108 Coulomb / gramo El coulomb C es la unidad de carga eléctrica en el SI Sistema Internacional de Unidades. Un coulomb es la cantidad de carga que pasa en un segundo en un punto dado de un circuito eléctrico, cuando la corriente es de un amperio. El análisis de estos resultados llevó a la conclusión de que los rayos catódicos estaban formados por partículas más ligeras que el átomo, por lo cual eran partículas subatómicas. A Thomson se le reconoce como el científico que descubrió la primera partícula subatómica, a la cual se le llamó más tarde electrón. El electrón tiene carga eléctrica negativa. El hecho de que la relación carga/masa del electrón sea independiente del gas que se coloca en el tubo, implica que el electrón es una partícula que constituye todos los átomos. 32 1.3.5.2.7 Medición de la carga del electrón El estadounidense Robert A. Millikan, figura 19, en 1909, hizo la primera medida precisa de la carga del electrón, en su famoso experimento de la gota de aceite. Figura 19. Robert Millikan. Figura 20. Experimento de Millikan. En la figura 20 se aprecia la imagen del experimento de Millikan, los electrones son producidos por la acción de Rayos X sobre las moléculas de las cuales está compuesto el aire. Pequeñas gotas de aceite recogen electrones y adquieren cargas eléctricas. Las gotitas de aceite se depositan entre dos placas horizontales y la masa de una sola gota se determina midiendo su velocidad de caída. Cuando las placas están cargadas, la velocidad de caída de la gota se modifica debido a que la gota cargada negativamente es atraída hacia la placa positiva. Las medidas de la velocidad de caída en estas circunstancias permiten calcular la carga de la gota. Debido a que una gota puede recoger uno o más electrones, las cargas calculadas no son idénticas, pero todas son múltiplos sencillos del mismo valor mínimo, el cual corresponde a la carga del electrón: e = -1,6022 x 10-19 Coulomb Al obtener el valor de la carga del electrón hallada por Millikan y el valor de la relación carga/masa e/m del electrón hallada por Thomson, se obtuvo el valor de la masa del electrón, despejando su valor a partir de la ecuación: m= e e/m 33 m = -1,6022 x 10-19 Coulomb / -1,7588 x 108 Coulomb / gramo m = 9,1096 x 10-28 gramos Cada átomo contiene un determinado número de electrones. Como este valor de carga es el más pequeño, se le considera como unidad de carga electronegativa e = -1. Los átomos tienen un valor de carga neta igual a cero, es decir son eléctricamente neutros. Esto significa que si se sabía que los átomos tenían electrones con carga eléctrica negativa, debían existir partículas con carga positiva en igual número para contrarrestar la carga negativa de los electrones y lograr la neutralidad del átomo. 1.3.5.3 MODELO ATOMICO DE THOMSON A partir de este razonamiento, en 1902, Joseph John Thomson y William Thomson Kelvin, conocido como Lord Kelvin, formularon un primer modelo para el átomo de Dalton. Imaginaron el átomo como un “budín con pasas”, la masa del budín representaba la carga positiva, correspondiendo a la mayor parte de la masa del átomo y las pasas representaban los electrones, distribuidos uniformemente en la masa positiva, para lograr que el átomo fuera eléctricamente neutro, como se aprecia en la figura 21. Figura 21. Modelo atómico de Thomson. 1.3.5.4 PROTÓN En 1886, Eugen Goldstein, sustituyó la placa sólida del cátodo por un cátodo perforado, como se muestra en la figura 22. Encontró que en la dirección contraria a los rayos catódicos, fluía una corriente de electricidad positiva. Goldstein los llamó rayos positivos o rayos canales por lo que pasaron a través de las perforaciones que realizó en el cátodo, como provienen del ánodo también se le llaman rayos anódicos. 34 Figura 22. Rayos canales. a) En un tubo de rayos catódicos los electrones viajan del cátodo al ánodo. b) En su trayectoria pueden chocar con átomos o moléculas de gas remanente en el tubo. La colisión da por resultado iones positivos, que tienden a viajar ahora hacia el electrodo negativo. c) Como el cátodo está perforado algunos iones acelerados lo atraviesan y d) forman los rayos canales que se detectan en la otra pared del tubo. Thomson tomó nuevamente los tubos para estudiar los rayos canales, a los que sometió a la acción de campos eléctrico y magnético, encontró diferentes trayectorias para los iones positivos formados. Cuando el gas en el tubo era neón, que es un elemento, obtuvo dos trayectorias, como si existieran dos átomos de neón con diferente masa, de esta manera descubrió los isótopos, en 1913. Unos años más tarde colocando gas hidrógeno en el tubo, se formaron los iones H2+ y H1+, desprovistos de su electrón. Thomson formuló que los iones hidrógeno positivos eran partículas subatómicas con el mismo valor de la carga del electrón pero de signo positivo, llamadas protones. En 1898, Wilhem Wein, determinó el valor carga/masa para el protón, la masa del protón es 1837 veces mayor que la del electrón. Fue hasta 1920 que se identificó el ion hidrógeno positivo, se le dio el nombre de protón, partícula de carga positiva que forma parte de todos los átomos. 35 1.3.5.5 MODELO ATÓMICO DE RUTHERFORD Rutherford reconoció que las partículas alfa podían usarse para conocer más acerca del átomo. En 1909, con sus alumnos Geiger y Mardsen, llevaron a cabo un experimento para poner a prueba el modelo atómico de Thomson, figura 23. Figura 23. Experimento de Rutherford. Utilizaron partículas alfa emitidas por un elemento radiactivo, radio o polonio, colocado dentro de una caja de concreto, para bombardear láminas delgadas de oro, platino o cobre. Las partículas alfa salen en forma de haz por un pequeño orificio. Alrededor de la placa metálica colocaron una pantalla fluorescente para detectar las partículas alfa después de interactuar con la lámina metálica. Rutherford esperaba observar según el modelo atómico de Thomson, que las partículas alfa positivas fueran uniformemente repelidas por la masa positiva distribuida uniformemente en el átomo. Encontró que la mayoría de las partículas alfa pasaban a través de la lámina y golpeaban la pantalla fluorescente en línea recta (O). Algunas partículas alfa se desviaban en pequeños ángulos (A), sólo pocas partículas alfa se desviaban en grandes ángulos (B). El modelo de Thomson no podía explicar el comportamiento de las partículas alfa. Rutherford pensó que la única explicación para que las partículas alfa fueran repelidas a grandes ángulos era que el átomo tuviera un núcleo pequeño y denso de carga positiva, unas 10000 veces más pequeño que el átomo, donde se concentran los protones y un 99,9% de la masa del átomo. La mayor parte del átomo es espacio vacío. Los electrones en el modelo de Rutherford se mueven alrededor del núcleo. 36 1.3.5.7 MODELO ATOMICO DE BOHR Figura 25. Niels Böhr. La teoría cuántica fue propuesta en primer lugar por Max Planck en 1900 para explicar la radiación de un cuerpo caliente. En 1905, Albert Einstein la utilizó para explicar la emisión de electrones por metales expuestos la luz. En 1913, Niels Böhr, figura 25, utilizó la teoría cuántica para desarrollar el modelo del átomo de hidrógeno. La teoría cuántica es una teoría general que se aplica a todas las interacciones de la materia con la energía. La teoría cuántica aplicada a la teoría atómica se fundamenta en los siguientes postulados: • Los átomos y las moléculas solo pueden existir en ciertos estados, que se caracterizan por una cierta energía. Cuando un átomo o molécula cambia de estado, debe absorber o emitir la cantidad exacta para ir a dicho estado. Los electrones de un átomo no pueden tener cualquier valor de energía, sino que poseen valores de energía definidos. El estado electrónico de energía más bajo es el estado fundamental. Un estado excitado es el que tiene más energía que el estado fundamental. • Un átomo o molécula se pude mover desde un estado de energía electrónica a otro, absorbiendo o emitiendo un fotón. • Los estados permitidos de energía de átomos o moléculas se pueden describir por una serie de números cuánticos. Niels Böhr, desarrolló un modelo sobre el comportamiento de los electrones en el átomo de hidrógeno. Böhr supuso que el átomo de hidrógeno constaba de un protón central alrededor del cual se movía el electrón en órbitas circulares. Relacionó la fuerza de atracción del protón y el electrón con la fuerza centrífuga debida al movimiento circular del electrón. Definió el número cuántico n, el cual solo puede tomar valores enteros positivos (1, 2, 3, …). En el átomo de hidrógeno normal, el electrón se encuentra en estado fundamental para el que n=1. Cuando un electrón absorbe energía se mueve a un estado superior, a un estado excitado, los cuales corresponden a n = 2, 3, 4… Cuando un electrón desprende energía en forma de luz (fotón) vuelve a un estado de energía más bajo ya sea otro nivel excitado o a su estado fundamental. Böhr dedujo que cada nivel de energía de un átomo sólo es capaz de mantener cierto número de electrones a la vez. El número máximo de electrones o población electrónica máximo por nivel de energía se calcula según la fórmula 2n2. En la cual n es igual al número del nivel de energía que se está llenando, como se muestra en la tabla 5. 37 Nivel de Energía (2n2) Población electrónica máxima 1 (2 x 12) 2 2 (2 x 12) 8 3 (2 x 32) 18 4 (2 x 32) 32 Tabla 5. Población electrónica máxima por nivel de energía. Por ejemplo, el diagrama de Böhr para el sodio es: El círculo central representa el núcleo del átomo, en el cual se hallan 11 protones y 11 neutrones; los círculos exteriores representan los niveles de energía, los cuales se representan por las letras K, L, M… o con los números arábigos 1, 2, 3… Bohr propuso un modelo planetario para el átomo, como si el sol fuera el núcleo y los electrones los planetas que giran en niveles de energía cuantizados en torno al núcleo. 1.3.5.8 MODELO MECÁNICO CUÁNTICO DEL ÁTOMO La teoría cuántica o mecánica cuántica se formuló durante los primeros treinta años del siglo XX, por los científicos Max Planck, Albert Einstein, Niels Böhr, Louis De Broglie, Erwin Schrödinger, Wolfgang Pauli, Werner Heisenberg y Paul Dirac. En 1924, Louis De Broglie postuló que el electrón tiene naturaleza dual, se comporta como partícula y como onda. Siendo el electrón una onda era muy difícil determinar la posición del electrón dentro del átomo. En 1920, los científicos se convencieron de que el modelo de Böhr debía ser abandonado porque no correspondía a la realidad. Se desarrolló la mecánica cuántica para describir e movimiento de pequeñas partículas confinadas en una pequeña porción del espacio. 38 En 1926, Erwin Schrödinger, figura 26, desarrolló una ecuación cuya solución está asociada a una serie de números cuánticos, por medio de los cuales es posible calcular las energías permitidas al electrón en el átomo de hidrógeno y de los demás átomos. Figura 26. Erwin Schrödinger. Cada electrón, en un átomo, tiene una serie de números cuánticos que fijan su energía y la forma de su nube de carga. Primer número cuántico, n. Niveles principales de energía. Es fundamental para determinar la energía del electrón. El número cuántico n sólo puede tomar valores enteros positivos, 1, 2, 3, El valor de n corresponde al nivel de energía principal. Si n= 1 el electrón está en el nivel 1 y así sucesivamente. Segundo número cuántico, l. Subniveles (s, p, d, f) Cada uno de los niveles principales de energía incluye uno o más subniveles. Los subniveles se denotan por el número cuántico l, la forma de la nube electrónica viene determinada por l, el cual toma valores desde 0 hasta (n-1): los subniveles son, s (sharp); p (principal); d (diffuse); f (fundamental). Tercer número cuántico, m. Orbitales Cada subnivel contiene uno o más orbitales, designados por el tercer número cuántico m. Este número cuántico indica cómo está orientada la nube electrónica que rodea al núcleo. El valor de m está relacionado con el de l, toma valores desde –l hasta +l pasando por cero. Cuarto número cuántico, ms, spin del electrón El número cuántico ms, este número está asociado al giro del electrón alrededor de sí mismo. Un electrón posee propiedades magnéticas, que son como las de una partícula cargada girando alrededor de su eje, hay dos posibilidades de giro, en dirección de las agujas del reloj o en sentido inverso, puede tomar dos valores +1/2 o -1/2 Principio de exclusión de Wolfang Pauli: En 1925, dijo que en un átomo no pueden existir dos electrones con los cuatro números cuánticos idénticos. 39 Nivel de Energía 1 2 l Valores desde 0 hasta (n-1) 0 s 0 s 1 p 0 s 1 p 2 d 0 s 1 p 2 d 3 f 3 4 Población electrónica máxima Tabla 6. Relación entre los números cuánticos principal (n) y azimutal (l). En la tabla 6 se observa que el primer nivel de energía solo posee un subnivel s, el segundo nivel de energía posee subniveles s y p, el tercer nivel de energía posee subniveles s, p y d, el cuarto nivel de energía posee subniveles s, p, d y f. El subnivel s, tiene orbital s, con simetría esférica. Cada subnivel p contiene 3 orbitales p, formados por dos lóbulos idénticos con la misma energía pero que se proyectan con distinta orientación en el espacio, px, py, pz. El subnivel d contiene cinco orbitales y el subnivel d tiene 7 orbitales con formas más complejas que los orbitales. 40 n Nivel de energía l Valores desde 0 hasta (n-1) Subnivel 1 0 s 0 1 0 s 0 1 1 p 1, 0, 1 3 0 s 0 1 1 p -1, 0, 1 3 2 d -2, -1, 0, 1, 2 5 0 s 0 1 1 p -1, 0, 1 3 2 d -2, -1, 0, 1, 2 5 3 f -3, -2, -1, 0, 1, 2, 3 7 2 3 4 m Valores desde –l Orbitales en hasta +l pasando por cada subnivel cero Total de orbitales por nivel de energía n2 1 4 9 16 Tabla 7. Relación entre los números cuánticos principal (n), azimutal (l) y magnético (m) El número cuántico magnético m define el número de orbitales por cada subnivel, como se aprecia en la tabla 7, al totalizar los distintos subniveles que conforman un mismo nivel de energía obtenemos el número de orbitales por nivel de energía, podemos apreciar que el número de orbitales por nivel de energía es igual a n2. Vemos que el número cuántico spin ms se deriva de aplicar el principio de exclusión de Pauli, entendido como que en cada orbital sólo pueden ir dos electrones con spin contrario, entendemos el porqué de la fórmula para determinar la población máxima de electrones por nivel de energía que estableció Bohr como 2n2, siendo 2 el número de electrones máximo que se pueden encontrar en un orbital atómico pero teniendo spin contrario y n2 el número de orbitales máximo por nivel de energía. Los subniveles se van llenando en orden ascendente, según el menor valor de n + l. Así por ejemplo observamos que se llena primero 4s2 que 3d10, porque para la notación 4s2, n = 4 y l = 0, la suma n + l = 4 + 0 = 4; para la notación 3d10, n = 3 y l = 2, siendo n + l = 3 + 2 = 5, por eso se llena primero 4s2 que 3d10. 41 1.3.5.9 CONFIGURACIÓN ELECTRÓNICA Se utiliza la notación espectral que se muestra en la tabla 8, para realizar la configuración electrónica o distribución de los electrones que posee un átomo en los diferentes subniveles de energía a partir de su número atómico Z. Tabla 8. Orden de llenado de los subniveles de energía Aprendimos en el curso anterior que los elementos en la Tabla periódica están organizados en orden creciente de sus números atómicos, porque la Ley Periódica Moderna postula que las propiedades químicas de los átomos son funciones periódicas de sus números atómicos Z. Ahora vamos a aplicar la teoría cuántica para realizar la configuración electrónica de un átomo, partiendo de su número atómico Z, a analizarla y establecer su relación con su ubicación en el sistema periódico. Como ejemplo que nos ayude a recordar, vamos a realizar la configuración electrónica del elemento calcio Ca cuyo número atómico Z es igual a 20. Recordemos que para denotar la configuración electrónica de un átomo, de forma abreviada, se utiliza el símbolo del gas noble que antecede al elemento en el sistema periódico, encerrado entre corchetes, representando la parte interna del átomo y al lado derecho aparece la notación correspondiente. 42 Configuración electrónica extendida del Calcio Configuración abreviada del Calcio 1s2 2s2 2p6 3s2 3p6 4s2 [ Ar ] 4s2 43 Análisis de la configuración electrónica del Calcio Análisis Respuesta Justificación Región s Observamos que el subnivel de mayor energía del nivel 4, es s, por lo tanto está ubicado en la región del subnivel s bloque p de la tabla periódica. Período 4 Observamos que el nivel de energía más externo es el 4, por consiguiente está ubicado en la tabla periódica en el período 4, que el subnivel de mayor energía del nivel 4, es s, por lo tanto está ubicado en la región del subnivel s o bloque s de la tabla periódica. Grupo IIA Observamos que posee dos electrones en su nivel de energía más externo, por consiguiente posee 2 electrones de valencia, razón por la cual está ubicado en el grupo o familia 2 (IIA). Familia Alcalinotérreos Concluimos que es el Calcio es un metal, porque ya estudiamos la ubicación de los elementos en el sistema periódico y más específicamente pertenece a la familia alcalinotérreos. Por la posición que ocupa en la tabla periódica deducimos que su electronegatividad es baja y tiene tendencia a cumplir la ley del octeto perdiendo sus dos electrones de valencia formando el catión Ca+2. Todas estas deducciones las realizamos aplicando los conocimientos adquiridos sin consultar la tabla periódica. Aprender a aplicar los conocimientos, para analizar y deducir, es fundamental para comprender los procesos químicos, recordemos que las bases del aprendizaje se construyen en estos primeros grados. Ahora vamos a consultar la tabla periódica para comprobar nuestras deducciones. Procedemos a realizar la configuración electrónica del elemento flúor F cuyo número atómico Z es igual a 9, este ejemplo desarrollamos la configuración hasta orbitales atómicos. 1 Configuración electrónica del Flúor Configuración abreviada del Flúor 1s2 2s2 2p5 [ He ] 2s2 2p5 Ahora, desarrollamos la configuración electrónica hasta orbitales atómicos, representando cada electrón con spin contrario mediante una flecha. Procedemos a realizar el análisis de la configuración electrónica del Flúor y su relación con su ubicación en la Tabla Periódica. Análisis de la configuración electrónica del Flúor Análisis Respuesta Justificación Región p Observamos que el subnivel de mayor energía del nivel 2, es p, por lo tanto está ubicado en la región del subnivel p bloque p de la tabla periódica. Período 2 Observamos que el nivel de energía más externo es el 2, por consiguiente está ubicado en la tabla periódica en el período 2. Grupo VIIA Observamos que posee siete electrones en su nivel de energía más externo que es el 2, por consiguiente posee 7 electrones de valencia, razón por la cual está ubicado en el grupo o familia 17(VIIA). 2 Familia Halógenos Concluimos que es el Flúor es un no metal, porque ya estudiamos la ubicación de los elementos en el sistema periódico y más específicamente pertenece a la familia halógenos. Por la posición que ocupa en la tabla periódica deducimos que la electronegatividad del Flúor es la más alta del sistema periódico, pues en el grupo VIIA está en la parte superior y en el período 2 está más a la derecha, tiene tendencia a cumplir la ley del octeto ganando un electrón formando el anión F-1. La Tabla Periódica es como un libro de química resumido, para comprender los procesos químicos es fundamental aprender a conocerla, a utilizar la información que hay en ella y a deducir información a partir de ella. 1.3.5.10 MODELO ESTANDAR A continuación abordaremos el Modelo Estándar el cual continúa teniendo vigencia en la actualidad y cuyo conocimiento forma parte de la cultura general de una persona, por lo cual nos interesa familiarizarnos con sus planteamientos desde temprana edad. En 1905, Albert Einstein, inició dos caminos revolucionarios para la ciencia cuando publicó la teoría especial de la relatividad y aportó una nueva forma de ver la radiación electromagnética desde el punto de vista de la teoría cuántica. Una partícula elemental es aquella que no está formada por otras partículas y que por tanto no se puede dividir. Para saber si una partícula es elemental hay que intentar romperla, se han creado muchos equipos para provocar colisiones como el ciclotrón, el sincrotrón y acelerador lineal, para acelerar partículas que van a chocar. Figura 27. Sincrotrón. Estos equipos han permitido descubrir más de 100 partículas subatómicas, las cuales se han clasificado en leptones (electrón, muon, mesón tau y tres tipos de neutrinos), son partículas ligeras y hadrones o partículas pesadas, se conocen más de 100 hadrones, incluyendo al protón y al neutrón, los hadrones están formados por quarks, se plantea la existencia de seis quarks, veamos la figura 28. 3 La búsqueda de partículas elementales continúa, con la idea de encontrar cuál es la parte más pequeña de la materia. Entre 1960 a 1975, varios de los más eminentes físicos fueron elaborando un modelo que permitiera explicar la constitución de la materia y sus leyes, se conoció como cromodinámica cuántica (QDC) y condujo al modelo estándar. Figura 28. Partículas elementales. 4 Se consideran 6 quarks y 6 leptones, figura 28, como se observa cada partícula tiene su símbolo y valor de carga. Un protón está formado por tres quark (uud), su carga total es +1; un neutrón también está formado por tres quarks (ddu), su carga es cero. El modelo estándar es una teoría que ha sido considerada la mejor de todas para explicar la naturaleza de la materia, figura 29, la cual identifica las partículas básicas especificando cómo interactúan. Figura 29. Naturaleza de la materia. El modelo estándar plantea que en la naturaleza existen dos tipos de partículas: Las que están asociadas a la materia reciben el nombre de fermiones (quarks, leptones y bariones) en honor a Enrico Fermi, los fermiones poseen spin fraccionario y no pueden ocupar el mismo estado cuántico al mismo tiempo, esta característica define la estabilidad de la materia y sus propiedades macroscópicas. Las que están asociadas a las interacciones se llaman bosones, en honor a Satyendranath Bose, los bosones poseen spin entero, varios bosones pueden ocupar un mismo estado cuántico, son las partículas que conforman los campos de fuerza y son las portadoras de las interacciones. 5 El modelo estándar establece que todo cuanto conocemos está formado por dos tipos de partículas y sus correspondientes antipartículas: los quarks y los leptones, que interactúan entre sí por medio de tres tipos de fuerza (electromagnética, nuclear fuerte y electrodébil). Estas fuerzas o interacciones son transmitidas por partículas especializadas llamadas bosones. De acuerdo con el modelo, los tres tipos de interacciones (electromagnética, nuclear fuerte y electrodébil) al nivel fundamental son las tres formas de manifestarse de una fuerza única. La otra gran fuerza de la naturaleza es la gravedad, la cual actúa por igual sobre la masa que sobre la energía, queda fuera del modelo estándar y es explicada por la teoría de la relatividad. Algunos de los mejores científicos están buscando la Teoría de la Gran unificación (TGU). Según el modelo estándar los seis quarks y sus correspondientes antiquarks no se presentan de forma individual, sino formando agrupaciones llamadas hadrones. La materia ordinaria está formada por solo dos tipos de quarks: quark u (up o arriba) y quark d (down o abajo), que se agrupan formando tripletes o bariones. El protón, figura 30, es un barión que está formado por dos quark u y un quark d (uud), El quark u tiene carga +2/3 y el quark d -1/3, la carga del protón es +2/3+2/3-1/3 = +1 Figura 30. Protón. El neutrón, figura 31, es un barión formado por dos quark d y un quark u (ddu). y la del neutrón 2/3-1/3-1/3 = 0. Los mesones están formados por un quark y un antiquark, por ejemplo, los piones, pi+ (ud-), o los kaones, k- (su-). Figura 31. Neutrón 6 Los otros cuatro tipos de quarks solo se presentarían como constituyentes de partículas supermásicas, en condiciones energéticas muy elevadas que se alcanzan únicamente en estrellas de neutrones o quásares o en formas de materia no observadas. El quark t (top o cima), se descubrió en el acelerador Tevatrón del Fermilab en 1995. Algo parecido ocurre con los transmisores de fuerza o bosones, sólo el fotón puede ser observado fácilmente. Para detectar los bosones Z, W, g, se requieren enormes energías, utilizando los aceleradores de partículas se han ido detectando los distintos tipos de quarks y los bosones. Los leptones son partículas inmunes a la fuerza fuerte; de los leptones, sólo el electrón es fácilmente detectable. Los neutrinos carecen de carga y de masa, son muy escurridizos, atraviesan la materia ordinaria como si no existiese, no obstante se han detectado los demás leptones. Nos surge el interrogante ¿Si es tan difícil detectar estas partículas, entonces cuáles se encuentran en la materia ordinaria que nos rodea? El mundo que nos rodea está constituido por quarks u y d, electrones, fotones y neutrinos electrónicos. Los quarks u y d forman los protones y los neutrones, los quarks constituyen menos del 0,1% del núcleo atómico y el núcleo atómico ocupa menos de la cienmilésima parte del átomo, la mayor parte del átomo es espacio vacío. El resto de las partículas sólo existirían a energías que se dan en algunas estrellas muy másicas y en explosiones procedentes de los confines del universo, pudiendo llegar a nosotros como parte de la radiación cósmica. 7 En los aceleradores de partículas se reproducen esas condiciones, haciendo posible observar las partículas de forma controlada. Los bosones son las partículas mediadoras de las cuatro fuerzas fundamentales. Según el modelo estándar el universo estaría lleno de un campo de Higgs que los fotones y otras partículas no másicas atravesarían sin interactuar con él, pero el campo de Higgs interactuaría con las partículas másicas a través del bosón de Higgs ofreciendo una resistencia a su desplazamiento, figura 32. Figura 32. Bosón de Higgs. El 4 de julio de 2012, se anunció el descubrimiento de una partícula compatible con el bosón de Higgs conocido comúnmente como partícula de Dios. Si el modelo estándar es correcto, la existencia del bosón y el campo de Higgs son fundamentales, pues explicarían la masa de los quarks, los bosones W y Z y los leptones. No todo tiene masa, el fotón va a la velocidad de la luz o no existe, figura 33. Todo cuanto conocemos se puede presentar como masa o en forma de energía, o como combinación de ambas formas. Figura 33. Fotón. 8 En los núcleos atómicos los neutrones y protones se mueven a velocidades cercanas a las de la luz. Cuando se comprende que la masa es una forma de energía, se entiende que se transforma en otras formas de energía, las partículas subatómicas ya no se ven como “cosas” sino como racimos de energía, que son entidades tetra dimensionales en espacio y tiempo, son patrones de actividad con un aspecto espacial que las hace parecer como objetos con una cierta masa y un aspecto temporal que las hace parecer como procesos que encierran la energía equivalente, como lo planteó Einstein: “Materia y energía no son realidades distintas sino formas distintas de una misma realidad. La cantidad total masa de materia más masa de energía permanece constante antes y después de un proceso cualquiera, es decir, es constante en el universo”. La interacción fuerte se debe al intercambio de gluones, las partículas portadoras de la interacción. Los gluones son partículas sin masa, junto con los quarks, son las partículas elementales inobservables directamente porque se encuentran confinados en los hadrones. Los nuevos postulados permitieron que se empezara a comprender el mundo como un todo, con una visión sistémica y ecológica. La física moderna revela la unidad del universo, la naturaleza comprende una red de relaciones entre las partes de un todo unificado, las partículas subatómicas no se pueden concebir como unidades aisladas sino como interconexiones e interrelaciones. La fuerza y la materia tienen un origen común en los patrones dinámicos llamados partículas. Los patrones de energía forman las estructuras nucleares, atómicas y moleculares que construyen la materia y nos dan el aspecto macroscópico que observamos. Los átomos están constituidos de partículas pero las partículas no están hechas de nada material. Ahora realizamos el siguiente ejercicio de relación interactivo, para retroalimentar el aprendizaje sobre el Modelo Estándar. 9 1.3.5.11 EJERCICIO MODELO ATOMICO ACTUAL Vamos a establecer la relación correcta entre cada partícula subatómica y el enunciado que le corresponda, utilizando un color para cada partícula. CONCEPTO ENUNCIADO FOTÓN Partículas que constituyen los protones y neutrones. FERMIONES Constituye la materia ordinaria. BOSONES Formado por dos quark u y un quark d QUARKS Formado por dos quark d y un quark u. HADRONES Partículas asociadas a la materia. QUARK UP Partículas inmunes a la fuerza fuerte. PROTÓN Partículas asociadas a las interacciones. LEPTONES Partículas que se intercambian en la interacción fuerte. ELECTRÓN Partículas que carecen de carga y de masa. NEUTRÓN Formados por un quark y un antiquark. NEUTRINOS Responsable de la radiación electromagnética. NEUTRINOS Agrupaciones de quarks. GLUONES Responsable de la electricidad y de las reacciones químicas. 10 1.3.5.12 EJERCICIOS SOBRE CONFIGURACIÓN ELECTRÓNICA Vamos a aplicar los aprendizajes adquiridos resolviendo los siguientes ejercicios: Para los elementos, Magnesio, Cloro, Aluminio, Azufre y Fósforo, determinamos lo siguiente: Elemento Símbolo Número Atómico Z Metal No Metal Metaloide Magnesio Cloro Aluminio Azufre Fósforo Completamos la configuración electrónica extendida y abreviada, para cada átomo, representando los electrones en los orbitales mediante flechas con spin contrario, utilizamos un color diferente para representar los electrones de valencia de cada átomo Luego analizamos la configuración electrónica para cada átomo y determinamos su ubicación en el sistema periódico. Al terminar el ejercicio, sustentamos y verificamos el análisis realizado, comparando con la Tabla Periódica. Configuración electrónica extendida del Magnesio Configuración abreviada del Magnesio 11 Análisis de la configuración electrónica del Magnesio Análisis Respuesta Justificación Región Período Grupo Familia Configuración electrónica extendida del Cloro Configuración abreviada del Cloro 12 Análisis de la configuración electrónica del Cloro Análisis Respuesta Justificación Región Período Grupo Familia Configuración electrónica extendida del Aluminio Configuración abreviada del Aluminio 13 Análisis de la configuración electrónica del Aluminio Análisis Respuesta Justificación Región Período Grupo Familia Configuración electrónica extendida del Azufre Configuración abreviada del Azufre 14 Análisis de la configuración electrónica del Azufre Análisis Respuesta Justificación Región Período Grupo Familia Configuración electrónica extendida del Fósforo Configuración abreviada del Fósforo 15 Análisis de la configuración electrónica del Fósforo Análisis Respuesta Justificación Región Período Grupo Familia 1.3.5.13 EJERCICIO EL ÁTOMO Y SUS PROPIEDADES En cada ejercicio encontramos información relacionada con un elemento químico y su símbolo atómico. A partir de esta información, vamos a determinar las propiedades atómicas: número atómico, número másico, número de protones, número de electrones, número de neutrones. Elemento Estroncio Carbono Información Símbolo Atómico Propiedades Si un individuo consumió alimentos cultivados y cosechados localmente, las relaciones de sus isótopos del estroncio en su dentadura serán reflejo de la región geológica que habitó. Z= El análisis de isótopos estables, como el Carbono 13, ofrece información para discutir los tipos de dietas consumidas por las poblaciones humanas. Z= A= P+ = e- = n0 = A= P+ = e- = n0 = 16 Rubidio La edad de las rocas y de los minerales puede determinarse midiendo en ellos la acumulación de los productos aparecidos a causa de la desintegración radiactiva. El rubidio se usan con frecuencia para datar rocas formadas por minerales corrientes, como granitos Z= A= P+ = e- = n0 = ACTIVIDAD 2. ¿Cómo se forman los iones y las moléculas? Más del 99% de la materia reside en los núcleos atómicos; la materia que observamos a diario, está formada por núcleos con vida larga, mientras que en el universo se forman núcleos con vida muy corta. Actualmente en los laboratorios de partículas se crean estos núcleos para ser estudiados. Seguramente nos preguntamos ¿por qué los protones y neutrones se quedan unidos en el núcleo? Figura 34. Átomo neutro. Los protones identifican un elemento, tienen carga positiva y de acuerdo con la ley de Coulomb las cargas iguales se repelen y las contrarias se atraen, los protones siendo de carga positiva originan una fuerza de repulsión considerable dada la cercanía en que están dentro del núcleo atómico, esta fuerza tiende a romper el núcleo y los neutrones son necesarios para darle estabilidad al núcleo. Además de las fuerzas de repulsión, hay fuerzas de atracción entre protones y neutrones debidas a interacciones nucleares. Recordemos que la interacción fuerte ocurre en el núcleo atómico y se debe al intercambio de gluones, los cuales son las partículas portadoras de la interacción, que los gluones son partículas sin masa y que junto con los quarks son inobservables directamente porque se encuentran confinados en los hadrones; esta fuerza fuerte mediada por los gluones, mantiene unido el núcleo del átomo, por eso los protones y neutrones permanecen confinados en el núcleo atómico. 17 Los elementos de número atómico bajo son más estables porque tienen igual número de protones y neutrones, a mayor número de protones se requieren más neutrones para que a través de la fuerza nuclear fuerte se logre mantener la estabilidad del núcleo. 2.1 ¿QUÉ PRINCIPIOS EXPLICAN LA FORMACIÓN DE IONES Y MOLÉCULAS? En el curso anterior empezamos a aprender acerca de cómo se unen los átomos para formar moléculas, estudiamos la Ley del Octeto, la Electronegatividad, aprendimos también cómo se forman los iones cuando dos átomos se combinan mediante el enlace iónico. En la naturaleza se observa que buena parte de la materia conocida y de los seres que la conforman, están constituidos por elementos que se encuentran en los primeros cuatro períodos de la Tabla Periódica, los cuáles se combinan de distintas formas para constituir aniones, cationes y moléculas, unidades fundamentales de los compuestos químicos. Los elementos que forman parte de la materia viva se llaman biogenéticos, C, H, O, N, P, S, Cl, Na, K, Mg, Fe, Si, Al, entre otros, forman moléculas inorgánicas y orgánicas que constituyen la materia viva. La química es el lenguaje de la naturaleza, nos interesa profundizar en los principios que explican la formación de iones y moléculas, de manera que podamos comprenderlos, relacionarlos y aplicarlos. Como siempre abordamos con mucho interés los aprendizajes propuestos, entendiendo que estamos construyendo las bases para aprendizajes futuros de mayor complejidad. 2.1.1 Electronegatividad Hemos estudiado en el curso anterior la propiedad atómica electronegatividad. Acerca de esta propiedad atómica es importante tener en cuenta lo siguiente: • • • Se define como la medida de la atracción que ejerce un átomo sobre los electrones comprometidos en un enlace. El científico Linus Pauling, estudió esta propiedad y definió una escala de electronegatividad, en la cual el Flúor tiene la mayor electronegatividad con un valor de 4. Sabemos que conocer el valor de electronegatividad de dos átomos que se enlazan nos ayuda a predecir si el enlace que forman es predominantemente iónico cuando 18 • la diferencia de electronegatividad entre los dos átomos es mayor de 1,7, o por el contrario, predominantemente covalente si la diferencia de electronegatividad es menor de 1,7. Analizamos la forma como varía la electronegatividad en el sistema periódico, determinando que para los elementos que ocupan un mismo período la electronegatividad aumenta de izquierda a derecha, siendo los más electronegativos los elementos que están más a la derecha de la tabla periódica y que para los elementos de un mismo grupo o familia, la electronegatividad aumenta de abajo hacia arriba, siendo los más electronegativos los que se encuentran en la parte superior del grupo. Es importante tener en cuenta que en el proceso de elaboración de la fórmula de un compuesto químico, los elementos menos electronegativos se colocan a la izquierda de la fórmula, los de electronegatividad media en la parte intermedia y los más electronegativos se colocan a la derecha. 2.1.2 Ley del octeto Formulada por Lewis, plantea que todo átomo tiende a adquirir la estructura o configuración electrónica del gas noble (ocho electrones en el nivel de energía más externo) que le queda más cercano en el sistema periódico, ya sea ganando, perdiendo o compartiendo sus electrones de valencia. 2.1.3 Valencia Podemos definir valencia como la capacidad de combinación que posee un átomo o el número de enlaces simples que está en capacidad de formar. En el curso anterior analizamos que son los electrones de valencia que posee un átomo en su nivel de energía más externo, los que determinan sus propiedades químicas y su comportamiento en las reacciones, también analizamos que los elementos que pertenecen a un mismo grupo o familia en el sistema periódico tienen el mismo número de electrones de valencia y poseen propiedades químicas semejantes. Comprendemos entonces que el número de enlaces simples que un átomo puede formar depende del número de electrones de valencia que posea y que utilice en determinado enlace, lo cual define su valencia. De forma sencilla podemos elaborar para los elementos de los Gupos o Familias A, la siguiente tabla de valencias: 19 GRUPO VALENCIAS IA 1 IIA 2 IIIA 1, 3 IVA 2, 4 VA 1, 3, 5 VIA 2, 4, 6 VIIA 1, 3, 5, 7 2.1.4 Número de Oxidación (Nox) Se define como la carga aparente que presenta un átomo en una molécula, Moeller, en 1952, dice que si el número de oxidación es: • • Positivo, significa el número de electrones que debe añadirse a un catión para convertirlo en un átomo neutro. Negativo, significa el número de electrones que debe eliminarse de un anión para convertirlo en un átomo neutro. Generalmente el Nox y la valencia tienen el mismo valor absoluto porque coinciden en el número, la diferencia es que la valencia no tiene signo porque se refiere al número de enlaces simples que el átomo forma, mientras que el Nox sí tiene signo + ó -, según sea la carga aparente del átomo en la molécula. El número de oxidación, lo abreviamos como Nox y es fundamental en la formulación de compuestos químicos, existen reglas que debemos tener en cuenta para asignarlo, analicemos la tabla 9. Tabla 9. Reglas para asignar Números de Oxidación. 20 2.1.5 Fórmulas químicas Así como los elementos químicos se representan por símbolos, los compuestos químicos se representan por fórmulas. La fórmula química es una representación de la molécula o unidad estructural de un compuesto, en la cual se indica la cantidad o proporción de cada átomo en la formación del compuesto. 2.2 FORMACIÓN DE IONES Vamos a analizar cómo se forman los iones y cómo se forma una molécula a partir de los iones. El Litio, tiene número atómico, Z, 3., por consiguiente, según su configuración electrónica, posee en su núcleo, tres protones y tres neutrones; en la periferia del átomo, posee tres electrones, 2 ubicados en el orbital s del nivel 1 y posee 1 electrón de valencia en el nivel 2. Recordemos que para denotar la configuración electrónica de un átomo, de forma abreviada, se utiliza el símbolo del gas noble que antecede al elemento en el sistema periódico más los subniveles que le hagan falta a nuestro elemento. En este caso sería Helio más 2s1. Analizamos la configuración electrónica del Litio, relacionándola con su ubicación en la Tabla Periódica, podemos deducir que: Su nivel de energía más externo es 2, por lo cual, está en el período 2. Posee 1 electrón de valencia, por lo cual, pertenece al Grupo IA. El subnivel de mayor energía del nivel más externo es s, por lo cual se ubica en la región s. Puesto que está ubicado en la izquierda de la Tabla Periódica, deducimos que su electronegatividad es baja y tiende a perder con facilidad su electrón de valencia, adquiriendo la estructura del Helio, el gas noble más cercano en el sistema periódico. 21 El átomo de Litio queda con 3 protones (+) en el núcleo y 2 electrones (-) en la periferia, lo cual, da un balance de carga: +3-2 = +1 El átomo de Litio perdió su electrón de valencia y se convirtió en el catión Li+1 Recordemos que un catión es un átomo o grupo de átomos que posee carga eléctrica positiva, porque ha perdido electrones. El valor de la carga depende del número de electrones perdidos. Analicemos ahora el Flúor, su numero atómico es 9, tiene la configuración electrónica siguiente: 22 Observamos que su número atómico Z es 9, posee en su núcleo, nueve protones y nueve neutrones; en la periferia del átomo, posee nueve electrones, 2 ubicados en el orbital s del nivel , 2 ubicados en el orbital s del subnivel s del segundo nivel de energía, 5 electrones ubicados en tres orbitales p en el segundo nivel de energía; notamos que posee 7 electrones de valencia en el nivel 2. El análisis de la configuración electrónica del Flúor, nos permite deducir que: Su nivel de energía más externo es 2, por lo cual, está en el período 2. Posee 7 electrones de valencia, por lo cual, pertenece al Grupo VIIA. El subnivel de mayor energía del nivel más externo es p, por lo cual se ubica en la región p. El flúor es el elemento químico más electronegativo de la Tabla Periódica, tiende a atraer un electrón para completar su octeto en el último nivel de energía. El átomo de Flúor gana un electrón y adquiere la estructura del gas noble Neón. 23 El átomo de Flúor queda con 9 protones (+) en el núcleo y 10 electrones (-) en la periferia, lo cual, da un balance de carga: +9-10 = -1 El átomo de Flúor ganó un electrón y se convirtió en el anión F-1 Un anión es un átomo o grupo de átomos que tiene una carga negativa, debido a que ha ganado electrones. El valor de la carga depende del número de electrones ganados. Los cationes y los aniones por tener cargas opuestas se atraen. El catión Li+1 y el anión F-1 se atraen y sus cargas se neutralizan cuando forman la sal fluoruro de litio LiF. En la fórmula que representa la molécula, el símbolo del elemento electropositivo se coloca a la izquierda y el símbolo del elemento electronegativo a la derecha y se omiten las cargas porque la molécula es neutra. Los aniones y cationes son muy importantes para todos los seres vivos, son proporcionados por las sales minerales disueltas en agua, éstas se disocian en los procesos químicos y los iones resultantes son utilizados por el organismo para realizar funciones que mantienen su equilibrio. La ausencia de iones causa desequilibrio funcional, y produce enfermedades que de no ser atendidas pueden producir la muerte. 24 Analizamos como ejemplo de compuestos los óxidos, los cuales se forman cuando un elemento se combina con el Oxígeno. En el ejemplo cada átomo de litio, posee un electrón de valencia, que transfiere al oxígeno por ser menos electronegativo, al perder un electrón, cada átomo de litio se convierte en un catión con carga +1, Li+1; el átomo de oxígeno gana en total dos electrones, se convierte en un anión con carga -2, O-2. Observamos que la valencia del elemento diferente al oxígeno es el subíndice que tiene el oxígeno en cada molécula y a su vez el subíndice del metal es 2 porque el oxígeno en la mayoría de compuestos trabaja con Nox -2. La suma algebraica de las Nox de la molécula debe ser igual a cero, la molécula resultante es neutra. Al representar la molécula obtenida mediante una fórmula molecular, se omiten los valores y signos de las cargas, la fórmula del óxido de litio es Li2O, el oxígeno se ubica al lado derecho y el elemento diferente al oxígeno a lado izquierdo. Los óxidos se nombran usando prefijos que indican la cantidad de átomos de Oxígeno y del otro elemento que lo acompaña en la molécula, por ejemplo: Br2 O7 Heptóxido de dibromo, porque tiene siete átomos de oxígeno y dos de bromo en su molécula. Los prefijos que usamos para indicar la cantidad de átomos presentes son: Mono = uno Bi o di = dos Tri = tres Tetra = cuatro Penta = cinco Hexa = seis Hepta = siete De igual forma, a partir del nombre del compuesto podemos obtener su fórmula, por ejemplo: Pentóxido de dinitrógeno: el nombre nos indica que la molécula tiene 5 átomos de oxígeno y dos átomos de nitrógeno. La carga o Nox del nitrógeno es el subíndice del oxígeno con carga positiva, es decir, +5 y la carga del oxígeno es el subíndice del nitrógeno, con carga negativa, es decir, -2. Al organizar la fórmula colocamos a la izquierda el nitrógeno y a la derecha el oxígeno, con sus respectivas cargas. La suma algebraica de las cargas debe dar cero. Para el nitrógeno (+5) x 2 átomos = +10 25 Para el oxígeno (-2) x 5 átomos = -10 Molécula = +10 – 10 = 0 N2+5 O5-2 Ahora vamos a poner en práctica los aprendizajes sobre los iones y las moléculas, desarrollando el ejercicio el juego de las moléculas. EL JUEGO DE LAS MOLÉCULAS Nos disponemos a aprender jugando, armando distintas moléculas de óxidos a partir de sus correspondientes cationes y aniones. En cada ejercicio te aparece el nombre de un óxido y varios cationes y aniones, debes escoger el catión y anión correctos, armando la fórmula de cada compuesto, aplicando lo aprendido. Disponemos de los cationes y aniones siguientes: N2+3 O7-2 P2+5 O3-2 Cl2+7 O2-2 C+4 O3-2 S+6 O5-2 Para cada óxido nombrado vamos obtener su fórmula correcta utilizando el catión y anión correspondiente: Nombre del compuesto Fórmula Trióxido de dinitrógeno Pentóxido de fósforo Heptóxido de dicloro Bióxido de carbono Trióxido de Azufre 26 ACTIVIDAD 3. Elementos comunes en diferentes seres naturales El Universo y la Tierra comparten elementos comunes: En el proceso de evolución de la tierra primero se originaron los elementos organogénicos, hidrógeno, carbono, nitrógeno, oxígeno, fósforo y azufre. Luego ocurrió la evolución molecular a partir de la cual se originaron moléculas orgánicas simples a partir de los elementos organogénicos, por ejemplo, agua, amoníaco, formaldehído, metano, monóxido de carbono; luego moléculas orgánicas complejas como aminoácidos y nucleótidos. Más tarde se produjeron los procesos de interacción entre las proteínas y los ácidos nucleicos dando lugar al primer complejo molecular capaz de reproducirse, el Ácido Desoxirribonucleico, ADN. Posteriormente ocurrió la evolución biológica, la cual comprende desde la formación de los primeros seres vivos hasta las formas más complejas. Este origen evolutivo común explica la semejanza en la composición química de los seres vivos. Es sorprendente que sólo 11 de los elementos de la tabla periódica forman la mayor parte de la materia viviente, oxígeno, carbono, nitrógeno, hidrógeno, calcio, fósforo, azufre, potasio, sodio, cloro y magnesio. 27 Sólo cuatro elementos, Oxígeno, Carbono, Nitrógeno e Hidrógeno, forman el 96% de la materia viva. Los otros siete elementos, calcio, fósforo, azufre, potasio, sodio, cloro y magnesio, forman el 3,6 % restante de la composición de los seres vivos. Los demás elementos como hierro, yodo, cobre, manganeso, cinc, cobalto, molibdeno, selenio, cromo, estaño, vanadio, flúor y silicio, solo están en trazas o pequeñísimas cantidades, pero cumplen funciones importantes en cada organismo. Ahora nos disponemos a dar curso libre a nuestra imaginación y a nuestra creatividad, participando activamente en la “Lluvia de ideas” para dar solución a la pregunta ¿Qué tenemos en común con las estrellas? ¿Qué tenemos en común con las estrellas? Lluvia de ideas, tormenta de ideas, brainstorming, stormboard Esta técnica de trabajo en grupo, se utiliza para potenciar la participación y la creatividad de los participantes, obteniendo un gran número de ideas enfocadas hacia la solución de la pregunta ¿Qué tenemos en común con las estrellas?, cuyo objetivo es darnos cuenta de la semejanza en la composición química de los seres de la naturaleza y del universo. El docente es el conductor del ejercicio, en primer lugar, coloca la pregunta en la parte central del tablero. En segundo lugar, propone a los estudiantes un ambiente tranquilo para participar, sin censurar, sin criticar, sin burla, acogiendo con respeto todas las ideas por locas que éstas parezcan, tomando en cuenta todas las ideas, propiciando que todas las personas piensen creativamente y se imaginen nuevas ideas. En tercer lugar, invita a los estudiantes a estimular la imaginación y a emitir las ideas libremente. En cuarto lugar, a medida que los estudiantes van generando ideas y pensamientos, el docente las va registrando en el tablero. En quinto lugar, conjuntamente con los estudiantes, seleccionan las ideas más relevantes, relacionadas con la pregunta planteada y con el objetivo de la lluvia de ideas. En sexto lugar, de estas ideas que consideraron relevantes, seleccionan las ideas principales, que mejor responden a la pregunta planteada. En séptimo lugar, elaboran conclusiones. 28 Resumen Analicemos el infograma con atención para realizar aprehensión de las ideas claves de esta unidad de aprendizaje. 12 14 6C 239 6C 92 Isótopos Z A U 239 Pu u Masa 94 Isóbaro Z A Protones Número Atómico d Neutrones Fuerza Nuclear Fuerte +2/3 antiene unidas las part culas en el Núcleo Atómico. u +2/3 -1/3 Protón Ley de Conservación de la masa. u +2/3 d d Número de Protones en el Núcleo Identifica los Átomos y Facilita ordenar los elementos en la Tabla Periódica -1/3 -1/3 Neutrón QUARKS LEPTONES C -1 +1 No permite ue se arran uen los protones del Núcleo. u C u +2/3 u U d d P d d u C u u C u u u C u u -1/3 d C u En el infograma se representan los postulados que han permitido que se empiece a comprender el mundo como un todo, con una visión holística y ecológica, entendiendo las partículas subatómicas como interconexiones e interrelaciones. La fuerza y la materia tienen un origen común en los patrones dinámicos llamados partículas. Los patrones de energía forman las estructuras nucleares, atómicas y moleculares que construyen la materia y nos dan el aspecto macroscópico que observamos. Los átomos están constituidos de partículas pero las partículas no están hechas de nada material. Recordemos que los iones se forman cuando los átomos neutros pierden o ganan electrones. Un catión es un átomo o grupo de átomos que posee carga eléctrica positiva, porque ha perdido electrones. El valor de la carga depende del número de electrones perdidos. Un anión es un átomo o grupo de átomos que tiene una carga negativa, debido a que ha ganado electrones. El valor de la carga depende del número de electrones ganados. 29 Los cationes y los aniones por tener cargas opuestas se atraen. El catión Li+1 y el anión F-1 se atraen y sus cargas se neutralizan cuando forman la sal fluoruro de litio LiF. Analizamos como ejemplo de compuestos los óxidos, los cuales se forman cuando un elemento se combina con el Oxígeno. La valencia del elemento diferente al oxígeno es el subíndice que tiene el oxígeno en cada molécula y a su vez el subíndice del metal es 2 porque el oxígeno en la mayoría de compuestos trabaja con Nox -2. La suma algebraica de las Nox de la molécula debe ser igual a cero, la molécula resultante es neutra. Los aniones y cationes son muy importantes para todos los seres vivos, son utilizados por el organismo para realizar funciones que mantienen su equilibrio. La ausencia de iones causa desequilibrio funcional, y produce enfermedades que de no ser atendidas pueden producir la muerte. Los compuestos se representan por fórmulas químicas, las cuáles indican la clase y la cantidad de átomos que forman una molécula de cada compuesto, al elaborar la fórmula, el símbolo del elemento menos electronegativo se coloca a la izquierda y el del más electronegativo a la derecha; la suma algebraica de las cargas de los iones debe ser igual a cero, porque las moléculas son neutras. Los átomos de los cuatro primeros períodos de la tabla periódica constituyen la mayor parte de la materia conocida, se unen para formar la gran diversidad de moléculas que se encuentran en la naturaleza, debemos entender que la química es el lenguaje de la naturaleza y nos compete aprenderlo, comprenderlo y aplicarlo. Tarea Vamos a consultar qué elementos y qué compuestos podemos encontrar en la industria y en el hogar, sus fórmulas químicas y sus usos. Con esta información, elaboramos una cartelera y la sustentamos en la siguiente clase. 30 INDICE DE FIGURAS Figura 1. El aire. Pixabay. (s.f.). Pixabay. Recuperado el 14 de Mayo de 2015, de Pixabay: http://pixabay. com/en/hot-air-balloons-hot-air-ballooning-439331/ Figura 2. Agua. Pixabay. (s.f.). Pixabay. Recuperado el 14 de Mayo de 2015, de Pixabay: http://pixabay. com/en/waterfall-water-level-movement-335985/ Figura 3. Bomba de hidrógeno. Emol. (s.f.). Emol. Recuperado el 14 de Mayo de 2015, de Emol: http://www.emol.com/ especiales/segunda_guerra_mundial/crono_guerra_fria.htm Figura 4. Formación del enlace covalente en la molécula de hidrógeno. Silberberg, M. (2002). Química General. México: McGraw Hill. Figura 5. El àtomo. Silberberg, M. (2002). Química General. México: McGraw Hill. Figura 6. Tabla periódica moderna, Wikipedia. (15 de 12 de 2009). Wikipedia. Obtenido de Wikipedia: http://es.wikipedia. org/wiki/Elemento_qu%C3%ADmico#/media/File:Periodic_table_large-es.svg Figura 7. Aristóteles. WhenInTime. (s.f.). WhenInTime. Recuperado el 14 de Mayo de 2015, de WhenInTime: http://whenintime.com/EventDetails.aspx?e=2f289320-b20e-4ca1-b4b6c3d2c0e6f9e0&t=/tl/federicort95/timeline/ Figura 8. Lavoisier y su esposa María Paulze. Spanish Arts. (s.f.). Spanish Arts. Recuperado el 15 de Mayo de 2015, de Spanish Arts: http://www.spanisharts.com/history/del_neoclasic_romant/imagenes/david/ lavoisier.html Figura 9. Jhon Dalton. History. (s.f.). History. Obtenido de History: http://mx.tuhistory.com/hoy-en-lahistoria/nacio-john-dalton 31 Figura 10. Michael Faraday. Rivero, F. (19 de 11 de 2007). Revista Digital de Ciencias. Obtenido de Revista Digital de Ciencias: http://www.clubcientificobezmiliana.org/revista/index.php?option=com_ content&task=view&id=51&Itemid=17 Figura 11. William Crookes. Wikipedia. (15 de 03 de 2015). Wikipedia. Obtenido de Wikipedia: http://es.wikipedia. org/wiki/William_Crookes Figura 12. Roentgen. Wikipedia. (27 de 03 de 2015). Wikipedia. Obtenido de Wikipedia: http://es.wikipedia. org/wiki/Wilhelm_R%C3%B6ntgen Figura 13. Tubo de rayos X. De la Llata Loyola, M. D. (2001). Química inorgánica. Editorial Progreso. Figura 14. Becquerel. Revista Vivat Academia. (10 de 04 de 2008). Revista Vivat Academia. Obtenido de Revista Vivat Academia: http://www3.uah.es/vivatacademia/anteriores/n92/ docencia.htm Figura 15. Marie Curie. Alianza Francesa. (20 de 11 de 2013). Alianza Francesa. Obtenido de Alianza Francesa: https://alianzafrancesadepiura.files.wordpress.com/2013/11/marie-curie-au-deladu-mythe-poster.jpg Figura 16. Ernest Rutherford. Wikipedia. (22 de 03 de 2015). Wikipedia. Obtenido de Wikipedia: http://es.wikipedia. org/wiki/Ernest_Rutherford Figura 17. J.J. Thomson. Wikipedia. (10 de 04 de 2013). Wikipedia. Obtenido de Wikipedia: http://an.wikipedia. org/wiki/Joseph_John_Thomson Figura 18. Experimento de Thomson, ESCEPTICISMO, C. (2005). El modelo atómico nuclear. Unimed Consulting, 74-92. Figura 19. Robert Millikan. Wikipedia. (24 de 03 de 2015). Wikipedia. Obtenido de Wikipedia: http://es.wikipedia. 32 org/wiki/Robert_Andrews_Millikan Figura 20. Experimento de Millikan. De la Llata Loyola, M. D. (2001). Química inorgánica. Editorial Progreso. Figura 21. Modelo atómico de Thomson. De la Llata Loyola, M. D. (2001). Química inorgánica. Editorial Progreso. Figura 22. Rayos canales. De la Llata Loyola, M. D. (2001). Química inorgánica. Editorial Progreso. Figura 23. Experimento de Rutherford ESCEPTICISMO, C. (2005). El modelo atómico nuclear. Unimed Consulting, 74-92. Figura 24. James Chadwick. Wikipedia. (22 de 03 de 2015). Wikipedia. Obtenido de Wikipedia: http://es.wikipedia. org/wiki/James_Chadwick Figura 25. Niels Böhr. Wikipedia. (22 de 03 de 2015). Wikipedia. Obtenido de Wikipedia: http://es.wikipedia. org/wiki/Niels_Bohr Figura 26. Erwin Schrödinger. Wikipedia. (22 de 03 de 2015). Wikipedia. Obtenido de Wikipedia: http://es.wikipedia. org/wiki/Erwin_Schrodinger Figura 27. Sincrotrón. Wikipedia. (22 de 03 de 2015). Wikipedia. Obtenido de Wikipedia: http://es.wikipedia. org/wiki/sincrotron Figura 28. Partículas elementales. ESCEPTICISMO, C. (2005). El modelo atómico nuclear. Unimed Consulting, 74-92. Figura 29. Naturaleza de la materia. Casaus, J. R. (2005). Cromodinámica Cuántica: el color de los quarks. Fotón, 1, 137. Figura 30. Protón. Wikipedia. (22 de 03 de 2015). Wikipedia. Obtenido de Wikipedia: http://es.wikipedia. 33 org/wiki/protón Figura 31. Neutrón. Wikipedia. (22 de 03 de 2015). Wikipedia. Obtenido de Wikipedia: http://es.wikipedia. org/wiki/neutrón Figura 32. Bosón de Higgs. Wikipedia. (16 de 08 de 2011). Wikipedia. Obtenido de wikipedia: http://es.wikipedia. org/wiki/Bos%C3%B3n_de_Higgs#/media/File:CMS_Higgs-event.jpg Figura 33. Fotón. Wikipedia. (22 de 03 de 2015). Wikipedia. Obtenido de Wikipedia: http://es.wikipedia. org/wiki/fotón Figura 34. Átomo neutro. Educar Chile. (2013). Educar Chile. Obtenido de Educar Chile: http://www.educarchile. cl/ech/pro/app/detalle?ID=133074 INDICE DE TABLAS Tabla 1. Evolución de la Teoría atómica. Creación propia. Tabla 2. Composición del aire. Creación propia. Tabla 3. Propiedades del hidrógeno. Creación propia. Tabla 4. Propiedades de las partículas subatómicas. Adaptada de Silberberg, M. (2002). Química General. México: McGraw Hill. Tabla 5. Población electrónica máxima por nivel de energía. Creación propia. Tabla 6. Relación entre los números cuánticos principal (n) y azimutal (l). Creación propia. 34 Tabla 7. Relación entre los números cuánticos principal (n), azimutal (l) y magnético (m) Creación propia. Tabla 8. Orden de llenado de los subniveles de energía Creación propia. Tabla 9. Reglas para asignar Números de Oxidación. Ostermann, F. &. ( (2000)). Física contemporánea en la escuela secundaria. In Enseñanza de las Ciencias (Vol. 18, 391-404. BIBLIOGAFÍA Abdalla, M. C. (2011). El Gran Colisionador de Hadrones ensaya la vida. Prometeica, 1(3), 56-67. Alvarado Zamorano, C. (2005). La estructura atómica y el enlace químico desde un punto de vista disciplinario. In Enseñanza de las Ciencias, 1-5). Ballesteros, A. B. (2013). ESTRATEGIAS Y MODELOS PARA LA ENSEÑANZA DEL CONCEPTO ORBITAL ATÓMICO. IX CONGRESO INTERNACIONAL SOBRE INVESTIGACION EN DIDACTICA DE LAS CIENCIAS, (págs. 259-265). Girona. Brown, T. L. (2004). Química. Pearson educación. Burns, R. (1996). Fundamentos de Química. México: Prentice Hall Hispanoamericana S.A. Cañón, G. P. (2007). Aprendizaje Activo de la Física y la Química. Equipo Sirius. Capra, F. (1995). El tao de la física. Editorial Sirio, SA. Capra, F. (1998). La trama de la vida. Barcelona: Anagrama. (s.f.). CARACTERISTICAS, E. A. Y. S. LAS CONDICIONES AMBIENTALES. Cardoso, J. L. (2001). La enseñanza de la estructura de los átomos y de las moléculas. Cardoso, J. L. V. (2001). La enseñanza de la estructura de los átoRevista de la Facultad de Ciencia y Tecnología, (9), 108-118. Cotton, F. A. (1978). Química inorgânica. Libros Técnicos e Científicos. De La Fuente, A. M. (2003). Estructura atómica: análisis y estudio de las ideas de los estudiantes (8º de EGB). De La Fuente, A. M., Perrotta, M. T., Dima, G., Gutiérrez, E., Capuano, V., & Follari, B. (2003). Estructura atómiEnseñanza de las Ciencias, 21(1), De La Fuente, A. M., Perrotta, M. T., Dima, G., Gutiérrez, E., Capuano, V., & Follari, B. (2003). Estructu123-134. De la Llata Loyola, M. D. (2001). Química inorgánica. Editorial Progreso. 35 De Posada Aparicio, J. M. (1993). Concepciones de los alumnos de 15-18 años sobre la estructura interna de la materia en el estado sólido. . De Posada Aparicio, J. M. (1993). Concepciones de los alumnos de 15Enseñanza de las Ciencias, Barcelona, 11(1), 12-19. ESCEPTICISMO, C. (2005). El modelo atómico nuclear. Unimed Consulting, 74-92. Gallardo, A. (s.f.). El oxígeno y los procesos de oxidación de materiales. García, R. B. (2013). EL BOSÓN DE HIGGS. Premios Nobel, 45. Gómez, J. L. (2011). Algunos aspectos de fundamentación de la Mecánica Cuántica un siglo después. Revista Española de Física, 17(1). Guychon, R. e. (2001). Nuevas determinaciones de isótopos estables para tierra del fuego. Revista Argentina de Antropología Biológica., 113-126. Obtenido de http://sedici.unlp.edu.ar/bitstream/ handle/10915/5621/Documento_completo.pdf?sequence=1 Izquierdo, M. (2006). La educación química frente a los retos del tercer milenio. Educación química, 114-128. Lucas, A. M.-R. (1990). Contra las interpretaciones simplistas de los resultados de los experimentos realizados en el aula. In Enseñanza de las Ciencias Vol. 8, 11-16). Masterton, W. L. (1987). Química general superior. Interamericana. Monarca, J. B. (2010). Habrá nueva Física en el Gran Colisionador de Hadrones. Elementos: Ciencia y Cultura, (79), 3-11. Morgan, C. R. (2013). Partículas constructoras del universo: una comparación de las predicciones del Modelo Estándar y Modelo 3-3-1. Revista CIENCIA Y TECNOLOGÌA, , 9(4), 121-134. Mortimer, C. B. (1983). Química. México: Grupo Editorial iberoamérica. NASA. (01 de 07 de 2013). Nasa. Obtenido de Nasa: http://nssdc.gsfc.nasa.gov/planetary/factsheet/ earthfact.html Ostermann, F. &. ( (2000)). Física contemporánea en la escuela secundaria. In Enseñanza de las Ciencias (Vol. 18, 391-404. Petrucci, R. H. (1977). Química general. Fondo Educativo Interamericano. RODRÍGUEZ MORALES, M. (2004). Formulación y nomenclatura. Química inorgánica. Sánchez. (2008). El gran acelerador de hadrones (LHC) y la búsqueda de la partícula divina. Nuclear España, 13. Silberberg, M. S. (2002). Química general: la naturaleza molecular del cambio y la materia. Solbes, J. C. (1987). Errores conceptuales en los modelos atómicos cuánticos. In Enseñanza de las Ciencias Vol. 5, 189-195. 36 Tejada Tovar, C. C. (2013). Enseñanza de la química basada en la formación por etapas de acciones mentales (caso enseñanza del concepto de valencia). . Revista Virtual Universidad Católica del Norte, 1(38),, 143-157. Theodore, B. L. (1993). Química la ciencia central. México: Ed. Prentice Hall. Tuzon, P., & Jordi, S. (2014). Análisis de la enseñanza de la estructura e interacciones de la materia según la física moderna en primero de bachillerato. Didáctica de las Ciencias Experimentales y Sociales, 175 - 195. Valentín, L. D. (2005). La superposición de modelos históricos en la enseñanza de la Química: presentación del concepto de elemento químico. Valentín, L., Dulce, M., & Furió Más, C. (2005). La superposición de modelos históricos en la enseñanzaIn Enseñanza de las ciencias, Valentín, L., Dulce, M., & Furió Más, C. (2005). La superposición de modelos históricos en l1-3. 37