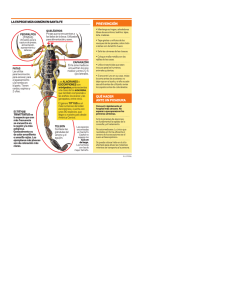
UNIVERSIDAD DE LA SIERRA DIVISIÓN DE CIENCIAS BIOLÓGICAS Programa de Licenciatura en Biología “Alacranes (Arachnida: Scorpiones), del estado de Sonora” MEMORIA PROFESIONAL Que para obtener el título de: Licenciado en Biología Presenta: Héctor Hugo Villa Corella Moctezuma, Sonora. Febrero, 2020 Moctezuma, Sonora, a 12 de febrero de 2020. DICTAMEN C. Héctor Hugo Villa Corella PRESENTE: Como resultado del análisis realizado a la Memoria de Estadía Profesional intitulada “Alacranes (Arachnida: Scorpiones), del estado de Sonora” y a propuesta de los C. Asesores M.C. Hugo Silva Kurumiya (Académico), Dr. Oscar Federico Francke Ballvé (Asesor de la Entidad Receptora, Departamento de Zoología, Instituto de Biología, Universidad Nacional Autónoma de México), y M.E.I.S.I. Salomé Frisby Durán (Sinodal) manifiesto a usted que en base al artículo 29 del Reglamento de Estadías de la Universidad de la Sierra su documento cumple con los requisitos establecidos al respecto por la institución. Por lo anterior, se dictamina favorablemente su trabajo y se le autoriza su reproducción para proceder a su exposición. Atentamente, M.C. Guilebaldo Lavandera Barreras Jefe de la División de Ciencias Biológicas C.c.p. Archivo. Gobierno del Estado de Sonora Unidos logramos más Universidad de l a Sierra Carretera Moctezum a- Cumpas Km . 2.5 | Moctezuma, Sonora | C.P. 84560 Teléfono (634) 342 9600 | www.unisierra.edu.mx Dedicatoria. Dedico esta tesis a mis padres Martin Villa Ballesteros y Yadira Minerva Corella Tapia que siempre me apoyaron incondicionalmente tanto económica como moralmente para poder a llegar a ser un profesional. A mis hermanos y demás familia en general por el apoyo que me brindaron día a día en el transcurso de cada año de mi carrera Universitaria “Yo, si algo deseo, no sueño, sino que actúo, y… siempre consigo aquello que deseo” Andrzej Sapowski I Agradecimientos Primeramente, agradezco a mis padres por haberme forjado como la persona que soy en la actualidad; muchos de mis logros se los debo a ustedes entre los que se incluye este. A mis hermanos por el apoyo brindado, por ser amigos y siempre estar cuando los necesito. Agradezco a la asociación GreaterGood.org en especial al Dr. Thomas R. Van Devender por la beca y el apoyo brindado para la realización de este trabajo, a mis asesores el Dr. Oscar Francke Ballvé por el apoyo y los comentarios brindados en la realización de este trabajo, al M.C. Diego Barrales Alcalá por el apoyo y la hospitalidad brindada, así como al personal del laboratorio de la Colección Nacional de Arácnidos (CNAN). Al grupo de trabajo “Estudios Integrales del Medio Natural” formado por; el M.C. Hugo Silva Kurumiya, a las M.C. Gertrudis Yánes Arvayo y María de la Paz Montañez Armenta por su apoyo en las recolectas, por los comentarios y el apoyo brindado. A la maestra Salome Frisby por los comentarios y el apoyo. A Richard Ayrey, Gerardo Acosta y Javier Escobedo por las imágenes proporcionadas, así como por los registros de especies. A mis compañeros de biología y a los ejidatarios en Moctezuma y Tepache; en especial a Guadalupe Montaño y al Prof. Renato Figueroa que ayudaron en las tareas de recolecta. A mis compañeros de clase por los buenos y malos momentos compartidos; así como a mis maestros que me forjaron a lo largo de los cuatro años de licenciatura. II Resumen Se realizó un estudio de diversidad taxonómica del orden Scorpiones del estado de Sonora y de la región de El Malpaís al noreste del estado. Se realizaron búsquedas bibliográficas de registros de las especies presentes en el estado en diferentes bases de datos (Madrean Discovery Expeditions; Madrean Archipelago Biodiversity Assestment; Naturalista; Azscorpions.org y las especies que se encuentran depositadas en la colección nacional de arácnidos CNAN) y artículos que mencionen registros en el estado, con el objetivo de conocer la diversidad de especies del estado de Sonora. Para la diversidad en El Malpaís se llevaron a cabo trabajos de campo comprendidos entre los meses de agosto del 2018 a octubre del 2019. Un total de 40 especies pertenecientes a cinco familias y 15 géneros se distribuyen en el estado; una de esta nueva para la ciencia Diplocentrus leptomanus sp.nov. El estado presenta una mayor diversidad y distribución en la zona desértica y serrana. En El Malpaís se registran cinco especies, tres familias y cuatro géneros. Las especies presentan una distribución en función del sustrato encontrándose dos ecomorfotipos y dos especies endémicas. Se incluye para cada especie su diagnosis, distribución y toxicidad. Se reportan tres especies consideradas de importancia médica: Centruroides sculpturatus Ewing, 1928; C. lauriadnae PonceSaavedra y Francke ,2019; C. pallidiceps Pocock, 1902 y cuatro especies que pueden generar daños: Centruroides edwardsii Gervais, 1843; Hadrurus arizonensis Ewing,1928; H. arizonensis pallidus Williams,1970 y Smeringurus mesaensis Stahnke, 1957. La conclusión de este trabajo es que el estado de Sonora presenta una gran diversidad siendo el tercer estado más diverso en cuanto alacranes se refiere, pero son necesarios más trabajos de investigación ya que la mayoría de los registros corresponden a trabajos anteriores, por lo que son necesarios más trabajos de recolecta en el estado. En cuanto a El Malpaís presenta una alta riqueza de especies de alacranes lo que la convierte en un área de suma importancia biológica. III Abstract This is a study of the taxonomic diversity of the scorpions order in the Sonora State in its region “El Malpais” localized in the northeast area of the state. A variety of bibliographic searches of the species were conducted by different databases (Madrean Discovery Expeditions; Madrean Archipelago Biological Assessment; Naturalist; Azcorpions.org and the species that are deposited in the national collection of CNAN arachnids), as well as articles pertinent to the Sonora state records. The intent of this research is to explore more deeply about the diversity of scorpion species of the Sonora state, primarily in El Malpais region. The current action research was developed in El Malpais from August 2018 to October 2019. Sonora state has 40 species belonging to five families and 15 genera all over the state, In Sonora a greater diversity is found in the desert and the mountain area. El Malpais posses five species, three families and four genera. The distribution of the species depend on the substrate, the diagnosis, distribution and toxicity are enclosed for each species. Three species from those that were reported are considered with medical importance according to their poisonousness: Centruroides edwardsii Gervais, 1843; Hadrurus arizonensis Ewing, 1928; H. arizonensis pallidus Williams, 1970, and Smeringurus mesaensis Stahnke 1957.This descriptive research lead to the conclusion that Sonora state has a great diversity of scorpions that places Sonora in the third position with the most diversity of scorpion species in the country. Despite the fact that Sonora has a great population of scorpion species most of the information gathered is from previous records, and recent studies are scarce. Due to the dominance of scorpion species more research should be done. The high richness of scorpion species in El Malpais constitute it as a great and important biological area to develop future fauna and flora researches. IV INDICE GENERAL Contenido Págs Dedicatoria. .......................................................................................................................................... I Agradecimientos ................................................................................................................................ II Resumen ............................................................................................................................................ III I. Introducción .................................................................................................................................... 9 II. Marco teórico. ............................................................................................................................... 11 2.1. Sistemática y filogenia...................................................................................................................... 11 Tabla I. Clasificación de los escorpiones. Las familias subrayadas corresponden a las listadas en el estado de Sonora. .................................................................................................................................... 12 2.2. Morfología ......................................................................................................................................... 13 2.2.1. Integumento ................................................................................................................................... 17 2.2.2. Sistema nervioso ........................................................................................................................... 19 2.2.3. Sistema digestivo .......................................................................................................................... 20 2.2.4. Sistema circulatorio ....................................................................................................................... 22 2.2.5. Sistema respiratorio ...................................................................................................................... 24 2.2.6. Sistema reproductivo. ................................................................................................................... 25 2.2.6.1. Aparato genital del macho. .......................................................................................... 26 2.2.6.2. Aparato genital de la hembra ....................................................................................... 28 2.2.6.3. Desarrollo embrionario ................................................................................................. 29 2.2.7. Glándula de veneno. ..................................................................................................................... 29 2.2.7.1. Veneno de los escorpiones .......................................................................................... 30 2.3. Distribución, hábitat y microhábitats ............................................................................................... 31 2.4. Importancia del grupo ....................................................................................................................... 33 2.5. Diversidad de alacranes................................................................................................................... 35 2.5.1. Diversidad de alacranes en México ................................................................................ 36 2.5.2. Diversidad en Sonora...................................................................................................... 37 2.5.3. Justificación ................................................................................................................................... 38 III. Objetivos ...................................................................................................................................... 39 3.1. Objetivo general ................................................................................................................................ 39 3.2. Objetivos específicos ....................................................................................................................... 39 IV. Materiales y Métodos ................................................................................................................. 40 4.1. Área de estudio ................................................................................................................................. 40 4.1.1. Ubicación del El Malpaís ................................................................................................. 41 4.2. Metodología ...................................................................................................................................... 43 4.2.1. Materiales ........................................................................................................................ 43 4.2.2. Diversidad de especies en Sonora ................................................................................. 43 4.2.3. Diversidad de especies en el área de El Malpaís ........................................................... 43 4.2.4. Distribución de especies en el estado de Sonora ........................................................... 44 4.2.5. Distribución de especies en El Malpaís .......................................................................... 45 4.2.6. Especies de importancia médica .................................................................................... 45 V. Resultados. .................................................................................................................................. 46 5.1. Diversidad de especies en Sonora.................................................................................................. 46 5.1.1 Familia Buthidae Kock,1837 ............................................................................................ 47 5.1.2. Familia Caraboctonidae Kraepelin, 1905 ........................................................................ 50 5.1.3. Familia Diplocentridae Karsch, 1880 .............................................................................. 51 5.1.4. Familia Superstitioniidae Stahnke, 1940......................................................................... 55 5.1.5. Familia Vaejovide Thorell, 1876 ...................................................................................... 55 5. 2. Diversidad de especies en el área del malpaís. ............................................................................ 74 V 5.3. Distribución de las especies del estado de Sonora ....................................................................... 77 5.4. Distribución de las especies de El Malpaís .................................................................................... 78 5.5. Especies de importancia médica ..................................................................................................... 79 VI. Discusiones ................................................................................................................................. 80 6.1. Diversidad de alacranes en sonora ................................................................................................. 80 6.2. Diversidad de alacranes en el área de El Malpaís ......................................................................... 80 6.3. Distribución de las especies en el estado de Sonora .................................................................... 81 6.4. Distribución de las especies de El Malpaís. ................................................................................... 82 6.5. Especies de importancia médica ..................................................................................................... 83 VII. Conclusiones ............................................................................................................................. 84 7.1. Diversidad de especies en Sonora.................................................................................................. 84 7.2. Diversidad de especies en El Malpaís ............................................................................................ 85 7.3. Distribución de las especies del estado de Sonora ....................................................................... 85 7.4. Distribución de las especies de El Malpaís .................................................................................... 85 7.5. Especies de importancia médica ..................................................................................................... 85 VII.Bibliografía .................................................................................................................................. 86 VI Tabla I II III IV V VI VII VIII IV Índice de Tablas Contenido Clasificación de los escorpiones Ecomorfotipo, microhábitats y modificaciones morfológicas de los escorpiones Especies de alacranes conocidas para el mundo Especies de alacranes conocidas para México Especies de alacranes conocidos para el estado de Sonora Especies de alacranes listadas para el estado de Sonora Especies de alacranes presentes en el área de El Malpaís Ecomorfotipos de las especies presentes en El Malpaís Grado de toxicidad para los géneros y especies registrados en el estado de Sonora VII Págs. 12 32 35 36 37 46 74 78 79 Figura 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 ÍNDICE DE FIGURAS Contenido Vista dorsal de un ejemplar de Paravaejovis spinigerus Vista dorsal del caparazón o carapacho de un alacrán Vista ventral de un ejemplar de Paravaejovis spinigerus Vista ventral de un alacrán mostrando sus estructuras Diagrama de representación de la cutícula de un alacrán Sistema nervioso de un alacrán Diagrama de la anatomía general de un alacrán Diagrama del sistema vascular de un alacrán Representación del pulmón de libro de un alacrán Aparato genital de macho de Buthus sp Vista dorsal del ovario de Rhopalurus rochae Representación esquemática de las glándulas de veneno de un alacrán Mapa de ubicación del área de estudio Especies de la familia Buthidae presentes en el estado de Sonora Especies de la familia Caraboctonidae presentes en el estado de Sonora Especies de la familia Diplocentridae presentes en el estado de Sonora Especies de la familia Superstitioniidae presentes en el estado de Sonora Especies del género Chihuahuanus presentes en el estado de Sonora Especies del género Gertschius presentes en el estado de Sonora Especies del género Kochius presentes en el estado de Sonora Especies del género Paravaejovis presentes en el estado de Sonora Especies del género Paruroctonus presentes en el estado de Sonora Especies del género Pseudouroctonus presentes en el estado de Sonora Especies del género Serradigitus presentes en el estado de Sonora Especies del género Smeringurus presentes en el estado de Sonora Especies del género Stahnkeus presentes en el estado de Sonora Especies del género Uroctonites presentes en el estado de Sonora Especies del género Vaejovis presentes en el estado de Sonora Especies de alacranes presentes en el área de El Malpaís VIII Págs. 13 14 15 16 18 20 21 24 25 27 28 30 42 49 51 54 55 56 58 59 60 62 64 66 67 68 70 73 76 I. Introducción Los artrópodos son el filo más diverso de los metazoos con más de un millón de especies descritas, al menos se han descrito 750,000 especies, más de tres veces el resto de las especies animales combinadas (Rupert y Barnes,1996); se incluyen, entre otros grupos, arácnidos, hexápodos, crustáceos y miriápodos. Dentro del grupo de los arácnidos se encuentra el orden escorpiones, animales ampliamente distribuidos en la mayor parte del planeta, aunque con marcada preferencia por las regiones tropicales y templadas. Los fósiles más antiguos conocidos de alacranes se remontan al Silúrico (en torno a 440 millones de años), de tal modo que son conocidos como fósiles vivientes. Su aspecto es básicamente el mismo, resultando su morfología extraordinariamente estable (aunque no así su tamaño: algunas especies fósiles alcanzaron el tamaño de un metro) (Teruel y Melic,2015). En la actualidad se han descrito 2,475 especies de alacranes distribuidas en 19 familias (Rein, 2019; Santibañez-Lopez, et al., 2019). Mexico alberga una de las diversidades más alta de alacranes del mundo (Gonzales-Santillán, 2004; Lourenco y Sissom, 2000; Sissom y Hendrixson, 2006; Francke, 2013); se tienen registradas ocho familias, 38 géneros y 306 especies (Francke, comunicación personal, 2020), de las cuales 31 especies (distribuidas en cinco familias), se han registrado para el estado de Sonora (Ponce-Saavedra y Francke, 2019). Seis de estas especies, Diplocentrus williamsi, Serradigitus polisi, S. yaqui, Vaejovis mauryi, V. pequeño y Kochius sonorae, aparentemente son endémicas (Castrezana, 2010). El nivel de conocimiento del grupo, en Sonora y en especial en la región de El Malpaís, es incierto. El malpaís es una meseta accidentada con grietas y crestas filosas de origen volcánico basáltico con vegetación predominante del tipo matorral espinoso de pie de monte, lo que le confiere unas condiciones de hábitat únicas. El Malpaís comprende los municipios de Moctezuma, Divisaderos y Tepache. 9 Para el estado de Sonora y la región de El Malpaís, se tiene escaso conocimiento sobre el orden Scorpiones, es por ello que con el presente trabajo se busca aumentar el conocimiento actual del grupo presentándose una actualización sobre las especies presentes en el estado en base a diferentes búsquedas bibliográficas, revisión de bases de datos de MDE (Madrean Discovery Expeditions); MABA (Madrean Archipelago Biodiversity Assestment); Naturalista y los registros de especies presentes en la Colección Nacional de Arácnidos (CNAN) del Instituto de Biología de la Universidad Nacional Autónoma de México. 10 II. Marco teórico. 2.1. Sistemática y filogenia El nombre de escorpiones o alacranes se relaciona con la raíz latina scorpĭo, ōnis, y la palabra al‘aqráb en árabe (Real Academia Española, 2019). Representan los arácnidos más primitivos que existen; actualmente se les considera como uno de los grupos más antiguos entre los animales que pueblan la tierra. Los primeros escorpiones aparecieron hace más de cuatrocientos millones de años. (Bellmann y Maier,1994). El estudio sistemático de los escorpiones comenzó con Linné (1758) con el reconocimiento de cinco especies incluidas en el género Scorpio. Más adelante Krapelin (1899) elaboro una clave de identificación para todos los taxa conocidos en su época. Thorell (1876) llevo a cabo una revisión de las especies conocidas hasta la fecha; Vachon (1963,1974) estableció los caracteres para agrupar géneros y familias en función de la dentición de los quelíceros y la tricobotriotaxia de los pedipalpos; Karmenz y Prendini, (2008) establecen caracteres morfológicos de los pulmones en libro para clasificar a los alacranes. Trabajos importantes en los últimos años sobre la clasificación de los escorpiones en los cuales se incorporan elementos filogenéticos obtenidos por análisis de caracteres genéticos mediante técnicas que utilizan marcadores moleculares se destacan el de Prendini y Wheeler, (2005); Monod y Prendini, (2014) y Sharma et al., (2015). El resultado obtenido ha generado controversia en las propuestas de clasificación presentadas y a la fecha, particularmente en los niveles supragenéricos aún no hay un consenso al respecto. Como producto de estos trabajos y las modificaciones más recientes (Santibañez-Lopez et al., 2019) se listan 19 familias pertenecientes al orden Scorpiones. 11 Tabla I. Clasificación de los escorpiones. Las familias subrayadas corresponden a las listadas en el estado de Sonora. Orden Scorpiones Koch 1837 Suborden Neoscorpionina Thorell y Lindström 1885 Infraorden Orthosterni Pocock 1911 Parvorden Buthida Soleglad & Fet 2003 Superfamilia Buthoidea Koch 1837 Familia Buthidae Koch 1837 Superfamilia Chaeriloidea Pocock 1893 Familia Chaerilidae Pocock 1893 Superfamilia Pseudochactoidea Gromov 1998 Familia Pseudochactidae Gromov 1998 Parvorden Iurida Soleglad y Fet 2003 Superfamilia Bothriuroidea Simon 1880 Familia Bothriuridae Simon 1880 Superfamilia Chactoidea Pocock 1893 Familia Chactidae Pocock 1893 Familia Euscorpiidae Laurie 1896 Familia Scorpiopidae Kraepelin 1905 Superfamilia Iuroidea Thorell 1876 Familia Iuridae Thorell 1876 Superfamilia Superstitionoidea Stahnke 1940 Familia Superstitioniidae Stahnke 1940 Superfamilia Scorpionoidea Latreille1802 Familia Diplocentridae Karsch 1880 Familia Hemiscorpiidae Pocock 1893 Familia Hormuridae Laurie 1896 Familia Scorpionidae Latreille 1802 Familia Urodacidae Pocock 1893 Superfamilia Vaejovoidea Thorell 1876 Familia Vaejovidae Thorell 1876 Subfamilia Smeringurinae Soleglad & Fet 2008 Subfamilia Syntropinae Kraepelin 1905 Subfamilia Vaejovinae Thorell 1876 Subfamilia Stahnkeninae Soleglad & Fet 2008 Familia Caraboctonidae Kraepelin 1905 Familia Heteroscorpionidae Kraepelin 1905 Familia Troglotayoscidae Lourenço 1998 Familia Typhlochactidae Mitchell 1971 Subfamilia Uroctoninae Mello-Leitao 1934 Modificado de: Santibañez-Lopez et al., 2019 12 2.2. Morfología Los ejemplares de este grupo se caracterizan por poseer el cuerpo dividido en dos segmentos o tagmas (figura 1), el prosoma y el opistosoma, a su vez el opistosoma se divide en dos secciones mesosoma y metasoma. En esta última porción se encuentra el telson, órgano que contiene las glándulas que producen el veneno. El color suele ser de amarillo o pardo hasta negro, salvo excepciones, como algunas especies cavernícolas y humícolas totalmente despigmentadas. El prosoma está comprendido por la cabeza, los quelíceros, un par de pinzas (pedipalpos) y los cuatro pares de patas. El opistosoma abarca el abdomen cuya porción final tiene apariencia de cola articulada cuyo último segmento, llamado telson, termina en un aguijón o aculeus (aparato inoculador del veneno). Éste tiene como función paralizar a sus presas, cumpliendo también una función defensiva. Las pinzas o quelas presentes en la parte anterior del alacrán son utilizadas para defensa, cavar cuevas, cazar y sujetar a sus presas o al momento del cortejo (Stockmann,2013). Figura 1. Vista dorsal de un ejemplar de Paravaejovis spinigerus 13 El prosoma presenta dorsalmente el carapacho, el cual es una pieza bien quitinizada que lleva los ojos medios y laterales. Es habitual la presencia de granulaciones y quillas o carenas (figura 2). En su parte ventral (figura 3) aparecen las coxas de los apéndices y una pequeña placa esternal o esternón situada entre los dos últimos pares de patas; debido a su forma variada (pentagonal, triangular o transversal), el esternón se ha considerado un importante carácter taxonómico en el nivel de clasificación familiar. Figura 2. Vista dorsal del caparazón o carapacho de un alacrán. Existen seis pares de apéndices: quelíceros, pedipalpos y cuatro pares de patas locomotoras (figura 3). Los quelíceros, de tamaño habitualmente modesto, están formados por tres artejos, terminados en una pinza que tiene la función de sujetar y desgarrar a las presas (formada por el dedo fijo o mano y el dedo móvil). Los dedos presentan rugosidades y sedas sensoriales, además de, internamente, potentes dientes, todo lo cual es utilizado en sistemática del grupo. Los pedipalpos son una de las características más destacables del animal por su gran tamaño y tienen una doble función, tanto prensil como sensorial, en estos se encuentran las tricobotrias, estructuras sensoriales específicas que se encuentran solo en el fémur, la patela, la mano y los dedos fijos y móviles de las quelas. son setas sensoriales, con mayor frecuencia largas y filiformes (Stockmann et al., 2010). 14 Los pedipalpos están formados por seis artejos: coxa, trocánter, fémur, patela, tibia (que está engrosada) y tarso (dedo movible), los dos últimos de los cuales forman la característica pinza o quela de los escorpiones. Las patas locomotoras están formadas por siete artejos: coxa, trocánter, fémur, patela, tibia, basitarso y telotarso. Su longitud aumenta del primer al cuarto par. Figura 3. Vista ventral de un ejemplar de Paravaejovis spinigerus mostrando los diferentes apéndices. El opistosoma (mesosoma y metasoma) presenta estructuras importantes; el mesosoma visto ventralmente presenta en su primer segmento la abertura genital, que está cubierta por un opérculo genital formado por dos placas situadas entre el esternón y la placa basal pectinal (segundo segmento), de la que parten los peines, órganos sensoriales que son exclusivos de los escorpiones y están formados por tres series longitudinales de láminas, laminillas o lamelas: las dorsales, las medias y articulados a éstas, los dientes, los cuales suelen estar separados en su base por una serie de piezas redondeadas a triangulares denominadas fulcras (ausentes en varios géneros o incluso en familias enteras). 15 Los peines (figura 4), varían según la especie y el sexo, tanto en la cantidad de dientes y láminas como en su forma y tamaño, por lo que ofrecen excelentes caracteres diagnósticos. Los peines son estructuras sensoriales en forma de peine, cada uno de estos peines está formado desde 3 a 40 dientes pectinales dependiendo de la especie, cada diente posee de cientos a miles de células dendríticas sensoriales las cuales proporcionan un medio para que los escorpiones sigan las señales químicas y probablemente brinde información al escorpión sobre si se está acercando o alejándose de su presa (Cowles, 2018), asi como la textura del substrato donde se encuentran. Figura 4. Vista ventral de un alacrán mostrando sus estructuras. En los segmentos III–VI aparecen los estigmas respiratorios o espiráculos, los cuales representan las aberturas al exterior de los pulmones en libro y funcionan como "escotillas", que el escorpión abre y cierra a voluntad. El metasoma o cola es otro de los rasgos característicos de los escorpiones. Está compuesto por cinco segmentos prismáticos a cilíndricos y termina en el telson, que contiene dos glándulas de veneno y el aguijón inoculador (Teruel y Melic, 2015). 16 2.2.1. Integumento El integumento o cutícula se refiere a la estructura de múltiples capas sobre la epidermis que recubre a los escorpiones, a estos como en los artrópodos terrestres, los provee de una cobertura de protección para los órganos internos y tejidos, además ayuda a reducir la perdida de agua, particularmente en las especies de hábitats áridos, es un punto de anclaje para los músculos, haciendo posible la locomoción y otros movimientos; y a través de su apertura respiratoria y estructuras sensoriales, es la conexión primaria del organismo con su entorno (Ribera et al, 2015). La cutícula es segregada por las células epidérmicas, colectivamente por la base de la membrana celular, la cuticular también es llamada por varios autores como integumento. La primera subdivisión de la cutícula está en una zona delgada externa a menudo con varias capas distintas, denominadas epicutícula y una región interna más gruesa, la procutícula, también frecuentemente subdividida. Por convención, la epicutícula se distingue como una zona externa que no contiene quitina; contrario a la procutícula que si contiene quitina (Nentwing,1987). La quitina (Poli-N -acetilglucosamina) es la molécula característica de la cutícula y puede ocupar el 50% del peso seco de la cutícula. La cutícula de los escorpiones está formada por cuatro capas: la epicutícula, por la exocutícula hialina, la exocutícula interna y la endocutícula. Epicuticula: La epicutícula se divide en cuatro capas: la membrana externa, una epicutícula externa, la cuticulina y una capa homogénea densa; su grosor total es de aproximadamente 0.3 µm, la capa más externa es una membrana delgada densa en electrones con un promedio de aproximadamente 3 nm, pero de espesor bastante irregular. Esta membrana no siempre parece seguir de cerca el contorno de la superficie de la cutícula, de modo que la siguiente capa más interna, la epicutícula externa, que es completamente luminosa de electrones, también parece variar en grosor. Debajo de la epicuticula externa se encuentra la cuticulina de aproximadamente 5 nm de grosor la cual es extremadamente densa en electrones. La densa capa homogénea que se encuentra debajo de la cuticulina constituye la mayor parte del grosor de la epicutícula (Filshie y Hadley, 1979). 17 Exocutícula hialina: De aproximadamente 7,5 μm de grosor, es el componente más fibroso externo de la cutícula. y consta de dos subcapas: la capa externa, de aproximadamente 2 μm de espesor, es laminar, con aproximadamente 20 láminas de diferente espesor (Hjelle,1990). La capa interna, aproximadamente 5,5 μm y no laminada, corresponde a la mesocutícula mencionada por Dennell (1975). Dentro de la exocutícula hialina resalta la presencia de la β-carbolina y 7-hidroxi4-metilcumarina que permite la fluorescencia de los escorpiones debido a estos compuestos químicos (Stachel et al.,1999). La falta de una explicación concreta sobre el porqué o para qué de este suceso, ha generado varias hipótesis entre los científicos. Entre una de las teorías del para qué, está la explicación de que su brillo es para atraer a sus presas, para advertir a los depredadores de su peligrosidad, como método de reconocimiento entre individuos, para encontrar escondites oscuros gracias a un juego de sombras con su cuerpo, y otras declaraciones más extrañas indican que es un mecanismo que responde a la luz de la luna (Wankhede, 2004). Exocutícula interna: Es la capa más interna de la exocutícula. Tiene aproximadamente 5 μm de grosor y es claramente laminada, siendo las láminas de un promedio de 0.2 μm. Endocutícula: Constituye la mayor parte de la cutícula, con un grosor total de 65-85 μm. Las tres o cuatro primeras láminas (las más externas) son uniformes y de aproximadamente 5,5 μm. Las siguientes laminillas son casi dos veces más gruesas, pero las láminas sucesivas se vuelven progresivamente más delgadas, hasta que las más internas miden aproximadamente 1 μm. Las laminillas son claramente definidas, y una membrana separa la exocutícula interna de la endocutícula (Hjelle,1990). Figura 5. Diagrama de representación de la cutícula de un alacrán (Modificado de Polis 1990): 1, epicuticula; 2, exocutícula (exocutícula hialina y mesocutícula); 3, exocutícula interna; 4 membrana externa de la endocutícula 5, capas internas de la endocutícula 6, epidermis; 7, canales de poros. 18 2.2.2. Sistema nervioso Como uno de los primeros artrópodos terrestres, los escorpiones han conservado una antigua organización del sistema nervioso, es funcionalmente capaz de integrar sentidos altamente sofisticados y producir movimientos maravillosamente coordinados en la locomoción, construcción de madrigueras y ataque a las presas. En comparación con otros invertebrados, los arácnidos generalmente tienen sistemas nerviosos altamente cefalizados que representan la fusión de muchos ganglios segmentarios (Root,1990). Sin embargo, en los escorpiones, además de una gran masa de tejido nervioso en la región cefalotorácica (prosoma), también se encuentra un largo cordón nervioso ventral con ganglios segmentarios. Esto contrasta con el altamente cefalizado sistema nervioso de las arañas, por ejemplo, y probablemente representa la condición primitiva. Los escorpiones también están equipados con órganos sensoriales inusuales, como las células nerviosas fotosensibles en la cola, un sistema de detección de presas sensible a la distancia y a la dirección en las patas y un par de pectinas, apéndices exclusivos de los escorpiones, que pueden tener una variedad de funciones, incluida la selección de la textura del sustrato; tienen forma de peine y, de esta manera, recuerdan a las antenas observadas en muchos hexápodos y crustáceos (Wolf, 2017). El sistema nervioso central de los escorpiones está formado por el cerebro (figura 6) (masa ganglionar supraesofágica, ganglio cerebral dorsal, masa nerviosa cerebral, protocerebro y tritocerebro); el ganglio subesofágico (masa del nervio torácico), que está conectado al cerebro por un par de comisuras circumesofágicas gruesas; tres ganglios mesosómicos libres; cuatro ganglios metasomales libres; presenta nervios inervados en las fibras de los músculos que se unen a un ganglio ventral central (Stockmann et al. 2010). El cerebro está unido al par de ojos compuestos localizados en el prosoma. 19 Figura 6. Sistema nervioso de un alacrán (Modificado Stockmann, 2010) C+GS: Cerebro y masa ganglionar supraesofágica; NP: nervio de las patas; CN: conexiones nerviosas; GM 1- GM3: ganglios mesosomicos libres; GM4-GM7: ganglios metasomales libres. 2.2.3. Sistema digestivo Una vez que el alacrán detecta a su presa, esta es atrapada por los pedipalpos, cubiertos, a lo largo de toda la longitud de los dedos, con filas de dentículos que evitan que la presa escape. El alacrán puede o no usar la picadura para paralizar a su presa. Una vez atrapada la presa es llevada a los quelíceros, que la trituran en una especie de pulpa masticada en la cavidad prebucal formada dorsalmente por los quelíceros, lateralmente por la base de los pedipalpos y las coxas del primer par de patas que presentan una proyección llamada gnatobase o coxapófisis, que tiene como función triturar y exprimir el alimento (Teruel y Melic, 2015). Las coxapófisis están equipadas con glándulas que se abren al exterior a través de los poros y están cubiertas con miles de espinas de púas, en las que la saliva se mezcla con la pulpa para la predigestión. El rostrum o epistoma también está cubierto de pelos y ocupa la parte posterior de esta cavidad. La pulpa fluye por los canales en las coxapófisis a una boca ventral minúscula. De esta manera, solo los líquidos y partículas muy finas ingresan a la boca y son transportados a la faringe, cuyas paredes están cubiertas por poderosos músculos fijados a los pliegues cuticulares internos, los apodemas (Farley, 2001). 20 La digestión tiene lugar en los divertículos digestivos (figura 7) (hepatopáncreas o glándula digestiva) que ocupan la mayor parte del mesosoma. Estas estructuras contienen células que segregan enzimas para fines de digestión externa y células responsables de la absorción de nutrientes. Los productos de desecho de la digestión, esencialmente paquetes de guanina, se encuentran en un íleon rectilíneo y son responsables de la mayor parte de la excreción de nitrógeno del animal. El agua se reabsorbe en el íleon (Hjelle,1990). En el extremo anterior del íleon, el tracto digestivo está unido por túbulos de Malpighi finos y ramificados, que desempeñan un papel menor en la osmorregulación, principalmente mediada por dos glándulas coxales ubicadas en el prosoma (Stockmann, 2013). Las heces se excretan por un intestino posterior corto, que termina en el ano, que se encuentra en el medio de cuatro válvulas anales ubicadas anterior al telson. El hepatopáncreas juega un papel importante en la fisiología del escorpión. Almacena agua y lípidos y también es el sitio de producción de enzimas y hemocianina, el pigmento a base de cobre responsable del transporte de oxígeno en la hemolinfa (Stockmann, 2013). Figura 7. Diagrama de la anatomía general de un alacrán: Negro, sistema nervioso; amarilló sistema digestivo; verde, sistema reproductivo. (Modificado de Stockmann, 2013). 21 2.2.4. Sistema circulatorio El sistema circulatorio de los escorpiones es semiabierto, lo que significa que hay una gran cavidad sanguínea, el hemoceloma, pero parte de la sangre está encerrada (Stockmann, et al., 2010). El sistema vascular de hemolinfa de los alacranes (figura 8) comprende un corazón de bombeo central que se extiende por todo el mesosoma y está encerrado en un pericardio (Hjelle,1990). Varias arterias se ramifican desde el corazón para suministrar diferentes órganos y regiones del cuerpo. Ocho pares de arterias cardíacas segmentarias emanan del corazón. Las arterias cardíacas salen del corazón en una posición ventrolateral directamente ventral a los ostiolos. El primer par de arterias cardíacas emana poco después de la transición del corazón hacia la aorta anterior. Las arterias cardíacas presentan un patrón de ramificación fina e irrigan los órganos y tejidos en el mesosoma. La transición del corazón a la aorta anterior ocurre en un punto donde el vaso dorsal pasa el diafragma. Anterior a este punto, la aorta desciende oblicuamente hacia el esófago delgado. La aorta se divide en dos grandes troncos que se extienden lateralmente alrededor del esófago. Seis pares de vasos principales se separan de la aorta antes de fusionarse con el vaso ventral. Estas son las arterias quelicerales, las arterias pedipalpales y las arterias de los cuatro pares de patas para caminar (arterias de las patas). Las arterias quelicerales forman un arco lateral alrededor del ganglio supraesofágico (cerebro) y continúan dorsalmente hacia los quelíceros. Dos ramas se separan de las ramas principales anterolaterales al cerebro (Stockmann et al., 2010). Una de ellas continúa hasta los ojos medios, mientras que la otra irriga los músculos del prosoma posterior. Varios vasos pequeños, que suministran musculatura y tejidos en el prosoma, emanan de estas arterias. Las arterias quelicerales se bifurcan para suministrar la musculatura queliceral. Las arterias pedipalpales son los vasos más grandes que se ramifican desde la aorta en la curva de los troncos de la aorta. 22 Estas arterias se extienden lateralmente alrededor de las comisuras esofágicas y dentro de los pedipalpos cerca de los nervios pedipalpales (Stockmann et al., 2010). Las arterias de las patas se extienden directamente hacia las patas correspondientes desde su origen en los troncos aórticos. En el camino, estas arterias producen varios vasos pequeños que irrigan los tejidos circundantes (principalmente la musculatura). Las arterias del primer par de patas emanan casi del mismo punto que las arterias pedipalpales, o se separan un poco a lo largo de ellas, de modo que ambas poseen un tronco común (Wirkner y Prendini, 2007). La hemolinfa de los escorpiones es de color azul, este color se produce por la presencia de la hemocianina, proteína presente en diversos ordenes de artrópodos y moluscos. El color azul se debe a la presencia de un hueso de cobre en la molécula; esta molécula está encargada del transporte del oxígeno (Goyffon, 2010). Su función es equivalente a la que la hemoglobina realiza en la sangre de otros animales y de los seres humanos, aunque el transporte de oxígeno no es tan eficiente. La hemocianina es cuantitativamente el principal componente sanguíneo, representa alrededor del 90% de las proteínas disueltas, sin embargo, la hemolinfa contiene otras moléculas de las que se destacan: • Carbohidratos: El principal carbohidrato en la hemolinfa de los insectos y el 90% de todos los artrópodos es trehalosa formada por dos moléculas de glucosa. • Aminoácidos solubles: Componentes del ciclo de la urea (citrulina y ornitina), presencia de taurina, prolina, acido glutámico entre otros. • Defensinas, péptidos antibacteriales de los artrópodos. son péptidos catiónicos no glicosilados que comprenden alrededor de 30 a 40 residuos de aminoácidos y una masa molar entre 3 y 4 kDa. 23 Figura 8. Diagrama del sistema vascular de un alacrán. (Modificado de Wikner et al., 2007), ao: aorta; ca: arteria cardiaca; ch: arteria de los quelíceros; he: corazón; IIV: arterias de las patas; oa arteria de los ojos; os: ostiolo; pa: aorta posterior; pp: arteria de los pedipalpos; tgl: arteria transglanglionar; vv: vaso ventral 2.2.5. Sistema respiratorio El sistema respiratorio consta de cuatro pares de órganos respiratorios, llamados pulmones de libro (figura 6). Se abren a la superficie a través de aberturas llamadas espiráculos (Hjelle,1990). Los pulmones del libro del escorpión se presentan en pares en el lado ventral del cuarto al séptimo segmento del mesosoma y se abren a través de espiráculos estrechos (o estigmas) a mitad de camino a lo largo de los esternitos. Cada espiráculo conduce a una aurícula con una superficie interna doblada que, en su mayor parte, está cubierta por pequeñas proyecciones cutáneas (Kamenz et al., 2005). Cada pulmón de libro consta de una pila de láminas foliares situado encima del esternito ventral. Las láminas son una doble capa de cutícula que está inundada por hemolinfa y rodeada de aire. Las capas adyacentes de cutícula que rodean el aire entre las laminillas son similares a las de los arácnidos terrestres y, por lo tanto, se llaman sacos aéreos. Los sacos aéreos se mantienen en su lugar mediante ligamentos en forma de banda de una capa suprayacente de tejido conectivo en el espacio hemolinfa, llamada fenestrada. 24 El intercambio gaseoso se da a través de los espiráculos; el aire fluye a través del espiráculo hacia la aurícula del pulmón del libro y desde allí hacia los sacos de aire entre las láminas, donde está separado de la hemolinfa solo por una sola capa de epidermis y cutícula. La hemolinfa fluye a través de las láminas desde el seno de hemolinfa ventral al seno neumocárdico lateral recibiendo oxígeno y liberando dióxido de carbono a lo largo del camino. La hemolinfa oxigenada se transporta dorsalmente al corazón y luego se distribuye por todo el cuerpo (Kamenz y Prendini, 2008). Figura 9. Representación del pulmón de libro de un alacrán, mostrando las estructuras en tres dimensiones (Modificado de Kamenz y Prendini, 2008). 2.2.6. Sistema reproductivo. La mayoría de las especies de alacranes tiene individuos machos y hembras y se reproducen sexualmente, sin embargo, en Liocheles australisiae Fabricius, 1775 y varias especies de la familia Buthidae se reproducen a través de la partenogénesis, un proceso mediante el cual los óvulos no fertilizados se convierten en embriones vivos. La reproducción en los escorpiones es indirecta; la intromisión ocurre a través de un espermatóforo. Los escorpiones poseen un complejo ritual de cortejo y apareamiento para efectuar la transferencia de un espermatóforo de macho a hembra (Hjelle,1990). 25 Los escorpiones machos localizan e identifican hembras de la misma especie usando una combinación de feromonas, comunicación vibratoria y contacto físico. El cortejo aborta a menos que cada uno haya satisfecho al otro de que son la especie correcta y el sexo opuesto. El cortejo comienza con una "danza" conocida como el paseo “paseo a dos”, donde el macho agarra los pedipalpos de la hembra con los suyos y la guía mientras busca un lugar para depositar su espermatóforo (Prendini, 2012). Dependiendo de la especie, el ritual de cortejo puede involucrar otros comportamientos como un "beso" queliceral, donde el macho agarra los quelíceros de la hembra con los suyos; temblor, un movimiento de balanceo hacia adelante y hacia atrás; y una "picadura sexual", donde el macho inyecta una pequeña cantidad de veneno en la hembra, probablemente como un medio de pacificación (Stockmann et al., 2010). Cuando el macho ha identificado un sustrato adecuado, deposita el espermatóforo, que se adhiere con un adhesivo "pie", guía a la hembra sobre el espermatóforo hasta que ingresa en su abertura genital. El espermatóforo específico de la especie catapulta la masa de esperma en el gonoporo femenino cuando se toca una palanca o gatillo (un mecanismo de cerradura y llave). La fertilización es interna (Prendini, 2012). 2.2.6.1. Aparato genital del macho. Los órganos masculinos consisten en testículos pareados (Figura 10), cada uno de los cuales está formado por cuatro túbulos longitudinales (troncos) unidos por cuatro túbulos transversales (trabéculas, anastomosis), formando así una red reticular de seis células (Hjelle, 1990). Los testículos de los escorpiones son tubos blancos, localizados en el mesosoma y se encuentran rodeados por la glándula digestiva. Hacia la parte anterior de estos se encuentran los órganos paraxiales entre un canal más delgado, los conductos espermáticos. Este conducto corre dentro del complejo de glándulas localizadas en el centro de cada órgano paraxial. 26 Cada órgano paraxial es por si solo una glándula, la cual conduce a un área común, la aurícula (cámara genital), donde la abertura genital se abre ventralmente entre las válvulas del opérculo genital. La superficie interna de las válvulas soporta las papilas genitales, visibles directamente o levantando las válvulas del opérculo. Una pequeña glándula en forma de botella se abre en cada válvula. Los órganos paraxiales están localizados en los lados del mesosoma y cubren al hemispermatóforo con sus superficies internas. Cada hemispermatóforo consiste de una base, un troco y un flagelo (en Buthidae) o una lámina en (en las otras familias) (Stockmann et al., 2010). Figura 10. Aparato genital de macho de Buthus sp (Modificado de Stockmann et al, 2010) Pg: papila genital;Ag: aurícula genital; Ga: glándulas accesorias; Vs1: vesícula seminal; Cd: conducto deferente; Vs2: Vesícula seminal; Gc: glándula cilíndrica; Op: órgano paraxial (con el hemispermatóforo adentro); F: flagelo; At: testículo; C: célula. 27 2.2.6.2. Aparato genital de la hembra Los órganos genitales femeninos también son tubulares (figura 11) y están organizados en forma de escalera que consta de tres o cuatro tubos longitudinales y de dos a cuatro ramas transversales, delimitando espacios llamados células. En la familia Buthidae generalmente tienen cinco pares de anastomosis (uniones entre estructuras) transversales que delimitan ocho células laterales, excepto en Tityus y Microtityus donde solo hay dos células laterales y en los pocos géneros donde las barras longitudinales se duplican y forman nueve células (Hjelle, 1990). Las otras familias tienen cuatro pares de anastomosis que constituyen seis células. Estos tubos forman un ovariutero, porque son simultáneamente el sitio de formación de las células sexuales femeninas (los ovocitos) y del desarrollo de los embriones (en el útero) hasta el nacimiento de las crías. Los tubos terminan en dos oviductos que a menudo se amplían al final en dos espermatecas que conducen a cada lado a una estructura común, la aurícula en salida ventral por la abertura genital entre las válvulas del opérculo genital. La espermateca puede ser lateral. Las espermatecas están ausentes de la mayoría de las especies de la familia Buthidae. Los tubos del ovario pueden contener numerosas excrecencias globulares correspondientes a embriones en desarrollo (Stockmann et al., 2010). Figura 11. Vista dorsal del ovario de Rhopalurus rochae: Cg, cámara genital; Tlo, trompa ovárica longitudinal; Fo, folículo ovárico; Ov, oviducto; Rs, receptáculo seminal; Tot, tubo ovárico transversal. (Modificado de Matthiesen 1970 y Polis, 1990). 28 2.2.6.3. Desarrollo embrionario Los escorpiones pueden ser divididos en dos grupos basado en la anatomía del sistema reproductivo femenino y el tipo de desarrollo embrionario (Francke, 1981). El desarrollo katoikogénico, donde los embriones se desarrollan en los divertículos del ovariutero y obtienen nutrición a través de conexiones especializadas con el intestino digestivo, está restringido a la superfamilia Scorpionoidea. El desarrollo apoikogénico, donde los embriones se desarrollan en el interior del ovariutero (considerado primitivo), es exhibido por todas las demás familias de escorpiones (Prendini, 2012). En el ovario de los escorpiones apoikogénicos, los ovocitos en crecimiento sobresalen de la pared ováriuterina y continúan el crecimiento previtelogénico y vitelogénico en la superficie de la gónada, acompañados por las células foliculares que cubren la superficie del ovocito y las células del tallo que se unen al ovocito con la pared ováriuterina. En el ovariutero katoikogénico, los ovocitos crecen en los alrededores de la pared ováriuterina llamados divertículos (Jedrzejowska et al., 2016). 2.2.7. Glándula de veneno. El veneno de los escorpiones es producido en dos glándulas simétricas localizadas a cada lado de la línea media de la vesícula del telson (Stockmann et al., 2010). Cada glándula se evierte mesal y dorsalmente con músculos compresores que presionan la glándula contra la cutícula a lo largo de sus superficies laterales y ventrales exteriores. Las glándulas están separadas por un tabique muscular vertical mediano. Cada glándula está provista de un conducto de salida, y estos se comunican con el exterior a través de aberturas muy próximas justo antes de la punta del aguijón. Cada glándula está cubierta por una membrana basal, dentro de la cual hay una capa de tejido conectivo; entre el tejido conectivo y el interior hay una sola capa de epitelio secretor glandular (Mazurkiewicz y Bertke, 1972). 29 Figura 12. Representación esquemática de las glándulas de veneno de un alacrán: Mc, músculos compresores; Cu, cutícula; Gv, glándula de veneno. (Modificado Polis, 1990). 2.2.7.1. Veneno de los escorpiones Todos los escorpiones son venenosos, pero menos del 2% son de importancia médica. Los escorpiones usan al veneno para paralizar a sus presas cuando el tamaño de estas lo requiere y eventualmente para defenderse de predadores o agresores. Contienen una variedad de compuestos biológicamente activos como enzimas, nucleótidos, lípidos, mucoproteínas, aminas biogénicas y péptidos, tóxicos para muchos organismos como insectos, arácnidos e incluso mamíferos, incluyendo al hombre. El veneno es una mezcla compuesta por gran cantidad de péptidos básicos (Stockmann et al., 2010). La característica más singular del veneno de escorpiones es que su letalidad radica en la presencia de toxinas dirigidas a sitios específicos modificando así el comportamiento de los mecanismos de selección iónica imprescindibles para la fisiología celular (de Roodt, 2015). De las 80 toxinas diferentes apenas unas 10 actúan sobre nuestro organismo y pueden ocasionar la muerte (Camacho-Ibarra et al., 2004). 30 Todas estas toxinas producen una perturbación severa de los procesos de excitación y conducción del impulso nervioso, además de alterar los procesos neuroquímicos al inducir liberación desorganizada de neurotransmisores como la acetilcolina, adrenalina y óxido nítrico (Camacho-Ibarra et al., 2004). Las toxinas de escorpiones afectan la permeabilidad a iones de células excitables y se han descripto cuatro diferentes familias de toxinas que interactúan con los canales iónicos: neurotoxinas moduladoras de canales de Na+, neurotoxinas bloqueadoras de canales de K+, neurotoxinas para canales de Cl- y neurotoxinas para canales de Ca2+. Las más estudiadas hasta el presente son las que actúan sobre los canales de Na+ y los de K (Possani et al., 2000). Una vez que el alacrán usa su veneno para matar a su presa, requiere tres semanas para reponerlo, tiempo en el cual no tendrá suficiente veneno para inyectarle a una persona. Ésta es la razón por la que existen individuos que han corrido con la suerte de haber sido picados y no haber presentado síntomas de envenenamiento. 2.3. Distribución, hábitat y microhábitats Los alacranes se distribuyen ampliamente en todas las regiones faunísticas del planeta; la diversidad de alacranes es mayor en áreas subtropicales (23-38 ° de latitud), disminuyendo hacia los polos y el ecuador. En contraste con muchos (pero no todos) grupos de animales que son más diversos en los trópicos, las comunidades más diversas de escorpiones se encuentran en áreas desérticas (Hibner, 1971); sin embargo, a nivel específico pueden presentar patrones de distribución espacial claramente influenciados por las preferencias de microhábitat. Es posible encontrarlos desde profundidades mayores de 800 metros bajo el nivel de la entrada a cuevas (Alacran tartarus Francke, 1982) hasta los 4.910 m, con una mayor diversidad de especies entre los 0 y 2.000 m (Polis, 1990; Ochoa et al., 2011). Varias especies se encuentran exclusivamente en cuevas (troglobios); y otros se pueden encontrar tanto en cuevas como en otros hábitats favorables (Lourenço y Francke, 1985). 31 Los troglofilos a menudo ocurren cerca de la entrada a la cueva, mientras que los troglobios viven en la zona obscura de muchos sistemas de cuevas. Existen especies que son generalistas, con amplia distribución geográfica y capaces de aprovechar un gran número de biotopos, mientras que otras se encuentran exclusivamente en ciertas vegetaciones y microhábitats, por lo que resultan ser organismos promisorios como indicadores ecológicos y en estudios biogeográficos Polis 1990; Lourenço 1997). Los escorpiones no se distribuyen al azar dentro de un hábitat, sino principalmente en microhábitats específicos, en los cuales encuentran condiciones ambientales propicias para su desarrollo; algunos se han especializado para subsistir en ciertos substratos, como dunas de arena, resultando en adaptaciones ecomorfotipicas. Prendini (2001) definió al substrato como el medio sobre en el que los animales viven, el cual constituye su refugio de las inclemencias del clima y la depredación, además de que es el lugar donde localizan su alimento y pareja (tabla II). Abajo esta definición de substrato, la tabla II muestra los microhábitats, ecomorfotipos y modificaciones morfológicas de los escorpiones. Tabla II. Ecomorfotipo, microhábitats y modificaciones morfológicas de los escorpiones Ecomorfotipo Microhábitat Litófilo Grietas de rocas grandes Psamófilo Zonas arenosas Pelófilo Galerías construidas en suelos compactos Modificaciones morfológicas Depresión dorsoventral del cuerpo, metasoma y pedipalpos comprimidos, uñas del telotarso curvas. Tarso y tibia con macrosedas elongadas (peines para arena) y uñas muy elongadas. Quelíceros elongados, quelas del pedipalpo robustas y apéndices locomotores cortos, robustos y con sedas espiniformes gruesas en los telotarsos. Galerías superficiales u Pedipalpos y/o metasoma robustos. oquedades bajo rocas. Bajo o dentro de objetos Errante Sin modificaciones. que estén en el substrato Dentro de cuevas y bajo Disminución del pigmento y atenuación de los Troglobio hojarasca densa apéndices. En el dosel de los árboles Depresión dorsoventral del cuerpo y elongación Arborícola o dentro de plantas de las uñas del telotarso. epifitas Modificado de: Polis,1990; Prendini, 2001; Gonzales-Santillán, 2001; Gonzales-Santillán, 2004. Lapidícola 32 2.4. Importancia del grupo Los escorpiones disfrutan de un atractivo público generalizado (en gran parte basado en el miedo). Su toxicidad, su tamaño relativamente grande y su temible apariencia, a pesar de la gran edad de su linaje, contribuyen a una fascinación que siempre los ha rodeado; los escorpiones han influido en la imaginación de los pueblos de Oriente y del Mediterráneo desde los primeros tiempos. Por ejemplo, según la leyenda Persia, cuando Mitra, el dios persa de la luz, sacrificó el toro sagrado cuya sangre era para fertilizar el universo, el espíritu maligno Ahriman envió un escorpión para destruir la fuente de la vida atacando los testículos del animal (Cumont 1896-99; cf. Vermaseren 1978). Los escorpiones, como agentes del Diablo, son prominentes en los monumentos a Mitra, cuyo culto era muy popular en los ejércitos romanos, persistiendo en casi cualquier lugar donde habían estado estacionados hasta el siglo V d. C., especialmente en el norte de África y Alemania. En el antiguo Egipto, los escorpiones se representaban con frecuencia en tumbas y monumentos. Se mencionan en el papiro de Ebers ("Cómo deshacerse de la casa de los escorpiones") y en varios pasajes del Libro de los Muertos. El Talmud y la Biblia también se refieren a los escorpiones como animales repugnantes y formidables. Según la mitología griega, el gran cazador Orión, hijo de Zeus, fue asesinado por un escorpión que la diosa Artemisa produjo cuando la desafió (Cloudsley,1990). Actualmente su importancia en la sociedad está marcada principalmente por el problema de salud que algunas especies representan. Todos los alacranes tienen en el metasoma, comúnmente llamada cola, un aguijón conectado a las glándulas de veneno y por ende todos los alacranes son de importancia médica; sin embargo, menos del 2 % de las 2,466 especies conocidas se consideran de importancia para la salud pública (Rein, 2019). En México de las 306 especies de alacranes registradas, la familia Buthidae es la única con especies consideradas de importancia para la salud pública. 33 Esta familia en México está representada por dos géneros: Centruroides y Chaneke Francke et al.,2014. De estos dos géneros, Chaneke está representado por cuatro especies, ninguna de ellas con importancia para la salud pública; mientras que Centruroides tiene 44 especies de las cuales 19 son consideradas en la categoría de importancia para la salud pública (Ponce- Saavedra et al., 2016). Por otro lado, el veneno de algunas especies posee propiedades antibacteriales que podrían utilizarse para combatir enfermedades como la malaria (Catterall, 1976; Conde et al., 2000) y otros investigadores afirman que el veneno del alacrán puede ser utilizado para combatir enfermedades autoinmunes como la diabetes o el lupus (Possani, 2017 en prensa), incluso en algunos lugares es utilizado como tratamiento para el cáncer. En cuanto a su importancia ecológica, los escorpiones poseen un papel fundamental como controladores de las poblaciones de insectos de los cuales se alimentan. Debido a que son uno de los artrópodos con mayor biomasa por hectárea, solamente por debajo de las hormigas y termitas, han llegado a ser uno de los mayores y más eficientes controladores biológicos de estos organismos, obteniendo una gran importancia en los ecosistemas donde se desarrollen, especialmente en aquellos donde los insectos podrían convertirse en una plaga (Polis, 1990; Ponce-Saavedra et al., 2006; Ponce-Saavedra y Francke, 2013; Ramírez- Arce, 2015); además fungen como fuente de alimentación para otras especies incluso para el Humano los cuales son consumidos en el Sureste de Asia y África (Stockmann et al., 2010), pero su consumo se está volviendo habitual en otras partes del Mundo. Como especies con selección tipo K (de equilibrio), y que comprenden un grupo importante de artrópodos depredadores en ecosistemas áridos, los escorpiones son bioindicadores valiosos. Su desaparición señala la degradación del hábitat y representan especies carismáticas 'emblemáticas' para programas destinados a conservar los invertebrados terrestres. 34 2.5. Diversidad de alacranes El interés por el estudio de los alacranes se remonta al siglo XVIII, por lo que a lo largo de la historia se han tenido diversos cambios en cuanto a la taxonomía del grupo, cinco especies bajo el género Scorpio son mencionadas por Linneo (1758) en la décima edición de “Systema Naturae”; C.L Koch (1837) en la revisión de la fauna enumera cuatro familias y 11 géneros; Peters (1861) reporta seis familias y 64 géneros; Sissom (1990) menciona nueve familias y 115 géneros de escorpiones existentes; Fet et al., (2000) reportan 16 familias, 155 géneros y 1259 especies; Coddington et al., (2004) reportan 1,340 especies distribuidas en 17 familias y 163 géneros; Prendini (2011) reporta 1,947 especies distribuidas en 18 familias y 151 géneros; Rein (2019) reporta 2,475 especies (tabla III) distribuidas en 19 familias. Tabla III. Familias, géneros y especies de alacranes conocidas para el mundo. * familias presentes en México. Familia Géneros Especies Bothriuridae 17 158 Buthidae* 96 1170 Caraboctonidae* 4 32 Chactidae* 15 208 Chaerilidae 1 48 Diplocentridae* 10 133 Euscorpiidae* 6 81 Hemiscorpiidae 1 16 Heteroscorpionidae 1 6 Hormuridae 11 88 Iuridae 4 14 Pseudochactidae 3 9 Scorpionidae 13 182 Scorpiopidae 8 72 Superstitionidae* 1 1 Troglotayoscidae 2 6 Typhlochactidae* 4 11 Urodacidae 1 20 Vaejovidae* 25 220 TOTAL 223 2,475 Modificado de Rein, 2019 35 2.5.1. Diversidad de alacranes en México Cerca de dos terceras partes de la biodiversidad mundial se localizan en poco más de una docena de países conocidos como países megadiversos. Como va siendo cada vez más del conocimiento público, México destaca entre ellos ya que somos la cuarta nación en cuanto a riqueza de especies (CONABIO, 2009); México es considerado uno de los países más diversos del mundo en cuanto alacranes refiere; se conocen 306 especies distribuidas en 8 familias (tabla IV) de las 19 familias listadas para el mundo. Tabla IV. Familias, géneros y especies de alacranes conocidas para México. * Familias presentes en Sonora. Familia Géneros Especies % Buthidae* 2 50 16.34 Caraboctonidae* 3 11 3.59 Chactidae 1 1 0.33 Diplocentridae* 3 60 19.61 Euscorpiidae 3 9 2.94 Superstitioniidae* 1 1 0.33 Typhlochactidae 4 11 3.59 Vaejovidae* 21 163 53.27 TOTAL 38 306 100 De las ocho familias de alacranes de que se conocen para Mexico la familia Vaejovidae es la más diversa en géneros y especies con aproximadamente el 50% en ambos casos, seguida por la familia Diplocentridae. Sin embargo, Buthidae es también una familia común con dos géneros y 50 especies, de las cuales 46 corresponden al género Centruroides, responsable del problema de alacranismo en diversas zonas del país. Una familia troglófila con muy buena representación en México es Typhlochactidae con cuatro géneros y 11 especies, la cual es hasta ahora una familia exclusiva de México y finalmente, de Superstitionidae sólo se conoce a Superstitonia donensis Stahnke, 1940, con registros para Sonora y Baja California, compartiendo distribución con algunas áreas de los Estados Unidos de Norteamérica (Ponce-Saavedra y Francke, 2013). 36 2.5.2. Diversidad en Sonora El estado de Sonora presenta una gran diversidad de especies gracias a la variedad de ecosistemas que forman un continuo de variación ecológica desde la costa árida del alto Golfo de California hasta las montañas frías y húmedas en lo alto de la Sierra Madre Occidental. Incluyen una multitud de tipos de vegetación, ecotonos y alta diversidad relacionados con la gran variabilidad climática, edáfica y topográfica de la región; desde los manglares, dos tipos de matorral espinoso y el Desierto Sonorense, con cuatro de sus siete subdivisiones, al bosque tropical caducifolio, los pastizales, los encinares y los bosques de pino-encino y mixtos de coníferas en las áreas de mayor elevación. En cuanto a diversidad de alacranes hay pocos estudios para la entidad, de los pocos estudios se destacan el trabajo de Sissom y Stockwell (1991) en el cual presenta una revisión sobre las especies de Serradigitus y Vaejovis en el estado con 6 especies para Serradigitus y 5 para Vaejovis; Sissom y Wheeler (1995) reportan 4 especies de Diplocentrus. GonzalesSantillán (2001) enlista 22 especies para el estado; Castrezana (2010) reporta 28 de las 306 especies listadas para el país distribuidas en 5 familias, Ponce-Saavedra y Francke (2019) enlistan 31 especies para el estado (tabla V) lo que representa el 10.16% de la totalidad de las especies listadas para el país, situándose entre los estados más diversos en cuanto a alacranes, solo por debajo de Oaxaca, Baja California Sur y Baja California Norte (Ponce-Saavedra y Francke, 2016). Tabla V. Familias, géneros y especies de alacranes conocidos para el estado de Sonora Familia Géneros Especies % Buthidae 1 3 9.67 Caraboctonidae 1 2 6.45 Diplocentridae 1 4 12.9 Superstitioniidae 1 1 3.2 Vaejovidae 9 21 67.7 TOTAL 13 31 100 Modificado de Ponce-Saavedra y Francke, 2019 37 2.5.3. Justificación La importancia de la biodiversidad se puede sintetizar en dos rasgos esenciales. Por un lado, es el fruto del trabajo de millones de años de la naturaleza, por lo que su valor es incalculable e irremplazable. Por otro, es garantía para el funcionamiento correcto del sistema que forman los seres vivos, junto con el medio en el que viven y al que contribuyen para su supervivencia. De esta forma, podemos afirmar que la biodiversidad no sólo es significativa para los seres humanos, sino que es esencial para la vida del planeta, por lo que debemos tratar de preservarla. Por lo antes mencionado conocer las especies para conservarlas es de vital importancia, ya que para preservar algo primero hay que conocerlo; en virtud de escasos trabajos referentes a riqueza de especies del orden Scorpiones para el estado y El Malpaís, el presente estudio surgió de la idea del grupo de trabajo “Estudios Integrales del Medio Natural” de la universidad de la Sierra los cuales han trabajado con otros grupos de plantas y animales en los últimos años. El trabajo presenta una actualización de las especies de alacranes presentes en el estado de manera que funciona como una guía de identificación, ya que se presenta la diagnosis, distribución y grado de toxicidad que presenta cada especie. Conocer las especies presentes en El Malpaís es importante ya que representa un área de importancia biológica por las cualidades de hábitat que posee; para el área han encontrado varios endemismos lo que demuestra la importancia de esta zona, lo que conlleva a que se realicen más trabajos enfocados en conocer la biodiversidad de la zona. 38 III. Objetivos 3.1. Objetivo general • Determinar las familias, géneros y especies de alacranes presentes en el estado de Sonora 3.2. Objetivos específicos • Conocer la diversidad de especies de alacranes presentes en El Malpaís. • Determinar la distribución de las especies en el estado de Sonora. • Determinar la distribución de las especies en el área de El Malpaís. • Identificar las especies de importancia médica en Sonora. 39 IV. Materiales y Métodos 4.1. Área de estudio El estado de Sonora se encuentra ubicado en el noroeste de México en la frontera con Estados Unidos. Tiene una extensión de 184 934 km 2, lo que lo hace el segundo más grande del país, y ocupa cerca de 9.2% del territorio nacional. Por su ubicación biogeográfica, Sonora se localiza en una zona de transición entre la región Neotropical y la región Neártica. Colinda al oeste con el estado de Baja California y el Golfo de California, al sur con el estado de Sinaloa, al este con Chihuahua y al norte con Arizona y Nuevo México (Molina-Freaner y Van Devender,2010). Una buena parte de su superficie está cubierta por matorrales desérticos, razón por la cual se le considera como una región árida. Las dos terceras partes del estado están dominadas por el desierto sonorense donde se encuentra la zona más árida de México. Sin embargo, el sur del estado sustenta selvas caducifolias y la Sierra Madre Occidental posee bosques de pino-encino, lo que genera una diversidad ecosistémica considerable (Brito-Castillo et al.,2010). En general se puede decir que se definen dos zonas: una montañosa, que además de poseer fértiles valles en las márgenes de los ríos, tiene llanuras abiertas en las planicies altas; la otra zona es de terreno plano, ya que a medida que se aproxima a la costa, va adquiriendo mayor extensión, hasta terminar en desiertos por su constitución geológica y su clima, donde la precipitación total anual es inferior a 50 mm. En la entidad abundan los climas áridos (Mosiño y García, 1973) con temperaturas extremosas y escasa precipitación. Aproximadamente 95% del estado de Sonora se caracteriza por tener alguna variante de clima seco, con escasa precipitación y alta temperatura. Según el sistema de clasificación climática de Köppen, modificado por García (1988), y el sistema de clasificación de comunidades bióticas de Brown y Lowe (1994), en Sonora se han clasificado 24 tipos diferentes de climas y cinco tipos diferentes de vegetación. 40 4.1.1. Ubicación del El Malpaís El Malpaís se ubica en la región noreste del estado a 150 km aproximadamente de la capital, la cual se encuentra entre los municipios de Moctezuma, Divisaderos y Tepache (Malpaís), siendo el municipio de Moctezuma el que mayor superficie abarca; con coordenadas 29.690345° de latitud norte 109.634162° de longitud oeste. El área pertenece a la cuenca del Río Yaqui, subcuenca Río Moctezuma, con diferentes corrientes intermitentes (Vega-Granillo, 2011). Corresponde a una meseta accidentada con grietas y crestas filosas de origen volcánico basáltico con vegetación predominante del tipo matorral espinoso de pie de monte; de las especies del matorral destacan por su abundancia: Vachellia campechiana, Bursera laxiflora, Fouquieria macdougalii, Haematoxylum brasiletto, Ipomoea arborescens, Jatropha cordata, Lysiloma divaricatum, Prosopis velutina, Mimosa distachya y Stenocereus thurberi, (Martinez-Yrízar, 2010). Con una elevación aproximada que va desde los 600 a los 800 msnm, un clima seco cálido (correspondiente al clima BS1h (x´) según la Clasificación Climática de Köppen) con temperaturas máximas de hasta 47.5° C, temperatura media máxima mensual de 31.2° C y una temperatura media mínima mensual de 13.7° C. La temperatura media anual es de 22.4° C; la época de lluvias se presenta en verano en los meses de julio y agosto con una precipitación media anual de 520.8 mm (Servicio Meteorológico Nacional, 2010). Los puntos de muestreo se limitaron en función del tipo de roca que poseen tomándose como sitios de mayor importancia áreas con rocas de formación volcánica (basalto). Cuatro localidades fueron seleccionadas: El Malpaís; Área central de El Malpaís donde no se presentan rocas de basalto; La Volanta y Rancho Los Mimbres (Figura 1). El área de estudio pertenece al Área de Protección de Flora y Fauna Bavispe (DOF, 2017). 41 Figura 13. Mapa de ubicación del área de estudio. Mapa base tomado de CONABIO. 42 4.2. Metodología 4.2.1. Materiales • • • • • • • Pinza metálica de punta estriada. Lámpara portátil. Linterna de luz ultravioleta Frascos con alcohol al 80%. Frasco contenedor. Cámara marca Canon rebel t6 Gps, marca GARMIN eTrex Legend H. • Libreta de campo, etiquetas de papel, lápiz. • Microscopio estereoscopio, marca Nikon SMZ1270 • Cámara digital Nikon Coolpix 4600 • Programas, ArcGis y Adobe Photoshop® CS6. 4.2.2. Diversidad de especies en Sonora Para conocer las especies presentes en el estado de Sonora se revisaron los ejemplares presentes en la colección nacional de arácnidos, se anotó el municipio donde colecto el ejemplar asi como la especie a la cuál corresponde. Se consultaron los artículos que mencionen especies con registro para el estado, en adicción a esto se consultaron las diferentes bases de datos con registros para el estado (MDE: Madrean Discovery Exeditions; Naturalista; MABA: Madrean Archipielago Biodiversity Assestment; Azscorpions.org) 4.2.3. Diversidad de especies en el área de El Malpaís Se utilizaron dos técnicas básicas para el muestreo de arácnidos y en particular de los alacranes: • Recolecta manual diurno bajo piedras y troncos. • Recolecta nocturna utilizando lámparas portátiles de luz ultravioleta. El trabajo de campo se realizó de agosto de 2018 a octubre 2019, realizando de 4 a 12 salidas por mes siendo los meses de verano los más activos, no se realizaron muestreos en invierno y periodo vacacional. Los ejemplares colectados se preservaron en alcohol etílico al 80%, se anotó la localidad y la fecha asi como la identificación previa de la especie si era posible al momento. 43 Los ejemplares colectados se encuentran depositados en la Colección Nacional de Arácnidos (CNAN), Instituto de Biología de la UNAM, CDMX, México. Los registros y fotos están disponibles en la base de datos de Madrean Discovery Expedition (madreandiscovery.org) y la Base de Datos de Avistamientos de la Universidad de la Sierra. 4.2.3.1. Identificación de especies En el trabajo de laboratorio se identificaron los ejemplares, provenientes del área de estudio, por medio de un microscopio estereoscopio, marca Nikon SMZ1270 se identificaron, de acuerdo con las claves de Ponce- Saavedra y Francke (2013), la cual indica seguir las características como: forma del esternón para identificación a nivel de familia. Para la identificación de las especies del género Centruroides se observaron el número de hileras de gránulos, en el dedo móvil del pedipalpo, observar las bandas longitudinales presentes o no en el mesosoma, coloración del carapacho, si presentaba espina en el telson, y hacia donde iba dirigida. Para los otros géneros presentes en el área, se revisaron las publicaciones de la descripción de los géneros presentes en el estado con el fin de conocer las claves taxonómicas de cada especie (Sissom,1991; Sissom y Wheeler,1995). Las medidas y términos están de acuerdo a Stanhke (1970), excepto para la tricobotriotaxia (Vachon, 1974). Para la realización de la guía de identificación se las especies se realizó una clave dicotómica con los principales caracteres morfológicos que permiten la diferenciación de las especies a nivel familia, género y especie, como son la forma del esternón, la forma de la quela, la presencia o ausencia de tricobotrias (tricobotriotaxia) entre otros. 4.2.4. Distribución de especies en el estado de Sonora Para determinar la distribución de las especies se anotaron en una tabla de Exceel las localidades y coordenadas registradas para cada especie obtenidas de las diferentes bases de datos, asi como de los registros de las especies presentes en la CNAN y registros personales. 44 Los datos fueron agregados como datos de longitud y latitud (X, Y) en ArcGIS 10.5 para obtener los mapas de distribución; se utlizaron como mapas base los mapas del portal Conabio. Para las imágenes de las especies que no se tenían colectadas estas se obtuvieron de las publicaciones originales o de imágenes capturadas en bases de datos. Las imágenes fueron editadas para una mayor resolución y para eliminar el fondo utilizando Adobe Photoshop® CS6. 4.2.5. Distribución de especies en El Malpaís Para determinar la distribución de las especies se anotaron las coordenadas donde se colectaron los especímenes de cada especie, se agregaron como datos de longitud y latitud en ArcGIS 10.5 para obtener los mapas de distribución utilizando como mapas base los mapas del portal Conabio (www.conabio.org.mx), los cuales fueron editados para mayor resolución. En cuanto a las fotografías de las especies colectadas se tomaron por medio de una cámara Réflex Canon T6. Las imágenes fueron editadas para una mayor resolución y para eliminar el fondo utilizando Adobe Photoshop® CS6. 4.2.6. Especies de importancia médica Para determinar la toxicidad del veneno de las especies se consultaron estudios sobre la toxicidad de alacranes conocidos y se extrapolo a las especies que no tienen estudios de acuerdo a su posición taxonómica (género y familia). La toxicidad se clasifico en cuatro tipos: 1/4 especies con baja toxicidad 2/4 especies moderadamente toxicas 3/4 especies toxicas, probablemente causan daño serio especies muy toxicas, posiblemente letales. 4/4 45 V. Resultados. 5.1. Diversidad de especies en Sonora A partir de la búsqueda bibliográfica, en bases de datos de Madrean Archipelago Biodiversity Assestment, Madrean Discovery Expeditions, Naturalista y las especies presentes en la colección nacional de arácnidos CNAN, así como registros personales se encontraron para el estado un total de cinco familias lo que representa el 62 % de las familias del país, 15 géneros y 40 especies tres de ellas con poblaciones con estatus subespecífico (tabla VI); este número de especies representa el 13.11 % a nivel nacional. Tabla VI. Especies de alacranes listadas para el estado de Sonora. * Especies endémicas Familia Buthidae Genero Centruroides Marx,1890 Diplocentridae Diplocentrus Karsch, 1880 Caraboctonidae Hadrurus Thorell, 1876 Superstitionidae Vaejovidae Superstitionia Stahnke, 1940 Chihuahuanus González Santillán y Prendini, 2013 Gertschius Graham y Soleglad 2007 Paravaejovis Williams, 1980 Kochius Soleglad y Fet, 2008 Pseudouroctonus Stahnke, 1974 Paruroctonus Werner, 1934 Serradigitus Stahnke, 1974 Smeringurus Haradon,1983 Stahnkeus Soleglad y Fet,2006 Uroctonites Williams y Savary, 1991 Vaejovis Koch,1836 Especie edwardsii Gervais, 1843 lauriadnae* Ponce-Saavedra y Francke,2019 pallidiceps Pocock, 1902 sculpturatus Ewing, 1928 gertschi Sissom y Walker, 1992 leptomanus* sp nov spitzeri Stahnke, 1970 peloncillensis Francke, 1975 williamsi* Sissom y Wheeler, 1995 arizonensis Ewing, 1928 arizonensis donensis Stahnke,1940 russelli (Williams, 1971) agilis (Sissom y Stockwell,1991) crassicorpus* Graham y Soleglad,2007 confusus (Stanhke,1940) spinigerus (Wood, 1863) colluvius Ayrey et al., 2019 sonorae*(Williams, 1971) apacheanus Gertsch y Soleglad, 1972 santarita Ayrey y Soleglad, 2015 baergi (Williams y Hadley, 1967) borregoensis Williams, 1972 borregoensis Williams, 1972 Subespecie arizonensis Ewing, 1928 pallidus Williams,1970 borregoensis Williams, 1972 stahnkei Gertsch y Soleglad, 1966 xanthus Gertsch y Soleglad, 1966 hearnei Williams, 1980 yaqui* Sissom y Stockwell, 1991 Mesaensis (Stahnke,1957) allredi (Sissom y Stockwell 1991) polisi* (Sissom y Stockwell, 1991) subtilimanus (Soleglad, 1972) huachuca (Gertsch y Soleglad, 1972) bandido* Graham et al., 2012 decipiens Hoffmann, 1931 islaserrano* Barrales-Alcalá et al.,2018 mauryi* Capes, 2001 montanus Graham y Bryson, 2010 patagonia Ayrey, 2018 pequeno* Hendrixson, 2001 46 5.1.1 Familia Buthidae Kock,1837 Esta familia está muy extendida en todo el mundo (solo no se encuentra en la Antártida y Nueva Zelanda), y se encuentra en hábitats tropicales, subtropicales y en parte templados. Con 96 géneros y 1162 especies, esta familia es la más grande de las familias de escorpiones (Rein, 2019). En el estado se registra un género y cuatro especies; representa el 10.5% de las especies listadas para el estado, solo se conoce a Centruroides lauriadnae Ponce- Saavedra y Francke, 2019 como especie endémica para el estado. Diagnosis. Escorpiones con esternón triangular; dedo móvil de los quelíceros con 2 dientes ventrales; Ortobotriotaxia tipo A, fémur de los pedipalpos con 11 tricobotrias, patela con 13 tricobotrias, ninguna de ellas en la cara ventral. Es la única familia del estado considerada de importancia médica. Género Centruroides Marx,1890 El género Centruroides Marx, 1890, actualmente contiene 93 especies, de las cuales 44 se han descrito o registrado para México, (Ponce-Saavedra et al., 2019; Rein,2019) y cuatro para el estado de Sonora. Es el único género del estado que es considerado de importancia médica. Se distribuye desde el sur de Estados Unidos de América hasta el norte de Sudamérica. Diagnosis. Fémur con tricobotriotaxia tipo A; de ocho a nueve filas de gránulos centrales en el borde interno de los dedos de los pedipalpos. Tergüitos I-VI con una quilla longitudinal media, aunque en V y VI pueden presentarse rudimentos de un par de quillas submedias; esternito III con un par de surcos débiles o sin ellos; espiráculos respiratorios alargados; telson con un tubérculo subaculear espiniforme o romo, a veces rudimentario; macho con los segmentos del metasoma proporcionalmente más largos y por lo general más delgados que en la hembra (Armas y Martín-Frías, 2008). Centruroides edwardsii (Gervais, 1843). Toxicidad. 1-2/4, especie no muy toxica, probablemente no causa daño. Diagnosis. Especie de mediana a grande (60–110 mm). patrón del subgrupo “bertholdii”; cuerpo marrón; quelas del pedipalpo, carapacho, tergüitos I-VII, segmento metasomal V y telson marrón rojizo oscuro; fémur y patela de los pedipalpos y patas marrón amarillento; peines de color amarillo claro; carenas en metasoma y pedipalpos son de color marrón oscuro. Metasoma coriáceo, con todas las carenas fuertemente denticuladas; telson con un tubérculo subaculear espiniforme dirigido hacia la porción basal del aguijón. Segmentos II a IV con más de tres (generalmente cuatro) pares de macrosetas ventrolaterales. Pedipalpos muy densamente hirsutos; quela más ancha que la patela y muy robusta en los adultos, con carena dorsal marginal casi lisa; dedos con ocho hileras principales de gránulos, flanqueados interna y externamente por numerosos gránulos supernumerarios. Conteo de dientes pectinales, 22-30 en hembras, 26-34 en machos. Distribución. México (especie introducida), El Salvador, Honduras, Nicaragua, Costa Rica, Colombia y Cuba. 47 Centruroides lauriadnae Ponce-Saavedra y Francke,2019 Toxicidad. 3/4, especie toxica, probablemente causa daño. Diagnosis. Longitud de los adultos entre 35 y 46 mm. Coloración típica de un alacrán “rayado”, con el carapacho fuertemente pigmentado y el patrón del subgrupo “infamatus”; dorsalmente ocre y ventralmente amarillo muy claro, con metasoma y patas amarrillo más claro. Pedipalpos con coloración ligeramente más clara y débilmente infuscados. Conteo de dientes pectinales de 23-25 (moda 24) en macho y poco más bajo en hembras 21-24 (moda 22). Carenas metasomales moderadas a bien desarrolladas y granulares a excepto en el segmento V del macho. Vesícula alargada, con tubérculo subaculear cónico y ubicado cerca de la base del aguijón. Distribución. Sonora. Especie endémica de la región del El Malpaís, Sonora, municipios de Divisaderos, Moctezuma y Tepache. Centruroides pallidiceps Pocock, 1902 Toxicidad. 3/4, especie toxica, probablemente causa daño. Diagnosis. Longitud de los adultos de 50 a 54 mm. Adultos con muy escasa pigmentación, coloración parda cobriza; carapacho con el patrón del subgrupo “elegans” (Ponce-Saavedra y Francke, 2019), borde anterior del carapacho cóncavo, poco granuloso, gránulos grandes en la parte anterior de las quillas superciliares y centrales laterales; mano globosa, con carenas muy débiles excepto la externa secundaria que está bien desarrollada y fuerte, pero es completamente lisa; quillas metasomales poco desarrolladas; el segmento metasomal V es de tamaño similar al IV, más alto en la región media basal, lo que le da una apariencia algo inflada, es completamente liso con vestigios de granulación en su cara ventral y entre 1.2 y 1.4 veces la longitud del cefalotórax; tubérculo subaculear reducido, espiniforme , alejado de la base del aguijón. Conteo de dientes pectinales de 22-23. Distribución. Sonora (Guaymas) y Sinaloa. Centruroides sculpturatus Ewing, 1928 Toxicidad. 4/4, especie muy toxica, posiblemente letal. Es la especie de mayor importancia médica para el estado. Diagnosis. Longitud de los adultos de 48 mm. Color general marrón amarillento. No hay rayas dorsales, manchas u otras marcas de color, carapacho sin color dorsal; surco mediano pronunciado; tegumento granular. Quelas delgadas, dedos aproximadamente una vez y media más largos que la mano. Sobre la parte posterior del carapacho hay un par de carenas longitudinales, tuberculadas, que se extienden hacia adelante desde el margen posterior aproximadamente a la mitad de la distancia a los ojos medios. Metasoma más largo que el mesosoma; segmento I aproximadamente dos veces más largo que ancho, tubérculo subaculear poco desarrollado, ubicado relativamente alejado de la base del aguijón. Dientes pectinales de 24- 28 en machos y 22- 24 en hembras. Distribución. Arizona, Sonora y algunas partes de Baja California; es la especie de mayor distribución de la familia Buthidae para el estado. 48 2/4 3/4 3/4 4/4 Figura 14. Especies de la familia Buthidae presentes en el estado de Sonora, los números representan la clave del municipio donde se tienen registros. Barra de escala 1 cm. 49 5.1.2. Familia Caraboctonidae Kraepelin, 1905 Género Hadrurus Thorell, 1876 Son los alacranes más grandes del Nuevo Mundo, alcanzando una longitud de 12–13 cm y una masa de 20–25 g, son llamados "escorpiones peludos gigantes" cuenta con siete especies y dos subespecies. (Francke y Prendini, 2008; Rein, 2019). Se distribuyen desde el Sur de Estados Unidos de América hasta el sur de México. Diagnosis. El dedo queliceral móvil no solo tiene una hilera de dientes en el margen superior, sino también un diente en el margen inferior. Ojos dorsales no muy alejados del centro del cefalotórax. Cola quillada. Patela del pedipalpo con seis o más tricobotrias en la cara ventral dispuestas de manera irregular; animales grandes con una longitud corporal mayor de 10 cm cuando adultos. Hadrurus arizonensis arizonensis Ewing, 1928 Toxicidad. 2/2, moderadamente toxica. Las especies pueden ser agresivas, picadura dolorosa. Diagnosis. Especie grande, los adultos alcanzan hasta 14 cm, es la especie de mayor tamaño para el estado. Coloración general amarillenta. Prosoma pardo con márgenes laterales y dos tercios anteriores del área interocular amarillenta. Tergüitos parduscos con márgenes laterales amarillentos. Metasoma, carena dorsal amarillenta de segmentos IV-V con largas setas; vesícula densamente cubierta de setas amarillentas; amarillo anaranjado en la base, negro en la punta. Patas y pedipalpos amarillentos; dedo móvil con 9 hileras de gránulos. Conteo de dientes pectinales, 28-34 en hembras, 32-39 dientes en machos. Distribución. Estados Unidos América: Arizona, California, Nevada y Utah; México: Sonora. Hadrurus arizonensis pallidus Williams, 1970 Toxicidad. 2/2, moderadamente toxica. Las especies pueden ser agresivas, picadura dolorosa. Diagnosis. Especie grande los adultos alcanzan hasta 14 cm. Coloración general amarillenta. prosoma amarillento con dos tercios anteriores del área interocular de color más claro. Mesosoma amarillento, bordes posteriores de tergüitos de color más claro. Metasoma, amarillento; filo de dedos fijos con 9 hileras de gránulos. Conteo de dientes pectinales 24-31 dientes en hembras; 32-37 dientes en los machos. Distribución. Estados Unidos América: Arizona y California; México; Sonora Baja California. 50 2/4 2/4 Figura 15. Especies de la familia Caraboctonidae presentes en el estado de Sonora, los números representan la clave del municipio donde se tienen registros. Barra de escala 1 cm. 5.1.3. Familia Diplocentridae Karsch, 1880 En el mundo, la familia Diplocentridae se compone de 10 géneros y 133 especies. En México están presentes 58 especies distribuidas en los géneros Bioculus Stahnke, 1968, Diplocentrus Peters, 1861 y Kolotl Santibáñez-López et al., 2014. Para el estado se registra el género Diplocentrus con cinco especies, es la segunda familia más diversa solo por debajo de Vaejovidae. Diagnosis. Escorpiones con esternón pentagonal; dedo móvil de los quelíceros sin dientes ventrales; fémur de los pedipalpos con tres tricobotrias, patela con 19 tricobotrias, tres de ellas en la cara ventral. Tubérculo subaculear desarrollado. Género Diplocentrus Peters,1861 El género Diplocentrus, presenta la mayor diversidad dentro de la familia Diplocentridae con 64 especies, de las cuales 51 se han registrado para México y 5 son listadas para él estado de Sonora siendo Diplocentrus leptomanus sp nov., y Diplocentrus williamsi Sissom y Wheeler, 1995 endémicas para el estado. 51 Su distribución va desde el sur de Estados Unidos hasta el norte de Honduras (Fet et al., 2000; Francke y Ponce-Saavedra, 2005; Ponce-Saavedra et al., 2016; Rein,2019). Diagnosis. Alacranes de talla variable (adultos de 2.5 a 15 cm), con las quelas de los pedipalpos muy desarrolladas y robustas; los telotarsos de las patas armados ventralmente con dos filas de sedas espiniformes; telson con un prominente tubérculo redondeado y sedoso bajo el aguijón; borde interno de los dedos de los pedipalpos con 6 secciones de gránulos. El género se distribuye desde el sur de EUA hasta honduras; ampliamente distribuido en la República Mexicana. Diplocentrus gertschi Sissom y Walker, 1992 Toxicidad. 1/4, especie de baja toxicidad. Diagnosis. Machos adultos de hasta 45 mm de largo, hembras de hasta 52 mm de largo. Color base marrón anaranjado oscuro a marrón, con marcas oscuras distintas a la longitud del cuerpo. Carapacho con granulación gruesa restringida a áreas que rodean el margen anterior y el surco mediano anterior; resto del carapacho densamente granulado. Conteo de dientes pectinales 13-15 en los machos, 9-12 en hembras. Metasoma I-IV con 10 quillas: carenas dorsolaterales y supramedianas laterales moderadas a fuertes y crenuladas, especialmente en III-IV; inframedianas, ventrolaterales y ventrales submedianas débilmente granuladas en los segmentos III-IV.Proporción de la quela largo / ancho 1.42-1.55; dedo fijo / ancho de la quela 0.75-0.87; longitud de dedo móvil / longitud de la quela 0.85-0.94. Pedipalpos: superficie dorsal del fémur claramente convexa, igual de ancho que alto; patela con una carena dorsal fuerte y lisa; quela longitud del dedo fijo / longitud del carapacho 0.62-0.69; longitud del dedo móvil / longitud del carapacho 0.94-1.00. Formula telotarsal: 4/5: 5/5-6: 6/6: 6/6 Distribución. Sinaloa, Nayarit, Jalisco y Sonora?, Sissom y Walker, 1992 mencionan un registró de un juvenil es la zona de Guaymas, pero esto talvez es atribuido a una mala identificación. Diplocentrus leptomanus sp. nov. Toxicidad. 1/4, especie de baja toxicidad. Diagnosis. Especie mediana, los adultos llegan a medir de 36 a 38 mm de longitud total; color castaño. Quelíceros con el dedo fijo más corto que el ancho de la quela, dedo móvil igual o menor al ancho de la quela. Mesosoma largo y esbelto. Patrón de tricobotrias tipo C (Ortobotriotaxia tipo C). Fémur de los pedipalpos más anchos que altos, patela con un ancho igual a la altura. Quelas aproximadamente tres veces más largas que anchas; proporción entre quela largo / ancho: 2.78-3.43, quela largo / alto 4.05-4.89. Dientes pectíneos: machos 12-15 (moda 14), hembras 10-12 (moda 11). Formula telotarsal: 5/5: 5-6/6: 6/7: 7/7. Distribución. Sonora, especie endémica de la región de El Malpaís. Diplocentrus spitzeri Stahnke, 1970 Toxicidad. 1/4, especie de baja toxicidad. Diagnosis. Adultos de 40-52 mm de longitud. Color base de adultos parduscos con pedipalpos rojizos, segmentos distales de metasoma I y telson de color marrón anaranjado a marrón rojizo; patas amarillo marrón. Margen anterior del carapacho con granulación moderada. 52 Conteo de dientes pectinales 13-16 en machos y 10-13 en hembras. Pedipalpo: cara dorsal del fémur algo convexa en el tercio proximal del segmento; carena dorsoexterna moderada, granulada. Proporción de la longitud del dedo móvil / longitud del metasoma V, 1.06-1.13 en machos, 1. 13-1.30 en hembras; longitud de dedo móvil / ancho de quela,1.16-1.30; quela largo / ancho ,1.95-2.09 (ambos sexos); segmento IIl del metasoma largo / ancho 1.21-1.34; segmento V del metasoma largo / ancho 2.32-2.60 en machos, 2.00-2.47 en hembras. Formula telotarsal: 6/6: 6 / 6-7: 7/7: 7/7. Distribución. Arizona y Sonora. Diplocentrus peloncillensis Francke, 1975 Toxicidad. 1/4, especie de baja toxicidad. Diagnosis. Especie mediana, longitud de los adultos no superior a 50 mm. Marrón claro con patrón oscuro claro bien definido; El tubérculo ocular mediano no contrasta bruscamente con las áreas circundantes por su coloración. Caparazón más corto que el dedo móvil de la quela. Metasoma V más corto que la patela del pedipalpo en machos adultos, aproximadamente de igual longitud en hembras y juveniles; patela con superficie dorsal plana. Proporción de la quela largo / ancho 1.96-2.11; quela largo/ alto 2.933.35. Tergüito VII con carenas indistintas, esternito VII con cuatro carenas. Dedo fijo del quelícero aproximadamente la mitad de largo de la quela. Fórmula telotarsal: 5/6: 6/6-7: 6/7: 6/7 Distribución. Estados Unidos de América: Nuevo Mexico y Arizona; México: Chihuahua y Sonora. Diplocentrus williamsi Sissom y Wheeler, 1995 Toxicidad. 1/4, especie de baja toxicidad. Diagnosis. Especie mediana 42 mm. Coloración, marrón anaranjado claro con claras marcas subyacentes oscuras; telson amarillo anaranjado. Segmentos del metasoma I-IV: carenas dorsolaterales en I-IV débiles a moderadas, cada una con varios gránulos redondeados. Carena lateral supramediana en I fuerte, granulosa; en II-IV moderado, granular; carena lateral inframediana en I fuerte, granulosa; en II moderado, granular; en III débil, representado por unos pocos gránulos redondeados; en IV esencialmente ausente; carena ventrolateral en I fuerte, granulosa; en II moderada, irregularmente crenulada; en III-IV moderado, con algunas crenulaciones irregulares. Fémur del pedipalpo con carena dorsoexterna vestigial a moderada, mayormente lisa con algunos gránulos proximales redondeados; quela relativamente delgada, con una proporción de la quela longitud / ancho 2,35-2,57 en los machos, 2,11-2,24 en hembras; relación de ancho- longitud del metasoma III del macho 1.36-1.4. Formula telotarsal: 5/6: 5/6: 6/7: 6-7/7 Distribución. Sonora, especie endémica del área de Álamos, Guaymas y Navojoa. 53 1/4 1/4 1/4 1/4 1/4 Figura 16. Especies de la familia Diplocentridae presentes en el estado de Sonora, los números representan la clave del municipio donde se tienen registros. Barra de escala 1 cm. 54 5.1.4. Familia Superstitioniidae Stahnke, 1940. Esta familia incluye un género y una especie, lleva el nombre de las montañas de Superstición al este de Phoenix, donde los primeros especímenes fueron recolectados por Herbert Stahnke. Los escorpiones de esta familia se encuentran en América del Norte (suroeste de los Estados Unidos y Noroeste de México). Superstitonia donensis Stahnke,1940 Toxicidad. 1/4, especie de baja toxicidad. Diagnosis. Pequeños escorpiones de hasta 25 mm. Coloración general amarillo parduzco. Prosoma amarillo parduzco con parches negros de forma irregular. Mesosoma amarillo parduzco, cada terguito con tres parches negros que forman una línea axial y dos líneas laterales a lo largo del mesosoma. Cola amarillenta con manchas negras; telson amarillo anaranjado, masivo; aguijón amarillo anaranjado en la base y negro en la punta. Patas, amarillo pálido con parches negros y una mancha marrón rojiza en las articulaciones entre segmentos. Pedipalpos, amarillentos con manchas negras; dedos de la quela marrón rojizo, cortos; dedos fijos y móviles con 5-7 hileras de gránulos. Conteo de dientes pectinales seis en ambos sexos. Distribución. Estados Unidos de América: Arizona, California, Nevada y Nuevo Mexico; Mexico: Baja California y Sonora. 1/4 Figura 17. Especies de la familia Superstitioniidae presentes en el estado de Sonora, los números representan la clave del municipio donde se tienen registros. Barra de escala 1 cm. 5.1.5. Familia Vaejovide Thorell, 1876 Esta es una gran familia con 25 géneros y 220 especies (Rein, 2019). Esta familia incluye solo especies de América del Norte (suroeste de Canadá, Estados Unidos y México) y América Central (Guatemala). Se encuentran en casi todos los hábitats, hasta la línea de árboles alpinos (más de 3.000 metros), aunque la mayoría se encuentran en hábitats áridos (a 70 m sobre el nivel del mar) y semiáridos. 55 En México se conocen 143 especies y 22 géneros, lo que la convierte en la familia más diversa del país. En Sonora está representada por nueve géneros y 22 especies, lo que la posiciona como la familia más diversa para el estado. Diagnosis. Alacranes de apariencia variada; esternón de forma variable pero nunca triangular, generalmente robustos; con hileras de dientecillos en los dedos de la quela del pedipalpo formando una línea continua en la que las hileras se separan por dientecillos de mayor tamaño, presentan cinco a siete hileras de gránulos medios. Ortobotriotaxia tipo C. Patela del pedipalpo con tres o menos tricobotrias en la cara ventral. Género Chihuahuanus González-Santillán & Prendini, 2013 En una revisión sistemática de la subfamilia Syntropinae Gonzáles-Santillán y Prendini, (2013) redefinieron a la subfamilia incluyendo a ocho especies con representantes desde el sur de Estados Unidos de América hasta el Norte de México. Diagnosis. En adultos está presente una pequeña área glandular fusiforme blanquecina en la superficie dorsal del telson, cerca de la base del aculeus. El dedo fijo de la quela chela consistentemente con cinco secciones primarias de dentículos medianos y cinco dentículos prolaterales en la fila de dentículos medianos; la tricobotria et está situada entre las quillas RD3 y RD4. El carapacho está sombreado y está formado de gránulos dispersos, gruesos, redondeados y finos. Chihuahuanus russelli (Williams, 1971) Toxicidad. 1/4, especie de baja toxicidad. Diagnosis. Especie mediana, los adultos pueden alcanzar hasta 41 mm. Coloración general amarillenta. Prosoma marrón con la parte anterior, con color ligeramente más claro; granulación fuerte, tergüitos del mesosoma marrones, gránulos bastante abundantes. Metasoma amarillento con carenas rojizas; telson amarillento; aguijón rojizo en la base y negro en la punta. Patas amarillentas. Pedipalpos amarillentos con carenas y dedos de la quela rojizos. Conteo de dientes pectinales 14 en hembras y 17 en machos. Distribución. Estados Unidos de América: Arizona, Nuevo Mexico y Texas; México: Sonora, Chihuahua, Durango y Coahuila. 1/4 Figura 18. Especies del género Chihuahuanus presentes en el estado de Sonora, los números representan la clave del municipio donde se tienen registros. Barra de escala 1 cm. 56 Género Gertschius Graham y Soleglad 2007. Género formado por dos especies con distribución solo en Estados Unidos (sur de Arizona y sureste Nuevo México), México (Sonora y potencialmente en Chihuahua). Diagnosis. El opérculo genital de la hembra está conectado a lo largo de toda su longitud, operando como una sola unidad. Telotarso de la pata con un solo par de setas distales ventrales. Los dientes basales pectinales (1–2) de la hembra son lisos, carecen de área sensorial, no están hinchados ni alargados. Los grupos de dentículos medianos (MD) del dedo de la quela son serrados y visibles debido a 4– 5 dentículos externos (OD) intermedios distintos que no son serrados; dentícula distal de los dedos no demasiado alargada o "en forma de gancho. La tricobotria de la quela Dt se localiza proximal del punto medio de la mano; la tricobotria Db está situada en la carena digital (D1); y la tricobotria se coloca adyacente o proximal a la dentícula interna (ID) (ID-6) e ib es proximal a la ID-6. Gertschius agilis (Sissom y Stockwell, 1991) Toxicidad. 1/4, especie de baja toxicidad. Diagnosis. Alacranes pequeños con una longitud total de adultos de 16–22 mm; en hembras con dos dientes pectinales basales que carecen de área sensorial; dentaduras medianas de los dedos de la quela (MD) aserrados, los dentículos externos (OD) no son excesivamente aserrados y se distinguen en toda la longitud del dedo; segmentos metasomales anchos, segmentos I – III más anchos que largos, segmentos IV y V largo / ancho 1.28, 1.31 y 1.84, 1.80 para hembras y machos. Ancho del telson / longitud de telson 0.40, 0.41 para hembras y machos; carena ventral submediana del metasoma, obsoleta a granular a crenulada; gancho lamelar del hemispermatóforo no particularmente alargado, longitud de lámina / longitud del gancho 2.727–2.830, longitud de lámina / longitud de la superficie ventral del gancho 4.884– 6.714; conteo de dientes pectinales 14-15 en hembras, 14-17 en machos. Distribución. Estados Unidos: sur de Arizona y suroeste de Nuevo México; México: norte de Sonora. Gertschius crassicorpus Graham y Soleglad,2007 Toxicidad. 1/4, especie de baja toxicidad. Diagnosis. Alacranes pequeños con una longitud de adultos de, 17–25 mm de longitud total; en hembras diente pectinal basal carente de área sensorial; los dentículos medianos del dedo de la quela (MD) aserrados basalmente, los dentículos externos (OD) no son demasiado aserrados y se distinguen en toda la longitud del dedo; dentículo distal del dedo de la quela no formado en un gancho alargado y que carece de un parche "blanquecino”. Dedo móvil del quelícero con serrula bien desarrollada; segmentos metasomales considerablemente anchos, segmentos I – III más anchos que largos, segmentos IV y V largo / ancho 1.06 - 1.40 y 1.15 - 1.54 para machos y hembras; ancho del telson / longitud de telson 0.49 y 0.51 para hembras y machos; carena ventral submediana del metasoma obsoleta a lisa; gancho lamelar hemispermatóforo considerablemente alargado. 57 Relación longitud de lámina / longitud del gancho de 2,22, longitud de lámina / longitud la superficie ventral del gancho de 3.2; conteo de dientes pectinales 13 en hembras, 15 en machos. Distribución. Sur de Sonora. 1/4 1/4 Figura 19. Especies del género Gertschius presentes en el estado de Sonora, los números representan la clave del municipio donde se tienen registros. Barra de escala 1 cm Género Kochius Soleglad y Fet, 2008 Género formado por 10 especies con distribución desde el sur de Estados Unidos al Norte de México. Diagnosis. Borde anterior del caparazón con marcada emarginación continua que se origina en los ojos laterales, con una pequeña hendidura mediana; segmentos metasomales IV – V proporción longitud / ancho 1.7–2.2 (1.91) y 2.4–3.3 (2.75) en los machos, y 1.5–2.3 (1.83) y 2.3–3.5 (2.72) para las hembras; segmentos I-III metasomales con carenas generalmente granulares a crenuladas; carena de la quela generalmente granular a crenulada. Kochius sonorae (Williams, 1971) Toxicidad. 1/4, especie de baja toxicidad. Diagnosis. Adultos de aproximadamente 30 mm de longitud. Color base amarillo marrón con marcas de color oscuro variable en caparazón y tergüitos. Conteo de dientes pectinales en machos de 14-16; en hembras 14-15. Metasoma muy esbelto con segmento V longitud-ancho 2.4-2.5. Telson delgado con setas largas, algunas de las cuales son más largas que el aguijón. Quela del pedipalpo robusta, con una proporción quela longitud/ ancho 2.8-3.1 y dedo móvil longitud quela- ancho 1.6-1.7; dedos cortos, con la longitud del dedo movible alrededor de 0,8. Carenas de la mano bien desarrolladas, granulosas en los machos, granulares en las hembras; dedo fijo con tricobotrias ib e it ambas ligeramente basales. Distribución. Sonora. 58 Kochius colluvius Ayrey y Myers, 2019 Toxicidad. 1/4, especie de baja toxicidad. Diagnosis. Pequeños escorpiones de hasta 27 mm. El color es amarillo parduzco, más claro en las patas con moteado subyacente en el carapacho y el mesosoma, rojo en las puntas de los dedos de la quela. Los dedos de la quela no están arqueados. Carapacho grueso granulado. Mesosoma grueso granulado. El dedo móvil del pedipalpo tiene 7 dentículos ID y el dedo fijo tiene 6. El carapacho del macho es más corto que el segmento V metasomal. Conteo de dientes pectinales para machos 14 y hembras 13. Sin tubérculo subaculear presente. Superficie ventral del tarsómero II con una hilera mediana de espínulas que termina distalmente con múltiples pares de espínulas. Distribución. Estados Unidos: Tucson, Sur de Arizona; México: Se han recolectado especímenes muy cerca de la frontera con Sonora por lo que se cree que se pueda encontrar en algunas localidades del estado. Toxicidad. Especie con baja toxicidad 1/4. 1/4 1/4 Figura 20. Especies del género Kochius presentes en el estado de Sonora, los números representan la clave del municipio donde se tienen registros. Barra de escala 1 cm Género Paravaejovis Williams 1970 Género formado por 12 especies, se distribuyen desde el Sur de Estados Unidos de América hasta el Norte de México. Diagnosis. Segmentos metasomales I – IV con carena ventromediana emparejada; dedos de la quela variables en longitud, pero nunca extremadamente alargados, dentículos basales OD ubicados basalmente o suprabasalmente en los dedos; tricobotrias de la quela ib – it, db – dt y eb – et colocados uniformemente sobre el dedo fijo, no en la mitad distal; segmentos metasomales I – IV ensanchados posteriormente; segmentos metasomales s moderados a fuertes, segmentos I – II generalmente tan anchos o más anchos que largos, relación longitud-ancho 0.67– 1.08 (0.889) y 0.83–1.31 (1.051) para el macho, y 0.67– 1.03 (0.813) y 0.77 –1,29 59 (0,94) para la hembra; carenas dorsolaterales de segmentos I-IV con dentículo distal notablemente más grande que otros dentículos. Paravaejovis confusus (Stahnke, 1940) Toxicidad. 1/4, especie de baja toxicidad. Diagnosis. Especie mediana de adultos alcanzando hasta 55 mm. Coloración amarillenta, prosoma amarillo naranja; mesosoma anaranjado; borde posterior de los tergüitos coloreados; metasoma anaranjado con carenas ligeramente más oscuras; telson naranja con el aguijón rojizo en la base y negro en la punta. Patas amarillentas; pedipalpos naranjas, dedos de la quela rojizos, largos; borde de los dedos de la quela con 6- 7 hileras de gránulos; conteo de dientes pectinales 10-14 en hembras; 14-19 en machos. Distribución. Estados Unidos; México: Baja California y Sonora. Paravaejovis spinigerus (Wood, 1863) Toxicidad. 1/4, especie de baja toxicidad. Diagnosis. Adultos de aproximadamente 70 mm de longitud. Color base marrón amarillo claro con marcas oscuras subyacentes variables en carapacho y tergüitos; posiciones de las carenas submedias, ventrolaterales y ventrales del metasoma de color negro. Conteo de dientes pectinales 22-27 en machos, 16-22 en hembras. Metasoma robusto; segmento V generalmente más ancho y profundo que III en adultos. Carenas ventrales del metasoma, débiles, lisas; carenas ventrales submedianas ausentes. Quelas; mano lisa, sin carenas notables; dedo fijo con tricobotria ib. Dirigida al sexto gránulo accesorio interno. Quela largo / ancho 3.23.7; longitud de dedo móvil / ancho de la mano 2.0-2.3. Distribución. Arizona, sur de California, y oeste de Nuevo México en los Estados Unidos y en norte de Baja California Norte y Sonora en México 1/4 1/4 Figura 21. Especies del género Paravaejovis presentes en el estado de Sonora, los números representan la clave del municipio donde se tienen registros. Barra de escala 1 cm. 60 Género Paruroctonus Werner, 1934. El género Paruroctonus es el segundo con más miembros de la familia Vaejovidae, solo por debajo del género Vaejovis, con 29 especies. Se distribuye desde el extremo sur de Canadá hasta el Altiplano de México. Diagnosis. La superficie inferior del dedo queliceral móvil no es lisa, pero puede tener un borde ondulado; el dedo fijo puede llevar de 1 a 3 tubérculos. Surco caudal dorsal débilmente desarrollado. Gránulos distales de quillas laterales dorsales y superiores no notablemente más grandes o más denticuladas que las anteriores; carena terminal dorsal en el segmento V no plano y triangular. Proporción del segmento V metasomal de largo / ancho usualmente sobre 2 .45. Paruroctonus baergi Williams y Hadley, 1967 Toxicidad. 1/4, especie de baja toxicidad. Diagnosis. Especie mediana, los adultos alcanzan hasta 46 mm de longitud. Coloración, carapacho, mesosoma, metasoma y pedipalpos de color amarillo pálido uniforme; patas de color similar, pero más ligero que los pedipalpos; pectinas casi blancas. Carapacho con el margen anterior recto, con seis cerdas erectas. superficie cubierta con gránulos grandes, surco mediano largo y estrecho en la parte anterior a los ojos medianos. Carena mediana de los segmentos III-VII lisos; segmento VII con dos pares de carenas laterales con gránulos dentados grandes; segmentos VI y VII con cerdas rojizas largas y erectas en el margen lateral. Diente terminal en el borde inferior del dedo móvil de los quelíceros claramente más largo que en el borde superior; machos con 18-23 dientes pectinales, hembras con 14-15 dientes; telson del mismo tono que los segmentos caudales anteriores; en machos quela con espacio distintivo en el extremo proximal de los dedos cuando está cerrado. Distribución. Sureste de Estados Unidos; Noreste de Mexico: Baja California y Sonora. Paruroctonus borregoensis Williams, 1972 Toxicidad. 1/4, especie de baja toxicidad. Diagnosis. Especie pequeña, de adultos alcanzan de 30 a 35 mm, cuerpo enteramente amarillo pálido blanquecino; carenas laterales inferiores de los segmentos metasomales I a IV crenuladas, carenas medianas inferiores ausentes en el segmento I, ligeramente crenuladas en los segmentos II y III; telotarso III con tres setas retrosuperiores; basitarso III con siete setas superiores; setas metasomales dorsales y dorsolaterales I-IV discretas en machos adultos, setas internas de la quela discretas en varones adultos; telson con aculeus alargado; pedipalpos en el macho con dedos cortos y palmas hinchadas; Dientes pectíneos: de 15 a 18 en machos, 11 en hembras. Distribución. Región del desierto de Colorado: California en Estados Unidos; Norte de Baja California y noreste de Sonora en México. Paruroctonus stahnkei Gertsch y Soleglad, 1966 Toxicidad. 1/4, especie de baja toxicidad. Diagnosis. Especie pequeña no superior a 26 mm con coloración amarillo pálido, con el carapacho esencialmente sin marcas de patrón oscuro, y líneas oscuras no presentes en la parte inferior del metasoma. Diente distal en el margen superior del dedo móvil del quelícero de tamaño reducido y mucho más pequeño que el diente 61 correspondiente del margen inferior. Metasoma, carenas laterales dorsal y superior de los segmentos I-IV en los machos menos fuertemente crenuladas que la de las hembras, con gránulos individuales pequeños y regularmente espaciados; en las hembras son bastante lisas, con menos gránulos. Carenas laterales inferiores de las hembras ausentes en los segmentos I y II, apenas visibles pero lisas en el segmento III, más desarrolladas y crenuladas en la mitad caudal del segmento IV. Carenas medianas inferiores de hembras ausentes en segmentos basales, apenas visibles y débilmente crenuladas en el segmento IV. Todas las carenas inferiores del macho finamente granuladas. Todos los segmentos con setas dispersas, pero aquellos en la superficie ventral en filas regulares; segmentos I-IV con 3-4-5-5 pares de setas en carenas medianas inferiores ausentes. Conteo de dientes pectinales: 14-15 en hembras y 20-23 en machos. Distribución. Estados unidos: Sureste de Arizona; México: norte y noreste de Sonora. Paruroctonus xanthus Gertsch y Soleglad, 1966 Toxicidad. 1/4, especie de baja toxicidad. Diagnosis. Especie mediana, de adultos alcanzan hasta 52 mm; coloración, cuerpo entero amarillo pálido a naranja; carapacho ojos medianos de tamaño mediano y colocados mucho antes del centro del carapacho, margen anterior esencialmente recto, con seis setas cortas; lados suavemente festoneados; ancho en el margen caudal redondeado igual a la longitud. Metasoma robusto y con solo cinco pares de setas en quillas medianas inferiores; telson largo y delgado y con el aguijón largo y ligeramente curvo. Pedipalpos con los dedos robustos, largos y festoneados, todas las carenas son visibles y tienen gránulos pálidos bastante gruesos, carenas internas de los dedos muy festoneadas, dedo fijo mucho más largo que la mano en relación 7.2 / 5.3 en hembras; márgenes internos de los dedos profundamente festoneados. Distribución. Estados Unidos: Sur de California y Sureste de Arizona; México: Noroeste de Baja California, Noreste de Sonora. 1/4 1/4 62 1/4 1/4 Figura 22. Especies del género Paruroctonus presentes en el estado de Sonora, los números representan la clave del municipio donde se tienen registros. Barra de escala 1 cm. Género Pseudouroctonus Stahnke, 1972 Género formado por 12 especies con distribución en Norte América. Diagnosis. El opérculo genital está completamente dividido en el macho, pero solo el tercio posterior está dividido en la hembra. El margen interior superior del dedo móvil queliceral tiene cuatro dentículos, de los cuales el segundo es mucho más grande que el tercero; el margen interno inferior tiene de cuatro a siete dentículos bien desarrollados. El margen inferior del dedo fijo tiene dos o tres dentículos relativamente grandes. El borde interno del dedo móvil del pedipalpo lleva una fila continua de pequeños gránulos denticulados, divididos en filas más cortas por cuatro gránulos denticulados grandes y está flanqueado por cinco gránulos interiores grandes más dos grandes en el extremo distal; diente terminal no en forma de garra. No presenta dientes supernumerarios. Pseudouroctonus apacheanus Gertsch y Soleglad, 1972 Toxicidad. 1/4, especie de baja toxicidad. Diagnosis. Longitud promedio de aproximadamente 25 mm con algunas hembras alcanzando 35 mm; coloración bastante uniforme de marrón oscuro a marrón, con todas las carenas más oscuras. Tubérculo del ojo medio colocado en frente del medio del carapacho; en ambos sexos, carapacho densamente provisto de gránulos de tamaño mediano; margen frontal con seis setas cortas; emarginación frontal poco redondeada. Ojos medios pequeños, 0,19 mm., Separados por diámetro completo. Quela de robustez media, con el dedo móvil algo más corto que la mano; mano más estrecha, no inflada en el lado interno. Carena superior prominente, crenulada a ligeramente granulada; todas las demás carenas granuladas. Flancos internos del dedo fijo, seis, del dedo móvil, siete. Superficie inferior interna del dedo móvil queliceral con 4 a 7 dentículos bien desarrollados y 2 a 3 dentículos bien desarrollados en la superficie inferior del dedo fijo. 63 Estigmas respiratorios alargados ovoides. Conteo de dientes pectinales con promedio de 10 para las hembras, 11 para los machos; margen inferior del dedo móvil del quelícero esencialmente liso. Distribución. Estados Unidos: Montañas del sur de Arizona, Nuevo México y el oeste de Texas; México, áreas serranas al este de Sonora. Pseudouroctonus santarita Ayrey y Soleglad, 2015 Toxicidad. 1/4, especie de baja toxicidad. Diagnósis. Especie pequeña de 24–29 mm de longitud en adultos. Coloración, la mitad posterior del carapacho y mesosoma naranja-marrón; caparazón anterior medio oscuro marrón. Metasoma marrón oscuro con carenas más oscuras; telson naranja. Pedipalpos de color marrón oscuro con carenas más oscuras. Metasoma fornido, segmentos III – V, proporción longitud / ancho 0.95– 1.00, 1.22–1.32 y 2.16– 2.22 en los machos, 0.90–0.95, 1.18–1.23 y 2.05–2.12 en las hembras. Segmentos metasomales IV-V anchos a relación de longitud de dedo fijo 0.86– 0.93 y 0.84–0.85 en machos, 0.83–0.86 y 0.79–0.83 en hembras; dedo fijo cuenta con 46-50 dientes medianos (MD) para machos y 47-53 para hembras. Distribución. Estados Unidos: Sur de Arizona, Montañas Santa Rita; México: se han recolectado especímenes muy cerca de la frontera con Sonora por lo que se cree que se pueda encontrar en algunas localidades del estado. 1/4 1/4 Figura 23. Especies del género Pseudouroctonus presentes en el estado de Sonora, los números representan la clave del municipio donde se tienen registros. Barra de escala 1 cm. Género Serradigitus Stahnke, 1974 Género formado por 19 especies, con distribución desde el oeste de América del Norte, en hábitats rocosos desde California hasta Texas y hacia el sur hasta la península de Baja California y el territorio continental de México. 64 Diagnosis. Los dedos fijos y móviles de la quela terminan en dentículos agrandados, con forma de garra; el dedo fijo de la quela lleva una fila de dentículos primarios aserrados continuos, no subdivididos o subdivididos en dos o tres secciones por dentículos ligeramente agrandados. El dedo móvil del quelícero muestra una serrula bien desarrollada en el aspecto ventrodistal; las hembras poseen de uno a tres dientes pectinales proximales que están alargados o más hinchados que los demás y sin área sensorial; todas las especies de Serradigitus tienen distintas capas blanquecinas, en la punta de los dedos de la quela. Serradigitus hearnei Williams, 1980 Toxicidad. 1/4, especie de baja toxicidad. Diagnosis. Adultos de 18 a 26 mm de largo. Color base marrón amarillento con ligeras marcas oscuras en el dorso. Conteo de dientes pectinales 16-19 en machos, 13-17 en hembras. Metasoma: segmentos I-II más anchos que largos; III casi tan largo como ancho; V 1.70-1.83 veces más largo que ancho; carenas ventromedianas en I-II ausentes a débiles, lisas; en III débiles, lisas; en IV irregularmente crenuladas; segmento V con espacios intercarenales moderadamente granulosos. Pedipalpos: longitud / ancho del fémur mayor que 3.55; dedo fijo de la quela con hilera primaria de dentículos dividida en dos o tres secciones; hilera primaria de dentículos de dedo fijo flanqueado por seis gránulos accesorios internos; dedo fijo con tricobotrias ib y it ambas distales al sexto gránulo accesorio interno; proporción longitud / ancho de quela 4.40-4.60; longitud de dedo móvil / ancho de la quela 2.80-3.00. Distribución. Conocido desde Trinidad hasta Loreto a lo largo de la costa del Golfo de California en Baja California y en varias islas del Golfo en Sonora. Serradigitus yaqui Sissom y Stockwell, 1991 Toxicidad. 1/4, especie de baja toxicidad. Diagnosis. Adultos de unos 20 mm de longitud. Color base marrón anaranjado a marrón amarillo con ligeras marcas oscuras en carapacho y terguitos. Conteo de dientes pectinales 16-17 en machos, 13-15 en hembras. Metasoma: segmentos I-III claramente más anchos que largos, con III largo / ancho 0.74- 0.94 veces más largo que ancho; V 1.80 veces más largo que ancho en los machos, 1.44-1.59 veces en las hembras; segmento V con espacios intercarenales densos, gruesos granulares. Pedipalpos: relación longitud / ancho del fémur 3.06-3.47; dedo fijo con hilera primaria dividida en tres o cuatro secciones, seis gránulos accesorios internos que flanquean la hilera primaria; tricobotrias ib a nivel del sexto gránulo accesorio interno, it ligeramente basal al quinto. Quela largo / ancho 4.23-4.67. Longitud del dedo móvil / longitud del carapacho 0,92 1,08; longitud de dedo móvil / ancho de la quela 2.74-3.09. Distribución. Sonora. Conocido desde Guaymas, Bahía de San Carlos al sur de San Pedro. 65 1/4 1/4 Figura 24. Especies del género Serradigitus presentes en el estado de Sonora, los números representan la clave del municipio donde se tienen registros. Barra de escala 1 cm. Género Smeringurus Haradon,1983. Pequeño género formado por cuatro especies se distribuye principalmente en México y el suroeste de los Estados Unidos. Está estrechamente relacionado con el género Paruroctonus, del que anteriormente se consideraba un subgénero. Diagnosis. Especies con numerosas setas cortas en las superficies intercarenales ventrales de los segmentos metasomales I-IV; las setas entre las membranas ventrales metasomales I-IV totalizan 20 o más en adultos y juveniles, 10 o más en juveniles con carapacho de 4 .0-5.0 mm de largo, cinco o más en inmaduros con carapacho de 2.5-3.9 mm de largo. Todos los segmentos metasomales más largos que anchos, excepto en estadios muy tempranos; segmento III largo / ancho en machos adultos mayor de 2.0, en hembras adultas mayores de 1.90, en juveniles de ambos sexos mayores de 1.70. Smeringurus mesaensis Stahnke, 1957 Toxicidad. 2/4, especies moderadamente toxicas. Diagnosis. Adultos de 80 mm de longitud; coloración general amarillenta, Prosoma: amarillento con pigmentación roja alrededor de los ojos medianos; terguitos lisos excepto en el segmento VII donde los gránulos están bien desarrollados. Cola: amarillenta con numerosas setas rojas en el lado ventral; machos adultos con dedos de los pedipalpos débilmente festoneados; las patas 1 y 2 carecen de cerdas grandes en la mitad de la longitud del basitarso a lo largo de la hilera retrolateral inferior de espinas; nueve o más setas retrolaterales muy largas en una fila pareja en el basitarso del tercer par de patas; 10 a 14 pares de setas ventrolaterales en el segmento metasomal V; carenas ventrales en segmentos metasomales I-III 66 ausentes o lisas; telson altura / ancho segmento metasomal V, menos de 0 .96. Conteo de dientes pectinales 23-25 en hembras, 32-39 en machos. Distribución. Áreas abiertas del desierto, principalmente arena eólica; Estados Unidos: California y Arizona; México: costa noreste de Baja California y noroeste de Sonora. 2/4 Figura 25. Especies del género Smeringurus presentes en el estado de Sonora, los números representan la clave del municipio donde se tienen registros. Barra de escala 1 cm. Género Stahnkeus Soleglad y Fet,2006. Género formado por cinco especies, antes incluidas en el género Serradigitus. Distribución. México; Baja California y Sonora; Estados Unidos: Arizona y California. Diagnosis. Estrechamente relacionado con el género hermano Serradigitus, del cual se puede distinguir por el siguiente carácter sinapomórfico (derivado): los dedos de la quela exhiben un número irregular de dentículos accesorios internos (IAD), el número aumenta durante el desarrollo ontogenético; el número de ID + IAD depende de la especie y varía de 6 a 18 y de 8 a 20 para los dedos fijos y móviles, respectivamente. Stahnkeus allredi Sissom y Stockwell 1991 Toxicidad. 1/4, especie de baja toxicidad. Diagnosis. Adultos de 20-25 mm de largo. Color base marrón amarillento, con ligeras marcas oscuras en carapacho y terguitos. Hembras con dos dientes pectinales proximales en cada peine, sin sensilia; diente proximal un poco más alargado que los otros. Segmentos metasomales I-II claramente más anchos que largos; III 0.89-1.03 veces más largo que ancho; V 1.71-1.94 veces más largo que ancho. Carena ventrolateral en I-IV débiles a crenuladas. Carenas ventrales submedianas en I-IV débiles, granulares. Pedipalpo: dedo fijo con hilera primaria dividida en cuatro secciones; seis a 11 gránulos accesorios internos en dedo fijo, nueve a 11 en dedo móvil. Tricobotrias ib y it situadas en un tercio basal del dedo fijo. Proporción longitud de la quela / ancho de la quela 3.79-4.18 en machos, 4.88 5.00 en hembras; longitud del dedo móvil / longitud del carapacho 0.97- 1.09; longitud de dedo móvil / ancho de la quela 2.52-2.71 en machos, 3.22-3.33 en hembras. Conteo de dientes pectinales 15-17 en machos, 14-16 en hembras. Distribución. Estados Unidos: Sur de Arizona; México: Norte y Centro de Sonora. 67 Stahnkeus polisi Sissom y Stockwell 1991 Toxicidad. 1/4, especie de baja toxicidad. Diagnosis. Adultos 30-40 mm de largo. Color base amarillo marrón a marrón, con débiles marcas dorsales oscuras; segmentos metasomales IV y V más oscuros que los segmentos anteriores; pedipalpos generalmente más oscuros que el cuerpo. Las hembras con diente proximal en cada peine más alargado, angular y carente de sensilia; segundo diente ligeramente hinchado, elíptico y sin sensilia. Segmentos metasomales I-II más anchos que largos, III-IV 0.94-1.00 veces más largos que anchos; V 1.80-1.94 veces más largo que ancho. Carena ventrolateral moderada, crenulada. Carena ventral submediana en I débil, lisa o con crenulaciones posteriores; II-IV moderadas, crenuladas a aserradas; relación longitud / ancho de quela 3.33 en machos, 3.90-4.83 en hembras. Quela del pedipalpo con el dedo fijo con tres o cuatro secciones de dentículos; siete a nueve gránulos accesorios internos a lo largo del margen dentado del dedo fijo quela; ocho a 11 en el dedo móvil. Tricobotrias ib y it del dedo fijo de la quela situadas cerca del dedo. Longitud del dedo móvil / ancho de quela de 2.18 en machos, 2.55-3.30 en hembras. El conteo de dientes pectinales 18 en holotipo macho, 15-21 en las hembras. Distribución. Se registran solo en el área de bahía de Kino y la Isla tiburón en Sonora. Stahnkeus subtilimanus Soleglad, 1972 Toxicidad. 1/4, especie de baja toxicidad. Diagnosis. Adultos de hasta 45 mm de longitud. Color general marrón a marrón oscuro con quelas marrón rojizo oscuro y segmentos metasomales distales; marcas oscuras subyacentes variables presentes. Carapacho densamente granular, especialmente en el margen anterior. Metasoma con carenas submedianas ventrales lisa, en I, crenulada débilmente en II, aserrada en III-V, segmentos II-III más largos que anchos; V 1.80-2.00 veces más largo que ancho. Pedipalpos: dedo fijo de la quela con fila primaria dividida en dos secciones; tricobotrias ib y it ubicadas cerca de la mitad del dedo; nueve a 15 (generalmente alrededor de 12) gránulos accesorios internos presentes en los dedos de la quela. Quela largo / ancho 4.805.50; dedo móvil claramente más largo que el carapacho; longitud del dedo móvil / ancho de la quela mayor que 3.10. Distribución. Conocido desde el río Colorado al sur de California y el sur de Arizona en los Estados Unidos; en México en el noreste de Sonora. 1/4 68 1/4 1/4 Figura 26. Especies del género Stahnkeus presentes en el estado de Sonora, los números representan la clave del municipio donde se tienen registros. Barra de escala 1 cm. Género Uroctonites Williams y Savary, 1991 Género pequeño formado por cuatro especies, se distribuyen en Arizona y California en los Estados Unidos y al Norte de Sonora en México. Diagnosis. Los miembros de este género se distinguen de otros vaejovidos por la presencia de una hilera de setas espiniformes gruesas a cada lado de la hilera ventromediana de espinas telotarsales. Tales sedas espiniformes están ausentes en otros vaejovidos. Se distingue de los miembros de Uroctonus por la falta de dentículos distintos en el margen ventral del dedo móvil de los quelíceros, por la presencia de solo dos tricobotrias en la superficie ventral del pedipalpo, por la proximidad relativa de los pares de tricobotrias et/est y eb1 / eb2, y por la terminación lineal de la carena ventromediana segmento V metasomal. Uroctonites huachuca Gertsch y Soleglad, 1972 Toxicidad. 1/4, especie de baja toxicidad. Diagnosis. Alacrán de tamaño promedio en adultos de 30 mm. Coloración general amarillo pálido, con carenas de pedipalpos y metasoma pigmentados de forma oscura en contraste con el color del cuerpo más claro. Patas y telson amarillo claro. Juveniles enteramente de color amarillo pálido hasta etapas subadultas; tubérculo del ojo medio colocado bien en frente de la parte media del carapacho; dedos de la quela fornidos y proporcionalmente más cortos en comparación con la mano; margen inferior del dedo móvil del quelícero crenulada, con unos pocos dientes pálidos, pero sin dientes oscuros; carenas laterales inferiores y medianas de segmentos basales del metasoma granuladas. conteo de dientes pectinales con un promedio de ocho para las hembras y nueve para los machos. Distribución. Sur de Arizona (Montañas de Santa Rita y Huachuca) y noroeste de Sonora. 69 1/4 Figura 27. Especies del género Uroctonites presentes en el estado de Sonora, los números representan la clave del municipio donde se tienen registros. Barra de escala 1 cm. Género Vaejovis Koch,1836 Es el género con el mayor número de especies para la familia Vaejovidae y la mayor distribución, desde el sur de los Estados Unidos, México y norte de Guatemala. Este género ha presentado varios problemas taxonómicos a lo largo de la historia, con respecto al número de especies incluidas y, por tanto, a su caracterización morfológica. De acuerdo con la clasificación propuesta por Sissom (2000) el género Vaejovis está subdividido en 5 grupos: eusthenura, intrepidus, mexicanus, nitidulus y punctipalpi; pero Gonzales-Santillan y Prendini (2013) revisaron la clasificación de la familia mediante análisis filogenéticos restringiendo el género Vaejovis a tres grupos: grupo “vorhiesi”, grupo “mexicanus” y grupo “Franckeus + nigrescens”. Actualmente el género está formado por 67 especies. Diagnosis. Debido a la marcada diferencia de características entre las especies este género no existe una diagnosis practica del género, la mayoría de las veces se utilizan caracteres plesiomórficos para diagnosticarlos o realizan una diagnosis comparativa. Grupo “Franckeus + nigrescens” Vaejovis decipens Hoffmann, 1931 Toxicidad. 1/4, especie de baja toxicidad. Diagnosis. Longitud total 50-60 mm. Color base marrón oscuro a marrón rojizo oscuro con marcas oscuras subyacentes variables. Metasoma con segmentos I-III más largos que anchos; V 2.2-2.5 veces más largo que ancho. Carenas ventrales submedianas en I ausente a débil, lisa; en II-IV débil, lisa con finas serraciones posteriores. Carena ventrolateral del metasoma moderada, débilmente granular. Quela del pedipalpo con carena digital de la mano lisa; carena ventrointerna débilmente granular; carena dorsointerna fuerte, con gránulos afilados y agrandados; festoneado de los dedos de la quela distintos en el macho. Quela del dedo fijó con la fila principal dividida en seis secciones, la del dedo móvil con siete secciones; tricobotrias ib y it situadas en la base extrema del dedo fijo. 70 Quela delgada con dedos largos, longitud / ancho de quela 4.3-4.8; longitud del dedo móvil / longitud del carapacho 1.1-1.3; dedo móvil largo / quela ancho 2.8 3.2. Conteo de dientes pectinales 22-25 en machos, 21-22 en hembras. Distribución. Conocido en la región de Batopilas en el sur de Chihuahua y en las montañas del sur y centro de Sonora. Vaejovis mauryi Capes 2001 Toxicidad. 1/4, especie de baja toxicidad. Diagnosis. Alacrán pequeño, de adultos alcanzan 36 mm. Color base del carapacho y tergüitos de color amarillo-marrón a naranja-marrón con un patrón oscuro subyacente. Área interocular oscuramente pigmentada. Metasoma naranja claro a naranja oscuro. presencia de granulación en el espacio intercarenal mediano ventral; carenas digitales secundarias y externas de las quelas más débiles que los otros representantes del grupo; ausencia de setas en la quela, metasoma y esternito VII; las carenas dorsolaterales son crenuladas. Conteo de dientes pectinales 17-17 en hembras. Distribución. Conocido solo en la localidad tipo en las cercanías de Mazatan, Bacanora y Soyopa en el estado de Sonora, México. Grupo “mexicanus” Vaejovis montanus Graham & Bryson, 2010. Diagnosis. Especie pequeña, con las hembras ligeramente más grandes que los machos (hasta aproximadamente 34,2 mm para las hembras). Color base marrón con manchas más oscuras en el carapacho, patas, tergüitos y metasoma. Machos con un área de pigmentación reducida en el esternito V. Posee los siguientes criterios del grupo ‘‘mexicanus’’: opérculo genital de hembras dividido en 1/5 posterior; dedo fijo igual o más largo que el ancho de la mano; carena ventral interna de la mano variable, desde ausente hasta bien desarrollada; tricobotrias ib e it de la quela se encuentra proximalmente en el dedo fijo, no en la mano; margen anterior del carapacho cóncavo, pero no profundamente bilobulado. Se distingue aún más de todos los otros vaejovidos en la siguiente combinación de caracteres: conteo de dientes pectinales 11-13; 7 dentículos ID en el dedo móvil del pedipalpo y 6 en el dedo fijo. Distribución. Conocido solo por la localidad tipo en el sur de Chihuahua y por El Horquetudo cerca de Yecora, Sonora, México. Toxicidad. Especie moderadamente toxica 2/4. Grupo “vorhiesi” Vaejovis bandido Graham et al., 2012. Diagnosis. Especie pequeña con un tamaño en los adultos de 25 mm en promedio, con machos más pequeños que las hembras. Color base marrón con manchas más oscuras en el carapacho, tergüitos, pedipalpos, metasoma y patas. Carenas medianas de tergüitos I - VII ausentes. Tricobotrias de la quela ib e it se encuentra en la base del dedo fijo; margen anterior del carapacho ligeramente emarginado. Dentículos ID del dedo fijo con 5 dentículos en el dedo móvil ID con 6; con un par de espínulas distales en la superficie ventral de los tarsos de patas. Las hembras adultas se distinguen de otras especies del género por: ancho de mano de 71 1.05–1.28; longitud del segmento metasomal V / longitud del segmento I, 2.34–2.45. Longitud de la mano de la quela / ancho de la mano, 2.10–2.16. Segmento metasomal V largo / ancho, largo del carapacho / ancho de la mano 3.00– 3.17. Conteo de dientes pectinales 13–14 en machos y 11–12 en hembras. Distribución. Conocido solo por la localidad tipo en la Sierra de los Ajos del norte de Sonora, México Toxicidad. Especie moderadamente toxica 2/4. Vaejovis islaserrano Barrales Alcalá et al.,2018. Diagnosis. Especie relativamente pequeña, con una longitud total en adultos que varía de 18 mm a 24 mm; coloración: coloración general amarillo pálido, con un patrón negro en el margen distal de las quelas. Pertenece al grupo "vorhiesi" debido a la presencia de los siguientes caracteres: la presencia de un tapón de apareamiento esclerotizado en el espermatóforo; tricobotria ib - sobre la base del dedo fijo de la quela; ausencia de setas en los lados prolateral y retrolateral en el primer par de patas. Esternito V con una notable mancha ovalada blanquecina en la quinta parte posterior, también presente en el esternito VII. Vesícula del telson, aproximadamente dos veces más larga que ancha (largo / alto: 2.44), y delgada, casi tan ancha como profunda (alto / profundo: 1.12). Dedo de los pedipalpos con márgenes dentados rectos, sin festonear. Distribución. Esta especie es conocida de algunas localidades en las elevaciones más altas de la Sierra La Mariquita y Sierra La Elenita en Sonora, México. Toxicidad. Especie moderadamente toxica 2/4. Vaejovis patagonia Ayrer, 2018. Diagnosis. Pequeños escorpiones (26 mm). El color es marrón oscuro, más claro en las patas, con motas subyacentes en el carapacho y el mesosoma. Dedo móvil del pedipalpo con 6 dentículos de ID y en el dedo fijo 5, similar a la mayoría de los miembros del sur del grupo "vorhiesi" de Arizona. El caparazón de la hembra es más corto que el quinto segmento metasomal. Conteo de dientes pectinales para las hembras 13.15. Machos adultos desconocidos. Tubérculo subaculear ausente. Distribución. Montañas Patagonia, Condado de Santa Cruz, Arizona, Estados Unidos; y en algunas localidades fronterizas en el norte de Sonora. Toxicidad. Especie moderadamente toxica 2/4. Vaejovis pequeno Hendrixson, 2001. Diagnosis. Especie pequeña de longitud promedio en adultos de 19.85 mm, Color base naranja-amarillo a naranja con patrón oscuro subyacente. Mesosoma con una franja longitudinal medial distinta. Posee carenas débiles, granulares, dorsales marginales y dorsointernas en las quelas del pedipalpo en los machos ; el lóbulo interno de la cápsula hemispermatofórica sin púas; los quelíceros con una serrula fuertemente desarrollada ; un par de espinas distales que flanquean la hilera de espinas ventromediana de los tarsos; segmento V del metasoma con carena ventral submediana de granular a débil; proporción de longitud / ancho del fémur pedipalpo 2,82; longitud del carapacho / longitud del segmento V metasomal 1.00, longitud del dedo fijo / longitud del carapacho 0.59 . Conteo de dientes pectinales 12-13 en machos y 11-13 en hembras. Distribución. Conocido solo en algunas localidades de Sonora en la región Central y sureste del estado. Toxicidad. Especie moderadamente toxica 2/4. 72 1/4 1/4 1/4 1/4 1/4 73 1/4 1/4 Figura 28. Especies del género Vaejovis presentes en el estado de Sonora, los números representan la clave del municipio donde se tienen registros. Barra de escala 1 cm. 5. 2. Diversidad de especies en el área del malpaís. Se encontraron para el área de El Malpaís un total de cinco especies; de estas una nueva para la ciencia, distribuidas en tres familias de las cinco presentes para el estado (tabla VII) lo que representa el 12.5% de las especies listadas para el estado en este trabajo y el 1.6% a nivel nacional. Tabla VII. Especies de alacranes presentes en el área de El Malpaís. * especies endémicas Familia Buthidae Koch, 1837 Diplocentridae Karsh,1880 Vaejovidae Stahnke, 1940 Género Especie lauriadnae* Ponce-Saavedra & Francke 2019 sculpturatus Ewing, 1928 Diplocentrus Peters,1861 leptomanus* sp.nov. Kochius Soleglad y Fet, 2008 sonorae Williams, 1971 Paravaejovis Williams, 1980 spinigerus Wood,1863 Centruroides Marx,1890 Centruroides lauriadnae Ponce-Saavedra y Francke,2019 Toxicidad. 3/4, especie toxica, probablemente causa daño serio. Diagnosis. Longitud de los adultos entre 35 y 46 mm. Coloración típica de un alacrán “rayado”, con el carapacho fuertemente pigmentado y el patrón del subgrupo “infamatus”; dorsalmente ocre y ventralmente amarillo muy claro, con metasoma y patas amarrillo más claro. Pedipalpos con coloración ligeramente más clara y débilmente infuscados. Conteo de dientes pectinales de 23-25 (moda 24) en macho y poco más bajo en hembras 21-24 (moda 22). Carenas metasomales moderadas a bien desarrolladas y granulares a excepto en el segmento V del macho. Vesícula alargada, con tubérculo subaculear cónico y ubicado cerca de la base del aguijón. 74 Distribución. Conocida solo en el área de El Malpaís, Sonora, México por lo que se consideran una especie micro endémica, de hábitos lapidícolas, especifica a sustrato de basalto. Se encontró en dos de las cuatro localidades muestreadas Centruroides sculpturatus Ewing, 1928 Toxicidad. 4/4, la mayoría de los casos reportados por intoxicación por picadura de alacrán de importancia médica para la zona se atribuyen a esta especie. Diagnosis. Longitud 52 mm. Color general marrón amarillento. No hay rayas dorsales, manchas u otras marcas de color. carapacho sin color dorsal; surco mediano pronunciado; tegumento granular. Quelas delgadas, dedos aproximadamente una vez y media más largos que la mano. Sobre la parte posterior del carapacho hay un par de quillas longitudinales, tuberculadas, que se extienden hacia adelante desde el margen posterior aproximadamente a la mitad de la distancia a los ojos medios. Mesosoma muy grueso granular arriba; cada tergüito con un margen posterior tuberculoso más o menos claramente elevado y una quilla mediana bien desarrollada. Metasoma más largo que el mesosoma; segmento I aproximadamente dos veces más largo que ancho, tubérculo subaculear poco desarrollado, ubicado relativamente alejado de la base del aguijón. Dientes pectinales de 24- 28 en machos y 22- 24 en hembras. Distribución. La mayoría de los especímenes recolectados se encontraron en zona urbana, del total de los especímenes colectados solo el 20 % (n=30) fue encontrado bajo rocas, bajo troncos, o en oquedades del suelo por lo que es considerada una especie lapidícola (Prendini, 2001), adaptada a varios tipos de hábitat. Se encontró en todas las localidades muestreadas. Diplocentrus leptomanus sp.nov. Toxicidad. 2/4, especie de moderada toxicidad. Diagnosis. Especie mediana, los adultos llegan a medir de 36 a 38 mm de longitud total; color castaño. Quelíceros con el dedo fijo más corto que el ancho de la quela, dedo móvil igual o menor al ancho de la quela. Mesosoma largo y esbelto. Patrón de tricobotrias tipo C (Ortobotriotaxia tipo C). Fémur de los pedipalpos más anchos que altos, patela con un ancho igual a la altura. Quelas aproximadamente tres veces más largas que anchas. Dientes pectíneos: machos 12- 15 (moda 14), hembras 10-12 (moda 11). Formula global de sedas espiniformes telotarsales: 5/5: 5-6/6: 6/7: 7/7. Distribución. Sonora. Actualmente solo se conoce exclusivamente en el área de El Malpaís que se encuentra entre los municipios de Moctezuma, Divisaderos y Tepache Sonora. El hábitat y habitus corresponden al ecomorfotipo pelófilo (Prendini,2001) como como el de la mayoría de las especies del género Diplocentrus. Solo se encontró en una de las cuatro localidades muestreadas. Paravaejovis spinigerus (Wood, 1863) Toxicidad. 1/4, especie con baja toxicidad. Diagnosis. Adultos de aproximadamente 70 mm de longitud. Color base marrón amarillo claro con marcas oscuras subyacentes variables en carapacho y tergüitos; posiciones de las carenas submedias, ventrolaterales y ventrales del metasoma de color negro. Conteo de dientes pectinales 22-27 en machos, 16-22 en hembras. Metasoma robusto; segmento V generalmente más ancho y profundo que el III en adultos. Carenas ventrales del metasoma, débiles, lisas; carenas ventrales submedianas ausentes. 75 Quelas; mano lisa, sin carenas notables; dedo fijo con tricobotria ib dirigida al sexto gránulo accesorio interno. Proporción quela largo / ancho 3.2-3.7; longitud de dedo móvil / ancho de la mano 2.0-2.3. Distribución. Es la especie de mayor distribución para el área y la más abundante, ya que se encontró en todas las localidades muestreadas. Kochius sonorae (Williams, 1971) Toxicidad. 1/4, especie con baja toxicidad. Diagnosis. Adultos de aproximadamente 30 mm de longitud. Color base amarillo marrón con color oscuro variable marcas en carapacho y terguitos. Conteo de dientes pectinales en machos de 14-16; en hembras 14-15. Metasoma muy esbelto con segmento V longitud-ancho 2.4-2.5; carenas ventrolaterales y ventral submedianas bien desarrolladas, crenuladas a aserradas. Quela del pedipalpo robusta, con una proporción quela longitud/ ancho 2.8-3.1 y dedo móvil longitud quela- ancho 1.6-1.7; dedos cortos, con la longitud del dedo móvil alrededor de 0,8. Carenas de la mano bien desarrolladas, granulosas en los machos, granulares en las hembras; dedo fijo con tricobotria ib e it ambas ligeramente basales. Distribución. En la zona de El Malpaís, es encontrada en mayor abundancia en zonas cercanas a arroyos, ríos y zonas de agricultura, generalmente bajo rocas o troncos, encontrándose solo en una de las localidades muestreadas. 3/4 4/4 1/4 76 1/4 1/4 Figura 29. Especies de alacranes presentes en el área de El Malpaís. Los mapas muestran los puntos de recolecta de cada una de las especies recolectadas para el área. Barra de escala 1 cm 5.3. Distribución de las especies del estado de Sonora La zona de mayor distribución para el estado es la zona norte donde se registran 24 especies, su mayoría en la zona desértica y serrana del estado. Once especies se registran como endémicas en su mayoría en las islas del cielo. La familia Buthidae Koch, 1837 se distribuye en casi toda la extensión territorial del estado, siendo Centruroides sculpturatus Ewing, 1928 la especie de esta familia con el mayor número de registros; las otras especies de la familia solo se registran en muy pocos localidades o sustratos específicos como es el caso de C. lauriandae Ponce-Saavedra, 2019. La familia Diplocentridae Karsch, 1880 se distribuye en su mayoría en la zona serrana del Norte del estado, la especie de mayor distribución es Diplocentrus spitzeri Stahnke, 1970 con registros en la zona serrana central de estado. La familia Caraboctonidae Kraepelin, 1905 solo se registra en la zona noreste del estado en la región desértica y costa. La familia Superstitionidae con solo un representante Superstitonia donensis Stahnke, 1940 se distribuye principalmente 77 en la región noreste del estado, aunque se tiene registro en los municipios de Hermosillo e Ímuris al Centro y Norte del estado. Por último, la familia Vaejovidae la más diversa presenta una distribución en casi toda la extensión territorial teniendo ejemplares en todo tipo de hábitat incluyendo las islas. La especie con más registros para esta familia es Paravaejovis spinigerus Wood, 1863. 5.4. Distribución de las especies de El Malpaís Las especies de la zona presentan una distribución agrupada debido a la heterogeneidad del medio; la localidad de mayor diversidad fue la de El Malpaís donde se colectaron cuatro de las cinco especies registradas para la zona solo no se encontró Kochius Sonorae Williams, 1971. La especie de mayor abundancia para esta localidad es Centruroides lauriadnae Ponce-Saavedra, 2019 la cual es endémica para la zona junto a D.leptomanus sp.nov. En el Rancho Los Mimbres se presentaron tres de las cinco especies: C.sculpturatus Ewing, 1928; K.sonorae y Paravejovis spinigerus Wood, 1963 siendo esta ultima la más abundante. Para la zona centro de El Malpaís en la cual la abundancia de rocas de basalto es muy poca y en la Volanta se encontraron tres especies: C.sculpturatus; K.sonorae y P.spinigerus, de igual manera que en Rancho Los Mimbres es la más abundante. Según la clasificación de ecomorfotipos propuestos por Prendini (2001) para los alacranes en el área de estudio se distribuyen dos ecomorfotipos (tabla VIII). Tabla VIII. Ecomorfotipos de las especies presentes en El Malpaís. Género Especie Ecomorfotipo Microhábitat Centruroides lauriadnae Lapidícola Bajo rocas de basalto, muy rara vez se encuentra en otro tipo de roca. Bajo troncos sculpturatus Lapidícola Bajo rocas, troncos u otros objetos. Diplocentrus leptomanus sp.nov Pelófilo Galerías baja rocas de basalto Kochius sonorae Lapidícola Bajo rocas o troncos cercanos a áreas húmedas. Paravaejovis spinigerus Lapidícola Bajo rocas, troncos o cualquier otro objeto. 78 5.5. Especies de importancia médica De la totalidad de las especies listadas para el estado solo tres son consideradas como especies que pueden generar problemas graves de salud, representan el 7.5% de las especies listadas para el estado. Solo Centruroides sculpturatus Ewing, 1928 se reporta con toxicidad de 4/4. Cuatro se consideran como especies que pueden generar daños, por lo que las 33 especies restantes no se consideran como especies que generen intoxicación. Tabla IV. Grado de toxicidad para los géneros y especies registrados en el estado de Sonora. Las especies sombreadas corresponden a las especies consideradas de importancia médica. Género Centruroides Marx,1890 Diplocentrus Karsch, 1880 Hadrurus Thorell, 1876 Superstitionia Stahnke, 1940 Chihuahuanus González Santillán y Prendini, 2013 Gertschius Graham y Soleglad 2007 Paravaejovis Williams, 1980 Kochius Soleglad y Fet, 2008 Pseudouroctonus Stahnke, 1974 Paruroctonus Werner, 1934 Serradigitus Stahnke, 1974 Smeringurus Haradon,1983 Stahnkeus Soleglad y Fet,2006 Uroctonites Williams y Savary, 1991 Vaejovis Koch,1836 Especie edwardsii Gervais, 1843 lauriadnae* Ponce-Saavedra y Francke,2019 pallidiceps Pocock, 1902 sculpturatus Ewing, 1928 gertschi Sissom y Walker, 1992 leptomanus* sp nov spitzeri Stahnke, 1970 peloncillensis Francke, 1975 williamsi* Sissom y Wheeler, 1995 arizonensis Ewing, 1928 arizonensis donensis Stahnke,1940 russelli (Williams, 1971) agilis (Sissom y Stockwell,1991) crassicorpus* Graham y Soleglad,2007 confusus (Stanhke,1940) spinigerus (Wood, 1863) colluvius Ayrey et al., 2019 sonorae*(Williams, 1971) apacheanus Gertsch y Soleglad, 1972 santarita Ayrey y Soleglad, 2015 baergi (Williams y Hadley, 1967) borregoensis Williams, 1972 borregoensis Williams, 1972 stahnkei Gertsch y Soleglad, 1966 xanthus Gertsch y Soleglad, 1966 hearnei Williams, 1980 yaqui* Sissom y Stockwell, 1991 Mesaensis (Stahnke,1957) allredi (Sissom y Stockwell 1991) polisi* (Sissom y Stockwell, 1991) subtilimanus (Soleglad, 1972) huachuca (Gertsch y Soleglad, 1972) bandido* Graham et al., 2012 decipiens Hoffmann, 1931 islaserrano* Barrales-Alcalá et al.,2018 mauryi* Capes, 2001 montanus Graham y Bryson, 2010 patagonia Ayrey, 2018 pequeno* Hendrixson, 2001 Toxicidad 2/4 3/4 3/4 4/4 1/4 1/4 1/4 1/4 1/4 2/4 2/4 1/4 1/4 1/4 1/4 1/4 1/4 1/4 1/4 1/4 1/4 1/4 1/4 1/4 1/4 1/4 1/4 1/4 2/4 1/4 1/4 1/4 1/4 1/4 1/4 1/4 1/4 1/4 1/4 1/4 79 VI. Discusiones 6.1. Diversidad de alacranes en sonora Se reportan 40 especies para el estado de Sonora, por lo que este trabajo contribuye con nueve nuevos registros para el estado y una nueva especie para la ciencia. Esta diversidad de especies coloca a Sonora como el tercer estado de mayor diversidad de alacranes solo por debajo de Oaxaca con 48 especies y Baja California Sur con 40 (Ponce- Saavedra y Francke, 2016). La familia con mayor riqueza es la familia Vaejovidae Thorell,1876 con 27 especies, seguida de la familia Diplocentridae Karsch, 1880 con cinco, lo que concuerda a nivel nacional (Ponce-Saavedra, et al., 2016). El estado presenta una gran diversidad de especies gracias a la variedad de ecosistemas los cuales incluyen una multitud de tipos de vegetación, ecotonos y alta diversidad relacionados con la gran variabilidad climática, edáfica y topográfica de la región; desde los manglares, dos tipos de matorral espinoso y el Desierto Sonorense, con cuatro de sus siete subdivisiones, al bosque tropical caducifolio, los pastizales, los encinares y los bosques de pino-encino y mixtos de coníferas en las áreas de mayor elevación. 6.2. Diversidad de alacranes en el área de El Malpaís Se encontraron para el área un total de cinco especies, lo que aumenta el número de especies reportadas en las bases de datos; esta diversidad coloca a la región del Malpaís como una región de alta riqueza de especies de alacranes teniendo más que la totalidad de especies listadas para los estados de México, con cinco especies, Campeche con cuatro, Tabasco y Tlaxcala con una especie (PonceSaavedra y Francke, 2016). La diversidad de la zona es gracias a sus características tanto topográficas como ecológicas ya que la variedad de condiciones permite una mayor diversidad, encontrándose no solo una gran variedad de alacranes si no de plantas y animales lo que en conjunto convierte a El Malpaís en un lugar de alta biodiversidad. 80 Son pocos los grupos taxonomicos que han sido estudiados en la zona; de los conocidos en los últimos años han sido reportadas como nuevas especies para la ciencia un total de cuatro: una especie de planta de la familia Asteraceae, una especie de insecto perteneciente al orden Blattodea, género Arenivaga, especie A. moctezuma Hopkins, 2012, y dos alacranes: Centruroides lauriadnae PonceSaavedra, 2019 y Diplocentrus leptomanus sp.nov., por lo que esta zona se vuelve un área de oportunidad para futuros estudios. 6.3. Distribución de las especies en el estado de Sonora La familia Buthidae Koch, 1837 está representada por el género Centruroides Marx 1980 y cuatro especies; son especies lapidícolas, registrándose en gran parte de la extensión territorial. Centruroides edwardsii Gervais, 1843 es una especie registrada recientemente, considerada como una especie introducida antes solo registrada en el estado de Sinaloa, pero se tienen registros más al norte en Sonora por lo que podría convertirse en una especie invasora. La familia Caraboctonidae representada por dos especies pertenecientes al género Hadrurus Thorell 1876 es la familia con los representantes de mayor tamaño para el estado se distribuyen originalmente en las áreas del gran desierto de altar y la zona del pinacate, sin embargo al ser especies de atractivo visual son utilizadas como mascotas lo que hace posible encontrarlas fuera de su distribución original por lo que al ser liberadas pueden convertirse en especies invasoras que compitan con las especies locales. La familia Diplocentridae Karsch, 1880 está representada por el género Diplocentrus Peters 1891 y cinco especies, una de estas nuevas para la ciencia, en el estado presentan una mayor distribución y abundancia en zonas de encinos y bosque de encino-pino con elevaciones mayores a 1500 msnm, pero es posible encontrarlos en zonas de menor elevación y vegetación del tipo matorral espinoso y selva baja como es el caso de D. leptomanus sp.nov y D. williamsi Sissom y Wheeler, 1995, estas dos últimas endémicas para el estado. 81 El género Diplocentrus se caracteriza por poseer especies de tipo Pelófilo por lo que es muy poco probable encontrarlos dentro de hogares o cerca de estos. La especie de mayor distribución para el estado es D. spitzeri Stahnke, 1970 encontrándose en la mayoría de las zonas serranas del norte y centro del estado. La familia Superstitionidae Stahnke, 1940 es la más pequeña del estado representada por un género y una especie Superstitionia donensis Stahnke, 1940, en México solo se distribuye en los Estados de Sonora y Baja California. En el estado se registra principalmente en la zona desértica al noreste del estado. Por último, la familia Vaejovidae Thorell, 1876 es la más diversa del estado con 27 especies y 10 géneros; se distribuyen por toda la extensión del estado siendo P. spinigerus Wood, 1863 la especie más abundante. El género Vaejovis Koch, 1836 representa el género más diverso con siete especies, se caracterizan por ser especies de baja distribución específicas a cierto tipo de hábitat en su mayoría de tipo bosque de encino y bosque de pino por lo que presentan alto grado de endemismo como es el caso de V. islaserrano Barrales- Alcalá et al., 2018 y V. bandido Graham et al., 2012 ambos endémicos para la zona serrana en la reserva de los Ajos y sierra la Elenita y la Mariquita al norte de Sonora. 6.4. Distribución de las especies de El Malpaís. La familia Vaejovidae Thorell, 1863 está representada por Paravaejovis spinigerus Wood 1863 y Kochius sonorae williams 1971, es la familia de mayor riqueza y abundancia por tener representantes en mayor cantidad de localidades. P. spinigerus es la especie que se recolecto en más localidades, es una especie lapidícola (Prendini, 2001) lo que le permite adaptarse a diferentes tipos de hábitat. Estos resultados concuerdan a nivel nacional al ser la familia Vaejovidae la más diversa para México (Ponce-Saavedra et al., 2019). La familia Buthidae Koch, 1837 está representada por el género Centruroides Marx 1890 y dos especies; C. lauriadnae Ponce-Saavedra y Francke 2019 y C. sculpturatus Ewing 1928, siendo C. sculpturatus la recolectada en mayor número de localidades. Al igual que P. spinigerus, C. sculpturatus es una especie lapidícola lo que le permite establecerse 82 en más sitios ya que no tiene afinidad aparente a ningún tipo de sustrato, solo se encontró que su abundancia disminuye en las zonas de basalto donde se encuentra C. lauriadnae, posiblemente atribuido a que su color lo hace más vulnerable a ser depredado de tal forma que su abundancia disminuye. C. lauriadnae es una especie de hábitos lapidícolas específica para el sustrato de tipo basáltico (origen volcánico) por lo que es muy poco común ser encontrada en otro tipo de sustrato convirtiéndola en una especie micro endémica; aunque se encontraron ejemplares en la zona urbana son atribuidos a la extracción de roca volcánica y material maderable de la zona los cuales pueden transportar a los alacranes. Por lo tanto, la familia Diplocentridae Karsch, 1880 es la familia con el menor número de representantes, con solo el género Diplocentrus Peters 1891 y la especie D. leptomanus sp. nov., la cual es nueva para la ciencia, es la segunda especie de alacrán reportada como endémica para la zona, es una especie Pelófila con afinidad a la zona de basalto por lo que su distribución está restringida a este sustrato. Es la segunda especie de alacrán reportada como endémica para el área lo que convierte a El Malpaís como un lugar importancia biológica por el alto grado de endemismo y especiación que presenta. 6.5. Especies de importancia médica De las 40 especies listadas para el estado solo siete se consideran que puedan generar daños a la salud, sin embargo, la toxicidad establecida para cada especie se basa en artículos de otras especies de similitud taxonómica por lo que es posible que algunas especies presenten más toxicidad pero sin causar daños considerables comparados a los daños que pueden generar otras especies de la familia Buthidae Koch, 1837 la cual es considerada la única familia de importancia médica para el estado con cuatro representantes dos de ellos de distribución restringida por lo que no se vuelven un problema a nivel estatal, la especie de mayor peligro dada su distribución y su toxicidad es Centruroides sculpturatus Ewing, 1928 registrándose en más del 60% de la extensión territorial del estado por que los casos de intoxicación por picadura de alacrán se atribuyen a esta especie. 83 VII. Conclusiones 7.1. Diversidad de especies en Sonora Un total de cinco familias, 15 géneros y 40 especies tres de ellas con estatus subespecífico y una nueva para la ciencia son registradas para el estado de Sonora, se reportan 11 especies listadas como endémicas y Centruroides edwardsii Gervais, 1843 se reporta como especie introducida. La alta diversidad de especies del estado concuerda con la alta diversidad en otros grupos taxonómicos tanto de plantas como animales. Es importante mencionar que los registros de las especies se basan en artículos anteriores, de tal modo que realizar más muestreos se vuelve importante para conocer si las especies se encuentran aún, o en que estatus se encuentran, porque en muchas de ellas no se tienen registros actuales ni imágenes en los últimos años, como es el caso de Vaejovis mauryi Capes, 2001 y Diplocentrus gertschi Sissom y Walker, 1992 esta última solo ha sido registrado una sola vez para Sonora y la localidad tipo se encuentra en Nayarit y Jalisco por lo que posiblemente se trate de una mala identificación. Este estudio permitió aumentar los registros de especies para el estado, sin embargo, muchos municipios y localidades se encuentran sin registros lo que ocasiona que posiblemente haya nuevas especies por conocer, así pues se vuelve importante seguir con más trabajos enfocados en conocer la diversidad no solo de alacranes si no de otros grupos ya que en Sonora no se cuenta con suficientes estudios enfocados en conocer la biodiversidad de estado. 84 7.2. Diversidad de especies en El Malpaís Un total de cuatro géneros y cinco especies se distribuyen en la región del Malpaís; una nueva para la ciencia y dos son endémicas para la zona, convirtiendo a El Malpaís como un lugar de alta diversidad por sus características haciendo importante que se realicen más estudios enfocados en conocer su riqueza. 7.3. Distribución de las especies del estado de Sonora El estado presenta una mayor distribución y abundancia en la zona desértica y serrana al norte del estado con registro de más del 50 % de las especies listadas para el estado. La familia de mayor distribución en la familia Vaejovidae Thorell, 1876 con almenos una especie para cada municipio. Paravaejovis spinigerus Wood, 1863 es la especie considerada con el mayor rango de distribución seguida de Centruroides sculpturatus Ewing, 1928. 7.4. Distribución de las especies de El Malpaís En El Malpaís se encontraron que las especies presentan una distribución agrupada donde las condiciones son más aptas para su establecimiento, se encontraron dos ecomorfotipo en las especies; Paravaejovis spinigerus Wood, 1863 y Centruroides sculpturatus Ewing, 1928 son las especies de mayor rango de distribución; dos especies son micro endémicas para la zona, Centruroides lauriadnae Ponce-Saavedra y Francke, 2019 y Diplocentrus leptomanus sp.nov., adaptadas a la topografía de origen volcánico basáltico de la zona. 7.5. Especies de importancia médica Siete de las 40 especies para el estado se consideran que puedan generar daños a la salud, de estas Centruroides sculpturatus Ewing, 1928 es la considerada de mayor riesgo por sus características. Son pocos los estudios sobre la caracterización del veneno de los alacranes de tal forma que su estudio se vuelve importante en especial en la familia Buthidae Koch, 1837. 85 VII.Bibliografía Arizona Scorpion World. Richard Ayrey. http://www.azscorpion.com/Sonora.html. Armas, L. F. y Martín-Frías E. 2008. El género Centruroides Marx, 1890 (Scorpiones: Buthidae) en el estado de Veracruz, México. Boletín de la Sociedad Entomológica Aragonesa (S.E.A.), 43: 7–22. Ayrey, R y Soleglad, M. 2015. New Analysis of the Genus Pseudouroctonus with the Description of Two New Species (Scorpiones: Vaejovidae). Euscorpius. 211. 1-55. Ayrey, R. 2018. A New Species of Vaejovis from the Patagonia Mountains, Southern Arizona (Scorpiones: Vaejovidae). Euscorpius. 262. Ayrey, R., Lawrence J., y Myers, B. 2019. A new species of Kochius from Avra Valley, southern Arizona (Scorpiones: Vaejovidae) Euscorpius. 2019. Barrales-Alcalá D.A., Francke O.F., Van Devender T.R., y Contreras-Félix G.A. 2018. A new Sky Island species of Vaejovis C. L. Koch, 1836 from Sonora, Mexico (Scorpiones, Vaejovidae). ZooKeys 760: 3753. https://doi.org/10.3897/zookeys.760.22714. Bellmann, H. y Maier. 1994. Arácnidos, Crustáceos y Miriápodos: artrópodos europeos y de la península Ibérica (excepto insectos) Guías de naturaleza Blume. Barcelona. Blume. Brito-Castillo, L., M.A. Crimmins y S.C. Díaz C. 2010. Clima. En: F.E. Molina-Freaner y T.R. Van-Devender, eds. Diversidad biológica de Sonora. UNAM, México, pp. 73-96. Brownell P.H. y Polis G. 2001. Scorpion Biology and Research. New York Oxford University press; pp.431. Camacho-Ibarra, J.A., Reyes-González, E.C., Sánchez-Ocampo., E.M. y Hernández-Cabrera, J.P. 2004. Intoxicación por picadura de alacrán: Experiencia del Hospital Militar Regional de Acapulco, Gro. Rev Sanid Milit Mex; 58(4). Pp.284-289. Castrezana S.J. 2010. Artrópodos terrestres no-hexápodos. En: F.E. Molina-Freaner y T.R. Van Devender, eds. Diversidad biológica de Sonora. UNAM, México, pp. 293-314. Catterall, W. A. 1976. Purification of a Toxic Protein from Scorpion Venom Which Activates the Action Potential Na+ Ionophore. The Journal of Biological Chemistry, 251 (18): 5528-5536. Cloudsley, J.L.1990. Scorpions in Mythology, Folklore, and History. PP 222-233. En: The Biology of Scorpions, G.A. Polis (eds). Stanford University Press, Stanford, California. 587 pp Coddington, J.A., Giribet, G., Harvey, M.S., Prendini, L. y Walter, D.E. 2004. Arachnida. pp.296-318 En: Cracraft, J y Donoghue (Eds) Assembling the Tree of Life. Oxford University Press, Oxford. Inglaterra. CONABIO. 2009. Sintesis Capital Natural de México, Conocimiento Actual, Evaluación Prespectivas de Sustentabilidad. Comisión nacional para el conocimiento y uso de la Biodiversidad.https://www.biodiversidad.gob.mx/pais/pdf/CapNatMex/Capital%20Natur al%20de%20Mexico_Sintesis.pdf Conde, R., Zamudio, F. Z., Rodríguez, M. H. y Possani, L. D. 2000. Scorpine, an antimalaria and anti-bacterial agent purified from scorpion venom. FEBS letters, 471, (2-3): 165-168. Cowles, J. 2018. Amazing Spiders. Princeton University Press, New Jersey. pp 328. 86 de Roodt, A.R. 2015. Veneno de escorpiones (alacranes) y envenenamiento. Acta Bioquímica Clínica Latinoamericana, 49 (1): 55-71 Dennell, R. 1975. The structure of the cuticle of the scorpion Pandinus imprrafor (Koch). Zoological Journal of the Linnean Society. 56,249-254. Ewing, H.E. 1928. The scorpions of the western part of the United States with notes on those occurring in northern Mexico. Proceedings of the United States National Museum, vol. 73, n. 9, p. 1-24. Fabricius. 1775. Systema entomologiae, sistens insectorum classes, ordines, genera, species, adiectis, synonymis, locis descriptionibus observationibus. Flensburg and Lipsiae. Farley, R. 2001. Structure, Reproduction, and Development. pp 13-78. En: Scorpion Biology and Research, Brownell P.H. y Polis G. (eds). Stanford University Press, Stanford, California. 587 pp Fet, V. y Soleglad M. E., 2005. Contributions to scorpion systematics. I. On recent changes in high-level taxonomy. Euscorpius, 31:1-13. Fet, V., Sissom, W. D., Lowe G., y Braunwalder, M. E. 2000. Catalog of the scorpions of the World (1758– 1998). The New York Entomological Society. pp 690. Filshie, B.K. y Hadley N.F. 1979. Fine structure of the cuticle of the dessert scorpion, Hadrurus arizonensis. TISSUE & CELL 11 (2) 249-26. Francke, O. F. y J. Ponce. 2005. A new species of Diplocentrus (Arachnida: Scorpiones) from Michoacán, Mexico. Revista Mexicana de Biodiversidad 76:49–53 Francke, O.F y Prendini, L. 2008. Phylogeny and classification of the giant hairy scorpions, Hadrurus Thorell (Iuridae Thorell): A reappraisal. Systematics and Biodiversity 6. Systematics and Biodiversity. 6. 205 - 223. Francke, O.F. 1975. A new species of Diplocentrus from New Mexico and Arizona (Scorpionida, Diplocentridae). Journal of Arachnology, vol. 2, n. 2, p. 107-118. Francke, O.F. 1981. Birth behavior and life history of Diplocentrus spitzeri Stahnke (Scorpiones: Diplocentridae). The southwestern Naturalist 25(4): 517-523. Francke, O.F. 1982. Studies of the scorpion subfamilies Superstitioninae and Typhlochactinae, with description of a new genus (Scorpiones, Chactoidea). Bulletin of the Texas Memorial Museum, n. 28, pp 51-61. Gertsch y Soleglad. 1966. Scorpions of the Vejovis boreus group (subgenus Paruroctonus) in North America. American Museum Novitates, n. 2278, p. 1-54. Gertsch y Soleglad. 1972. Studies of North American scorpions of the genera Uroctonus and Vejovis. Bulletin of the American Museum of Natural History, n. 148, p. 549–608. Gertsch y Soleglad. 1972.Studies of North American scorpions of the genera Uroctonus and Vejovis. Bulletin of the American Museum of Natural History, n. 148, p. 549–608. Gertsch, W. J. y Allred, D. M. 1965. Scorpions of the Nevada Text Site. Brigham Young Univ. Sci. Bull., Biol. Ser., 6 :1-15. Gervais. 1843. Les principaux résultats d'un travail sur la famille des Scorpions. Société Philomatique de Paris. Extraits des Procès-Verbaux des Séances, vol. 5, n. 7, p. 129– 131. Gonzales-Santillan. 2004. Diversidad, taxonomía y hábitat de alacranes. pp 25-35, en García Aldrete, A. N. y R. Ayala (Eds). 2004. Artrópodos de Chamela. Instituto de Biología, UNAM. Mexico. 87 González Santillán y Prendini. 2013.Redefinition and generic revision of the North American vaejovid scorpion subfamily Syntropinae Kraepelin, 1905, with descriptions of six new genera. Bulletin of The American Museum of Natural History, no 382, p. 1-71. Gonzalez- Santillan, E. 2001. Catcilogo de escorpiones de la Coleccwn Nacional de Arcicnidos (CNAN). Tesis de licenciatura. Facultad de Ciencias, Universidad N acional Autonoma de Mexico, Mexico, D. F. pp 145. Goyffon, M. 2010. Blood or haemolymph of Scorpions. pp 101-110. En: Stockmann, R., Ythier, E. & Fet, V.(eds). Scorpions of The World. Verrières-le-Buisson: N.A.P. Editions. pp 565. Graham y Bryson. 2010.Vaejovis montanus (Scorpiones: Vaejovidae), a new species from the Sierra Madre Occidental of Mexico. Journal of Arachnology, vol. 38, n. 2, p. 285-293. Graham y Soleglad. 2007. A New Scorpion Genus Representing a Primitive Taxon of Tribe Stahnkeini, with a Description of a New Species from Sonora, Mexico (Scorpiones: Vaejovidae). Euscorpius, n. 57, p. 1–13. Graham y Soleglad. 2007. A New Scorpion Genus Representing a Primitive Taxon of Tribe Stahnkeini, with a Description of a New Species from Sonora, Mexico (Scorpiones: Vaejovidae). Euscorpius, n. 57, p. 1–13. Graham, Ayrey y Bryson. 2012. Multivariate methods support the distinction of a new highland Vaejovis (Scorpiones: Vaejovidae) from the Sierra de los Ajos, Mexico. Journal of Arachnology, p. 40, n. 3, p. 281-290. Haradon. 1983. Smeringurus, a new subgenus of Paruroctonus Werner (Scorpiones, Vaejovidae). Journal of Arachnology, vol. 11, n. 2, p. 251–270. Haradon. 1984. New and redefined species belonging to the Paruroctonus borregoensis group (Scorpiones, Vaejovidae). Journal of Arachnology, vol. 12, n. 3, p. 317-339. Hendrixson. 2001. A new species of Vaejovis (Scorpiones, Vaejovidae) from Sonora, Mexico. Journal of Arachnology, vol. 29, n. 1, p. 47-55. Hibner, T. 1971. The Scorpions of Joshua Tree National Monument. Master’s thesis, Cal. State Univ, Long Beach. Hjelle, J.T. 1990. Anatomy and Morphology. pp. 9-63. En: The Biology of Scorpions, G.A. Polis (eds). Stanford University Press, Stanford, California. 587 pp Hoffmann. 1931. Monografias para la Entomología Medica de Mexico. Monografia num. 2. Los Scorpiones de Mexico. Primera parte Diplocentridae, Chactidae, Vejovidae. Anales del Instituto de Biología Mexico, vol. 2, n. 4, p. 291-408. Jędrzejowska I., Szymusiak K., Mazurkiewicz-Kania M., y Garbiec.A. 2016. Scorpion katoikogenic ovariuterus - Much more alike to apoikogenic type than it seemed to be. Arthropod Struct Dev. ;45(5):488-495 Kamenz, C., J.A. Dunlop, y G. Scholtz. 2005. Characters in the book lungs of Scorpiones (Chelicerata, Arachnida) revealed by scanning electron microscopy. Zoomorphology 124: 101–109. Karmenz, C y Prendini, L. 2008. An atlas of book lung fine structure in the order Scorpiones (Arachnida). Bulletin of the American Museum of Natural History, no. 316. Karsch, K. 1880. Arachnologische blätter. X. Scorpionologische fragmente. Z. Gess. Naturw. Halle, 53: 404-409. Koch, 1837. Scorpionen. Übersicht des Arachnidensystems. Nürnberg, C.H. Zeh'sche Buchhandlung, p. 36–40. Koch. 1836. Die Arachniden. Nürnberg, Dritter Band, p. 1-104. 88 Koch. 1837. Scorpionen. Übersicht des Arachnidensystems. Nürnberg, C.H. Zeh'sche Buchhandlung, p. 36–40. Kraepelin, K. 1899. Scorpiones und Pedipali. En: K. Moebius, F. Dahl (Ed) Das Tierreich Heraesgegeben von der Deuts Zollogeischen Gesellschaft. Berlin R Friendlende en Sohn Verlag (Arachnoidea). pp 1-265. Kraepelin. 1905. Die Geographische Verbreitung der Scorpione. Zoologische Jahrbücher, Abtheilung für Systematik, vol. 22, n. 3, p. 321–364. Linné, C.V. 1758. Systema Naturae per regna tria naturae, secundum classes, ordines, genera, species, cum characteribus, dyfferentiis. Locis Ed 10 Holmiae Stockholm Laurentii Salvii, 1 821 pp. Lourenco, W.R y Sissom, W. D. 2000. Scorpiones. Pp. 115-135. En: Llorente, J., E. Gonzales y N. Papayero (Eds). Biodiversidad, taxonomía y biogeografía de artrópodos de México: Hacia una síntesis de su conocimiento. Universidad Nacional Autónoma de México. Lourenço, W.R. y Francke, O.F. 1985. Revision des connaissances sur les scorpions cavernicoles (troglobies) (Arachnida, Scorpions). Mém. Biospéol.. 12. 3-7. Lourenço, W.R.1997. Synopsis de la faune de scorpions de Colombie, avec des considérations sur la systématique et la biogéographie des espéces. Revue Suisse de Zoologie 104: 61-94. Madrean Archipelago Biodiversity Assestment, Sky Island Alliance. http://madrean.org/. Madrean Discovery Expeditions (MDE), GreaterGood.org. http://madreandiscovery.org/. Martínez-Yrízar, A., Felger, R.S. y Búrquez, A. 2010. Los ecosistemas terrestres: un diverso capital natural. En: F.E. Molina-Freaner y T.R. Van Devender, eds. Diversidad biológica de Sonora. UNAM, México, pp. 129-156. Mazurkiewicz, J.E y Bertke, E.M. 1972. Ultraestructura de la glándula venenosa del escorpión, Centruroides sculpturatus (Ewing). Journal of Morfology, 137 (3), 365– 383. doi: 10.1002 / jmor.1051370307 Molina-Freaner, F.E. y Van Devender, T.R. Diversidad biológica de Sonora. UNAM, México, pp. 293-314. Monod, L. y L. Prendini. 2015. Evidence for Eurogondwana: The roles of dispersal,extinction and vicariance in the evolution and biogeography of Indo-Pacifc Hormuridae (Scorpiones: Scorpionoidea). Cladistics. (En prensa) MOSIÑO A.P. y GARCÍA, E. 1981. The Variability of Rainfall in Mexico and its Determination by Means of the Gamma Distribution. Geografiska Annaler 63: 1-10 Naturalista, CONABIO. http://www.naturalista.mx Nentwig, W.1987. Ecophysology of Spiders. Springer-verlag, Berlin Heidelberg. pp 448. Ochoa, J.; Ojanguren, A.; MattonI, C.; Prendini, L. 2011. Systematic revision of the Andean scorpion genus Orobothriurus Maury, 1976 (Bothriuridae), with discussion of the altitude record for scorpions. Bulletin of the American Museum of Natural History 359: 1-90. Peters. 1861.Ueber eine neue Eintheilung der Skorpione und ueber die von ihm in Mossambique gesammelten Arten von Skorpionen, aus welchem hier ein Auszug mitgetheilt wird. Monatsberichte der Königlichen Preussischen Akademie der Wissenschaften zu Berlin, vol. 1861, no 1, p. 507–516. 89 Pocock. 1902. Arachnida. Scorpiones, Pedipalpi, and Solifugae. Biologia CentraliAmericana, Francis y Taylor, Londres, vol. 9, p. 1-71 Polis, G.A y Lourenço.W.R. 1986. Sociality among scorpions. In: Proceedings of the 10th International Congress of Arachnology, Jaca 1: 111-115. Polis, G.A. 1990. The Biology of Scorpions. Stanford University Press, Stanford, CA, 1990.Pp 587. Ponce-Saavedra, J., Francke, O. F. 2019. Una especie nueva de alacrán del género Centruroides (Scorpiones: Buthidae) del noroeste de México. Revista Mexicana de Biodiversidad. 90. 10.22201/ib.20078706e.2019.90.2660. Ponce-Saavedra, J., Francke, O. F., Quijano-Ravell, A. F. y Cortés-Santillán, R. 2016. Alacranes (Arachnida: Scorpiones) de importancia para la salud pública en México Folia Entomológica Mexicana (n. s.), 2, 45–70. Ponce-Saavedra, J., Francke, O.F. 2013. Clave para la identificación de especies de alacranes del género Centruroides Marx 1890 (Scorpiones: Buthidae) en el Centro Occidente de México.Biológicas , 15 (1): 52-62. Ponce-Saavedra, J., Francke, O.F., Suzán, H. 2006. Actividad superficial y utilización del hábitat por Centruroides balsasensis Ponce y Francke (Scorpiones: Buthidae). Biológicas, 8: 130-137. Possani, L.D. 2017. Veneno de alacrán, amigo de la salud. EL UNIVERSAL. https://www.eluniversal.com.mx/articulo/nacion/sociedad/2017/07/2/veneno-dealacran-amigo-de-la-salud. Possani, L-D., Merino, E, Corona, M., Bolívar, F. y Becerril, B. 2000. Peptides and genes coding for scorpion toxins that affect ion-channels. Biochimie 82 861-868 Prendini, L. 2001. Substratum specialization and speciation in southern African scorpions: the Effect Hypothesis revised. p. 113-138. In: Fet, V & P. A. Selden (Eds.). Scorpions 2001 In Memoriam Gary A. Polis. British Arachnological Society, London. 404 pp Prendini, L. y W. C. Wheeler. 2005. Scorpion higher phylogeny and classifcation, taxonomic anarchy, and standards for peer review in online publishing. Cladistics 21(5): pp 446-494. Prendini. 2012. Scorpions. American Museum of Natural History. Recuperado el 3 de noviembre, 2019 de http://research.amnh.org/users/lorenzo/PDF/Prendini.2012.pdf Ramírez-Arce, D. 2015. Uso del hábitat y actividad superficial del escorpión Centruroides margaritatus en el Parque Nacional Palo Verde, Guanacaste, Costa Rica. Cuadernos de Investigación UNED . 2015, vol.7, n.2, pp.279-286. Real Academia Española. 2019. Recuperado el 20 de septiembre, 2019 de https://dle.rae.es. Rein, J.O. 2019. The scorpion files. Trondheim: Norwegian University of Science and Technology. Recuperado el 22 de octubre, 2019 de https://www.ntnu.no/ub/scorpionfiles/ Ribera, I., Melic, A. y Torralba, A. 2015. Revista IDE@ - SEA, nº 2. 1-30. Recuperado el 25 de octubre, 2019. http://www.sea-entomologia.org. Root, T.M. 1990. Neurobiology. pp. 167-199. En: The Biology of Scorpions, G.A. Polis (eds). Stanford University Press, Stanford, California. 587 pp Ruppert, E.E y Barnes, R.D. 1996. Zoología de los invertebrados. México, DF: McGraw-Hill Santibañez-Lopez, C.E., González-Santillán, E., Monod, L. y Sharma, P.P. 2019. Phylogenomics facilitates stable scorpion systematics: Reassessing the relationships of 90 Vaejovidae and a new higher-level classification of Scorpiones (Arachnida). Molecular Phylogenetics and Evolution Volume 135, Pp.22-30. Santibáñez-López, C.E.; Francke, O.F., Prendini, L. 2014. Kolotl, n. gen. (Scorpiones: Diplocentridae), a New Scorpion Genus from México. American Museum novitates 3815. Servicio Meteorológico Nacional. 2010. Acceso el 25 de octubre de 2019 en http://smn.cna.gob.mx/es/ Sharma, P.P., Fernández, R., Esposito, L.A., González-Santillán, E., Monod, L. 2015. Phylogenomic resolution of scorpions reveals multilevel discordance with morphological phylogenetic signal. Proc. Biol. Sci. 282, 20142953. https://doi.org/10.1098/rspb.2014.295. Sissom & Walker. 1992. A new species of Diplocentrus from western Mexico (Scorpiones, Diplocentridae). Southwestern Naturalist, vol. 37, n. 2, p. 126-131. Sissom y Stockwell. 1991. The genus Serradigitus in Sonora, Mexico, with descriptions of four new species (Scorpiones, Vaejovidae). Insecta Mundi, vol. 5, n. 3/4, p. 197-214. Sissom y Wheeler. 1995. Scorpions of the genus Diplocentrus (Diplocentridae) from Sonora, Mexico, with description of a new species. Insecta Mundi, vol. 9, n. 3/4, p. 309316. Sissom, W. D. 1990. Systematics, biogeography and paleontology. In G. A. Polis (ed.), Biology of scorpions, pp. 64-160. Stanford, California: Stanford University Press. Sissom, W.D y Hendrixson, B.E. 2006. Scorpion biodiversity and patterns of endemism in northern Mexico. Pp 122-137. En: Cartron, J.LE. y G. Ceballos (Eds.) Biodiversity, Ecosystems and Conservation in northern Mexico. Oxford University Press. Oxford. Inglaterra. Soleglad y Fet. 2006. Contributions to scorpion systematics. II. Stahnkeini, a new tribe in scorpion family Vaejovidae (Scorpiones: Chactoidea). Euscorpius, n. 40, p. 1-32. Soleglad, M. E. y V. Fet. 2008. Contributions to scorpion systematics. III. Subfamilies Smeringurinae and Syntropinae (Scorpiones: Vaejovidae). Euscorpius 71:1-115. Soleglad, M.E y Fet, V. 2003. Sistemática de alto nivel y filogenia de los escorpiones existentes (Scorpiones: Orthosterni). Euscorpius.n. 11.pp. 1-175. Soleglad. 1972. Two new scorpions of the wupatkiensis group of the genus Vejovis (Scorpionida: Vejovidae). Wasmann Journal of Biology, vol. 30, n. 1/2, p. 179-195. Stachel, S.J., Stockwell, S.A. y VanVranken, D.L. 1999. The fluorescence of scorpions and cataractogenesis. Chem. Biol., 6: 531-539. Stahnke, H. L. 1970. Scorpion nomenclature and mensuration. Entomological News, 81, 297–316. Stahnke. 1940. The scorpions of Arizona. Iowa State College Journal of Science, vol. 15, n. 1 p. 101–103. Stahnke. 1957. A new species of scorpion of the Vejovidae, Paruroctonus vachoni. Entomological News, vol. 72, n. 8, p. 206-212. Stahnke. 1968. Some diplocentrid scorpions from Baja California del Sur, Mexico. Proceedings of the California Academy of Sciences, vol. 35, n. 14, p. 273–320 Stahnke. 1970. Diplocentrus spitzeri, a new Arizona species of scorpion. Entomological news, vol. 81, n. 1, p. 25-32. Stahnke. 1974. Revision and keys to the higher categories of Vejovidae (Scorpionida). Journal of Arachnology, vol. 1, n. 2, p. 107–141. 91 Stockmann, R. 2013. Introduction a Scorpion Biology and Ecology. En: Gopalakrishnakone P., Ferroni Schwartz E., Possani L., Rodríguez de la Vega R. (eds) Scorpion Venom. Springer, Dordrecht Stockmann, R. E. Ythier. y Fet, V. 2010. Scorpions of the world. Verrières-le-Buisson: N.A.P. Editions Teurel, R. y Melic, A. 2015. Clase Arachnida Orden Scorpiones. Revista IDE-SEA,18, 1-17. Recuperado el 20 de octubre,2019. http://www.sea-entomologia.org. Thorell, T. 1876. On the classification of Scorpions Annals and Magazine of Natural History,4 (17). Pp 1-15. Vachon, M. 1963. De lutilié, en systematic, dune nomenclature de chelicéres chez les Scorpions Bulletin du Muséum National d Histoire Naturalle,35 (2). Pp 161-166. Vachon, M. 1974. Études des caractères utilisés pour classer les familles et les genres des scorpions (Arachnides). 1. La trichobothriotaxie en arachnologie. Sigles trichobothriaux et types de trichobothriotaxie chez les Scorpions. Bulletin du Muséum national d’Histoire naturelle, 3e série, 140 Zoologie, 104, pp 857–958. Vega-Granillo, E.L.; Cirett-Galán, S; De la Parra-Velasco, M.L.; y Zavala-Juárez, R.2011. Hidrogeología de Sonora, México, En: Calmus, Thierry, ed., Panorama de la geología de Sonora, México: Universidad Nacional Autónoma de México, Instituto de Geología, Boletín 118, cap. 8, p. 267–298 Wankhede, R.A. 2004. Extraction, Isolation, Identification and Distribution of Soluble Fluorescent Compounds from the Cuticle of Scorpion (Hadrurus arizonensis). (Tesis de maestria). Marshall University. Huntington, Virginia. Werner. 1934. Scorpiones und Pedipalpi. Arachnoidea, Klassen und Ordnungen des Tierrichs, p. 1–316. William y Savary. 1991. Uroctonites, a new genus of scorpion from western North America (Scorpiones: Vaejovidae). Pan-Pacific Entomologist, vol. 67, n. 4, p. 272-287. Williams S.C. 1970. A systematic revision of the giant hairy scorpion genus Hadrurus. Occasional Papers of the California Academy of Sciences 87:1-62 Williams y Hadley. 1967. Scorpions from the Puerto Penasco area (Cholla Bay), Sonora, Mexico with a description of Vaejovis baergi n.sp. Proceedings of the California Academy of Sciences, vol. 35, n. 4, p. 103-116. Williams. 1971. New and little-known scorpions belonging to the punctipalpi group of the genus Vaejovis from Baja California, Mexico, and adjacent area (Scorpionida: Vaejovidae). The Wasmann Journal of Williams. 1972. Four new scorpion species belonging to the genus Paruroctonus (Scorpionida: Vaejovidae). Occasional Papers of the California Academy of Sciences, n. 94, p. 1-16. Williams. 1980. Scorpions of Baja California, Mexico, and adjacent islands. Occasional Papers California Academy of Sciences, n. 135, p. 1-127. Wirkner, C.S y Prendini, L. 2007. Comparative Morphology of the Hemolymph Vascular System in Scorpions–A Survey Using Corrosion Casting, MicroCT, and 3DReconstruction. JOURNAL OF MORPHOLOGY 268:401–413 Wolf, H. 2017. Scorpions pectines e Idiosyncratic chemo- and mechanosensory organs. Arthropod Structure & Development 46. pp. 753-764 Wood. 1863. Descriptions of new species of North American Pedipalpi. Proceedings of the Academy of Natural Sciences in Philadelphia, vol. 1863, Pp. 107-112. 92 VIII. Anexos INDICE DE ANEXOS Anexo Contenido CLAVE TAXONÓMICA PARA LA IDENTIFICACIÓN DE FAMILIAS, GÉNEROS Y I II III ESPECIES DE ALACRANES DE LA REGIÓN DE EL MALPAÍS. DIVISIÓN MUNICIPAL DEL ESTADO DE SONORA CREDITOS DE FOTOGRAFIA Págs 94 96 97 ANEXO 1: CLAVE TAXONÓMICA PARA LA IDENTIFICACIÓN DE FAMILIAS, GÉNEROS Y ESPECIES DE ALACRANES DE LA REGIÓN DE EL MALPAÍS 1. Alacranes con las hileras de dientecillos de los dedos de la quela del pedipalpo, oblicuas e imbricadas; patela del pedipalpo sin tricobotrias en la cara ventral; esternón triangular. Familia Buthidae..…………….………………………………………………………….…….... 2 1’. Alacranes con las hileras de dientecillos de los dedos de la quela del pedipalpo formando una línea continua en la que las hileras se separan por dientecillos de mayor tamaño; patela del pedipalpo con tricobotrias en la cara ventral. Esternón pentagonal. Familia Diplocentridae………………….………………………………………………….…..…………. 3 2. Alacranes esbeltos de tamaño pequeño (20-30 mm de longitud total), medianos (50-70 mm) y grandes (80-100 mm o un poco más de longitud total); con 7, 8 o 9 hileras oblicuas de dientecillos en los dedos de la quela del pedipalpo, sin contar una pequeña hilera apical formada por 2-3 dientecillos peines con más de 11 dientes tanto en machos como en hembras terguitos con la superficie variable en granulación, desde lisa a granulosa, siempre con sólo una quilla media bien diferenciada; esternón de forma triangular . Centruroides Marx 1890 …………………………………………….…..…...………………………...………... 4 2’. Alacranes con ojos medios y laterales bien desarrollados y aparentes; Peines con fulcra, forma del carapacho y conteo de dientes pectinales variable ………………………………….……………………………………………………….……..…….5 3. Alacranes de talla variable (adultos de 2.5 a 15 cm), con las quelas de los pedipalpos muy desarrolladas y robustas; los telotarsos de las patas armados ventralmente con dos filas de sedas espiniformes; telson con un prominente tubérculo redondeado y sedoso bajo el aguijón; borde interno de los dedos de los pedipalpos con 6 secciones de gránulos. Diplocentrus……… ..……………………………………………………….……………………6 4.Longitud total de los adultos entre 35 y 46 mm. Coloración típica de un alacrán “rayado”, con el carapacho fuertemente pigmentado y el patrón del subgrupo “infamatus”: Tubérculo subaculear cónico y ubicado cerca de la base del aguijón Conteo de dientes pectinales de 23-25 en los machos y un poco más bajo 21-24, en hembras .…. Centruroides lauriandae. 4’ Longitud 52 mm. Color general marrón amarillento. No hay rayas dorsales, manchas u otras marcas de color. carapacho sin color dorsal; surco mediano pronunciado; tegumento 93 granular. tubérculo subaculear poco desarrollado, ubicado relativamente alejado de la base del aguijón. Dientes pectinales de 24- 28 en machos y 22- 24 en hembras …… ………………..……………………………………………………...Centruroides sculpturatus. 5. Patela del pedipalpo con tres o menos tricobotrias en la cara ventral; alacranes de tamaño mediano a pequeño (generalmente menos de 80 mm de longitud corporal), dedos de la quela del pedipalpo presentan cinco a siete hileras de gránulos medios: de hábitos variable. Familia Vaejovidae …………….……………………………………...……………………..…..7 6. Especie mediana, los adultos llegan a medir de 36 a 38 mm de longitud total; color castaño. Quelíceros con el dedo fijo más corto que el ancho de la quela, dedo móvil igual o menor al ancho de la quela. Quelas aproximadamente tres veces más largas que anchas; proporción entre quela largo / ancho: 2.78-3.43, quela largo / alto 4.05-4.89. Dientes pectíneos: machos 12-15 (moda 14), hembras 10-12 (moda 11). Formula telotarsal: 5/5: 56/6: 6/7: 7/7 ……….…...…………………………………………...Diplocentrus leptomanus. 7.Segmentos metasomales I – IV con carena ventromediana emparejada, dentículos basales OD ubicados basalmente o suprabasalmente en los dedos; tricobotrias de la quela ib – it, db – dt y eb – et colocados uniformemente sobre el dedo fijo, no en la mitad distal; segmentos metasómicos I – II generalmente tan anchos o más anchos que largos, relación longitud-ancho 0.67–1.08 (0.889) y 0.83–1.31 (1.051) para el hombre, y 0.67– 1.03 (0.813) y 0.77 –1,29 (0,94) para la hembra. Hoffmannius Soleglad y Fet, 2008……….……………8 7’. Borde anterior del caparazón con marcada emarginación continua que se origina en los ojos laterales, con una pequeña hendidura mediana; segmentos metasomales IV – V proporción longitud / ancho 1.7–2.2 (1.91) y 2.4–3.3 (2.75) en los machos, y 1.5–2.3 (1.83) y 2.3–3.5 (2.72) para las hembras; segmentos I-III metasomales con carena generalmente granulares a crenulados; carena de la quela generalmente granular a crenulada. Kochius Soleglad y Fet, 2008 ….…………………………….…….………………………………………9 8. Adultos de aproximadamente 70 mm de longitud. Color base marrón amarillo claro con marcas oscuras subyacentes variables en carapacho y tergitos; posiciones de las carenas submedias, ventrolaterales y ventrales del metasoma de color negro. Conteo de dientes pectinales 22-27 en machos, 16-22 en hembras. Metasoma robusto; segmento V generalmente más ancho y profundo que el III en adultos. Carenas ventrales del metasoma, débiles, lisas; carenas ventrales submedianas ausentes….…….. Hoffmannius spinigerus. 9. Adultos de aproximadamente 30 mm de longitud. Color base amarillo marrón con color oscuro variable marcas en caparazón y terguitos. Conteo de dientes pectinales en machos de 14-16; en hembras 14-15. Quela del pedipalpo robusta, con una proporción quela longitud/ ancho 2.8-3.1 y dedo móvil longitud quela- ancho 1.6-1.7; dedos cortos, con la longitud del dedo movible alrededor de 0,8……….….....….……………….Kochius sonorae. 94 ANEXO 2: DIVISIÓN MUNICIPAL DEL ESTADO DE SONORA. 1 Aconchi 26 Etchojoa 49 Quiriego 2 3 4 Agua Prieta Álamos Altar 27 70 28 Fronteras Gral Plutarco E. Calles Granados 50 51 52 Rayón Rosario Sahuaripa 5 Arivechi 29 Guaymas 53 San Felipe de Jesús 6 Arizpe 30 Hermosillo 72 San Ignacio Río Muerto 7 Atil 31 Huachinera 54 San Javier 8 Bacadéhuachi 32 Huásabas 55 San Luis Río Colorado 9 Bacanora 33 Huatabampo 56 San Miguel de Horcasitas 10 Bacerac 34 Huépac 57 San Pedro de la Cueva 11 Bacoachi 35 Imuris 58 Santa Ana 12 Bácum 21 La Colorada 59 Santa Cruz 13 Banámichi 36 Magdalena 60 Sáric 14 Baviácora 37 Mazatán 61 Soyopa 15 Bavispe 38 Moctezuma 62 Suaqui Grande 71 Benito Juárez 39 Naco 63 Tepache 16 Benjamín Hill 40 Nácori Chico 64 Trincheras 17 Caborca 41 Nacozari de García 65 Tubutama 18 Cajeme 42 Navojoa 66 Ures 19 Cananea 43 Nogales 67 Villa Hidalgo 20 Carbó 44 Onavas 68 Villa Pesqueira 22 Cucurpe 45 Opodepe 69 Yécora 23 Cumpas 46 Oquitoa 24 Divisaderos 47 Pitiquito 25 Empalme 48 Puerto Peñasco 95 ANEXO 3: Créditos de fotografías Alice Abela. Uroctonites huachuca Andrew Block. Centruroides edwardsii Chris Benesh. Paruroctonus stahnkei Fritz Geller. Hadrurus arizonensis pallidus Héctor Villa. Centruroides lauriadnae; C. sculpturatus; C. pallidiceps; Diplocentrus leptomanus; Jain Prakrit. Chihuahuanus russelli. Jay Keller. Paruroctonus xanthus; Stahnkeus subtilimanus. Kari Mcwest. Vaejovis decipens. M.Brummermann. Superstitionia donensis. Matthew R. Graham y Michael E. Soleglad. Gertschius crassicorpus. Michael Jacobi. Diplocentrus peloncillensis; Stahnkeus allredi. Richard Ayrey. Gertschius agilis; Kochius colluvius; Paruroctonus borregoensis; Pseudoroctonus santarita; Robyn Waayers. Paruroctonus baergi. Thomas, R. Vandevender. Diplocentrus williamsi; Pseudoroctonus apacheanus; Smeringurus mesaensis; Warren, E. Savary. Diplocentrus spitzeri. Hadrurus arizonensis arizonensis; Kochius sonorae; Paravaejovis confusus; P. spinigerus. Serradigitus yaqui; Stahnkeus polisi; Vaejovis patagonia. Vaejovis bandido; V. islaserrano; V. pequeno. 96