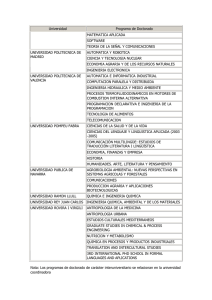
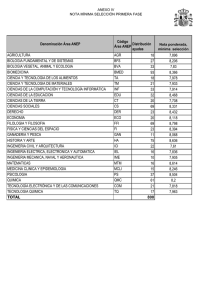
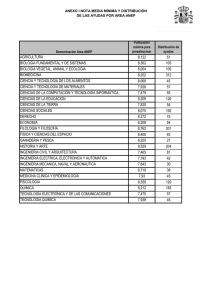
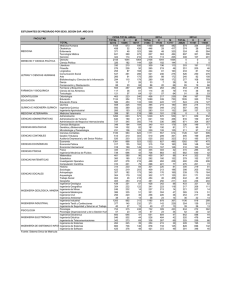
FACULTAD DE INGENIERÍA ESCUELA PROFESIONAL DE INGENIERIA DE SISTEMAS INFORME Nº 003 Y 004-2016 A : Ing. Pablo Aparicio Aya Arapa Docente de curso: Química I De : Orestes Ramirez Ticona Estudiante ASUNTO : LEY DE GASES Tacna – Perú 2016 QUIMICA GENERAL INGENIERIA DE SISTEMAS LEY DE GASES INDICE Contenido I. OBJETIVO........................................................................................................................... 3 II. FUNDAMIENTO TEORICO.................................................................................................... 3 III. PROCEDIMIENTO EXPERIMENTAL.................................................................................... 6 MATERIALES....................................................................................................................... 6 EXPERIMENTO Nº 1 ................................................................................................................... 9 COMPROBACION DE LA LEY DE BOYLE ........................................................................................ 9 REPORTE..................................................................................................................................15 GRAFIQUE................................................................................................................................16 INVESTIGACION........................................................................................................................17 EXPERIMENTO Nº 2 ..................................................................................................................21 COMPROBACION DE LA LEY DE CHARLES ...................................................................................21 REPORTE..................................................................................................................................24 GRAFIQUE................................................................................................................................25 INVETIGACION .........................................................................................................................26 IV. CONCLUSION ................................................................................................................28 V. RECOMEDACION ...............................................................................................................29 BIBLIOGRAFÍA ..........................................................................................................................29 ORESTES RAMIREZ TICONA 2 QUIMICA GENERAL I. INGENIERIA DE SISTEMAS OBJETIVO Visualizar y reconocer los materiales y equipos de laboratorio. Conocer la dependencia que existe entre el volumen ocupado por una masa gaseosa y su temperatura y también la dependencia que existe entre el volumen y la presión a la cual se somete el gas. Que el alumno conozca la dependencia que existe entre el volumen ocupado por una masa gaseosa y su temperatura y también la dependencia que existe entre el volume n y la presión a la cual se somete el gas II. FUNDAMIENTO TEORICO Todo en el Universo está formado por materia. La materia se puede encontrar en 3 estados de agregación o estados físicos: sólido, líquido y gaseoso. Para entender los diferentes estados en los que la materia existe, es necesario entender algo llamado Teoría Molecular cinética de la Materia. La Teoría Molecular cinética tiene muchas partes, pero aquí introduciremos sólo algunas. Uno de los conceptos básicos de la teoría argumenta que los átomos y moléculas poseen una energía de movimiento, que percibimos como temperatura. En otras palabras, los átomos y moléculas están en movimiento constante y medimos la energía de estos movimie ntos como la temperatura de una sustancia. Mientras más energía hay en una sustancia, mayor movimiento molecular y mayor la temperatura percibida. Consecuenteme nte, un punto importante es que la cantidad de energía que tienen los átomos y las moléculas (y por consiguiente la cantidad de movimiento) influye en su interacció n. ¿Cómo se producen estos diferentes estados de la materia? Los átomos que tienen poca energía interactúan mucho y tienden a "encerrarse" y no interactuar con otros átomos. Por consiguiente, colectivamente, estos átomos forman una sustancia dura, lo que llamamos un sólido. Los átomos que poseen mucha energía se mueven libremente, volando en un espacio y forman lo que llamamos gas. Los gases se forman cuando la energía de un sistema excede todas las fuerzas de atracción entre moléculas. Así, las moléculas de gas interactúan poco, ocasionalme nte chocándose. En el estado gaseoso, las moléculas se mueven rápidamente y son libres de circular en cualquier dirección, extendiéndose en largas distancias. A medida que la temperatura aumenta, la cantidad de movimiento de las moléculas individua les aumenta. Los gases se expanden para llenar sus contenedores y tienen una densidad baja. Debido a que las moléculas individuales están ampliamente separadas y pueden circular libremente en el estado gaseoso, los gases pueden ser fácilme nte comprimidos y pueden tener una forma indefinida. ORESTES RAMIREZ TICONA 3 QUIMICA GENERAL INGENIERIA DE SISTEMAS El comportamiento de todos los gases se ajusta a tres leyes, las cuales relacionan el volumen de un gas con su temperatura y presión. Los gases que obedecen estas leyes son llamados gases ideales o perfectos. En el siguiente informe estudiaremos la ley de Boyle y Mariotte y la ley de Charles y Gay-Lussac. ley general de los gases o ecuación general de los gases Las leyes parciales analizada precedentemente pueden combinarse y obtener una ley o ecuación que relaciones todas las variables al mismo tiempo. Según esta ecuación o ley general Esto significa que, si tenemos una cantidad fija de gas y sobre la misma variamos las condiciones de presión (P), volumen (V) o temperatura (T) el resultado de aplicar esta fórmula con diferentes valores, será una constante. Veamos un ejemplo, para aclarar: Supongamos que tenemos una cierta cantidad fija de un gas (n1 ), que está a una presión (P1 ), ocupando un volumen (V1 ) a una temperatura (T1 ). Estas variables se relacionan entre sí cumpliendo con la siguiente ecuación: Donde R es una constante universal conocida ya que se puede determinar en forma experimental. La misma fórmula nos permite calcular el volumen molar de un gas (n): A modo de experimento, a la misma cantidad fija de gas (n1 ) le cambiamos el valor a alguna de las variables tendremos entonces una nueva presión (P2 ), un nuevo volumen (V2 ) y una nueva temperatura (T2 ). Como ya conocemos le ecuación general colocamos en ella los valores de cada variable: Según la condición inicial: Según la condición final: Vemos que en ambas condiciones la cantidad de gas (n1 ) es la misma y que la constante R tampoco varía. Entonces, despejamos n1 R en ambas ecuaciones: 𝒏𝟏 𝑹 = 𝑷𝟏 ⋅ 𝒗 𝟏 𝑻𝟏 𝒏𝟏 𝑹 = 𝑷𝟐 ⋅ 𝒗 𝟐 𝑻𝟐 ORESTES RAMIREZ TICONA 4 QUIMICA GENERAL INGENIERIA DE SISTEMAS Marcamos con rojo n1 R para señalar que ambos resultados deben ser iguales entre sí, por lo tanto: 𝑷𝟏 ⋅ 𝒗 𝟏 𝑷 𝟐 ⋅ 𝒗 𝟐 = 𝑻𝟏 𝑻𝟐 variables que afectan el comportamiento de los gases 1. presión Es la fuerza ejercida por unidad de área. En los gases esta fuerza actúa en forma uniforme sobre todas las partes del recipiente. La presión atmosférica es la fuerza ejercida por la atmósfera sobre los cuerpos que están en la superficie terrestre. Se origina del peso del aire que la forma. Mientras más alto se halle un cuerpo menos aire hay por encima de él, por consiguiente, la presión sobre él será menor. 2. temperatura Es una medida de la intensidad del calor, y el calor a su vez es una forma de energía que podemos medir en unidades de calorías. Cuando un cuerpo caliente se coloca en contacto con uno frío, el calor fluye del cuerpo caliente al cuerpo frío. La temperatura de un gas es proporcional a la energía cinética media de las moléculas del gas. A mayor energía cinética mayor temperatura y viceversa. La temperatura de los gases se expresa en grados kelvin. 3. cantidad La cantidad de un gas se puede medir en unidades de masa, usualmente en gramos. De acuerdo con el sistema de unidades SI, la cantidad también se expresa mediante el número de moles de sustancia, esta puede calcularse dividiendo el peso del gas por su peso molecular. 4. volumen Es el espacio ocupado por un cuerpo. 5. densidad Es la relación que se establece entre el peso molecular en gramos de un gas y su volumen molar en litros. El comportamiento de todos los gases se ajusta a tres leyes, las cuales relacionan el volumen de un gas con su temperatura y presión. Los gases que obedecen estas leyes son llamados gases ideales o perfectos. ORESTES RAMIREZ TICONA 5 QUIMICA GENERAL III. INGENIERIA DE SISTEMAS PROCEDIMIENTO EXPERIMENTAL MATERIALES Mechero Bunsen Tapón horadado para el Erlenmeyer Bureta de 50 ml Soporte universal Jeringa grande y embolo Malla con asbesto Termómetro de 0 − 100°𝐶 Pinzas y nuez Pera de nivel Trípode Regla graduada de un metro Manguera de látex Erlenmeyer de 25 ml Probeta de 10 ml ORESTES RAMIREZ TICONA 6 QUIMICA GENERAL INGENIERIA DE SISTEMAS ORESTES RAMIREZ TICONA 7 QUIMICA GENERAL INGENIERIA DE SISTEMAS ORESTES RAMIREZ TICONA 8 QUIMICA GENERAL INGENIERIA DE SISTEMAS EXPERIMENTO Nº 1 COMPROBACION DE LA LEY DE BOYLE 1. Mida el volumen muerto de la bureta (Vm), comprendido entre la marca final de la escala y la llave. Para lo cual ponga agua de caño hasta la mitad de la bureta previamente sujeta al soporte. Coloque un vaso de 250 ml debajo de la bureta y abra la llave dejando caer el agua hasta la marca final (aplique su conocimiento de la lectura del menisco). Luego reemplace el vaso por una probeta limpia y sea de 10 ml y deja caer el agua que contiene el volumen muerto y anote este volumen. ORESTES RAMIREZ TICONA 9 QUIMICA GENERAL INGENIERIA DE SISTEMAS 2. Arme su equipo según como se muestra en la gráfica (vierta agua de caño por la pera de nivel hasta la marca 10 y a esta misma altura asegure la pera, de tal manera que el agua que contiene la pera esté al mismo nivel con el agua de la bureta) ORESTES RAMIREZ TICONA 10 QUIMICA GENERAL INGENIERIA DE SISTEMAS 3. Antes de iniciar, asegúrese que no haya burbujas de aire en el tubo exista escape de aire en el sistema. Para esto levante la pera de nivel 10, teniendo la llave abierta. Luego cierre la llave y alternativamente pera unas dos veces. Al volver a nivelar el agua (sin abrir la llave) bureta debe ser de nuevo 10. Si no es así, revise todas las conexiones el profesor. de goma y no hasta la marca eleve o baje la la marca en la y consulte con ORESTES RAMIREZ TICONA 11 QUIMICA GENERAL INGENIERIA DE SISTEMAS 4. Nuevamente abra la llave y baje la pera hasta que el nivel se detenga en la marca 10; luego cierra la llave. 5. Determine el volumen inicial (v1) según la siguiente ecuación: 𝑽𝟏 = 𝑽𝒃 − 𝟏𝟎 + 𝑽𝒎 Dónde: Vb es el volumen de la bureta y Vm es el volumen muerto (lea el volume n con precisión de 0.1 ml). La presión inicial P1 es la presión atmosférica actual del laboratorio (si no se tiene un manómetro, podemos tomar como P1 la presión promedio estándar para Tacna que es aproximadamente 960 g/cm2 o 706 mmHg). ORESTES RAMIREZ TICONA 12 QUIMICA GENERAL INGENIERIA DE SISTEMAS 6. Suba la pera, (sin abrir la llave de la bureta) hasta que obtenga un desnivel de 1 metro puede ser de 80 o 90 cm. De acuerdo al tamaño del tubo de goma). Lea el cambio de volumen (∆𝑉), o sea la diferencia entre la lectura de la bureta y la anterior. Por lo tanto, el volumen V2 será igual a: 𝑽𝟐 = 𝑽𝟏 − ∆𝑽 𝑷𝟐 = 𝑷𝟏 + ∆𝒉 𝟏𝒎 𝒅𝒆 𝒈𝒖𝒂 ; donde ∆𝑉 es el cambio de volumen. ; donde ∆ℎ es la altura equivalente a 1 metro de agua en mmHg. = 73.5 mmHg 7. Repetir el procedimiento, pero esta vez bajando la pera de agua hasta obtener un desnivel aproximadamente de 1 metro (teniendo el nivel de la pera a 1 metro por debajo del nivel del agua en la bureta). ORESTES RAMIREZ TICONA 13 QUIMICA GENERAL INGENIERIA DE SISTEMAS Hallar el volumen 𝑽𝟑 según: 𝑽𝟑 = 𝑽𝟏 − 𝜟𝑽 ; donde ∆𝑉 es el nuevo cambio de volumen. 𝑷𝟑 = 𝑷𝟏 − 𝜟𝒉 ; donde ∆ℎ es la nueva altura equivalente a 1 m de agua, pero en mmHg. I. REGLA PRESION VOLUMEN NIVEL DEL LECTURA LIQUIDO +1m (mmHg) 706 + 73.5 = 779.5 (ml) V2 (16 .4) 11.6 0m 706 V1 (18) 10 -1m 706 – 73.5 = 632.5 V3 (19 .3) 8.7 manómetro ORESTES RAMIREZ TICONA 14 QUIMICA GENERAL INGENIERIA DE SISTEMAS REPORTE II. REGLA PRESION VOLUMEN NIVEL DEL LECTURA LIQUIDO +1m (mmHg) 706 + 73.5 = 779.5 (ml) V2 (16 .4) 11.6 0m 706 V1 (18) 10 -1m 706 – 73.5 = 632.5 V3 (19 .3) 8.7 manómetro Datos del experimento, en el siguiente cuadro: Nro. V (ml) P (mmHg) P.V. 1 18 706 12708 2 16.4 776.5 12783.8 3 19.3 632.5 12207.25 ORESTES RAMIREZ TICONA 15 QUIMICA GENERAL INGENIERIA DE SISTEMAS GRAFIQUE ORESTES RAMIREZ TICONA 16 QUIMICA GENERAL INGENIERIA DE SISTEMAS INVESTIGACION 1. Averigüe ¿Cuál es la presión atmosférica en la ciudad de Tacna? ¿A qué altitud? Y ¿cómo se llama el dispositivo que mide la presión atmosférica (Presión del aire)? Presión atmosférica: 1016.93 hPa altitud 562 msnm el dispositivo se llama barómetro 2. ¿Qué es un nanómetro? ¿Pará qué sirve? Dé dos ejemplos. Es un instrumento de medición para la presión de fluidos contenidos en recipientes cerrados. Se distinguen dos tipos de manómetros, según se empleen para medir la presión de líquidos o de gases En la mecánica la presión se define como la fuerza por unidad de superfic ie que ejerce un líquido o un gas perpendicularmente a dicha superficie. Ejemplo: Hallar la relación entre los gases de X, Y, Z en los manómetros indican a continuación. Relación entre las densidades del agua y el mercurio es; d water<dmercury y P0 = 75 cm Hg. Ejemplo: Buscar la presión de gas Y (presión atmosférica es de 75 cm de Hg). ORESTES RAMIREZ TICONA 17 QUIMICA GENERAL INGENIERIA DE SISTEMAS se puede escribir; PX+60=75 PX=15 cm Hg y PY=PX+30=15+30=45 PY=45 cm Hg 3. Defina la presión gaseosa y proporcione sus unidades más comunes La presión se define como una fuerza aplicada por unidad de área, es decir, una fuerza dividida por el área sobre la que se distribuye la fuerza. P(Pa) = F(N) / A (m2) ORESTES RAMIREZ TICONA 18 QUIMICA GENERAL INGENIERIA DE SISTEMAS 4. RESUELVA LOS SIGUIENTES CÁLCULOS: a) Un globo de sonda que contiene helio a nivel del mar tiene un volumen de 10 litros a 25° C y una atmósfera de presión. El globo se eleva una cierta altura donde la temperatura es 17° C y la presión es de 500 mmHg ¿Cuál es el nuevo volumen del globo? V1 =10L P1 =1 T1 = atm 25ºC=298.15K T2 =17ºC = P2 =500mmHg = V2 =? Tenemos la fórmula que es la siguiente: 𝑷𝟏 𝑽𝟏 𝑷𝟐 𝑽𝟐 = 𝑻𝟏 𝑻𝟏 290.15K 0,66atm 𝑷𝟏 ∗ 𝑽𝟏 ∗ 𝑻𝟐 = 𝑷𝟐 ∗ 𝑽𝟐 ∗ 𝑻𝟏 Despejamos: 𝑽𝟐 = 𝑷 𝟏 ∗𝑽𝟏 𝑻𝟐 𝑷 𝟐 𝑻𝟏 ORESTES RAMIREZ TICONA 19 QUIMICA GENERAL INGENIERIA DE SISTEMAS 𝑽𝟐 = 𝟏∗𝟏𝟎∗𝟐𝟗𝟎.𝟏𝟓 𝟎.𝟔𝟔∗𝟐𝟗𝟖.𝟏𝟓 𝑽𝟐 = 𝟏𝟒. 𝟕𝟒𝑳 b) ¿Qué volumen ocuparía 2,5 L de N 2 que se encuentra a 20° C y 2 atm si lo trasladamos a condiciones normales de 0° C y 1 atm? 𝑽𝟏 = 2.5 𝐿 𝑷𝟏 = 2 𝑎𝑡𝑚 𝑻𝟏 = 20°𝐶 + 273.15 = 293.15°𝐾 𝑻𝟐 = 0°𝐶 + 273.15 = 273.15°𝐾 𝑷𝟐 = 1 𝑎𝑡𝑚 𝑽𝟐 =? 𝑷𝟏 𝑽𝟏 𝑷𝟐 𝑽𝟐 = 𝑻𝟏 𝑻𝟏 𝑷𝟏 ∗ 𝑽𝟏 ∗ 𝑻𝟐 = 𝑷𝟐 ∗ 𝑽𝟐 ∗ 𝑻𝟏 Despejamos 𝑽𝟐 = 𝑷 𝟏 ∗𝑽𝟏 𝑻𝟐 𝑽𝟐 = 𝟐∗𝟐.𝟓∗𝟐𝟕𝟑.𝟏𝟓 𝑷 𝟐 𝑻𝟏 𝟏∗𝟐𝟗𝟑.𝟏𝟓 𝑽𝟐 = 𝟒. 𝟔𝟔 𝑳 ORESTES RAMIREZ TICONA 20 QUIMICA GENERAL INGENIERIA DE SISTEMAS EXPERIMENTO Nº 2 COMPROBACION DE LA LEY DE CHARLES Relación volumen-temperatura a presión constante. 1. Armar el equipo, consistente en una jeringa grande unida a un tapón de jebe y a un matraz de 25 ml.. ORESTES RAMIREZ TICONA 21 QUIMICA GENERAL INGENIERIA DE SISTEMAS 2. Cuando este el sistema ajustado, esperar que la marca del pistón móvil marque en el acero. Anote la temperatura del baño de agua en el vaso 3. Encienda el mechero y empiece a calentar el agua muy lentamente, retirando el machero si la temperatura subiera rápido (agitar el agua con una varilla con cuidado). ORESTES RAMIREZ TICONA 22 QUIMICA GENERAL INGENIERIA DE SISTEMAS 4. Cuando la temperatura del agua haya subido unos 10 grados, retire el mechero y espere un minuto para que la temperatura sea homogénea en el agua y en el Erlenmeyer 5. Lea la temperatura y el volumen desplazado en el embolo. 6. Nuevamente acerque el mechero para aumentar la temperatura poco a poco y retira las operaciones y lecturas de temperatura y de ascenso del agua, procurando que los instrumentos de volumen se chequeen por cada 10℃ hasta alcanzar una temperatura de unos 60℃. ORESTES RAMIREZ TICONA 23 QUIMICA GENERAL INGENIERIA DE SISTEMAS VARIACION DE VOLUMEN TEMPERATURA VOLUMEN FINAL (C ) (ml ) ( V ) 0 2 4 6 8 20 30 40 50 60 112 114 118 124 132 REPORTE Tabulando los datos sacados del experimento de 10℃ hasta alcanzar una temperatura de unos 60℃. VARIACION DE VOLUMEN TEMPERATURA VOLUMEN FINAL (C ) (ml ) 20 30 40 50 60 70 80 112 114 118 124 132 142 154 ( V ) 0 2 4 6 8 10 12 Reporte de los datos del experimento: T (C ) V (ml ) 1 2 3 4 5 20 30 40 50 60 112 114 118 124 132 V T 0.179 0.263 0339 0.403 0.454 OBSERVACION: la correcta observación de estos experimentos nos llevara a una correcta explicación de estos fenómenos ORESTES RAMIREZ TICONA 24 QUIMICA GENERAL INGENIERIA DE SISTEMAS GRAFIQUE ORESTES RAMIREZ TICONA 25 QUIMICA GENERAL INGENIERIA DE SISTEMAS INVETIGACION Resuelva los siguientes cálculos: a) Un globo sonda que contiene helio a nivel del mar tiene un volumen de 10 litros a 25℃ y una atmosfera de presión. El globo se eleva una cierta altura donde la temperatura es 17℃ y la presión es de 500 mmHg. ¿Cuál es el nuevo volumen del globo? i. Datos: Pinicial 1atm Tinicial 25C 298 K ii. T final 17C 290 K Pfinal 500mmHg 0.65atm V final ? Tenemos la fórmula que es la siguiente: Pi *Vi * T f Pf *V f * Ti iii. iv. Despejamos: v. V f ( Pi *Vi * T f ) /( Pf * Ti ) vi. = (1atm*10L*298k) / (0,65atm*290k) vii. = (2980) / (188,5) viii. = 15,8L. b) ¿Qué volumen ocuparía 2,5 l de N_2 que se encuentra a 20℃ y 2 atm si lo trasladamos a condiciones normales de 0℃ y 1 atm?? Datos: P = presión en atmosferas V = volumen en litros n = número de moles R = 0.082 T = temperatura absoluta. PV = nRT 1 x 10 = n x 0.082 x 298.15 10 = n x 24.4483 n = 10/24.4483 = 0.409026394 moles He ORESTES RAMIREZ TICONA 26 QUIMICA GENERAL INGENIERIA DE SISTEMAS PV = nRT 0.657894736 x V = 0.409026394 x 0.082 x 290.15 0.657894736 x V = 9.731678674 V = 9.731678674/0.657894736 = 14.79215158 litros Indique como cambia el volumen de cierta cantidad de gas si: c) Se aumenta su presión a 25℃, de 1 atm, 2 atm. Pues esta aumenta ya que la presión 1 es directamente proporcional a la temperatura final. d) Se baja su temperatura a una presión de 1 atm, de 300 a 100. Esta disminuye porque la presión final es directa a la temperatura final. e) Se aumenta la temperatura de 200 a 300, aumentando simultáneamente la presión de 2 a 3 atm. ¿A qué temperatura el volumen molar de un gas ideal, estando a 1 atm, es igual a 10 litros/mol? ¿y a 100 litros/mol? Ocurre que la presión inicial es directa a la presión final e inversa a la temperatura fina mientras que la temperatura inicial es directa a la temperatura final e inversa a la presión final. ORESTES RAMIREZ TICONA 27 QUIMICA GENERAL IV. INGENIERIA DE SISTEMAS CONCLUSION A una presión constante el volumen de un gas se expande cuando se calienta y se contrae cuando se expande. La temperatura y el número de moles para demostrar la ley de Boyle deben ser constantes. La presión para demostrar la ley de charle debe ser constante. Si la presión de un gas se duplica el volumen disminuye, y si la presión disminuye el volumen aumenta. También se comprobó la ley de Boyle que dice que a temperatura constante el volumen es inversamente proporcional a la presión; cuando se calculó el nivel de agua de la bureta dentro de la probeta. Las relaciones de temperatura-volumen de los gases se describen por la ley de Charles y Gray-Lussac: el volumen es directamente proporcional a la temperatura (a P y n constantes). La de Boyle Mariott establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente, cuando la temperatura es constante. Por concluir se puede decir que las leyes de Charles y Boyle Mariott son muy importantes en nuestra Química ya que cada una tiene su pensamiento. La de Charles nos dice que estudió por primera vez la relación entre el volumen y la temperatura de una muestra de gas a presión constante y observó que cuando se aumentaba la temperatura el volumen del gas también aumentaba y que al enfriar el volumen disminuía. Reconocimos aprendiendo las técnicas de separación aplicando sus diferentes métodos de cada ingrediente ORESTES RAMIREZ TICONA 28 QUIMICA GENERAL V. INGENIERIA DE SISTEMAS RECOMEDACION Es necesario tener los implementos completos en el laboratorio como lavadores, cucharas, cucharones y creo que sería bueno que cada estudiante cuente con sus propios materiales para que así cada quien pueda trabajar solo y aprender aún más. (R. Chang, 2006) BIBLIOGRAFÍA (s.f.). Greiner, W., & Neise. (18 de mayo de 2016). Ley de Boyle-Mariotte. Obtenido de Ley de Boyle-Mariotte: https://es.wikipedia.org/wiki/Ley_de_Boyle-Mariotte R. Chang. (2006). Propiedades de gases. En R. Chang, PROPIEDADES DE LOS GASES (págs. 156-190). anonimo: 6ta edicion. Obtenido de Ley de Boyle: http://catedras.quimica.unlp.edu.ar/intqca/briand/leyesdelosgases.pdf ORESTES RAMIREZ TICONA 29