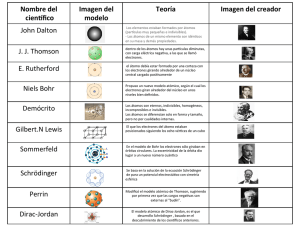
LOS MODELOS ATOMICOS PRESENTADO POR EDWIN LINARES YANEIDA SUAZA QUE ES UN MODELO ATOMICO Un modelo atómico es una representación estructural de un átomo, que trata de explicar su comportamiento y propiedades. A lo largo del tiempo existieron varios modelos atómicos y algunos más elaborados que otros en la que hubieron cuatro principales que fueron: Modelo atómico de Dalton, que surgió en el contexto de la química, el primero con bases científicas.(1803) Modelo atómico de Thomson, o modelo del budín, donde los electrones son como las "frutas" dentro de una "masa" positiva.(1904) Modelo atómico de Rutherford, el primero que distingue entre el núcleo central y una nube de electrones a su alrededor.(1911) Modelo atómico de Bohr, un modelo cuantizado del átomo, con electrones girando en órbitas circulares.(1913) Teoría atómica de Dalton fue el primer modelo atómico con bases científicas, formulada en 1808 por John Dalton, el imaginaba a los átomos como diminutas esferas, y algunos de sus postulados eran: Los elementos químicos están formados por partículas muy pequeñas indestructibles e invisibles llamados átomos Todos los átomos de un elementos químico dado son idénticos en su masa y demás propiedades Los átomos de diferentes elementos químicos son distintos, en particular sus masa son diferentes Los átomos permanecen sin división, aun cuando se combinen en las reacciones químicas Modelo atómico tipo esfera Tipos de átomos de diferentes (Dalton) dimensiones representadas a partir de tamaños diferentes de esferas con el descubrimiento del electrón en 1897 por Joseph Thomson, el modelo de Dalton muestra sus primeras debilidades, ya que se denomino qué la materia esta constituida por dos partes: una negativa y otra positiva Modelo atómico de Thomson Thomson propuso un modelo en la cual los electrones de carga negativa Estaban inmersos en una masa de carga como una especie de pastel de pasas Posteriormente jean perrin propuso modificaciones a este modelo donde las “pasas” es decir los electrones se situaban en la parte posterior del pastel la cual esta era la carga positiva : En este modelo hay dos consecuencias importantes que son: # la materia es neutra por lo cual debe haber igual cantidad de carga positiva y negativa #los electrones pueden extraerse de los átomos, pero no así las cargas positivas Modelo atómico de Rutherford Ernst Rutherford, presenta un modelo de átomo que se basa en el preexistente modelo de Thomson, ya que mantiene esa composición de carga negativa y positiva. Sin embargo, a Diferencia del anterior postula, dos modificaciones esenciales: #la parte positiva se concentra en el núcleo, el cual también contiene virtualmente toda la masa del átomo # los electrones se ubican orbitando al núcleo en orbitas circulares o electicas con un espacio vacío entre ellos ( similitud o sistema solar) Modelo atómico de Bohr En este Bohr creía que el átomo eras un pequeño sistema solar con un núcleo en el centro y los electrones moviéndose alrededor del núcleo en orbitas bien definidas “ las orbitas están cuantiadas ósea que los electrones puedan estar solo en ciertas orbitas los postulados mas importantes eran: Cada orbita tiene una energía asociada, la mas externa es la mayor energía Los electrones no radian la energía (luz) mientras permanezca en orbitas estables Los electrones pueden saltar de una a otra orbita, si lo hace desde una de menor energía a una de mayor energía absorbe un cuarto de energía, y si pasa de una de mayor a una de menor, pierde energía en forma de radiación (luz) Modelo atómico actual El modelo atómico actual fue desarrollado durante la década de 1920, sobre todo por Schrödinger y Heidelberg. Es un modelo de gran complejidad matemática, tanta que usándolo sólo se puede resolver con exactitud el átomo de hidrógeno. Para resolver átomos distintos al de hidrógeno se recurre a métodos aproximados.