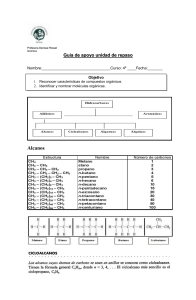
Química Orgánica UNIDAD I: ESTRUCTURA Y PROPIEDADES DE LOS COMPUESTOS ORGÁNICOS CONCEPTOS PREVIOS Química del carbono Los seres vivos están formados principalmente por C carbono, H hidrógeno, O oxígeno y N nitrógeno, y, en menor medida, contienen también S azufre y P fósforo junto con algunos halógenos y metales. De ahí que los compuestos de carbono se conozcan con el nombre de compuestos orgánicos (o de los seres vivos). Pero, cuidado, también hay muchos otros compuestos de carbono que no forman parte de los seres vivos. La parte de la Química que estudia los compuestos del carbono es la Química Orgánica o Química del Carbono, pues este elemento es común a todos los compuestos orgánicos. La Química Orgánica es la Química del Carbono. Por compuestos orgánicos entendemos los compuestos del carbono, excepto los óxidos CO y CO2 y los carbonatos que se estudian como compuestos inorgánicos desde siempre. La Química Orgánica no es sólo la química de los compuestos de los seres vivos, son también los compuestos derivados del petróleo, del carbón, y los preparados sintéticamente en el laboratorio. La Química Orgánica estudia aspectos tales como: Los componentes de los alimentos: carbohidratos, lípidos, proteínas y vitaminas. Industria textil Madera y sus derivados Industria farmacéutica Industria alimenticia Petroquímica Jabones y detergentes Cosmetología Estos son solo algunos de los muchos ejemplos que podríamos citar sobre el estudio de la química orgánica. Para entender mejor las características de los compuestos orgánicos, presentamos una tabla comparativa entre las características de los compuestos orgánicos e inorgánicos. 1 Química Orgánica La configuración electrónica del carbono es: [C]=1s2 2s2 2px1 2py1 2pz0 Dada la poca diferencia de energía entre los orbitales 2s y los 2p es fácil promocionar un electrón 2s a un orbital 2p, obteniéndose la configuración: [C]=1s2 2s1 2px1 2py1 2pz1 Esto permite la formación de cuatro enlaces covalentes por compartición de electrones, ya sea consigo mismo o con otros elementos, se gana así con creces la energía antes invertida en promocionar el electrón a un orbital superior. Hibridación La hibridación es un fenómeno que consiste en la mezcla de orbítales atómicos puros para generar un conjunto de orbítales híbridos, los cuales tienen características combinadas de los orbítales originales. - Hibridación sp3 La configuración electrónica desarrollada para el carbono es: 2 Química Orgánica El primer paso en la hibridación, es la promoción de un electrón del orbital 2s al orbital 2p. Después de la promoción electrónica sigue la mezcla de los orbítales formándose 4 orbítales híbridos del tipo sp3, cada uno con un electrón. Estos orbítales son idénticos entre sí, pero diferentes de los originales ya que tienen características de los orbítales “s” y “p” combinadas. Estos son los electrones que se comparten. En este tipo de hibridación se forman cuatro enlaces sencillos. - Hibridación sp2 En este tipo de hibridación se combinan solo dos orbítales “p” con un orbital “s” formándose tres orbítales híbridos sp2. El átomo de carbono forma un enlace doble y dos sencillos. - Hibridación sp En este tipo de hibridación sólo se combina un orbital “p” con el orbital “s”. Con este tipo de hibridación el carbono puede formar un triple enlace. Geometría molecular El tipo de hibridación determina la geometría molecular la cual se resume en el siguiente cuadro. Tipo de hibridación sp3 sp2 sp Tipo de enlace Sencillo Doble Triple Geometría molecular Tetraédrica Triangular plana Lineal Ángulo de enlace 109.5 ° 120 ° 180 ° 3 Química Orgánica Longitud de enlace En geometría molecular, la longitud de enlace o distancia de enlace es la distancia media en el tiempo entre los núcleos de dos átomos unidos mediante un enlace químico en una molécula. La longitud de enlace se relaciona inversamente con el orden de enlace, y crece con los radios de los átomos que se enlazan. Cuanto mayor es el orden de enlace entre dos átomos determinados, menores serán las longitudes de enlaces que ellos forman. Orden de enlace Distancia de enlace (pm) C-C (simple) 1 154 C=C (doble) 2 134 C≡C (triple) 3 130 La longitud del enlace es aproximadamente igual a la suma de los radios covalentes de los átomos participantes en ese enlace. Si los átomos que se unen tienen radios grandes, la distancia de enlace también lo será. La longitud de enlace también se relaciona inversamente con la fuerza de enlace y con la energía de disociación de enlace, dado que un enlace más fuerte también es un enlace más corto. En un enlace entre dos átomos idénticos, la mitad de la distancia de enlace es igual al radio covalente. Las longitudes de enlace se miden en las moléculas por medio de la difracción de rayos X. El enlace entre dos átomos es distinto de una molécula a otra. Por ejemplo, el enlace carbonohidrógeno en el metano es diferente a aquél en el cloruro de metilo. Sin embargo, es posible hacer generalizaciones cuando la estructura general es la misma. - Longitudes de enlace del carbono con otros elementos A continuación se muestra una tabla con longitudes de enlace simple entre carbono y otro elemento. Las longitudes de enlace están dadas en picómetros. Por aproximación, las distancias de enlace entre dos átomos diferentes es la suma de los radios covalentes individuales. 4 Química Orgánica El gran número de compuestos orgánicos y la tremenda variedad de sus tamaños y estructuras hace necesaria una mínima sistematización en su nomenclatura. La IUPAC (Unión Internacional de Química Pura y Aplicada) diseñó unas normas que se basan fundamentalmente en la utilización de prefijos que indican el número de átomos de carbono de las cadenas carbonadas y sufijos para informar sobre la presencia de los diversos grupos funcionales, que se convierten en prefijos específicos cuando no actúan como grupo principal en los compuestos polifuncionales. Veremos más despacio las normas básicas de formulación de las funciones orgánicas más representativas. Fórmulas químicas La fórmula química es la forma escrita de una molécula. Debe proporcionar, como mínimo, dos informaciones importantes: qué elementos forman el compuesto y en qué proporción se encuentran dichos elementos en el mismo. La fórmula puede ser: - Empírica: Es la fórmula más simple posible. Indica qué elementos forman la molécula y en qué proporción están. Es la fórmula que se obtiene a partir de la composición centesimal de un compuesto. Por ejemplo, si tenemos un hidrocarburo (formado por H y C) podemos combustionarlo en presencia de oxígeno, y a partir del CO2 y H2O que se forman determinar la cantidad de C e H que contiene. Bastará calcular los moles de C e H, y dividir estas dos cantidades por el valor más pequeño determinando la proporción de los átomos en el compuesto, es decir, su fórmula empírica. Ejemplo : CH, compuesto formado por carbono e hidrógeno, en la proporción: 1 a 1. - Molecular: Indica el número total de átomos de cada elemento en la molécula. Para conocer la fórmula molecular a partir de la empírica es preciso conocer la masa molecular del compuesto. A partir de las propiedades coligativas, como presión osmótica, descenso crioscópico o aumento ebulloscópico, podemos determinar la masa molecular, y a partir de ésta la fórmula molecular con una simple proporción. Hay tres formas distintas de escribir una fórmula molecular: 5 Química Orgánica Expresa el tipo y número de átomos de la molécula. Pero no informa de los enlaces que presenta la misma. En ella se representa sólo los enlaces carbono-carbono. Se representan todos los enlaces de la molécula. Condensada Semidesarrollada Desarrollada o Estructural - Ejemplo : C6H6 compuesto formado por 6 átomos de carbono y seis de hidrógeno Enlace triple carbono-carbono. Ejemplo: H - C ≡ C - H En la mayor parte de los casos bastará con la fórmula semidesarrollada. Geométricas: Abrevian la escritura e indican la distribución de los átomos en el plano o en el espacio. Planas En lugar de: CH3 - CH2 - CH2 - CH2 - CH2 - CH2 - CH2 - CH3 Tridimensionales Las cuñas y líneas discontinuas pretenden ayudar a dar perspectiva a la molécula. COOH y H están en el plano. OH está detrás del plano. CH3 está delante del plano. Cadena carbonada Es la secuencia de átomos de carbono, unidos entre sí, que forman el esqueleto de la molécula orgánica. Hay diferentes tipos de cadena, según sea a su forma: - Abierta o acíclica: Los átomos de carbono extremos no están unidos entre sí. No forman anillos o ciclos. Puede ser: Lineal Ramificada - No llevan ningún tipo de substitución. Los átomos de carbono pueden escribirse en línea recta. Aunque también se poden escribir retorcidas para ocupar menor espacio. Es importante saber ver que aunque esté torcida es una cadena lineal. De alguno de los carbonos de la cadena lineal sale otra u otras cadenas secundarias o ramas. Cerrada o cíclica: El último carbono de la cadena se une al primero, formando un ciclo o anillo. Hay varios tipos: Homocíclica Heterocíclica Monocíclica Policíclica Los átomos del ciclo son átomos de carbono. Algún átomo de carbono del ciclo fue substituido por otro átomo, por ejemplo N, S, O, etc. Sólo hay un ciclo. Hay varios ciclos unidos. 6 Química Orgánica Primario Secundario Terciario Cuaternario Si está unido a átomos de hidrógeno. Si está unido a dos átomos de carbono. Si está unido a tres átomos de carbono. Si está unido a cuatro átomos de carbono. Isómeros Se llaman isómeros a dos o más compuestos diferentes que tienen la misma fórmula molecular, pero diferente fórmula estructural, y diferentes propiedades físicas o químicas. Estructural: Los isómeros se diferencian por el orden en que están enlazados los átomos en la molécula. Isomería de cadena: Distinta colocación de algunos átomos en la cadena. Isomería de posición: Distinta posición del grupo funcional. Isomería de función: Distinto grupo funcional. Estereoisomería: Los isómeros se diferencian por la disposición tridimensional de los átomos en la molécula. Isomería geométrica o cistrans: propia de los compuestos con dobles enlaces. Isomería óptica: propia de compuestos con carbonos asimétricos, es decir, con los cuatro substituyentes diferentes. Función química y grupo funcional Se llama función química a cada grupo de compuestos con propiedades y comportamientos químicos característicos. 7 Química Orgánica Cada función se caracteriza por poseer un agregado, de uno o varios átomos, al que se denomina grupo funcional. Nomenclatura Es el conjunto de reglas que permiten asignar, unívocamente, un nombre a cada compuesto químico. - Nomenclatura sistemática Es la que se ajusta a un sistema prefijado. Se deben seguir los convenios establecidos por la I.U.P.A.C. (Unión Internacional de Química Pura y Aplicada). - Nomenclatura tradicional Arraigada en el lenguaje químico convencional, aún que no sigue unas normas prefijadas. Muchos de estos nombres tradicionales están aceptados por la IUPAC. TIPOS DE COMPUESTOS Tipos de funciones Ahí tienes los 17 tipos de funciones que vamos a tratar. Así mismo muchos compuestos comparten varias funciones en su molécula, para nombrarlos tienes que tener en cuenta el orden de preferencia de los grupos funcionales. FUNCIÓN GRUPO FUNCIONAL Alcanos No tiene EJEMPLO Alquenos Alquinos Hidrocarburos cíclicos No tiene 8 Química Orgánica Orden de preferencia • Cuando en un compuesto hay un sólo grupo funcional, la cadena principal es la que contiene la función, y se numera de tal forma que corresponda al carbono de la función el localizador más bajo posible. • Cuando en el compuesto hay más de un grupo funcional, la cadena principal es la que contiene la función preferente; las demás funciones no se tienen en cuenta y se nombran como substituyentes. El orden de preferencia acordado por la IUPAC es: 9 Química Orgánica Nombre Ac. carboxílico Éster Amida Nitrilo Aldehído Cetona Alcohol Fenol Amina Éter Doble enlace Triple enlace Halógeno Nitroderivados Radical alquilo Fórmula R-COOH R-COOR’ R-CO-NH2 R-C≡N R-COH R-CO-R’ R-OH Ar-OH R-NH2 R-O-R’ R=R’ R≡R’ R-X R-NO2 R-R’ Terminación -oico -oato -amida -nitrilo -al -ona -ol -ol -amina -oxi-eno -ino -ano Como substituyente carboxioxicarbonilcarbamoílcianoformiloxohidroxihidroxiaminooxi-, oxa...enil...inilfluoro-, cloro-, bromo-, iodonitro...il- ALCANOS ¿Qué son? Son compuestos de C e H (de ahí el nombre de hidrocarburos) de cadena abierta que están unidos entre sí por enlaces sencillos (C-C y C-H). Su fórmula molecular es , siendo n el nº de carbonos. ¿Cómo se nombran? Los cuatro primeros tienen un nombre sistemático que consiste en los prefijos met-, et -, propy but- seguidos del sufijo "-ano". Los demás se nombran mediante los prefijos griegos que indican el número de átomos de carbono y la terminación "-ano". Fórmula Nombre Radical Nombre Metano Metil-(o) Etano Etil-(o) Propano Propil-(o) Butano Butil-(o) Pentano Pentil-(o) 10 Química Orgánica Hexano Hexil-(o) Heptano Heptil-(o) Octano Octil-(o) Otros nombres de la serie de los alcanos son los siguientes: Nº de C Nombre Nº de C Nombre 9 nonano 30 triacontano 10 decano 31 hentriacontano 11 undecano 32 dotriacontano 12 dodecano 40 tetracontano 13 tridecano 41 hentetracontano 14 tetradecano 50 pentacontano 15 pentadecano 60 hexacontano 16 hexadecano 70 heptacontano 17 heptadecano 80 octacontano 18 octadecano 90 nonacontano 19 nonadecano 100 hectano 20 eicosano 200 dihectano 21 heneicosano 300 trihectano 22 docosano 579 nonaheptacontapentahectano Se llama radical alquilo a las agrupaciones de átomos procedentes de la eliminación de un átomo de H en un alcano, por lo que contiene un electrón de valencia disponible para formar un enlace covalente. Se nombran cambiando la terminación -ano por -ilo, o -il cuando forme parte de un hidrocarburo. Cuando aparecen ramificaciones (cadenas laterales) hay que seguir una serie de normas para su correcta nomenclatura. 11 Química Orgánica • Se elige la cadena más larga. Si hay dos o más cadenas con igual número de carbonos se escoge la que tenga mayor número de ramificaciones. 3-metil-hexano • Se numeran los átomos de carbono de la cadena principal comenzando por el extremo que tenga más cerca alguna ramificación, buscando que la posible serie de números "localizadores" sea siempre la menor posible. 2,2,4-trimetil-pentano, y no 2,4,4-trimetil-pentano • Las cadenas laterales se nombran antes que la cadena principal, precedidas de su correspondiente número localizador y con la terminación "-il" para indicar que son radicales. • Si un mismo átomo de carbono tiene dos radicales se pone el número localizador delante de cada radical y se ordenan por orden alfabético. 4-etil-2-metil-5-propil-octano • Si un mismo radical se repite en varios carbonos, se separan los números localizadores de cada radical por comas y se antepone al radical el prefijo "di-", "tri-", "tetra-", etc. 2,3-dimetil-butano • Si hay dos o más radicales diferentes en distintos carbonos, se nombran por orden alfabético anteponiendo su número localizador a cada radical. en el orden alfabético no se tienen en cuenta los prefijos: di-, tri-, tetra-etc. así como sec-, terc-, y otros como cis-, trans-, o-, m-, y p-; pero cuidado si se tiene en cuenta iso-. 12 Química Orgánica 5-isopropil-3-metil-octano • Por último, si las cadenas laterales son complejas, se nombran de forma independiente y se colocan, encerradas dentro de un paréntesis como los demás radicales por orden alfabético. En estos casos se ordenan por la primera letra del radical. Por ejemplo, en el (1,2dimetilpropil) si tendremos en cuenta la "d" para el orden alfabético, por ser un radical complejo. 5-(1,2-dimetilpropil)-4-etil-2-metil-nonano Ejemplos 3-metil-pentano 4-etil-2,4-dimetil-hexano 3-isopropil-2,5-dimetilheptano 13 Química Orgánica La nomenclatura de la IUPAC admite los nombres tradicionales de algunos radicales substituidos, lo que facilita la nomenclatura en estos casos: isopropilo (isómero do propilo) (1-metiletilo) isobutilo (2-metilpropilo) secbutilo (butilo secundario) (1-metilpropilo) terbutilo terciario) (butilo (1,1-dimetiletilo) isopentilo (3-metilbutilo) neopentilo (2,2-dimetilpropilo) ALQUENOS ¿Qué son? Son hidrocarburos de cadena abierta que se caracterizan por tener uno o más dobles enlaces, C=C. ¿Cómo se nombran? Se nombran igual que los alcanos, pero con la terminación en "-eno". De todas formas, hay que seguir las siguientes reglas: • Se escoge como cadena principal la más larga que contenga el doble enlace. De haber ramificaciones se toma como cadena principal la que contenga el mayor número de dobles enlaces, aunque sea más corta que las otras. 3-propil-1,4-hexadieno 14 Química Orgánica • Se comienza a contar por el extremo más cercano a un doble enlace, con lo que el doble enlace tiene preferencia sobre las cadenas laterales a la hora de nombrar los carbonos, y se nombra el hidrocarburo especificando el primer carbono que contiene ese doble enlace. 4-metil-1-penteno • En el caso de que hubiera más de un doble enlace se emplean las terminaciones, "-dieno", "-trieno", etc., precedidas por los números que indican la posición de esos dobles enlaces. 1,3,5-hexatrieno Ejemplos eteno (etileno) propeno 1-buteno 2-buteno etenilo (vinilo) 2-propenilo (alilo) 1-propenilo 1,3-butadieno 3-etil-4-metil-1-penteno 6-metil-3-propil-1,3,5heptatrieno 15 Química Orgánica ALQUINOS ¿Qué son? Son hidrocarburos de cadena abierta que se caracterizan por tener uno o más triples enlaces, Carbono-Carbono. ¿Cómo se nombran? En general su nomenclatura sigue las pautas indicadas para los alquenos, pero terminando en "-ino". Más interesante es la nomenclatura de los hidrocarburos que contienen dobles y triples enlaces en su molécula. • En este caso, hay que indicar tanto los dobles enlaces como los triples, pero con preferencia por los dobles enlaces que serán los que dan nombre al hidrocarburo. 1-buten-3-ino • La cadena principal es la que tenga mayor número de insaturaciones (indistintamente), pero buscando que los números localizadores sean los más bajos posibles. En caso de igualdad tienen preferencia los carbonos con doble enlace. 4-(3-pentinil)-1,3-nonadien-5,7-diino Ejemplos etino (acetileno) propino 1-butino 2-butino etinilo 2-propinilo 1-propinilo 1-pentino 16 Química Orgánica HIDROCARBUROS CÍCLICOS ¿Qué son? Son hidrocarburos de cadena cerrada. Los ciclos también pueden presentar insaturaciones. ¿Cómo se nombran? Los hidrocarburos cíclicos se nombran igual que los hidrocarburos (alcanos, alquenos o alquinos) del mismo número de átomos de carbono, pero anteponiendo el prefijo "ciclo-". ciclobutano • Si el ciclo tiene varios substituyentes se numeran de forma que reciban los localizadores más bajos, y se ordenan por orden alfabético. En caso de que haya varias opciones decidirá el orden de preferencia alfabético de los radicales. 1-etil-3-metil-5-propil-ciclohexano • En el caso de anillos con insaturaciones, los carbonos se numeran de modo que dichos enlaces tengan los números localizadores más bajos. 3,4,5-trimetil-ciclohexeno • Si el compuesto cíclico tiene cadenas laterales más o menos extensas, conviene nombrarlo como derivado de una cadena lateral. En estos casos, los hidrocarburos cíclicos se nombran como radicales con las terminaciones "-il", "-enil", o "-inil". 3-ciclohexil-4-ciclopentil-2-metil-hexano 17 Química Orgánica Ejemplos ciclopropano ciclobutano ciclopentano ciclohexano ciclohexeno 1,5-ciclooctadieno 1,1,2-trimetil-ciclopentano 4-etil-4,5-dimetilciclohexeno HIDROCARBUROS AROMÁTICOS ¿Qué son? Son hidrocarburos derivados del benceno. El benceno se caracteriza por una inusual estabilidad, que le viene dada por la particular disposición de los dobles enlaces conjugados. ¿Cómo se nombran? Reciben este nombre debido a los olores intensos, normalmente agradables, que presentan en su mayoría. El nombre genérico de los hidrocarburos aromáticos mono y policíclicos es "areno" y los radicales derivados de ellos se llaman radicales "arilo". Todos ellos se pueden considerar derivados del benceno, que es una molécula cíclica, de forma hexagonal y con un orden de enlace intermedio entre un enlace sencillo y un doble enlace. Experimentalmente se 18 Química Orgánica comprueba que los seis enlaces son equivalentes, de ahí que la molécula de benceno se represente como una estructura resonante entre las dos fórmulas propuestas por Kekulé, en 1865, según el siguiente esquema: • Cuando el benceno lleva un radical se nombra primero dicho radical seguido de la palabra "-benceno". clorobenceno, metilbenceno (tolueno) y nitrobenceno • Si son dos los radicales se indica su posición relativa dentro del anillo bencénico mediante los números 1,2; 1,3 ó 1,4, teniendo el número 1 el substituyente más importante. Sin embargo, en estos casos se sigue utilizando los prefijos "orto", "meta" y "para" para indicar esas mismas posiciones del segundo substituyente. A) 1,2-dimetilbenceno, (o-dimetilbenceno) o (o-xileno) B) 1,3-dimetilbenceno, (m-dimetilbenceno) o (m-xileno) C) 1,4-dimetilbenceno, (p-dimetilbenceno) o (p-xileno) • En el caso de haber más de dos substituyentes, se numeran de forma que reciban los localizadores más bajos, y se ordenan por orden alfabético. En caso de que haya varias opciones decidirá el orden de preferencia alfabético de los radicales. 1-etil-2,5-dimetil-4-propilbenceno • Cuando el benceno actúa como radical de otra cadena se utiliza con el nombre de "fenilo". 19 Química Orgánica 4-etil-1,6-difenil-2-metil-hexano Ejemplos fenilo bencilo cumeno estireno naftaleno antraceno fenantreno bifenilo 20 Química Orgánica HALOGENUROS DE ALQUILO ¿Qué son? Son hidrocarburos que contienen átomos de halógeno en su molécula: R-X, Ar-X. ¿Cómo se nombran? Aunque no son hidrocarburos propiamente dichos, al no estar formados únicamente por hidrógeno y carbono, se consideran derivados de estos en lo referente a su nomenclatura y formulación. • Se nombran citando en primer lugar el halógeno seguido del nombre del hidrocarburo, indicando, si es necesario, la posición que ocupa el halógeno en la cadena, a sabiendas de que los dobles y triples enlaces tienen prioridad sobre el halógeno en la asignación de los números. 1-clorobutano • Si aparece el mismo halógeno repetido, se utilizan los prefijos di, tri, tetra, etc. 3,3,4-tricloro-1-buteno • Cuando todos los hidrógenos de un hidrocarburo están substituidos por un halógeno se antepone el prefijo per-al nombre del halógeno. percloropentano Ejemplos 1-cloro-propano 2,3-dibromo-butano 1-bromo-2-buteno 1,2-dicloro-benceno o-dicloro-benceno ALCOHOLES ¿Qué son? Su estructura es similar a la de los hidrocarburos, en los que se substituye un o más átomos de hidrógeno por grupos "hidroxilo", -OH. 21 Química Orgánica ¿Cómo se nombran? • Se nombran como los hidrocarburos de los que proceden, pero con la terminación "-ol", e indicando con un número localizador, el más bajo posible, la posición del grupo alcohólico. Según la posición del carbono que sustenta el grupo -OH, los alcoholes se denominan primarios, secundarios o terciarios. 2-butanol • Si en la molécula hay más de un grupo -OH se utiliza la terminación "-diol", "-triol", etc., indicando con números las posiciones donde se encuentran esos grupos. Hay importantes polialcoholes como la glicerina "propanotriol", la glucosa y otros hidratos de carbono. 1,2,3-propanotriol ou glicerina • Cuando el alcohol non es la función principal, se nombra como "hidroxi-", indicando el número localizador correspondiente. 3-hidroxi-4-metil-pentanal Ejemplos etanol 2-propanol 3-buten-1-ol propanotriol (glicerol ou glicerina) 4-metil-ciclohexanol 2-hidroxi-butanal 22 Química Orgánica FENOLES ¿Qué son? Son derivados aromáticos que presentan grupos "hidroxilo", -OH. Los fenoles tienen cierto carácter ácido y forman sales metálicas. Se encuentran ampliamente distribuidos en productos naturales, como los taninos. ¿Cómo se nombran? • Se nombran como los alcoholes, con la terminación "-ol" añadida al nombre del hidrocarburo, cuando el grupo OH es la función principal. Cuando el grupo OH no es la función principal se utiliza el prefijo "hidroxi-" acompañado del nombre del hidrocarburo. 1,2-bencenodiol • Si el benceno tiene varios substituyentes, diferentes del OH, se numeran de forma que reciban los localizadores más bajos desde el grupo OH, y se ordenan por orden alfabético. En caso de que haya varias opciones decidirá el orden de preferencia alfabético de los radicales. 2-etil-4,5-dimetilfenol Ejemplos bencenol hidroxibenceno (fenol) 1,2-bencenodiol (pirocatecol) 1,3-bencenodiol (resorcinol) 1,4-bencenodiol (hidroquinona) 4-etil-1,3-bencenodiol 23 Química Orgánica 2-etil-5-metil-bencenol ÉTERES ¿Qué son? Son compuestos que resultan de la unión de dos radicales alquílicos o aromáticos a través de un puente de oxígeno -O-. ¿Cómo se nombran? • Se nombran interponiendo la partícula "-oxi-" entre los dos radicales. Se considera el compuesto como derivado del radical más complejo, así diremos metoxietano, y no etoximetano. metoxietano • También podemos nombrar los dos radicales, por orden alfabético, seguidos de la palabra "éter". etil isopropil éter En éteres complejos podemos emplear otros métodos: • Si los grupos unidos al oxígeno son iguales y poseen una función preferente sobre la éter, después de los localizadores de la función éter se pone el prefijo oxi- y el nombre de los grupos principales. 3,3'-oxidipropan-1-ol • Si aparecen varios grupos éter se nombran como si cada uno substituyera a un CH2 a través de la partícula -oxa-. 3,6-dioxaheptan-1-ol • Si un grupo éter está unido a dos carbonos contiguos de un hidrocarburo se nombran con la partícula epoxi-. 24 Química Orgánica 2,3-epoxibutano Ejemplos metoxietano etil metil éter etoxieteno etenil etil éter etil vinil éter metoxibenceno fenil metil éter isobutil isopropil éter bencil fenil éter 4-metoxi-2-penteno ALDEHÍDOS ¿Qué son? Se caracterizan por tener un grupo "carbonilo" C=O, en un carbono primario. ¿Cómo se nombran? • Sus nombres provienen de los hidrocarburos de los que proceden, pero con la terminación "-al". butanal • Si hay dos grupos aldehídos se utiliza el término "-dial". 25 Química Orgánica butanodial • Pero si son tres o más grupos aldehídos, o este no actúa como grupo principal, se utiliza el prefijo "formil-" para nombrar los grupos laterales. 3-formilpentanodial ácido 3-formilpentanodioico Ejemplos etanal butanal 3-butenal 3-fenil-4-pentinal butanodial 4,4-dimetil-2hexinodial CETONAS ¿Qué son? El grupo carbonilo, C = O, se encuentra en un carbono secundario. ¿Cómo se nombran? • Se pueden nombrar de dos formas: anteponiendo a la palabra "cetona" el nombre de los dos radicales unidos al grupo carbonilo 26 Química Orgánica metil propil cetona • o, más habitualmente, como derivado del hidrocarburo por substitución de un CH2 por un CO, con la terminación "-ona", y su correspondiente número localizador, siempre el menor posible y prioritario ante dobles o triples enlaces. 3-pentanona • Cuando la función cetona no es la función principal, el grupo carbonilo se nombra como "oxo". ácido 4-oxopentanoico Ejemplos propanona, ou dimetilcetona (acetona) butanona, ou etil metil cetona 2-pentanona,ou metil propil cetona 3-buten-2-ona ciclohexanona 4-hexin-2-ona,ou 2-butinil metil cetona ÁCIDOS CARBOXÍLICOS ¿Qué son? Se caracterizan por tener el grupo "carboxilo" -COOH en el extremo de la cadena. ¿Cómo se nombran? 27 Química Orgánica • Se nombran anteponiendo la palabra "ácido" al nombre del hidrocarburo del que proceden y con la terminación "-oico". ácido etanoico • Son numerosos los ácidos dicarboxílicos, que se nombran con la terminación "-dioico" ácido propanodioico • Cuando los grupos carboxílicos se encuentran en las cadenas laterales, se nombran utilizando el prefijo "carboxi-" y con un número localizador de esa función. Aunque en el caso de que haya muchos grupos ácidos también se puede nombrar el compuesto posponiendo la palabra "tricarboxílico", "tetracarboxílico", etc., al hidrocarburo del que proceden. Ácido 2-carboxipentanodioico o ácido 1,1,3-propanotricarboxílico Ejemplos ác. metanoico (ác. fórmico) ác. etanoico (ác. acético) ác. propenoico ác. benceno-carboxílico (ác. benzoico) 1,1,3-propanotricarboxílico ÉSTERES ¿Qué son? Son compuestos que se forman al sustituir el H de un ácido orgánico por una cadena hidrocarbonada, R'. 28 Química Orgánica ¿Cómo se nombran? • Se nombran partiendo del radical ácido, RCOO, terminado en "-ato", seguido del nombre del radical alquílico, R'. etanoato de etilo o acetato de etilo Si el grupo éster no es el grupo principal el nombre depende de que sea R o R' el grupo principal. • Si es R el grupo principal el substituyente COOR' se nombra como alcoxicarbonil- o ariloxicarbonil-. ácido 3-etoxicarbonil-propanoico • Si es R' el grupo principal el substituyente RCOO se nombra como aciloxi-. ácido 3-butanoiloxi-propanoico Ejemplos metanoato de metilo (formiato de metilo) etanoato de etilo (acetato de etilo) benzoato de etilo propanoato de fenilo 3-butenoato de metilo isopentiloato de isopropilo 29 Química Orgánica AMINAS ¿Qué son? Se pueden considerar compuestos derivados del amoníaco (NH3) al sustituir uno, dos o tres de sus hidrógenos por radicales alquílicos o aromáticos. Según el número de hidrógenos que se substituyan se denominan aminas primarias, secundarias o terciarias. ¿Cómo se nombran? • Se nombran añadiendo al nombre del radical hidrocarbonado el sufijo "-amina". metilamina • En las aminas secundarias y terciarias, si un radical se repite se utilizan los prefijos "di-" o "tri-", aunque, frecuentemente, y para evitar confusiones, se escoge el radical mayor y los demás se nombran anteponiendo una N para indicar que están unidos al átomo de nitrógeno. N-etil-N-metil-propilamina • Cuando las aminas primarias no forman parte de la cadena principal se nombran como substituyentes de la cadena carbonada con su correspondiente número localizador y el prefijo "amino-". ácido 2-aminopropanoico • Cuando varios N formen parte de la cadena principal se nombran con el vocablo aza. 2,4,6-triazaheptano • Los N que no formen parte de la cadena principal se nombran como amino-, aminometil-, metilamino-, etc. 30 Química Orgánica 2-amino-3-aminometil-5-metilamino-1,6-hexanodiamina Ejemplos metilamina trimetilamina N-metiletilamina N-etil-Nmetilpropilamina fenilamina (anilina) ácido 2aminopropanoico AMIDAS ¿Qué son? Derivan de los ácidos carboxílicos por substitución del grupo -OH por un grupo dando lugar a amidas sencillas, amidas N-substituidas o N, N-disubstituidas. ¿Cómo se nombran? • Se nombran como el ácido del que provienen, pero con la terminación "-amida". etanamida ou acetamida 31 Química Orgánica • Si se trata de amidas substituidas hay que especificar los radicales unidos al nitrógeno anteponiendo la letra N. N-metil-etanamida • Se utiliza el sufijo -carboxamida para el grupo -CO-NH2 cuando el ácido de referencia se nombra usando el sufijo -carboxílico. 1,2,4-butanotricarboxamida • Cuando la función amida no es la principal, el grupo -CO-NH2 se nombra por el prefijo carbamoil-, y un grupo como -CO-NH-CH3 por el prefijo metilcarbamoil-. El grupo -NHCO-CH3 se nombra como acetamido-, y el grupo -NH-CO-CH2-CH2-CH3 como propanocarboxamido-. ácido 4-carbamoilhexanoico ácido 4-etanocarboxamidohexanoico 32 Química Orgánica Ejemplos etanamida o acetamida benzamida N-metiletanamida o Nmetilacetamida N-metilbenzamida diacetamida N-metildiacetamida NITROCOMPUESTOS ¿Qué son? Se pueden considerar derivados de los hidrocarburos en los que se substituyó uno o más hidrógenos por el grupo "nitro", -NO2. ¿Cómo se nombran? • Se nombran como substituyentes del hidrocarburo del que proceden indicando con el prefijo "nitro-" y un número localizador su posición en la cadena carbonada. 2-nitrobutano • Las insaturaciones tienen preferencia sobre el grupo nitro. 3-nitro-1-propeno 33 Química Orgánica Ejemplos nitrometano 3-nitro-1-propeno 2-nitrobutano nitrobenceno p-cloronitrobenceno 2,4,6-trinitrotolueno (T.N.T.) NITRILOS ¿Qué son? Se caracterizan por tener el grupo funcional "ciano" -CN, por lo que a veces también se les denomina cianuros de alquilo. ¿Cómo se nombran? • Hay varios sistemas válidos de nomenclatura para estos compuestos. En los casos sencillos las posibilidades son tres: A) añadir el sufijo -nitrilo al nombre del hidrocarburo de igual número de átomos de carbono; 34 Química Orgánica etanonitrilo B) considerarlo como un derivado del ácido cianhídrico, HCN; cianuro de propilo C) nombrarlo como derivado del ácido RCOOH, relacionando RCOOH con RCN, en el caso de que dicho ácido tenga nombre trivial aceptado. acetonitrilo • Otra nomenclatura para el grupo -CN es el sufijo -carbonitrilo. 1,1,2,2-etanotetracarbonitrilo • Cuando el grupo CN no sea el principal se nombra como cianoEjemplos etanonitrilo cianuro de metilo acetonitrilo 3-metil-butanonitrilo cianuro de fenilo benzonitrilo ciclohexanocarbonitrilo 35 Química Orgánica 1,1,2,2etanotetracarbonitrilo 2-butenonitrilo UNIDAD I: REGLAS DE NOMENCLATURA Nomenclatura IUPAC para Alcanos 1) Seleccione la cadena continua más larga de átomos de carbono como la cadena principal del hidrocarburo base. Si dos cadenas tienen la misma longitud aquella que tenga más cadenas laterales es la principal. Entonces se da nombre al alcano como derivado de este hidrocarburo base. 2) El nombre del hidrocarburo base tiene la terminación usual -ano precedida de: met, et, prop, but, pent, hex, etc., que corresponde a: C1, C2, C3, C4, C5, C6 etc., en la cadena principal. 3) Las cadenas laterales se consideran como sustituyentes que reemplazan hidrógenos en la cadena principal. Sus posiciones se indican por números asignados a los carbonos del hidrocarburo base. Se numeran consecutivamente los átomos de carbono de la cadena principal a partir de uno de sus extremos de tal forma que la posición de los sustituyentes se indique con los números más pequeños posibles. Cuando se compara las series de números que compiten, la que tenga el número menor en el primer punto de diferencia es la que se escoge. 36 Química Orgánica 4) El nombre de los sustituyentes se pone antes del nombre del hidrocarburo base, en orden alfabético. El nombre del último sustituyente se liga con el nombre del hidrocarburo base como una sola palabra. Al ordenar alfabéticamente los sustituyentes no se consideran los prefijos escritos en cursiva:(n-, sec-, ter-, etc.) ni los prefijos mutiplicadores:(di-, tri- tetra-, etc.) a menos que el prefijo multiplicador sea parte de un radical complejo encerrado entre paréntesis. 5) Cada sustituyente se precede de un número que denota su posición en la cadena principal. Siempre se separan los números del nombre del sustituyente con guiones. Cuando dos sustituyentes están en posiciones equivalentes, al primero citado se le asigna el número menor. 6) Los sustituyentes idénticos se indican por los prefijos multiplicadores: di-, tri- tetra-, etc. Esos prefijos se hacen preceder de números consecutivos que designan la posición de cada uno de los sustituyentes idénticos. Los números se ordenan en orden creciente de magnitud y se separan por comas. 7) Para dar nombre a un radical complejo a) Escoja la cadena continua mayor dentro del grupo, comenzando por el carbono ligado a la cadena principal. Cualquier grupo unido a esta cadena que se escogió se identificará como sustituyente de esta cadena en la forma usual. b) El primer carbono (C1) de la cadena secundaria escogida es el que está unido a la cadena principal del hidrocarburo base. Los números de los otros carbonos de esta cadena se colocan de acuerdo a éste. c) El nombre completo del grupo complejo se encierra entre paréntesis y el número que denota su posición en la cadena principal del hidrocarburo base se coloca antes del primer paréntesis. 8) Las reglas de IUPAC permiten el uso de nombres comunes de los alcanos no sustituídos tales como: isobutano, isopentano, neopentano, isohexano y de los grupos alquilo no sustituídos tales como: isopropil (metiletil o 1-metiletil), sec-butil (1-metilpropil), isobutil (2-metilpropil), ter-butil (dimetiletil), isopentil (3-metilbutil), neopentil (2,2-dimetilpropil), ter-pentil (1,1- dimetilpropil), isohexil (4-metilpentil). Nomenclatura IUPAC para Alquenos y Alquinos Los alquenos y los alquinos se identifican usando prácticamente las mismas reglas que se emplearon para asignar nombres a los alcanos pero hay algunas modificaciones: 37 Química Orgánica 1) Se selecciona como cadena principal del hidrocarburo base la cadena continua más larga que contenga la unión C=C o C≡C. 2) El nombre del hidrocarburo base se caracteriza por la terminación eno- si tiene un enlace C=C y por la terminación ino- si tiene un enlace C≡C. 3) Se enumera la cadena principal de átomos de carbono que contiene el enlace múltiple, comenzando por el extremo más cercano a dicha unión. De esta forma, se asigna el número más bajo posible a la posición del enlace múltiple. 4) El más bajo de los números asociados con los dos carbonos de la unión múltiple se escoge para indicar la posición del enlace y este número aparece inmediatamente antes del nombre del alqueno o del alquino. Para los compuestos complejos el número que designa un doble enlace se puede colocar entre el prefijo (alc-) y el sufijo (eno- o ino-). 5) Cuando existen dos o más uniones C=C o C≡C en la cadena continua más larga que contiene tales enlaces se usa las terminaciones:-adieno, -atrieno, etc. o -adiino, atriino, y se indica cada una de las posiciones múltiples por un número, por ejemplo: 2-metil-1,3-butadieno. 6) Cuando en el mismo compuesto existen enlaces C=C y C≡C se escoge como cadena principal aquella que contenga el número máximo de esas uniones. Los dobles enlaces tienen precedencia sobre los triples al asignar el nombre. Se asignan los números más pequeños posibles a las uniones múltiples aunque en algunos casos esto hace que un enlace C≡C sea localizado por un número más pequeño que un enlace C=C. Sin embargo, cuando hay posibilidad de elección a los dobles enlaces se les asigna los menores números. 7) Los sustituyentes y sus posiciones se indican en la forma usual. Nomenclatura IUPAC para compuestos que contienen Grupos Funcionales Los compuestos orgánicos que contienen grupos funcionales (por ejemplo, R-X en donde X es un grupo funcional) se identifican indicando el reemplazo de un hidrógeno en un compuesto base acíclico o cíclico (R-H) por el grupo X. El nombre de un compuesto R-X acíclico se asigna según las siguientes reglas: 1) Cuando existen dos o más grupos funcionales en un compuesto se debe determinar cuál es el grupo principal. En la tabla se da el orden de prioridad de varios grupos funcionales. El grupo que está más arriba en este orden es considerado como el grupo principal o función principal. El grupo funcional en un compuesto monofuncional es el grupo pricipal de ese compuesto. 38 Química Orgánica 2) La cadena continua más larga que contiene el grupo principal se escoge como la cadena principal del compuesto. Para hacerlo se sigue un orden de procedencia sucesivamente hasta que se puede hacer una decisión y seleccionar la cadena principal: a) La que contenga el mayor número de grupos principales b)La que tenga el número máximo de enlaces múltiples c) La de mayor longitud d)La de mayor número de enlaces C=C, etc. 3) Se enumera la cadena principal en tal forma que se usen los números más bajos posibles para indicar la posición del grupo principal. 4) La última parte de un nombre sustitutivo se construye citando el sufijo correspondiente al grupo principal (véase la tabla) después del nombre compuesto base R-H (su nombre se decide por el número de átomos de carbono y el grado de insaturación en la cadena principal). La posición del grupo principal y la posición de los enlaces múltiples se indica de la siguiente manera: a) Si la cadena principal es saturada: se coloca un número que indica la posición del grupo principal, luego el nombre del alcano (omitiendo la o final si el sufijo empieza con vocal) y por último el sufijo. Por ejemplo: 4-butanol, 4-butanotiol b) Si la cadena principal contiene un enlace C=C: se coloca un número que indica la posición del doble enlace, luego el nombre del alqueno (omitiendo la o final si el sufijo empieza con vocal, y por último el sufijo, que indica la posición y nombre del grupo principal. Por ejemplo: 3-buten-2-ol. c) Si la cadena principal contiene un enlace C≡C: se coloca un número que indica la posición del triple enlace, luego el nombre del alquino (omitiendo la o final si el sufijo empieza con vocal), y por último el sufijo, que indica la posición y nombre del grupo principal. Por ejemplo: 3-butin 2-ona. 5) Los grupos funcionales que no se escogieron como función principal se identifican como sustituyentes usando losprefijos apropiados (véase la tabla). Ciertos grupos funcionales no tienen un sufijo conveniente y se identifican como sustituyentes con los prefijos siguientes: flúor- para F-, cloro- para Cl-, bromo- para -Br, yodo- para I-, alcoxi- para RO-, nitroso- para -NO, nitro- para -NO2. 6) Todos los sustituyentes se deben citar en orden alfabético. En esta ordenación no se consideran los prefijos multiplicadores a menos que sean parte del nombre de un radical complejo encerrado entre paréntesis. 7) Las posiciones de los sustituyentes deben indicarse con la notación adecuada: los números se separan unos de otros por medio de comas y de las palabras por medio de guiones. 39 Química Orgánica Cadenas Laterales y Radicales Tal como se mencionó anteriormente, un tipo de sustituyentes de las cadenas principales son las cadenas laterales, también conocidas como radicales. Los radicales son el conjunto de átomos que resulta de la pérdida formal de un hidrógeno de un hidrocarburo. Si el hidrocarburo era un alcano, el radical será un alquilo, mientras que si es un alqueno o alquino, los radicales originados serán alquenilos o alquinilos, respectivamente. Punto de unión con la cadena principal H3C CH3 CH CH2 CH2 ó ó CH3 Isopropilo Propilo CH3 CH2 CH2 CH2 ó CH CH2 CH2 CH3 ó n-butilo o butilo normal Isobutilo CH3 H3C CH CH2 ó C CH3 ó H3C CH3 sec-butilo ter-butilo CH CH ó HC2 CH2 ó HC C H2C Etenilo o Vinilo ó ó Fenilo 2-propenilo o Alilo Etinilo ó ó Bencilo 40 Química Orgánica Ciclopentilo Ciclobutilo Ciclohexilo 3-metilciclohexilo Nomenclatura de Amina Las aminas pueden considerarse como derivados del amoníaco en las cuales uno a más de los hidrógenos han sido reemplazados por radicales alquílicos o arílicos, dando origen así a las aminas primarias, secundarias y terciarias. a) Para las aminas primarias (se ha reemplazado sólo un hidrógeno por una cadena alquílica o arílica), se las nombra tomando el nombre del radical sin la letra o final y agregando la palabra amina. Ejemplo: etilamina. En caso de que el grupo amino se encuentre en una posición no terminal de una cadena, se tomará como C-1 el carbono en el cual se encuentra el grupo amino, nombrándose la cadena como un radical compuesto. Ejemplo: (1-etil-4metilpentil)amina. b) Las aminas secundarias y terciarias se nombran como si fueran derivados de aminas primarias, precedidas por los nombres del o los grupos alquilos adicionales. Estos grupos alquilos se nombran anteponiendo la letra N-para indicar que se encuentran sustituyendo los hidrógenos de la amina y no la cadena principal. Ejemplo: N-etilbutilamina. Nomenclatura en derivados del Benceno El anillo bencénico puede encontrarse en una molécula ya sea como sustituyente de una cadena principal (en cuyo caso se lo nombrará como radical, es decir, fenilo), o bien como parte principal o base de la estructura. Las reglas de nomenclatura a adoptar en caso de que el benceno sea la estructura principal son las siguientes: a) Si el benceno está monosustituido, se le asigna el número 1 al carbono que porta la sustitución, y el nombre se construye ligando el nombre del sustituyente con la palabra benceno, no siendo necesario citar el número del localizador, por ejemplo: etilbenceno. b) Si el benceno está polisustituído se debe elegir una numeración que le otorgue los menores números a todos los sustituyentes del anillo. Si varias de esas secuencias numéricas son iguales, se elige la que le asigna el menor número al sustituyente que precede por orden alfabético. El nombre se forma enunciando los sustituyentes por orden alfabético precedidos por sus números localizadores a los que le sigue la palabra benceno. Ejemplo: 1-etil-3,5-dimetilbenceno (recordar que los prefijos multiplicadores no se alfabetizan). c) Si el benceno está disustituido, siguiendo las reglas anteriores se pueden obtener sólo 3 tipos de disustituciones: 1,2-; 1,3-; y 1,4-. A la sustitución 1,2- se la conoce como sustitución orto y se la suele abreviar con una o- delante del nombre, por ejemplo: o41 Química Orgánica dinitribenceno o 1,2-dinitrobenceno. De manera análoga, la sustitución 1,3- recibe el nombre de sustitutción meta y la 1,4- sustitución para, abreviándose con una m y una p respectivamente (m-nitroclorobenceno, p-dietilbenceno). Existen estructuras derivadas del benceno que poseen nombres propios que se utilizan comúnmente y son aceptados por la IUPAC. Los más comunes son: CH3 Tolueno OH NH2 Fenol Anilina COOH Acido Benzoico TABLA DE PREFIJOS Y SUFIJOS PARA ALGUNOS GRUPOS FUNCIONALES SEGUN LA NOMENCLATURA SUSTITUTIVA DE LA IUPAC GRUPO FUNCIONAL C OH PREFIJO (carboxi-) SUFIJO -oico [ácido] -carboxílico [ácido] (sulfo-) -sulfónico [ácido] (alcoxicarbonil-) -oato -carboxilato (haloformil-) -oilo [halogenuro de] -carbonilo [halogenuro] (carbamoil-) O C N -amida -carboxamida (ciano-) -nitrilo C H (fornil-) -carbonitrilo -al -carbaldehído C (oxo-) -ona O O H hidroxi- -ol amino- -amina O SO3H C OR O C X O C NH2 O NH2 42 Química Orgánica En los casos en que hay dos sufijos para el mismo grupo funcional, el inferior es el único que se usa cuando el grupo funcional está ligado a un sistema cíclico. Los prefijos encerrados entre paréntesis rara vez se emplean en el nombre de compuestos sencillos, apareciendo casi de forma exclusiva como sufijos. No ocurre lo mismo con los grupos -OH y -NH2, los cuales corrientemente pueden aparecer acompañando a un grupo funcional de mayor prioridad, como por ejemplo en los aminoácidos. TABLA DE PRIORIDADES EN NOMENCLATURA IUPAC PARA ALGUNOS GRUPOS FUNCIONALES COMUNES ESTRUCTURA PARCIAL NOMBRE + N(CH3)3 ión onio (ej: amonio) CO2H ácido carboxílico SO3H ácido sulfónico CO2R éster CONR2 amida CN nitrilo CHO aldehído CO cetona ROH alcohol ArOH fenol NR2 amina C alqueno C C C alquino X halógeno NO2 nitro- C6H5 R fenilalquil- 43 Química Orgánica 44