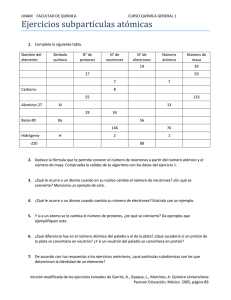
INSTITUCION EDUCATIVA N° 113 “Daniel Alomía Robles” AREA: C.T.A Grado: 3ro“D” “E” Profesor: José Rivera Aldave Fecha: 05- 05 - 09 SESION DESARROLLADA DEL APRENDIZAJE I.- UNIDAD DE TRABAJO: EL ATOMO II.-PROGRAMA INFORMACIÓN: 1.- Concepto de átomo 2.- Partes de un átomo 3.- Partículas subatómicas 4.- Propiedades del núcleo 5.- Tipo de átomos: Isótopos, isóbaros e isótonos III.- OBJETIVOS.• Diferencian el concepto de partícula molécula y átomo • Calcular el número de protones y neutrones de un elemento dado, su número atómico y su número de masa. • Explica y elabora modelos del átomo en términos de partículas fundamentales, como núcleo periferia protones, neutrote y electrones. IV.- MOTIVACIÓN Y APREHENSION.- Los alumnos electrizan cuerpos por frotamiento y por inducción y determinan experimentalmente la naturaleza de las cargas. Construyen modelos atómicos usando recursos al alcance de los alumnos. Analizan y comentan sobre las partes del átomo y sus propiedades. Realizan ejercicios para determinar el numero de protones, neutrones, electrones, numero atómico, etc. V.- ADQUISICIÓN Y RETENCIÓN.1.- EL ATOMO.- Es una partícula ínfima de todo elemento químico. Antiguamente se consideraba indivisible. El diámetro del 8 átomo es de 10- cm. Y esta formado por un núcleo, de naturaleza positiva, que contiene a los protones y neutrones y por los electrones de naturaleza negativa.2.- PARTES DE UN ATOMO.- Esta formado por: A).- EL NÚCLEO B).- LA NUBE ELECTRÓNICA:A.- NÚCLEO.- Parte central llamado núcleo donde se encuentra el 99.99% del peso total del átomo. Se encuentra formado por nucleones, los cuales pueden ser de dos clases protones (p+) y neutrones (n ). a).- PROTONES.- Fue descubierta por Ernest Rutherford en 1911. Se encuentra alojada dentro del núcleo y su masa es de 1.672 x 10 -24 g b).- NEUTRONES.- Son partículas subatómicas sin carga eléctrica y tiene una masa de 1,675 x 10 -24 g y fue descubierta por James Chadwick en 1932. a.- ELECTRONES.- Fue descubierta por Joseph Thomson en 1897. Son partículas subatómicas que tienen carga eléctrica negativa y se mueven en regiones llamadas capas o niveles de energía su masa es de 9. 11 x 10 Partícula Masa(g) -28 g Masa Carga Carga Descubrido (uma) Eléctrica eléctrica r relativa Electrón 9. 11 x 10 -28 g 0.0005 -1.6 x 10 -19 -1 Joseph Thomson Protón 1.672 x 10 -24 g 1.007 +1.6 x 10 -19 +1 Ernest Rutherford Neutrón 1,675 x 10 -24 g 1.008 0 0 J. Chadwick 3.- EL ÁTOMO Y OTRAS PARTÍCULAS SUBATÓMICAS ATOMO PARTICULAS SUBATOMICAS PROTONES NEUTRONES ELECTRONES OTRAS PARTICULAS SUBATOIMICAS POSITRONES NEUTRINOS MESONES LOS QUARKS HIPERONES NUCLEONES LEPTONES 4.- PROPIEDADES DEL ATOMO .- Las propiedades del átomo que dependen del núcleo, son las siguientes: A).- Representación del núcleo 1. Número atómico (Z) 2. Número de masa (A) B).- Tipos de átomos 1. Isótopos 2. Isóbaros 3. isotonos C).- Radioactividad A.-REPRESENTACIÓN DEL NÚCLEO .- El núcleo del átomo se representa con tres elementos fundamentales. a.- Símbolo del elemento b.- Numero de masa (protones + neutrones= nucleones) c.- Número atómico A 27 E Al Z 13 Donde; E.- símbolo del átomo A = numero de masa Z = numero atómico 1.-NUMERO DE MASA.(A).- Es la suma de protones y neutrones(nucleones) contenidos en el núcleo atómico. Se representa con la letra mayúscula A 2.- NUMERO ATOMICO .- (Z).- Es el número de protones que se encuentra en el núcleo de cada átomo y se representa por la letra mayúscula Z • El número de protones es igual al número de electrones • El numero atómico representa: * Numero de protones en el núcleo * Numero de electrones en su nube electrónica * Numero de orden en la T.P B.- TIPOS DE ÁTOMOS TIPOS DE ATOMOS ISOTOPOS ISOBAROS ATOMO DE UN MISMO ELEMENTO ATOMO DE DIFERENTE ELEMENTO Igual Z pero diferente A ISOTONOS ISOELECTRICOS ATOMOS DE DIFERENTE ELEMENTO Diferente Z pero igual A IONES Igual numero de neutrones Igual numero de electrones 1.- ISÓTOPOS.- (iso = igual; topos = lugar Llamados también hilidos, son átomos diferentes de un mismo elemento, es decir poseen un mismo numero atómico pero diferente cantidad de neutrones. Tienen propiedades químicas iguales, ya que tienen el mismo número de electrones. Tienen propiedades físicas diferentes, puesto que su masa es distinta para cada isótopo. Los isótopos radiactivos o artificiales reciben el nombre de RADIOISÓTOPOS. Ejemplos Isótopos del Hidrógeno Protio 1 H H 2 Deuterio 1 Isótopo del Oxigeno: 1 15 O 16 8 Isótopo del Uranio. 3 tritio 1 O 25 8 235 U H 0 8 236 U 238 U 92 92 92 2.- ISOBAROS: Son átomos que corresponde a elementos diferentes pero estos poseen una misma cantidad de nucleones fundamentales (igual numero de masa) Poseen propiedades físicas semejantes pero difieren en sus propiedades químicas. N C 13 13 7 6 3.- ISOTONOS: Son átomos de diferentes elementos, que tienen igual numero de neutrones, pero diferente numero atómico y diferente numero de masa. Ejemplos B 12 5 6 11 6n C 13 23 N Na 7 6n 11 Mg 24 12 6n 12 n 12 n 4.- ISOELECTRICOS .- Son átomos que tienen igual numero de electrones. Iones catión (-) y anión(+) Ej Cloro -2 +1 +1 Na , H , Au +3 CUESTIONARIO 1. ¿Cuales son las partículas subatómicas? 2. ¿Como se concibe en la actualidad el átomo? 3. ¿Porque los protones no se repelen en el núcleo? 4. ¿Que demostró Thomson? 5. ¿Cuales son las partes de un átomo? 6. Porque es importante el núcleo? 7. ¿Como se representa el núcleo de un átomo. De 4 ejemplos? 8. ¿Que diferencia hay entre isótopos e isóbaros? 9. ¿Que representa el numero atómico? Las Flores, 05 de Mayo del 2009 José Rivera Aldave Profesor de CTA Rossana Quispe Sandoval SDFG EJERCICIOS DEL LIBRO 1.- Representa el núcleo del Oxigeno, aluminio, plomo. 2.- Representa el núcleo del elemento N° 15 de la TP y determina el número de protones, electrones y neutrones. 3.- Un átomo neutro de número atómico 31 y número de masa 70 tiene: a).- 31 p y 32 e b).- 31 p y 39 e c).- 32 p y 39e d).- 31 e y 39 n e).- 39 p y 31 n 4.- El átomo del paladio tiene 46 p ; 60 n y 46 electrones. Determina el número atómico y el número de masa respectivamente. a).- 46 y 60 b).- 46 y 46 c).- 60 y 106 d).- 60 y 92 e).- 46 y 106 5.- Cuales de las siguientes proposiciones son correctas: I).- Un átomo con numero de masa 24 y numero atómico 11 tiene 13 n II).- Un átomo con 16 p+ y 16 n° tienen un numero de masa 32 III).- El átomo con 26 p+ y 23 e-, tienen el numero atómico 26 a).-Solo I b).- I y II c).- I y III d).- II y III e).- I , II y III 6.- Indique la especie química que posee mayor número de neutrones a).- 20 Ne b).- 35 Cl c).- 31 P d).- 33S e) .- 33 K 10 17 15 16 19 7.- Considera las siguientes especies químicas 44 Sc+3 21 40 Ca 20 39 K 19 40 K 19 a).- hay 1 catión b).- Hay 2 isóbaros c).- Hay 2 isoeléctricos d).- Hay 2 isótopos e).- Hay 2 isotonos 8.- una especie química presenta 29 protones, 35 neutrones y 28 electrones. Indique su número atómico, número de masa, y la carga de la especie. a).- 35 , 64; +1 b).- 28 ; 53 ; +1 c).- 29 ; 64: +1 d).- 29; 64; -1 e).- 28; 64, +1 +3 127 9.- Para el siguiente Cation Sb Indique que alternativas son correctas. 51 I.- Posee 76 neutrones II.- El átomo neutro tiene 51 electrones III.- su núcleo posee 48 protones a).- I y III b).- II y III c).- III d).- I y II e).- solo II 10.- Un átomo presenta numero de masa 127, numero atómico 53 . Calcular el número de neutrones a).- 53 b).- 73 c).- 54 d).- 74 e).- 68 11.- Un átomo neutro que tiene 18 electrones y 40 nucleones. ¿Cual es el valor de Z? a).- 22 b).- 18 c).- 40 d).- 58 e).- 20 19 12.- La suma de protones y electrones de F es 9 a).- 10 b).- 18 c).- 19 d).- 9 e).- 28 13.- Un átomo presenta 78 electrones y 120 neutrones. Calcular el número de masa a).- 198 b).- 200 c).- 205 d).- 196 e).- 194