Calibración de Balanza y Verificación Volumétrica - Análisis Químico
Anuncio

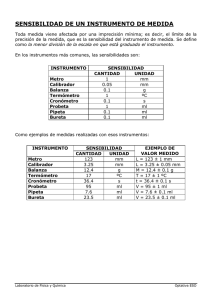
PRACTICA 1 DE LABORATORIO DE PRINCIPIOS DE ANÁLISIS QUÍMICO CALIBRACIÓN DE LA BALANZA Y VERIFICACIÓN DE MATERIAL VOLUMÉTRICO OBJETIVOS: Adquirir practica en la utilización de la balanza y el material volumétrico. Identificar los errores que pueden influir en un resultado experimental. Aprender a hacer un análisis estadístico de resultados y para qué sirve RESUMEN: Se aprendió a usar una balanza de manera adecuada, midiendo pesas de diferentes masas, adicional se puso a prueba la exactitud del material volumétrico, y la precisión, pesando experimentalmente diferentes volúmenes repetidas veces. Finalmente se analizó estadísticamente el margen de error que presentaron los resultados experimentales, el cual fue muy bajo. MATERIALES Y REACTIVOS El instrumento que más se usó durante la práctica fue la balanza, con ella se obtuvo las medidas de las pesas de calibración, los volúmenes de agua del balón volumétrico, la probeta graduada, la pipeta aforada/graduada y la bureta. Como algunos instrumentos volumétricos no podían pesarse directamente en la balanza, también se usaron envases de plástico pequeños para traspasar volúmenes obtenidos y pesar. El único reactivo utilizado fue el Agua destilada. PROCEDIMIENTO Para la parte de las balanzas, se utilizaron pesas de distintas masas para obtener datos de masas reales tomadas 5 veces por cada masa y se anotaron 6 pesas cada una con diferente masa. En la parte de la verificación del material volumétrico se verificaron 4 instrumentos volumétricos (Balón aforado 25mL, probeta de 25mL, Pipeta de 10 mL, Bureta de 25mL) cada instrumento se afora con agua destilada, el agua destilada es el único reactivo que utilizamos. Primero se toma el peso que arroja la balanza de cada instrumento sin agua, y después se toma el peso de cada instrumento con agua, así se saca una diferencia de pesos, y se puede estimar el volumen promedio de cada instrumento con la ecuación resaltada en la parte de cálculos y resultados. Para la Pipeta aforada y la Bureta, por el tamaño de la altura de dichos instrumentos, no es posible calcular su peso directamente de las balanzas analíticas que tenemos en el laboratorio, se emplea un recipiente patrón (Vasos precipitados) para el cálculo de dichos pesos. CÁLCULOS Y RESULTADOS Calibración de la Balanza Masa Nominal (g) 1 2 10 20 50 100 Masa Real (g) 1,0043 2,0052 10,0077 20,0207 49,1625 100,0419 Desvest.M Desviación Estándar x 2 0,000109 0,0002180 0,0001 0,0002000 0,00015 0,0003000 0,000134 0,0002680 0,000084 0,0001680 0,000122 0,0002440 Masas Reales (g) 120,0000 y = 0,9981x - 0,0685 R² = 0,9999 100,0000 80,0000 60,0000 40,0000 20,0000 0,0000 0 20 40 60 80 100 120 Masas Nominales (g) Fig.1: Grafica de la curva de calibración de la Balanza. Con su respectiva ecuación de la recta. Cálculos para el Balón Aforado de 25 mL W1 /g W2 /g 23,0886 23,0885 47,9131 47,9099 A /g cm-3 B /g cm-3 D /g cm-1 0,00086748 8,0 0,997992 Gama / ºC-1 0,0000065 T /ºC 22 23,0885 23,0885 23,0889 23,0886 47,9092 47,9083 47,9101 47,9101 Promedio ṽ20=(47,9101-23,0886)*((1/(0,997992-0,00086))*(((1-0,00086/8)+((1-0,0000065*(22-20))) ṽ20=24,89 mL uc ṽ20=0,03 Promedio S %Er CV, % 24,89 mL 0,00178 mL 0,109 % 0,00716 % Tol del Balón Aforado: 0,04 Tol Max: 0,08 Tol. ≥ (((0,109)+2(0,00716))/(100)))*25mL Tol ≥ 0,0308 0,04 mL ≥ 0,0308 Cálculos para la Probeta 25 mL W1 /g W2 /g A /g cm-3 53,6645 78,3063 0,00086748 53,6644 53,6643 53,6642 53,6643 78,3057 78,3051 78,3044 78,3053 53,6643 78,30536 Promedio B /g cm-3 D /g cm-1 8,0 Gama / ºC-1 0,997992 0,0000065 T /ºC 22 ṽ20=(78,3053-53,6643)*((1/(0,997992-0,00086))*(((1-0,00086/8)+((1-0,0000065*(22-20))) ṽ20=24,72 mL uc ṽ20=0,03 Promedio S %Er CV, % 24,89 0,00060 0,28013 0,00241 mL mL % % Tol de la Probeta: ± 0,5mL Tol Max: 0,5 mL Tol. ≥ (((0,28013)+2(0,00241))/(100)))*25mL Tol ≥ 0,071mL 0,5 mL ≥ 0,071mL Cálculos para la Pipeta Aforada 10 mL W1 /g W2 /g 77,879 77,8784 77,8788 77,8788 77,8787 77,8787 A /g cm-3 87,8122 0,00086748 87,8103 87,8097 87,8176 87,8121 87,81238 Promedio B /g cm-3 D /g cm-1 8,0 0,997992 Gama / ºC-1 0,0000065 ṽ20=(87,8123-77,8787)*((1/(0,997992-0,00086))*(((1-0,00086/8)+((1-0,0000065*(22-20))) ṽ20= 9,97 mL uc ṽ20= 0,03 Promedio S %Er 9,97 0,00307 0,034 mL mL % T /ºC 22,9 CV, % 0,03079 % Tol de la Pipeta ± 0,020 mL Tol Max: 0,4 mL Tol. ≥ (((0,034)+2(0,03079))/(100)))*10mL Tol ≥ 0,0095mL 0,020 mL ≥ 0,0095mL Cálculos para la Bureta 25 mL W1 /g W2 /g 5,4003 5,4022 5,4023 5,4091 5,4001 33,1926 33,1903 33,1891 33,1882 33,1926 5,4028 33,19056 Promedio A /g cm-3 B /g cm-3 D /g cm-1 0,00086748 8,0 0,997992 Gama / ºC-1 0,0000091 ṽ20=(33,19056-5,4028)*((1/(0,997992-0,00086))*(((1-0,00086/8)+((1-0,0000091*(22-20))) ṽ20=27,88 mL uc ṽ20=0,03 Promedio S %Er CV, % 27,88 0,00547 0,13564 0,01964 mL mL % % Tol de la Bureta: ± 0,05 mL Tol Max: 0,1 mL Tol. ≥ (((0,135)+2(0,01964))/(100)))*25mL T /ºC 22 Tol ≥ 0,04mL 0,05 mL ≥ 0,0095mL DISCUSIÓN: El coeficiente de variación que presentaron los datos del volumen del balón aforado es de 0,071583; esto quiere decir que hubo alta precisión en las medidas tomadas. Atribuimos este resultado a que estuvimos muy pendientes de ajustar en cada medición el menisco en la línea de afore. Además la tolerancia hallada con los resultados (0,0308) también es baja. Por otra parte no fue exacta la medición experimental del volumen respecto a la información proporcionada por el instrumento, puesto que un volumen que debía ser de 25ml ± 0,04, en el promedio experimental dio 24,89, se salió del rango 24,96-25,04. Posiblemente hubo un error aleatorio, como de condiciones ambientales, contaminación de los instrumentos (instrumentos con trozos de impurezas) que alteraron el objetivo de exactitud o el instrumento tenia mal proporcionada información. Los resultados de las pesas de calibración presentaron una desviación estándar casi despreciable, entre 0,0001 y 0,0002, esto quiere decir que todos los valores se acercaron a la media. Asumimos que la confiabilidad de estos datos se debe principalmente al instrumento de medición, que tiene una incertidumbre de 0,0001 g. Con la probeta de 25ml la medida experimental promedio fue de 24,64 ml, respecto a la exactitud este resultado tiene coherencia con la tolerancia del instrumento que es de 0,5. Es importante resaltar que esta tolerancia es la más alta comparada con la de los demás instrumentos de medida utilizados, esto a su vez influyó en que el porcentaje de error relativo en esta medida fuera el más alto con un porcentaje de 0,28013%. El error relativo más bajo fue el obtenido con los datos de la pipeta aforada (0,034), esto se debe a que el instrumento tiene una tolerancia de 0,020 mL, lo cual reduce el margen de error. Por otra parte, la tolerancia hallada con las medidas obtenidas fue de 0,0095, esto también nos indica alta precisión. En la bureta hubo un error relativo de 0,13564%, este valor es más alto que el de la pipeta. Un factor que influyó fue la tolerancia del instrumento que es de 0,05mL, lo cual aumenta el error sistemático en comparación al de la pipeta. Adicional creemos que hubo un error aleatorio, poniendo las cantidades adecuadas de agua, o varianza en las condiciones ambientales, puesto que el promedio del resultado experimental :27,88 ml teniendo en cuanta la tolerancia instrumental no queda en el rango de 25mL. Uno de los factores que pudo influir en los errores presentados por los volúmenes de pipeta aforada y bureta, fue el hecho de haber traspasado el volumen a un envase para pesar, pues la masa posiblemente no se pasó completamente, por viscosidad y también por posibles impurezas que contaminaron los instrumentos, a este le podemos llamar un error aleatorio. CONCLUSIONES Para medir una masa y un volumen respectivamente, la balanza debe estar calibrada antes de cualquier medición y el material volumétrico purgado, con los volúmenes ajustados a la línea de afore. Siempre hay un margen de error, puede ser uno sistemático como el error instrumental y/o aleatorio como el dictamen del observador o algo que dependa de él. El análisis de datos nos permite entender que tanto varían los datos, la magnitud del error. Con esta información podemos reconocer que tan confiables son unos datos, y profundizar en las causas de dichos resultados. BIBLIOGRAFIA Química Analítica. D.A. Skoog, D.M. West y F.J. Holler, 6ª Ed. Mc Graw Hill, 1995. Química Analítica Cuantitativa. R.A. Day y A.L. Underwood, 5ª Ed. Prentice Hall, 1995 Análisis Instrumental. J.F. Rubinson y K.A. Rubinson, Prentice Hall, 2000 Principios de Análisis Instrumental. Skoog, Holler y Nieman, 5ª Ed. Mc Graw Hill, 2001