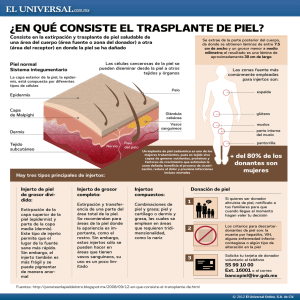
RECHAZO Rechazo: es el proceso por el cual el sistema inmunitario reconoce al órgano trasplantado (injerto) como extraño, se sensibiliza contra él y reacciona para tratar de destruirlo. Esta reacción inmunológica está provocada por antígenos extraños del injerto, no existentes en el receptor. Con excepción del sistema del grupo sanguíneo ABO, los antígenos del MHC son los más importantes en el desencadenamiento del rechazo. Dentro del componente celular cabe destacar: 1.-Linfocitos T citotóxicos específicos 2) Citotoxicidad celular dependiente de anticuerpos 3) La actividad citotóxica natural o NK. Rechazo Clínico El rechazo del injerto es un proceso complejo que comprende varios componentes entre ellos: 1.-Linfocitos T y B, 2.-Macrofagos, 3.-Citocinas con lesión inflamatoria local y el daño consiguiente del injerto. El rechazo puede clasificarse en 4 tipos con base en el tiempo y la patogenia: 1.-Hiperagudo 2.-Agudo acelerado 3.-Agudo 4.-Crónico Hiperagudo -Se presenta en el trascurso de minutos u horas tras reanudarse el riego sanguineo en el órgano trasplantado . -Se debe a la presencia de anticuerpos preformados en el receptor que son específicos para el donador. -Estos antícuerpos pueden dirigirse contra los antígenos HLA del donador o bien pertenecer al grupo sanguíneo ABO. - Los anticuerpos se unen al endotelio vascular en el injerto y activan la cascada del complemento que conducen a la activación de plaquetas y la coagulación intravascular diseminada. En el caso de anticuerpos preformados, el rechazo se produce con una especial rapidez provocando una microtrombosis masiva del injerto, conocida como rechazo hiperagudo. Esto significa que el receptor se sensibilizó antes a los aloantígenos del injerto, ya sea por transfusiones sanguíneas, trasplantes previos o embarazos. Los anticuerpos formados de antemano son citotóxicos, anti-HLA clase I o anti-ABO. La secuencia de fenómenos que conforman esta respuesta es la siguiente: 1.-Primero hay daño mediado por anticuerpos en la superficie endotelial de las arteriolas del injerto; 2.-Después, se activa el complemento, lo que induce daño en la pared vascular con trombosis y oclusión de los vasos del órgano injertado, lo que al final conduce a la pérdida del injerto. El estudio histopatológico muestra necrosis fibrinoide de la pared vascular, trombos de fibrina, marginación de neutrófilos y necrosis isquémica. -El resultado es la inchazón y obscurecimiento del injerto que sufre necrosis isquémica. -Este tipo casi nunca es reversible de tal manera que es fundamental prevenirlo. -La prevención se logra al comprobar que el injerto es compatible en ABO y llevar a cabo estudios de compatibilidad cruzada antes del trasplante. -Esta última prueba in vitro consiste en mezclar células del donador con suero del receptor para buscar pruebas de destrucción de las células del donador por anticuerpos del receptor. -Una compatibilidad cruzada positiva indica la presencia de anticuerpos preformados en el receptor específico para el donador y en consecuencia un gran riesgo de rechazo hiperagudo si se lleva a cabo el trasplante. -Riñon y páncreas son más susceptibles al rechazo hiperagudo. -Corazon y pulmón también susceptibles pero menos frecuente. -El hígado es insensible al rechazo hipergaudo. -También se da en los xenoinjertos Rechazo Agudo Acelerado -Se observa en los primeros días, entre el primero y quinto día después del trasplante. -Incluye lesiones de mediación celular y por anticuerpos. -Es factible cuando se sensibiliza un receptor por exposiciones previas a antigenos que se encuentran en el donador lo que tiene como resultado una reacción de memoria inmunitaria. -La causa también es la presencia de anticuerpos preformados. Es probable que su presentación más tardía se deba a la cantidad disponible de anticuerpos circulantes; se cree que es una respuesta rápida de la memoria inmunológica. Se debe a la acción combinada de anticuerpos y células, es difícil de controlar y su presencia favorece la pérdida temprana del injerto. Rechazo Agudo -Es el más común pero con la inmunosupresión moderna es cada vez menos frecuente. -Se observa en el trascurso de unos días o unos cuantos meses después del trasplante. -Es de manera predominante un proceso de mediación celular y los linfocitos son las principales células que participan. -El paciente puede presentar síntomas como: fiebre, calosfrios, mal estar y artralgias, sin embargo con los actuales inmunosupresores casi todos los episodios de rechazo agudo son asintomáticos. Rechazo agudo ocurre varios días o semanas después del trasplante. Cerca de 90% se debe a mecanismos inmunitarios celulares, los cuales son fáciles de revertir con el tratamiento adecuado. En este tipo de rechazo es posible reconocer tres procesos secuenciales: 1) Reconocimiento, durante el cual el sistema inmunitario del receptor detecta la presencia de antígenos extraños en el injerto. 2) Rechazo, en el que los anticuerpos antidonador y las clonas de células T y B del receptor se expanden y atacan al injerto. 3) Regulación, cuando el sistema inmunitario regula deprimiendo los anticuerpos antidonador y la respuesta de las células T -Por lo general se manifiestan con valores de laboratorio anormales (ej. creatinina elevada en trasplante renal elevación de trasaminasas en trasplante hepático). -Los episodios de rechazo agudo también pueden mediarlos una reacción inmunitaria humoral en lugar de la celular. -Las células B pueden elaborar anticuerpos antidonador que por lo general dañan el injerto. Rechazo Crónico -Ocurre en meses o años después del trasplante. -Encontramos atrófia, fibrosis y arterioclerosis. -La función del injerto se deteriora con lentitud durante meses o años. El daño al órgano trasplantado es lento y progresivo; los mecanismos inmunológicos que participan son: las reacciones de hipersensibilidad tardía, la generación de aloanticuerpos y los factores de crecimiento. El principal hallazgo histopatológico: • En los aloinjertos renales es la vasculopatía proliferativa. • En el trasplante pulmonar, la bronquiolitis obliterante. • En el trasplante hepático, hay daño inmunológico en los vasos sanguíneos y los conductos biliares. Podrían intervenir: virus, secuelas de inmunosupresores o de microrrechazos repetidos. Tolerancia en el Trasplante La tolerancia en el trasplante puede definirse de dos maneras complementarias 1.-Tolerancia clínica o funcional: que es la supervivencia del órganos o tejido en un receptor normal en ausencia de imunosupresión. 2.-Tolerancia inmunológica que es la ausencia de una respuesta inmunitaria detectable a un órgano o tejido funcional en ausencia de inmunosupresión Si el receptor de un aloinjerto dispone de un sistema inmunitario totalmente funcional, casi de manera invariable el trasplante habrá de producir alguna forma de rechazo, por lo cual el paciente trasplantado tendrá que recibir tratamiento con inmunosupresores para mantener la función del injerto de por vida, y así, evitar una respuesta inmunitaria que ataque el injerto. Existen 2 tipos de tratamientos inmunosupresores 1.-Específicos 2.-Inespecíficos Inespecíficos: tienen por objeto reducir la actividad global del sistema inmunitario frente a cualquier estímulo antigénico, pero tiene el inconveniente de que inducen una gran susceptibilidad frente a las infecciones en los receptores de trasplantes. Específicos: No se cuenta con inmunosupresión específica, es decir aquella que inactiva en forma exclusiva las clonas de linfocitos específicos contra los antígenos del donante sin afectar las demás clonas, de tal manera que le paciente no se exponga a padecer infecciones ni efectos secundarios En el tratamiento inmunosupresor se pueden distinguir tres formas: 1.-Tratamiento de inducción: Se administran dosis altas de medicamento y compuestos biológicos para prevenir el rechazo e inducir una respuesta de tolerancia al injerto, en lo posible. 2.-Tratamiento para revertir un episodio de rechazo agudo ya establecido Se utilizan dosis altas de esteroides, preparaciones de compuestos biológicos como los anticuerpos monoclonales anti –CD3 y otros inmunosupresores más potentes que se agregan al régimen que el paciente ya recibía desde antes. 3.-Tratamiento de Mantenimiento Incluye dosis moderadas de los fármacos que integraron el tratamiento de inducción; su objetivo es prevenir episodios de rechazo al mismo tiempo que conservar la capacidad de defensa contra las infecciones. Imnumosupresión Clinica -La inmunosupresión es la base que permite el desarrollo de los trasplantes. -Se lleva a cabo mediante medicamentos solos o cambinados para prevenir el rechazo y a la vez no deprimir tanto el sistema inmune como para dejarlo indefenso. Fármacos no biológicos Inmunosupresores Agentes biológicos Primarios Fármacos no biológicos Secundarios Terciarios Primarios -Son de mayor potencia y se pueden usar como monoterápia. Ciclosporina A : -El más conocido. -Bloquea la expresión de citocinas que promueven la activación de las células T como la interleucina 2 y 4, factor de necrosis tumoral etc. -Dosis: 8 a10 mgrs /kg/día en los primeros días de trasplante para obtener concentraciones terapeuticas de 250 a 400 ng/ml. -Dosis de mantenimiento: 3 a5 mg/ kg/día y niveles de 150 a 250 ng/ml en los primeros 6 meses , después de un año niveles de 75 a 250 ng/ml. -Cuando se utiliza ciclosporina intravenosa se debe utilizar la tercera parte de la dosis V. O. para obteber valores séricos similares. -Efectos secundarios frecuentes: nefrotoxicidad, hipertensión, hirsutismo, hipercolesterolemia, neurotoxicidad e hiperplasia gingival. Tacrolimus (FK 506) -Es un macrólido, es más potente que la Cs A, se utiliza en monoterápia para trasplante hepático ortotópico. -Dosis inicial: 0.20 mg/kg/ día para obtener niveles de 5 a 20 ng/ml. -Dosis de mantenimiento: o.10 a 0.12 mg/kg/día para niveles de 5 a 10 ng/ml. -Efectos secundarios: nefrotoxicidad, neurotoxicidad, intolerancia a la glucosa, hiperlipidemia, hipertensión, enfermedad linfoproliferativa relacionada con el trasplante. Sirolimus(rapamicina) -Es un macrólido -Su mecanismo de acción es mediante una proteína denominada target rapanicin, reduciendo la proliferación celular citocinodependiente en la fase 61 a 5 de la mitosis. -Dosis de inicio: 6 mg/día, para valores de 5 a 20 ng/ml. -Dosis de mantenimiento: 2 a 3 mg/día para niveles de 5 a 15 ,,ng/ml. -Efectos secundarios: Hipercolecterolemia, hipertrigliceridemia, trombocitopenia, retardo en la cicatrización de las heridas y neumonitis no infecciosa. Secundarios Azatriopina -Es un imidazol derivado de la 6 mercaptopurina -Dosis 1 a 3 mg/kg/día. -Efectos secundarios:supresión hematológica, pancreatitis, hepatitis y colestasis. -En muchos programas se ha abandonado su uso desde la aparición del micifenolato de mofetil. Micofenolato de mofetilo -El micofenolato de mofetilo y el ácido micofenólico con capa entérica son derivados de varias especies de Penicillum. -Dosis:600mg/m2/día para niños. 1 a 2 grs./día para adultos. -Efectos secundarios: gastrointestinales, diarrea, neutropenia, anemia. Terciarios Esteroides -Los más usados son la prednisona y la metilpresnisolona. -Disminuyen la acción fagocitaria de macrófagos y mediadores de la respuesta inflamatoria. Prednisona Dosis: 1 mg/kg/día, inicialmente, con reducción hasta 5 a 10 mgrs. día de mantenimiento. Metilprednisolona 250 a 1000 mgrs. diarios IV por 3 – 5 días Efectos secundarios: osteoporosis, sx de Cushing, alteraciones de tolerancia a la glucosa, retención hídrica etc. La combinación de fármacos no biológicos permite crear esquemas: Triples: CsA – MMF – PDN Dobles: CsA – MMF Monoterapias eligiendo de acuerdo con las caraterísticas del paciente y la mejor combinación. Agentes Biológicos -Son inductores básicamente globuilinas antilinfocito, que pueden ser policlonales (ATGAM y timoglobulina) o monoclonales ( OKT3, Basiliximab, Daclizumab), los cuales se utilizan en pacientes con alto riesgo de rechazo y tienen como finalidad disminuir, la respuesta inmune mientras se establece la función del órgano trasplantado, mientras se logran los valores óptimos del inmunosupresor de base.