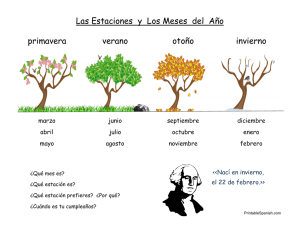
Caracterización biótica del complejo de páramos las Hermosas en Jurisdiccióm de Cortolima y CVC
Anuncio

CARACTERIZACIÓN BIÓTICA DEL COMPLEJO DE PÁRAMOS LAS HERMOSAS EN JURISDICCIÓN DE CORTOLIMA Y CVC Contrato de prestación No. 14-13-014-184CE Fundación Ecológica Reserva Las Mellizas Objeto: Aunar esfuerzos técnicos, científicos, administrativos y financieros con el fin de elaborar los estudios bióticos a escala 1:25.000 del Complejo de Páramos Las Hermosas para identificar la franja de transición páramo-bosque conforme a los compromisos establecidos con el Fondo Adaptación en el Convenio Interadministrativo No. 13 – 014 (FA No. 005 de 2013). Convenio interadministrativo 13-014 (FA 005 de 2013) Instituto de Investigación de Recursos Biológicos Alexander von Humboldt - Fondo Adaptación Subdirección de Servicios Científicos y Proyectos Especiales Instituto de Investigación de Recursos Biológicos Alexander von Humboldt Bogotá, D.C., 2015 ESTUDIO DE FLORA, EDAFOFAUNA EPÍGEA, ANFIBIOS Y AVES EN EL COMPLEJO DE PÁRAMOS LAS HERMOSAS Transectos altitudinales, municipios de Sevilla, Tuluá, Palmira (Valle del Cauca) y Rioblanco (Tolima) Componente Biótico Convenio de Cooperación No. 14-13-014-184CE de 2015 Instituto de Investigación de Recursos Biológicos Alexander von Humboldt (IAvH), Fundación Ecológica las Mellizas INSTITUTO DE INVESTIGACIÓN DE RECURSOS BIOLÓGICOS ALEXANDER VON HUMBOLDT (IAVH) ARMENIA ABRIL DE 2015 ESTUDIO DE FLORA, EDAFOFAUNA EPÍGEA, ANFIBIOS Y AVES EN EL COMPLEJO DE PÁRAMOS LAS HERMOSAS Transectos altitudinales, municipios de Sevilla, Tuluá, Palmira (Valle del Cauca) y Ríoblanco (Tolima) Equipo de trabajo Coordinador: Jorge Hernán López Guzmán Profesionales en Botánica: Emanuel Andrés Ruíz Molina y Juan Manuel Duque Profesionales en Edafofauna Epígea: Leonardo Fabio Rivera Pedroza y Roberto Carlos Silva Profesional en Anfibios: Wolfgang Edgar Buitrago González Profesionales en Avifauna: Albert Ospina Duque, Jean Wilmar Parra Colorado y Wilmer Antonio Cardona Ocampo Asesor: Vladimir Rojas Díaz Auxiliares de campo Botánica: Diego Fernando Londoño y Yerly Andrés Martínez Anfibios: Carlos Mario Gómez López, Carlos Alberto Londoño Guarnizo, Edilberto Quintero Castillo, Cristian González Acosta, Diana Marcela Sánchez Bellaizá y Valentina Rubio Aves: Esteban Castaño Osorio, Yemay Toro Lopéz, Laura Ximena Cabrera Casas, y Sebastián Guerrero Peláez Acompañamiento técnico e interventoría María Victoria Sarmiento y Olga Adriana León Instituto de Investigación de Recursos Biológicos Alexander von Humboldt Componente Biótico, Convenio de Cooperación No. 14-13-014-184CE de 2015 Instituto de Investigación de Recursos Biológicos Alexander von Humboldt (IAvH) Fundación Ecológica las Mellizas Armenia, abril de 2015 TABLA DE CONTENIDO INTRODUCCIÓN .................................................................................................... 7 1. ANTECEDENTES ............................................................................................... 8 2. DESCRIPCIÓN GENERAL COMPLEJO DE PÁRAMOS LAS HERMOSAS ..... 9 2.1 PÁRAMOS DEL DEPARTAMENTO DEL VALLE DEL CAUCA EN EL COMPLEJO LAS HERMOSAS ............................................................................... 9 2.2 PÁRAMOS DEL DEPARTAMENTO DEL TOLIMA EN EL COMPLEJO LAS HERMOSAS .......................................................................................................... 10 2.3 COMPLEJOS DE PÁRAMO ESTUDIADOS.................................................... 11 3. METODOLOGÍA ............................................................................................... 19 3.1 VEGETACIÓN ................................................................................................. 19 3.1.1 Selección de localidades (transectos) y estaciones de muestreo.................................. 19 3.1.2 Datos de campo ....................................................................................................................................... 22 3.1.3 Toma de muestras botánicas............................................................................................................ 23 3.1.4 Análisis de datos ..................................................................................................................................... 23 3.2 EDAFOFAUNA ................................................................................................ 25 3.2.1 Métodos ....................................................................................................................................................... 25 3.2.2 Preservación del material biológico ............................................................................................... 27 3.2.3 Análisis de datos ..................................................................................................................................... 27 3.3 ANFIBIOS........................................................................................................ 29 3.3.1 Métodos de muestreo ........................................................................................................................... 29 3.3.2 Preservación del material biológico ............................................................................................... 32 3.3.3 Análisis de datos ..................................................................................................................................... 34 3.4 AVES ............................................................................................................... 35 3.4.1 Métodos ....................................................................................................................................................... 35 Detalles metodológicos para los muestreos de aves en cada localidad de estudio ......... 36 3.4.2 Análisis de los datos .............................................................................................................................. 38 4. RESULTADOS TRANSECTO ALTITUDINAL, FINCA LA TRAVIATA, VEREDA MIRAFLORES, MUNICIPIO DE SEVILLA (VALLE DEL CAUCA) ....................... 41 4.1 VEGETACIÓN ................................................................................................. 41 4.1.1 Descripción de las estaciones de muestreo .............................................................................. 41 4.1.2 Representatividad de los muestreos ............................................................................................. 59 4.1.3 Riqueza y composición florística ..................................................................................................... 61 4.1.4 Estratos vegetales .................................................................................................................................. 66 4.1.5 Índice de Valor de Importancia (IVI) .............................................................................................. 67 4.1.6 Conclusiones ............................................................................................................................................. 69 4.2 EDAFOFAUNA ................................................................................................ 69 4.2.1 Riqueza y composición de especies en el transecto altitudinal ...................................... 69 4.2.2 Hábitos ecológicos ................................................................................................................................. 79 4.2.3 Conclusiones ............................................................................................................................................. 80 4.3 ANFIBIOS........................................................................................................ 81 4.3.1 Riqueza y composición de especies ............................................................................................. 81 4.3.2 Datos importantes ................................................................................................................................... 93 4.3.3 Conclusiones ............................................................................................................................................. 94 4.4 AVES ............................................................................................................... 94 4.4.1 Riqueza y composición de especies ............................................................................................. 94 4.4.2 Gremios Tróficos .................................................................................................................................. 106 4.4.3 Conclusiones .......................................................................................................................................... 108 4.5 CONSIDERACIONES FINALES TRANSECTO MUNICIPIO DE SEVILLA ... 109 5. RESULTADOS TRANSECTO FINCA LA CASCADA, VEREDA SANTA LUCÍA, MUNICIPIO DE TULUÁ, VALLE DEL CAUCA................................................... 111 5.1 VEGETACIÓN ............................................................................................... 111 5.1.1 Descripción de las estaciones ....................................................................................................... 111 5.1.1.1 Estación uno – E1 (3500 m.s.n.m) .......................................................................................... 111 5.1.2 Representatividad de los muestreos .......................................................................................... 128 5.1.3 Riqueza y composición florística. ................................................................................................. 130 5.1.3.1 Diversidad alfa () ........................................................................................................................... 132 5.1.4 Estratos de la vegetación ................................................................................................................. 135 5.1.5 Índice de Valor de Importancia (IVI) ........................................................................................... 136 5.1.6 Conclusiones .......................................................................................................................................... 138 5.2 EDAFOFAUNA .............................................................................................. 139 5.2.1 Riqueza y composición de especies en el transecto altitudinal ................................... 139 5.2.2 Hábitos ecológicos .............................................................................................................................. 152 5.2.3 Conclusiones .......................................................................................................................................... 153 5.3 ANFIBIOS...................................................................................................... 153 5.3.1 Riqueza y composición de especies .......................................................................................... 153 5.3.2 Datos importantes ................................................................................................................................ 164 5.3.3 Recomendaciones ............................................................................................................................... 164 5.3.4 Conclusiones .......................................................................................................................................... 164 5.4 AVES ............................................................................................................. 166 5.4.1 Riqueza y composición de especies .......................................................................................... 166 5.5 CONSIDERACIONES FINALES TRANSECTO MUNICIPIO DE TULUÁ ...... 179 6. RESULTADOS TRANSECTO ALTITUDINAL, PREDIO EL AUXILIO, VEREDA LAS MERCEDES, MUNICIPIO DE RIOBLANCO (TOLIMA) ............................. 182 6.1 VEGETACIÓN ............................................................................................... 182 6.1.1 Descripción de las estaciones de muestreo ........................................................................... 183 6.1.2 Representatividad de los muestreos .......................................................................................... 201 6.1.3 Riqueza y composición florística .................................................................................................. 203 6.1.4 Estratos de la vegetación ................................................................................................................. 208 6.1.5 Índice de Valor de Importancia (IVI) ........................................................................................... 208 6.2 EDAFOFAUNA .............................................................................................. 211 6.2.1 Riqueza y composición de especies en el transecto altitudinal ................................... 211 6.2.2 Hábitos ecológicos .............................................................................................................................. 225 6.2.3 CONCLUSIONES ................................................................................................................................ 226 6.3 ANFIBIOS...................................................................................................... 227 6.3.1 Riqueza y composición de especies .......................................................................................... 227 6.3.1.2 Diversidad Alfa (α). .......................................................................................................................... 233 6.3.2 Datos importantes ................................................................................................................................ 238 6.3.3 Recomendaciones ............................................................................................................................... 238 6.3.4 Conclusiones .......................................................................................................................................... 238 6.4 AVES ............................................................................................................. 239 6.4.1 Riqueza y composición de especies .......................................................................................... 239 6.5 CONSIDERACIONES FINALES TRANSECTO MUNICIPIO DE RIOBLANCO ............................................................................................................................ 252 7. RESULTADOS TRANSECTO ALTITUDINAL, FINCA LA VICTORIA, VEREDA LA NEVERA, MUNICIPIO DE PALMIRA (VALLE DEL CAUCA) ...................... 256 7.1 VEGETACIÓN ............................................................................................... 256 7.1.1 Descripción de las estaciones ....................................................................................................... 256 7.1.2 Curva de representatividad de los muestreos ....................................................................... 271 7.1.3 Riqueza y composición florística .................................................................................................. 273 7.2 EDAFOFAUNA .............................................................................................. 282 7.2.1 Riqueza y composición de especies en el transecto altitudinal ................................... 282 7.2.2 Hábitos ecológicos .............................................................................................................................. 294 7.2.3 CONCLUSIONES ................................................................................................................................ 295 7.3 ANFIBIOS...................................................................................................... 296 7.3.1 Riqueza y composición de especies .......................................................................................... 296 7.3.2 Datos importantes ................................................................................................................................ 305 7.3.3 Conclusiones .......................................................................................................................................... 305 7.4 AVES ............................................................................................................. 306 7.4.1 Riqueza y composición de especies .......................................................................................... 306 7.4.2 Gremios Tróficos .................................................................................................................................. 317 7.4.3 Conclusiones .......................................................................................................................................... 318 7.5 CONSIDERACIONES FINALES TRANSECTO MUNICIPIO DE PALMIRA .. 318 Bibliografía......................................................................................................... 322 INTRODUCCIÓN La definición de páramo ha sido objeto de controversia durante décadas (p.ej. ver Cuatrecasas 1934, 1958; Cleef 1981, Mora & Sturm 1998), sin embargo, existen acuerdos conceptuales que lo definen como “un socio-ecosistema propio de la alta montaña ecuatorial ubicado predominantemente entre el límite superior del bosque andino y si se da el caso, con el límite inferior de los glaciares y bordes de nieve, con predominio de clima frío y relieve modelado por la acumulación y retiro de las masas glaciares. Como rasgo distintivo, presenta vegetación de pajonales, frailejonales, chuscales, matorrales y formaciones discontinuas de bosque; con presencia de turberas, humedales, lagos y lagunas, quebradas y ríos, entre otras fuentes hídricas subterráneas o subsuperficiales. Es además un territorio pluriétnico y multicultural, en la medida que se reconoce que los páramos en general han sido habitados, intervenidos y transformados, moldeando los patrones pre-existentes” (Sarmiento et al. 2013). “El gradiente altitudinal presenta tres franjas generales: páramo bajo, páramo alto y superpáramo. Se incluyen además en ésta definición, los páramos azonales y aquellos páramos transformados por la actividad humana (páramos antropizados). Los límites altitudinales del páramo varían entre las cordilleras y sus vertientes (exteriores e interiores), debido a factores locales orográficos, edafológicos y climáticos, así como por la trayectoria de las intervenciones humanas” (Sarmiento et al. 2013). Colombia con aproximadamente 2'906.137 hectáreas en ecosistemas de páramo (Sarmiento et al. 2013), es el país que tiene mayor extensión y diversidad de este tipo de ecosistemas en el planeta (Gómez et al. 1999). Esta posición privilegiada del país implica un compromiso importante en cuanto al conocimiento de los mismos y su conservación. Un primer y fundamental paso para el cumplimiento de dicho compromiso es generar información básica que permita conocer los límites inferiores del ecosistema de páramo. Cambios en la composición y estructura de las comunidades de flora y fauna, como respuesta a cambios entre áreas de vegetación dominada por formaciones boscosas y áreas dominadas por vegetación típica de páramo, pueden ofrecer una perspectiva útil para ubicarlos espacialmente. En el presente informe, se exponen los resultados de estudios relativos a vegetación, edafofauna epígea, anfibios y aves, realizados en los complejos de páramos Chilí-Barragán y las Hermosas, en el primer complejo los estudios se realizaron en el municipio de Sevilla, y en el segundo, en los municipios de Tuluá y Palmira (Valle del Cauca) y Ríoblanco (Tolima). Los estudios se realizaron con el propósito de caracterizar gradientes altitudinales entre el bosque altoandino y el páramo, de modo que contribuyan con la identificación de los límites inferiores de este último, en el marco del convenio de cooperación No. 14-13-014-184CE establecido entre el IAvH y la Fundación Ecológica las Mellizas. 1. ANTECEDENTES El Artículo 202 del Plan Nacional de Desarrollo 2010-2014 (Ley 1450 de 2011), establece: “Los ecosistemas de páramo deben ser delimitados a escala 1:25.000, con base en estudios técnicos, económicos, sociales y ambientales, los cuales deben ser realizados por las autoridades ambientales”. En concordancia, el Fondo de Adaptación y el IAvH, suscribieron el convenio No. 005 de 2013, con el propósito de elaborar los insumos técnicos y recomendaciones para la delimitación de los ecosistemas estratégicos priorizados (páramos y humedales), por parte del Ministerio de Ambiente y Desarrollo Sostenible -MADS-. El IAvH por su parte, estableció convenios de cooperación con grupos de investigación con influencia en los diferentes complejos de páramos de Colombia. Para la realización de los estudios bióticos del complejo de páramos las Hermosas (HMS), el IAvH suscribió el convenio de cooperación No. 14-13-014-184CE con la Fundación Ecológica Las Mellizas. Así, la Fundación las Mellizas realizó una recopilación de trabajos llevados a cabo en ecosistemas de alta montaña en el área de influencia del complejo HMS en los departamentos del Valle del Cauca y Tolima, con la cual se elaboró el documento denominado “Recopilación de información secundaria componente biótico, complejo de páramos las Hermosas (López et al. 2014). En el documento de recopilación de información, se revisaron 12 estudios relacionados con flora, anfibios y aves en ecosistemas de alta montaña en los departamentos del Valle del Cauca (ocho documentos) y Tolima (dos); dos documentos integran diferentes localidades de páramo en la región centro occidente de Colombia. Los estudios están enfocados principalmente en el conocimiento de la composición de especies, sin embargo, en algunos de ellos se hacen aproximaciones importantes en la definición de especies propias de franjas altitudinales como bosques altoandinos y páramos (Anexo 1). De acuerdo a los estudios consultados, se registran un total de 135 especies de aves y 12 de anfibios en el Valle del Cauca, y 141 spp. de aves en el Tolima. No se encontró información de fauna edáfica en ecosistemas de alta montaña en el Valle del Cauca, sin embargo, en un convenio anterior entre el IAvH y la F. Las Mellizas, en el marco de este mismo proyecto “Insumos técnicos para la delimitación de páramos” se realizaron muestreos de este grupo, en tres localidades del complejo de páramos Chilí-Barragán, siendo la más cercana al presente estudio, en el municipio de Génova, donde se reportaron 32 morfoespecies. Los estudios fueron realizados entre los meses de septiembre de 2014 y marzo de 2015. 2. DESCRIPCIÓN GENERAL COMPLEJO DE PÁRAMOS LAS HERMOSAS El complejo de páramos Las Hermosas está ubicado en los Andes colombianos, en la cordillera Central. Comprende ocho municipios del departamento del Valle del Cauca, tres del Tolima y uno del Cauca, en una franja altitudinal comprendida entre los 3.000 y 4.000 m de altitud y posee una extensión total de 208.011 hectáreas (Tabla 1) (Sarmiento et al. 2013). En este complejo el clima es característico de las zonas de páramo, con temperaturas entre 0 y 8 ºC y precipitación de 2.000 mm/año para las zonas ubicadas por encima de los 2.800 m de altitud (Morales et al. 2007). Tabla 1. Complejo páramos Las Hermosas Departamento Cauca Municipio Miranda Sub total Cauca Valle del Cauca Buga El Cerrito Florida Ginebra Palmira Pradera Sevilla Tuluá Sub total Valle del Cauca Chaparral Tolima Planadas Ríoblanco Sub total Tolima Total complejo Fuente: Sarmiento et al. 2013 Área (Has) 110 110 20.338 4.392 10.269 2.873 16.090 5.257 1.285 8.423 68.928 39.100 46 99.828 138,973 208.011 2.1 PÁRAMOS DEL DEPARTAMENTO DEL VALLE DEL CAUCA EN EL COMPLEJO LAS HERMOSAS En el departamento del Valle del Cauca, los páramos se distribuyen sobre las cordilleras Central y Occidental. En la cordillera Central, existen 68.928 Ha de páramos aproximadamente (Sarmiento et al. 2013), de las cuales el 35% (24.135 Has) hacen parte del Parque Nacional Natural las Hermosas. En el estudio sobre el estado actual de los páramos en el Valle del Cauca, se tomó la cota de 2.800 m.s.n.m como área de influencia y la de 3.400 m.s.n.m como páramo propiamente dicho (Devia et al. 2007). En la cordillera Central, en este departamento, se reportan las siguientes áreas de páramo: Peñas Blancas (municipio de Sevilla), Barragán - Santa Lucía y Japón (Tuluá), Combia - Pan de Azúcar (El Cerrito), Las Domínguez (Buga, Ginebra y El Cerrito), La Nevera (Palmira) y Tinajas (Palmira, Pradera y Florida) (Tabla 2). Tabla 2. Páramos del Valle del Cauca Estudio páramos CVC- Inciva 2007 Municipio Buga El Cerrito Florida Ginebra Palmira Pradera Sevilla Área Páramo 1.812,4 4.287.1 9.369 2.147,4 2.682,9 4.637,8 5.999,7 Área Influencia 5.595,7 8.262,1 4.430,7 3.385 3.253 3.738,8 4.854,1 Tuluá 4.260,2 15.587,4 Total 35.196,5 49106.8 Fuente: Devia et al. 2007 y García et al. 2005. Total Libro Páramos – GTP 2005 7.408,1 12.549,1 13.799,7 5.532,4 5.936.1 8.376,6 10.853,8 27.302,1 13.775,1 13.786,2 5.561,4 21.223.3 8.388,9 10.868,2 19847,6 84.303,4 21.960,9 122.863 2.2 PÁRAMOS DEL DEPARTAMENTO DEL TOLIMA EN EL COMPLEJO LAS HERMOSAS Los páramos del Tolima están ubicados en las cordilleras Oriental y Central y se distribuyen en el departamento de norte a sur, limitando con los departamentos de Caldas, Risaralda y Quindío en el sector del Parque Nacional Natural (PNN) Los Nevados; con el Valle del Cauca, en el sector del PNN Las Hermosas; con los departamentos de Cauca y Huila en el sector del PNN del Nevado del Hulia y con Cundinamarca en el PNN Sumapaz (Ocampo et al. 2009). En este departamento, el complejo de páramos las Hermosas, se ubica en los municipios de Chaparral, Rioblanco y Planadas (Sarmiento et al. 2013). De acuerdo con el estudio "Estado actual y plan de manejo de los páramos del departamento del Tolima (Ocampo et al. 2009)", el municipio que presenta la mayor extensión en páramo es Rioblanco y el de menor área, planadas (Tabla 3). Tabla 3. Áreas del complejo de páramos Las Hermosas en el departamento del Tolima Municipio Chaparral Río Blanco Planadas Vereda Alto Ambeima Argentina Hermosas El Cairo El Davis La Aurora Hermosas Lg Río San Fernanado San Jose de Las Hermosas Sector Tequendama PNN Las Hermosas Sub total Albania Campo Hermoso La Playa La Reina Las Mercedes Lg Territorios Nacionales Yarumales Subtotal Lg Marquetalia Peñarrica Resguardo Indígena Subtotal Total Fuente: Ocampo et al. 2009. Área (has) 721,45 417,13 913,06 265,26 711,12 378,45 5,70 1.775,32 7.720,20 1.235,24 28.044,33 42.187,26 513,53 2530,20 1661,64 295,05 726,66 579,45 79.982,92 102,10 86.391,55 86,04 0,46 33,40 133,52 253.4 128.832,21 2.3 COMPLEJOS DE PÁRAMO ESTUDIADOS En el presente trabajo se estudiaron tres localidades ubicadas en el complejo de páramos las Hermosas, y una en el complejo Chilí-Barragán (Tabla 4 Figura 1). En cada localidad se estableció un transecto de estudio que cubrió entre cinco y seis estaciones de muestreo (E) distanciadas entre si por 80 m altitudinales, donde se muestrearon cuatro grupos biológicos (plantas, fauna edáfica, anfibios y aves), propuestos por el Instituto Humboldt, como indicadores de cambios en la transición bosque páramo (Marín et al. 2014). Para aves, los transectos estuvieron ubicados en las mismas zonas de los otros grupos, pero presentaron variaciones en cuanto al número de estaciones (entre cuatro y cinco) y las distancias entre estas (100, 125 y 200 m altitudinales) (Tabla 5, Figura 2, Figura 3, Figura 4,Figura 5). Tabla 4. Localidades estudiadas Departamento Valle del Cauca Valle del Cauca Tolima Valle del Cauca Complejo de páramo Hermosas Cuenca hidrográfica Municipio Tuluá Tuluá Hermosas Amaime Palmira Hermosas Hereje Ríoblanco ChilíBarragán Bugalagrande Sevilla Vereda Santa Lucía La Nevera Las Mercedes Miraflores Finca/Predio La Cascada La Victoria El Auxilio Travita Figura 1. Mapa de los complejos Hermosas y Chilí-Barragán con la ubicación de las localidades de muestreo (transectos). Fuente mapa base: Sarmiento et al. 2013. Figura 2. Transecto y estaciones de muestreo cuenca río Bugalagrande, municipio de Sevilla (Valle del Cauca), vereda Miraflores, finca la Traviata. Fuente mapa base: Sarmiento et al. 2013 Figura 3. Transecto y estaciones de muestreo, cuenca río Tuluá, municipio de Tuluá, corregimiento de Santa Lucía, finca la Cascada. Figura 4. Transecto y estaciones de muestreo, cuenca del río Hereje, municipio de Ríoblanco (Tolima), predio el Auxilio. Fuente mapa base: Sarmiento et al. 2013 Figura 5. Transectos y estaciones de muestreo, cuenca del río Amaime, municipio de Palmira (Valle del Cauca), vereda la Nevera, finca la Victoria. Tabla 5. Localidades estudiadas (transectos) y estaciones de muestreo Localidad/Transecto Sevilla/ Finca la Traviata Tuluá/Picos del Japón Rioblanco/ Predio el Auxilio (propiedad de Cortolima) Palmira/Finca la Victoria Estación Altitud y distancia entre estaciones de muestreo Plantas, Edafofauna y Anfibios 1 3520 (80 m.s.n.m) 2 3 4 5 6 Coordenadas Coordenadas estaciones de muestreo estaciones de muestreo Altitud y distancia Plantas, Edafofauna y Aves entre estaciones de Anfibios muestreo Aves Latitud Longitud Latitud Longitud 4º0´3,7´´ 75º47´53´´ 3.520 (100 m.s.n.m) 3440 3360 3280 3200 3120 4º0´2,1´´ 4º0´3,5´´ 4º0´3,3´´ 3º59´58,7´´ 4º0´2,8´´ 75º48´2,9´´ 75º48´9,1´´ 75º48´14´´ 75º48´20´´ 75º48´25´´ 3.420 3.320 3.220 3.120 1 3500 (80 m.s.n.m) 3º58´30,4´´ 75º58´03,7´´ 3.500 (125 m) 2 3 4 5 1 2 3 4 5 6 1 3420 3340 3260 3180 3520 (80 m.s.n.m) 3440 3360 3280 3200 3120 3420 (m.s.n.m) 3º58´30,8´´ 3º58´40,1´´ 3º58´45,5´´ 3º58´52,7´´ 3º18´55,6´´ 3º18´55,5´´ 3º18´55,1´´ 3º18´56,0´´ 3º18´38,3´´ 3º18´37,4´´ 3º 32´14,5´´ 75´58´22,5´´ 75º58´22,8´´ 75º58´26,8´´ 75º58´24,1´´ 75º59´43,6´´ 75º59´43,6´´ 75º59´49,6´´ 75º59´59,0´´ 75º59´26,2´´ 75º59´24,2´´ 76º04´40,9´´ 2 3340 3º 32´16,5´´ 76º04´36,3´´ 3.295 3 4 5 3260 3180 3100 3º32´18,5´´ 3º32´23,2´´ 3º32´34,1´´ 3.170 3.045 76º04´31,6´´ 76º04´29,4´´ 76º04´29,4´´ 18 4º0´3,7´´ 4º0´4,1´´ 4º0´3,6´´ 4º0´49,2´ 3º59´2,2´ 75º47´53´´ 75º48´6´´ 75º48´11,1´ 75º48´17,1´´ 75º48´27,6´´ 3.375 3.250 3.125 3º58´30,4´´ 3º58´32,9´´ 3º58´37,7´´ 3º58´52,5´´ 75º58´03,7´´ 75º58´23´´ 75º58´22,7´´ 75º58´25,7´´ 3.520 (200 m) 3.320 3.120 2.920 3º18´55,6´´ 3º18´56,6´´ 3º18´34,6´´ 3º18´17,9´´ 75º59´43,6´´ 75º59´38´´ 75º59´24,6´´ 75º58´24,8´´ 3.420 (125 m) 3º32´14,5´´ 76º04´40,9´´ 3º32´22,1´´ 76º4´34,5´´ 3º32´12,8´´ 76º4´24,2´´ 3º32´22,5´´ 76º4´16,4´´ 3. METODOLOGÍA Para el muestreo de los cuatro grupos biológicos estudiados: plantas, fauna edáfica, anfibios y aves, se siguió la propuesta metodológica planteada por el equipo de trabajo de páramos del Instituto Alexander von Humboldt (Marín et al. 2014), realizando algunos ajustes relacionados con el contexto de las áreas de trabajo. 3.1 VEGETACIÓN Para determinar la composición, estructura y patrones de distribución de riqueza de la vegetación en las cuatro localidades estudiadas en los complejos de páramos las Hermosas y Chilí-Barragán, se siguió la siguiente metodología: 3.1.1 Selección de localidades (transectos) y estaciones de muestreo Un transecto comprende el gradiente altitudinal de bosque altoandino y páramo. Este transecto está conformado por estaciones de muestreo, distanciadas entre sí máximo 100 m altitudinales y mínimo 70 m altitudinales (Marín et al. 2014). En cada localidad de los complejos de páramos mencionados, se estableció un transecto de estudio conformado por cinco a seis estaciones de muestreo (E), distanciadas entre si por 80 m de altitud (Figura 6 y Figura 7), estos transectos presentaron longitudes variables, de acuerdo a la pendiente del terreno. El número de estaciones y la distancia entre ellas se determinó teniendo en cuenta diferentes factores: coberturas vegetales existentes, grado de inclinación del terreno y condiciones de acceso, entre otras. En cada estación se establecieron tres parcelas para el muestreo de vegetación, ubicadas a una distancia aproximada de 30 metros cada una. Para el levantamiento de las parcelas al interior de las estaciones se realizaron muestreos por formación vegetal así: - Arbustales y herbazales: tres parcelas de 4 m x 12,5 m (50 m2), divididas en cinco subparcelas de 4 m x 2,5 m (Figura 7 y Figura 8). - Formaciones boscosas: tres parcelas de 4 m x 25 m (100 m2) divididas en cinco subparcelas de 4 m x 5 m, (Figura 7 y Figura 8). En cada parcela se halló el ángulo de la pendiente según la propuesta de Lozano et al. (2009). 19 A B E1 E2 E1 E2 E3 E3 E4 E5 E4 E5 E6 D C E1 E2 E3 E1 E4 E5 E2 E3 E4 Figura 6. Transectos y estaciones de muestreo. A. Sevilla, B. Tuluá, C. Río Blanco y D. Palmira. Todas las estaciones para el muestreo de plantas estuvieron separadas entre sí por 80 m altitudinales. En Ríoblanco fueron seis estaciones, pero dos se ubicaron en un sector diferente al de la foto, ya que las condiciones de pendiente y coberturas vegetales no eran las apropiadas para los muestreos a partir de la estación cuatro. 20 A B C D Figura 7. Esquema de las estaciones de muestreo para vegetación y parcelas (réplicas) en su interior. A. Sevilla. B. Tuluá. C. Río Blanco. D. Palmira. Las estaciones y parcelas resaltadas en negrita corresponden a las muestreadas como formaciones de herbazales y arbustales, y las demás a formaciones boscosas. Fuente: Modificado de Marín et al. 2014 21 Figura 8. Dimensiones de las parcelas (réplicas) y subparcelas en formaciones de herbazales y arbustales y en formaciones boscosas. Fuente: Tomado de Marín et al. (2014). 3.1.2 Datos de campo En el bosque y arbustales de páramo se tomaron los siguientes datos para cada morfoespecie con un diámetro basal ≥ 2 cm a 30 cm del suelo: - Altura total del individuo - Altura a la primera ramificación (árboles) - Estratos de vegetación - Estado fenológico - Cobertura de copa (m2) que fue calculada de acuerdo con Rangel & Velásquez (1997). En herbazales, donde se encuentran arbustos y otras especies como frailejones, cuyo conteo de individuos pueda realizarse fácilmente, se registraron las variables anotadas anteriormente para arbustales. En el caso de macollas y otras especies cuya individualización es difícil (individuos con reproducción clonal), se registró: - Altura total - Cobertura de copa - Porcentaje de cobertura con respecto a cada subparcela - Formas de crecimiento - Estado fenológico En cada estación altitudinal se elaboró un perfil vertical a escala de la vegetación, con base en los levantamientos realizados. Para ello, en cada subparcela se ubicó un punto de coordenada (x, y) estimada en metros, con el fin de ubicar los individuos en los perfiles. 22 3.1.3 Toma de muestras botánicas Se recolectaron hasta tres ejemplares de cada morfoespecie, en lo posible en estado fértil, los cuales fueron preservados de acuerdo a métodos estandarizados, para posteriormente ser depositados en el Herbario Federico Medem, Bogotá –FMB- del IAvH. Para su identificación hasta el menor nivel taxonómico posible, se efectuaron comparaciones con catálogos, monografías y guías de flora como: Gentry (1993), Vargas (2002), Moller y Yánez (1999), Ulloa y Moller (1993), Murillo y Harker (1990), Vélez (1992), Mendoza y Ramírez (2006), Sklenar et al. (2005), Pedraza-Peñalosa et al. (2004), entre otros. En el caso del material que no pudo ser determinado por el equipo, se consultó a varios especialistas asociados con los herbarios de la región. 3.1.4 Análisis de datos 3.1.4.1 Representatividad de los muestreos Para cada estación, se realizó una curva de acumulación de especies con el fin de evaluar el esfuerzo de muestreo, utilizando la información sobre la presencia y abundancia de las especies en cada una de las parcelas. El análisis se realizó con el programa EstimateS 9.1.0 (www.viceroy.eeb.uconn.edu//stimates), utilizando los estimadores Chao 1 y Bootstrap. De igual manera se realizó una curva de acumulación de especies para todo el transecto por estaciones con el estimador Chao 1. 3.1.4.2 Riqueza y composición florística Se determinaron la composición y riqueza florística de cada estación altitudinal, con base en el número de individuos, especies, géneros y familias más representativos en cada una de ellas. Para determinar la diversidad se realizaron los análisis de la diversidad Alfa () y Beta () a través del cálculo de los siguientes índices: 3.1.4.2.1 Diversidad Alfa () Se empleó el índice de diversidad de Shannon-Wiener (H`) para estimar la diversidad florística, dado que la estimación es independiente del tamaño de la muestra porque estima la diversidad sobre la base de una muestra tomada al azar y que presumiblemente contiene todas las especies de la comunidad propuesto por Magurran (1988); además se empleó una prueba t para comparar los índices de Shannon-Wiener. Por otro lado, se utilizó el índice inverso de Simpson (D`), considerado un índice de dominancia, ya que este es sensible a la abundancia de las especies más frecuentes en la comunidad (Magurran 1988). Este índice es aplicable a biotas pequeñas por ser un estimador sin sesgo (Cañas 2000). 23 3.1.4.2.2 Diversidad Beta () Los análisis de datos se adelantaron con métodos cuantitativos (similitud / disimilitud) y cualitativos, que permiten conocer el recambio de especies a lo largo del gradiente altitudinal evaluado. Se analizó la similitud entre las estaciones de muestreo a lo largo del gradiente, utilizando índices como BrayCurtis (cuantitativo), Sorensen (cualitativo) y Jaccard; se usó además, el algoritmo UPGMA o grupos pareados para generar el dendrograma a partir de la distancia promedio de los grupos a comparar (Villareal et al. 2006). Los datos también fueron analizados con el índice de Whittaker, a partir de la presencia ausencia de las especies en un conjunto de muestras, contrastando el promedio del número de especies por muestra, versus el número total de especies. También muestra el número de especies que se pierden o se ganan a medida que se comparan las muestras como lo propone Villareal et al. (2006). 3.1.4.3 Estratos vegetales Para la caracterización vertical de la vegetación se siguió la propuesta de Rangel & Lozano (1986), citada en Villareal et al. (2006), que propone los siguientes estratos según su altura: - Rasante <0,3 m - Herbáceo 0,3 – 1,5 m - Arbustivo 1,5 – 5 m - Subarbóreo o de arbolitos 5 – 12 m - Arbóreo inferior 12 – 25 m - Arbóreo superior >25 m 3.1.4.4 Índice de Valor de Importancia (IVI) En cada una de las estaciones altitudinales y parcelas evaluadas al interior de estas, se calculó el IVI, teniendo en cuenta la sumatoria de la densidad (DeR), la frecuencia (FR) y la dominancia (DoR) relativas según Finol (1976). 24 3.2 EDAFOFAUNA 3.2.1 Métodos La evaluación de la edafofauna epígea se realizó usando dos métodos complementarios de colecta, enfocados a obtener la mayor información de la artropofauna del suelo en cada estación altitudinal y la extracción por recolecta manual. Los muestreos se realizaron en las mismas estaciones altitudinales establecidas para flora y anfibios. En las localidades de Tuluá y Ríoblanco se llevaron a cabo réplicas temporales para los tres grupos de fauna (edafofauna, anfibios y aves), que consistieron en realizar otra visita de campo en el mismo periodo climático de la primera (lluviosas), siguiendo la misma metodología y esfuerzo de muestreo (Tabla 6). Tabla 6. Visitas y réplicas en los transectos estudiados Localidad/Transecto Fechas de visitas y réplicas Septiembre 25 al 1 de octubre de 2014 Octubre 23 al 31 de 2014 Noviembre 19 al 27 de 2014 Enero 6 al 15 de 2015 Febrero 12 al 21 de 2015 Marzo 3 al 13 de 2015 Sevilla Tuluá Río Blanco Palmira 3.2.1.1 Trampas de caída (Pitfall) Estas trampas fueron construidas con recipientes plásticos de 15 cm de diámetro y capacidad de 1/2 litro, las cuales fueron enterradas hasta que su boca quedó a ras del suelo; posteriormente fueron llenadas con una solución de agua y una gota de jabón (Villarreal et al. 2006). Los recipientes fueron instalados con un plato dispuesto en una pequeña base de alambre en forma de techo, para evitar su colmatación por el agua, propia de las precipitaciones de la zona (Díaz et al. 2007). Las trampas fueron retiradas luego de 48 horas de estar enterradas, tiempo en el cual se estima una alta representatividad de la fauna de artrópodos epígeos. En los municipios de Sevilla y Río Blanco, se establecieron seis estaciones, mientras que en Tuluá y Palmira, cinco estaciones; todas separadas por 80 m de elevación una de la otra. Para todos los casos su establecimiento inició desde la parte más alta (E1) y en el descenso se ubicaron las estaciones subsiguientes (Figura 9). En cada estación altitudinal se trazó un segmento lineal de 100 m, sobre el cual se ubicaron diez trampas, separadas entre sí 10 m (10 unidades de muestreo, separadas 10 m entre sí) (Figura 9). Se considera que este método de captura permite una buena estimación de la diversidad de especies de artrópodos de suelo (Southwood 1978, Gorny & Grüm 1993). Adicionalmente, se trató de establecer el trampeo lo más alejado posible de las perturbaciones causadas por el muestreo de los demás grupos biológicos. El esfuerzo de muestreo real empleado fue de 48h/trampa/estación, por 10 trampas en cada estación altitudinal, para un total de 480h/trampa/estación. Para 25 los transectos con 6 estaciones el esfuerzo fue de 2880h/trampa/transecto y para los que presentaron cinco estaciones fue de 2400h/trampa /transecto en total. 3.2.1.2 Extracción y captura manual Consistió en la búsqueda activa y la captura con pinzas, de los individuos posados en la vegetación presente sobre el transecto, en depósitos de detritus y al interior de troncos en descomposición. Se incluyó la búsqueda de artrópodos sobre excretas de vertebrados, al interior de cada una de las formaciones vegetales y en frutos en descomposición. La busqueda fue realizada preferencialmente en zonas cercanas a cada punto de muestreo donde se encontraban dispuestas las trampas de caída, se realizó entre las 16:00 y las 18:00 horas, y se dirigió principalmente hacia la colecta de artrópodos de fácil detección en suelo y en vegetación. El material colectado fue puesto en la trampa de caída más cercana al sitio evaluado. Se invirtieron aproximadamente 3,3h/hombre/estación de búsqueda manual, para un total de 19,8 horas/hombre/transecto para los transectos con seis estaciones y 16,5 horas/hombre/transecto para los que presentaron cinco estaciones. Figura 9. Esquema de la disposición de las trampas de caída (Pitfall), en cada estación altitudinal de muestreo. El gráfico ilustra el ejemplo de los transectos de Sevilla y Río Blanco. En Tuluá y Palmira fueron cinco estaciones. Fuente: Modificado de Marín et al. 2014. 26 3.2.2 Preservación del material biológico Los ejemplares recolectados fueron preservados en alcohol al 70%, en frascos de vidrio debidamente rotulados. El material recolectado se depositó en las colecciones de entomología del Instituto Alexander von Humboldt y la Universidad del Valle. 3.2.3 Análisis de datos 3.2.3.1 Esfuerzo de muestreo En el caso de las trampas de caída, el esfuerzo de muestreo se estimó como horas/trampa/estación, teniendo en cuenta que fueron 10 trampas en cada estación para cinco o seis estaciones según la localidad. La captura manual tuvo un esfuerzo de muestreo estimado en horas/hombre, buscando sobre material vegetal y en el suelo, en las cercanías a cada unidad de muestreo, en cada estación altitudinal. Acumulación de especies y porcentaje de representatividad Se utilizó el programa EstimateS 9.1.0 (www.viceroy.eeb.uconn.edu//stimates) para generar curvas de acumulación de especies e índices de estimación de diversidad, tanto para todo el muestreo como para cada estación altitudinal por separado. EstimateS aplica un algoritmo de aleatorización que permite obtener un promedio del número de nuevos registros capturados; de esta manera es posible estimar el porcentaje de representatividad del muestreo realizado y su efectividad. Para este estudio se calculó la diversidad por medio de los estimadores Chao 1 y Chao 2, los cuales son estimadores robustos de la riqueza específica mínima, que asumen que no se espera encontrar ninguna especie adicional cuando todas las especies en la muestra están representadas por al menos dos individuos (o muestras) (Chao et al. 2005). El estimador Chao 1 está basado en el número de especies en una muestra, que están representados por un individuo (singletons) o por dos individuos (doubletons); está basado en la abundancia (Chao 1984). El estimador Chao 2 se basa en las especies que aparecen solo en una muestra (uniques) o en dos muestras (duplicates); está basado en la incidencia (Chao 1984). Adicionalmente se analizó el comportamiento de las especies que presentaron uno y dos individuos (singletons / doubletons, respectivamente), para analizar el supuesto de que cuantas más especies raras haya, mayor será el número de especies que quedan por aparecer en el inventario (Jiménez-Valverde & Hortal 2003). 27 3.2.3.2 Clasificación taxonómica Se clasificaron todos los individuos colectados hasta el menor nivel taxonómico posible. Se realizó un análisis comparativo de la riqueza específica y la abundancia general de la edafofauna encontrada. Para efectos del análisis se usó el término “morfoespecie” (Mayr 1963), el cual ha sido ideado para favorecer las investigaciones ecológicas donde la precisión específica no es posible por razones de tiempo o presupuesto. Este término se basa fundamentalmente en la presencia de variación reconocida, diferencias morfológicas o discontinuidades entre individuos (King 1993), en este caso, de la misma zona ecológica. Se agruparon todos los individuos registrados en las dos técnicas de muestreo (transectos y búsqueda libre) en una sola lista como una réplica; se hizo lo mismo con los demás estaciones. Cada bloque constituyó la unidad de muestreo comparativa para el análisis (Villareal et al. 2006). Se realizó un análisis general sobre los órdenes más abundantes, coleóptera y diptera, entre los cuales se priorizó escarabajos de la familia Carabidae (Coleoptera: Adephaga), por ser depredadores y descomponedores dentro del ecosistema (Uribe & Vallejo 2013). En algunos casos, se hizo énfasis en morfos o grupos particularmente abundantes de un transecto altitudinal. Adicionalmente, se indagó bibliográficamente sobre el hábito alimenticio de las diferentes morfoespecies identificadas, agrupándolos dentro de grupos tróficos para así analizar posibles relaciones en la zona de estudio. 3.2.3.3 Riqueza y composición 3.2.3.3.1 Diversidad alfa (α) Se evaluó la riqueza y abundancia relativa de las especies (o morfoespecies) encontradas en las diferentes estaciones altitudinales, además de analizar las diferentes relaciones entre éstas. Se estimó la diversidad por medio del índice Shannon (H’), el cual estima la diversidad sobre la base de una muestra tomada al azar y que presumiblemente contiene todas las especies de la comunidad (Magurran 1988). Posteriormente los resultados obtenidos para el índice Shannon dentro de las estaciones altitudinales, se contrastaron entre sí con una prueba t o un análisis de varianza (Magurran 2004), para determinar si las diferencias numéricas son o no significativas. Se calculó el índice de diversidad de Simpson (D`), considerado como índice de dominancia, ya que este es sensible a la abundancia de las especies más frecuentes en la comunidad (Magurran 1988). Este se deriva de la teoría de probabilidades y mide la probabilidad de encontrar dos individuos de la misma especie en dos “extracciones” sucesivas al azar sin reposición. En principio esto constituye una propiedad opuesta a la diversidad, lo que plantea el problema de elegir una transformación apropiada para obtener una cifra correlacionada positivamente con la diversidad, que para este caso es el inverso (1 - D). Todos los cálculos se realizaron utilizando el programa Past 3.06 (Hammer et al. 2001). 28 Se ajustó el índice de abundancia relativa (diversidad-dominancia) para el trabajo con artrópodos en este tipo de ecosistemas de alta montaña, determinando el rango de abundantes, comunes, poco comunes y escasas (Villareal et al. 2006) según el número de morfoespecies encontradas. 3.2.3.3.2 Diversidad beta (β) La diversidad beta dentro de cada zona se analizó mediante el índice β W (diversidad beta de Whittaker), que indica esencialmente cuán diferentes son las especies entre las distintas unidades ambientales (Magurran 1988). En esencia, este índice cuantifica qué tan diferente es la composición de especies (diversidad alfa) entre comunidades (Whittaker 1960). Se analizó la disimilitud por medio del análisis SIMPER (Clarke 1993), con una medida de distancia/similitud de Bray-Curtis entre pares de biotas, con el fin de analizar cómo se da el recambio de especies en las diferentes estaciones altitudinales. Con el fin de determinar si existen patrones de similitud en la composición entre estaciones altitudinales, se construyeron agrupamientos de similitud basados en el índice Jaccard, el cual mide la similitud que existe entre dos estaciones de muestreo. Este índice no tiene en cuenta las ausencias conjuntas y pondera por igual las concordancias y las no concordancias; para éste se usó el método de agrupamiento pareado. Adicionalmente se realizó un análisis de similitud basado en datos de presencia/ausencia de especies, utilizando el coeficiente Sorensen (S) (Villareal et al. 2006). Estos índices expresan el grado en el que comunidades son semejantes en relación a las especies que las componen. 3.3 ANFIBIOS 3.3.1 Métodos de muestreo Sevilla. Los muestreos fueron realizados por cuatro personas (dos personas trabajaron las tres estaciones mas altas y las otras dos en las tres mas bajas), entre el 25 y 30 de septiembre de 2014, en un rango de altitud comprendido entre los 3520 y 3120 m. En este gradiente de elevación se establecieron seis estaciones, cada una separada de la anterior y la siguiente por 80 m. Los muestreos nocturnos se realizaron entre las 19:00 y 01:00 horas, y en el día entre las 09:00 - 12:00 y las 14:00 - 17:00 horas. Cada estación se muestreó por dos días con sus respectivas noches. Tuluá. Los muestreos fueron realizados por cuatro personas entre el 23 y 31 de octubre y entre el 19 y 27 de noviembre de 2014. Los dias efectivos de muestreo fueron cinco para cada salida y los observadores estuvieron juntos en cada estación. En esta localidad se realizó una réplica temporal (ambas en época lluviosa) que aumentó el esfuerzo de muestreo y por consiguiente permitió robustecer los datos. Se trabajó en un rango de altitud comprendido entre los 3500 y los 3180 m en el páramo del Japón. En este gradiente se establecieron cinco estaciones, cada una separada de la anterior y siguiente por 80 metros en 29 altitud. Los muestreos nocturnos se realizaron entre las 18:30 y 00:30 horas (5 horas transectos – 1 hora de búsqueda libre) y en el día hubo cambios entre réplicas; en la primer salida se realizó entre las 16:30 - 18:30 horas (1 hora transectos – 1 hora de búsqueda libre) y en la segunda salida se realizó entre las 13:30 - 18:30 horas (4 horas transectos – 1 hora de búsqueda libre). Cada estación se muestreó por un día con su respectiva noche. En la réplica se aumentó el esfuerzo de muestreo con el objetivo de incrementar la posibilidad de registrar individuos. Rioblanco. Los muestreos fueron realizados por cuatro personas (todos los observadores trabajaron en la misma estación) entre el 8 y 13 de enero, y el 14 y 19 de febrero de 2015. En esta localidad, también se realizó una réplica temporal (ambas salidas en época lluviosa) que permitió aumentar el esfuerzo de muestreo y con esto hacer más robustos los datos. Se trabajó en un rango de altitud comprendido entre los 3520 y los 3120 m en el sector conocido como páramo del Meridiano. En este rango de altitud se establecieron seis estaciones, cada una separada de la anterior y siguiente por 80 metros en altitud. El transecto altitudinal fue establecido en el sector suroriental del complejo de páramos Las Hermosas. Los muestreos nocturnos se realizaron entre las 18:30 y 00:30 horas (5 horas transectos – 1 hora de búsqueda libre) y en el día entre las 14:30 - 18:30 horas (3 horas transectos – 1 hora de búsqueda libre). Cada estación se muestreó por día con su respectiva noche. Palmira. Los muestreos fueron realizados por tres personas (los tres observadores trabajaron juntos por estación) entre el 4 y 10 de marzo de 2015, en un rango de altitud comprendido entre los 3520 y 3200 m, en el sector conocido cmo páramo de La Nevera. En este gradiente de elevación se establecieron cinco estaciones, cada una separada de la anterior y la siguiente por 80 m. Los muestreos nocturnos se realizaron entre las 19:00 y 01:00 horas (5 horas transectos – 1 hora de búsqueda libre) y en el día entre 14:00 - 18:00 horas (3 horas transectos – 1 hora de búsqueda libre). Cada estación se muestreó por día con su respectiva noche. La información sobre las localidades y la descripción del protocolo de trabajo se resume en la Tabla 7. Los muestreos en todas las localidades presentaron el mismo número de transectos por estación e incluyeron los recorridos de búsqueda libre. Teniendo en cuenta que factores como el clima y la detectabilidad de individuos no son constantes, se realizaron algunas variaciones en el tiempo usado para los muestreos. 30 Tabla 7. Descripción del esquema de trabajo en los sitios estudiados Transecto/Localidad Sevilla UM / EM Transectos 6 / 40 h/obs EM Búsqueda libre 8 h/obs. No. Estaciones 6 No. De Visitas 1 Tuluá 12 / 60 h/obs 16 h/obs. 5 2 Río Blanco 12 / 80 h/obs 16 h/obs. 6 2 Palmira 6 / 24 h/obs 6 h/obs. 5 1 UM: unidades de muestreo (transectos por estación); EM: esfuerzo de muestreo por estación Métodos de muestreo para todos los sitios Siguiendo lo sugerido en el protocolo de Marín et al. (2014), los muestreos hicieron énfasis en la exploración de todos los microhábitats disponibles presentes en cada estación; por ejemplo, bajo y sobre rocas, troncos caídos, bordes de quebradas, colchones de hepáticas, macollas, bajo-entre y sobre necromasa de frailejones y puyas, troncos de árboles y arbustos, sobre el suelo cubierto por hojarasca o desnudo, entre vegetación rasante, dentro de pozos y quebradas. Para el laboratorio de diversidad funcional del Instituto Humboldt, se documentó la plantilla de la plataforma institucional de datos (I2D) con la información que se describe a continuación. De cada individuo se registró fecha y hora de observación, fotografías, medidas morfométricas, peso, sexo (cuando fue posible), catedorias de edad para individuos de desarrollo directo (juvenil o adulto; basados en el protocolo, a los individuos juveniles no se les tomó ningún dato) y el comportamiento del animal en el momento de registro (p.ej. saltando, cantando, en amplexus o en reposo) entre otros. Además, se registraron datos sugeridos por Crump & Scott (1994) para la caracterización del microhábitat en anfibios: ubicación respecto a cuerpos acuáticos, posición vertical o altura de percha, tipo de sustrato en que se encuentran (p.ej. troncos, ramas, hojas, hojarasca, piedras). 3.3.1.1 Transectos de muestreo En cada estación altitudinal se localizaron seis transectos de muestreo, cada uno de 50 m de longitud x 4 m ancho. Estos transectos se distribuyeron de tal forma que cubrieran la mayor diversidad de hábitats posible en cada estación (p.ej. bosque maduro lejos de quebrada, bosque ribereño, áreas en sucesión). Los transectos quedaron separados entre sí por una distancia de 30 a 50 m acorde a lo permitido por la topografía (Figura 10). Cada transecto se muestreó durante 50 minutos en la noche y en el día y 50 ó 60 minutos en el día. 31 Figura 10. Esquema del diseño de muestreo utilizado en los transectos altitudinales de los municipio de Sevilla (Valle del Cauca) y Rioblanco (Tolima). En los transectos de Tuluá y Palmira se establecieron cinco estaciones de muestreo. 3.3.1.2 Búsqueda libre Adicionalmente, se utilizó la técnica de encuentro visual aleatorio (Crump & Scott 1994); recorridos en áreas no abarcadas por los transectos haciendo una revisión minuciosa en todos los microhábitats disponibles para registrar el mayor número posible de especies. Se hicieron dos recorridos de encuentro visual aleatorio por noche y por día; el recorrido visual aleatorio tuvo una duración de una hora en la noche y una hora en el día. 3.3.2 Preservación del material biológico Los individuos observados se identificaron en campo por conocimiento previo, descripción en literatura (Boulenger 1882; Lynch 1979, 1980, 1991; Peracca 1904, Lynch y Ruíz-Carranza 1983, Lynch, Ruíz-Carranza y Ardila-Robayo 1996) o su posible presencia en el área (Ruíz-Carranza et al. 1996, Ardila & Acosta 2000, Lynch & Suárez-Mayorga 2002, Bernal et al. 2005, Bernal & Lynch 2008). Teniendo en cuenta lo último, se elaboró un listado de las especies presentes o potencialmente presentes en el área de estudio (Anexo 2). Cuando no fue posible la identificación, se recolectaron hasta diez individuos por especie y fueron preparados acorde al protocolo establecido por Cortez et al. (2006) que se describe a continuación: Sacrificio. Se debe realizar de manera rápida, eficaz y sin provocar dolor o sufrimiento a los individuos, permitiendo que estos queden totalmente relajados y flácidos para que puedan ser acomodados de la manera más indicada para permitir la realización de estudios posteriores. Aplicar anestésicos de uso tópico como lidocaína a nivel cutáneo para anfibios de tamaño pequeño y mediano; y xilocaína como inyección intracardíaca en el caso de anfibios grandes. 32 Fijación. La fijación es un proceso químico que previene la descomposición y degradación de los tejidos producida por autolisis. El fijador utilizado es alcohol al 96%. Una vez muerto el espécimen, debe colocarse en un recipiente de plástico con tapa hermética ajustada, sobre el fondo del cual previamente se han extendido toallas blancas lisas de papel absorbente embebidas en alcohol 96%. Es importante que no se utilicen toallas teñidas o con grabados, puesto que pueden colorear los ejemplares y dejar marcas indeseables sobre la piel, que después pueden ser confundidas con características morfológicas de interés. Cada espécimen es posicionado dentro del recipiente de manera que se faciliten su futura revisión. Se colocan de tal forma que el cuerpo esté flexionado de manera natural; la boca se mantiene abierta con ayuda de un pequeño trozo papel para facilitar el posterior examen de los dientes (Figura 11). (A) (B) Figura 11. A) Posición anatómica en la que se deben fijar los especímenes; B) forma de mantener abierta la cavidad bucal en los individuos. Tomado de Cortez et al. (2006) Después de pocas horas, la mayoría de los ejemplares se endurece lo suficiente para conservar su forma; en este momento se amarra la etiqueta sobre la rodilla en la pierna derecha (Figura 12). En ejemplares de gran tamaño se recomienda que el proceso de fijación tenga un tiempo de duración mínimo de 24 horas. Finalmente se preservan en alcohol al 96% para su posterior deposito en colección. 33 Figura 12. Etiquetado de los especímenes. Tomado de Cortez et al. (2006) Despues de la fase de campo se determinaron en laboratorio y quedaron listos para su posterior donación a las colecciones zoológicas del Instituto Alexander von Humboldt y la colección de Herpetología de la Universidad del Quindío. En el muestreo se siguió el protocolo de bioseguridad planteado por Aguirre & Lampo (2006) con el fin de prevenir o minimizar la posibilidad de introducir enfermedades a las zonas visitadas; por ejemplo, desinfectar el equipo de campo (botas, cubos plásticos) con etanol al 70% o hipoclorito de sodio al 4%. 3.3.3 Análisis de datos 3.3.3.1 Riqueza y composición de especies Se hace un listado de las especies registradas en el estudio y se reporta el número de individuos adultos. También se estimó el índice de abundancia relativa para cada estación que indicó la frecuencia de detección de cada especie. Los rangos de abundancia están dentro de cuatro categorías Abundante ≥10; Común 6 – 9; Poco común 3 - 5; Rara ≤2) y se obtuvieron según los criterios descritos en Villareal et al. (2004) con algunas modificaciones. Para conocer el estado actual de las especies se recopila información sobre la categoría de amenaza, el nivel de endemismo y si esta categorizada en algún apéndice CITES. Finalmente, para describir algunos rasgos ecológicos de cada especie se realizó un gráfico de frecuencias para identificar en que rango de hora se detectó la mayor cantidad de individuos y se tabulan datos de microhábitat como la preferencia del sustrato. 3.3.3.1.1 Representatividad del muestreo Las curvas de acumulación de especies permiten establecer la efectividad de los muestreos y la potencial riqueza de especies que pudiese estar presente en cada estación. Los estimadores para la elaboración de las curvas se obtuvieron con el programa EstimateS versión 9.1.0. (www.purl.oclc.org/estimates) y se utilizaron los estimadores de riqueza (Chao 1, ACE y Jackknife 1) basados en abundancia acorde a lo sugerido por Gotelli & Colwell (2011); Villarreal et al. (2004). Las 34 unidades de muestreo serán los transectos. Los cálculos de los índices de diversidad se realizaron en el programa Past 3.06 (Hammer et al. 2001). 3.3.3.1.2 Diversidad alfa La composición y estructura de los ensamblajes de anfibios en cada nivel de elevación (estación) se evaluaron estimando la riqueza de especies y la diversidad con base en los índices de Shannon-Wiener y Pielou. Como un complemento a los cálculos de diversidad realizados, se utilizó el índice inverso de Simpson (Hill 1973) y la modificación del índice de Shannon-Wiener propuesta por Jost (2006). Estas dos últimas medidas de diversidad son usadas por muchos ecólogos ya que sus unidades son en número de especies y eliminan sesgos al comparar muestras. Los índices de diversidad de ShannonWiener fueron comparados estadísticamente con una prueba t para determinar si las diferencias numéricas son o no significativas entre las estaciones. Para comparar la estructura de los ensamblajes entre estaciones se utilizaron las curvas de diversidad-dominancia. 3.3.3.1.3 Diversidad Beta Para identificar el patrón de distribución de las especies entre estaciones se realizó el análisis de agrupamiento de especies basado en los índices de similitud de Jaccard, Sorensen y Bray-Curtis. Estos análisis se realizaron en el programa Past 3.06 (Hammer et al. 2001). Además, se utilizó el índice de complementariedad entre pares de alturas (estaciones) acorde a los lineamientos de Halffter & Moreno (2005) para estimar la diversidad β con el índice de Whittaker (Whittaker 1972). 3.4 AVES 3.4.1 Métodos Para el estudio de la avifauna se utilizaron dos métodos complementarios: conteo por puntos de banda fija y redes de niebla. Los métodos utilizados permitieron generar información sobre riqueza (diversidad alfa), composición de especies, abundancia relativa, recambio (diversidad beta) y presencia de especies amenazadas. En cada una de las cuatro localidades estudiadas, se estableció un transecto con diferente número de estaciones altitudinales, teniendo siempre como punto de partida la estación uno como la de mayor elevación, para los demás grupos (plantas, fauna edáfica y anfibios), sin embargo, en el trabajo con avifauna se ampliaron las distancias entre estaciones de muestreo, teniendo en cuenta la alta movilidad de este grupo (Tabla 8). 35 Tabla 8. Transectos estudiados y distribución de los sitios de muestreo de aves Localidad/Transecto Sevilla Tuluá Río Blanco Palmira Número de estaciones 5 4 4 4 Diferencia altitudinal entre estaciones (m) 100 125 200 125 Gradiente altitudinal 3.520 a 3.120 3.500 a 3.125 3.520 a 2.920 3.420 a 3.045 3.4.1.1 Conteo por puntos de radio fijo Este metodo consistió en establecer puntos de conteo de radio fijo cada 90 metros aproximadamente en cada una de las estaciones altitudinales, en cada punto se documentó la presencia y número de individuos de las aves a través de registros visuales o auditivos, durante 30 minutos en cada punto; para evitar el solapamiento de los datos se registraron las aves en un radio de 20 metros de acuerdo a las condiciones de visibilidad. Los muestreos en la mañana se realizaron desde las 6:00 hasta las 9:00 horas, incluyendo los desplazamientos, y en la tarde desde las 13:00 hasta las 16:00 horas. Como complemento también se realizaron conteos aleatorios durante los desplazamientos a otros puntos y entre estaciones (Figura 13). Los puntos de conteo establecidos fueron georreferenciados con GPS Garmin vista HCx, con sistema de coordenadas WGS 84; en los lugares donde fue posible realizar registros fotográficos, se utilizó una cámara Canon SX 40. Para las observaciones se utilizaron binoculares Nikon Trailblazer 10X42, y grabadora de periodista Sony, con la cual, se grabaron vocalizaciones de manera oportunista de las especies que presentaban dudas para su determinación. Detalles metodológicos para los muestreos de aves en cada localidad de estudio En puntos de conteo se realizaron cinco puntos por estación, con excepción del transecto de Sevilla, donde se establecieron seis (Tabla 9). A continuación se especifican los ajustes en cada transecto para el método de puntos de conteo. Sevilla. Se conformó por cinco estaciones de muestreo distanciadas por 100 metros altitudinales; en cada estación se establecieron seis puntos de conteo, distanciados por 90 metros aproximadamente. En cada estación se realizaron tres repeticiones en cada punto de conteo (día y medio: dos mañanas y una tarde), de esta manera se consideraron 18 unidades de muestreo por estación. Tuluá. Se conformó por cuatro estaciones de muestreo distanciadas por 120 m altitudinales. En esta localidad se realizaron dos réplicas temporales (ambas en periódo climático lluvioso), en las cuales, debido a la lluvia fue necesario ajustar el número de repeticiones para el método de puntos de conteo, en la primera 36 réplica se realizaron dos y en la segunda tres repeticiones en cada estación de muestreo, sumando un total de 25 unidades de muestreo por estación. Rioblanco. Se conformó por cuatro estaciones distanciadas 200 metros altitudinales. En este transecto se realizaron dos réplicas temporales (ambas en periódo climático lluvioso), e igual que en el transecto anterior, se ajustaron las repeticiones para el método de puntos de conteo, en la primera réplica se realizaron dos y en la segunda tres repeticiones por estación, sumando un total de 25 unidades de muestreo por estación. Palmira. se conformó por cuatro estaciones distanciadas por 120 metros altitudinales. En este transecto se realizaron dos repeticiones por punto de conteo en cada estación, sumando un total de 10 unidades de muestreo. 3.4.1.2 Redes de niebla Las redes de niebla permitieron la captura y manipulación de las aves facilitando la identificación, en especial de especies crípticas. En todos los transectos se instalaron seis redes de niebla por estación, distribuidas en dos grupos de tres redes, separados por 100 m aproximadamente (Figura 13). En la Tabla 9 se indica el número de unidades de muestreo por localidad de estudio. Las redes tenían las siguientes características: material (nylon y poliéster), 12 m de largo y 30 mm de ojo de malla. Siguiendo lo propuesto por Villareal et al. (2006), el trabajo con redes permitió obtener datos sobre: - Morfometría: longitud total del ala, envergadura, distancia entre plumas primarias y secundarias, longitud y graduación de la cola, longitud total y longitud del culmen expuesto, altura y ancho del pico, longitud del tarso, el hallux y peso. - Estado de desarrollo (adulto o juvenil). - Sexo. Los individuos que presentaron plumaje en mal estado, muda de plumas o ausencia de éstas en la cola, no fueron medidos pero sí registrados. Una vez procesadas las aves, se les hizo un corte en una pluma caudal para identificar las recapturas. Para la toma de los datos morfométricos se utilizó: balanza digital de 100 g AWS, dinamómetro marca pesola AVINET de 300 g, calibrador digital Stanley y regla de tope. 37 Figura 13. Representación esquemática de las metodologías empleadas en los muestreos de aves (redes de niebla y puntos de conteo. Tabla 9. Número de estaciones y unidades de muestreo (UM) en puntos de conteo (PC), y redes de niebla (R). Localidad/Transecto Número de estaciones UM (PC) UM (R) 5 4 4 4 18 25 25 10 6 12 12 6 Sevilla Tuluá Ríoblanco Palmira Número de visitas (Réplicas temporales) 1 2 2 1 3.4.2 Análisis de los datos 3.4.2.1 Riqueza y composición de especies La composición de la avifauna se estableció con base en la riqueza y abundancia, para esto se tuvo en consideración la riqueza como el número total de especies y la abundancia como el número de individuos registrados por especie. Para determinar la representatividad de los muestreos se utilizaron los estimadores no paramétricos Chao 1 y Chao 2, y que fueron calculados con el programa EstimateS win 9.1.0, (Moreno 2001, Villareal et al. 2006). Estos estimadores fueron representados en curvas de acumulación de especies por estación altitudinal con el programa graficador Sigmaplot 11.0. Se estimó el índice de abundancia relativa, entendido como la frecuencia de detección de una especie, para esto se agruparon los datos obtenidos con las 38 dos metodologías (Puntos de conteo y captura con redes) en cada estación altitudinal. Las especies amenazadas de extinción se determinaron según lo definido en Renjifo et al. 2014 y la Resolución No. 0192 de 2014 del Ministerio de Ambiente y Desarrollo Sostenible (MADS). Las especies endémicas o casi endémicas se categorizaron de acuerdo a Chaparro-Herrera et al. 2013 y Renjifo et al. 2001. Además se identificaron especies presentes en el apéndice II de la Convención Internacional sobre el Comercio de Fauna y Flora Amenazadas (www.cites.org/esp/resources/pub/checklist11/Indice_de_especies_CITES.pdf). Los rangos de abundancia que se determinaron fueron: abundante, común, poco común y rara (Villarreal et al. 2006). El arreglo taxonómico siguió a South American Classification Commite, (http://www.museum.lsu.edu/~Remsen/SACCBaseline.html - visitada en abril de 2015). La identificación de las vocalizaciones registradas durante los puntos de conteo se realizó a través de su comparación con la guía sonora de aves de los Andes (Álvarez et al. 2007); para la identificación de las aves registradas mediante puntos de conteo y capturadas mediante redes de niebla se utilizaron guías de campo (Hilty & Brown 2001, MacMullan et al. 2010). 3.4.2.1.1 Diversidad Alfa. Para estimar la diversidad de la avifauna se empleó el índice de Shannon-Wiener (H`), este índice expresa la uniformidad de los valores de importancia a través de todas las especies de la muestra (Moreno 2001). Esta estimación es independiente del tamaño de la muestra porque estima la diversidad sobre la base de una muestra tomada al azar y que presumiblemente contiene todas las especies de la comunidad (Magurran 1988). Además, se utilizó el índice de diversidad de Simpson (1-D), considerado como índice de dominancia, ya que este es sensible a la abundancia de las especies más frecuentes en la comunidad (Magurran 1988). Este índice es aplicable tanto a biotas pequeñas como grandes, caracterizándose en estas últimas por ser un estimador sin sesgo (Cañas 2000). 3.4.2.1.2 Diversidad Beta (β) Se calculó la diversidad beta mediante la complementariedad de especies entre pares de elevaciones (Halffter & Moreno 2005). Para identificar el recambio de especies entre bosque y páramo, se comparó con respecto a su diversidad beta para las estaciones en el transecto altitudinal. Para lo cual, se construyó una matriz de abundancia con base en los datos de campo. De esta manera se realizaron análisis de agrupamiento usando como medida de similitud los índices de Jaccard, Sorensen, Bray-Curtis y Whittaker. Para realizar estos cálculos se utilizó el programa Past versión 3.06 (Hammer et al. 2001). 39 40 4. RESULTADOS TRANSECTO ALTITUDINAL, FINCA LA TRAVIATA, VEREDA MIRAFLORES, MUNICIPIO DE SEVILLA (VALLE DEL CAUCA) 4.1 VEGETACIÓN 4.1.1 Descripción de las estaciones de muestreo 4.1.1.1 Estación uno - E1 (3520 m.s.n.m) Se encontraron coberturas vegetales abiertas de porte bajo como pajonales y herbazales, dominados por Poaceae (Calamagrostis spp., Cortaderia spp.) y Cyperaceae (Rhynchospora caucana, Carex bonplandii); frailejonales dominados por rosetas caulescentes de Espeletia hartwegiana; y rosetales acaulescentes de Puya trianae, coberturas que comúnmente se encuentran en filos y cimas de las montañas (Figura 14 A). Humedales-turberas, dominados por hierbas (Castilleja spp., Hypochaeris spp., Pedicularis incurva), Poaceas y cojines (Sphagnum, Plantago rigida), ubicadas en zonas planas (Figura 14B y Anexo 3). Las anteriores coberturas se encuentran moderadamente intervenidas, ya que hace aproximadamente 15 años fueron usadas para pastoreo de bovinos y se realizaban quemas 1 , sin embargo, actualmente se evidencian avanzados procesos de regeneración. Se encuentran también coberturas de porte medio y semiabiertas como matorrales-arbustales, dominados por Diplostephium spp., Pentacalia spp., Hypericum laricifolium, H. strictum, Blechnum loxense, Bejaria resinosa, Gaultheria spp., Plutarchia monantha, Pernettya prostrata, Gaiadendron punctatum y Hesperomeles spp.; chuscales (Chusquea tessellata) y bosques enanos con dosel más o menos continuo de hasta 8 m de altura, donde dominan Weinmannia mariquitae, Ocotea infrafoveolata, Hedyosmum cumbalense, Hesperomeles ferruginea, Clethra ovalifolia y algunas especies de matorrales. En esta estación, los matorrales y bosques enanos no son la cobertura vegetal dominante, estando ubicadas principalmente en las laderas, áreas rocosas y en las riberas de quebradas o fuentes de agua. Estratos vegetales estación uno Las tres parcelas evaluadas presentaron una pendiente de 0-15%, con plantas entre <0,1 y 1,6 m, que conforman los siguientes tres estratos vegetales: Rasante (<0,3 m): dominado por especes como Lycopodium spp., Huperzia spp., Cladonia sp., Disterigma empetrifolium, Pernettya postrata, Gentiana sedifolia, Sisyrinchium cf. trinerve y Achiachne aff. pulvinata. 1Información suministrada por el Sr. Diego Osorio, propietario de la finca la Traviata. 41 Herbáceo (0,3-1,5 m): dominado por especies como pastos (Calamagrostis sp., Cortaderia sp.), Chusquea tessellata, Valeriana microphylla, Puya trianae, helechos (Jamesonia alstonii); Baccharis tricuneata y Lupinus cf. microphyllus. Arbustivo (1,5-5 m): dominado por especies como Espeletia hartwegiana, Hypericum laricifolium, Diplostephium spp., Pentacalia spp. y Miconia salicifolia (Figura 15). A B Figura 14. Área de influencia E1 (3520 m.s.n.m). A. Pajonales, herbazales y frailejonales. B. Turberas – humedales. Sevilla, Valle del Cauca. 42 Figura 15. Perfil de vegetación arbustiva en la E1, parcela tres (3520 m.s.n.m). 1. Baccharis tricuneata, 2. Cladonia sp. 3. Chusquea tessellata, 4. Lycopodium jussiaei, 5. Diplostephium sp. 2, 6. Chusquea tessellata, 7. Disterigma empetrifolium, 8. Myrteola nummularia, 9. Miconia salicifolia,10. Jamesonia alstonii, 11. Huperzia cf. callitrichaefolium, 12. Espeletia hartwegiana, 13. Calamagrostis sp., 14. Blechnum loxense, 15. Espeletia hartwegiana, 16. Disterigma empetrifolium, 17. Pernettya prostrata, 18. Chusquea tessellata, 19. Espeletia hartwegiana, 20. Jamesonia alstonii, 21. Hypericum laricifolium, 22. Calamagrostis sp., 23. Espeletia hartwegiana, 24. Lupinus cf. microphyllus 25. Disterigma empetrifolium, 26. Lycopodium jussiaei, 27. Cladonia sp. Eje x, longitud del transecto (m); eje y, altura de la vegetación (m). Ilustración Yoao Palchukan (2015). 43 4.1.1.2 Estación dos – E2 (3440 m.s.n.m) Se presentan coberturas vegetales de porte bajo y abiertas como pajonales o herbazales, dominados por especies de las familias Poaceae (Calamagrostis spp., Cortaderia spp.) y Cyperaceae (Rhynchospora caucana, Carex bonplandii); Orthrosanthus chimboracensis), Puya trianae y Espeletia hartwegiana (Figura 16). También se encontraron coberturas de porte medio y semiabiertas como matorralesarbustales, dominados por Diplostephium spp., Pentacalia spp., Hypericum laricifolium, Escallonia myrtilloides, Blechnum loxense, Bejaria resinosa, Gaultheria sclerophylla, Themistoclesia cf. mucronata, Plutarchia monantha, Pernettya prostrata, Brachyotum ledifolium, Myrsine dependens, Gaiadendron punctatum y Hesperomeles spp.; chuscales (Chusquea tessellata) y bosques enanos con dosel moderadamente continuo donde dominan, Weinmannia mariquitae, W. pubescens, Ocotea infrafoveolata, Hedyosmum cumbalense, Hesperomeles ferruginea, Miconia chlorocarpa, Clethra ovalifolia y algunas especies de matorrales (Figura 17, Anexo 3). En la E2, los matorrales y bosques enanos se empiezan a presentar como coberturas dominantes, formando una franja más o menos continua con dosel de 5-7 m de altura, donde se entremezclan a medida que se desciende en altitud hasta predominar bosques estratificados, en estados sucesionales intermedios a avanzados. Estas coberturas se encuentran moderadamente perturbadas, estando ubicadas en laderas o áreas rocosas. Estratos vegetales estación dos Las tres parcelas evaluadas presentaron una pendiente de 0-60%, con plantas entre 0,03 y 12 m, conformando los siguientes estratos vegetales: Rasante (<0,3 m): dominado por Licopodios (Lycopodium spp., Huperzia spp.); Puya trianae, helechos (Jamesonia alstonii), líquen de los renos (Cladonia sp.); Disterigma empetrifolium, Pernettya postrata, Sisyrinchium cf. trinerve y pasto (Achiachne aff. pulvinata). Herbáceo (0,3-1,5 m): dominado por pastos (Calamagrostis sp., Cortaderia sp.), chusque (Chusquea tessellata); Pentacalia vaccinioides, Lupinus cf. microphyllus y Blechnum loxense. Arbustivo (1,5-5 m): dominado por frailejones (Espeletia hartwegiana), Hypericum laricifolium, Diplostephium spp., Pentacalia spp., Miconia chlorocarpa, Hedyosmum cumbalense, Myrsine dependens, Gaiadendron punctatum. 44 Arbolitos (5-12 m): representado principalmente por Weinmannia mariquitae, Bejaria resinosa, Gaiadendron punctatum, Hedyosmum cumbalense y Geissanthus bogotensis (Figura 17). Figura 16. Herbazales, arbustales y arbolitos de páramo. Área de influencia E2 (3440 m.s.n.m). Sevilla, Valle del Cauca. 45 Figura 17. Perfil de vegetación arbustiva en la E2, parcela uno a 3440 m.s.n.m 1. Blechnum loxense, 2. Hedyosmum cumbalense 3. Weinmannia mariquitae, 4. Bejaria resinosa, 5-6. Pernettya prostrata, 7. Puya trianae, 8. Jamesonia alstonii, 9. Cladonia sp., 10. Diplostephium cf. schultzii, 11. Calamagrostis sp., 12. Miconia chlorocarpa, 13. Puya trianae, 14. Espeletia hartwegiana, 15. Blechnum loxense, 16. Myrsine dependens, 17. Espeletia hartwegiana, 18. Miconia chlorocarpa, 19. Jamesonia alstonii, 20. Orthrosanthus chimboracensis, 21. Hypericum laricifolium, 22. Gaiadendron punctatum, 23. Pernettya prostrata, 24. Calamagrostis sp., 25. Orthrosanthus chimboracensis, 26. Espeletia hartwegiana. Eje x, longitud del transecto (m); eje y, altura de la vegetación (m). Ilustración Yoao Palchukan (2015). 46 4.1.1.3 Estación tres – E3 (3360 m.s.n.m) Se encontraron coberturas de porte medio y alto, cerradas, conformadas por bosques maduros, secundarios y algunos arbustales densos, en estados sucesionales intermedios a avanzados, que entremezclados forman una franja más o menos continua con dosel de hasta 17 m de altura. Esta estación se caracteriza por la cobertura densa de musgos que tapizan el suelo y un alto epifitismo en troncos de árboles y arbustos. Las especies dominantes son Weinmannia mariquitae, W. pubescens, formando a veces rodales casi monotípicos; otras especies existentes son: Ocotea infrafoveolata, Hedyosmum cumbalense, Oreopanax floribundum, O. discolor, Saurauia ursina, Brunellia goudotii, Miconia chlorocarpa, M. pletorica, Geissanthus cf. andinus, G. bogotensis y Clethra ovalifolia. Estas coberturas se encuentran moderada a levemente intervenidas, la topografía del terreno es quebrada a escarpada, con pendientes medias a altas (Figura 18). Estratos vegetales estación tres Las tres parcelas evaluadas presentaron una pendiente media de 20-60%,con plantas entre 1,6 y 17 m de altura, correspondientes a los siguientes estratos estratos vegetales: Rasante (<0,3 m): dominado por musgos (Sphagnum sp.), selaginelas (Selaginella sp.), helechos lengua de venado (Elaphoglossum sp.); Pilea sp., Sisyrinchium cf. trinerve. Herbáceo (0,3-1,5 m): dominado por Neurolepis sp., Notopleura sp. y Blechnum sp. Arbustivo (1,5-5 m): dominado por Cyathea sp., Palicourea ovalis, Palicourea cf. andaluciana, Miconia spp., y Hedyosmum cumbalense. Arbolitos (5-12 m): dominado por Weinmannia mariquitae, Ocotea infrafoveolata, Oreopanax discolor y Geissanthus cf. andinus. Se presenta alto epifitismo de briófitas (Sphagnum sp.), bromelias (Tillandsia stipitata, T. compacta, Racinaea tetrantha), orquídeas (Stelis spp., Oncidium sp., Epidendrum sp.) y anturios (Anthurium oxybelium). Arbóreo inferior (12-25 m): Dominado por Weinmannia mariquitae, W. pubescens, Ocotea infrafoveolata, Brunellia goudotii, Geissanthus cf. andinus y Hedyosmum cumbalense (Figura 19). 47 Figura 18. Área de influencia E3 (3360 m.s.n.m), Interior de formación boscosa. Sevilla, Valle del Cauca. 48 Figura 19. Perfil de vegetación arbustiva en la E3, parcela tres a 3360 m.s.n.m 1. Brunellia goudotii, 2. Clethra ovalifolia, 3. Palicourea cf. andaluciana, 4. Weinmannia mariquitae, 5. Palicourea cf. andaluciana, 6. Weinmannia mariquitae, 7. Myrcianthes cf. orthostemon, 8. Geissanthus cf. andinus, 9. Miconia pletorica, 10. Cyathea sp. 1, 11. Gordonia sp., 12. Cyathea sp. Eje x, longitud del transecto (m); eje y, altura de la vegetación (m). Ilustración Yoao Palchukan (2015). 49 4.1.1.4 Estación cuatro - E4 (3280 m.s.n.m) Se encontraron coberturas de porte medio y alto, cerradas, conformadas por bosques maduros y secundarios, en estados sucesionales intermedios a avanzados, que entremezclados forman una franja más o menos continua con dosel hasta 22 m de altura (Figura 20). Esta estación presenta un epifitismo moderado a alto en troncos y ramas de árboles. Las especies dominantes son Weinmannia mariquitae y W. Pubescens, formando rodales casi monotípicos; otras especies representativas fueron: Ocotea infrafoveolata, Hedyosmum cumbalense, Oreopanax floribundum, O. discolor, Saurauia ursina, Brunellia goudotii, Miconia chlorocarpa, M. pletorica, Geissanthus cf. andinus, G. bogotensis y Clethra ovalifolia. Estas coberturas se encuentran moderada a levemente intervenidas, la topografía del terreno es quebrada a escarpada, con pendientes medias a altas. Figura 20. Área de influencia E4 (3280 m.s.n.m), interior de formación boscosa. Sevilla, Valle del Cauca. 50 Estratos vegetales estación cuatro En E4, las tres parcelas evaluadas presentaron una pendiente de 20-60%,con plantas entre 1,6 y 17 m de altura, correspondientes a los siguientes estratos vegetales: Rasante (<0,3 m): dominado por musgos (Sphagnum sp.), selaginelas (Selaginella sp.), helechos (Elaphoglossum sp., Blechnum sp.), ortigas (Pilea sp.), entre otras. Herbáceo (0,3-1,5 m): dominado por Greigia cf. nubigena, Neurolepis sp., Rhynchospora cf. caucana, Anthurium oxybelium, Chusquea cf. scandens y Tropaeolum sp., entre otras. Arbustivo (1,5-5 m): dominado por Cyathea sp., Chusquea cf. scandens, Palicourea ovalis, Palicourea cf. andaluciana y Miconia spp.), entre otras. Arbolitos (5-12 m): dominado por Vallea stipularis, Weinmannia mariquitae, Oreopanax discolor, Geissanthus cf. andinus, Palicourea ovalis, Palicourea cf. andaluciana y Miconia spp., entre otras. Se presenta un moderado a alto epifitismo de briófitas (Sphagnum sp.), bromelias (Tillandsia stipitata, T. compacta, Racinaea tetrantha), Orchidaceae (Stelis spp., Oncidium sp, Epidendrum sp.) y anturios (Anthurium oxybelium). Arbóreo inferior (12-25 m): dominado por Weinmannia mariquitae, W. pubescens, Clethra revoluta, Brunellia goudotii y Geissanthus bogotensis, G. cf. andinus), entre otras (Figura 21) 51 Figura 21. Diagrama de perfil de vegetación en la E4, parcela tres a 3280 m.s.n.m 1. Miconia pletorica, 2. Weinmannia pubescens, 3. Cyathea sp., 4. Clethra ovalifolia, 5. Palicourea ovalis, 6. Maytenus cf. myricoides, 7. Miconia pletorica, 8. Palicourea ovalis, 9. Cestrum sp.,10. Cyathea sp., 11. Weinmannia pubescens, 12. Palicourea ovalis, 13. Palicourea ovalis. Eje x, longitud del transecto (m); eje y, altura de la vegetación (m). Ilustración Yoao Palchukan (2015). 52 4.1.1.5 Estación cinco – E5 (3200 m.s.n.m) Se encontraron coberturas de porte medio y alto, cerradas, que conforman un bosque secundario, en estado sucesional intermedio a avanzado, con dosel continuo hasta 25 m de altura (Figura 22). En esta estación, los bosques empiezan a fragmentarse y a estar rodeados o divididos por potreros, rastrojos o regeneraciones tempranas, dada la cercanía a las áreas productivas de las fincas. Se encuentran regeneraciones naturales de Freziera canescens, F. reticulata al interior, sobre antiguos caminos o claros que cruzan el bosque, siendo un grupo de especies pioneras importante y común en esta zona. En esta área, la fragmentación de los bosques por acción antrópica, empieza a confinarlos hacia las quebradas y zonas de ladera más escarpada. Esta estación se caracteriza por la cobertura densa de helechos hemiepífitos (Plagiogyria semicordata), un moderado a alto epifitismo en troncos de árboles. Las especies dominantes son: Drimys granadensis, W. pubescens, Ocotea infrafoveolata, Ocotea sp., Axinaea macrophylla, Ruagea hirsuta, Podocarpus oleifolius, Myrcianthes cf. orthostemon, Hedyosmum cuatrecazanum, H. cf. goudotianum, Oreopanax floribundum, O. discolor, Saurauia ursina, Brunellia goudotii, M. pletorica, Geissanthus cf. andinus, G. bogotensis, Vallea stipularis y Clethra ovalifolia. Estas coberturas se encuentran moderada a altamente intervenidas, debido a la cercanía a potreros de las fincas. Figura 22. Área de influencia E5 (3200 m.s.n.m), interior de formación boscosa. Sevilla, Valle del Cauca. 53 Estratos vegetales estación cinco Las tres parcelas evaluadas presentaron una pendiente media de 20-80% o superior, con plantas entre 1,5 y 22 m de altura, correspondientes a los siguientes estratos vegetales: Rasante (<0,3 m): dominado por Rhynchospora cf. caucana, helechos (Elaphoglossum sp., Polypodium sp. Blechnum sp.) y Pilea sp., entre otras. Herbáceo (0.3-1.5 m): dominado por helechos (Plagiogyria semicordata), Chusquea cf. scandens y Nasa puracensis, entre otras. Arbustivo (1,5-5 m): dominado por Cyathea sp., Palicourea ovalis, Palicourea cf. andaluciana, Miconia pletorica y Gaiadendron punctatum, entre otras. Arbolitos (5-12 m): dominado por Palicourea ovalis, Palicourea cf. andaluciana y Miconia pletorica, entre otras. Se presenta moderado a alto epifitismo de bromelias (Tillandsia stipitata, T. compacta, Racinaea tetrantha), orquídeas (Stelis spp., Oncidium sp, Epidendrum sp.) y anturios (Anthurium oxybelium, A. martae). Arbóreo inferior (12-25 m): dominado por Weinmannia pubescens, Ruagea hirsuta, Hedyosmum cuatrecazanum, H. cf. goudotianum, Axinaea macrophylla, Clethra ovalifolia, C. revoluta, Vallea stipularis, Ocotea infrafoveolata, Drimys granadensis, Podocarpus oleifolius, Brunellia goudotii y Geissanthus cf. andinus, G. bogotensis, entre otras (Figura 23) 54 Figura 23. Perfil de vegetación boscosa en la E5, parcela tres a 3200 m.s.n.m 1. Podocarpus oleifolius, 2. Weinmannia pubescens, 3. Palicourea ovalis, 4 Oreopanax caricaefolium, 5. Geissanthus cf. andinus, 6. Ocotea sp. 1, 7. Clethra ovalifolia, 8. Myrcianthes cf. orthostemon, 9. Hedyosmum cf. goudotianum, 10. Ocotea sp. 1, 11. Ruagea hirsuta, 12. Cyathea sp., 13. Axinaea macrophylla, 14. Palicourea cf. andaluciana, 15. Clethra ovalifolia. Eje x, longitud del transecto (m); eje y, altura de la vegetación (m). Ilustración Yoao Palchukan (2015). 55 4.1.1.6 Estación seis – E6 (3120 m.s.n.m) Se encontraron coberturas de porte medio y alto, cerradas, conformadas por bosques maduros y secundarios, en estados sucesionales intermedios a avanzados, que forman una franja más o menos continua, con dosel de hasta 22 m de altura. Igual que la estación anterior, las formaciones boscosas de esta área están restrigidos a terrenos encañonados y de alta pendiente (Figura 24). Se presenta un moderado a alto epifitismo en troncos de árboles. Las especies dominantes fueron: Drimys granadensis, W. pubescens, Ocotea spp., Nectandra sp., Axinaea macrophylla, Ruagea hirsuta, Podocarpus oleifolius, Myrcianthes cf. orthostemon, Hedyosmum cuatrecazanum, H. cf. goudotianum, Oreopanax floribundum, Saurauia ursina, Brunellia goudotii, Miconia spp., Vallea stipularis y Clethra revoluta. Estas coberturas se encuentran moderada a altamente intervenidas, por su proximidad a las áreas productivas de las fincas, la topografía del terreno es quebrada y escarpada. Figura 24. Zonas de influencia E6 (3120 m de altitud), panorámica e interior de formaciones boscosas. Sevilla, Valle del Cauca. Estratos vegetales estación seis Las tres parcelas evaluadas presentaron una pendiente media de 20-80%, con plantas entre 1,5 y 22 m de altura, correspondientes a los siguientes estratos vegetales: - Rasante (<0,3 m): dominado por selaginelas (Selaginella sp.) y Pilea sp., entre otras. 56 - Herbáceo (0,3-1,5 m): Dominado por helechos (Blechnum sp.) y Chusquea cf. scandens, entre otras. - Arbustivo (1,5-5 m): Dominado por Siparuna echinata, Cyathea sp., chusque Chusquea cf. scandens, Palicourea ovalis, Palicourea cf. andaluciana, Miconia spp., Smilax sp., entre otras. - Arbolitos (5-12 m): Dominado por Palicourea ovalis, Palicourea cf. andaluciana), Cestrum sp.), Oreopanax caricaefolium, O. floribundum, Viburnum pichinchense, y Miconia spp.), entre otras. Se presenta moderado a alto epifitismo de bromelias (Tillandsia stipitata, T. compacta), orquídeas (Stelis spp., Oncidium sp., Epidendrum sp.) y anturios (Anthurium oxybelium, A. martae). - Arbóreo inferior (12-25 m): Dominado por Weinmannia pubescens, Ruagea hirsuta, Hedyosmum cuatrecazanum, H. cf. goudotianum, Axinaea macrophylla, Clethra revoluta, laureles (Ocotea sp., Nectandra sp., Drimys granadensis, Podocarpus oleifolius y Brunellia goudotii, entre otras (Figura 25). 57 Figura 25. Perfil de vegetación boscosa en la E6, parcela tres a 3120 m.s.n.m. 1. Clethra revoluta, 2. Palicourea ovalis, 3-5. Axinaea macrophylla, 6. Vallea stipularis, 7. Buddleja incana, 8. Hedyosmum cf. goudotianum, 9. Oreopanax caricaefolium, 10. Palicourea ovalis, 11. Miconia pustulata,12. Tournefortia cf. polystachia, 13. Cervantesia tomentosa, 14. Ruagea hirsuta, 15. Saurauia ursina, 16. Ocotea sp. 2. Eje x, longitud del transecto (m); eje y, altura de la vegetación (m). Ilustración Yoao Palchukan (2015). 58 4.1.2 Representatividad de los muestreos El muestreo fue significativo en las seis estaciones con valores mayores al 80%, para el estimador de riqueza de especies, Boostrap. En cuanto al estimador basado en la abundancia (Chao 1), E1, E2 y E6 fueron representativas con un 97%, 78% y 84% respectivamente, mientras que las estaciones E3, E4 y E5 alcanzaron valores menores al 60% (Figura 26). En la Figura 26G, se reúnen las curvas del estimador Chao 1 para las seis estaciones, en las que se observa que en las estaciones E3, E4 y E5 no se alcanza la asíntota. 59 50 50 Observadas Chao 1 Bootstrap 40 30 Riqueza Riqueza 40 Observadas Chao 1 Bootstrap 20 30 20 10 10 A 0 0 1 2 B 0 0 3 30 30 Riqueza Riqueza Observadas Chao 1 Bootstrap 40 20 20 10 10 C 0 0 1 2 D 0 0 3 2 3 50 Observadas Chao 1 Bootstrap 40 Observadas Chao 1 Bootstrap 40 30 Riqueza Riqueza 1 Unidades de muestreo Unidades de muestreo 50 20 10 30 20 10 E 0 0 1 2 F 0 3 0 Unidades de muestreo 50 1 2 3 Unidades de muestreo E1 E2 E3 E4 E5 E6 40 Riqueza 3 50 Observadas Chao 1 Bootstrap 40 2 Unidades de muestreo Unidades de muestreo 50 1 30 20 10 G 0 0 1 2 3 Unidades de muestreo Figura 26. Curvas de acumulación de especies de la riqueza observada y la riqueza estimada por Bootstrap y Chao 1 en el transecto de Sevilla, Valle del Cauca. A. E1 (3520 m), B. E2 (3440 m), C. E3 (3360 m), D. E4 (3280 m), E. E5 (3200 m), F. E6 (3120 m), G. Curvas con el estimador Chao 1 para cada estación. 60 4.1.3 Riqueza y composición florística La E2 tuvo la mayor representatividad en cuanto al número de especies (34), géneros (33), familias (21) e individuos (193), respecto a las demás estaciones, ya que es una zona donde se encuentraron especies de arbustos y arbolitos, que configuran alta riqueza y abundancia de plantas (Figuras 27 y 28). Las estaciones E3 y E4, presentaron la menor abundancia y riqueza vegetal en todo el transecto altitudinal, lo anterior, puede estar relacionado con que son áreas donde se encontraron rodales de Weinmannia spp., Ocotea infrafoveolata, Hedyosmum cumbalense, Brunellia goudotii y Geissanthus cf. andinus (Figuras 27 y 28). Las estaciones a mayor altitud en el transecto (E1, 3.520 y E2, 3.440), presentaron un alto número de individuos, 161 y 193 respectivamente, puesto que la vegetación en su mayoría está compuesta de estratos bajos, lo que significa, que las plantas requieren menos espacio para su desarrollo y por ende mayor segregación de individuos. Por el contrario, en las demás estaciones del transecto, se encontró el menor número de individuos: 88 (E3), 112 (E4), 116 (E5) y 117 (E6) respectivamente, lo que puede estar relacionado con que las especies de ésta zona, presentan mayor área basal y cobertura de copa, por lo que requieren mayor espacio para su desarrollo, e influyen en que exista menor abundancia Figuras 27 y 28). Ninguna familia botánica presentó mas de seis especies en el transecto. Asteraceae (en E1) y Ericaceae (en E2) con seis especies respectivamente, fueron las familias más ricas, seguidas de Melastomataceae con 5 (en E3) y 6 (en E6). Melastomataceae se reportó en todas las estaciones con más de tres especies, excepto en la E1, donde no se observó. Familias como Asteraceae, Ericaceae, Poaceae y Lycopodiaceae fueron representativas sólo en E1 y E2, ya que presentaron más de dos especies. Otras familias como, Araliaceae, Melastomataceae, Cunoniaceae, Primulaceae, Lauraceae, Chloranthaceae y Clethraceae, presentaron mayor representatividad en las cuatro estaciones más bajas del transecto (E3 a E6) (Figura 29), según autores como Gentry (1995) y Rangel (1995) estas últimas familias son típicas de ecosistemas boscosos. 61 40 Especies Géneros Familias Abundancias 30 20 10 0 Estaciones Figura 27. Riqueza y composición florística en el transecto de Sevilla, Valle del Cauca. 250 Abundancias 200 150 100 50 0 Estaciones Figura 28. Abundancia florística en el transecto de Sevilla Sevilla, Valle del Cauca. 62 7 Riqueza 6 5 4 3 2 1 0 E1 (3520 m) E2 (3440 m) E3 (3360 m) E4 (3280 m) E5 (3200 m) E6 (3120 m) Familias por Estaciones Figura 29. Familias botánicas con mayor número de especies en las estaciones del transecto altitudinal de Sevilla, Valle del Cauca. 4.1.3.1 Diversidad Alfa () Los valores más altos del índice de diversidad de Shannon-Wiener (H`), los presentaron E1 y E6 respectivamente, y los valores más bajos E3, E5 y E4, donde predominaron formaciones boscosas. El alto valor de diversidad en la E6, posiblemente se debe a su número de especies (30), las cuales estuvieron representadas con pocos individuos (Tabla 10). Iguamente, el mayor valor del índice inverso de Simpson (S), lo obtuvo la E2, lo que puede estar relacionado con que presentó el mayor número de especies (34) e individuos (193), en segundo lugar se ubicó la E1. Estas dos estaciones (E1 y E2) estuvieron ubicadas en coberturas vegetales donde habitan especies con poca dominancia (Tabla 10). El menor índice inverso de Simpson, se presentó en la E5, y el menor índice de diversidad de Shannon-Wiener, se presentó en la E3. Estos resultados pueden estar relacionados con que en la E5, se presenta una especie con 38 individuos (Palicourea ovalis), mientras que en la E3, las especies más abundantes (Clethra ovalifolia, Weinmannia mariquitae, Geissanthus cf. andinus, Palicourea cf. andaluciana) no superan los 15 individuos (Anexo 3). 63 Además se corroboró por medio de una prueba t que existen diferencias significativas entre la estación E1 y las estaciones E2-E5, al igual que la E2 con las estaciones E3-E6, teniendo en cuenta que es muy poca la diferencia entre la E1 y E2 (P< 0,05 en todos los casos), es decir, que estas dos franjas altitudinales (E1 y E2) presentan diferencias en cuanto a la riqueza frente al resto de alturas (Tabla 11). Tabla 10. Índice de Dominancia de Simpson (S) e Índice de Diversidad de ShannonWiener (H`) para las estaciones estudiadas en el transecto de Sevilla, Valle del Cauca. Índices de Diversidad E1 E2 E3 E4 E5 E6 Simpson (Inverso) 0,93 0,95 0,89 0,90 0,86 0,91 Shannon-Wiener (ln) 2,88 3,24 2,52 2,62 2,59 2,91 Tabla 11. Prueba de t Índice de Diversidad de Shannon-Wiener (H`) para las estaciones estudiadas en el transecto de Sevilla, Valle del Cauca. E1 E1 (3520 m) E2 E3 -4,3976 3,2795 6,1276 E4 2,7842 E2 (3440 m) 1,46E-05 E3 (3360 m) 0,00132 1,01E-08 E4 (3280 m) 0,0058643 2,25E-09 0,3818 E5 (3200 m) 0,010165 2,93E-07 0,63703 0,74181 E6 (3120 m) 0,84367 0,0013022 0,0097526 0,04382 E5 2,5987 E6 0,19747 6,2714 5,3484 3,266 -0,87679 -0,47257 -2,6106 0,32988 -2,0272 -2,0583 0,0407 4.1.3.2 Diversidad beta () Los índices de similitud de Sorensen y de Jaccard se observan en los dendrogramas (Figura 30 A y C) formando dos grupos: uno conformado por las estaciones E1 y E2 con un 56% (Sorensen) y 36% (Jaccard) de similitud; el segundo grupo está conformado por dos subgrupos, uno de ellos con un 51% (Sorensen) y 35% (Jaccard) de similitud entre las E6 y E5; referente al segundo subgrupo presenta una similitud de 58% (Sorensen) y 38% (Jaccard) entre E4 y E3. Nótese que los resultados arrojados por el índice de similitud de Bray-Curtis, son diferentes, ya que agrupa E5 y E4 con un 48% de similitud, a su vez, E6 con 34% y finalmente E3 con 21%, mientras que las estaciones E1 y E2 siguen agrupadas como en los demás índices pero en este caso con un 65% de similitud (Figura 30 B). Debido a las diferencias en las topologías de los tres dendrogramas ilustrados en la Figura 30, se releva el hecho que con un nivel de similitud de 30% en el resultado de Sorensen hay dos grupos, uno compuesto por E1 y E2 y otro 64 conformado por E3-E6; en el análisis Bray-Curtis quedarían tres grupos, uno compuesto por E1 y E2, otro formado por las estaciones E4-E6 y E3 como grupo aparte; finalmente en Jaccard se siguen presentando tres grupos, E1 y E2 en uno, en el otro E6 y E5 y por último E4 y E3; en síntesis, los bajos niveles de similitud entre las parejas de elevaciones parecen sugerir afinidades por proximidad más que debidas al parámetro analizado. Sólo en el caso del análisis con Bray-Curtis, la comparación entre E1 y E2, sugieren una mayor afinidad (65%) entre ellas, tal vez como resultado de la dominancia que presentan algunas especies en cada una de ellas. En contraste, las estaciones subsiguientes parecen tener relaciones menos estrechas entre sí. Figura 30. Índices de similitud para vegetación en el transecto de Sevilla, Valle del Cauca. A. Sorensen, B. Bray-Curtis y C. Jaccard. 65 Índice de Whittaker De acuerdo a este índice, las E1 y E2 difieren en más del 79% con las E3, E4, E5 y E6. La E1 en particular se distancia claramente de las E3, E4 y E6 con un porcentaje del 100% al igual que la E2 de la estación E5 (Tabla 12); estas diferencias son considerables dada la composición de especies de estos sitios, ya que a medida que aumenta la distancia entre estas comunidades disminuye la similitud. No obstante, las E1 y E2 tienen tan solo un 45% de diferencia entre ellas ya que tienen algunas especies en común, confirmando los resultados obtenidos de los análisis anteriores. Es de notarse que hay una disminución de la similitud con la distancia y el recambio de especies significativo del 100% y 79% de la estación tres con respecto a las estaciones uno y dos, ya que la E1 no comparte ninguna especie con la estaciones E3, E4 y E6; de igual manera la E2 tampoco comparte especies con la E5. Tabla 12. Índice de Whittaker para el transecto ubicado en Sevilla E1 E2 E3 E4 E5 E1 3520 m 0 E2 3440 m 0,45 0 E3 3360 m 1,00 0,79 0 E4 3280 m 1,00 0,89 0,41 0 E5 3200 m 0,96 1,00 0,46 0,50 0 E6 3120 m 1,00 0,97 0,69 0,73 0,46 E6 0 4.1.4 Estratos vegetales Los estratos herbáceo y rasante fueron los predominantes en E1 y E2, ubicadas a mayor altitud en el transecto altitudinal (3520 y 3540 m respectivamente); en menor porcentaje también se presentó el estrato arbustivo. Este último tuvo una mayor representación en las cuatro estaciones más bajas (E3 a E6). Los arbolitos predominaron en E3, E4, E5 y E6, siendo menor su porcentaje de especies, a medida que disminuyó la elevación, caso contrario sucedió con los árboles, que aumentaron a medida que disminuyó la altitud (Figura 31). 66 60 Arbóreo Porcentaje de individuos 50 Arbolitos 40 Arbustivo 30 Herbáceo 20 Rasante 10 0 Estaciones Figura 31. Distribución de individuos según estratos vegetales por estación, en el transecto de Sevilla, Valle del Cauca. 4.1.5 Índice de Valor de Importancia (IVI) Uno de los resultados obtenidos refiere a la heterogeneidad cubierta por las parcelas escogidas al momento de calcular los IVI's. Así, es posible observar que las variables que contribuyen en el cálculo del IVI, dejan entrever algunas diferencias que no fueron corroboradas por medio de métodos estadísticos. La dominancia relativa por ejemplo, es relevante en E1 y E3 donde las especies Calamagrostris effusa y Weinmannia mariquitae dominan la elevación referida. De igual forma, la densidad de Palicourea ovalis es la variable más importante en las estaciones (E5 y E6) (Tabla 13). Las frecuencias relativas por su parte permanecen más o menos constantes en todas las estaciones. Todo lo anterior, para enfatizar que los valores más altos del IVI, están influenciados por el aporte de las dominancias relativas en todo el transecto, de allí que Calamagrostris effusa en E1 (64,60) y Weinmannia mariquitae en E3 (50,51) son las especies con mayor índice de valor de importancia con 80,17 y 73,61 respectivamente (Tabla 13 y Figura 32) En las estaciones E1 y E2, además de Calamagrostris effusa se destacaron especies como Chusquea tessellata, Espeletia hartwegiana, Lycopodium jussiaei e Hypericum laricifolium. Algunas de las especies mencionadas son hierbas y arbustos características de formaciones vegetales paramunas (Cuatrecasas 1958, Cleef 1980). C. tessellata e H. laricifolium son especies de mayor valor de importancia que solo se encuentran en la estación E1, sin embargo P. trianae y J. alstonii se encuentran en la E2. 67 Tabla 13. Especies con mayor Índice de Valor de Importancia en las E1 y E2 del transecto de Sevilla, Valle del Cauca Familia Especie Estaciones E1 / IVI E2 / IVI 80,17 38,56 Poaceae Calamagrostis sp. Bromeliaceae P. trianae Pteridaceae J. alstonii Lycopodiaceae L. jussiaei 22,37 18,73 Asteraceae E. hartwegiana 23,03 16,83 Poaceae C. tessellata 23,23 Blechnaceae H. laricifolium 18,77 22,89 19,9 En las tres estaciones más bajas (E4 a E6), las especies de mayor importancia son Palicourea ovalis con 37,67 en la E4 y 47,97 en la E5, esto debido su alta densidad (E4, 20,54 y E5, 32,76); y Hedyosmum cf. goudotianum con 38,02 en la E6 explicado por su considerable área basal (Figura 32). Figura 32. Especies que presentaron el mayor valor en el Índice de Valor de Importancia (IVI) en el transecto altitudinal de Sevilla, Valle del Cauca. 68 4.1.6 Conclusiones En las dos estaciones ubicadas a mayor elevación (3520 y 3440m), Calamagrostis effusa presentó los mayores valores del Índice de Valor de Importancia (IVI). Explicándose por su alta frecuencia, abundancia y dominancia. Los aportes de los habitantes de la zona, relevan que el páramo presentó presión por ganadería bovina (quemas y pastoreo) en décadas anteriores. Actualmente se observan procesos de regeneración natural avanzados, el paisaje de pajonales es complementado con parches de bosques achaparrados. No se evidenció presencia de ganado. En las dos estaciones ubicadas a mayor altitud (3520 y 3440 m), predominaron estratos vegetales rasante y herbáceo, representados por especies como: Chusquea tessellata, Calamagrostis effusa, Espeletia hartwegiana, Lycopodium jussiaei, Hypericum laricifolium, Pernettya prostrata, Pentacalia vaccinioides y Diplostephium cf. schultzii. En las cuatro estaciones ubicadas entre 3360 y 3120 m, predominaron estratos vegetales de arbolitos, arbustos y árboles, con especies como: Geissanthus bogotensis, Miconia spp., Oreopanax discolor y Weinmannia pubescens. A partir de E3, ubicada a 3.360 m de altitud, la composición, diversidad y estratos vegetales cambiaron. Asi mismo la diversidad de Shannon-Wiener disminuyó y se evidenció un recambio de especies según el índice de Whittaker. 4.2 EDAFOFAUNA 4.2.1 Riqueza y composición de especies en el transecto altitudinal Se clasificaron 60 morfoespecies distribuidas en 11 órdenes y 38 familias. El número total de individuos recolectados fue 556. Los órdenes con mayor riqueza fueron: Coleoptera con 22 morfos y Diptera con 18, seguido por Araneae 5, Orthoptera y Hemiptera con 3, Hymenoptera con 2, los otros cinco órdenes presentaron una sola morfoespecie (Figura 33). La morfoespecie con mayor número de individuos fue el escarabajo (Carabidae) Dyscolus sp.1, con 90 individuos (Figura 33), seguida por un grillo de la familia Grillidae (Gryllus sp.2, con 83; un escarabajo Staphylinidae sp.3 con 36; un colémbolo de la familia Entomobryidae (sp.5) con 34 individuos, Glyptolenus sp.10 con 31 (Figura 33) y Philosciidae (sp.4) con 30 individuos. Las demás morfoespecies presentan menos de 20 individuos (Anexo 4). En cuanto a órdenes, resaltan Coleoptera y Diptera no solo por su abundancia y riqueza específica, sino por contribuir en gran medida a los procesos de descomposición de materia en el suelo (Salazar-Ortega 2008) y su aporte en biomasa en el ecosistema (Sánchez-Ramos 1993). El aporte de estos dos grupos presenta diferencias en la medida que se disminuye en altura de las estaciones en 69 las que se realizó el muestreo (Figura 34). Se pudo observar que la mayoría de las especies del orden díptera, se encuentran en mayor proporción las tres últimas estaciones, adicionalmente con abundancias semejantes entre estas cotas altitudinales (Figura 34, Anexo 4). 25 ** Número de individuos Dyscolus sp1 20 Glyptolenus sp10 ** Dyscolus sp11 15 10 5 0 E1 (3520) E2 (3440) E3 (3380) E4 (3300) E5 (3220) E6 (3160) Estaciones altitudinales Figura 33. Abundancia de tres morfoespecies de la familia Carabidae, destacadas por altamente detectables en las seis estaciones de muestreo del transecto de Sevilla, Valle del Cauca. ** Para esta especie el número de indivíduos se dividió sobre dos (N/2) en E5 y en E6, para facilitar las comparaciones. 14 No de especies 12 10 Coleoptera Diptera 8 6 4 2 0 E1 (3520) E2 (3440) E3 (3360) E4 (3280) E5 (3200) E6 (3120) Estaciones altitudinales Figura 34. Número de especies de los dos órdenes más ricos de la edafofauna presente en seis estaciones de muestreo. Transecto altitudinal Sevilla, Valle del Cauca. 70 Riqueza de Carabidae en las estaciones altitudinales Dos especies del género Dyscolus (Anexo 4) y una del género Glyptolenus (Coleoptera: carabidae), se asociaron a las tres estaciones de menor elevación (Figura 33). Únicamente Dyscolus sp.1 presentó un individuo en E3, los demás no se encontraron en las tres estaciones de mayor elevación. La morfoespecie Dyscolus sp.1 fue la más abundante. Su abundancia aumentó a medida que descendió la elevación (Anexo 4), presentando el mayor número en la estación seis donde se colectaron 48 individuos (Figura 33). Según (Martínez & Ball 2003), Dyscolus es el género con más especies de la tribu en Colombia. En general, los carábidos son básicamente depredadores y ocupan una variedad de hábitats, como ambientes de agua dulce, playas de mar, hendiduras en rocas, cavernas, glaciares de alta montaña, desde el subsuelo a las copas de los árboles (Erwin 1991). Su importancia aumenta dado que entre los artrópodos, probablemente sea uno de los taxones mejor estudiados, debido a su diversidad, larga historia evolutiva, amplio espectro de comportamiento y sensibilidad a cambios ambientales (Erwin et al. 1979). De este grupo, las especies de la tribu (Platynini), como Dyscolus y Glyptolenus, cazan otros artrópodos, aparentemente con preferencia nocturna, sobre el suelo, hojarasca y en zonas cercanas a fuentes de agua. En Colombia, la tribu comprende los géneros Dyscolus Dejean, Glyptolenus Bates, Glyptolenoides Perrault, Incagonum Liebherr, Sericoda Kirby, Laemostenus Bonelli (introducido) y posiblemente Onypterygia Dejean (conocido de Centro América y Venezuela) (Martínez & Ball 2003). 4.2.1.1 Diversidad alfa Representatividad y esfuerzo de muestreo Se calculó que el muestreo tuvo una representatividad entre 81% según el índice de Chao 1 y 73% según el índice Chao 2. Las curvas de acumulación de especies muestran una tendencia a seguir creciendo. De igual forma, el comportamiento paralelo de la curva de los singletons (con 41% de representatividad) con la curva de los doubletons (con representatividad del 24%), predicen que se encontrarán pocas especies raras si se aumenta el esfuerzo de muestreo (Figura 35), lo que significa un muestreo aceptable para la zona evaluada. 71 300 Transecto No de indivíduos 250 S(est) Singletons Mean Doubletons Mean Chao 1 Mean Chao 2 Mean 200 150 100 50 0 0 1 2 3 4 E1 5 6 E2 40 30 No de morfoespecies 30 20 20 10 10 0 0 5 0 10 0 72 5 10 E3 E4 30 70 60 No de morfoespecies 50 20 40 30 10 20 10 0 0 5 0 10 0 No de morfoespecies E5 70 60 60 50 50 40 40 30 30 20 20 10 10 0 5 10 E6 70 0 5 0 10 0 Unidades de muestreo 5 10 Unidades de muestreo Figura 35. Curvas de acumulación de especies para la Edafofauna epígea realizada para las seis estaciones de muestreo en el transecto de Sevilla, Valle del Cauca. En general la tendencia de las curvas de Chao1 y Chao2 (menos en E2 y E3) muestran que se podrían seguir encontrando especies a medida que se aumente el muestreo. Pero sugieren que el número de especies es alto, a pesar de haber empleado un esfuerzo de muestreo bajo. Este resultado se corrobora al observar 73 la tendencia paralela de los singletons y los doubletons, los cuales no predicen nuevos aportes de especies raras al listado general. Riqueza y abundancia de especies por estación altitudinal Se observó que la riqueza y la abundancia aumentan a medida que disminuye la altura en las estaciones altitudinales, comportamiento que sigue la regla de Rapoport para las evaluaciones de la edafofauna respecto a la altura (Sanders 2002) (Figura 36). La franja altitudinal más pobre y menos abundante fue E1 (3520 m.s.n.m), de forma inversa la más rica y con más individuos fue la última estación, E6 (3120 m.s.n.m) (Tabla 14). La estación altitudinal que reportó mayor porcentaje de especies fue E6 (53%), seguido de E5 con 46%, E4 con 44%, E3 34%, E2 22% y E1 con 19% (Tabla 14). Abundancia 35 90 30 80 25 No de individuos No de morfoespecies Riqueza 20 15 10 5 70 60 50 40 30 20 10 0 0 E1 E2 E3 E4 E5 E6 (3520) (3440) (3380) (3300) (3220) (3160) E1 E2 E3 E4 E5 E6 (3520) (3440) (3380) (3300) (3220) (3160) Estaciones altitudinales Estaciones altitudinales Figura 36. Riqueza y abundancia de especies de Edafofauna en seis estaciones altitudinales del transecto de Sevilla. Índices Shannon y Simpson Según el índice Shannon, E6 (3120 m.s.n.m) fue el sitio más diverso, al mismo tiempo que Simpson (1-D) nos muestra que en esta misma estación presentó una distribución más equitativa de elas especies (Tabla 14). No obstante, estos dos valores son muy semejantes a los de las cuatro últimas estaciones y se hace diferente en las dos primeras, mostrando así un posible vínculo entre este grupo de estaciones altitudinales (E3, E4, E5 y E6). Como es sabido, la diversidad biológica varía a lo largo de gradientes, lo cual se asocia generalmente a cambios sistemáticos en factores ambientales (Brown & Lomolino 1998). 74 Tabla 14. Diversidad Alfa en Edafofauna epígea de las seis estaciones. Sevilla, (Valle del Cauca). Estación Altitudinal Shannon H Simpson 1-D Riqueza Abundancia E1 (3520 m) 2,109 0,8388 11 22 E2 (3440 m) 2,385 0,8906 13 32 E3 (3380 m) 2,799 0,9244 20 39 E4 (3300 m) 3,012 0,9363 26 49 E5 (3220 m) 2,967 0,9331 27 71 E6 (3160 m) 3,096 0,9419 31 80 Se corroboró por medio de una prueba t que existen diferencias significativas entre la estación E6 con E1, E2 y E3; del mismo modo, la estación E4 y la estación E5 difieren de E1 y E2. Por otro lado, E1, E2 y E3, no parecen presentar diferencias entre sí. Estos resultados están mostrando dos grandes franjas, la primera compuesta por E1-E2-E3 donde se observa una diversidad semejante; y la segunda por E4-E5-E6, las cuales difieren del primer bloque, pero se asemejan entre si (Tabla 15). Tabla 15. Valores t student y P valor para las medias de la riqueza observada en cada estación altitudinal, transecto Sevilla (Valle del Cauca). Estaciones E1 E1 E2 E3 E4 E5 E6 -0,468 -0,019 -2,963 -3,132 -3,668 -1,474 -2,74 -2,592 -3,466 -1,23 -1,474 -2,183 -0,206 -0,961 E2 P:0,641 E3 P:0,059 P:0,145 E4 P:0,004 P:0,008 P:0,223 E5 P:0,002 P:0,012 P:0,145 P:0,836 E6 P:0,0005 P:0,001 P:0,033 P:0,340 -0,753 P:0,454 *Los números subrayados presentan diferencias significativas. Comportamiento de la diversidad a lo largo del gradiente altitudinal Tal como se ha visto, la altitud tiene influencia sobre la riqueza de especies presentes en cada estación muestreada, lo que se observa al comparar las estaciones E1 hasta E6, donde se encontró una clara tendencia al incremento a medida que se desciende en altura. Este resultado se sustenta en la tendencia que genera el gradiente altitudinal al limitar la distribución espacial y temporal de muchos organismos, ya que incluye variaciones climáticas que implican cambios 75 en la productividad, competencia y depredación dentro de un sistema (Rahbek 1995, Lomolino 2001). Rangos de abundancia En ninguna de las seis estaciones se observaron especies que se presentaran en los 10 trampas por estación de muestreo. Se determinaron como especies abundantes aquellas observadas en las diez trampas, comunes las observadas entre nueve y cinco trampas, poco comunes las observadas entre cuatro y dos trampas y especies escasas las que fueron observadas una sola vez (Figura 37). Se observó que la cantidad de especies raras y poco comunes es relativamente alto frente al número total de especies en cada una de las estaciones altitudinales (Figura 37), lo que indica una alta proporción de fauna edáfica con individuos raros, poco abundantes y restringidos, propios de estos ecosistemas altoandinos. Por el contrario, se observaron pocas especies abundantes y como caso particular, no se encontró ninguna especie común en ninguna de las seis estaciones altitudinales, lo cual puede ser un efecto de la baja incidencia de las especies capturadas. Figura 37. Curvas de diversidad-dominancia de las morfoespecies de Edafofauna Epígea colectadas en las seis estaciones del transecto de Sevilla (Valle del Cauca). Nota: Los números pertenecen al código de cada especie que se encuentran en el anexo 4. Por otro lado se observaron relativamente pocas especies abundantes por estación altitudinal. La morfoespecie Gryllus sp.2 no se presentó en E1, se presentó en baja proporción en E2 y E3, pero se catalogó como abundante en E4, E5 y E6, mostrando un claro aumento de abundancia desde los 3280 m.s.n.m (E4) hacia abajo (Figura 37). 76 4.2.1.2 Diversidad beta (β) Índice de Whittaker En cuanto al análisis de recambio de especies, se observó un alto recambio de especies (de una estación a la siguiente) tanto entre E1 y E2 como entre E2 y E3 (Tabla 15, subrayados). Tabla 15. Recambio entre pares de estaciones altitudinales según Whittaker Estaciones altitudinales E1 E2 E3 E4 E5 E2 0,750 E3 0,806 0 0,636 0 E4 0,783 0,692 0,521 0 E5 0,789 0,800 0,489 0,471 0 E6 0,857 0,727 0,529 0,473 0,482 Análisis de disimilitud SIMPER (Bray-Curtis) Los porcentajes de disimilitud por medio del análisis SIMPER (Bray-Curtis) mostraron que E1 y E2 mantienen las mayores diferencias al ser contrastados con las demás estaciones altitudinales (Tabla 16, subrayados), lo que muestra los sitios con la mayor diferencia en composición en todo el transecto. En cuanto al recambio de especies, se observó un mayor efecto en el paso de E1 hacia E2 y de E2 a E3, es decir, en esos dos puntos se dan dos importantes cambios de diversidad de edafofauna en la zona (Tabla 16, subrayados). Caso contrario, desde E4 hasta E6 el porcentaje de recambio es muy bajo, con lo que asumimos que la fauna es relativamente similar a estas alturas. Tabla 16. Porcentaje de disimilitud entre pares de alturas por medio del análisis SIMPER Estaciones altitudinales E1 E2 85% E3 85% 84% E4 89% 79% 60% E5 92% 87% 71% 43% E6 96% 90% 75% 54% E2 77 E3 E4 E5 33% Análisis de agrupamiento Analizando la composición por medio del índice Jaccard, se observan tres grupos con bajo porcentaje de semejanza entre las seis estaciones así: el primero formado por E1, el segundo por E2, el tercero por E3-E4-E5 y E6 con 33% de similitud (Figura 38 A). El índice Jaccard muestra el primer punto de recambio en la estación E1 y seguidamente otro recambio que se da en la estación E2, mostrando una diversidad altamente cambiante en la parte más alta del transecto. El análisis del agrupamiento Sorensen-Dice, refuerza el resultado de Jaccard y le da más confianza a los grupos conformados. El grupo integrado por las cuatro estaciones de la mitad E3, E4, E5 y E6, presentan un porcentaje de similitud casi del 50% y se segregan igualmente E1, separado de E2, mostrando que son las estaciones más disímiles, presumiblemente una separación dada más por el efecto de la baja incidencia de especies (Figura 38 B). Similarity 1,0 0,8 0,6 0,4 0,2 2 (3.440) 3 (3.360) 4 (3.280) 5 (3.200) 6 (3.120) A. 1 78 Similarity 0,96 0,80 0,64 0,48 0,32 0,16 2 (3.440) 3 (3.360) 4 (3280) 5 (3.200) 6 (3.120) 1 (3.520) B. Figura 38. Clúster de similitud de la edafofauna epígea presente en las seis estaciones de muestreo. Sevilla, Valle del Cauca. A. Jaccard, B. Sorensen-Dice. * La línea negra muestra el punto de corte para los tres grupos formados. Agrupamiento de las estaciones Tanto el recambio con Whittaker, como con SIMPER, muestran dos importantes zonas de recambio. Estos dos análisis separan tres grupos según la similitud de la composición presente entre las seis estaciones. Las tres franjas que se generan inician con la estación E1, la cual rápidamente presenta diferencias respecto a la estación subsiguiente E2, la cual a su vez difiere de E3. Este resultado nos muestra un rápido recambio en la parte más alta del transecto. 4.2.2 Hábitos ecológicos En este transecto se encontró que 45% de las familias de artrópodos recolectadas presentan hábitos alimenticios principalmente depredadores, seguidos por artrópodos herbívoros los cuales constituyeron un 25%, omnívoros 16% y finalmente un 14% para otras estrategias alimenticias (saprófitos y parásitos). Se observó que el porcentaje de depredadores disminuye a media que descienden las estaciones altitudinales, pero inversamente, tanto saprófitos como omnívoros, tendieron al incremento con la disminución de la altitud. Los herbívoros por su parte no presentan una tendencia visible (Tabla 17). De igual forma, la proporción de depredadores disminuyó frente a los herbívoros a medida que se disminuía en altura. En este sentido, la estación E1 presentó una proporción del 54% de depredadores frente a 18% de herbívoros, E2 54% de depredadores frente a 15% herbívoros y el grupo E3-E4-E5-E6 35% de depredadores frente a 25% de herbívoros. 79 Tabla 17. Proporción de los principales grupos tóficos por estación altitudinal en el transecto de Sevilla. Gremio E1 (3520m) E2 (3440m) E3 (3380m) E4 (3300m) E5 (3220m) E6 (3160m) Depredadores 64% 62% 50% 38% 15% 35% Herbívoros 27% 15% 20% 12% 11% 23% Omnívoros 9% 23% 25% 19% 19% 23% Saprófitos 0 0 5% 8% 7% 10% Estos resultados sugieren que a mayor altitud, la proporción de los diferentes grupos puede cambiar y por tanto también su participación en procesos como descomposición, entre otros procesos edáficos. Sin embargo, hacen falta más estudios a nivel de grupos funcionales, incluso en gradientes altitudinales, para establecer estos cambios, pues en términos globales se sabe que la abundancia de la edafofauna disminuye con la altitud (Leaky & Proctor 1987). 4.2.3 Conclusiones Se estima que 73% de la especies según Chao 2, es una diversidad de especies alta, teniendo en cuenta el esfuerzo de muestreo empleado. No obstante el número de especies aumenta con el tamaño de la muestra y es muy posible que el poco muestreo empleado sea un sesgo metodológico que nos induzca errores de estimación e interpretación de los resultados. Tanto la riqueza como la abundancia aumentaron a medida que disminuyó la altitud, sin mostrar una clara tendencia de recambio altitudinal de las morfoespecies capturadas. Este resultado es reforzado por los análisis de recambio de especies, los cuales no muestran agrupaciones sólidas en la franja evaluada. Del grupo de carábidos, la morfoespecie Dyscolus sp.1 aumenta a medida que disminuye el gradiente altitudinal, especialmente en las estaciones E4, E5 y E6, mostrando su poca preferencia por las coberturas de herbazal arbustal de las estaciones más elevadas. Por el contrario los géneros Glyptolenus sp.10, Dyscolus sp.11 presentan un comportamiento opuesto, salvo que son especies menos densas; mostrando que en general las especies de la tribu Platynini (Carabidae) tienen potencial para realizar estudios de recambio altitudinal en estos ecosistemas altoandinos. Los géneros Dyscolus y Glyptolenus (tribu Platynini), podrían usarse como herramienta para evaluar los recambios altitudinales de los ecosistemas altoandinos (Maveety et al. 2011), dada su posible afinidad a ciertas alturas, o a su fácil capacidad de detección (Figura 33). Adicionalmente, estas especies 80 presentan una asociación con determinados componentes del hábitat, lo cual ha sido usado para estudios del estado de conservación (Pearson 1994). La resolución taxonómica a la cual se llegó y el bajo conociemiento de la edafofauna de páramo en Colombia, no nos permite determinar con una alta confianza las morfoespecies propias de una franja altitudinal. 4.3 ANFIBIOS 4.3.1 Riqueza y composición de especies En el transecto altitudinal de Sevilla se registraron un total de 150 individuos (94 adultos y 56 juveniles), que se agrupan en seis especies de anuros y estos a su vez, en dos familias taxonómicas. Tres especies fueron catalogadas como abundantes de acuerdo al índice de abundancia relativa. Sin embargo, esto cambia entre estaciones. En E1, Pristimantis simoterus y P. racemus fueron las más abundantes, mientras que en E3, E4 y E5, la más abundante fue P. peraticus (Tabla 18). De las especies capturadas se colectaron algunos individuos que fueron depositados en las colecciones del IAvH y la Universidad del Quindío (Anexo 5), con el fin de confirmar identidades y disponener de especímenes de referencia, igualmente, se obtuvieron muestras de tejidos y datos funcionales que serán usados por el laboratorio de diversidad funcional del IAvH, y fueron documentados en la Plataforma Institucional de Datos (I2D). Tabla 18. Riqueza, abundancia y abundancia relativa de los anfibios adultos registrados en el transecto de Sevilla, Valle del Cauca Estaciones / m s.n.m. Familias/Especies E1/3520 Craugastoridae Pristimantis simoterus Pristimantis racemus E2/3440 E3/3360 E4/3280 E5/3200 E6/3120 21 (Ab) 3 (Pc) 0 0 0 0 10 (Ab) 1 (Ra) 0 0 0 0 Pristimantis peraticus 0 2 (Ra) 6 (Com) 25 (Ab) 11 (Ab) 3 (Pc) Pristimantis aff. supernatis 0 0 0 0 2 (Ra) 0 Pristimantis buckleyi 0 0 0 0 1 (Ra) 3 (Pc) Bufonidae Osornophryne aff. bufoniformis 2 (Ra) 0 0 0 2 (Ra) 2 (Ra) Total individuos 33 6 6 25 16 8 El índice de abundancia relativa se muestra entre paréntesis; sus categorías son: Ab= Abundante; Com= Común; Pc= Poco común y Ra= Rara. A pesar de escucharse en actividad bastantes machos en el área de estudio, sólo se detectaron tres bajo este comportamiento (dos individuos de P. peraticus y uno de P. buckleyi). Se realizó un gráfico de frecuencias para identificar en que rango de hora se detectó la mayor cantidad de individuos por especie (Figura 39). 81 Figura 39. Frecuencia de detección de individuos por intérvalos de hora en el transecto de Sevilla, Valle del Cauca. Entre las especies observadas, solo una está catalogada con algún nivel de riesgo, dos más están como casi amenazadas y las demás en preocupación menor (www.iucnredlist.org - consultada el 15 de abril de 2015, versión 2014.3). A pesar de contar con información en listas rojas mundiales (IUCN), que demuestran el nivel de amenaza de algunas especies y su endemismo para la cordillera Central de Colombia, se evidencia la existencia de vacíos de información en literatura nacional especializada, en cuanto a los criterios para definir el nivel de amenaza de las especies. Es posible que existan especies sin categoría de amenaza, porque se describieron recientemente y se sabe poco de sus poblaciones debido a limitantes en la resolución taxonómica y a restricciones de tipo logístico, al acceso a las áreas donde habitan (Fernández 2011; RiveraCorrea 2012). Además, teniendo en cuenta el tipo de ecosistema en el que habitan estas ranas y el aislamiento por grandes barreras geográficas, se observa la restringida distribución de tres especies que fueron registradas para el estudio y que además son endémicas para Colombia, más específicamente en la cordillera Central. Las otras tres tienen una estrecha distribución entre Colombia y Ecuador, de manera que se catalogan como Casi endémicas (Tabla 19). Desde hace algunos años se viene documentando que la distribución aislada y restringida es comúnmente observada en las ranas del género Pristimantis que habitan en las cordilleras, debido a esto se genera una estrecha relación entre los individuos y el ecosistema que habitan, dando como resultado a nivel regional que estos organismos soporten procesos únicos que son expresados en una alta endemicidad (Lynch et al. 1997; Lynch 1999; Ardila y Acosta 2000). Ninguna de las especies ha sido 82 objeto del comercio de fauna silvestre, de manera que no están catalogadas dentro de ningún apéndice del CITES en el 2015 (www.checklist.cites.org/#/en). Para los anfibios se hace evidente que dependiendo del tipo de ecosistema en el que se encuentren, hacen uso de un hábitat específico, y en el caso de las poblaciones paramunas, además de esto, deben reducir su exposición a la radiación solar como medida de protección. Precisamente en las estaciones ubicadas en este tipo de estructuras (frailejonal, pajonal y arbustal) la mayoría de individuos se asociaron a la necromasa de los frailejones durante el día. Esto concuerda con las observaciones de Navas (1999) quien afirma que las especies de anuros están asociadas a las características del ambiente que explotan y en el caso de condiciones extremas, las poblaciones son obligadas a refugiarse en un microhábitat específico para evitar efectos de la radiación solar, bajas y altas temperaturas. Tabla 19. Endemismo y categorías de amenaza de los anfibios registrados en el transecto de Sevilla (Valle del Cauca). Estado de Amenaza de acuerdo a diferentes fuentes RuedaMin. CastroIUCN Almonacid Ambiente Herrera y 2014.3 et al. 2004 Resolución Bolívar192 de 2014 García. 2010 Familia/Especie Endemismo* Craugastoridae Pristimantis simoterus Endémico NT - - - Pristimantis racemus Endémico LC - - LC Pristimantis peraticus Endémico LC - - LC Pristimantis aff. supernatis Casiendémico Casiendémico VU - - VU LC - - LC - - Pristimantis buckleyi Bufonidae Osornophryne aff. CasiNT bufoniformis endémico * Basado en IUCN 2014.3 LC: preocupación menor, NT: casi amenazada, VU: vulnerable. www.minambiente.gov.co/.../resoluciones/2014/res_0192_2014.p... En general, la composición de especies se puede estratificar de acuerdo a la disponibilidad de microhábitats. Por ejemplo, las especies que habitan en las estaciones E1 y E2 (Pristimantis simoterus y P. racemus) prefieren asociarse a frailejones, mientras que las observadas en E3, E4, E5 y E6 (P. peraticus, P. supernatis y P. buckleyi), a diferentes estratos de la vegetación (Figura 20). Este comportamiento es observado en otras especies por Muñoz-Guerrero et al. (2007) quienes encuentran que dependiendo de la disponibilidad de microhábitats en diferentes ambientes, las especies aprovechan un recurso específico. 83 Tabla 20. Uso de microhábitats por adultos de las especies de anfibios observados en el transecto de Sevilla, Valle del Cauca. Las estaciones se agrupan en pares (1-2); (3-4); (56) ESTACIONES 1 y 2 ESPECIE ESTRATO – (ABUNDANCIA) MICROHÁBITAT Pristimantis simoterus Rasante (21) Frailejón Necromasa de Frailejón Puya Herbáceo (3) Frailejón Puya Pristimantis racemus Rasante (7) Necromasa de Frailejón Puya Perchada en hojas Osornophryne bufoniformis Herbáceo (4) Frailejón Rasante (2) Hojarasca Poaceae Pristimantis peraticus Rasante (2) Puya Necromasa de Frailejón ESTACIÓN 3 y 4 Pristimantis peraticus Rasante (7) Hojarasca Musgo y hepática Perchada en hojas Herbáceo (24) Helecho Perchada en hojas ESTACIÓN 5 y 6 Pristimantis peraticus Rasante (4) Hojarasca Puya Pristimantis aff. supernatis Pristimantis buckleyi Herbáceo (10) Perchada en hojas Rasante (1) Perchada en hojas Herbáceo (1) Perchada en hojas Rasante (4) Hojarasca Perchada en Hojas Osornophryne bufoniformis Rasante (4) Hojarasca Musgo y hepática 84 4.3.1.1 Representatividad del muestreo Los registros fueron obtenidos con un esfuerzo de muestreo total de 240 horas/observador en los transectos y 48 horas/observador con la técnica de búsqueda libre fuera del área abarcada por los transectos. El esfuerzo de muestreo fue igual para cada estación (40 h/obs. transectos y 8 h/obs. búsqueda libre por estación). Las curvas de acumulación de especies se agruparon por pares de estaciones (1-2; 3-4; 5-6) para aumentar la muestra, por lo tanto cada curva queda con 12 unidades de muestreo. Los estimadores usados fueron Chao 1, ACE y Jackknife 1. En las estaciones (12) los observados llegan a cuatro especies y los estimadores Jackknife 1 y ACE 1 tienden a seis especies pero no se logra la asíntota en la curva, estando la representatividad del muestreo por el orden del 68% y el 77%. de manera que se espera que a través de repeticiones se registren más especies en el tiempo (Figura 40 A). Los resultados sugieren que para los pares de estaciones (3-4) y (56) los muestreos permiten un buen estimado de la riqueza de anfibios ya que la representatividad del muestreo estuvo por encima del 80%. A pesar de tener pocas especies, el esfuerzo de muestreo permite observar que con las doce unidades de muestreo se alcanza a tener una muestra representativa, donde los estimadores logran una asíntota y los singletons y doubletons tienden a decrecer y estabilizarse (Figuras 40 B y C). Se debe tener en cuenta que es un estudio base, cuya evaluación ecológica rápida reduce la detectabilidad, además se desarrolla en un solo periodo de tiempo y con esto no se permite observar todas las especies que se han reportado allí (Anexo 2). (A) 85 (B) (C) Figura 40. Curvas de acumulación de especies para el ensamblaje de anfibios por pares de estaciones. A) E1-E2, B) E3-E4, C) E5-E6. Transecto de Sevilla (Valle del Cauca). Si se observa la Tabla 18 de riqueza de especies, se encuentra que entre las estaciones (5-6) se registran cuatro especies. En la curva de acumulación de especies de este par de estaciones solo aparecen dos especies, esto es debido a que las otras dos especies fueron vistas en búsqueda libre y esta metodología no está en las curvas como unidades de muestreo. 86 4.3.1.2 Diversidad Alfa (α). En cuanto al ensamblaje de anfibios, los índices muestran que la diversidad de Shannon-Wiener Exp. (H') es más alta en las estaciones E2 y E6, ya que presentan una alta riqueza y la abundancia de cada una de las especies tiende a ser homogénea, de manera que son las estaciones con mayor Equidad (J) también. Aunque la estación E5 fue la de mayor riqueza, ésta presenta una especie muy dominante, de manera que el índice de Simpson inverso demuestra que en esta estación, la dominancia es la más alta con respecto a las demás, después de la E3 y E4 que sólo tienen una especie. Como particularidad se tiene que en las estaciones E3 y E4 sólo se registró una especie y los índices con esos valores no aportan mucha información (Tabla 21). Para el transecto altitudinal se esperaría que los índices de diversidad describieran una tendencia, mostrando un valor de diversidad más alto en las estaciones de menor elevación. Este supuesto es tenido en cuenta debido a que la estructura vegetal de los bosques ofrece una mayor complejidad estructural y por ende, una mayor disponibilidad de microhábitats en la que coexisten un número más alto de especies (Rincón & Castro 1998; Gutiérrez-Cárdenas 2005; García et al. 2007). La detectabilidad de las especies también se puede hacer mas difícil en lugares con mayor disponibilidad de hábitats, sin embargo un aspecto importante a considerar son las fluctuaciones naturales en la dinámica de las poblaciones de anfibios (Pounds et al. 1997) de manera que la baja abundancia registrada podría deberse a una época del año con baja actividad poblacional de manera natural. También es posible que procesos antrópicos como la destrucción, fragmentación y pérdida de hábitat que se han registrado anteriormente en áreas naturales del Valle del Cauca, sean factores que han derivado en el declive de numerosas especies en las cobertura naturales que persisten (Bustamante et al. 2005; Velásquez et al. 2008; Castro-Herrera & Vargas-Salinas 2008). Tabla 21. Patrones de diversidad en los ensamblajes de anfibios registrados en el transecto altitudinal de Sevilla (Valle del Cauca). Índices/estación m.s.n.m Riqueza Abundancia E1 (3520) 3 E2 (3440) 3 E3 (3360) 1 E4 (3280) 1 E5 (3200) 4 E6 (3120) 3 33 6 6 25 16 8 Shannon Exp (H)* 2,269 2,748 1 1 2,588 2,951 Equidad (J) 0,7458 0,9206 0 0 0,6858 0,9851 1,99 2,57 1 1 1,97 2,91 Simpson inverso * Modificación del índice de Shannon acorde a Jost (2006). Exp (H). Con los valores estimados de diversidad se realizó la prueba t que determina si existen diferencias numéricas de la diversidad entre estaciones. Las diferencias más claras se observan para las estaciones E3 y E4 con respecto a las demás. 87 Esto se debe a que en las estaciones E3 y E4 solo se observó una especie. En las demás estaciones los valores de riqueza y abundancia fueron mayores, de manera que el análisis estadísticamente muestra que existen allí diferencias significativas (Tabla 22). Tabla 22. Prueba t para comparar valores de diversidad (Índice de Shannon-Wiener) entre pares de estaciones en el gradiente de altitud. Valores arriba de la diagonal indican el valor del estadístico t, valores debajo de la diagonal corresponden al valor P. Estaciones E1 E2 E3 E1 -0,75 7,47 E2 0,47 1,39E-08 0,0047 4,37 E3 E4 1,39E-08 0,0047 - E5 0,61 E6 0,16 0,86 E4 E5 E6 7,47 -0,52 -1,48 4,37 - 0,19 -0,26 -4,13 -7,75 -4,13 -7,75 0,00079 0,00079 0,8 5,46E-05 5,46E-05 -0,49 0,63 Algunas especies tienden a ser abundantes como Pristimantis simoterus y P. peraticus, mientras que otras tienden a ser escasas o raras dependiendo de la estación en la que se encuentren (Figura 41). Se logra observar que de acuerdo a la estructura vegetal de las estaciones, predomina una especie en cada una de ellas, encontrándose que en las estaciones E1 y E2 de frailejonal, pajonal y arbustal, es más dominante P. simoterus, mientras que en las estaciones E5 y E6 de bosque, domina P. peraticus. Debido a que solo se registró una especie (P. peraticus) en las estaciones (E3 - E4) que incluyen estructura de bosque, las curvas de diversidad-abundancia fueron realizadas solo para las estaciones (E1 E2) y (E5 - E6). 88 Figura 41. Curvas de diversidad-dominancia de anfibios para las estaciones con más de una especie (Estaciones E1, E2, E5 y E6). Las especies se representan a través de letras en la figura; A= P. simoterus; B= P. racemus; C= O. bufoniformis; D= P. peraticus; E= P. aff. supernatis y F= P. buckleyi. 89 4.3.1.3 Diversidad Beta β El ensamblaje de los anfibios cambió su configuración entre estaciones a medida que se desciende altitudinalmente (Figura 42). Esto se observa de manera más definida entre las estaciones (E2 - E3), ya que de la estación E3 hacia abajo, no se vuelven a registrar Pristimantis racemus ni P. simoterus; en cambio, se registraron otras especies como P. buckleyi y P. supernatis. Se registra P. peraticus como una especie que se encuentra en distintas coberturas vegetales del gradiente altitudinal, es decir, en las estaciones de frailejonal-pajonal y en las de bosque. Lynch y Suárez-Mayorga (2002) ubican esta especie como exclusiva de páramo, y en el presente estudio se encontró como abundante y común en las estaciones con formaciones boscosas. Figura 42. Recambio en el ensamble de anfibios del gradiente altitudinal comprendido entre los 3520 (E1) y 3120 m.s.n.m (E6), transecto altitudinal de Sevilla, Valle del Cauca). *Fotografía obtenida de CalPhotos Database. Las demás son autoría de Wolfgang Buitrago-Gozález y Carlos Londoño-Guarnizo. 90 Índice de Similitud En las formaciones boscosas (E3, E4, E5 y E6) predominó Pristimantis peraticus, mientras que en áreas de frailejonal-pajonal y arbustal, predominaron, P. simoterus y P. racemus. En las estaciones E3 y E4, ubicadas a una altitud intermedia, se encontró solo la presencia de P. peraticus, pero en abundancia relativamente alta con respecto a lo observado en las demás estaciones. En las estaciones (E5 y E6) se observan otras especies que aunque no son muy abundantes, se observaron sólo en formaciones boscosas: P. buckleyi y P. supernatis. Otras especies se distribuyen en los dos ecosistemas del gradiente (páramo y bosque): Osornophryne bufoniformis y P. peraticus. Estas tendencias se observan en el gráfico de agrupamiento de las estaciones a través de los índices de similitud de Jaccard y Sorensen, siendo el segundo quien debido a su procesamiento matemático más elaborado, arroja un agrupamiento con un mayor ajuste (Figuras 43 A y C). El conglomerado con Bray-Curtis es diferente debido a que es un índice que trabaja con abundancias y esto genera que se reagrupen las estaciones en un orden alternativo (Figura 43 B). 91 (A) (B) (C) Figura 43. Agrupamiento de similitud entre estaciones del transecto de Sevilla (Valle del Cauca). a. Índice de similitud de Bray-Curtis, b. Índice de similitud de Jaccard, c. similitud de Sorensen. Los números de cada rama corresponden a la elevación (m) de las estaciones. 92 Recambio de especies La complementariedad de la composición de especies entre pares de biotas fue calculada con el índice de reemplazo de especies de Whittaker (Tabla 23). El análisis indica que las estaciones cercanas entre sí, tienen valores bajos en el índice, demostrando que el recambio es poco. Al comparar estaciones más distantes se observa que la complementariedad aumenta, demostrando lo diferentes que son esos pares de estaciones. De manera que la fauna de anfibios en estructuras de bosques es más similar entre sí que con respecto a la presente en las estaciones de frailejonal-pajonal y arbustal. Existe un recambio de especies a medida que se asciende altitudinalmente en las pendientes andinas, de manera que en ecosistemas de páramo la riqueza de fauna anura disminuye y es diferente a la de bosque (Lynch 1999; Lynch & Suárez-Mayorga 2002; Bernal & Lynch 2008). Con los datos obtenidos en el transecto altitudinal se puede identificar que la tendencia no es muy clara como para que se aproxime a estos supuestos. Posiblemente esto se deba a que la franja altitudinal estudiada es muy estrecha. Tabla 23. Índice de complementariedad de Whittaker entre estaciones para los anuros del transecto altitudinal de Sevilla (Valle del Cauca). Estaciones E1 E2 E1 E2 0,33 E3 E4 E5 E6 1 1 0,71 0,66 0,5 0,5 0,71 0,66 0 0,6 0,5 0,6 0,5 E3 E4 E5 0,14 E6 4.3.2 Datos importantes Pristimantis simoterus es una especie endémica para Colombia, y concentra su distribución en la cordillera Central en los departamentos de Caldas, Risaralda, Quindío y Tolima. En el presente estudio se registra en el departamento del Valle del Cauca, al sur del complejo de páramos Chilí-Barragán. Este registro amplía su área de distribución en la vertiente occidental de la cordillera Central. De acuerdo al listado de anfibios paramunos de Colombia (Anexo 6), cinco de las seis especies registradas en el estudio de Sevilla, coinciden con la preferencia de ecosistema en el que habitan (páramo o bosque). Sólo Pristimatis peraticus difiere de lo registrado en el listado de anfibios paramunos de Colombia, ya que lo ubican como exclusivo de páramo, y en el presente estudio se registró como abundante y común en las estaciones con formaciones boscosas. 93 4.3.3 Conclusiones La abundancia de las especies cambió en el gradiente de altitud. El cambio se observa en Pristimantis simoterus y P. peraticus. La primera es más abundante en E1 y E2, mientras que la segunda aunque aparece desde E2, es más abundante en E3, E4 y E5. Se registró una especie que está catalogada en peligro de extinción y dos que están casi amenazadas. Sumado a esto se documenta que de las seis especies vistas, tres son endémicas para Colombia y las otras tres casi endémicas. Los anfibios se refugian en microhábitats específicos dependiendo de la estructura vegetal predominante. Los observados en las estaciones E1 y E2, prefirieron refugiarse entre la necromasa de frailejón y los de las estaciones E3, E4, E5 y E6 en perchas sobre plantas. 4.4 AVES 4.4.1 Riqueza y composición de especies Se obtuvieron 473 registros durante 360 horas/red y 45 horas/observador, los registros representaron 70 especies agrupadas en 24 familias (Anexo 6). Las familias con mayor riqueza fueron: Trochilidae (14), Thraupidae (11), Tyrannidae (7) y Grallariidae (5). Durante los desplazamientos entre estaciones, se registraron ocho especies: Anas andium, Geranoaetus albicaudatus, Ensifera ensifera, Andigena nigrirostris, Campephilus pollens, Falco sparverius, Thraupis cyanocephala y Piranga rubriceps; dado que éstas no fueron registradas en los puntos de conteo, no se consideraron en los análisis. Es por esto que los análisis de diversidad alfa y beta se realizaron con 62 especies registradas de forma sistemática. Se colectaron dos especímenes, uno de Glaucidium jardinii y otro de Grallaria squamigera, que fueron depositadas en el museo del IAvH. Entre las 62 especies motivo de análisis, 29 fueron registradas únicamente en algunas estaciones: seis en la E1, dos en las estaciones E2 y E3, 10 en la E4 y 11 en la E5. Metallura tyrianthina y Turdus fuscater fueron registradas en todas las estaciones. Se obtuvo un total de 111 registros de 34 especies por vocalizaciones, y 134 registros de 40 especies mediante observaciones directas; es decir, 22 especies se registraron de ambas maneras; 14 se registraron únicamente mediante vocalizaciones y 20 se registraron sólo con observaciones directas. En el gradiente se encontraron tres especies amenazadas, y una casi amenazada de extinción, según lo definido en Renjifo et al. 2014. Además se encontraron 12 especies endémicas o casi endémicas, de acuerdo a Chaparro-Herrera et al. 2013 (Tabla 24). Las 14 especies de la familia Trochilidae y tres de Psittacidae registradas en el transecto, se encuentran en el apéndice II de la Convención Internacional sobre el Comercio de Fauna y Flora Amenazadas 94 (www.cites.org/esp/resources/pub/checklist11/Indice_de_especies_CITES.pdf) (Anexo 6). Tabla 24. Aves amenazadas de extinción y endémicas registradas en el transecto de Sevilla, Valle del Cauca Familia Especie Categoría de amenaza Nivel de Endemismo Anatidae Anas andium Casi-endémico Scolopacidae Gallinago nobilis Casi-endémico Trochilidae Eriocnemis derbyi Casi-endémico Trochilidae Eriocnemis mosquera Casi-endémico Trochilidae Heliangelus exortis Casi-endémico Trochilidae Coeligena lutetiae Casi-endémico Ramphastidae Andigena hypoglauca VU Ramphastidae Andigena nigrirostris NT Casi-endémico Psittacidae Hapalopsittaca fuertesi CR Endémico Psittacidae Bolborhynchus ferrugineifrons Psittacidae Ognorhynchus icterotis Thraupidae Urothraupis stolzmanni Casi-endémico Parulidae Myioborus ornatus Casi endémico Endémico EN Casi-endémico CR: En peligro crítico; EN: En Peligro; Vu: vulnerable; NT: Casi amenazado. 4.4.1.1 Representatividad del muestreo Las curvas resultado del análisis con el estimador Chao 2 para el método con redes de niebla (Figura 44), permiten identificar que la E2 tuvo un comportamiento alejado de las demás estaciones, una circunstancia derivada de la baja tasa de captura en esta estación. Asimismo E1 y E3 se comportan en claro ascenso aunque con una riqueza relativamente baja. Las restantes, E4 y E5, permiten identificar un punto de inicio de estabilización. No obstante, la riqueza en ambas estaciones son las más altas del gradiente. En los puntos de conteo, las curvas se comportaron asintóticas, sin embargo, igual que en el método anterior las estaciones E4 y E5 presentan las riquezas más elevadas, con una leve tendencia a seguir aumentando en el caso de E4. Las demás estaciones aunque con riquezas más modestas, las tres curvas parecen estabilizarse a partir de la mitad de unidades de muestreo (Figura 44). 95 Figura 44. Curvas de acumulación de especies basadas en Chao 2. A: Redes de niebla y B: Puntos de conteo. Transecto altitudinal en Sevilla, Valle del Cauca Estación uno - E1 (3520 m.s.n.m) La complementariedad metodológica que se utilizó, dio resultados contrastantes entre los métodos. En las redes de niebla la representatividad del muestreo fue de 91% para Chao 1 y 46% para Chao 2. En general los dos estimadores calculados predicen un mayor número de especies y no se observa aproximación a una asíntota. Por su parte en los puntos de conteo la representatividad de cada uno de los estimadores, mostró una mayor tendencia hacia la asíntota, aunque no se nota explícita (Tabla 25, Figura 45). Tabla 25. Comparación de los estimadores Chao 1 y 2, entre métodos de muestreo de Aves, en el transecto de Sevilla. Redes Puntos conteo Chao 1 Chao 2 Chao 1 Chao 2 E1 (3520) 91% 46% 90% 83% Estaciones E2 (3420) E3 (3320) 66% 45% 70% 37% 96% 72% 93% 87% 96 E4 (3220) 35% 40% 73% 67% E5 (3120) 71% 54% 62% 52% Figura 45. Curva de acumulación de especies observadas y estimadas: Chao1 y Chao2, E1 (3520 m.s.n.m). A: Redes de niebla y B: Puntos de conteo. Transecto altitudinal Sevilla, Valle del Cauca Durante el muestreo en esta estación se registraron 17 especies agrupadas en 10 familias, siendo las más representativas, Trochilidae con cinco especies y Thraupidae con tres. Se consideraron seis especies como abundantes, ya que se registraron en más de cinco oportunidades, estas fueron: Cistothorus platensis (23), Phrygilus unicolor (18), Diglossa humeralis (8), Sporagra spinescens (7) y Turdus fuscater (6) (Figura 46). Entre las especies consideradas raras por ser registradas entre una y dos veces, se encuentran: Bolborhynchus ferrugineifrons, Metallura williami, Ramphomicron microrhynchum y Grallaria rufula (Figura 46, Anexo 6). Las especies que sólo se capturaron en esta estación fueron: Patagioenas fasciata, Bolborhynchus ferrugineifrons, Ramphomicron microrhynchum, Grallaria quitensis, Myornis senilis, y Phrygilus unicolor. Es importante resaltar el registro de B. ferrugineifrons, debido a que es una especie endémica de la cordillera Central de los Andes colombianos (Hilty & Brown, 2001; Stiles, 1998) y rara (Kattan, 1992; López-Lanus et al., 2000). De acuerdo con Ridgely (1981); Raves y Giraldo (1987), B. ferrugineifrons demuestra preferencias por zonas ecotonales entre bosques altoandinos y páramos donde los cambios del paisaje por actividades antrópicas (cultivos de papa y potreros) son evidentes. 97 M. leucophrys T. fuscater O. icterotis A. igniventris B. montana M. ornatus M. tyrianthina T. vassorii Z. capensis H. superciliaris M. squamiger O. underwoodii A. lacrymosus E. derbyi H. exortis A. cupripennis I. rufivertex A. hypoglauca A. schistaceus C. lutetiae C. coruscans D. cyanea G. linearis G. nuchalis H. fuertesi I. chrysater M. poecilocercus O. cinnamomeiventris S. spillmanni S. azarae Abundancia relativa ni/N E. mosquera 0,20 0,15 0,10 Abundancia relativa ni/N C 0,25 0,05 0,00 98 T. vassorii S. spinescens M. williami C. herrani M. tyrianthina I. rufivertex H. exortis G. nobilis E. mosquera E. derbyi D. lafresnayii T. fuscater U. stolzmanni 0,00 O. fumicolor 0,00 M. squamiger 0,05 D. humeralis aterrima 0,05 M. ornatus 0,10 C. platensis 0,15 Abundancia relativa ni/N 0,20 A. lacrymosus G. rufula R. microrhynchum M. williami G. rufula P. fasciata M. senilis M. tyrianthina I. rufivertex E. mosquera B. ferrugineifrons G. quitensis D. lafresnayii C. herrani T. fuscater S. spinescens D. humeralis aterrima P. unicolor C. platensis Abundancia relativa ni/N 0,25 M. leucophrys M. williami M. ornatus A. igniventris L. lafresnayi P. montagnii T. fuscater C. torquata E. derbyi H. fuertesi P. arcuata P. riefferii A. somptuosus M. tyrianthina O. underwoodii T. solstitialis D. lafresnayii G. jardinii G. nuchalis G. ruficapilla G. squamigera H. exortis H. gularis M. squamiger O. frontalis P. cinnamomeus S. spillmanni S. azarae T. vassorii Z. capensis A. hypoglauca T. fuscater P. arcuata O. underwoodii M. williami C. lutetiae P. ruficeps E. derbyi A. igniventris P. montagnii O. fumicolor H. exortis G. rufula A. hypoglauca A. orthonyx C. torquata A. lacrymosus M. tyrianthina M. ornatus M. leucophrys Abundancia relativa ni/N A B 0,25 0,20 0,15 0,10 D 0,25 0,20 0,15 0,10 0,05 0,00 E 0,25 0,20 0,15 0,10 0,05 0,00 Figura 46. Abundancia de especies A: E1, B: E2, C: E3, D: E4, E: E5. Transecto altitudinal en Sevilla, Valle del Cauca Estación dos – E2 (3420 m.s.n.m) Las representatividad para el método redes de niebla en esta estación fue baja (Tabla 25, Figura 47), probablemente como resultado de tener las menores riquezas y abundancias de todo el gradiente evaluado. Además ninguna especie estuvo representada por más de cinco individuos. No obstante, la representatividad fue mayor para los dos estimadores con la metodología de puntos de conteo. Figura 47. Curva de acumulación de especies observadas y estimadas: Chao 1 y Chao 2, E2 (3.420 m de altitud). A: Redes de niebla y B: Puntos de Conteo En la E2 se registraron 20 especies, ubicadas en 10 familias, de las cuales, Thraupidae y Trochilidae fueron las que presentaron el mayor número con seis especies respectivamente. Para el muestreo en esta estación, las especies más abundantes fueron: Grallaria rufula (6), Anisognathus lacrymosus y Myioborus ornatus (5). En cuanto a las especies consideradas raras por el número de registros se destacan: Gallinago nobilis, Chalcostigma herrani y Heliangelus exortis (Figura 46). Las especies exclusivas de esta elevación fueron Gallinago nobilis y Urothraupis stolzmanni. Estación tres –E3 (3320 m.s.n.m) Las curvas de acumulación para el muestreo en esta estación con el método de redes de niebla, arrojaron una representatividad baja. Estos valores reflejan la dificultad de capturar aves en el sotobosque, principalmente cuando la cobertura vegetal es compleja en su estructura vertical, ya que la gran mayoría de la actividad de los organismos se concentra en el dosel. Lo anterior contrasta con la alta representatividad en los puntos de conteo (Tabla 25, Figura 48), donde la detección de las aves de forma directa e indirecta aumenta el número de registros. 99 Figura 48. Curva de acumulación de especies observadas y estimadas: Chao 1 y Chao 2, E3 (3320m). A: Redes de niebla y B: Puntos de Conteo En esta zona se registraron 20 especies pertenecientes a 10 familias, donde Trochilidae contó con ocho especies y Tyrannidae con tres. Entre las especies abundantes por presentar más de cinco registros se encuentran: Eriocnemis mosquera (11), Mecocerculus leucophrys (9), Myioborus ornatus (7), y Metallura tyrianthina (6). Con uno o dos registros se encontraron especies como: Eriocnemis derbyi y Pipreola arcuata (Figura 46). Las detecciones exclusivas de esta estación fueron Acropternis orthonyx y Pseudotriccus ruficeps. Estación cuatro – E4 (3220 m.s.n.m) Las curvas de acumulación para el muestreo en esta estación, para ambos métodos, presentaron una representatividad baja en ambos indicadores (Tabla 25, Figura 49). Sin embargo, el patrón no es muy diferente del observado en las estaciones precedentes. Las redes permiten predecir una fracción de la riqueza predicha por los puntos de conteo. 100 Figura 49. Curva de acumulación de especies observadas y estimadas: Chao 1 y Chao 2, E4 (3.220m). A: Redes de niebla y B: Puntos de Conteo En la E4 el total de especies registradas fue de 31, pertenecientes a 15 familias, entre las cuales, las que presentaron el mayor número de especies fueron Trochilidae con siete y Thraupidae con cuatro. Entre las especies abundantes se encuentran: Mecocerculus leucophrys y Metallura williami (12), Myioborus ornatus (11) y Anisognathus igniventris (8). Entre las especies con menos registros se encontraron: Diglossa lafresnayii y Grallaria squamigera (Figura 46). En esta elevación el número de taxones registrado exclusivamente lo conforman especies de muy diversos hábitos, como: Glaucidium jardinii, Lafresnaya lafresnayi, Hellmayrea gularis, Grallaria ruficapilla, Grallaria squamigera, Ochthoeca frontalis, Pyrrhomyias cinnamomeus, Pipreola riefferii, Troglodytes solstitialis y Anisognathus somptuosus. Estación cinco - E5 (3120 m.s.n.m) Las curvas de acumulación de especies en ambos métodos de muestreo, predicen una riqueza elevada en contraste con las estaciones anteriores, sin embargo, los valores de los estimadores son relativamente bajos (Tabla 25, Figura 50). Aunque el método de redes de niebla sugiere riquezas estimadas cercanas a las 25 especies, lo más relevante en este caso fue la tendencia asintótica que presentó la curva de ambos estimadores, diferente a las otras elevaciones. Caso opuesto se dio en los puntos de conteo puesto que los estimadores presentan una tendencia a seguir aumentando, aunque la riqueza de esta estación fue casi similar a la E4, la representatividad fue menor en este gradiente analizado. 101 Figura 50. Curva de acumulación de especies observadas y estimadas: Chao 1 y Chao 2, E5, transecto de Sevilla (3120 m.s.n.m). A: Redes de niebla y B: Puntos de Conteo. En esta estación se registraron 30 especies, pertenecientes a 13 familias, Trochilidae y Thraupidae, con siete respectivamente, fueron las familias que presentaron mayor número de especies. Las especies abundantes fueron: M. leucophrys y T. fuscater (21), O. icterotis (17), A. igniventris (16) Buthraupis montana (15). Entre las especies con pocos registros se destacan H. fuertesi, A. hypoglauca, C. coruscans y Scytalopus spillmanni (Figura 46). El conjunto de taxones exclusivos lo conforman: Zentrygon linearis, O. icterotis, Aglaeactis cupripennis, Colibri coruscans, Mecocerculus poecilocercus, Ochthoeca cinnamomeiventris, B. montana, Diglossa cyanea, Hemispingus superciliaris, Atlapetes schistaceus e Icterus chrysater. De acuerdo a lo encontrado en el gradiente altitudinal, se resalta la presencia de cuatro especies con alguna categoría de amenaza, se hace énfasis en el registro del Loro Orejiamarillo (O. icterotis), ave con distribución restringida a los Andes colombianos y norte de Ecuador, en elevaciones similares a las ocupadas en este estudio. Los registros de poblaciones cercanas a la zona de trabajo son del mismo complejo de páramos Chilí-Barragán, en Roncesvalles, Tolima. Esta especie fue registrada en la E5, allí se observó un grupo de 15 individuos utilizando únicamente parches de bosque sin atravesar áreas de potreros. Esta observación, corrobora la baja tolerancia de la especie a la transformación del paisaje, ya que el deterioro de los lugares de anidación y de forrajeo, son una de las principales causas del declive poblacional de estos organismos (Snyder et al. 2002). Con respecto a la representatividad de los muestreos, la diferencia de los valores arrojados en las curvas de acumulación entre los dos métodos, se debe principalmente a la baja proporción de captura de las redes con respecto a los puntos de conteo. Las redes de niebla son una técnica complementaria que permite registrar especies raras y poco conspicuas por movilizarse entre el estrato rasante y sotobosque; contrario a los punto fijos, que permiten visualizar individuos de especies conspicuas y abundantes que forrajean principalmente en el dosel y 102 muchas veces formando bandadas mixtas, que aseguran un mayor registro. Sin embargo, con las redes de niebla se logró obtener datos importantes que contribuyeron a robustecer el muestreo en esta área, además de aportar los datos de rasgos funcionales que se sistematizaron en la Plataforma Institucional de Datos (I2D), para posteriores anális por parte del laboratorio diversidad funcional del IAvH. De acuerdo a la riqueza encontrada en cada una de las estaciones, las ubicadas en gradientes más bajos (E3, E4 y E5) presentaron mayor número de especies, esto se puede deber a la complejidad en su estructura vegetal generando mayor oferta de hábitats para las aves, siendo esto un atributo típico de bosque. 4.4.1.2 Diversidad alfa Según el índice de Shannon (H´), la E4 presentó el mayor valor de este índice, con la E5 fueron las elevaciones donde se presentó la mayor riqueza, esto supone junto con la abundancia una proporción equitativa de las especies comparado con la E1, donde se presentó una mínima diferencia con la E4, y estuvo por encima de las E2 y E3 (Tabla 26). En E2, E3 y E4 las especies más comunes presentaron registros por debajo de 15 individuos, mientras que en E1 y E5 presentaron por encima de 20, en el caso de la estación uno se evidenció una dominancia de dos especies comunes en pajonales y arbustales (C. platensis y P. unicolor). De acuerdo a la prueba t, se presentaron diferencias significativas entre la diversidad (H´) encontrada en E1 y el resto de las estaciones en el transecto altitudinal (P-valor <0,05) (Tabla 27); esto es un factor que explica la tendencia de los índices encontrados, siendo la diversidad en la estación uno la más baja y con mayor dominancia de especies (1-D) con relación a la riqueza encontrada. Estos resultados explican la heterogeneidad de las áreas boscosas, complejas en su estructura tanto horizontal como vertical (MacArthur 1961, Nocedal 1984), encontradas a partir de la E2 hasta la E5, ya que estas coberturas generan una mayor disponibilidad de hábitats y nichos ecológicos para las aves. Tabla 26. Diversidad alfa para las cinco estaciones en el transecto altitudinal de Sevilla Estaciones Riqueza E1 (3520) E2 (3420) E3 (3320) E4 (3220) E5 (3120) 17 20 20 31 30 Abundancia 88 60 71 93 150 Diversidad(H´) 2,34 2,876 2,741 3,013 2,823 Dominancia(1-D) 0,8616 0,9383 0,9208 0,931 0,9168 103 Tabla 27. Tabla de doble entrada para la prueba t (student) y P valor para los índices de diversidad de Shannon-Wiener. E1 (3520) E1 (3520) E2 (3420) E3 (3320) E4 (3220) E5 (3120) -3,53 -2,53 -4,06 -3,52 0,91 -1,04 -0,08 -1,77 -0,96 E2 (3420) 0,0005 E3 (3320) 0,0121 0,3628 E4 (3220) 7,19E-05 0,3000 0,0779 E5 (3120) 0,0005 0,9347 0,3367 0,94 0,3461 4.4.1.3 Diversidad Beta En el Índice de Jaccard se evidencian dos grupos de acuerdo a la similitud de especies encontradas entre estaciones; siendo las E1 y E2 las que presentaron la mayor similitud (42%), el otro grupo que se evidencia está conformado por E3, E4 y E5, en este grupo se presentaron porcentajes de similitud bajos, donde E4 y E5 fueron similares en un 35% (Figura 51 A). En el Índice de Sorensen, se presentó el mismo patrón anterior, aunque con similitudes un tanto mayores, con dos grupos: uno conformado por E3, E4 y E5, con 49% de similitud, y otro por E1 y E2, con 60%. Por el contrario, se evidenció una baja similitud entre E1 y E5 con 13% (Figura 51 B). Para el Índice Bray-Curtis basado en abundancia, la diversidad beta mostró una tendencia algo distinta de los análisis anteriores; E3 y E4 presentaron, 41% de similitud, por el contrario la similitud más baja se presentó entre E1 y E2 (Figura 52). Índice de Whittaker En este análisis se muestra un recambio de especies en las estaciones muestreadas. E5 contrastada con E1, tienen una mayor disimilitud (Tabla 28), así mismo, se evidencia cómo la similitud en la composición cambia conforme aumenta la distancia entre las comunidades de aves. Este patrón muestra que la similitud disminuye y el recambio de especies aumenta con la distancia (Calderón et al. 2012, Anderson et al. 2011). De acuerdo con el análisis de diversidad beta, se evidencia una mayor similitud entre las estaciones más próximas, por ejemplo, E1 y E2 compartieron cuatro especies: C. herrani, C. platensis, D. humeralis y S. spinescens; mientras que E4 y E5 compartieron cinco especies: Grallaria nuchalis, Hapalopsittacca fuertesi, Scytalopus spillmanni, Synallaxis azarae y Zonotrichia capensis. 104 Figura 51. Agrupamiento con base en la composición de la avifauna del transecto de Sevilla. A: índice de Jaccard y B: Sorensen Figura 52. Índice de Bray- Curtis: Agrupamiento con base en la composición y abundancia de la avifauna del transecto altitudinal de Sevilla 105 Tabla 28. Análisis de disimilitud de Whittaker para las estaciones del transecto altitudinal de Sevilla. Estaciones y elevaciones E1 (3.520) E1 (3.520) E2 (3.420) E3 (3.320) E2 (3.420) E3 (3.320) E4 (3.220) E5 (3.120) E4 (3.220) 0,40541 0,72973 0,83333 0 0,5 0,64706 0 0,4902 0 0,87234 0,64 0,56 0,47541 E5 (3.120) 0 0 Lo anterior indica, que debido a la composición y estructura del ensamblaje de aves en las diferentes estaciones, se evidencia un recambio de especies a medida que se asciende en el gradiente altitudinal, de esta manera no es claro marcar una línea o gradiente donde se establece un recambio, pero es claro que en las estaciones más altas (E1 y E2) se registraron especies comunes de áreas abiertas donde existen dominancia de matorrales, frailejonales, chuscales y pajonales; esto indica que la composición y estructura de aves en la alta montaña está relacionada con la estructura vegetal encontrada. Una de las razones para este patrón, pueden ser las condiciones ambientales, que cambian conforme aumenta la distancia entre estaciones altitudinales; hay una disminución de la similitud ambiental con la distancia, lo que implica que exista una separación de las especies con diferentes características fisiológicas. Otro factor que puede influenciar, está relacionado con la configuración del ambiente y el tiempo, ya que puede influir en el movimiento de las especies (Calderón et al. 2012). A mayor número de barreras, la similitud decrece más abruptamente que en un sitio topográficamente abierto y homogéneo (Nekola & White 1999, Soininen et al. 2007). 4.4.2 Gremios Tróficos Los gremios tróficos fueron asignados con base en Renjifo (1999) con modificaciones, de acuerdo a la dieta de cada especie (Tabla 29). En las tres primeras estaciones (E1, E2 y E3), predominaron los nectarívoros-insectívoros (NI), y en las estaciones más bajas (E4 y E5) predominaron los insectívoros. Se obtuvo un registro de una rapaz diurna (G. jardinii) en la estación cuatro (E4) (Figura 53). 106 Tabla 29. Gremios tróficos de Aves transecto de Sevilla. Tipo de alimentación Rapaz diurna Frutos Frutos e insectos Frutos, insectos y néctar Néctar e insectos Insectos Semillas Abreviación R/D FR FR-I FR-I-N NI I SE La disponibilidad de recursos alimenticios es uno de los factores determinantes en la dinámica y estructuración de las comunidades de aves (Nocedal 1984, Wolda 1990). Su composición en función de los gremios alimenticios, está estrechamente relacionada con la estructura de la vegetación (Laurance & Bierregaard 1997). Los hábitats con una estructura vegetal compleja y formada por varios estratos de cobertura, presentan principalmente especies de hábitos insectívoros, frugívoros y nectarívoros (Rappole et al. 1993). De acuerdo con lo anterior, en todo el transecto altitudinal fueron representativos estos tres gremios, siendo más abundantes en las estaciones bajas (E3, E4 y E5). Se destacan las aves nectarívoras de la familia Trochilidae, ya que fueron abundantes en todo el transecto altitudinal, esto se debe a la existencia de especies de plantas de la familia Ericaceae, Rubiaceae, Melastomataceae, entre otras, que ofrecen alimento de forma constante durante los periodos de floración. La etapa de floración de las plantas y el tiempo seco, permitió que se presentara una mayor abundancia de insectos, favoreciendo que aves de este gremio fueran abundantes en todas las estaciones. 107 12 E1 (3.520) E2 (3.420) E3 (3.320) E4 (3.220) E5 (3.120) N° especies 10 8 6 4 2 0 FRU NI I FR-I FR-I-N SE RD Gremios Figura 53. Número de especies de acuerdo a los gremios tróficos en cada una de las estaciones en el transecto altitudinal de Sevilla. 4.4.3 Conclusiones Se registraron tres especies con alguna categoría de amenaza de fuertesi (CR), Ognorhynchus icterotis (EN) y A. hypoglauca especies han sido reportadas en otras localidades del complejo Chilí-Barragán, donde se realizó el presente estudio, y en colindante hacia el norte (Los Nevados). Se resalta el registro de dos especies endémicas, H. fuertesi y B. ferrugineifrons; y diez especies casi-endémicas. extinción: H. (VU). Estas de páramos el complejo De acuerdo con los índices de diversidad, la estación E4 presentó los valores más altos con relación a las estaciones de elevaciones mayores. La importancia de la cobertura vegetal en la dinámica y establecimiento de las poblaciones de aves, en estos gradientes donde la complejidad vertical de la vegetación promueve una mayor cantidad de nichos. Se encontró un recambio de especies a medida que se desciende en el gradiente altitudinal, cuando la cobertura vegetal cambió (3420 y 3320 m.s.n.m). 108 4.5 CONSIDERACIONES FINALES TRANSECTO MUNICIPIO DE SEVILLA Los análisis de agrupamiento permitieron establecer que la flora del gradiente evaluado presenta un primer grupo compuesto por las estaciones más elevadas. Sin embargo la unión con las demás estaciones se presenta a niveles muy bajos de similitud, sugiriendo que las biotas entre 3440 y 3360 m son muy diferentes entre ellas, algo que también apoya el análisis de complementariedad. Es igualmente interesante que las topologías de los tres dendrogramas cambian no sólo en los niveles de relacionamiento entre las cuatro elevaciones restantes sino que dichas relaciones parecieran relevar la proximidad entre pares de estaciones, excepto en el caso del análisis de los datos de abundancia. En el caso de la edafofauna, el patrón descrito anteriormente, acerca de la baja similitud entre las elevaciones mayores y el grupo de las bajas, parece conservarse. Lo más notable, es que la edafofauna parece responder al empobrecimiento de la biota y por tal razón 3520 m es una elevación que no comparte muchos elementos con su inmediata vecina. El grupo conformado por las demás elevaciones estudiadas por su parte, aparecen más estables en los dos modelos de análisis evaluados. Los anfibios por su parte, dejan entrever que aunque los relacionamientos son bajos, menos de 10%, hasta 25% dependiendo del modelo, las elevaciones superiores se relacionan más entre ellas que con las elevaciones más bajas. Mientras que las relaciones entre las estaciones de media altura, están sesgadas por la baja capturabilidad que se presentó en el grupo. Asimismo las estaciones más bajas permiten ver una similitud relativamente alta, aunque probablemente este patrón está influenciado por la baja riqueza encontrada en el grupo. Las aves describen el mismo patrón del bajo soporte numérico en la similutud de las estaciones más altas con respecto de las bajas. Pareciera que entre 3520 y 3420 m la cantidad de elementos compartidos es sustancialmente diferente de los que se encuentran más abajo en el gradiente. No obstante cada modelo de análisis permite ver un relacionamiento distinto entre las estaciones tres a cinco, sugiriendo que la baja riqueza y evidente dominancia de algunas especies tienen efecto sobre la topología de cada dendrograma. 109 110 5. RESULTADOS TRANSECTO FINCA LA CASCADA, VEREDA SANTA LUCÍA, MUNICIPIO DE TULUÁ, VALLE DEL CAUCA 5.1 VEGETACIÓN El área estudiada (transecto) en el municipio de Tuluá, se caracteriza por ser un derivado de la cordillera Central, que se ramifica del eje central; la divisoria de aguas o filo de esta estribación marca el límite entre los corregimientos de Barragán y Santa Lucía. El sector específico donde se realizaron los muestreos, se conoce localmente como páramos o picos del Japón, que corresponde a un macizo montañoso con topografía abrupta, angosta en la parte superior y pendiente con afloramientos rocosos en las laderas (Figura 54). A B Figura 54. Panorámicas páramo del Japón. A) Al fondo, páramo del Japón desde el eje principal de la cordillera Central, B) Páramo de Barragán y Santa Lucía, al fondo picos del Japón. 5.1.1 Descripción de las estaciones 5.1.1.1 Estación uno – E1 (3500 m.s.n.m) La estación uno del transecto se ubicó en la parte superior de los páramos del Japón, donde se presentan coberturas vegetales de porte bajo y abiertas como pajonales-frailejonales, dominados por Poaceae (Calamagrostis sp., Cortaderia sp., Rhynchospora cf. caucana), frailejones (Espeletia hartwegiana). Estas coberturas se asocian con Hypericum laricifolium, especie que predomina en esta cota en arbustales bajos y pajonales-frailejonales (Figura 55) y (Anexo 7). 111 Figura 55. Pajonales-frailejonales y arbustales en la E1 (3500 m.s.n.m). Tuluá (Valle del Cauca). Se encuentran también coberturas de porte bajo a medio y semiabiertas a cerradas como arbustales, los cuales son el tipo de cobertura más común en esta estación. Predominan Hypericum laricifolium, Diplostephium spp., Pentacalia spp., Hesperomeles ferruginea y Escallonia myrtilloides. Se encuentran además chuscales (Chusquea tessellata) densos y bosques achaparrados con dosel discontinuo de hasta 13-15 m de altura, donde dominan especies como, Weinmannia mariquitae, Miconia salicifolia, Brachyotum lindenii, Hedyosmum cumbalense, Hesperomeles ferruginea, tapizados con musgos y briófitos sobre el suelo. En la estación uno existen algunos árboles emergentes de hasta 18 m. Los matorrales y bosques achaparrados se presentan en algunos sitios como coberturas dominantes y continuas, y se ubican principalmente en laderas pronunciadas, áreas rocosas, zonas resguardadas, y riberas de quebradas (Figura 56 A). En la zona de influencia de esta estación, existe una antena de telecomunicaciones, una vivienda abandonada, vestigios de antiguos campamentos de la fuerza pública y una carretera, lo que indica que posiblemente la intervención por actividades antrópicas en la zona fue alta (Figura 56 B). Actualmente este sector se encuentra en procesos de regeneración natural. 112 A B Figura 56. Área de influencia E1 (3500 m.s.n.m), A. Bosques achaparrados y arbolitos emergentes; B. Casa abandonada y carretera en desuso. Tuluá (Valle del Cauca) Estratificación y perfiles de las parcelas estación uno Las tres parcelas evaluadas presentaron una pendiente de 0-15%, principalmente con plantas entre <0,1 y 2,5 m, que conforman tres estratos vegetales, que se decriben a continuación: - Rasante (<0,3 m): dominado por Disterigma empetrifolium, Sisyrinchium cf. trinerve, Lycopodium jussiaei, Valeriana microphylla y Lupinus cf. microphyllus. - Herbáceo (0,3-1,5 m): dominado por pastos (Calamagrostis sp.), Cortaderia sp., Rhynchospora cf. caucana, Senecio formosus, Acaena elongata, Valeriana microphylla, Puya hamata y helechos (Jamesonia alstonii). - Arbustivo (1,5-5 m): dominado por Espeletia hartwegiana, Hypericum laricifolium, Diplostephium cf. pittieri, Pentacalia spp., Ageratina tinifolia, Brachyotum lindenii, Hesperomeles ferruginea, H. Obtusifolia (Figura 57). 113 Figura 57. Perfil de vegetación arbustiva en la estación uno, parcela dos a 3500 m.s.n.m 1. Espeletia hartwegiana, 2. Cortaderia sp., 3. Achiachne aff. pulvinata, 4. Puya hamata, 5. Hesperomeles ferruginea, 6. Valeriana microphylla, 7. Cyrtochilum cf. annulare, 8. Espeletia hartwegiana subs. centroandina, 9. Gomphichis cf. caucana, 10. Achiachne aff. pulvinata, 11. Sisyrinchium cf. trinerve, 12. Lupinus cf. microphyllus, 13. Espeletia hartwegiana subs. centroandina, 14. Hypericum laricifolium, 15. Lycopodium jussiaei, 16. Hypericum laricifolium, 17. Pernettya prostrata, 18. Gaultheria sclerophylla, 19. Espeletia hartwegiana subs. centroandina, 20. Cortaderia sp., 21. Pentacalia vaccinioides, 22. Jamesonia alstonii, 23. Calamagrostis sp., 24. Valeriana microphylla, 25. Rynchospora cf. caucana, 26. Calamagrostis sp. Eje x, longitud del transecto (m); eje y, altura de la vegetación (m). Ilustración Yoao Palchukan (2014). 114 5.1.1.2 Estación dos – E2 (3420 m.s.n.m) En la estación dos se hallan coberturas de porte medio y alto, cerradas, conformadas por bosques maduros, secundarios y matorrales semidensos y densos, en estados sucesionales intermedios a avanzados, entremezclados en una franja más o menos continua con dosel de hasta 13-20 m de altura. Se presenta una cobertura densa de musgos y briófitos sobre el suelo y un alto epifitismo en troncos de árboles y arbustos. Las especies dominantes son Weinmannia mariquitae, Brunellia goudotii, Miconia spp., Geissanthus bogotensis, Maytenus myricoides y Clethra revoluta (Figura 58 y Anexo 7). Estas coberturas se encuentran moderadamente intervenidas, la topografía es ondulada a quebrada, con pendientes medias. Estratificación y perfiles de las parcelas estación dos Las tres parcelas evaluadas presentaron una pendiente media de 5-50%, con plantas entre 1,4 y 19 m de altura, correspondientes a los siguientes estratos vegetales: Rasante (<0,3 m): dominado por musgos (Sphagnum spp.), selaginelas (Selaginella sp.), licopodios (Lycopodium spp., Huperzia spp.), Sisyrinchium cf. trinerve, helechos (Elaphoglossum spp.) y Nertera granadensis. Herbáceo (0,3-1,5 m): dominado por Neurolepis sp., Rhynchospora cf. caucana, Cortaderia sp., Greigia vulcanica, Rubus gachetensis y Ribes leptostachyum. Arbustivo (1,5-5 m): dominado por Cestrum sp., Palicourea cf. ovalis, Palicourea cf. andaluciana, Chusquea sp., Desfontainia spinosa y Miconia sp., M. polyneura. Arbolitos (5-12 m): dominado por Weinmannia mariquitae, Miconia sp., M. polyneura, Oreopanax cf. floribundum, O. tolimanum, Geissanthus bogotensis. Se presenta alto epifitismo de briófitas (Sphagnum sp.), bromelias (Tillandsia stipitata, T. compacta), orquídeas (Stelis spp., Pleurothallis sp., Epidendrum sp.). Arbóreo (12-25 m): dominado por Weinmannia mariquitae, Maytenus myricoides, Clethra revoluta, Brunellia goudotii y Geissanthus bogotensis. Se presenta alto epifitismo de briófitas (Sphagnum sp.), líquenes, bromelias 115 (Tillandsia stipitata, T. compacta) y algunas orquídeas como Stelis spp., Pleurothalis sp., Epidendrum sp. (Figura 59 y Anexo 7). Figura 58. Formaciones boscosas, área de influencia E2 (3420 m.s.n.m). Tuluá (Valle del Cauca). 116 Figura 59. Perfil de vegetación arbustiva en la estación dos, parcela tres a 3420 m.s.n.m 1. Oreopanax tolimanum, 2. Miconia sp. 1, 3. Aegiphila bogotensis, 4-5. Maytenus myricoides, 6. Gynoxys cf. littlei, 7. Hedyosmum cf. goudotianum var. goudotianum, 8. Palicourea cf. andaluciana, 9. Miconia chlorocarpa, 10. Cestrum sp. 1, 11. Clethra revoluta, 12. Weinmannia mariquitae, 13. Geissanthus bogotensis, 14. Berberis verticillata, 15. Miconia sp. 1. Eje x, longitud del transecto (m); eje y, altura de la vegetación (m). Ilustración Yoao Palchukan (2014). 117 5.1.1.3 Estación tres – E3 (3340 m.s.n.m) En la estación tres se encontraron coberturas de porte medio y alto, cerradas, conformadas por bosques maduros, secundarios y algunos arbustales densos y semiabiertos, en estados sucesionales intermedios a avanzados, que entremezclados forman una franja moderadamente continua, con dosel de hasta 13-17 m de alto. Se presenta una cobertura densa de musgos y líquenes que tapizan el suelo y un alto epifitismo en troncos de árboles y arbustos en el sotobosque. Las especies dominantes son Weinmannia mariquitae, Ocotea infrafoveolata, Hedyosmum cf. goudotianum, Oreopanax floribundum, O. discolor, Saurauia ursina, Brunellia goudotii, Miconia polyneura, Miconia. sp., Geissanthus andinus, G. bogotensis, Meliosma sp. y Clethra revoluta (Figura 60 A y B). Estas coberturas se encuentran moderadamente intervenidas y parcialmente fragmentadas, la topografía del terreno es levemente ondulada a quebrada, con pendientes medias a altas. En la E3, se encuentran también arbustales de porte medio-bajo y semiabiertos, con presencia de herbazales altos y rastrojos, posiblemente generados a través de procesos de paramización. Estas zonas se encontraron principalmente cerca de fuentes hídricas, donde probablemente se abrieron claros en el pasado para ganadería o cultivos. Allí predominan Rhynchospora cf. caucana, Carex sp., Cortaderia sp., Diplostephium cf. pittieri, Pentacalia cf. trichopus, Gynoxys cf. littlei, Hypericum laricifolium, Escallonia myrtilloides, Gaultheria sp., Plutarchia monantha, Pernettya postrata, Brachyotum ledifolium, Freziera longipes, Myrsine dependens, Hesperomeles ferruginea, H. obtusifolia, Miconia chlorocarpa, Berberis verticillata, Saracha quitensis. Estos arbustales-herbazales se presentan como coberturas azonales o no dominantes en esta cota. La topografía del terreno es quebrada, con pendientes medias a altas (Figura 60 C y D). Estratificación y perfiles de las parcelas estación tres Las tres parcelas evaluadas presentaron una pendiente de 5-80%, con plantas entre 0,9 y 18 m de altura, correspondientes a los siguientes estratos vegetales: Rasante (<0,3 m): dominado por musgos (Sphagnum sp.), helechos Elaphoglossum sp., Sisyrinchium cf. trinerve. Herbáceo (0,3-1,5 m): dominado por Rhynchospora cf. caucana, Carex sp., Cortaderia sp., Greigia vulcanica y helechos (Blechnum sp.). 118 Arbustivo (1,5-5 m): dominado por chusques (Chusquea sp.), Palicourea cf. andaluciana, Gaultheria sp., Plutarchia monantha, Pernettya postrata, Tibouchina grossa, Cavendishia cf. nitida, Miconia sp., Diplostephium cf. pittieri, Pentacalia cf. trichopus, Gynoxys cf. littlei, Hypericum laricifolium y Escallonia myrtilloides. Arbolitos (5-12 m): dominado por Palicourea cf. andaluciana, Weinmannia mariquitae, Ocotea infraveolata, Oreopanax discolor, O. tolimanum y Geissanthus andinus, G. bogotensis. En el sotobosque se presenta alto epifitismo de briófitas (Sphagnum sp.), bromelias (Tillandsia stipitata, T. compacta) y orquídeas (Stelis spp., Pleurothallis sp., Epidendrum sp.). Arbóreo inferior (12-25 m): dominado por Weinmannia mariquitae, Ocotea infrafoveolata, Vallea stipularis, Brunellia goudotii, Saurauia ursina, Maytenus myricoides y Geissanthus andinus (Figura 61). 119 Figura 60. Área de influencia E3, (3.340 m.s.n.m), Tuluá. A y B) Interior de formaciones boscosas; C y D) Claros paramizados, en el área de influencia estación tres (de altitud). 120 Figura 61. Perfil de vegetación arbustiva en la estación tres, parcela uno a 3340 m.s.n.m 1. Brunellia goudotii, 2. Ocotea infrafoveolata, 3. Palicourea cf. andaluciana, 4. Brunellia goudotii, 5. Weinmannia mariquitae, 6. Miconia sp. 1, 7. Brunellia goudotii, 8. cf. Symplocos sp., 9. Clethra revoluta, 10. Miconia sp. 1, 11. Palicourea cf. andaluciana, 12. Geissanthus bogotensis, 13. Cavendishia cf. nitida, 14. Brunellia goudotii, 15. Myrsine dependens, 16. Tibouchina grossa, 17. Gynoxys cf. littlei, 18. Vallea stipularis. Eje x, longitud del transecto (m); eje y, altura de la vegetación (m). Ilustración Yoao Palchukan (2014). 121 5.1.1.4 Estación cuatro – E4 (3260 m.s.n.m) En la estación cuatro se encontraron coberturas de porte medio y alto, cerradas, conformadas por bosques maduros y secundarios, en estados sucesionales intermedios a avanzados, que entremezclados forman una franja más o menos continua con dosel de hasta 13-20 m de altura. Se presenta un epifitismo moderado a alto en troncos y ramas de árboles. Las especies dominantes son Weinmannia mariquitae, Ocotea infrafoveolata, Myrcianthes cf. orthostemon, Hedyosmum cf. goudotianum, Saurauia ursina, Brunellia goudotii, Geissanthus bogotensis, Myrcianthes cf. orthostemon, Gordonia humboldtii, Miconia polyneura y Clethra revoluta (Figura 62). Estas coberturas se encuentran moderadamente intervenidas, la topografía del terreno es levemente ondulada a escarpada, con pendientes medias a altas. Estratificación y perfiles de las parcelas estación cuatro Las tres parcelas evaluadas presentaron una pendiente de 5-50%, con plantas entre 1,7 y 20 m de altura, correspondientes a los siguientes estratos vegetales: Rasante (<0,3 m): Dominado por musgos (Sphagnum sp.), licopodios (Lycopodium jussiaei, Huperzia sp.), selaginelas (Selaginella sp.), helechos (Blechnum sp.), Oxalis cf. subintegra. Herbáceo (0,3-1,5 m): Dominado por Rhynchospora cf. caucana, Carex sp., Gunnera sp., Palicourea cf. andaluciana. Arbustivo (1,5-5 m): Dominado por Hedyosmum cf. goudotianum var. goudotianum, Piper sp., Chusquea sp., Monnina angustata, Cestrum sp., Gordonia humboldtii. Arbolitos (5-12 m): Dominado por Ocotea infrafoveolata, Myrcianthes cf. orthostemon, Hedyosmum cf. goudotianum var. goudotianum, Geissanthus bogotensis, Palicourea cf. ovalis, Palicourea cf. andaluciana y Miconia polyneura. Se presenta un moderado a alto epifitismo de briófitas (Sphagnum sp.), helechos (Elaphoglossum sp.) y bromelias (Tillandsia stipitata, T. compacta). Arbóreo inferior (12-25 m): Dominado por Weinmannia mariquitae, Ocotea infrafoveolata, Clethra revoluta, Myrcianthes cf. orthostemon, Gordonia humboldtii, Brunellia goudotii y Geissanthus bogotensis (Figura 63). 122 Figura 62. Formaciones boscosas E4 (3260 m.s.n.m). Tuluá (Valle del Cauca). 123 Figura 63. Diagrama de perfil de vegetación en la estación cuatro, parcela dos a 3260 m.s.n.m 1. Hedyosmum cf. goudotianum, 2. Monnina angustata, 3. Oreopanax discolor, 4. Weinmannia mariquitae, 5. Hedyosmum cf. goudotianum, 6. Gordonia humboldtii, 7. Hedyosmum cf. goudotianum, 8. Miconia polyneura, 9. Hedyosmum cf. goudotianum, 10. Clethra revoluta, 11. Hedyosmum cf. goudotianum, 12. Gynoxys cf. littlei, 13. Miconia polyneura, 14. Clethra revoluta, 15. Hedyosmum cf. goudotianum var. goudotianum. Eje x, longitud del transecto (m); eje y, altura de la vegetación (m). Ilustración Yoao Palchukan (2014). 124 5.1.1.5 Estación cinco – E5 (3180 m.s.n.m) En la estación cinco se encontraron coberturas cerradas, de porte medio y alto, conformadas por bosques maduros y secundarios, en estados sucesionales intermedios a avanzados, que entremezclados forman una franja moderadamente continua, con dosel de hasta 17-22 m de altura. En esta cota, los bosques empiezan a fragmentarse y a estar rodeados por potreros, rastrojos o regeneraciones tempranas, dada la cercanía a las áreas productivas de las fincas. Se encuentran regeneraciones naturales de Freziera spp. hacia la zona inferior de esta franja, siendo un grupo de especies pioneras importante y común en esta cota. Los bosques están ubicados principalmente en áreas pendientes y encañoadas asociadas a las riberas de las quebradas. Al interior de las formaciones boscosas, se presenta un moderado a alto epifitismo en troncos de árboles. Las especies dominantes son W. mariquitae, W. pubescens, Ocotea infrafoveolata, Axinaea macrophylla, Drimys granadensis, Myrcianthes cf. orthostemon, Hedyosmum cf. goudotianum, Saurauia ursina, Cythea sp., Brunellia goudotii, Miconia spp., Geissanthus andinus, G. bogotensis, Vallea stipularis y Clethra revoluta (Figura 64). Estratificación y perfiles de las parcelas estación cinco Las tres parcelas evaluadas presentaron una pendiente media mayor de 40%, con plantas entre 2 y 22 m de altura, correspondientes a los siguientes estratos vegetales: Rasante (<0,3 m): dominado por musgos (Sphagnum sp.), licopodios (Lycopodium jussiaei, Huperzia sp.), selaginelas (Selaginella sp.), helechos (Blechnum sp.) y Pilea sp. Herbáceo (0,3-1,5 m): dominado por helechos (Blechnum sp.), Palicourea spp., Cavendishia cf. nitida. Arbustivo (1,5-5 m): dominado por Palicourea spp., Clethra revoluta, Cavendishia cf. nitida, Miconia sp. Arbolitos (5-12 m): dominado por Palicourea sp., Siparuna echinata, Weinmannia mariquitae, Clethra revoluta y Miconia polyneura, Miconia sp. Se presenta moderado a alto epifitismo de bromelias (Tillandsia stipitata, T. 125 compacta), orquídeas (Stelis spp., Oncidium sp, Epidendrum sp.) y anturios (Anthurium oxybelium). Estrato arbóreo inferior (12-25 m): dominado por Weinmannia mariquitae, W. pubescens, Hedyosmum cf. goudotianum var. goudotianum, Axinaea macrophylla, Clethra revoluta, Vallea stipularis, Meliosma sp., Ocotea infrafoveolata, Drimys granadensis, Brunellia goudotii y Geissanthus andinus, G. bogotensis, entre otras (Figura 65). Figura 64. Interior de formaciones boscosas, área de influencia E5 (3.180 m.s.n.m), Tuluá 126 Figura 65. Perfil de vegetación boscosa en la estación cinco, parcela tres a 3180 m.s.n.m 1. Myrcianthes cf. orthostemon, 2. Geissanthus andinus, 3. Drimys granadensis, 4 Axinaea macrophylla, 5. Melioma sp., 6. Hedyosmum cf. goudotianum var. goudotianum, 7. Weinmannia mariquitae, 8. Palicourea cf. ovalis, 9. Clethra revoluta, 10. Miconia sp. 1, 11. Vallea stipularis, 12. Ocotea infrafoveolata, 13. Hedyosmum cf. goudotianum var. goudotianum, 14. Oreopanax discolor. Eje x, longitud del transecto (m); eje y, altura de la vegetación (m). Ilustración Yoao Palchukan (2014). 127 5.1.2 Representatividad de los muestreos De acuerdo al estimador de riqueza de especies Boostrap, el muestreo fue significativo en las cinco estaciones con valores mayores al 70%, para el estimador de riqueza de especies Boostrap; en cuanto al estimador basado en la abundancia (Chao 1) las estaciones E1, E2, E4 y E5 fueron representativas con un 92%, 96%, 86% y 94% respectivamente, mientras que E3 alcanzó sólo el 65% (Figura 66). En la figura 66 se reúnen las curvas del estimador Chao 1 para las cinco estaciones, en las que se observa que sólo en la E3 no se alcanza la asíntota. 128 60 60 Observadas Observadas 50 Chao 1 50 Chao 1 Bootstrap Bootstrap 40 Riqueza Riqueza 40 30 30 20 20 10 10 B A 0 0 0 1 2 3 0 1 Unidades de muestreo 2 3 Unidades de muestreo 60 60 Observadas Observadas Chao 1 50 Chao 1 50 Bootstrap Bootstrap Riqueza Riqueza 40 40 30 30 20 20 10 C 10 0 1 2 D 0 3 0 1 Unidades de muestreo 2 3 Unidades de muestreo 60 60 Observadas E1 Chao 1 50 E2 50 Bootstrap E3 E4 E5 Riqueza Riqueza 40 30 40 30 20 20 10 E 0 0 1 2 F 10 0 3 1 2 3 Unidades de muestreo Unidades de muestreo Figura 66. Curva de acumulación de especies de la riqueza observada y la riqueza estimada por Bootstrap y Chao 1 en el transecto de Tuluá. A. E1 (3500 m.s.n.m), B. E2 (3420 m.sn.m), C. E3 (3340 m.s.n.m), D. E4 (3260 m.s.n.m), E. E5 (3180 m.s.n.m), F. Curvas con el estimador Chao 1 para cada estación. 129 5.1.3 Riqueza y composición florística. Las estaciones uno y tres, presentaron la mayor riqueza en el transecto altitudinal (E1-30 y E3-36 especies) y (E1-27 y E3-30 géneros) (Figura 67). En la estación tres, la riqueza puede estar relacionada con la existencia de diferentes coberturas vegetales como bosques maduros y secundarios en diferentes estados sucesionales, al igual que arbustales, producto de la apertura de claros. En la estación uno el alto número de especies vegetales puede estar relacionado con la gemorfología de la montaña donde se ubica el páramo del Japón, ya que es angosta en su parte superior y está rodeada de laderas que favorecen la existencia de diversas coberturas vegetales, como pajonalesfrailejonales, arbustales y formaciones boscosas de porte mediano, generando un paisaje complejo en cuanto a estructura y composición florística. En las estaciones cuatro y cinco ubicadas en formaciones boscosas se encontró el menor un número de especies (22 spp.) y géneros (E4-20 y E5-18), pero una mayor abundancia en la E4 (224), estas dos estaciones son áreas en las que dominan pocas especies como W. mariquitae, W. pubescens, Ocotea infrafoveolata, Axinaea macrophylla, Drimys granadensis, Myrcianthes cf. orthostemon, Hedyosmum cf. goudotianum y Saurauia ursina; además hay algunas áreas de regeneraciones naturales de Freziera spp. Igualmente, a partir de la E5 (3.180 m.s.n.m), la intervención y fragmentación influye en el número de especies existentes (Figuras 67 y 68). 50 Especies Géneros Familias 40 Abundacias 30 20 10 0 Estaciones Figura 67. Riqueza florística en el transecto de Tuluá (Valle del Cauca) 130 250 200 Abundacias 150 100 50 0 Estaciones Figura 68. Abundancia florística en el transecto de Tuluá (Valle del Cauca) Las familias que presentaron el mayor número de especies en el transecto altitudinal fueron: Asteraceae (E1) y Melastomataceae (E3) con siete especies cada una. Igualmente, Melastomataceae fue la familia con mayor número de especies en las estaciones dos y cinco con cuatro especies respectivamente. Rosaceae, tuvo cuatro especies en la estación uno y dos en la estación E2. La máxima representación de la familia Ericaceae fue de tres especies en las estaciones uno y tres (Figura 69). Familias como Asteraceae, Rosaceae, Ericaceae y Poaceae fueron representativas en coberturas paramunas de la estación uno, ya que presentaron más de tres especies, así también son exclusivas en el registro para la E1, a excepción de Rosaceae que también se registró en la estación E2. Los anteriores datos coinciden con estudios realizados por Devia et al. (2007) sobre el estado actual de los páramos Barragán - Santa Lucía en el municipio de Tuluá. 131 8 7 Riqueza 6 5 4 3 2 1 0 E1 (3500 m) E2 (3420 m) E3 (3340 m) E4 (3260 m) E5 (3180 m) Familias por Estaciones Figura 69. Familias florísticas con mayor número de especies en las estaciones del transecto altitudinal de Tuluá (Valle del Cauca). 5.1.3.1 Diversidad alfa () El índice de diversidad de Shannon-Wiener (H`), osciló entre 3,09 (E1) y 1,72 (E4) en las cinco estaciones estudiadas, los valores más bajos de diversidad se presentaron en las estaciones cuatro, dos y cinco respectivamente, lo cual conicide con áreas de formaciones boscosas. En las estaciones uno y tres la diversidad presentó los mayores valores, sin variaciones significativas (E1-3,09 y E3 3,05) (Tabla 30), lo anterior, posiblemente por su mayor número de especies (E1-30 y E3-36), las cuales, en su mayoría están representadas con pocos individuos. El mayor Índice inverso de Simpson (S), lo obtuvo la estación uno (0,95), el cual es acorde con los resultados del índice Shannon-Wiener, en esta estación se encontraron especies con poca dominancia; posteriormente estuvieron las estaciones tres,cinco, dos y cuatro respectivamente (Tabla 30). La menor diversidad de Simpson se evidencia en las estaciones dos y cuatro que también presentan el menor valor de diversidad de Shannon-Wiener y el menor valor de riqueza de especies (E2-24 y E4-22). Esto quiere decir que existen muchos organismos de la misma especie y pocas especies dentro de las parcelas, con respecto a las demás estaciones (Tabla 30). Complementario a los índices de diversidad, se realizó una prueba t, que evidencia que existen diferencias significativas entre la estación uno y las estaciones dos, cuatro y cinco (P< 0,05), mientras que con la estación tres, no hay 132 diferencias significativas (Tabla 31). Las estaciones uno y tres fueron las que presentaron mayor diversidad según los índices calculados (Tabla 30). Tabla 30. Índice de Dominancia de Simpson (S) e Índice de Diversidad de ShannonWiener (H`) para las estaciones estudiadas en el transecto de Tuluá Índices de Diversidad E1 E2 E3 E4 E5 Simpson (Inverso) 0,95 0,82 0,93 0,65 0,89 Shannon-Wiener (ln) 3,09 2,35 3,05 1,72 2,63 Tabla 31. Prueba de t Índice de Diversidad de Shannon-Wiener (H`) para las estaciones estudiadas en el transecto de Tuluá Estaciones E1 E1 (3500 m) E2 E3 5,9598 E4 E5 0,48249 11,402 4,1028 -5,3718 3,9336 -1,5877 10,499 3,5784 E2 (3420 m) 1,01E-08 E3 (3340 m) 6,30E-01 1,78E-07 E4 (3260 m) 1,06E-25 1,01E-04 E5 (3180 m) 6,75E-05 1,14E-01 0,00044955 7,90E-23 -5,6561 4,12E-08 5.1.3.2 Diversidad beta () En los índices de similitud de Sorensen y Jaccard se observa un grupo con las estaciones dos, tres, cuatro y cinco, con un 39% (Sorensen) (Figura 70 A) y 20% (Jaccard) de similitud (Figura 70 C); a su vez, este grupo cuenta con una mayor similaridad del 60% (Sorensen) y 39% (Jaccard) entre las estaciónes tres y dos. El índice de similitud de Bray-Curtis, sigue agrupando las estaciones tres y dos con el mayor índice de similitud (44%), además agrupa las estaciones cinco y cuatro, con una afinidad del 21%; por otro lado la estación uno siempre aparece como un grupo diferenciado de las demás estaciones, con un nivel de similitud de 36% para Sorensen, y 12% para Bray-Curtis y Jaccard (Figura 70 B). 133 Figura 70. Índices de similitud, A) Sorensen, B) Bray-Curtis y C) Jaccard. Transecto Tuluá (Valle del Cauca). Indice de Whittaker De acuerdo a este índice, la estación uno difiere claramente en más del 85% de las demás estaciones, en particular con la estación cinco, con un porcentaje del 100%; al igual que las estaciones dos y tres que se diferencian de la estación cinco, en un 65% y 62% (Tabla 32); estas diferencias son considerables dada la composición de especies de estos sitios, ya que a medida que aumenta la distancia entre estas comunidades disminuye la similitud. Sin embargo, la estación dos tan solo tiene un 40% y 48% de disimilitud, respecto a las estaciones tres y cuatro confirmando los resultados obtenidos de los análisis anteriores. Es de notarse que hay un decaimiento de la similitud con la distancia y el recambio de especies significativo (96%) de la estación uno, respecto a la estación dos. 134 Tabla 32. Índice de Whittaker para el transecto altitudinal de Tuluá (Valle del Cauca). E1 3500 m E2 3420 m E3 3340 m E4 3260 m E5 3180 m E1 E2 E3 E4 E5 0 0,96 0,85 0,96 1,00 0 0,40 0,48 0,65 0 0,52 0,62 0 0,55 0 5.1.4 Estratos de la vegetación La distribución de individuos basada en la caracterización de la distribución vertical de la vegetación, evidencia que las hierbas y rasantes son los estratos de vegetación predominantes en la estación uno ubicada a mayor altitud del transecto altitudinal (3500 m.s.n.m). Los arbustos tienen mayor representatividad en las cuatro estaciones más bajas (3420 a 3180 m.s.n.m) con porcentajes que superan 37%, dominando especialmente en las estaciones dos y tres (3420 y 3340 m.s.n.m) con un 49% y 64% respectivamente. Los arbolitos predominaron notablemente en la estación cuatro con un 58%. La representación arbórea (>12 m de altura), se hace evidente a partir de la estación dos, con un porcentaje del 10%, incrementando en la estación cinco a 21% (Figura 71). 70 Arbóreo Porcentaje de individuos 60 Arbolitos 50 40 Arbustivo 30 Herbáceo 20 Rasante 10 0 Estaciones Figura 71. Distribución de individuos según las formas de crecimiento por estación en el transecto de Tuluá (Valle del Cauca). 135 5.1.5 Índice de Valor de Importancia (IVI) La densidad relativa en la E1 se mantiene con un promedio de 8%, para la E2 es variable, el mayor número de individuos lo presentaron Miconia sp.1 (55) y Palicourea cf. andaluciana (23), especies que se encontraron con grandes poblaciones en esta estación; en la E3, la densidad varía poco, sólo P. cf. andaluciana y Diplostephium cf. pittieri, forman poblaciones densas, con un 13,27% y 11,85% de densidad relativa respectivamente; en la E4, se evidenció una gran representación de Hedyosmum cf. goudotianum, con 128 individuos (57,14%), lo cual, hace que sea la especie mas importante de la estación, las demás especies varian entre 4 y 29 individuos; finalmente, en la E5 sobresale nuevamente H. cf. goudotianum, con un 15,96% y Palicourea sp. con 24,47%, de densidad relativa, las demás especies mantienen valores bajos entre 2,13% y 4,26% (Figura 72). En cuanto a las frecuencias para la E1 se mantiene constante, ya que las especies se encontraron en las tres parcelas; en la E2, la mayoría de especies se registraron en todas las parcelas, menos Maytenus myricoides que sólo se encontró en la parcela 3 con 5 individuos; para la E3, la mayoría de las especies se encontraron en 2 parcelas (parcelas 1 y 2), D. cf. pittieri, solo se encontró en la parcela 3; en la E4, las especies se encontraron en las tres parcelas, excepto Gordonia humboldtii, que solo se encontó en las parcelas 1 y 2; en la E5, solo H. cf. goudotianum es frecuente en todas las parcelas, las demás especies solo están en 1 o 2 parcelas (Tabla 33, Figura 72). Las especies más dominantes en la E1 fueron Hypericum laricifolium y Calamagrostis sp. con 32,80% y 27,47%, las demás, no sobrepasaron el 6,27% de dominancia; para la E2, Miconia sp. 1 se destaca en el primer lugar con el 39,34% de dominancia y M. myricoides en segundo lugar del índice de valor de importancia, con 21,42% de dominancia relativa; Brunellia goudotii, Gynoxys cf. littlei y Weinmannia mariquitae son las tres especies con mayor IVI en la E3, debido a su alta dominancia, con 29,78%, 17,86% y 15,61% respectivamente; en la E4 H. cf. goudotianum y W. mariquitae son las especies con mayor IVI, debido a su dominancia relativa de 32,98% y 27,09% cada una; por último en la E5, la dominancia no varia mucho a excepción de Palicourea sp. que tiene un porcentaje muy bajo de 1,91%, pero su alta densidad (24,47%) hace que se mantenga en el tercer puesto del IVI (Tabla 33, Figura 72). Las cinco especies que presentaron los mayores valores de IVI en la estación uno fueron: Hypericum laricifolium, Calamagrostis sp., Espeletia hartwegiana, Lycopodium jussiaei y Valeriana microphylla. Entre las anteriores, H. laricifolium y Calamagrostis sp. presentaron el valor más alto de IVI, con 46,59% y 41,25% (Tabla 33, Figura 72). Todas las anteriores son hierbas y arbustos características de formaciones vegetales paramunas (Cuatrecasas 1958, Cleef 1980). 136 Tabla 33. Especies con mayor Índice de Valor de Importancia en cada una de las estaciones, del transecto de Tuluá. Familia Especie Estaciónes / IVI E1 Chloranthaceae Myrtaceae Rubiaceae Lauraceae Melastomataceae Chloranthaceae Cunoniaceae Melastomataceae Theaceae Polygalaceae Brunelliaceae Asteraceae Rubiaceae Asteraceae Melastomataceae Celastraceae Primulaceae Cunoniaceae Hypericaceae Poaceae Asteraceae Lycopodiaceae Valerianaceae H. cf. goudotianum M. cf. orthostemon Palicourea sp. O. infrafoveolata A. macrophylla H. cf. goudotianum W. mariquitae M. polyneura G. humboldtii M. angustata B. goudotii G. cf. littlei P. cf. andaluciana D. cf. pittieri Miconia sp. 1 M. myricoides G. bogotensis W.mariquitae H. laricifolium Calamagrostis sp. E. hartwegiana L. jussiaei V. microphylla E2 E3 E4 E5 36,82 33,08 31,93 28,55 23,64 23,65 25,40 97,44 37,53 26,48 24,72 16,39 39,71 30,63 20,49 18,56 84,15 27,23 21,17 14,58 46,59 41,25 20,34 17,83 16,85 En las cuatro estaciones más bajas del transecto, dos especies comparten altos valores de IVI en más de una estación; éstas son: Palicourea cf. andaluciana y Weinmannia mariquitae. La primera es una fuente importante de néctar y frutos para las aves, y la segunda es frecuente en filos de montaña (Vargas 2002), el resto de especies son de importancia particular en cada estación (Tabla 33, Figura 72). 137 Dominancia relativa 120 Frecuencia relativa 100 I.V.I Densidad relativa 80 60 40 20 0 E1 (3500 m) E2 (3420 m) E3 (3340 m) E4 (3260 m) E5 (3180 m) Especies Figura 72. Especies que presentaron los mayores valores de Índice de Valor de Importancia (IVI) en el transecto altitudinal del municipio de Tuluá. 5.1.6 Conclusiones Se encontró que a partir de la estación dos, ubicada a 3420 m., la diversidad y formas de crecimiento de la vegetación cambian. En la estación ubicada por encima de 3420 m., predominan los estratos vegetales rasante y herbáceos; en las cuatro estaciones ubicadas hacia abajo, predominan los arbolitos, arbustos y árboles. En la estación E3 (3340 m.), se encontraron arbustales y herbazales aislados de porte medio-bajo y semiabiertos con especies propias de páramo como: Hypericum laricifolium, Escallonia myrtilloides, Pernettya prostrata, Hesperomeles ferruginea, Miconia chlorocarpa, Berberis verticillata, Saracha quitensis, Greigia vulcanica, entre otras. Lo anterior puede estar influenciado por la apertura de claros para producción agropecuaria en décadas anteriores. En la estación E1 a 3500 m., las coberturas se hallan moderada a altamente intervenidas por intervención antrópica en décadas anteriores, lo que se evidenció con la existencia de construcciones abandonadas como viviendas y campamentos de la fuerza pública, sin embargo, algunos sectores de esta zona se encuentran en avanzados procesos de regeneración natural. 138 5.2 EDAFOFAUNA 5.2.1 Riqueza y composición de especies en el transecto altitudinal Se colectaron 634 individuos los cuales se clasificaron en 64 morfoespecies, distribuidas en 11 órdenes y aproximadamente 38 familias. La especie con mayor número de individuos fue el grillo del género Gryllus sp.2 con 75 individuos, seguida por un escarabajo de la familia Staphylinidae sp.3 con 62, una cochinilla (Isopoda sp.4) con 60 individuos, un coleóptero (Goniocellus sp.10b) con 48 y finalmente dos coleópteros de la familia Carabidae, Bembidion sp.22 y Dercylus sp.21 con 43 y 34 individuos respectivamente. El resto de morfoespecies presentan menos de 30 individuos (Figura 73 y Anexo 8). La morfoespecie Gryllus sp.2 perteneciente a la familia Gryllidae, fue la más abundante en el transecto. Se observó que esta especie no se presenta en las dos primeras estaciones altitudinales, es muy escasa en la tercera, pero comienza a ser dominante en las dos últimas estaciones altitudinales, lo cual la liga a pisos térmicos que se encuentren por debajo de los 3300 m.s.n.m (Anexo 8). En un estudio realizado en bosque andino por Sandoval y Fagua (2006), en el Santuario de Flora y Fauna Guanentá - Alto Río Fonce (Santander, Colombia), se observó que la riqueza y la diversidad de ortópteros declina directamente con el aumento de la altitud, lo que se relacionó con la reducción de la diversidad y disponibilidad de recursos vegetales en altitudes superiores. Los órdenes más numerosos fueron: Coleoptera con 33 morfoespecies, seguidos por Diptera con 16 y Araneae con 5, los demás órdenes presentaron entre una y dos morfoespecies (Figura 74). Entre estos se observó mayor abundancia de coleóptera en las tres primeras estaciones, más que en las dos últimas, lo cual se nota mejor en la primer visita realizada a este transecto. El orden díptera no presentó mayores cambios en toda la franja altitudinal (Anexo 8). 139 25 Goniocellus sp.10b Bembidion sp. 22 Dercylus sp. 21 Dyscolus sp. 1b Goniocellus sp.10b No de individuos 20 15 10 5 0 E1 (3500) E1* E2 (3420) E2* E3 (3340) E3* E4 (3260) E4* E5 (3180) E5* Estaciones altitudinales Figura 73. Abundancia de cinco morfoespecies de la familia Carabidae con preferencias altitudinales en cinco estaciones de muestreo. Tuluá (Valle del Cauca). *Estaciones del segundo evento de muestreo para el mismo transecto (ambas réplicas en estación climática lluviosa). 14 No de especies 12 Coleoptera Diptera 10 8 6 4 2 0 E1 (3500) E1* E2 (3420) E2* E3 (3340) E3* E4 (3260) E4* E5 (3180) E5* Estaciones altitudinales Figura 74. Número de especies de los dos órdenes más ricos de la edafofauna presente en cinco estaciones de muestreo. Tuluá (Valle del cauca). *Estaciones del segundo evento de muestreo en el mismo transecto altitudinal y sitios de muestreo. 140 Como se pudo observar, Coleoptera sigue siendo el grupo más abundante y con mayor número de familias de todos los transectos evaluados en el complejo de páramos las Hermosas. Resalta la familia Chrysomelidae, la cual se presentó únicamente en las dos primeras estaciones, con preferencia en la E1 (Anexo 1). Se ha reportado que los Chrysomelidos presentan un aumento en diversidad alfa con el incremento en altitud y una disminución en la abundancia y densidad de individuos en localidades altas (Sánchez-Reyes et al. 2014), lo cual concuerda con los resultados obtenidos en el presente transecto. Riqueza de Carabidae en las estaciones altitudinales Del mismo grupo de los coleópteros, se colectaron ocho morfoespecies de la familia Carabidae, la cual está representada en el mundo por más de 30 mil especies, 5.000 de ellas en el trópico (con 366 géneros según Reichardt 1977). En Colombia la familia es importante por su alta frecuencia y abundancia en ecosistemas de baja intervención (Camero y Chamorro 1999), generando información ecológica sustancial acerca del funcionamiento de la comunidad ecosistémica y sobre el estado de conservación de los mismos (Ribera y Foster 1993). Según Carmero (2003), tanto la composición como la distribución de Carabidos varían en la medida que se asciende a lo largo de un gradiente altitudinal; las especies encontradas en el perfil caracterizan un ecosistema natural en particular, debido al alto grado de especiación alopátrica y de endemismos del Neotrópico. Particularmente en este transecto, se observó una mayor abundancia neta en las estaciones intermedias (E2, E3 y E4) y una disminución en las estaciones extremas (E1 y E5) (Figura 75). Mostrando rangos altitudinales intermedios de preferencia en esta familia, que posiblemente expliquen la disminución de individuos a los 3500 m.s.n.m (Anexo 8). 80 Abundancia de Carábidos 70 60 50 40 30 20 10 0 E1 (3500) E2 (3420) E3 (3340) E4 (3260) E5 (3180) Figura 75. Abundancia de especies de la familia Carabidae a través del gradiente altitudinal muestreado. Tuluá (Valle del cauca). 141 De esta familia, la morfoespecie Dyscolus sp.1b y Goniocellus sp.10b de la tribu Platynini, se presentaron únicamente en las dos últimas estaciones en los dos eventos de muestreo; Dercylus sp.21 se presenta en todas las estaciones menos en la última y Bembidion sp.22 se presentó en estaciones intermedias E2, E3 y E4 (Figura 73, Anexo 8). Diversos morfos de esta familia presentaron comportamientos semejantes en los transectos de Sevilla y Palmira, lo que muestra un patrón sólido de tendencias. Esto demuestra también que entre especies, existen distribuiciones altitudinales que pueden servir para determinar rangos altitudinales de distribución. Esto a su vez crea un parámetro para evaluar ecosistemas altoandinos según la fauna de carábidos encontrada en cada nivel altitudinal. Es de esperarse que existan diferencias en la composición de las especies de carábidos a lo largo de gradientes altitudinales, donde la selección de poblaciones por factores externos genera cambios intra-específicos en su historia evolutiva, y la diferenciación de poblaciones seleccionadas produce poblaciones de especies distintas, emparentadas entre sí al menos en un mínimo de variaciones corporales (Krekeler 1962). 5.2.1.1 Diversidad alfa Representatividad y esfuerzo de muestreo Se calculó que el muestreo tuvo una representatividad en general de 90% y 75% según los índices Chao1 y Chao2. La curva de acumulación de especies Chao2 para todo el transecto muestra una leve tendencia a seguir creciendo, con lo que se asume que es posible encontrar algunas especies; por el contrario el comportamiento de las curvas de los singletons con 24% y de los doubletons con 27%, predice que no se seguirán encontrando nuevas especies si se continúan realizando más muestreos, dado su cruce entre la cuarta y la quinta estación (Figura 76). 142 90 No de morfoespecies Transecto S(est) Singletons Mean Doubletons Mean Chao 2 Mean Chao 1 Mean 80 70 60 50 40 30 20 10 0 0 1 2 3 4 5 Estaciones altitudinales E1 E1* 60 45 40 No de individuos 50 35 40 30 25 30 20 20 15 10 10 5 0 0 0 5 10 143 0 5 10 No de individuos E2 E2* 80 50 70 45 40 60 35 50 30 40 25 30 20 15 20 10 10 5 0 0 0 5 10 0 5 E3 E3* 30 40 35 25 No de individuos 10 30 20 25 15 20 15 10 10 5 5 0 0 0 5 10 0 No de individuos E4 5 10 15 E4* 30 30 25 25 20 20 15 15 10 10 5 5 0 0 0 5 10 144 0 5 10 E5 E5* 45 35 No de individuos 40 30 35 25 30 25 20 20 15 15 10 10 5 5 0 0 0 5 10 Unidades de muestreo 0 5 10 Unidades de muestreo Figura 76. Curvas de acumulación de especies para la Edafofauna epígea realizada para las cinco estaciones de muestreo. Tuluá (Valle del cauca). Aunque se presentaron especies diferentes en las dos réplicas, se pudo observar que la tendencia de las curvas es semejante en ambas replicas temporales, mostrando solidez de la tendencia observada (Figura 76). Al evaluar la incidencia con Chao2 por separado en cada estación altitudinal, se observan estaciones con un buen porcentaje de muestreo como E3 (92%), estaciones con un muestreo aceptable como E4 y E5 (77 y 78%); y estaciones con un muestreo bajo, como es el caso de E1 y E2 (54 y 57%) (Figura 76, E1 a E5); lo que a al parecer son porcentajes altos de muestreo, con una alta diversidad de especies colectada para el esfuerzo de muestreo empleado. De igual forma, la abundancia Chao 1 muestra comportamientos semejantes a Chao 2. Por otro lado se observó una disminución en el número de especies observado a medida que se disminuye en altitud. 145 Riqueza y abundancia de especies por estación altitudinal Se observó que mientras la riqueza disminuye a medida que disminuye la altura, la abundancia hace lo contrario (Tabla 34), comportamiento atípico de la edafofauna respecto a altura en estos ecosistemas; lo cual demuestra que existen presiones diferentes a la altura como la diversidad vegetal de cada estación altitudinal, que pueden estar afectando el comportamiento de la diversidad presente en la zona. La franja altitudinal más pobre y menos abundante fue E4 (3260 m), de forma inversa las más ricas fueron la primera y la segunda estación (3500 y 3420 m) (Tabla 34, Figura 77). Tabla 34. Diversidad Alfa en Edafofauna epígea de las cinco estaciones altitudinales. Tuluá, Valle del cauca. Estación Altitudinal Shannon H Simpson 1-D Riqueza Abundancia E1 3,001 0,9281 30 79 E2 2,853 0,9143 30 140 E3 2,826 0,9206 28 160 E4 2,434 0,8628 22 133 E5 2,513 0,8707 23 122 Abundancia 35 180 30 160 No de indivíduos No de morfoespecies Riqueza 25 20 15 10 5 140 120 100 80 60 40 20 0 0 1 2 3 4 5 1 Estaciones altitudinales 2 3 4 5 Estaciones altitudinales Figura 77. Riqueza y abundancia de especies de Edafofauna, en seis estaciones altitudinales. Tuluá (Valle del cauca). 146 Índices Shannon y Simpson Según el índice Shannon, E1 (3500 m) fue la estación más diversa, más rica en especies y con las más altas dominancias. Esta estación presentó valores semejantes a los de las dos estaciones contiguas (E2 y E3), pero difirieron de las dos últimas (E4 y E5), las cuales presentaron los valores más bajos del muestreo (Tabla 34). Estadísticamente por medio de una prueba t no se encontraron diferencias significativas entre estaciones, con los datos disponibles no se detectan diferencias en cuanto a la riqueza frente al resto de alturas (Tabla 35) y esto probablemente sea un efecto de la baja incidencia de las especies colectadas. Tabla 35. Valores t student y P valor para las medias de la riqueza observada en cada estación altitudinal. Estaciones E1 E1 E2 E3 E4 E5 -1,332 1,850 -1,060 -0,971 -0,901 -0,037 0,182 0,565 0,780 E2 P: 0,188 E3 P: 0,069 P: 0,371 E4 P: 0,292 P: 0,970 P: 0,573 E5 P: 0,335 P: 0,856 P: 0,438 0,380 P: 0,704 Comportamiento de la diversidad lo largo del gradiente altitudinal Dentro de la variación altitudinal de la fauna, la relación existente entre la riqueza de especies y la elevación es un patrón ecológico frecuentemente documentado, además de polémico, debido a que generalizaciones o explicaciones universales del fenómeno no han podido ser desarrolladas (Sandoval y Fagua 2006). Rahbek (1995) atribuye este fenómeno a que el comportamiento de la curva de riqueza de especies es muy variado, ya que puede diferir entre taxones idénticos o disímiles y cambiar local o regionalmente, lo que puede darnos una idea de por qué se dieron estos resultados de los índices ecológicos entre estaciones. Es por esto que se ha reportado que la diversidad de especies de insectos y otros artrópodos presente en los trópicos de alta montaña, se debe a la heterogeneidad macroespacial y microespacial relacionadas con las diferencias en el relieve y con las diferencias de la arquitectura de la vegetación de pequeños y grandes espacios (Amat y Vargas 1991). Rangos de abundancia Se determinaron cinco especies como abundantes (aquellas observadas en las cinco estaciones), 15 como comunes (observadas entre tres y cuatro estaciones), 147 13 como poco comunes (observadas en dos estaciones) y 31 especies como escasas (las que fueron observadas una sola vez) (Figura 78). Estos rangos están mostrando un elevado porcentaje de especies escasas (48%) frente al número total de especies determinadas en el muestreo (Figura 78), indicando así que casi la mitad de los individuos muestreados en estos dos transectos son particulares de una estación altitudinal, poco abundantes y restringidos a estos ecosistemas altoandinos. 5 4 3 2 Cantharidae sp.73b Labidus sp.69 Curculionidae sp.71b Pheidole sp.65 Nitidulidae sp.1 Curculionidae sp.63 Curculionidae sp.60 Muscidae sp.47 Chrysomelidae sp.56 Coleoptera sp.33 Curculionidae sp.42 Chrysomelidae sp.32 Oxytrechus sp.11b Curculionidae sp.23 Silphidae sp. 67 Bembidion sp. 10 Empididae sp.62 Cicadellidae sp.57 Ptilodactylidae sp.34 Ichneumonidae sp.50 Araneae sp.12 Blattidae sp.30 Curculionidae sp.19 Melolonthinae sp.38 Phoridae sp.9 Sciaridae sp.14 Araneae sp.18 Forficulidae sp.39 Goniocellus sp.10b Isopoda sp.4 0 Dercylus sp. 21 1 Bradycellus sp.1 Estaciones / Incidencia 6 Morfoespecies Figura 78. Curvas de diversidad-dominancia de las morfoespecies de edafofauna epígea, colectadas a lo largo del transecto altitudinal. Tuluá (Valle del cauca). Al evaluar los rangos de abundancia para para cada estación altitudinal, no se observan especies que aparezcan en las 20 trampas de caída usadas en los dos eventos de muestreo; además se observa una alta riqueza de especies con abundancia baja o pobremente representadas, ya que la mayor parte de las especies se encuentran entre cuatro estaciones o en una (Figura 79). Se determinaron como especies abundantes aquellas observadas en las 20 trampas por estación, comunes las observadas entre 19 y diez trampas, poco comunes las observadas entre ocho y tres trampas y especies escasas las que fueron observadas una o dos veces (Figura 79). Se observó que la mayor cantidad de especies se agrupan dentro de la categoría de escasas en cada estación altitudinal, seguida por las especies catalogadas como poco comunes (Figura 79), mostrando una alta diversidad de individuos escasos y raros en el ecosistema. Por el contrario, se observaron pocas especies comunes y poco comunes en ninguna de las cinco estaciones altitudinales, lo cual puede ser un efecto de la baja incidencia de las especies capturadas. 148 Figura 79. Curvas de diversidad-dominancia de las morfoespecies de Edafofauna Epígea colectadas en cinco estaciones muestreadas. Tuluá (Valle del cauca). Nota: Los números pertenecen al código de cada especie que se encuentran en el anexo 8. 5.2.1.2 Diversidad beta (β) Índice de Whittaker En cuanto al análisis de recambio de especies con Whittaker, se observa un alto recambio de especies (de una estación a la siguiente) tanto entre la E1 a E2, como entre la E4 a E5, aunque en este último caso fue un poco bajo (Tabla 36). Tabla 36. Recambio entre pares de estaciones altitudinales según Whittaker Estaciones altitudinales E1 E2 0,551 E3 0,653 0,370 E4 0,714 0,490 0,333 E5 0,625 0,600 0,454 E2 E3 E4 0,463 Análisis de disimilitud SIMPER (Bray-Curtis) Los porcentajes de disimilitud por medio del análisis SIMPER (Bray-Curtis), muestran que en E1 se dan las mayores diferencias al ser contrastados con las demás estaciones altitudinales. Es decir, en esta estación presenta un importante cambio de diversidad de edafofauna en la zona, sobre todo por el alto porcentaje de disimilitud que se observa entre esta estación y E2. Por otro lado fue posible notar grandes diferencias entre E5 y el resto de estaciones, aunque al compararla con E4 no se observe un claro recambio (Tabla 37, subrayado). 149 Tabla 37. Porcentaje de disimilitud entre pares de alturas por medio del índice SIMPER. Estaciones altitudinales E1 E2 71% E3 78% 40% E4 78% 49% 41% E5 73% 67% 57% E2 E3 E4 42% Estos resultados se asemejan al observado en los recambios que se dan a nivel de la vegetación en los dos eventos de muestreo realizados (Ver índice Whittaker de vegetación). Análisis de agrupamiento (Jaccard) El análisis de conglomerados (Cluster) con el índice de Jaccard, sugiere tres grupos (o zonas) con las cinco estaciones así: la primera en E1, la segunda formada por E2-E3-E4 con una semejanza del 40% y la tercera en E5 (Figura 80 A). Este mismo índice muestra una fuerte disimilitud en el paso de la estación E1 a E2, dejando ver la primera zona de recambio tal como lo mostraron los índices de Whittaker y Simper. Al realizar el análisis con el índice Sorensen-Dice, se observa una mayor solidez de los grupos sugeridos por Jaccard, mostrando una similitud del 56% entre el grupo formado por las estaciones E2-E3-E4, separados tanto de la primera estación (E1), como de la última (E5) (Figura 80 B). Quizás estos resultados estén mostrando que se trata de comunidades diferentes en composición de edafofauna, pero muy seguramente el resultado también esté influenciado por el efecto de la baja incidencia de especies colectadas, a pesar de haber realizado dos repeticiones temporales en los mismos sitios de muestreo. 150 Similarity 0,96 0,80 0,64 0,48 0,32 0,16 E1 (3500) E4 (3260) E3 (3340) E2 (3420) E5 (3180) E1 (3500) E4 (3260) E3 (3340) E2 (3420) E5 (3180) A. Similarity 0,96 0,80 0,64 0,48 0,32 B. Figura 80. Clúster de similitud de Jaccard de la edafofauna epígea presente en las cinco estaciones de muestreo, A) Jaccard, B) Sorensen-Dice. Tuluá (Valle del cauca). La línea vertical negra muestra el punto de corte de semejanza para el grupo E2-E3-E4. Agrupamiento de las estaciones Los diferentes índices con los que se analizó la diversidad beta, mostraron claramente una principal zona de recambio que se da entre las estaciones E1 a E2. Posteriormente se pudo notar, aunque con una tendencia más débil, un segundo recambio dado de la E4 a E5, mostrando así tres grupos altitudinales tal 151 como se esquematizaron en los agrupamientos de Jaccard y Sorensen-Dice (Figura 80 A y B). En el primer caso, las estaciones E1 y E2 presentan una estructura vegetal diferente, principalmente porque en E1 prevalece el estrato bajo (rasante, hierba y roseta), lo que puede estar marcando la diferencia entre este y los demás sitios. Posteriormente se observó que los arbustos empiezan a tener mayor representatividad en las cuatro estaciones siguientes (E2 a E5) con porcentajes que superan 37% y especialmente dominando en las estaciones dos y tres (E23420 y E3-3340 m) con un 49% y 64% respectivamente. Tal como se notó con los índices ecológicos, es posible que las tendencias en vegetación sean las que influencian las diferencias de edafofauna entre rangos altitudinales, por encima de la misma influencia neta de la altura. Sandoval y Fagua (2006), muestran un claro ejemplo de este comportamiento en un estudio con ortópteros en un gradiente altitudinal, donde observan que las agrupaciones formadas se encuentran relacionadas posiblemente con las diferencias en la estructura y composición de la vegetación a lo largo del gradiente. 5.2.2 Hábitos ecológicos Los principales artrópodos depredadores pertenecen a las clases Insecta (17 morfos) y Arachnida (cinco morfos). En este transecto se encontró que 40% de las familias de artrópodos colectadas presentan un hábito alimenticio herbívoro, seguidos por artrópodos con hábitos principalmente depredadores los cuales constituyeron el 30%, omnívoros con 8%, parásitos 8% y finalmente un 14% para otras estratégias alimenticias (saprófitos, detritívoros y carroñeros) (Tabla 38). Tabla 38. Número de individuos según los principales hábitos alimenticios por estación altitudinal en el transecto de Tuluá (Valle del cauca). No. de especies/morfoespecies Gremio E1 (3500) E2 (3420) E3 (3340) E4 (3260) E5 (3180) Herbívoro 13 11 10 7 6 Depredadores 7 12 13 12 9 Omnívoro 3 1 2 3 5 Saprófagos/Carroñeros 4 8 6 3 6 Parásitos/parasitoides 3 1 1 1 0 *Los números corresponden a las especies de cada gremio, presentes en cada estación altitudinal. Se observó un aumento general en la proporción de depredadores frente a los herbívoros a medida que se disminuía en altura. En sentido inverso, hubo una tendencia de los herbívoros a disminuir con la disminución en altura. 152 En el caso de los descomponedores, según un estudio en alta montaña realizado en el parque ecológico distrital de montaña Entrenubes (Bogotá, Colombia), la presencia de grupos saprófagos descomponedores de desechos orgánicos y madera en descomposición, así como escarabajos estercoleros (Scarabaeidae) y tijeretas (Forficulidae) entre otros, sugiere que los procesos de reciclaje de nutrientes y reincorporación de materia orgánica al suelo dentro del bosque se encuentran activos, lo que enriquece el flujo energético del ecosistema y acelera los procesos de regeneración (Corporación Suna Hisca 2003). En nuestro caso se presentó un porcentaje alto de morfos pertenecientes a este grupo (14%), repartidos en todas las estaciones evaluadas, lo que demuestra un ciclo activo en todos los sitios. 5.2.3 Conclusiones Este transecto presentó 80 morfoespecies más que las registradas en el tranecto realizado en Sevilla (Valle del Cauca) en este estudio. No obstante, en este caso se realizaron dos réplicas en la misma área, que pueden significar menos especies al ser comparada con el transecto mencionado. La riqueza aumentó mientras que la abundancia disminuyó a medida que disminuyó la elevación. El gremio de depredadores aumentó mientras que el de los herbívoros disminuyó con el nivel altitudinal. Los coleópteros crisomélidos se presentaron únicamente en las dos primeras estaciones con preferencia en E1. El género Dyscolus (Platynini) presenta una tendencia al aumento a medida que se desciende en altitud; en oposición a la tendencia del morfo Bembidion sp. 22. Se establecieron tres grupos altitudinales separados: uno formado por E1, el segundo formado por E2-E3 y E4 y el último formado por E5. Igual que en otros transectos, este resultado muestra un rápido recambio en la parte más alta del transecto (entre E1 a E2), que se estabiliza en las tres estaciones posteriores y vuelve a cambiar en E5. 5.3 ANFIBIOS 5.3.1 Riqueza y composición de especies En el transecto altitudinal de Tuluá se registraron un total de 120 individuos (61 adultos y 59 juveniles) que se agrupan en tres especies de anuros de la misma familia taxonómica. Cada especie fue catalogada en diferentes categorías de abundancia relativa de acuerdo a la estación donde fue vista. A medida que se descendió altitudinalmente, cada especie domina con su abundancia en una 153 estación en particular; Pristimantis simoterus es abundante en la E1; P. peraticus en la E3; y P. uranobates en la E4 (Tabla 39). De las especies capturadas se colectaron cinco individuos que fueron depositados en las colecciones del IAvH y la Universidad del Quindío (Anexo 9), con el fin de confirmar identidades y disponer de especímenes de referencia, igualmente, se obtuvieron muestras de tejidos y datos funcionales que serán usados por el laboratorio de diversidad funcional del IAvH, y fueron documentados en la Plataforma Institucional de Datos (I2D). Tabla 39. Riqueza, abundancia y abundancia relativa de los anfibios adultos registrados el transecto de Tuluá, Valle del Cauca. Estaciones / m.s.n.m Taxa E1/3500 Craugastoridae Pristimantis simoterus E2/3420 22 (Ab) Pristimantis peraticus 2 (Ra) 5 (Pc) 6 (Co) 24 5 4 (Pc) 11 Pristimantis uranobates Total individuos E3/3340 E4/3260 1 (Ra) 2 (Ra) E5/3180 1 (Ra) 13 (Ab) 15 5 (Pc) 6 El índice de abundancia relativa se muestra entre paréntesis; sus categorías son: Ab= Abundante; Com= Común; Pc= Poco común y Ra= Rara. A pesar de escucharse en actividad bastantes machos en el área de estudio, sólo se detectaron cinco individuos de la especie Pristimantis simoterus realizando este comportamiento. Se realizó un gráfico de frecuencias para identificar en qué rango horario se detectó la mayor cantidad de individuos por especie (Figura 81). Se puede identificar el predominio de avistamientos de ranas en la noche. Una manera de explicar esto es por razones de protección, pues son organismos que debido a las características de su piel, deben proteger la humedad que hay en ella y esto logran hacerlo asociándose a micro-ambientes y llevando a cabo su actividad en horas específicas ya que la radiación solar se convierte en un factor limitante en coberturas vegetales simplificadas (p.ej. páramo) (Navas 1999; Ardila y Acosta 2000; Lynch y Suarez-Mayorga 2002). 154 Figura 81. Frecuencia de detección de individuos por rangos de hora en el transecto altitudinal de Tuluá, Valle del Cauca. Entre las especies observadas solo una está catalogada con un nivel de conservación cercano a la amenaza (NT: casi amenazada) de acuerdo a la lista roja de especies amenazadas (www.iucnredlist.org - consultada el 15 de abril de 2015, versión 2014.3). Si se tiene en cuenta el tipo de ecosistema en el que habitan estas ranas y el aislamiento por grandes barreras geográficas, podemos identificar la restringida distribución de las tres especies que fueron registradas para el estudio y que además son endémicas para Colombia, dos de ellas, específicamente para la zona centro de la cordillera Central; Pristimantis simoterus en los departamentos de Caldas, Risaralda, Quindío y Tolima; P. peraticus en los departamentos de Valle del Cauca y Tolima (Castro et al. 2004 a,b en www.iucnredlist.org, versión 2014.3; Acosta 2015 en www.batrachia.com, referencia V.05.2015, consultadas en abril de 2015.) (Tabla 40). Para el estudio se registra P. simoterus en el departamento del Valle del Cauca, lo cual amplía el conocimiento sobre su distribución a nivel nacional. La distribución aislada es comúnmente observada en las ranas del género Pristimantis que habitan en las cordilleras, ya que tienen áreas de distribución restringidas debido a la estrecha relación que se genera entre los individuos y el ecosistema que habitan, dando como resultado a nivel regional que estos organismos soporten procesos únicos que son expresados en una alta endemicidad (Lynch et al. 1997; Lynch 1999; Ardila & Acosta 2000). Ninguna de las especies ha sido objeto del comercio de fauna silvestre, de manera que no están catalogadas dentro de ningún apéndice del CITES en el 2015 (www.checklist.cites.org/#/en). 155 Tabla 40. Endemismo y categorías de amenaza de los anfibios en el transecto de Tuluá (Valle del Cauca) Estado de Amenaza por fuente Familia/Especie Endemismo* IUCN 2014.3 RuedaAlmonacid et al. 2004 Resolución 192 de 2014 CastroHerrera, F y W. BolívarGarcía. 2010 Craugastoridae Pristimantis simoterus Endémico NT - - - Pristimantis peraticus Endémico LC - - LC Pristimantis uranobates Endémico LC - - LC Endemismo basado en IUCN 2014.3 NT: casi amenazado, LC: preocupación menor www.minambiente.gov.co/.../resoluciones/2014/res_0192_2014.p... Los microhábitats preferidos por los individuos para percharse y refugiarse son las hojas de diferentes plantas (representadas en su mayoría por plantas de la familia Poaceae y Melastomataceae) y las hojas de frailejón en el páramo. En menor medida se observó el uso de otros microhábitats como hojarasca, bromelias, helechos, musgos y hepáticas (Tabla 41). Para los anfibios se hace evidente que dependiendo del tipo de ecosistema en el que se encuentren los individuos, hacen uso de un hábitat específico y en el caso de las poblaciones paramunas, también se observa que reducen al máximo su exposición a la luz del día. Esto concuerda con las observaciones de Navas (1999) quien dice que las especies de anfibios están asociadas a las características del ambiente que explotan, de manera que en el caso de condiciones extremas, las poblaciones son obligadas a refugiarse en un microhábitat específico para evitar efectos de la radiación solar, bajas y altas temperaturas. A nivel general, el ensamble de especies se puede estratificar en el transecto de acuerdo a la estructura del ecosistema y disponibilidad de microhábitats. Por ejemplo, en ecosistemas compuestos por frailejonal, pajonal y arbustal (E1) Pristimantis simoterus prefiere asociarse a frailejones, mientras que las especies de coberturas boscosas (E2, E3, E4 y E5) como P. peraticus y P. uranobates, prefieren usar las perchas de las hojas de distintas plantas. Así mismo es el comportamiento de otras especies como lo observaron por Muñoz-Guerrero et al. (2007) quienes encuentran que dependiendo de la disponibilidad de microhábitats en diferentes ambientes, las especies aprovechan un recurso específico. 156 Tabla 41. Uso de microhábitats por adultos de las especies de anfibios observados en el transecto de Tuluá (Valle del Cauca). Las estaciones se agrupan en pares excepto la E3 (1-2); (3); (4-5). ESTACIONES 1 y 2 ESPECIE ESTRATO (ABUNDANCIA) MICROHABITAT Pristimantis peraticus Rasante (2) Perchada en hojas Bromelia Herbáceo (5) Perchada en hojas Bromelia Pristimantis simoterus Rasante (15) Musgo y Hepática Frailejón Perchada en hojas Herbáceo (7) Frailejón Perchada en hojas ESTACIÓN 3 ESPECIE ESTRATO (ABUNDANCIA) MICROHABITAT Pristimantis peraticus Rasante (3) Hojarasca Perchada en hojas Helecho Herbáceo (3) Perchada en hojas Pristimantis simoterus Herbáceo (1) Bromelia Pristimantis uranobates Rasante (3) Perchada en hojas Helecho Herbáceo (1) Perchada en hojas ESTACIONES 4 Y 5 Especie Pristimantis peraticus ESTRATO (ABUNDANCIA) MICROHABITAT Herbáceo (1) Perchada en hojas Pristimantis simoterus Herbáceo (2) Perchada en hojas Pristimantis uranobates Rasante (5) Hojarasca Musgo y hepática Tronco Perchada en hojas Bromelia Herbáceo (12) Perchada en hojas Helecho Arbustivo (1) Perchada en hojas 157 5.3.1.1 Representatividad del muestreo Los registros fueron obtenidos con un esfuerzo de muestreo total de 300 h/obs en los transectos y 80 h/obs con la técnica de encuentro visual aleatorio fuera del área abarcada por los transectos. El esfuerzo de muestreo fue igual entre estaciones. En la primera visita el esfuerzo fue de 24 h/obs en transectos y 8 h/obs en búsqueda libre por estación, y en la réplica, de 36 h/obs en transectos y 8 h/obs en búsqueda libre por estación. Se elaboró una curva de acumulación de especies agrupando las cinco estaciones del transecto de Tuluá para lograr con esto aumentar la muestra (Figura 82). Esta medida se tomó debido a la baja representatividad de datos por causa de la baja actividad de los anfibios en el transecto y también por factores climáticos que limitaron la ejecución de la metodología adecuadamente. Los estimadores no paramétricos usados fueron los que se basan en abundancias (ACE, Chao 1, y Jackknife 1). Los resultados indican que para el transecto altitudinal de Tuluá, los muestreos permiten un buen estimado de la riqueza de anfibios ya que los estimadores muestran que la representatividad del muestreo estuvo por encima del 90%. Los singletons y doubletons fueron muy pocos, observándose en la figura que tienden a cero a medida que aumenta el esfuerzo de muestreo y a su vez, los estimadores exhiben la asíntota en tres especies. Se debe tener en cuenta que es un estudio base, cuya evaluación ecológica rápida reduce la detectabilidad, además se desarrolla en un solo periodo climático (lluvioso) y con esto no se permite observar todas las especies que se han reportado allí (Anexo 2). 158 Figura 82. Curva de acumulación de especies para el ensamblaje de anfibios en el transecto altitudinal de Tuluá (Valle del Cauca). 5.3.1.2 Diversidad Alfa (α) En cuanto al ensamblaje de anfibios, los índices muestran que la diversidad de Shannon-Wiener en su modificación por Jost (2006), es alta en la E3 con respecto a las demás, pues fue en la estación que se vieron más especies. La equidad es mayor también en la E3, pues allí, las abundancias entre especies están en valores cercanos, mientras que en la E1 las abundancias son muy diferentes y el índice lo demuestra con un valor bajo. Así mismo, el índice de Simpson inverso da su valor más bajo en la E2 ya que solo hay una especie allí. La siguiente estación con más dominancia es la E1, que tiene dos especies pero una presenta mayor abundancia. De manera que se puede inferir que la E3 fue la que presentó el ensamble con mayor diversidad y menor dominancia (Tabla 42). Para el transecto altitudinal se esperaría que los índices de diversidad describieran una tendencia, mostrando un valor de diversidad más alto en las estaciones de menor elevación. Para este transecto aún no es muy definida la tendencia. No se cumple posiblemente debido a procesos históricos de intervención antrópica que han afectado el ensamblaje de anfibios en la zona. La estructura vegetal de los bosques ofrecen una mayor complejidad estructural y por ende, una mayor disponibilidad de microhábitats en la que coexisten un mayor número de especies (Rincón & Castro 1998; Gutiérrez-Cárdenas 2005; García et al. 2007) de manera que la destrucción, fragmentación y pérdida de hábitat que se ha reportado anteriormente en áreas naturales del Valle del Cauca, son factores que juntos han significado posiblemente el declive de numerosas especies en cobertura de bosque (Bustamante et al. 2005; Velásquez et al. 2008; Castro-Herrera y VargasSalinas 2008). 159 Tabla 42. Patrones de diversidad en los ensamblajes de anfibios registrados en el transecto altitudinal de Tuluá (Valle del Cauca) Índices/estación E1 (3500) E2 (3420) E3 (3340) E4 (3260) E5 (3180) Riqueza 2 1 3 2 2 Abundancia 17 5 9 13 5 Shannon Exp (H)* 1,3322 1 2,5004 1,4809 1,5692 Equidad (J) 0,4138 - 0,8342 0,5665 0,65 Simpson Inverso 1,18 1 2,28 1,30 1,38 * Modificación del índice de Shannon acorde a Jost (2006). Exp (H). Con los valores estimados de diversidad se realizó la prueba t que determina si existen diferencias numéricas de la diversidad entre las estaciones en el gradiente de altitud. Se observa que las estaciones cercanas como en el caso de E1 con respecto a E2 y E3 presentan diferencias ya que no comparten las mismas especies y las abundancias son muy diferentes. Lo mismo ocurre en E2 con respecto a E3 y E4 (Tabla 43). Tabla 43. Prueba t para comparar valores de diversidad (Índice de Shannon-Wiener) entre pares de estaciones en el gradiente de altitud. Valores arriba de la diagonal indican el valor del estadístico t, valores bajo la diagonal corresponden al valor P (* diferencia significativa). E1 (3500) E1 (3500) E2 (3420) E3 (3340) E4 (3260) E5 (3180) 2,0717 -2,7978 -0,4811 -0,5368 -5,1656 -2,2974 -1,658 2,1262 1,4356 E2 (3420) 0,049* E3 (3340) 0,0099* 0,0003* E4 (3260) 0,63 0,036* 0,043* E5 (3180) 0,6 0,14 0,17 -0,1803 0,86 Las curvas de diversidad dominancia permiten observar que las especies tienden a ser abundantes en estaciones específicas; Pristimantis simoterus es abundante en la E1; en las E2 y E3 es más abundante P. peraticus; finalmente dos últimas estaciones (E4 y E5), son dominadas por P. uranobates, que tiende a ser la especie abundante. De manera que se observa un leve patrón de recambio en la abundancia en el gradiente de altitud (Figura 83). 160 Figura 83. Curvas de diversidad-abundancia de anfibios en las estaciones del transecto altitudinal de Tuluá (Valle del Cauca). En la E2 solo se registró una especie (P. peraticus), no se incluyó en el gráfico. 5.3.1.3 Diversidad Beta β El ensamble de los anfibios se modificó entre estaciones a medida que se desciende altitudinalmente (Figura 84). Aunque las especies comparten su distribución en las estaciones intermedias, se observa un recambio entre las estaciones más distantes (E1 y E5) cuando se deja de observar Pristimantis simoterus en la E5 y P. uranobates se ausenta en la E1 y E2. Se logra identificar que P. peraticus está en todo el transecto altitudinal, excepto en E4. Sin embargo, se esperaría que estuviese allí por continuidad de distribución en el gradiente de altitud. Pristimantis simoterus es una especie que habita principalmente en coberturas de frailejonal, pajonal y arbustal (www.iucnredlist.org, versión 2014.3. consultada en noviembre de 2014), sin embargo, fue vista en estaciones ubicadas en cobertura de bosque. Estructuralmente se observa que el bosque debido a un proceso de intervención quedó con claros que hoy día se están recuperando y son áreas de sucesión intermedia que contienen elementos de páramo, y es allí donde ésta especie fue hallada. Es posible que sea una especie que ha podido colonizar por procesos de intervención humana, como lo mencionan Lynch y SuárezMayorga (2002). 161 Figura 84. Recambio en la composición y estructura de ensamblajes de anfibios entre 3500 m.s.n.m (E1) y 3180 m.s.n.m (E5). Transecto altitudinal de Tuluá (Valle del Cauca). Fotografias por Wolfgang Buitrago-González. Similitud Los índices de similitud de Bray-Curtis, Jaccard y Sorensen muestran las agrupaciones que se ajustan al recambio de las especies en el gradiente de altitud. El índice de Bray-Curtis muestra las E2 y E3 como las más similares en un mismo clúster. Estas estaciones solo comparten una especie con una abundancia similar, de manera que lo anterior es el resultado de agrupar abundancias. Luego, a este clúster se unen E4 y E5 con una similitud del 40 %. Finalmente la E1 se agrupa con las anteriores pero con un nivel de similitud muy bajo (Figura 85 a). El índice de Jaccard se basa en la presencia-ausencia, de manera que el clúster agrupa las E1, E3 y E4 en un resultado muy influenciado por Pristimantis simoterus, además la ausencia de esta especie en la E2, hace que el clúster agrupe (E1 - E3) como las más similares y deja E2 y E5 agrupadas con un 50 % (Figura 85 b). Finalmente el clúster de Sorensen se ajusta mejor por el algoritmo que utiliza. La figura muestra el mismo orden de agrupamiento que Jaccard, pero con un nivel de similitud más alto entre los grupos (Figura 85 c). 162 (b) (a) (c) Figura 85. Clúster de similitud de anfibios entre estaciones altitudinales del transecto altitudinal de Tuluá (Valle del Cauca). a) Bray-Curtis, b) Jaccard; c) Sorensen. Números en paréntesis corresponden a la elevación (m) de las estaciones. Recambio de especies El índice de reemplazo de especies de Whittaker (Tabla 44), indica en general que las estaciones cercanas entre sí, tienen valores bajos en el índice, demostrando que el recambio es poco. Al comparar estaciones más distantes se esperaría que la disimilitud aumentara considerablemente, no obstante, el comportamiento no es muy marcado, ya que los valores del índice no son muy altos y en general son homogéneos entre pares de estaciones, excepto las E2 y E4 que son totalmente diferentes en su composición. Lynch (1999) describe el recambio de especies a medida que se asciende altitudinalmente en las pendientes andinas y agrega que en ecosistemas de páramo la riqueza de fauna anura es modesta, generalmente menos de diez especies. En este caso los resultados muestran que la fauna de anfibios estudiada exhibe una distribución similar, de manera que no se evidencia una tendencia clara sobre recambio de especies en el gradiente estudiado. En áreas de coberturas boscosas ubicadas a elevaciones medias se espera registrar la mayor diversidad y a medida que se asciende altitudinalmente ir reduciéndose progresivamente (Lynch & Suárez-Mayorga 2002; Bernal & Lynch 2008). Con los datos obtenidos en el transecto altitudinal del páramo del Japón se 163 puede identificar que no existe una tendencia que se aproxime a estos supuestos, y esto se debe posiblemente a que el gradiente altitudinal estudiado fue corto (1334 m longitudinales aprox.) Tabla 44. Índice de disimilitud de Whittaker entre estaciones para los anuros del transecto altitudinal de Tuluá (Valle del Cauca) Estaciones E1 E1 E2 E3 E4 E5 0,33 0,2 0,5 0,5 0,5 1 0,33 0,2 0,2 E2 E3 E4 0,5 E5 5.3.2 Datos importantes Pristimantis simoterus es una especie endémica para Colombia, y concentra su distribución en la cordillera Central, en los departamentos de Caldas, Risaralda, Quindío y Tolima (Castro et al. 2004b. en www.iucnredlist.org). En el presente estudio se registra en el departamento del Valle del Cauca, al norte del complejo de páramos Las Hermosas. Este registro amplía la distribución reportada por Castro et al. 2004b hacia el sur de la cordillera Central en 66,05 Km aproximadamente. En un estudio realizado en el complejo de páramos ChilíBarragán, también se reportó esta especie en la cuenca alta del río Tibí (Sevilla, Valle del Cauca) (López et al. 2014). 5.3.3 Recomendaciones Se recomienda ampliar el gradiente con el objetivo de abordar una mayor área altitudinal que permita identificar la tendencia en el recambio de especies y a su vez la zona de transición entre el ecosistema de páramo y el bosque altoandino. 5.3.4 Conclusiones Se encontraron tres especies de anfibios típicos de zonas altas de la cordillera Central, de las cuales una está catalogada como casi amenazada por la IUCN. Las especies reportadas son endémicas de Colombia, específicamente para la zona centro de la cordillera Central. dos de ellas La actividad de las ranas fue mayor en la noche como sucede en la mayoría de ranas del género Pristimantis. Los individuos dependiendo de la estación, prefieren asociarse a un microhábitat en particular, los de la E1 se asocian a frailejones y musgos, mientras que los de la E2 en adelante a las perchas de las hojas en diferentes plantas. 164 Se registraron tres especies y la curva de acumulación de especies mostró que para el espacio de tiempo usado en el estudio, es la riqueza esperada. 165 5.4 AVES 5.4.1 Riqueza y composición de especies Durante 576 horas/red y 72 horas/observador se obtuvo un total de 593 registros, pertenecientes a 74 especies de aves agrupadas en 24 familias (Anexo 10). Las familias que presentaron mayor número de especies fueron Thraupidae (15), Trochilidae (9), Tyrannidae (7) y Grallariidae (5). Durante los desplazamientos entre estaciones y la zona del campamento se registraron cinco especies: Systellura longirostris, Adelomyia melanogenys, Phrygilus unicolor, Zonotrichia capensis, Cacicus chrysonotus; dado que éstas no fueron registradas en los puntos de conteo, no se consideraron en los análisis. Es por esto que los análisis de diversidad alfa y beta se realizaron con 69 especies registradas de forma sistemática. Se recolectó un espécimen de Grallaricula lineifrons que fue depositado en el museo del IAvH. Entre las 69 especies motivo de análisis, 25 fueron registros únicos en las estaciones; 10 en E1, tres en E2, cuatro en E3 y ocho en E4; 12 especies fueron registradas en todas las estaciones: Eriocnemis mosquera, Ochthoeca frontalis, Anisognathus igniventris, A. lacrymosus, Grallaria nuchalis, Mecocerculus leucophrys, Metallura tyrianthina, Myioborus ornatus, Penelope montagnii, Scytalopus latrans, Tangara vassorii y Turdus fuscater. Durante el muestreo con redes de niebla se capturaron 28 especies, en puntos de conteo se registraron 65 especies, de las cuales, 170 registros (33 especies) fueron por vocalizaciones y 196 registros (55 especies) mediante observaciones. 12 especies se registraron en ambos métodos (redes y puntos de conteo). Durante los muestreos, se encontraron tres especies con algún grado de amenaza, según lo definido en Renjifo et al. 2014. Además de una especie endémica y cinco casi endémicas, de acuerdo a Chaparro-Herrera et al. 2013 (Tabla 45). Las nueve especies de la familia Trochilidae y tres de la familia Psittacidae registradas en este gradiente se encuentran en el apéndice II de la Convención Internacional sobre Comercio de Fauna y Flora Amenazadas (www.cites.org/esp/resources/pub/checklist11/Indice_de_especies_CITES.pdf. consultada en abril de 2015) (Anexo 10). 166 Tabla 45. Aves endémicas y amenazadas de extinción registradas en el gradiente altitudinal. Familia Especie Categoría de amenaza Nivel de Endemismo Trochilidae Eriocnemis mosquera Casi-endémico Trochilidae Heliangelus exortis Casi-endémico Ramphastidae Andigena hypoglauca VU Psittacidae Hapalopsittaca fuertesi CR Psittacidae Leptosittaca branickii VU Grallariidae Rhinocryptidae Corvidae Parulidae Grallaricula lineifrons Scytalopus spillmanni Cyanolyca armillata Myoborus ornatus Endémico Casi-endémico Casi-endémico Casi endémico CR: En peligro crítico; VU: Vulnerable. 5.4.1.1 Representatividad del muestreo Las curvas resultado del análisis con el estimador Chao 2 para el método con redes de niebla (Figura 86), permiten identificar que E1 y E4 tuvieron un comportamiento alejado de las demás estaciones, debido a la baja tasa de captura en la estación cuatro y de la representación de un único individuo por especie en la mayoría de las capturas. No obstante, la riqueza en la estación uno fue la más alta con este método. Por el contrario, E2 y E3, se comportan en claro ascenso aunque con una riqueza relativamente baja. En los puntos de conteo las curvas se comportaron asintóticas, sin embargo, igual que en el método anterior, E1 presentó la riqueza más elevada, con una tendencia a seguir aumentando (Tabla 46). 167 Figura 86. Curvas de acumulación de especies basadas en Chao 2 para Aves en el transecto altitudinal de Tuluá (Valle del Cauca). A: Redes de niebla y B: Puntos de conteo. Tabla 46. Comparación de los estimadores Chao 1 y 2, Aves registradas en el transecto altitudinal de Tuluá entre métodos y estaciones. Redes Puntos conteo Chao 1 Chao 2 Chao 1 Chao 2 Estaciones/Altitud E1 (3.500 m) E2 (3.375 m) E3 (3.250 m) 40% 65% 77% 42% 67% 53% 92% 72% 93% 72% 70% 63% E4 (3.125 m) 33% 35% 91% 73% Estación uno - E1 (3500 m.s.n.m) La complementariedad metodológica que se utilizó, dio resultados contrastantes entre los métodos. En las redes de niebla la representatividad del muestreo fue de 40% para Chao 1 y 42% para Chao 2 (Tabla 46). En general los dos estimadores calculados predicen un mayor número de especies, y no se observa aproximación a una asíntota. Por su parte en los puntos de conteo la representatividad de cada uno de los estimadores, mostró mayor tendencia a la asíntota (Figura 87) 168 Figura 87. Curva de acumulación de especies observadas y estimadas: Chao 1 y Chao 2 para la estación uno – E1 (3500 m.s.n.m). A: Redes de niebla y B: Puntos de Conteo. Tuluá (Valle del Cauca) En la E1, se registraron un total de 43 especies pertenecientes a 19 familias, siendo la más representativa Thraupidae, con siete especies. Se consideraron cinco especies como abundantes, ya que presentaron más de cinco registros: Cistothorus platensis (20), Anisognatus igniventris (16), Tangara vassorii (11), Turdus fuscater (8), Diglossa humeralis y Hemispingus verticalis (6). Siete especie se consideraron raras, ya que se registraron en una sola oportunidad, entre ellas: Accipiter striatus, Asthenes flammulata y Colaptes rivolii (Figura 88 A, Anexo 10). Diez especies se registraron únicamente en esta estación, entre ellas: Gallinago jamesoni, C. platensis y Leptosittaca branickii. 169 B. montana M. ornatus A. lacrymosus G. nuchalis P. arcuata H. exortis H. atropileus M. tyrianthina C. eximia H. superciliaris P. montagnii A. pallidinucha H. frontalis M.s leucophrys O. murina T. vassorii A. kingi C. unirufa H. verticalis O. frontalis P. tumultosus S. latrans S.s spillmanni T. solstitialis T. fuscater A. orthonyx A. igniventris C. lutetiae C. torquata E. mosquera G. lineifrons M. squamiger P. ruficeps T. serranus B. montana M. ornatus A. lacrymosus G. nuchalis P. arcuata H. exortis H. atropileus M. tyrianthina C. eximia H. superciliaris P. montagnii A. pallidinucha H. frontalis M.s leucophrys O. murina T. vassorii A. kingi C. unirufa H. verticalis O. frontalis P. tumultosus S. latrans S.s spillmanni T. solstitialis T. fuscater A. orthonyx A. igniventris C. lutetiae C. torquata E. mosquera G. lineifrons M. squamiger P. ruficeps T. serranus Aubundancia relativa ni/N T. vassorii P. montagnii A. igniventris M. leucophrys M. ornatus M. tyrianthina M. williami A. lacrymosus G. jardinii T. fuscater A. schistaceus P. tumultosus C. unirufa G. quitensis G. rufula G. squamigera S. latrans D. cyanea M. nigrocristata S. spillmanni P. nigrocapillus A. hypoglauca C. olivascens D. albilatera D. humeralis E. mosquera G. nuchalis H. exortis H. gularis H. verticalis O. frontalis S. unirufa T. holostictus T. personatus T. serranus C. platensis A. igniventris T. vassorii T. fuscater D. humeralis H. verticalis M. nigrocristata A. torquatus E. mosquera C. inornata L. branickii M. leucophrys T. solstitialis A. lacrymosus A. schistaceus G. quitensis G. rufula M. squamiger M. tyrianthina M. williami M. striaticollis O. fumicolor A. orthonyx D. cyanea G. jamesoni G. jardinii G. ruficapila G. squamigera H. exortis L. lafresnayi O. murina P. montagnii P. carunculatus T. personatus A. striatus A. flammulata C. goudotii C. rivolii G. nuchalis M. ornatus O. frontalis P. nigrocapillus S. latrans Abundancia relativa ni/N A B 0,15 0,15 0,10 0,10 0,05 0,05 0,00 0,00 C D 0,15 0,15 0,10 0,10 0,05 0,05 0,00 0,00 Figura 88. Abundancia de especies en el transecto altitudinal en el municipio de Tuluá. A: E1, B:E2, C: E3 y D:E4. Estación dos – E2 (3375 m.s.n.m) Las representatividad para el método redes de niebla en esta estación no fue tan baja como en la estación anterior. La E2 presentó el valor más alto para el estimador Chao 2, pese a tener una de las más bajas riquezas en el gradiente altitudinal. No obstante, la representatividad fue mayor para los dos estimadores con la metodología de puntos de conteo (Tabla 46, Figura 89). En la E2, se registraron 35 especies pertenecientes a 15 familias, siendo la más representativa Thraupidae, con siete especies. Se consideraron ocho especies 170 como abundantes, ya que presentaron más de cinco registros, entre estos se destaca: T. vassorii (21), Penelope montagnii (18) y A. igniventris (13). 14 especies fueron considerdas raras por presentar un solo registro, entre ellas: Andigena hypoglauca, Turdus serranus y Trogon personatus (Figura 88 B, Anexo 10). Las especies que solo se registraron en esta estación fueron: A. hypoglauca, Hellmayrea gularis y Thripadectes holostictus. Figura 89. Curva de acumulación de especies observadas y estimadas: Chao 1 y Chao 2 para la estación dos – E2 (3375 m.s.n.m). A: Redes de niebla y B: Puntos de Conteo. Tuluá (Valle del Cauca) Estación tres – E3 (3250 m.s.n.m) Las curvas de acumulación para el muestreo en esta estación con el método de redes de niebla, arrojaron una representatividad baja, principalmente para el estimador Chao 2. Estos valores reflejan la dificultad de capturar aves al interior de bosque, principalmente cuando la cobertura vegetal es compleja en su estructura vertical, ya que la actividad de los organismos se concentra en el dosel. Lo anterior contrasta con la alta representatividad en los puntos de conteo (Tabla 46, Figura 90, donde la detección de las aves de forma directa e indirecta aumentó el número de registros. 171 Figura 90. Curva de acumulación de especies observadas y estimadas: Chao 1 y Chao 2 para la estación tres – E3 (3250 m.s.n.m). A: Redes de niebla y B: Puntos de Conteo. Tuluá (Valle del Cauca) En la E3, se registraron 39 especies pertenecientes a 17 familias, siendo las más representativas, Thraupidae con ocho especies y Tyrannidae con seis. Se consideraron ocho especies como abundantes, ya que presentaron más de cinco registros, entre estas se destacan: M. ornatus (23) y M. leucophrys (19); entre las especies consideradas raras por presentar un registro, se encontraron: Cnemothraupis eximia y Coeligena lutetiae. Las especies que solo se registraron en esta estación fueron: Conirostrum sitticolor, Cyanolyca armillata, Hapalopsittaca fuertesi y Mecocerculus poecilocercus (Figura 88 C y Anexo 10). Estación cuatro – E4 (3125 m.s.n.m) Las curvas de acumulación para el muestreo en esta estación, para redes de niebla, presentaron una representatividad baja en ambos indicadores. El patrón de representatividad de los muestreos, no es diferente del observado en las estaciones precedentes, en puntos de conteo fue mayor (Tabla 46 y Figura 91). 172 Figura 91. Curva de acumulación de especies observadas y estimadas: Chao 1 y Chao 2 para la estación cuatro – E4 (3125 m.s.n.m). A: Redes de niebla y B: Puntos de Conteo. En la E4, se registraron 34 especies, pertenecientes a 14 familias, siendo la más representativa, Thraupidae con nueve especies. Se consideraron cuatro especies como abundantes, ya que presentaron más de cinco registros, entre estas se destacan: Buthraupis montana (11) y M ornatus (10). Entre las especies consideradas raras por presentar un registro se encuentran: Aglaiocercus kingi y Atlapetes pallidinucha (Figura 88 D y Anexo 10). Ocho especies fueron únicas para esta estación, entre ellas: Aglaiocercus kingi, B. montana, Coeligena torquata y Grallaricula lineifrons. A pesar del bajo número de registros en comparación con las tres estaciones anteriores, se realizó la captura y posterior colecta de Grallaricula lineifrons, ave de la familia Grallariidae, que habita en el sotobosque de bosques enanos y densos entre 2900 y 3400 m (Hilty & Brown 2001; Rivera-Pedroza & Ramírez 2005). Posee una distribución limitada a los Andes Colombianos y Ecuatorianos (Ridgely & Greenfield 2001, en Rivera-Pedroza & Ramírez 2005), por lo que se considera casi-endémica (Chaparro et al, 2013). Esta especie toma especial relevancia, debido a que se le considera como un ave rara por la dificultad para ser observada y por el bajo número de reportes que presenta, siendo únicamente registrada en las áreas de influencia de los volcanes Puracé (Cauca) y Galeras (Nariño) (Renjifo & Kattan 2002, en Renjifo et al. 2002); Villamaría (Caldas) (SCO, 2011) y en el Quindío (Génova y Pijao) (Rivera-Pedroza & Ramírez 2005 y Baquero et al. 2011). Lo anterior representa que este es el primer registro de la especie para el Valle del Cauca. 173 5.4.1.2 Diversidad alfa Índices de Dominancia. Según el índice de Shannon (H´) utilizado para evaluar las estaciones en el transecto altitudinal, la estación uno mostró la mayor riqueza y diversidad; por el contrario la estación dos presentó la menor diversidad y una de las menores riquezas en el gradiente altitudinal. Con respecto a la dominancia de especies (1D), las estaciones uno y cuatro presentaron la mayor dominancia, esto contrasta con la riqueza, ya que en estas estaciones se presentaron la mayor y la menor riqueza (Tabla 47). Lo anterior, puede estar relacionado con la heterogeneidad de las coberturas vegetales de la estación uno, donde se encontraron arbustales, pajonales y formaciones boscosas (ver descripción del componente de flora), dado a que la amplitud de la cima de la montaña, donde están ubicados los páramos del área de estudio (picos del Japón), es angosta y está rodeada de bosques, lo que configura un paisaje complejo en estructuras vegetales, que generan diversidad de hábitats y nichos ecológicos para las aves. Tabla 47. Diversidad alfa para las cuatro estaciones en el transecto altitudinal. Estaciones/m.s.n.m Riqueza Abundancia E1 (3500) E2 (3375) E3 (3250) E4 (3125) 43 35 39 34 159 146 171 112 Diversidad(H´) 3,408 3,071 3,228 3,263 Dominancia(1-D) 0,9525 0,934 0,9429 0,9525 De acuerdo con los resultados de la prueba t, se presentaron diferencias significativas en la diversidad (H´), encontrada entre E1 y E2, (P-valor <0,05) (Tabla 48); esto es un factor que explica la tendencia de los índices encontrados, siendo la diversidad en la estación uno la más alta y la estación dos la más baja. El establecimiento de los puntos de conteo en la estación uno, abarcó diferentes coberturas (borde de bosque, arbustales, pajonales y frailejonales) lo que posibilitó el registro de especies adaptadas a diferentes hábitats; contrario sucedió en la estación dos, ya que los muestreos estaban ubicados en interior de bosque, posibilitando el registro de especies asociadas a coberturas boscosas como: H. gularis, T. holostictus y A. hypoglauca. 174 Tabla 48. Tabla de doble entrada para la prueba T (student) y P valor para los índices de diversidad de Shannon-Wiener para el transecto altitudinal. Estaciones/m.s.n.m E1 (3500) E1(3500 m) E2 (3375) 2,88 E2(3375 m) 0,0041 E3(3250 m) 0,1353 0,1444 E4(3125 m) 0,1334 0,1500 E3 (3250) 1,49 E4 (3125) -1,50 -1,46 -1,44 0,01 0,9884 5.4.1.3 Diversidad Beta De acuerdo a los índices de Jaccard y Sorensen, se evidencia un grupo importante integrado por las tres primeras estaciones, entre las estaciones uno y dos se presentó una similitud del 48% para el índice de Jaccard, y 64% para Sorensen; por otro lado, la estación cuatro presentó poca similitud con las demás estaciones (Figura 92). Con el Índice de Bray-Curtis, se evidenció una tendencia similar a los análisis anteriores, sin embargo, en este índice las estaciones dos y tres presentaron una mayor similitud (50%) que las demás estaciones (Figura 93). En cualquier caso, se debe señalar que similitudes por debajo del 50% entre grupos, como en este caso, dan cuenta de lo heterogénea que es la avifauna del gradiente evaluado. Figura 92. Agrupamiento con base en la composición y abundancia de la avifauna del transecto altitudinal. A: índice de Jaccard y B: Sorensen 175 Figura 93. Índice de Bray- Curtis: Agrupamiento con base en la composición y abundancia de la avifauna del transecto altitudinal. Índice de Whittaker En este análisis, se muestra un recambio en la composición y estructura de aves en las estaciones muestreadas. En la estación cuatro, contrastada con la estación uno, existe una mayor disimilitud (valores más altos) (Tabla 49). Así mismo, se evidencia cómo la similitud en la composición cambia conforme aumenta la distancia entre las comunidades de aves. Este patrón muestra que la similitud disminuye y el recambio de especies aumenta con la distancia (Calderón et al. 2012, Anderson et al. 2011). Tabla 49. Análisis de Whittaker para las estaciones del transecto altitudinal. Estaciones/Altitudes E1 (3.500m) E2 (3.375m) E3 (3.250m) E1 (3.500m) 0 E2 (3.375m) 0,35897 0 E3 (3.250m) 0,36585 0,35135 0 E4 (3.125m) 0,53247 0,47826 0,42466 E4 (3.125m) 0 De acuerdo con los anteriores análisis, se observó una mayor similitud entre las tres primeras estaciones, ya que compartieron siete especies. Con esto se infiere que debido a la composición y estructura de aves en las diferentes estaciones, no se evidencia un recambio de especies a medida que se asciende en el gradiente altitudinal. De esta manera, no es claro marcar una línea o gradiente donde se evidencia un recambio, pero si que en las estaciones más altas se registraron especies comunes de áreas abiertas donde existen dominancia de áreas boscosas matorrales, frailejonales, chuscales y pajonales. Esto indica que la composición y estructura de aves en la alta montaña está relacionada con la estructura vegetal encontrada. 176 Una de las razones para este patrón, pueden ser las condiciones ambientales, que cambian conforme aumenta la distancia; hay una disminución de la similitud ambiental con la distancia, lo que implica que exista una separación de las especies con diferentes características fisiológicas. Otro factor que puede influenciar, está relacionado con la configuración del ambiente y el tiempo, ya que puede influir en el movimiento de las especies (Calderón et al. 2012). A mayor número de barreras, la similitud decrece más abruptamente que en un sitio topográficamente abierto y homogéneo (Nekola & White 1999, Soininen et al. 2007). Es de resaltar que las similitudes en la composición de aves encontrada entre estaciones es baja, esto lo explica la alta movilidad del grupo y la especificidad de algunas aves, un ejemplo claro son algunos colibries, cucracheos y semilleros, ya que estan más asociados a coverturas vegetales de menor altura como algunas gramíneas y ericaceas, además en estos ecosistemas las cobertura cabian abruptamente por la perturbación de algunas áreas. Según lo arrojado por los análisis, se evidencia que la estación cuatro difiere de las demás estaiones, es decir, existe un cambio en la composición y estructura de las aves entre 3250 y 3125 m.s.n.m 5.4.2 Gremios Tróficos Los gremios tróficos fueron asignados con base en Renjifo (1999b) con modificaciones, de acuerdo a la dieta de cada especie (Tabla 50). Tabla 50. Gremios tróficos Tipo de alimentación Rapaz diurna Frutos Frutos e insectos Frutos, insectos y néctar Néctar e insectos Insectos Semillas Abreviación R/D FR FR-I FR-I-N NI I SE En todo el transecto altitudinal los insectívoros estuvieron mejor representados, siendo más relevantes en la estación uno con 22 especies; los frugívoros que complementan su dieta con insectos (FR-I) fueron más relevantes en las estaciones más bajas (E3 y E4), y los nectarívoros (NI) en la primera y última estaciones con cinco y seis especies respectivamente (Figura 94). La disponibilidad de recursos alimenticios es uno de los factores determinantes en la dinámica y estructuración de las comunidades de aves (Nocedal 1984, Wolda 1990). Su composición en función de los gremios alimenticios, está estrechamente relacionada con la estructura de la vegetación (Laurance & Bierregaard 1997). Los 177 hábitats con una estructura de vegetación compleja y formada por varios estratos presentan principalmente especies de hábitos insectívoros, frugívoros y nectarívoros (Rappole et al. 1993). De acuerdo con lo anterior, en todo el transecto altitudinal fueron representativos estos tres gremios. La etapa de floración de las plantas y regimen climático, permitió que se presentara una mayor abundancia de insectos, favoreciendo que aves de este gremio fueran más abundantes en todas las estaciones. 25 E1 (3.500m) E2 (3.375m) E3 (3.250m) E4 (3.125m) N° Especies 20 15 10 5 0 FRU I RD NI FR-I FR-I-N Gremios Figura 94. Número de especies de acuerdo a los gremios tróficos. Se destacan las aves nectarívoras de la familia Trochilidae, ya que se registraron nueve especies en todo el transecto altitudinal. Los nectarívoros son un grupo importante en la dinámica de ecosistemas altoandinos, este grupo se ve favorecido por la presencia de especies de plantas de las familias Ericaceae, Rubiaceae, Melastomataceae, entre otras, que ofrecen alimento de forma constante durante la etapa de floración. 5.4.3 Conclusiones Se registraron tres especies de especial interés para la conservación por estar amenazadas de extinción: H. fuertesi (CR), L. branickii y A. hypoglauca (VU). Se resalta el registro de una especie de distribución restringida, H. fuertesi especie en peligro crítico (CR), y considerada como especie sombrilla para fortalecer estrategias encaminadas a la conservación de su hábitat. 178 De acuerdo con los índices de dominancia la estación uno (E1), presentó los valores más altos, con relación a las estaciones que se encontraban en elevaciones más bajas. Se encontró un recambio de especies a medida que se asciende en el gradiente altitudinal, principalmente entre los 3.250 m a 3.125 m, es decir en las estaciones E3 y E4. De acuerdo con los gremios alimenticios evaluados, las aves que basan su alimentación en insectos, estuvieron mejor representadas. 5.5 CONSIDERACIONES FINALES TRANSECTO MUNICIPIO DE TULUÁ El análisis de agrupamiento de la flora con todos los modelos usados, permite identificar claras diferencias entre la E1 y las demás estaciones en el transecto, de hecho, E1, apenas se agrega en niveles inferiores al 10% de similitud. Luego se resaltan los niveles de relación entre E2 y E3 que varían entre 40 y 60%, de acuerdo al modelo de análisis pero el grupo es consistente. E4 y E5 por su parte, forman patrones muy semejantes en los análisis de incidencia, sin embargo conforman un grupo con relaciones apenas del 20% en el análisis de abundancias. En resumen las afinidades entre las estaciones evaluadas, permiten identificar E1 como la menos comparable y E2, E3 como el par de elevaciones más semejantes. Los demás grupos tienen menos soporte numérico. El índice de complementariedad, permitió establecer un patrón similar, E1 difiere en más de 85% de las demás estaciones; en particular de E5, con un porcentaje del 100%. Las estaciones dos y tres se diferencian de la estación cinco, en 65% y 62% respectivamente. A partir de E2 (3420 m.), la diversidad y formas de crecimiento de la vegetación cambian. En E1, predominan los estratos vegetales rasante y herbáceo; en las cuatro estaciones ubicadas hacia abajo, predominan los arbolitos, arbustos y árboles; sin embargo, hasta la estación E3 (3340 m.), se encontraron arbustales y herbazales aislados de porte medio-bajo y semiabiertos con especies propias de páramo. Especies como H. laricifolium, Calamagrostis sp., E. hartwegiana, L. jussiaei y V. microphylla, propias y comunes en parámo, presentaron altos valores de importancia en E1 (3500 m.). Las coberturas se hallan moderada a altamente perturbadas por intervención antrópica. En el caso de la edafofauna, E1 es la menos similar de las estaciones, adjuntándose a las demás en niveles entre 15% y 35%, porcentajes bajos, en cualquier comparación. El grupo más semejante en los modelos de análisis lo conforman E3 y E4 con similitudes entre 50 y 65%. E2 se adiciona luego en niveles alrededor de 50% y finalmente E5 se adiciona entre 35 y 48%. La riqueza aumentó mientras que la abundancia disminuyó a medida que se descendió el gradiente de altitud. De forma paralela a la abundancia, el gremio de 179 depredadores aumentó mientras que el de los herbívoros disminuyó con el nivel altitudinal. Los coleópteros crisomélidos sólo se detectaron en las dos primeras estaciones. De la misma forma el género Dyscolus presentó una tendencia al aumento a medida que se desciende en altitud, opuesta a la tendencia de Bembidion sp. 22., y de los dípteros y arañas. Los anfibios por su parte, mostraron semejanzas dependiendo del modelo de análisis. Los modelos de incidencia tienen patrones similares aunque los niveles difieren. E2 y E5 se agrupan con el resto de estaciones a niveles de 35% y 62%, mientras que E1 y E3 son las más parecidas entre sí. En el caso de considerar las abundancias, E1 se adiciona al resto sólo a nivel de 20%, mientras que E2 y E3 se parecen 70% y E4, E5 se asemejan menos de 60%. Se encontraron tres especies de anfibios típicos de zonas altas de la cordillera Central, de las cuales una está catalogada como casi amenazada por la IUCN. Las especies reportadas son endémicas de Colombia, dos de ellas específicamente para la zona centro de la cordillera Central. Los individuos dependiendo de la estación, prefieren asociarse a un microhábitat en particular, los de la E1 se asociaron a frailejones y musgos, mientras que los de la E2 en adelante a las perchas de las hojas en diferentes plantas. En el caso de las aves, los análisis de incidencia, E4, la estación más baja es la que menos se parece a las demás apenas logra niveles entre 35% y 50%. E2 y E3 conforman el grupo más parecido con niveles entre 48 y 65%, mientras que E1 se adiciona a este grupo a niveles entre 45 y 63%. El agrupamiento con Bray Curtis, muestra una topología muy similar aunque los niveles se comparan más con Jaccard que con Sorensen. Se registraron dos especies de interés para la conservación y con alguna categoría de amenaza: H. fuertesi (CR), L. branickii y A. hypoglauca (Vu). Se resalta la detección de H. fuertesi, una especie de distribución restringida, y considerada como especie sombrilla para fortalecer estrategias encaminados a la conservación de su hábitat. De acuerdo con los índices de dominancia, E1, presentó los valores más altos, con relación a las estaciones más bajas, ya que en estas elevaciones con diferentes coberturas vegetales promueven una mayor cantidad de nichos para las aves. Se encontró un recambio de especies a medida que se asciende en el gradiente altitudinal, principalmente entre 3250m y 3125m, es decir entre las estaciones E3 y E4. 180 181 6. RESULTADOS TRANSECTO ALTITUDINAL, PREDIO EL AUXILIO, VEREDA LAS MERCEDES, MUNICIPIO DE RIOBLANCO (TOLIMA) 6.1 VEGETACIÓN El transecto altitudial de Rioblanco (Tolima) se realizó en un predio de la Corporporación Autónoma Regional de Tolima (Cortolima), denominado El Auxilio, adquirido con fines de conservación de la diversidad biológica y el agua. El área donde está ubicado el predio se conoce como el páramo del Meridiano, zona de influencia del resguardo indígena Paéz, Las Mercedes (Figura 95 A y B). La topografía del páramo del Meridiano presenta pendientes pronunciadas en las laderas y una zona relativamente plana, por donde corre el río Hereje; en las laderas, las coberturas vegetales predominates son formaciones boscosas en diferentes estados sucecionales, en la parte superior existen picos abruptos y escarpes rocosos, al igual lagunas, y en la zona plana, algunos sectores tienen potreros destinadas a la ganadería bovina (Figura 95 C y D). B A C D Figura 95. Fotos del páramo del Meridiano, A) Indígenas Paeces, B) Equipo de trabajo y médico de la comunidad Paez en ritual de bienvenida a la zona, C) Cañón del río Hereje, y D) Picos y escarpes rocosos. Rioblanco (Tolima). 182 6.1.1 Descripción de las estaciones de muestreo 6.1.1.1 Estación uno - E1 (3520 m.s.n.m) En la estación uno se encontró cobertura vegetal de porte bajo a medio y semiabierto a cerrado, conformada por arbustales y arbolitos emergentes dispersos. Predominan rosetas de helechos (Blechnum loxense); Diplostephium bicolor, D. cf. schultzii, Temistoclesia cf. mucronata, Cavendishia bracteata, Gaultheria spp., Disterigma spp., Vaccinium floribundum, Pernettya prostrata, Greigia sp., Gaiadendron punctatum, Myrsine cf. panamensis, M. dependens, Chusquea tessellata, Hesperomeles obtusifolia y Monnina revoluta. Los arbolitos emergentes dispersos presentan hasta 5 m de altura, donde domina Weinmannia mariquitae, Oreopanax tolimanum, Maytenus sp., Miconia spp. y Clusia cf. alata. El estrato rasante presenta un tapizado de musgos (Prionodon sp., Sphagnum sp.), líquenes (Cladonia sp.) y pasturas (Achiachne aff. pulvinata) (Anexo 11). Estos arbustales se encuentran moderada a altamente intervenidos. En la zona de influencia de E1, existen varios caminos que fueron abiertos con el propósito de evaluar la viabilidad de la instalación de unas redes de alta tensión eléctrica por parte de la Empresa de Energía de Bogotá (EEB) (Isai Noscué, gobernador indígena Paez, com.pers), con lo que se ha generado un impacto negativo sobre coberturas vegetales y suelo que fue evidente en la realización del muestreo. En la E1, los arbustales se presentan como las coberturas dominantes, se encontraron en zonas de topografía quebrada o escarpada, con relieve montañoso, el cual predomina en el área de estudio, donde la exposición al viento en estos filos del macizo puede ser variable, así como las propias condiciones microclimáticas, ecológicas y de manejo, lo que probablemente ha limitado el establecimiento de otras coberturas como herbazales o frailejonales, los cuales se observaron en las mismas cotas (o incluso por debajo) pero en sitios de topografía plana-ondulada (Figura 96). Antes de la adquisición del predio El Auxilio con fines de conservación, en los valles y zonas planas se presentaba ganadería extensiva (relatos de indígenas Paeces que acopañaron la salida de campo), actualmente, estas zonas están dominadas por herbazales de Calamagrostis sp., los frailejonales están reducidos y se presentan pocos adultos y muchos juveniles dispersos. 183 Estratos vegetales estación uno Las tres parcelas evaluadas presentaron una pendiente de 10-60%, con plantas entre <0,1 y 3 m, que conforman tres estratos vegetales, que se describen a continuación: Rasante (<0,3 m): dominado por musgos (Prionodon sp., Sphagnum sp.), Disterigma empetrifolium, D. cf. acuminatum, líquenes (Cladonia sp.), y helechos (Elaphoglossum sp.). Herbáceo (0,3-1,5 m): dominado por Disterigma cf. acuminatum, Pernettya postrata, Vaccinium floribundum, Greigia sp., Chusquea tessellata, Hypericum strictum y helechos (Blechnum loxense, Elaphoglossum sp.). Arbustivo (1,5-5 m): dominado por Blechnum loxense, Weinmannia mariquitae, Diplostephium bicolor, D. cf. schultzii, Gynoxis laurata, Temistoclesia cf. mucronata, Cavendishia bracteata, Gaultheria spp., Disterigma cf. acuminatum, Gaiadendron punctatum, Myrsine cf. panamensis, M. dependens, Chusquea tessellata, Hesperomeles obtusifolia, Oreopanax tolimanum, Maytenus sp. y Monnina revoluta (Figura 97). Figura 96. Arbustales en el área de influencia de la E1 (3520 m.s.n.m). Rioblanco (Tolima). 184 Figura 97. Perfil de vegetación arbustiva en la E1, parcela uno (3520 m.s.n.m). 1. Myrsine cf. panamensis, 2. Pentacalia sp.2, 3. Blechnum loxense, 4. Chusquea tessellata, 5. Prionodon sp., 6. Miconia sp. 6, 7. Elaphoglossum sp., 8. Diplostephium bicolor, 9. Greigia sp., 10. Pernettya prostrata, 11. Maytenus sp., 12. Hypericum strictum, 13. Gynoxys laurata, 14. Prionodon, 15. Bartsia sp., 16. Cavendishia bracteata, 17. Hesperomeles obtusifolia, 18. Weinmannia mariquitae, 19. Varasia sp., 20. Myrsine dependens, 21. Bomarea linifolia, 22. Disterigma cf. acuminatum, 23. Prionodon sp., 24. Diplostephium bicolor, 25. Vaccinium floribundum. Eje x, longitud del transecto (m); eje y, altura de la vegetación (m). Ilustración Yoao Palchukan (2015). 185 6.1.1.2 Estación dos – E2 (3440 m.s.n.m) Predominan los arbustales de porte medio-bajo y semiabiertos a cerrados, de 3-5 m de altura, en las partes planas y con suelos húmedos existen herbazales (Calamagrostis sp.) y chuscales altos (Chusquea tessellata). Son comunes las rosetas de helechos (Blechnum loxense); Diplostephium bicolor, D. cf. schultzii, Temistoclesia cf. mucronata, Gaultheria spp., Disterigma spp., Vaccinium floribundum, Pernettya prostrata, Greigia sp., Gaiadendron punctatum, Berberis sp., orquídeas (Epidendrum spp.), Miconia chlorocarpa, Myrsine cf. panamensis, M. dependens, Weinmannia mariquitae, Escallonia myrtilloides, Hesperomeles obtusifolia, H. ferruginea y Monnina revoluta (Anexo 11). Se presenta un tapizado denso de musgos sobre el suelo. Estas coberturas se encuentran moderada a levemente intervenidas. La topografía del terreno es ondulada a levemente quebrada, con pendientes medias a bajas (Figura 98). Estratos vegetales estación dos Las tres parcelas evaluadas presentaron una pendiente de 10-40%, con plantas entre <0,1 y 3,5 m, que conforman tres estratos vegetales, que se describen a continuación: Rasante (<0,3 m): dominado por pastos (Calamagrostis sp., Achiachne aff. pulvinata), musgos (Sphagnum sp., Prionodon sp.), Disterigma empetrifolium, Pernettya spp., helechos (Jamesonia alstonii, Elaphoglossum sp.), líquenes (Cladonia sp.) y licopodios (Lycopodium jussiaei). Herbáceo (0,3-1,5 m): dominado por pastos (Calamagrostis sp.), chusque (Chusquea tessellata), Pentacalia vaccinioides, Greigia sp., Vaccinium floribundum y Rynchospora cf. caucana. Arbustivo (1,5-5 m): dominado por chusque (Chusquea tessellata), helechos (Blechnum loxense), Diplostephium bicolor, D. cf. schultzii, Gynoxis laurata, Gaultheria sp., Temistoclesia cf. mucronata, Greigia sp., Berberis sp., Gaiadendron punctatum, Escallonia myrtilloides, Myrsine cf. panamensis, M. dependens, Hesperomeles ferruguinea, H. obtusifolia y Monnina revoluta (Figura 99). 186 Figura 98. Herbazales y arbustales, área de influencia E2 (3440 m.s.n.m). Rioblanco (Tolima). 187 Figura 99. Perfil de vegetación arbustiva en la E2, parcela tres (3440 m.s.n.m). 1. Blechnum loxense, 2. Chusquea tessellata, 3. Prionodon sp., 4. Vaccinium floribundum, 5. Diplostephium cf. schultzii, 6. Pentacalia sp., 7. Rubus gachetensis, 8. Prionodon sp., 9. Hesperomeles obtusifolia, 10. Calamagrostis sp., 11. Lycopodium jussiaei, 12. Prionodon sp., 13. Pernettya prostrata, 14. Themistoclesia cf. mucronata, 15. Elaphoglossum sp., 16. Gaultheria sclerophylla, 17. Blechnum loxense, 18. Diplostephium cf. schultzii, 19. Rubus gachetensis, 20. Prionodon sp., 21. Gaiadendron punctatum, 22. Gaultheria sclerophylla, 23. Myrsine cf. panamensis, 24. Weinmannia mariquitae. Eje x, longitud del transecto (m); eje y, altura de la vegetación (m). Ilustración Yoao Palchukan (2015). 188 6.1.1.3 Estación tres – E3 (3360 m.s.n.m) Predominan los arbustales de porte medio-alto y semiabiertos, de 3-5 m de altura, entremezclados con herbazales (Calamagrostis sp.) y chuscales altos (Chusquea tessellata) hacia las partes más planas y con suelos más húmedos, además de algunos relictos pequeños de bosques achaparrados con árboles emergentes de 8-14 m de altura y dosel discontinuo. Entre los chuscales y herbazales existen pequeños humedales dominados por musgo (Sphagnum sp.). En los arbustales son comunes Diplostephium cf. schultzii, Blechnum loxense, Jamesonia alstonii, Temistoclesia cf. mucronata, Gaultheria spp., Disterigma spp., Vaccinium floribundum, Pernettya prostrata, Gaiadendron punctatum, Berberis sp., Miconia spp., Bomarea linifolia, Ageratina cf. popayanensis, Baccharis tricuneata, Myrsine cf. panamensis, Hesperomeles obtusifolia, H. ferruginea y Monnina revoluta (Anexo 11). Se presenta un tapizado denso de musgos sobre el suelo (Sphagnum sp.), así como orquídeas (Cyrtochilum sp.). En los bosques achaparrados de la E3, predominan Clusia cf. alata de hasta 10-14 m de altura, algunos Weinmannia mariquitae y Oreopanax tolimanum. Estos bosques se encuentran hacia las zonas más inclinadas de esta cota (Figura 100). Estas coberturas se encuentran moderada a levemente intervenidas. La topografía del terreno es plana a levemente quebrada, con pendientes bajas a medias. Estratos vegetales estación tres Las tres parcelas evaluadas presentaron una pendiente de 0-20%, con plantas entre <0,1 y 4 m, que conforman tres estratos vegetales, que se describen a continuación: Rasante (<0,3 m): dominado por pastos (Calamagrostis sp.), musgos (Sphagnum sp., Prionodon sp.), Disterigma spp., Pernettya spp., helechos (Jamesonia alstonii, Elaphoglossum sp.) y licopodios (Lycopodium jussiaei). Herbáceo (0,3-1,5 m): dominado por pastos (Calamagrostis sp.), chusque (Chusquea tessellata), helechos (Jamesonia alstonii, Blechnum loxense) y Disterigma cf. acuminatum. Arbustivo (1,5-5 m): dominado por chusque (Chusquea tessellata), Blechnum loxense, Diplostephium cf. schultzii, Temistoclesia cf. mucronata, Berberis sp., Gaiadendron punctatum, Oreopanax tolimanum, Myrsine cf. panamensis, Miconia spp. y Hesperomeles obtusifolia (Figura 101). 189 Figura 100. Herbazales y arbustales, área de influencia E3 (3360 m.s.n.m). Rioblanco (Tolima). 190 Figura 101. Perfil de vegetación arbustiva en la E3 (3360 m.s.n.m), parcela tres 1. Chusquea tessellata, 2. Calamagrostis sp 3. Jamesonia alstonii, 4. Pernettya prostrata, 5. Chusquea tessellata 6. Prionodon sp., 7. Disterigma empetrifolium., 8. Diplostephium cf. schultzii, 9. Jamesonia alstonii, 10. Prionodon sp., 11. Calamagrostis sp, 12. Chusquea tessellata, 13. Diplostephium cf. schultzii, 14. Pentacalia cf. sp., 15. Hesperomeles obtusifolia, 16. Cynanchum cf. sp., 17. Jamesonia alstonii, 18. Jamesonia alstonii, 19. Disterigma empetrifolium, 20. Diplostephium cf. schultzii 21. Calamagrostis sp, 22. Blechnum loxense, 23. Clusia cf. alata, 24. Myrsine cf. panamensis. Eje x, longitud del transecto (m); eje y, altura de la vegetación (m). Ilustración Yoao Palchukan (2015). 191 6.1.1.4 Estación cuatro - E4 (3280 m.s.n.m) En la estación cuatro se encontraron coberturas de porte medio y medio-alto, cerradas a semiabiertas, conformadas por arbustales densos entremezclados con árboles emergentes o pequeños relictos de bosques achaparrados con dosel discontinuo de 5-14 m de altura. Las especies dominantes son Weinmannia mariquitae, Diplostephium bicolor, D. cf. schultzii, Gaiadendron punctatum, Ageratina tinifolia, A. cf. popayanensis, Berberis sp., Brachyotum ledifolium, Clusia cf. alata, Miconia spp., Myrsine cf. panamensis, M. dependens, Escallonia myrtilloides, Clethra revoluta, Monnina angustata, Hesperomeles obtusifolia, H. ferruginea, Chusquea tessellata, Blechnum loxense, Temistoclesia cf. mucronata, Cavendishia cf. bracteata, Vaccinium floribundum, Rynchospora cf. caucana, Carex bonplandii y Poaceae (Neurolepis sp., Cortaderia sp.) (Anexo 11). Estas coberturas se encuentran moderada a altamente intervenidas, la topografía del terreno es levemente plana a quebrada, con pendientes bajas a medias. La E4 se ubicó en el área de influencia de una carretera que del corregimiento de la Herrera, va al páramo el Meridiano, el tramo de esta vía, posterior a la casa del predio el Auxilio es poco transitado (Figura 102). Estratos vegetales estación cuatro Las tres parcelas evaluadas presentaron una pendiente de 10-60%, con plantas entre <0,1 y 8 m, que conforman cuatro estratos vegetales, que se desciben a continuación: Rasante (<0,3 m): dominado por musgos (Sphagnum sp., Prionodon sp.), Disterigma empetrifolium, Pernettya postrata, Vaccinium floribundum, Nertera granatensis, helechos (Jamesonia alstonii, Elaphoglossum sp.) y licopodios (Lycopodium jussiaei). Herbáceo (0,3-1,5 m): dominado por pastos (Calamagrostis sp., Neurolepis sp., Cortaderia sp.), Rynchospora cf. caucana, Carex bonplandii, Chusquea tessellata, Rubus gachetensis y Disterigma cf. acuminatum. Arbustivo (1,5-5 m): dominado por Weinmannia mariquitae, Chusquea tessellata, Blechnum loxense, Diplostephium bicolor, D. cf. schultzii, Temistoclesia cf. mucronata, Vaccinium floribundum, Escallonia myrtilloides, Berberis sp., Gaiadendron punctatum, Monnina angustata, Oreopanax 192 tolimanum, Ageratina tinifolia, A. cf. popayanensis, Myrsine cf. panamensis, M. dependens, Brachyotum ledifolium, Hedyosmum cf. goudotianum, Miconia spp., Hesperomeles obtusifolia, y H. ferruguinea. Arbolitos (5-12 m): dominado por Clusia cf. alata, Weinmannia mariquitae, Escallonia myrtilloides, Myrsine cf. panamensis, Clethra revoluta (Figura 103). Figura 102. Herbazales y arbutales, área de influencia E4 (3280 m.s.n.m). Rioblanco (Tolima). 193 Figura 103. Diagrama de perfil de vegetación en la E4, parcela dos a 3280 m.s.n.m 1. Chusquea tesellata, 2. Erato vulcanica, 3. Oxalis medicaginea, 4. Plutarchia monantha, 5. Tillandsia sp., 6. Parathesis sp., 7. Cavendishia bracteata, 8. Myrsine dependens, 9. Nertera granatensis, 10. Parathesis sp., 11. Macrocarpa macrophylla, 12. Schefflera cf. uribei, 13. Prionodon sp., 14. Anthurium oxybelium, 15. Ocotea infrafoveolata, 16. Clethra revoluta, 17. Erato vulcanica, 18. Monnina angustata, 19. Rubus gachetensis, 20. Maytenus sp., 21. Prionodon sp. 22. Palicourea cf. andaluciana, 23 Clusia cf. alata, 24. Myrsine dependens, 25. Hedyosmum cf. goudotianum, 26. Weinmannia mariquitae, 27. Themistoclesia cf. mucronata, 28. Maytenus cf. sp., 29. Rubus gachetensis, 30. Pernettya postrata, 31. Cyathea sp.2, 32. Elaphoglossum sp., 33. Galium hipocarpium, 34. Miconia plethorica, 35. Rynchospora cf. caucana, 36. Gaiadendron punctatum, 37. Gynoxis cf. littlei, 38. Blechnum loxense, 39. Ageratina cf. popayanensis, 40. Ugny myricoides. Eje x, longitud del transecto (m); eje y, altura de la vegetación (m). Ilustración Yoao Palchukan (2015). 194 6.1.1.5 Estación cinco – E5 (3200 m.s.n.m) Se encontraron coberturas vegetales de porte medio y alto, cerradas, conformadas por bosques maduros y secundarios, en estados sucesionales intermedios a avanzados, con dosel más o menos continuo de hasta 15-20 m de altura. En esta cota, los bosques se observan continuos a lo largo de la franja de transición arbustal-bosque, especialmente hacia las quebradas, ríos y zonas de alta pendiente, topografía predominante en el área. En la composición de los bosques es notoria la abundancia de Freziera spp. y Weinmannia spp., sobre todo hacia los bordes. Se presenta un moderado a alto epifitismo con algunas especies de bromelias (Tillandsia stipitata, T. compacta), orquídeas (Pleurothallis spp., Stelis spp., Cyrtochilum sp, Epidendrum spp.) y anturios (Anthurium oxybelium). Las especies dominantes son Weinmannia mariquitae, W. rollotii, Freziera reticulata, F. canescens, F. cf. bonplandiana, Clethra ovalifolia, C. revoluta, Ocotea infrafoveolata, Axinaea macrophylla, Hedyosmum cf. cuatrecazanum, Saurauia ursina, Cythea sp., Brunellia spp., Miconia spp., Myrsine guianensis, Oreopanax discolor, Maytenus sp. y Schefflera cf. uribei (Anexo 11). Estas coberturas se encuentran moderada a levemente intervenidas, la topografía del terreno es quebrada a escarpada, con pendientes medias a altas (Figura 104). Estratos vegetales estación cinco Las tres parcelas evaluadas presentaron una pendiente superior de 30-90%, con plantas entre 0,6 y 19 m de altura, correspondientes a cuatro estratos vegetales que se describen a continuación: Rasante (<0,3 m): dominado por musgos (Sphagnum sp., Prionodon sp.) y helechos (Elaphoglossum sp.). Herbáceo (0,3-1,5 m): dominado por helechos (Thelypteris sp.) y Greigia sp. Arbustivo (1,5-5 m): dominado por pastos (Neurolepis sp.), chusque (Chusquea sp.), Anthurium oxybelium, Myrsine dependens, Clethra ovalifolia, Cavendishia cf. nitida, Piper cf. cyprium, Macrocarpaea macrophylla, Schefflera cf. uribei y Cyathea sp. Arbolitos (5-12 m): dominado Brunellia sp., Hedyosmum cf. cuatrecazanum, Freziera reticulata, F. canescens, F. cf. bonplandiana, Weinmannia mariquitae, W. 195 rollotii, Clethra ovalifolia, Myrsine guianensis, Axinaea macrophylla, Miconia plethorica, Oreopanax discolor, Ocotea infrafoveolata, Schefflera cf. uribei, Maytenus sp. Se presenta moderado a alto epifitismo de bromelias (Tillandsia stipitata, T. compacta), orquídeas (Pleurothallis spp., Stelis spp., Cyrtochilum sp, Epidendrum spp.) y Anthurium oxybelium). Arbóreo inferior (12-25 m): dominado por Weinmannia mariquitae, W. rollotii, Freziera reticulata, Maytenus sp., Axinaea macrophylla, Clethra revoluta, Ocotea infraveolata, Brunellia sp. y Myrsine guianensis (Figura 105). Figura 104. Interior de formación boscosa, área de influencia E5 (3200 m.s.n.m). Rioblanco (Tolima). 196 Figura 105. Perfil de vegetación boscosa en la E5, parcela dos a 3.200 m. 1. Cyathea sp., 2. Weinmannia mariquitae, 3. Oreopanax discolor, 4. Freziera cf. canescens, 5. Clethra ferruginea, 6. Weinmannia rollotii, 7. Brunellia sp., 8. Axinaea macrophylla, 9. Schefflera cf. uribei, 10. Anthurium oxybelium, 11. Myrsine guianensis, 12. Piper cf. cyprium, 13. Clethra ovalifolia, 14. Weinmannia mariquitae, 15. Maytenus sp. Eje x, longitud del transecto (m); eje y, altura de la vegetación (m). Ilustración Yoao Palchukan (2015). 197 6.1.1.6 Estación seis – E6 (3120 m.s.n.m) Se encontraron coberturas de porte medio y alto, cerradas, conformadas por bosques maduros y secundarios, en estados sucesionales intermedios a avanzados, con dosel moderadamente continuo de hasta 15-20 m de altura. En esta cota, los bosques empiezan a fragmentarse y a estar rodeados o divididos por quebradas, potreros, rastrojos o regeneraciones tempranas, dada la cercanía a áreas productivas. En la composición de los bosques es notoria la abundancia de Freziera spp. y Weinmannia spp., sobre todo hacia los bordes. Se presenta de moderado a alto epifitismo representado por bromelias (Tillandsia stipitata, T. compacta), orquídeas (Pleurothallis spp., Stelis spp., Cyrtochilum sp, Epidendrum spp.) y anturios (Anthurium oxybelium). Las especies dominantes son Weinmannia mariquitae, W. rollotii, Freziera reticulata, F. canescens, F. cf. bonplandiana, Clethra ovalifolia, C. revoluta, Ocotea infrafoveolata, Axinaea macrophylla, Hedyosmum cf. cuatrecazanum, Saurauia ursina, Cythea sp., Brunellia spp., Miconia spp., Myrsine guianensis, Oreopanax discolor, Maytenus spp. y Schefflera cf. uribei (Anexo 11). Estas coberturas se encuentran moderada a altamente intervenidas, la topografía del terreno es quebrada a escarpada, con pendientes medias a altas (Figura 106). Estratos vegetales estación seis Las tres parcelas evaluadas presentaron una pendiente superior de 30-90%, con plantas entre 0,7 y 19 m de altura, correspondientes a cuatro estratos vegetales, que se describen a continuación: Rasante (<0,3 m): dominado por musgos (Sphagnum sp., Prionodon sp.), Begonia sp., Nertera granatensis y helechos (Elaphoglossum sp., Blechnum sp.). Herbáceo (0.3-1.5 m): dominado por helechos (Thelypteris sp., Blechnum sp.), Tropaeolum sp., Columnea sp., Pilea sp., Notopleura sp. y Greigia sp. Arbustivo (1.5-5 m): dominado por Chusquea sp., Cythea sp., Cavendishia cf. nitida, Macleania rupestris, Piper cf. cyprium, Palicourea cf. andaluciana, Oreopanax discolor, O. cf. caricaefolium y Ribes leptostachyum. 198 Arbolitos (5-12 m): dominado por Hedyosmum cf. goudotianum), Axinaea macrophylla y Miconia spp., Oreopanax discolor, Schefflera cf. uribei, Cythea sp., Maytenus cf. myricoides, y Elaeagia sp. Se observó de alto a moderado epifitismo de bromelias (Tillandsia stipitata, T. compacta), orquídeas (Pleurothallis spp., Stelis spp., Cyrtochilum sp, Epidendrum spp.) y anturios (Anthurium cf. bogotensis). Arbóreo inferior (12-25 m): dominado por Weinmannia mariquitae, W. rollotii, Freziera reticulata, Maytenus cf. myricoides, Axinaea macrophylla, Miconia spp., Clethra revoluta, Oreopanax discolor, Schefflera cf. uribei, Brunellia sp. y Myrsine guianensis (Figura 107). Figura 106. Formaciones boscosas, área de influencia E6 (3120 m.s.n.m). Rioblanco (Tolima). 199 Figura 107. Perfil de vegetación boscosa en la E6, parcela tres a 3120 m.s.n.m. 1. Mikania sp., 2. Miconia sp. 2, 3. Chusquea sp., 4. Hedyosmum cf. goudotianum, 5. Solanum sp., 6. Palicourea ovalis, 7. Oreopanax cf. caricaefolium, 8. Oreopanax discolor, 9. Brunellia sp., 10. Axinaea macrophylla, 11. Cyathea sp., 12. Brunellia sp., 13. Cyathea sp., 14. Brunellia sp., 15. Saurauia ursina. Eje x, longitud del transecto (m); eje y, altura de la vegetación (m). Ilustración Yoao Palchukan (2015). 200 6.1.2 Representatividad de los muestreos El muestreo fue significativo en las seis estaciones, con valores mayores al 85%, para el estimador de riqueza de especies, Boostrap. En cuanto al estimador basado en la abundancia (Chao 1), E1, E2, E3, E4 y E5 fueron representativas con un 90%, 86%, 89%, 81% y 94% respectivamente, mientras que la estación E6 llegó al 57% de efectividad (Figura 108). 201 100 100 Observadas Chao 1 Bootstrap Observadas Chao 1 Bootstrap 80 60 Riqueza Riqueza 80 40 60 40 20 20 A A 0 0 1 2 B 0 0 3 1 2 Unidades de muestreo Unidades de muestreo 100 100 Observadas Chao 1 Bootstrap Observadas Chao 1 Bootstrap 80 60 Riqueza Riqueza 80 40 60 40 20 20 C 0 0 1 2 D 0 0 3 1 2 3 Unidades de muestreo Unidades de muestreo 100 100 Observadas Chao 1 Bootstrap 80 Observadas Chao 1 Bootstrap 80 60 Riqueza Riqueza 3 40 60 40 20 20 E 0 0 1 2 F 0 0 3 1 2 3 Unidades de muestreo Unidades de muestreo 100 E1 E2 E3 E4 E5 E6 Riqueza 80 60 40 20 G 0 0 1 2 3 Unidades de muestreo Figura 108. Curvas de acumulación de especies de la riqueza observada y la riqueza estimada por Bootstrap y Chao 1. A. E1 (3520 m.s.n.m), B. E2 (3440 m.s.n.m), C. E3 (3360 m.s.n.m), D. E4 (3280 m.s.n.m), E. E5 (3200 m.s.n.m), F. E6 (3120 m.s.n.m), G. Curvas con el estimador Chao 1 para cada estación. Rioblanco (Tolima). 202 6.1.3 Riqueza y composición florística La E4 tuvo la mayor representatividad en cuanto al número de especies (73), géneros (59), familias (38) e individuos (292), ya que es una zona donde se encontraron especies de arbustos y arbolitos, lo que permite obtener una configuración más compleja, logrando así una alta riqueza y abundancia de plantas. Las estaciones E5 y E6, presentaron la menor abundancia y riqueza vegetal en todo el transecto altitudinal, lo anterior, puede estar relacionado una notoria abundancia de Clethra ovalifolia, Myrsine guianensis, Weinmannia spp., Miconia spp. y Brunellia sp. (Figuras 109 y 110). Ninguna familia botánica presentó más de diez especies en el transecto, siendo Asteraceae y Ericaceae las que registraron el mayor número (10 cada una) en la estación E4, y posteriormente Melastomataceae, con 7 especies en la misma estación; el resto de las familias oscilaron entre dos y seis especies. Familias como Asteraceae y Ericaceae fueron representativas de la E1 a E4, ya que presentaron más de cuatro especies cada una. Otras familias como, Melastomataceae y Araliaceae tienen mayor representatividad con más de tres especies cada una en las dos estaciones más bajas del transecto (E5 y E6) (Figura 111). Especies Géneros Familias 80 70 Riqueza 60 50 40 30 20 10 0 Estaciones Figura 109. Riqueza y composición florística en el transecto de Rioblanco. 203 300 Abundacias 250 200 150 100 50 0 Estaciones Figura 110. Abundancia florística en el transecto de Rioblanco. 12 Riqueza 10 8 6 4 2 0 E1 (3520 m) E6 (3120 m) E2 (3440 m) E3 (3360 m) E4 (3280 m) E5 (3200 m) Familias por Estaciones Figura 111. Familias botánicas con mayor número de especies en las estaciones del transecto altitudinal de Rioblanco. 204 6.1.3.1 Diversidad Alfa () Los valores más altos de diversidad fueron arrojados en E4 y E2 con 4 y 3,36 respectivamente para Shannon-Wiener (H`) y de 0,98 y 0,96 para Simpson (S), estos altos niveles de diversidad probablemente se deben al número de especies (E4-73 y E2-40). En cuanto a los valores más bajos se encuentran las E5 y E6 con un índice H`= 2,84 y 2,85 respectivamente y con un índice S= 0,92 para ambas estaciones, donde se encontró igualmente un bajo número de especies (E5-26 y E6-25) (Tabla 51). En E4 y E2 las coberturas vegetales presentaron por una alta riqueza y diversidad de especies, con poca dominancia, y las E5 y E6 ubicadas en las zonas mas bajas del transecto altitudinal, presentaron baja riqueza y diversidad con alta dominancia de pocas especies, lo anterior, posiblemente por la moderada a alta intervención antrópica de estos sitios. Estos análisis se corroboraron por medio de una prueba t, que arrojó diferencias significativas entre las E1 y E2, con las E3-E6 (P< 0,05 en todos los casos), así también diferencias entre la E3 con la E4, y a su vez se diferencia con las E5 y E6. Es claro que no hay diferencias significativas entre las E1 y E2, ubicadas a mayor altitud en el transecto, ya que son similares en cuanto a su riqueza, y son diferentes al resto de altitudes (estaciones), lo mismo ocurrió con las E5 y E6 (Tabla 52). Tabla 51. Índice de Dominancia de Simpson (S) e Índice de Diversidad de ShannonWiener (H`) para las estaciones estudiadas en el transecto de Rio Blanco. Índices de Diversidad E1 E2 E3 E4 E5 E6 Simpson (Inverso) 0,95 0,96 0,94 0,98 0,92 0,92 Sannon-Wiener (ln) 3,20 3,36 3,02 4,00 2,84 2,85 Tabla 52. Prueba de t Índice de Diversidad de Shannon-Wiener (H`) para las estaciones estudiadas en el transecto de Rioblanco. E1 E1 (3520 m) E2 -1,9095 E3 E4 E5 E6 2,1574 -10,631 3,8626 3,6584 3,8007 -8,7473 5,4983 5,0587 -11,087 1,547 1,668 12,736 11,139 E2 (3440 m) 5,69E-02 E3 (3360 m) 3,18E-02 1,75E-04 E4 (3280 m) 1,61E-23 4,61E-17 E5 (3200 m) 1,39E-04 8,66E-08 0,12293 6,28E-29 E6 (3120 m) 0,00034904 1,23E-06 0,096963 1,2165E-20 1,02E-23 205 0,29172 0,77082 6.1.3.2 Diversidad beta () Los índices de similitud de Sorensen, Bray-Curtis y Jaccard, formaron dos grupos, uno con las E1 a E4, con un 40% de similitud (Sorensen), 35% (Bray-Curtis) y 26% (Jaccard); y un segundo grupo, con las E5 y E6, similares en un 58% (Sorensen), 30% (Bray-Curtis) y 42% (Jaccard) (Figura 112). Los resultados arrojados por el diferente manera las estaciones, 60% (Figura 111 B), a diferencia encuentran relación en las E1 y 112 A y C). índice de similitud de Bray-Curtis, agrupan de estableciendo similitudes en las E2 y E3 con un de los demás análisis (Sorensen y Jaccard) que E2 con un 68% y 50% respectivamente (Figura Los tres índices de similitud muestran dos grupos claros que están relacionados con las estaciones de la parte alta del transecto (E1 a E4) y las estaciones de formaciones boscosas de la parte baja del transecto (E5 y E6), que tienen un corte de similitud de 37% (Sorensen), 29% (Bray-Curtis) y 24% (Jaccard). En síntesis, los bajos niveles de similitud entre las parejas de elevaciones parecen sugerir afinidades por proximidad más que debidas al parámetro analizado. Las mayores afinidades se evidencian en las E1 y E2 con un 68% (Sorensen) y en las estaciones E5 y E6 con un 58% (Jaccard); tal vez estos resultados se deban a la dominancia que presentan algunas especies en estas estaciones. En contraste, las estaciones subsiguientes parecen tener relaciones menos estrechas entre sí. 206 Figura 112. Índices de similitud para la vegetación, A. Sorensen, B. Bray-Curtis y C. Jaccard. Rioblanco (Tolima). Índice de Whittaker De acuerdo con este índice, E1, E2, E3 y E4 difieren en más del 78% con E5 y E6; particularmente, la E3 diverge en un 100% de la E6 (Tabla 53), es decir que la composición de especies entre estos sitios no es compartida ya que a medida que aumenta la distancia entre los ensamblajes disminuye la similitud. Por otro lado, las E1 y E2 solo se complementan en 33% y las estaciones E2 y E3 en un 36% (Tabla 53), debido a las especies en común, apoyando los resultados de los análisis anteriores. 207 Tabla 53. Índice de Whittaker para el transecto ubicado en Rioblanco. E1 E1 (3520 m) 0 E2 (3440 m) E3 (3360 m) E4 (3280 m) E5 (3200 m) E6 (3120 m) 0,33 0,43 0,59 0,90 0,97 E2 E3 E4 E5 E6 0 0,36 0,57 0,94 0,97 0 0,62 0,97 1,00 0 0,78 0,90 0 0,41 0 6.1.4 Estratos de la vegetación Los estratos herbáceo y rasante fueron los predominantes en E1, E2, E3 y E4, ubicadas a mayor altitud en el transecto (E1 3520 m y E4 3280 m); en menor porcentaje también se presentó el estrato arbustivo. Este último tuvo una mayor representación en las dos estaciones más bajas (E5 y E6), en donde se empiezan a registrar arbolitos, siendo menor su porcentaje de especies, a medida que disminuyó la elevación, caso contrario sucede con los árboles, que aumentaron a medida que disminuyó la altitud (Figura 113). 70 Arbóreo Porcentaje de individuos 60 Arbolitos 50 40 Arbustivo 30 Herbáceo 20 Rasante 10 0 Estaciones Figura 113. Distribución de individuos según estratos vegetales por estación, en el transecto de Rioblanco. 6.1.5 Índice de Valor de Importancia (IVI) La dominancia relativa para todo el transecto fue variable, menos en E4, para las demás estaciones sobresalen en dominancia especies como, Brunellia sp. (E6), C. 208 tessellata (E3) y B. loxense (E1), que además son las que presentaron mayores valores de IVI en cada estación, con 49,26, 41,83 y 37,57 respectivamente (Figura 114, Tablas 54 y 55) . Para la densidad relativa E5 y E6, son destacadas por las especies W. mariquitae (E5), Miconia sp. 2 y Brunellia sp. (E6), las cuales forman poblaciones sobresalientes en estas alturas (3200 y 3120 m.). E1, E2, E3 y E4, presentan densidades constantes pero dominancias variables que definen sus posiciones en el IVI. En cuanto las frecuencias relativas permanecen más o menos constantes en todas las estaciones (Figura 114). En E1 a E4, además de B. loxense se destacaron especies como Prionodon sp., Calamagrostis sp., C. tessellata y J. alstonii. Algunas de las especies mencionadas son rasantes, hierbas y arbustos características de formaciones vegetales paramunas (Cuatrecasas 1958, Cleef 1980). G. punctatum y L. jussiaei, fueron especies con un alto valor de IVI, que se encontraron con mayor número de individuos en la E2, J. alstonii y D. cf. schultzii se encuentran en la E3 con mayor densidad, por último, especies como R. cf. caucana, D. cf. acuminatum y B. lindenii se registraron en la E4 de igual manera con mayor densidad (Tabla 54). Tabla 54. Especies con mayor Índice de Valor de Importancia en las E1 a E4, transecto altitudinal Rioblanco (Tolima). Familia Blechnaceae Prionodontaceae Primulaceae Rosaceae Poaceae Poaceae Loranthaceae Lycopodiaceae Pteridaceae Asteraceae Cyperaceae Ericaceae Melastomataceae Especie B. loxense Prionodon sp. M. cf. panamensis H. obtusifolia C. tessellata Calamagrostis sp. G. punctatum L. jussiaei J. alstonii D. cf. schultzii R. cf. caucana D. cf. acuminatum B. lindenii Estaciones IVI/E1 IVI/E2 IVI/E3 IVI/E4 37,57 33,81 36,64 30,69 13,81 18,27 17 15,57 23,38 41,83 12,99 28,73 23,8 16,46 15,37 32,16 26,16 13,39 13,08 11,88 En las tres estaciones más bajas (E4 a E6) ubicadas en coberturas boscosas, es muy variable la dominancia, la densidad y la frecuencia relativa (Figura 113); las especies que presentaron mayores valores de IVI fueron Brunellia sp. con 49,25 (E6) y 23,62 (E5); esto debido su alta dominancia (E6-30,75 y E5-13,38); y en la E5 W. mariquitae con 48,17 explicado igualmente por su considerable dominancia de 22,17% (Figura 113). 209 Tabla 55. Especies con mayor Índice de Valor de Importancia en E5 y E6 del transecto de Rioblanco (Tolima). Familia Brunelliaceae Melastomataceae Cyatheaceae Pentaphylacaceae Araliaceae Cunoniaceae Celastraceae Primulaceae Clethraceae 60 Densidad relativa Estaciones Especie IVI/E5 23,62 Brunellia sp. Miconia sp. 2 Cyathea sp. F. reticulata S. cf. uribei W. mariquitae Maytenus sp. M. guianensis C. ovalifolia IVI/E6 49,26 38,57 23,20 21,88 21,36 48,17 21,64 21,38 20,72 Frecuencia relativa Dominancia relativa 50 I.V.I 40 30 20 10 0 E1 (3520 m) E2 (3440 m) E3 (3360 m) E4 (3280 m) E5 (3200 m) E6 (3120 m) Especies Figura 114. Especies que presentaron el mayor valor en el Índice de Valor de Importancia (IVI). Rioblanco (Tolima). 210 6.1.6 Conclusiones vegetación Rioblanco Para las cuatro estaciones ubicadas a mayor altitud (3.520 a 3.280 m), predominaron estratos vegetales rasante y herbáceo y en las dos estaciones ubicadas a menor altitud (entre 3.200 y 3.120 m) predominaron estratos vegetales de arbolitos, arbustos y árboles. Lo anterior indica que a partir de E5, ubicada a 3.200 m de altitud, la composición, diversidad y estratos vegetales cambiaron. Igualmente, se evidenció un recambio de especies según el índice de Whittaker. El estrato vegetal rasante, compuesto por formas de crecimiento como rosetas y talófita-líquen, sólo se encontró en las cuatro primeras estaciones. El estrato vegetal de arbustos se presentó en todas las estaciones, sin embargo, su mayor abundancia se encontró en las estaciones E5 y E6. Las estaciones E1-E4 presentan dominancia de especies arbustivas y leñosas de porte bajo y medio, que conforman un páramo bajo por dispersión y colonización en sitios de topografía quebrada y escarpada con alta heterogeneidad. Hacia las estaciones E3 - E4 se presenta la zona de transición de páramo a bosque, franja en la cual se pueden presentar también zonas de páramo medio con herbazal-frailejonal, aunque son azonales hacia esta cota comprendida entre las E3 – E4. 6.2 EDAFOFAUNA 6.2.1 Riqueza y composición de especies en el transecto altitudinal Se colectaron 861 individuos los cuales se clasificaron dentro de 83 morfoespecies, distribuidas en 11 órdenes y aproximadamente 39 familias. La morfoespecie con mayor número de individuos fue el grillo del género Gryllus sp.2 con 125 individuos, seguida por una cochinilla (Isopoda sp.4) con 104 individuos, un coleóptero Bembidion sp.22 con 90, otro escarabajo Staphylinidae sp.3 con 52, un hemíptero Cercopidae sp.76 con 48 individuos y finalmente una araña Araneae sp.18 con 39 individuos. El resto de morfoespecies presentan menos de 30 individuos (Anexo 12). Por su parte, la morfoespecie Gryllus sp.2 perteneciente a la familia Gryllidae, fue la más abundante en todo el transecto, resultado que se repitió igualmente en los transectos realizados en Tuluá, Sevilla y Palmira (del presente estudio). Por otro lado se pudo percibir una dominancia en las estaciones bajas, mostrando una preferencia y una alta dominancia en toda la zona de estudio (Anexo 12). 211 Sandoval y Fagua (2006) observaron que la riqueza y la diversidad de ortópteros disminuye a medida que aumenta la altitud, relacionando este comportamiento con la reducción de la diversidad y disponibilidad de recursos vegetales en altitudes superiores. Lo cual nos puede estar mostrando una buena disposición de recursos a lo largo de todo el gradiente. Los órdenes más numerosos fueron: Coleoptera con 32 morfoespecies, seguidos por Diptera con 22, Hymenoptera con 7 y Araneae con 6, los demás órdenes presentaron entre cuatro y una morfoespecies (Figura 115). Para el análisis se dio prioridad sobre los órdenes Coleoptera y Diptera, por ser los más abundantes y los que han generado más estudios de edafofauna a nivel mundial; dados todos los procesos en los que participan en el ecosistema, en especial su acción depredadora sobre otras especies (Figura 115). 14 Coleoptera No de morfoespecies 12 Diptera 10 8 6 4 2 0 E1 E1* E2 E2* E3 E3* E4 E4* E5 Estaciones altitudinales E5* E6 E6* Figura 115. Número de especies de los dos órdenes más ricos de la edafofauna presente en seis estaciones de muestreo, transecto Ríoblanco (Tolima). *Estaciones de la segunda réplica de muestreo para el mismo transecto (ambas en temporada lluviosa). Se pudo observar que la tendencia general en el orden díptera, es a disminuir a medida que se desciende en altitud (exceptuando en E4), comportamiento que posiblemente está ligado a los cambios en la composición de la vegetación de cada nivel altitudinal. Otra posibilidad es que la abundancia y distribución local de los morfos de Diptera encontrados, posiblemente estén reflejando la dinámica hidrológica de las vegas, particularmente hablando de aquéllas morfoespecies cuyos ciclos biológicos estén asociados a la existencia de acumulaciones superficiales de agua (Cepeda et al. 2006). De igual forma se pudo observar morfoespecies del orden díptera asociadas a las dos primeras estaciones, como muscoidea sp.122, presente sólo en la estación uno. Igualmente una especie de tábano (Tabanidae sp.95) se encontró 212 únicamente en la estación dos, a diferencia del tábano más abundante en la zona (Dicladocera macula), el cual se encontró desde la estación cuatro hasta la última estación (E6). Así mismo un taquínido (Tachinidae sp.5) se reportó únicamente en la estación E6, siguiendo la tendencia de este grupo a presentarse en altitudes inferiores a los 3360 m.s.n.m. El resto de morfoespecies son generalistas a las cuatro estaciones posteriores a la estación dos (p. ej. E3, E4, E5 y E6) Coleoptera por su parte es un grupo megadiverso a nivel mundial y abundante en la zona de estudio, lo cual se comprueba al ser el orden que más familias suma al listado total de especies en los cuatro transectos evaluados para el complejo de páramos Las Hermosas. Resaltan los morfos Coleoptera sp.33, Chrysomelidae sp.85 y Erotylidae sp.107, por presentarse únicamente en la primera estación (Anexo 12). De estos se sabe que los Chrysomelidos presentan preferencias por tierras altas (Sánchez-Reyes et al. 2014). Riqueza de Carabidae en las estaciones altitudinales Se colectaron seis morfoespecies de la familia Carabidae, el cual es un porcentaje alto frente riqueza de especies de otras familias del orden Coleóptera. Tanto la composición como la distribución de las especies de la familia Carabidae varían en la medida que se asciende a lo largo de un gradiente altitudinal; las especies encontradas en el perfil caracterizan un ecosistema natural en particular, debido al alto grado de especiación alopátrica y de endemismos del neotrópico (Camero y Chamorro 1999). En ese sentido, se observó en este transecto una tendencia al aumento de la riqueza de especies con la disminución de la altura, seguido de un aumento de la abundancia de algunas especies, apoyando esta teoría (Figuras 116 y 117) 7 Abundancia neta 6 5 4 3 2 1 0 1 (3520) 2 (3440) 3 (3360) 4 (3280) 5 (3200) 6 (3120) Estaciones altitudinales Figura 116. Abundancia neta de especies de la familia Carabidae, a través del gradiente altitudinal muestreado, transecto Ríoblanco (Tolima). 213 Por su parte, el género Bembidion sp.22 de la tribu Bembidiini, se presenta exclusivamente en las dos estaciones más bajas del transecto (Figura 116, Anexo 13). Este morfo ha presentado un comportamiento consistente, demostrando su eficacia como herramienta para evaluar los recambios altitudinales de los ecosistemas altoandinos evaluados. Igualmente especies como Bradycellus sp.1 y Carabidae sp.114, tendieron al aumento desde E2 hacia E6; Carabidae sp.11 y Carabidae sp.116 se presentaron únicamente en las dos estaciones intermedias E3 y E4; y Dercylus sp. 21 se observó generalista, con bajas densidades a lo largo del gradiente (Figura 116). 16 No de individuos 14 12 10 ** Bradycellus sp.1 Carabidae sp11 Dercylus sp. 21 Bembidion sp. 22 Carabidae sp.114 Carabidae sp.116 ** 8 6 4 2 0 1 (3520) 1* 2 (3440) 2* 3 (3360) 3* 4 (3280) 4* 5 (3200) 5* 6 (3120) 6* Estaciones altitudinales Figura 117. Abundancia de seis morfoespecies de carábidos con preferencias altitudinales presentes en seis estaciones de muestreo, transecto Ríoblanco (Tolima). *Estaciones de la segunda réplica de muestreo en el mismo transecto altitudinal ** Para esta especie el número de indivíduos se dividió sobre tres (N/3) en E6 y en E6*, para facilitar las comparaciones. Es de resaltar la riqueza de la familia caradidae, tanto por el número de especies, como por sus preferencias altitudinales, mostrando mayor riqueza a medida que se deciende en altitud. Además de un cambio significativo en el número de especies con la altitud, hay un alto grado de especificidad de sitio, lo que sugiere preferencias para altitudes específicas para la mayoría de especies de escarabajos carábidos (Maveety et al. 2011). Estos patrones podrían explotarse para posteriores estudios altitudinales en estos ecosistemas altoandinos. 214 6.2.1.1 Diversidad alfa Representatividad y esfuerzo de muestreo Se calculó que el muestreo tuvo una representatividad en general de entre 47% según el índice de abundancia Chao1 y 51% según el índice de incidencia Chao2. Ambas curvas de acumulación de especies muestran tendencia a seguir creciendo, pero se observa mucho más acentuada en la curva Chao2, prediciendo que se pueden seguir encontrando morfos, en la medida que se realicen más muestreos en la zona. Las especies que se encuentran con un solo indivíduo (Singletons) y con dos indivíduos (Doubletons), apoyan el resultado, al mostrar su amplia separación y la divergencia de ambas curvas (Figura 118, esquema de la parte superior). 300 Transecto No de morfoespecies 250 S(est) Singletons Mean Doubletons Mean Chao 2 Mean Chao 1 Mean 200 150 100 50 0 0 1 2 3 4 Estaciones altitudinales 215 5 6 No de morfoespecies E1 E1* 60 70 50 60 50 40 40 30 30 20 20 10 10 0 0 0 5 10 0 E2 5 10 E2* 20 70 No de morfoespecies 60 50 40 10 30 20 10 0 0 0 5 10 0 E3 5 10 E3* 60 40 No de morfoespecies 50 30 40 30 20 20 10 10 0 0 0 5 10 0 216 5 10 E4 E4* 70 No de morfoespecies 50 60 40 50 30 40 30 20 20 10 10 0 0 0 5 0 10 E5 5 10 E5* 35 25 30 20 No de morfoespecies 25 20 15 15 10 10 5 5 0 0 0 5 10 0 217 5 10 E6 90 E6* 50 80 40 No de morfoespecies 70 60 30 50 40 20 30 20 10 10 0 0 0 5 0 10 5 10 Unidades de muestreo Unidades de muestreo Figura 118. Curvas de acumulación de especies para la Edafofauna epígea realizada para las seis estaciones de muestreo, transecto Ríoblanco (Tolima). *Estaciones de la segunda réplica de muestreo en el mismo transecto altitudinal, ambas en epoca climática lluviosa La abundancia Chao1 y la incidencia Chao2, en general sobreestima la riqueza de especies, pero ambos muestran curvas que tienden a la asíntota (exceptuando E4). Chao2 estima muestreos muy pobres, a excepción de E5, donde la colecta alcanzó el 92%. El resto de estaciones presentaron muestreo por debajo del 60% (E1: 55%, E2: 37%, E3: 55%, E4:49% y E6: 56%), lo cual es bajo comparado con los demás transectos realizados. Riqueza y abundancia de especies por estación altitudinal Se observó que la riqueza y la abundancia aumentan con la disminución altitudinal, excepto en la estación E5, donde el bajo número de especies se podría explicar con el buen porcentaje de muestreo calculado con Chao2 (Figura 118) y la alta diversidad Shannon (Tabla 56). La franja altitudinal más rica en especies y abundante fue E6 (3120 m.s.n.m), de forma inversa las más pobre E2 (3440 m.s.n.m) y la menos abundante E1 (3520 m.s.n.m) (Tabla 56 y Figura 119). 218 Tabla 56. Diversidad Alfa en Edafofauna epígea de seis estaciones altitudinales, transecto Ríoblanco (Tolima). Estación Altitudinal Shannon H Simpson 1-D Riqueza Abundancia E1 2,923 0,9268 25 52 E2 2,071 0,7742 17 62 E3 2,964 0,8964 35 95 E4 2,779 0,8982 30 100 E5 2,832 0,9131 27 109 E6 2,961 0,9144 47 443 Riqueza Abundancia 50 250 40 200 No de indivíduos No de morfoespecies 45 35 30 25 20 15 10 150 100 50 5 0 0 1 2 3 4 5 6 (3520) (3440) (3360) (3280) (3200) (3120) 1 2 3 4 5 6 (3520) (3440) (3360) (3280) (3200) (3120) Estaciones altitudinales Estaciones altitudinales Figura 119. Riqueza y abundancia relativa de especies de Edafofauna, en seis estaciones altitudinales, transecto Ríoblanco (Tolima). Índices Shannon y Simpson La diversidad presenta un comportamiento sinusoide entre estaciones, lo cual podría tener más explicación por las condiciones de los sitios de muestreo y la baja eficiencia del muestreo realizado (Camero 2003), que por un efecto de la altitud. Según el índice Shannon, E3 (3540 m) fue la estación más diversa, más rica en especies y con las más altas dominancias. Esta estación presentó valores semejantes a los de las dos estaciones contiguas (E2 y E3), pero difirieron de las dos últimas (E4 y E5), las cuales presentaron los valores más bajos del muestreo 219 (Tabla 56). La prueba t mostró diferencias significativas entre estaciones, principalmente de E6, E1 y E2 (Tabla 57). Principalmente se observó que E6 es diferente del resto de estaciones altitudinales, mostrando un claro cambio de diversidad desde los 3200 a los 3120 m.s.n.m Tabla 57. Valores t student y P valor para las medias de la riqueza observada en cada estación altitudinal, transecto Ríoblanco (Tolima). Estaciones E1 E1 E2 E3 E4 E5 E6 -0,442 -1,922 -1,891 -2,471 -3,357 -2,368 -1,145 -1,970 -3,252 -0,149 -0,735 -3,015 -0,271 -2,889 E2 P: 0,659 E3 P: 0,058 P: 0,020 E4 P: 0,062 P: 0,255 P: 0,881 E5 P: 0,015 P: 0,052 P: 0,463 P: 0,787 E6 P: 0,001 P: 0,001 P: 0,003 P: 0,001 -3,318 P: 0,001 *Los números subrayados presentan diferencias significativas. Comportamiento de la diversidad a lo largo del gradiente altitudinal Tradicionalmente, el análisis de la biodiversidad ha sido cuantificar el número o riqueza de especies en una determinada área geográfica, relacionando la diversidad con factores biológicos (e.g., selección r-K) y ecológicos como la latitud (Brown & Lomolino 1998). Otros factores como la heterogeneidad del hábitat, la competencia y la depredación, afectan directamente los patrones ecológicos en un lugar determinado. Dentro de la variación altitudinal de la fauna, la relación existente entre la riqueza de especies y la elevación es un patrón ecológico frecuentemente documentado, además de polémico, debido a que generalizaciones o explicaciones universales del fenómeno no han podido ser desarrolladas (Sandoval y Fagua 2006). Rahbek (1995) atribuye este fenómeno a que el comportamiento de la curva de riqueza de especies es muy variado, ya que puede diferir entre taxones idénticos o disímiles y cambiar local o regionalmente, lo que puede darnos una idea de porque se dieron estos resultados de los índices ecológicos entre estaciones. Aunque según la regla de rappaport se espera que las primeras estaciones sean menos diversas que las últimas, resalta que el comportamiento no es continuo en el gradiente altitudinal. La gran diversidad de E1, propia de pisos altitudinales menos afectados por la altura como E6, posiblemente sea un reflejo de la estructura vegetal y del estado de conservación de las zonas altas, más que un efecto directo de la altitud. De igual forma está implícita la influencia de la alta 220 heterogeneidad macroespacial y microespacial de estos ecosistemas altoandinos (Amat y Vargas 1991). Rangos de abundancia Para el análisis de todo el transecto se determinaron cuatro abundantes (aquellas observadas en las seis estaciones), 25 (observadas entre cinco, cuatro y tres estaciones), 11 como (observadas en dos estaciones) y 43 especies como escasas observadas una sola vez) (Figura 120). especies como como comunes poco comunes (las que fueron Estos rangos están mostrando un elevado porcentaje de especies escasas (52%) frente al número total de especies determinadas en el muestreo. Este porcentaje muestra que más de la mitad de especies en estos dos eventos de muestreo son particulares de una estación altitudinal, son poco abundantes y restringidos a estos ecosistemas altoandinos como en los otros transectos evaluados. Esta situación nos da una alerta y nos muestra la vulnerabilidad de la fauna altoandina, especialmente a elevaciones pertenecientes a páramo. 7 Estación / incidencia 6 5 4 3 2 1 Carabidae sp.116 Reduviidae sp.89 Muscoidea sp.113 Erotylidae sp.107 Ichneumonidae sp.104 Hymenoptera sp.98 Calliphoridae sp.101 Tabanidae sp.95 Dicladocera macula Chrysomelidae sp.85 Ichneumonidae sp.88 Empididae sp.82 Cercopidae sp.79 Cercopidae sp.76 Araneae sp.55 Cyrtacanthacridinae sp.61 Phoridae sp.49 Acrididae sp.52 Gryllidae sp.43 Forficulidae sp.39 Coleoptera sp.33 Phengodidae sp.27 Muscidae sp.16 Opilionida sp.20 Phoridae sp.8 Araneae sp.12 Isopoda sp.4 Bradycellus sp.1 0 Morfoespecies Figura 120. Curvas de diversidad-dominancia de las morfoespecies de edafofauna epígea, transecto Rioblanco (Tolima). En cuanto a los rangos de abundancia por estación altitudinal, no se observaron especies generalistas, es decir, aquellas presentes en las 20 trampas de caída usadas en las dos réplicas. Además se observa que las mayores incidencias se 221 presentan por debajo de las cinco estaciones altitudinales, teniendo su punto máximo en una sola estación altitudinal (Figura 121), corroborando la alta presencia de especies únicas observada en la Figura 120. Figura 121. Curvas de diversidad-dominancia de las morfoespecies de Edafofauna Epígea colectadas en seis estaciones muestreadas, transecto Riblanco (Tolima). Nota: Los números pertenecen al código de cada especie que se encuentran en el Anexo 12. 6.2.1.2 Recambio de especies (diversidad β) Índice de Whittaker En cuanto al análisis de recambio de especies con Whittaker, se observan bajos porcentajes de recambio entre estaciones altitudinales (de una estación a la siguiente). Posiblemente un punto de cambio, aunque poco perceptible, sea el que se da en el paso de E2 a E3, el resto de valores tiende a ser muy semejantes como para sugerir tendencias (Tabla 58). Tabla 58. Recambio entre pares de estaciones altitudinales según Whittaker Estaciones altitudinales E1 E2 E3 E4 E5 E1 E2 E3 E4 E5 E6 0 0,57 0,57 0,60 0,54 0,61 0 0,62 0,53 0,59 0,69 0 0,51 0,42 0,56 0 0,58 0,56 0 0,43 222 Análisis de disimilitud SIMPER (Bray-Curtis) Los porcentajes de disimilitud por medio del análisis SIMPER (Bray-Curtis), muestran resultados semejantes a los de Whittaker. Las diferencias son muy bajas entre contrastes de estaciones (Tabla 59), pero se observa alguna pequeña diferencia entre las tres primeras estaciones (paso de E1 a E2 y de E2 a E3) (Tabla 59, resaltados). Tabla 59. Porcentaje de disimilitud entre pares de alturas por medio del análisis SIMPER, transecto Ríoblanco (Tolima). Estaciones altitudinales E1 E2 E3 E4 E5 E2 E3 57% 57% 62% E4 60% 53% 51% E5 54% 59% 42% 42% E6 61% 69% 56% 56% 43% Análisis de agrupamiento (Jaccard y Sorensen-Dice) El análisis de conglomerados (Cluster) con el índice de Jaccard, sugiere un grupo (o zona) conformado por cuatro estaciones y dos altitudes que se separan por su composición de especies, segregando las estaciones así: una primera zona en E1, la segunda formada por E3-E5-E6, una tercera en E4 y una cuarta en E2 (Figura 122 A). No obstante, estas segregaciones presentaron un bajo porcentaje de similitud (33%), lo que disminuye la confianza en los grupos generados. Por su parte el índice Sorensen-Dice, genera una mayor solidez de los grupos sugeridos por Jaccard, mostrando una similitud del 50% entre el grupo formado por las estaciones E3-E5-E6, separándolos del resto de estaciones (Figura 122 B) La alta similitud obtenida en la composición de especies puede explicarse por la elevada movilidad y ámbito de hogar que poseen la mayoría de especies de pompílidos en relación a la búsqueda de hembras y presas 223 Similarity 0,96 0,80 0,64 0,48 0,32 A. E1 (3520) E5 (3200) E3 (3360) E6 (3120) E4 (3280) E2 (3440) Similarity 0,96 0,80 0,64 0,48 E1 (3520) E5 (3200) E3 (3360) E6 (3120) E4 (3280) E2 (3440) B. Figura 122. Clúster de similitud (Jaccard) de la edafofauna epígea presente en las seis estaciones de muestreo, transecto Ríoblanco (Tolima). A. Jaccard, B. Sorensen-Dice. Nota: La línea negra muestra el punto de corte. Si bien el porcentaje de similitud es bajo, es muy posible que los pequeños cambios en composición presentes entre estaciones nos estén mostrando una 224 tendencia de recambio (ecotono), desde la segunda estación, hacia las estaciones más bajas, permitiéndonos suponer que se trate de comunidades diferentes. Agrupamiento de las estaciones Como se pudo observar, la diversidad beta no refleja claramente asociaciones entre estaciones altitudinales. Los índices de diversidad mostraron ser altamente homogéneos, describiendo cambios poco marcados entre estaciones, mostrando más una ecoclina que zonas de transición entre un ecosistema y otro. Como resultado, los índices se segregan con una similitud débil entre las seis estaciones altitudinales esquematizadas en los clusters Jaccard y Sorensen (Figura 122) Las estaciones E1 y E2 a pesar de estar contiguas y con microhábitats semejantes, comparten un bajo porcentaje de especies (31%). Posteriormente se presenta un pequeño cambio entre E2 y E3, que nos da una pequeña margen de cambio, igual a lo ocurrido en el muestreo de herpetofauna, donde las dos primeras estaciones comparten todas sus cuatro especies. Se ha demostrado que la estructura y composición de la vegetación a lo largo de un gradiente, son las que determinan la composición de algunos artrópodos (p.ej. Sandoval y Fagua 2006). En este sentido la caracterización vegetal muestra semejanzas en los perfiles de altura de las estaciones E1 y E2, seguido de E3, donde ya se observa una disminución en la altura de los estratos vegetales. Con lo que se determina esa primera zona de recambio de E2 a E3, así la diversidad beta no haya sido tan determinante. El resto de estaciones (de E3 a E6) no muestra cambios evidentes en composición de edafofauna (con los análisis realizados). Seguramente desde E3, el cual presenta un herbazal-arbustal de Chusquea tesellada con Calamagrostis sp., bajo, semidenso a abierto (≤ 3m), este último dando una zona de transición, ya que en las estaciones consecutivamente inferiores los estratos estuvieron por encima de los 7 metros. 6.2.2 Hábitos ecológicos Los principales artrópodos depredadores pertenecen a las clases Insecta (14 morfos) y Arachnida (seis morfos). En este transecto encontramos que 30% de las familias de artrópodos colectadas presentan un hábito alimenticio herbívoro, seguidos por artrópodos con hábitos principalmente depredadores los cuales constituyeron el 24%, omnívoros con 5%, parásitos-parasitoides 17% y finalmente un 12% para otras estratégias alimenticias (saprófitos, detritívoros y carroñeros). Respecto a los descomponedores, la descomposición y el ciclaje de nutrientes están regulados por factores fisicoquímicos ambientales, la calidad del sustrato y la comunidad de estos organismos (Joffre y Ǻgren 2001). Esta función ecológica está principalmente representada por la microbiota (hongos y bacterias) y la fauna edáfica (artrópodos). 225 Se observaron proporciones semejantes entre depredadores y herbívoros, específicamente, se observó que ambos grupos aumentan drásticamente en abundancia después de la segunda estación altitudinal hasta la última. Esto sugiere que a media que cambia la altitud, la proporción de los diferentes grupos puede variar y por tanto también su participación en los procesos ecológicos, entre otros procesos edáficos. No obstante, este resultado también podría ser una consecuencia directa del tipo de muestreo empleado para colectar edafofuna. Sin embargo hacen falta más estudios a nivel de grupos funcionales, incluso en gradientes altitudinales, para establecer estos cambios, pues en términos globales se sabe que la abundancia de la edafofauna disminuye con la altitud (Leaky y Proctor 1987). Por último, es importante saber que aunque las especies son el resultado de la interacción entre el genoma y el ambiente (Brussaard 1998). Ya que en ecosistemas de alta montaña no se conoce cuál es realmente la importancia y el papel que cumple la fauna edáfica como reguladora del proceso de descomposición de la materia orgánica del suelo, ni tampoco se conoce la variedad de grupos taxonómicos que esta fauna (diversidad), la información que aporta este proyecto es de vital importancia para el entendimiento de estos procesos en los ecosistemas altoandinos. 6.2.3 CONCLUSIONES La riqueza fue 19 especies mayor que las reportadas para el transecto realizado en Tuluá, donde también se realizaron dos eventos de muestreo sobre el mismo transecto; lo que demuestra la alta riqueza de esta zona. Se recolectaron seis morfoespecies de la familia Carabidae, riqueza alta frente a las especies de coleópteros de otras familias del grupo. Este grupo presentó una tendencia al aumento en riqueza de especies con la disminución de la altura. Las grupos tróficos fueron proporcionalmente semejantes entre transectos, mostrando consistencia en los sitios evaluados para el complejo de páramos Las Hermosas. En el complejo de páramos Las Hermosas, los principales artrópodos componentes de la fauna edáfica son los herbívoros, seguidos por los de hábito depredador. Tanto la riqueza como la abundancia aumentaron a medida que disminuyó la elevación. No se presentaron especies generalistas en todo el transecto, por el contrario si, una alta presencia de especies únicas. 226 Se establecieron tres grupos altitudinales separados según la composición presente en las cinco estaciones altitudinales: uno formado por E1, el segundo formado por E3-E5 y E6, el tercero por E4 y E2. 6.3 ANFIBIOS 6.3.1 Riqueza y composición de especies En el transecto altitudinal de Rioblanco se registraron un total de 132 individuos (73 Adultos y 59 Juveniles) que se agrupan en seis especies de anuros de dos familias taxonómicas. Tres especies fueron catalogadas como abundantes de acuerdo al índice de abundancia relativa. Sin embargo, esto cambia entre estaciones. En E1, Pristimantis obmutescens es la más abundante junto con P. peraticus. La segunda especie también es abundante en E4 y E5. Luego, en E6 la especie más abundante fue P. leptolophus (Tabla 60). De las especies observadas se colectaron algunos individuos que pasaran a ser voucher del estudio en el transecto de Rioblanco, Tolima (Anexo 13). También serán usadas para obtener de ellos tejido y con esto complementar la investigación a través de estudios genéticos por parte del Instituto Humboldt. Finalmente también serán usadas para confirmar identidades taxonómicas. Entre las especies observadas, solo una está catalogada como casi amenazada (NT), de acuerdo a la lista roja de especies amenazadas, versión 2014.3 (IUCN 2014). Además, teniendo en cuenta el tipo de ecosistema en el que habitan estas ranas y el aislamiento por grandes barreras geográficas, podemos identificar la restringida distribución de las especies que fueron registradas para el estudio. De las especies observadas, cuatro son endémicas para Colombia, específicamente para la cordillera Central (Castro et al. 2004 a, c, d, e; Yánez-Muñoz et al. 2010, en www.iucnredlist.org, versión 2014.3, consultada en 11/05/2015; Acosta 2015, en www.batrachia.com, consultada 15/04/2015) (Tabla 61). Tabla 60. Riqueza, abundancia y abundancia relativa de anfibios adultos registrados en el transecto altitudinal (evento de muestreo uno y réplica). Rioblanco (Tolima). Estaciones / m s.n.m. Familias/Especies E1/3520 E2/3440 E3/3360 E4/3280 E5/3200 E6/3120 1(Ra) 2(Ra) 1(Ra) 2(Ra) 1(Ra) 5(Pc) 0 0 0 0 2(Ra) 6(Com) Pristimantis peraticus 7(Com) 1(Ra) 4(Pc) 12(Ab) 7(Com) 4(Pc) Pristimantis aff. obmutescens 7(Com) 2(Ra) 0 0 0 0 0 0 1(Ra) 2(Ra) 0 2(Ra) 1(Ra) 16 1(Ra) 6 2(Ra) 8 0 16 0 10 0 17 Craugastoridae Pristimantis buckleyi Pristimantis leptolophus Pristimantis aff. vicarius Bufonidae Osornophryne sp. Total individuos () El índice de Abundancia Relativa se muestra entre paréntesis; sus categorías son: Ab= Abundante; Com= Común; Pc= Poco común y Ra= Rara. 227 La distribución aislada es comúnmente observada en las ranas del género Pristimantis que habitan en las cordilleras, ya que tienen áreas de distribución restringidas debido a la estrecha relación que se genera entre los individuos y el ecosistema que habitan, dando como resultado a nivel regional que estos organismos soporten procesos únicos que son expresados en una alta endemicidad (Lynch et al. 1997; Lynch 1999; Ardila y Acosta 2000). Ninguna de las especies ha sido objeto del comercio de fauna silvestre, de manera que no están catalogadas dentro de ningún apéndice del CITES en el 2015 (www.checklist.cites.org/#/en). Tabla 61. Endemismo y categorías de amenaza de los anfibios en el transecto altitudinal (evento de muestreo uno y réplica). Rioblanco (Tolima). Estado de Amenaza por fuente RuedaAlmonacid et al. 2004 Resolución 192 de 2014 Endemismo* IUCN 2014.3 CastroHerrera, F y W. BolívarGarcía. 2010 Pristimantis buckleyi Casi Endémica LC - - LC Pristimantis leptolophus Endémica LC - - - Pristimantis peraticus Endémica LC - - LC Pristimantis aff. obmutescens Endémica LC - - LC Pristimantis aff. vicarius Endémica NT - - - - - - - - Familias/Especies Craugastoridae Bufonidae Osornophryne sp. *El endemismo se obtuvo de la base de datos de la IUCN 2014.3 y Acosta (2014) LC: baja alarma, NT: casi amenazada. Aunque la actividad de los machos no fue tan marcada como en otros transectos, se detectaron cuatro individuos vocalizando; dos de la especie Pristimantis leptolophus, uno de P. cf. obmutescens y uno de P. buckleyi. Se realizó un gráfico de frecuencias para identificar en que rango de hora se detectó la mayor cantidad de individuos por especie (Figura 123). Se puede identificar el predominio de avistamientos de ranas en la noche. Una manera de explicar esto es por razones de protección, pues son organismos que debido a las características de su piel, deben proteger la humedad que hay en ella y esto logran hacerlo asociándose a micro-ambientes y llevando su actividad en horas específicas ya que la radiación solar se convierte en un factor trascendental, por lo menos en páramo (Navas 1999; Ardila y Acosta 2000; Lynch y Suarez-Mayorga 2002). 228 Figura 123. Frecuencia de detección de individuos por rangos de hora en el transecto altitudinal (evento uno y réplica). Rioblanco (Tolima). Los microhábitats preferidos por los individuos para percharse y refugiarse son los estratos de vegetación rasante y herbácea (representadas en su mayoría por plantas de las familias Poaceae y Melastomataceae) seguido de las bromelias y epífitas en general. En menor medida se observó el uso de otros microhábitats como hojarasca, musgos y hepáticas, aunque esto puede variar un poco de acuerdo a la especie (Tabla 62). Este comportamiento ha sido documentado en ranas especialmente las de la familia Craugastoridae que habitan los bosques de alta montaña. Los individuos se caracterizan por asociar su actividad a plantas como Melastomataceae, Araceae y helechos para percharse (Rincón-Franco y Castro-Herrera 1998). Para los anfibios se hace evidente que dependiendo del tipo de ecosistema en el que se encuentren los individuos, hacen uso de un hábitat específico, y en el caso de las poblaciones paramunas, además de esto, deben reducir su exposición a la radiación solar como medida de protección. Precisamente en las estaciones ubicadas en este tipo de coberturas (pajonal y arbustal) la mayoría de individuos se asociaron a bromelias y musgo. Esto concuerda con las observaciones de Navas (1999) quien dice que las especies de anuros están asociadas a las características del ambiente que explotan y en el caso de condiciones extremas, las poblaciones son obligadas a refugiarse en un microhábitat específico para evitar efectos de la radiación solar, bajas y altas temperaturas. A nivel general, la composición de especies se puede estratificar altitudinalmente de acuerdo a la disponibilidad de microhábitats. Por ejemplo, en ecosistemas compuestos por pajonal y arbustal, estaciones E1, E2, E3 y E4, las ranas como Pristimantis aff. obmutescens prefieren asociarse a bromelias, mientras que las especies de coberturas boscosas a la vegetación en diferentes estratos. Así 229 mismo es el comportamiento de otras especies como lo observaron MuñozGuerrero et al. (2007) quienes encuentran que dependiendo de la disponibilidad de microhábitats en diferentes ambientes, las especies aprovechan un recurso específico. Tabla 62. Uso de sustratos vegetales por adultos de anfibios observadas en el transecto altitudinal (evento uno y réplica). Rioblanco (Tolima). Especies Estaciones 1 y 2 Osornophryne sp. Estrato (Abundancias) Microhábitat Musgo y hepática Rasante (2) Pristimantis buckleyi Rasante (3) Raíces Perchada en hojas Pristimantis obmutescens Rasante (7) Musgo y hepática Bromelia y epifita Herbáceo (4) Perchada en hojas Bromelia y epifita Rasante (3) Perchada en hojas Herbáceo (3) Perchada en hojas Osornophryne sp. Rasante (2) Musgo y hepática Pristimantis buckleyi Rasante (2) Perchada en hojas Pristimantis peraticus Estaciones 3 y 4 Herbáceo (1) Perchada en hojas Pristimantis leptolophus Herbáceo (3) Perchada en hojas Pristimantis peraticus Rasante (5) Hojarasca Herbáceo (10) Perchada en hojas Herbáceo (2) Perchada en hojas Rasante (7) Hojarasca Herbáceo (1) Perchada en hojas Pristimantis leptolophus Herbáceo (8) Perchada en hojas Pristimantis peraticus Rasante (1) Perchada en hojas Herbáceo (8) Perchada en hojas Arbustivo (1) Perchada en hojas Pristimantis vicarius Perchada en hojas Estaciones 5 y 6 Pristimantis buckleyi Pristimantis vicarius Bromelia y epifita Bromelia y epifita 6.3.1.1 Representatividad del muestreo Los registros fueron obtenidos con un esfuerzo de muestreo total de 480 horas/observador en los transectos y 96 h/o con la técnica de encuentro visual aleatorio fuera del área abarcada en los transectos. El esfuerzo de muestreo fue igual entre estaciones (40 h/o en transectos y 8 h/o en búsqueda libre por estación). Se dedicó el mismo esfuerzo de muestreo tanto en la primera visita como en la réplica. Las curvas de acumulación de especies se agruparon por pares de estaciones (E1-E2; E3-E4; E5-E6) para aumentar la muestra, por lo tanto cada curva queda con 12 unidades de muestreo, y al sumarle la réplica temporal quedan con 24 unidades. 230 Los estimadores usados fueron Chao 1, ACE y Jackknife 1. Los resultados sugieren que los muestreos en los pares de estaciones permiten un buen estimado de la riqueza de anfibios ya que la representatividad del muestreo estuvo por encima del 80% según los estimadores. Los estimadores exhiben levemente la asíntota en la curva de acumulación para los pares de estaciones E1-E2, terminando en cuatro especies, mientras que en los pares de estaciones E3-E4 y E5-E6, los estimadores muestran que posiblemente se pueden encontrar más especies aumentando el esfuerzo de muestreo. Los singletons y doubletons son muy variables, en las E1-E2 y E3-E4 los doubletons tienden al aumento; en las E5-E6 tanto singletons como doubletons aunque muestran una línea más estable, tienden aumentar (Figura 124). En general se espera que a través de repeticiones se registren más especies en el tiempo. 231 A B C Figura 124. Curvas de acumulación de especies para el ensamblaje de anfibios de las estaciones A) E1-E2; B) E3-E4; C) E5-E6. Transecto altitudinal Rioblanco (Tolima). Las curvas de acumulación muestran que entre pares de estaciones las especies observadas siempre son cuatro y se esperaría que fueran aumentando a medida que se desciende. Estudios demuestran que la riqueza de anuros se incrementa conforme se desciende altitudinalmente en los Andes colombianos (CortezFernández 2006). Sin embargo se debe tener en cuenta que a medida que se desciende altitudinalmente, así mismo, la estructuración vegetal y el número de hábitats incrementan (Cortez-Fernández 2006), lo que hace más compleja la 232 detectabilidad de individuos en la estructura de bosque con respecto a la de áreas de arbustal, frailejonal-pajonal. 6.3.1.2 Diversidad Alfa (α). En cuanto al ensamblaje de anfibios, los índices muestran que la diversidad de Shannon es alta en las estaciones E3 y E6 con respecto a las demás, pues fueron algunas de las que aportaron más especies pero con menor dominancia. La equidad es mayor en la E2 y E6, pues las abundancias entre especies allí están en valores cercanos. En cuanto al índice de Simpson inverso, se puede identificar con los valores más bajos que las E1, E4 y E5 presentan mayor dominancia ya que las abundancias son muy heterogéneas entre especies. De manera que se puede determinar que la E4 fue la que presentó mayor dominancia y menor diversidad (Tabla 63). Tabla 63. Patrón de diversidad en el ensamble de anfibios registrados en el transecto altitudinal. Rioblanco (Tolima) Índices/estación E1 (3520) E2 (3440) E3 (3360) E4 (3280) E5 (3200) E6 (3120) Riqueza 4 4 4 3 3 4 Abundancia 16 6 8 16 10 17 Shannon Exp (H)* 2,92 3,78 3,35 2,08 2,23 3,74 Equidad (J) 0,771 0,959 0,875 0,669 0,729 0,952 Simpson inverso 2,56 3,57 2,94 1,69 1,85 3,57 * Modificación del índice de Shannon acorde a Jost (2006). Exp (H). Para el transecto altitudinal se esperaría que los índices de diversidad describieran una tendencia, mostrando un valor de diversidad más alto en las estaciones de menor elevación ya que se ha demostrado que en elevaciones medias hay mayor riqueza de especies y va reduciéndose a medida que se llega a mayor altitud (Bernal & Lynch 2008, Hutter et al. 2013). Para este transecto aún no es muy definida la tendencia. La estructura vegetal de los bosques ofrecen una mayor complejidad estructural y por ende, una mayor disponibilidad de microhábitats en la que coexisten un mayor número de especies (Rincón & Castro 1998; Gutiérrez-Cárdenas 2005; García et al. 2007) de manera que la destrucción, fragmentación y pérdida de hábitat que se han registrado antes en áreas naturales del Tolima y en general en los andes ha significado el declive de numerosas especies en cobertura de bosque (Bustamante et al. 2005; Velásquez et al. 2008; Castro-Herrera y Vargas-Salinas 2008; LlanoMejía et al. 2010). Con los valores estimados de diversidad se realizó una prueba t, que determina si existen diferencias numéricas de la diversidad en el gradiente de altitud. No se evidencia un patrón claro con las diferencias entre estaciones, ya que todas excepto uno de los pares evaluados de estaciones presentan diferencias significativas en cuanto a su diversidad. El par de estaciones que si muestran 233 diferencias entre sus diversidades son, E4 con respecto a E6, las demás, de acuerdo al análisis, no tienen diferencias (Tabla 64). Tabla 64. Prueba t para comparar valores de diversidad (Índice de Shannon-Wienner) entre pares de estaciones en el transecto altitudinal. Valores arriba de la diagonal indican el valor del estadístico t, valores bajo la diagonal corresponden al valor P (*= diferencia significativa). Estaciones E1 E1 E2 E3 E4 E5 E6 -0,86 -0,43 1,23 0,88 -1,19 0,33 1,86 1,53 0,03 1,46 1,16 -0,38 -0,2 -2,58 E2 0,4 E3 0,65 0,74 E4 0,22 0,08 0,16 E5 0,38 0,14 0,25 E6 0,24 0,97 0,7 0,83 0,01 -1,93 0,07 Los valores de p<0.05 muestran levemente la diferencia entre la diversidad de las estaciones mas alejadas. En general los valores de p son muy cercanos y no exhiben diferencias significativas que sean determinantes. Las curvas de diversidad dominancia permiten observar que las especies tienden a ser abundantes en estaciones especificas; dos especies, Pristimantis peraticus y P. obmutescens son abundantes en E1; en E2, E4 y E5 las especie más abundante es P. peraticus; finalmente en la última estación, E6 P. leptolophus tiende a ser la especie abundante. De manera que se observa un leve patrón de recambio en la abundancia en el gradiente de altitud (Figura 125). 234 Figura 125. Curvas de diversidad-abundancia de anfibios en las seis estaciones del transecto altitudinal. Rioblanco (Tolima). Pristimantis peraticus (A); P. obmutescens (B); P. buckleyi (C); Osornophryne sp. (D); Pristimantis cf. vicarius (E); P. leptolophus (F) 6.3.1.3 Diversidad Beta β La composición de los anfibios se modificó entre estaciones a medida que se desciende altitudinalmente (Figura 126). Aunque algunas especies comparten su distribución en las estaciones intermedias, se observa un recambio entre las estaciones más distantes, E1 y E6. Esto se manifiesta cuando se deja de observar Pristimantis obmutescens a partir de la E3 y a cambio de esto se observan P. vicarius y P. leptolophus en las estaciones más bajas E3-E6. Se logra identificar que P. peraticus y P. buckleyi están en todo el transecto de altitud, habitando en coberturas de arbustal-pajonal y bosque. Algunas especies se pueden considerar generalistas ya que tienen la particularidad de ocupar amplios rangos altitudinales en un gradiente, pudiendo abarcar más de un piso altitudinal (Cortez-Fernandez 2006). Otras especies tienen vacíos en la presencia a través del gradiente, sin embargo se esperaría que estuviesen allí por continuidad de distribución en el gradiente de altitud. 235 Figura 126. Recambio en el ensamblaje de anfibios en el gradiente de altitud comprendido entre los 3520 msnm (E1) y 3120 msnm (E6), en el transecto altitudinal. Rioblanco (Tolima). Fotografias por Wolfgang Buitrago-González y Carlos LondoñoGuarnizo" Similitud Los índices de similitud de Bray-curtis, Jaccard y Sorensen muestran las agrupaciones que se ajustan al recambio de las especies en el gradiente de altitud (Figura 126). El índice de Bray-curtis, basado en abundancias muestra las estaciones E4-E5 como las más similares en un mismo cluster, compartiendo alrededor del 60% de su contenido. Luego se agrupan allí las estaciones E3 y E6. Finalmente la E1 y E2 se agrupan con las anteriores pero con un nivel de similitud muy bajo (Figura 127 A). El índice de Jaccard se basa en la presencia-ausencia, de manera que el cluster agrupa las estaciones E1–E2 en un nivel de similitud del 100% como respuesta a la similitud en composición de las especies entre estas estaciones (Figura 127 B). Luego, a medida que se desciende en el gradiente altitudinal, las estaciones se van agrupando en pares en orden ascendente, tal cual se trabajó en las curvas de acumulación de especies 236 A) B) C) Figura 127. Cluster de similitud entre estaciones del transecto del Meridiano, departamento del Tolima. Similitud Bray-Curtis A); Jaccard B); Sorensen C). Los números de cada rama corresponden a la elevación (m) de las estaciones. El agrupamiento arrojado por Sorensen muestra el mismo esquema de asociaciones que Jaccard pero con un nivel de precisión mayor. Se puede identificar como las estaciones E1-E2 difieren del agrupamiento que se da entre las estaciones E3-E4 y E5-E6. Estas tendencias se observan en los gráficos de agrupamiento (Figura 127 B). Recambio de especies El índice de reemplazo de especies de Whittaker (Tabla 65) indica en general que las estaciones cercanas entre sí, tienen valores bajos en el índice, demostrando que el recambio es poco. Al comparar estaciones más distantes se esperaría que la disimilitud aumentara considerablemente, no obstante, el comportamiento es diferente, ya que los valores del índice no son muy altos y en general son homogéneos entre pares de estaciones. Un caso particular es el que presentan los pares de estaciones E1 y E2 con respecto a E6 cuyo valor a pesar de no ser muy alto indica que serían los pares de estaciones más disímiles. Lynch (1999) describe el recambio de especies a medida que se asciende altitudinalmente en las pendientes andinas y agrega que en ecosistemas de páramo la riqueza de fauna anura es modesta, generalmente menos de diez especies. En 237 este caso los resultados muestran que la fauna de anfibios en las zonas estudiadas no exhiben ese comportamiento, de manera que no se evidencia una tendencia clara sobre recambio de especies en el gradiente estudiado. En áreas de coberturas boscosas ubicadas a elevaciones medias se espera registrar la mayor diversidad y a medida que se asciende altitudinalmente ir reduciéndose progresivamente (Lynch y Suárez-Mayorga 2002; Bernal y Lynch 2008) Con los datos obtenidos en el transecto altitudinal se puede identificar que no existe una tendencia que levemente se aproxime a estos supuestos y esto se debe posiblemente a que la franja altitudinal estudiada es muy estrecha. Tabla 65. Índice de disimilitud de Whittaker entre estaciones para los anuros del transecto altitudinal. Rioblanco (Tolima) Estaciones E1 E1 E2 E2 E3 E4 E5 E6 0 0,2 0,33 0,33 0,4 0,2 0,33 0,33 0,4 0,11 0,33 0,2 0,25 0,11 E3 E4 E5 0,11 E6 6.3.2 Datos importantes Varias especies registradas en el presente estudio representan una extensión de distribución a nivel departamental para Colombia. Pristimantis obmutescens, P. vicarius y P. leptolophus son especies endémicas para Colombia, y concentran su distribución en la cordillera Central en los departamentos de Cauca y Huila; Cauca, Huila, Nariño y Putumayo; Cauca y Huila respectivamente. En el presente estudio se registran en el departamento del Tolima, al sur del complejo de páramos Las Hermosas. Estos registros amplían su áreas de distribución en la cordillera y aportan conocimiento sobre las especies para la ciencia. 6.3.3 Recomendaciones Se recomienda ampliar el gradiente con el objetivo de abordar una mayor área altitudinal que permita identificar la tendencia en el recambio de especies y a su vez la zona de transición entre el ecosistema de páramo y el bosque altoandino. 6.3.4 Conclusiones Los diferentes análisis demuestran que algunas especies de anfibios son dependientes de la cobertura vegetal y las condiciones climáticas, permitiendo identificar que especies como P. obmutescens y Osornophryne sp. se asocian exclusivamente a la estructura de pajonal-arbustal. 238 El estrato vegetal preferido por las ranas en las estaciones de la E1 a E4 es la vegetación rasante, mientras que en las estaciones E5 y E6 se asocian a la estructura herbácea. 6.4 AVES 6.4.1 Riqueza y composición de especies Se obtuvieron 706 registros durante 672 horas/red y 50 horas/observador, los registros representaron 89 especies agrupadas en 26 familias (Anexo 14). Las familias con mayor riqueza fueron: Thraupidae (22), Trochilidae (13), Tyrannidae (13) y Rhinocryptidae (5). Entre las 89 especies motivo de análisis, 41 fueron registradas únicamente en algunas estaciones: seis en la E1 y E2, 15 en la estación tres, y 14 en la E4. Anisognathus lacrimosus, Anisognathus igniventris y Turdus fuscater fueron registradas en todas las estaciones. Se obtuvo un total de 78 registros de 50 especies por vocalizaciones, y 300 registros de 40 especies mediante observaciones directas; de esta manera, 20 especies se registraron de ambas maneras. En el transecto se encontraron dos especies amenazadas de extinción, según lo definido en Renjifo et al. 2014; se encontraron nueve especies casi-endémicas, de acuerdo Chaparro-Herrera et al. 2013 (Tabla 66). Las 13 especies de la familia Trochilidae y dos de Psittacidae registradas en el transecto, se encuentran en el apéndice II de la Convención Internacional sobre el Comercio de Fauna y Flora Amenazadas (CITES 2013) (Anexo 14). Tabla 66. Aves amenazadas de extinción y endémicas registradas en el transecto de Rioblanco, Tolima. Familia Especie Categoría de amenaza Nivel de Endemismo Trochilidae Eriocnemis derbyi Casi-endémico Trochilidae Eriocnemis mosquera Casi-endémico Ramphastidae Andigena hypoglauca VU Psittacidae Leptosittaca branickii VU Rhinocryptidae Scytalopus spillmanni Casi-endémico Tyrannidae Uromyias agilis Casi-endémico Corvidae Cyanolyca armillata Casi-endémico Troglodytidae Cinnycerthia unirufa Casi-endémico Thraupidae Urothraupis stolzmanni Casi-endémico Emberizidae Atlapetes pallidinucha Casi-endémico Parulidae Myoborus ornatus Casi-endémico 239 VU: Vulnerable 6.4.1.1 Representatividad del muestreo Las curvas resultado del análisis con el estimador Chao 2 en el método con redes de niebla (Figura 128 A), permiten identificar que la E2 y E3 presentaron un comportamiento alejado de las demás estaciones. Asimismo E1 y E4 se comportan en claro ascenso pese a que la riqueza fue igual en todas las estaciones. En los puntos de conteo, las curvas se comportaron asintóticas, sin embargo, a diferencia del método anterior, las estaciones E3 y E4 presentan las riquezas más elevadas, con una leve tendencia a seguir aumentando en el caso de E4. Las demás estaciones, aunque con riquezas más modestas, las tres curvas parecen estabilizarse a partir de la mitad de unidades de muestreo a excepto la E1 (Figura 127 B). Figura 128. Curvas de acumulación de especies basadas en Chao 2 para el transecto de Rioblanco, Tolima. A: Redes de niebla y B: Puntos de conteo. Estación uno - E1 ( 3520 m.s.n.m) La representatividad con los dos métodos en este gradiente mostró valores por debajo del 70% (Tabla 67, Figura 129), en general los dos estimadores calculados predicen un mayor número de especies y no se observa aproximación a una asíntota, probablemente como resultado de tener las menores riquezas y abundancias de todo el gradiente evaluado. 240 Tabla 67. Comparación de los estimadores Chao 1 y Chao 2, entre métodos de muestreo de Aves, en el transecto de Rioblanco, Tolima Redes Puntos conteo Chao 1 Chao 2 Chao 1 Chao 2 Estaciones/m.s.n.m E1(3520) E2(3320) E3(3120) 48% 75% 72% 53% 60% 61% 69% 43% 75% 33% 38% 64% E4(2920) 48% 53% 64% 50% Figura 129. Curva de acumulación de especies observadas y estimadas: Chao1 y Chao2, E1 (3420 m.s.n.m). A: Redes de niebla y B: Puntos de conteo. Transecto altitudinal Rioblanco, Tolima. En la E1 se registraron 21 especies agrupadas en nueve familias, siendo las más representativas, Trochilidae con seis especies y Thraupidae con siete. Se consideraron dos especies como abundantes, ya que se registraron en más de cinco oportunidades, estas fueron: Diglossa lafresnayii (10) y Chalcostigma herrani (7) (Figura 130 A). Entre las especies consideradas raras por ser registradas entre una y dos veces, se encuentran: Metallura williami, y Scytalopus opacus (Figura 130 A, Anexo 14). Las especies exclusivas en esta estación fueron: Asthenes fuliginosa, Catamenia inornata, Grallaria rufula, Orochelidon murina, S. opacus y Systellura longirostris. 241 M. ornatus T. fuscater P. cyanoleuca Z. capensis T. solstitialis p. cinnamomeus L. branickii H. leucophrys C. coruscans S. zonaris A. mercenaria A. lacrymosus L. lafresnayi A pallidinucha P. fasciata A. hypoglauca A. schistaceus M. squamiger M. leucophrys M. striaticollis M. fumigatus T. vassorii T. personatus A. igniventris B. nigrocristatus C. goudotii C. rubrirostris C. torquata C. rivolii C. atratus D. albilatera D. cyanea H. gularis H. atropileus H. frontalis H. superciliaris I. rufivertex O. cinnamomeiventris O. frontalis P. carunculatus P. arcuata S. nigricans S. magallanica T. cyanocephala T. collaris Abundancia relativa ni/N M. ornatus A. igniventris p. cinnamomeus M. nigrocristata T. fuscater A. lacrymosus T. solstitialis B. montana H. atropileus A. pallidinucha C. chrysonotus C. diadema M. squamiger S. latrans M. tyrianthina S. zonaris D. cyanea M. leucophrys O. cinnamomeiventris A. somptuosus A. schistaceus C. sitticolor C. atratus C. armillata P. ruficeps A. agilis C. pollens D. lafresnayii E. mosquera G. nuchalis H. gularis M. poecilocercus S. spillmanni T. vassorii Z. capensis A. melanogenys A. hypoglauca A. flammulata C. herrani C. goudotii C. rubrirostris C. eximia C. lutetiae D. albilatera D. humeralis D. taeniata H. verticalis H. leucophrys M. williami O. rufipectoralis P. fasciata P. carunculatus P. riefferii R. microrhynchum Abundancia relativa ni/N 0,20 0,20 0,15 0,15 0,10 0,10 0,05 0,05 0,00 0,00 242 M. tyrianthina M. ornatus A. pallidinucha A. igniventris A. lacrymosus D. cyanea E. mosquera C. platensis D. lafresnayii I. rufivertex C. herrani M. leucophrys T. solstitialis T. fuscater A. cupripennis C. unirufa C. sitticolor D. albilatera M. williami P. fasciata U. stolzmanni A. agilis H. verticalis T. personatus B. montana D. humeralis Eriocnemis derbyi P arcuata R. microrhynchum A. orthonyx M. nigrocristatus E. vestita M. senilis O. fumicolor P. nigrocapillus S. latrans S. spillmanni S. magallanica T. vassorii U. stolzmanni T. fuscater S. longirostris S. opacus O. fumicolor M. williami E. derbyi D. humeralis A. fuliginosa A. cupripennis O. frontalis M. tyrianthina G. rufula C. inornata A. lacrymosus A. igniventris E. mosquera O. murina I. rufivertex C. herrani D. lafresnayii Abundancia relativa ni/N 0,20 A A B B C C 0,20 0,15 0,10 0,05 0,00 D (3 .5 2 0) 0,15 0,10 0,05 0,00 Figura 130. Abundancia de especies, A: E1, B: E2, C: E3, D: E4. Transecto altitudinal Rioblaco, Tolima. Estación dos – E2 (3320 m.s.n.m) La representatividad obtenida con el método redes de niebla tuvo mayor valor comparado con la anterior estación (Tabla 67, Figura 131), por ejemplo para el estimador Chao 1 fue de 75% y 60% para Chao 2. Por su parte en los puntos de conteo la representatividad estuvo por debajo del 50% (Tabla 67, Figura 131). Figura 131. Curva de acumulación de especies observadas y estimadas: Chao 1 y Chao 2, E2 (3320 m.s.n.m). A: Redes de niebla y B: Puntos de Conteo. Rioblanco (Tolima). En E2 se registraron 39 especies, ubicadas en 12 familias, de las cuales, Thraupidae (12) y Trochilidae (8) fueron las que presentaron el mayor número de especies. 14 especies fueron consideradas abundantes, entre estas: Metallura tyrianthina (20), y Myioborus ornatus (19). En cuanto a las especies consideradas raras por el número de registros, se destacan: Acropternis orthonyx y Sporagra magellanica (Figura 130 B). Las especies exclusivas de esta elevación fueron A. orthonyx, Cinnycerthia unirufa, Cistothorus platensis, Eriocnemis vestita, Myornis senilis y Phyllomyias nigrocapillus. Estación tres – E3 (3120 m.s.n.m) Las curvas de acumulación para el muestreo en esta estación, para ambos métodos, presentaron una representatividad baja en ambos indicadores, aún teniendo las riquezas más altas en todo el gradiente (Tabla 67, Figura 132). El patrón no es diferente al observado en las estaciones precedentes. 243 Figura 132. Curva de acumulación de especies observadas y estimadas: Chao 1 y Chao 2, E3 (3320 m.s.n.m). A: Redes de niebla y B: Puntos de Conteo. Transecto altitudinal Rioblanco, Tolima. En E3 el total de especies registradas fue de 54, pertenecientes a 20 familias, entre las cuales, las que presentaron el mayor número de especies fueron Thraupidae con 15, seguida de Trochilidae y Tyrannidae con siete. Entre las especies abundantes se encontraron: M. ornatus (44), A. igniventris (21) Pyrrhomyias cinnamomeus (17). Entre las especies con menos registros se encontraron: Andigena hypoglauca y Cnemoscopus rubrirostris (Figura 130 C). En esta elevación, el número de taxones con registro exclusivo lo conforman 15 especies de diversos hábitos: Pseudotriccus ruficeps, Grallaria nuchalis y Catamblyrhynchus diadema (Figura 130 C). Estación cuatro – E4 (2920 m.s.n.m) Las curvas de acumulación para el muestreo en esta estación con el método de redes de niebla, arrojaron una representatividad baja. Lo anterior contrasta con una mayor representatividad obtenida en los puntos de conteo (Tabla 67, Figura 133), donde la detección de las aves de forma directa e indirecta aumentó el número de registros. 244 Figura 133. Curva de acumulación de especies observadas y estimadas: Chao 1 y Chao 2, E4 (2920 m.s.n.m). A: Redes de niebla y B: Puntos de Conteo. Rioblanco, Tolima. En la E4 se registraron 45 especies pertenecientes a 20 familias, donde Thraupidae contó con 11 especies y Tyrannidae con siete. Entre las especies abundantes por presentar más de cinco registros se encuentran: M. ornatus (20), T. fuscater (16), P. cyanoleuca y Z. capensis (13). Con uno o dos registros se encontraron especies como: Trogon collaris y Tangara cyanocephala (Figura 130 D). 14 especies fueron reportes exclusivos de esta estación, entre estas: Coeligena torquata, Colaptes rivolii, Colibri coruscans y Sayornis nigricans. De acuerdo a lo encontrado en el gradiente altitudinal, se evidencian patrones encaminados a comprender la dinámica de los ecosistemas altoandinos; en las E1 y E2, la segunda familia más representativa fue Trochilidae, siendo este un grupo que a medida que se ascendió en elevación, aumentó su riqueza y abundancia, contrario sucedió con los Tyrannidae y otros insectívoros como Furnariidae, que a medida que se descendió en altitud aumentaron en número de especies. Por otro lado, la familia Thraupidae, estuvo representado en todo el transecto, esto marca una dinámica establecida por las diferentes coberturas vegetales, puesto que las estaciones más elevadas presentaban plantas de la familia Ericaceae con una importante oferta de alimento para los nectarívoros y frugívoros cuando posteriormente producen frutos. Con respecto a la representatividad de los muestreos, la diferencia de los valores arrojados en las curvas de acumulación entre los dos métodos, se debe principalmente a la baja proporción de captura de las redes con respecto a los puntos de conteo. Las redes de niebla son una técnica complementaria que permite registrar especies raras y poco conspicuas por movilizarse entre el estrato rasante y sotobosque; contrario a los punto fijos, que permiten visualizar individuos de especies conspicuas y abundantes que forrajean principalmente en el dosel y 245 muchas veces formando bandadas mixtas, que aseguran un mayor registro. Sin embargo, con las redes de niebla se lograron obtener datos importantes que contribuyeron a robustecer el muestreo en esta área, además de aportar los datos de rasgos funcionales que se sistematizaron en la Plataforma Institucional de Datos (I2D), para posteriores análisis por parte del laboratorio diversidad funcional del IAvH. 6.4.1.2 Diversidad alfa Según el índice de Shannon (H´), E3 presentó el mayor valor de este índice, con E4 fueron las elevaciones donde se presentó la mayor riqueza, esto supone junto con la abundancia una proporción equitativa de las especies comparado con la E1, donde se presentó una diferencia considerable con E3, y estuvo por encima de E2 y E4 (Tabla 68). En E1, E2 y E4 las especies más comunes presentaron registros por debajo de 21 individuos, mientras que en E1 presentó por encima de 40, en el caso de la estación uno se evidenció una dominancia de dos especies comunes (D. lafesnayii y C. herrani) forrajeando en flores de la familia Ericaceae. De acuerdo a la prueba t, se presentaron diferencias significativas entre la diversidad (H´) encontrada entre E1 y el resto de las estaciones en el transecto altitudinal (P-valor <0,05) (Tabla 69); esto es un factor que explica la tendencia de los índices encontrados, siendo la diversidad en la estación uno la más baja y con mayor dominancia de algunas especies (1-D) con relación a la riqueza encontrada. Estos resultados explican la heterogeneidad de las áreas boscosas, complejas en su estructura tanto horizontal como vertical (MacArthur 1961, Nocedal 1984), encontradas a partir de la E2 hasta la E4, ya que estas coberturas generan una mayor disponibilidad de hábitats y nichos ecológicos para las aves. Tabla 68. Diversidad alfa para las cinco estaciones en el transecto altitudinal de Rioblaco (Tolima) Estaciones Riqueza Abundancia Diversidad(H´) Dominancia(1-D) E1(3.520m) E2(3.320m) 21 39 50 214 2,725 3,272 0,9104 0,9511 246 E3(3.120m) 54 274 3,377 0,9447 E4(2.920m) 45 168 3,254 0,9441 Tabla 69. Tabla de doble entrada para la prueba t (student) y P valor para los índices de diversidad de Shannon-Wiener. E1(3.520m) E1 (3.520) E2(3.320m) -4,54 E2 (3.320) 2,22E-05 E3 (3.120) 2,57E-06 0,27 E4 (2.920) 0,0002 0,55 E3(3.120m) E4(2.920m) -5,07 3,84 -1,08 -0,59 1,48 0,13 6.4.1.3 Diversidad Beta En el Índice de Jaccard se evidencian dos grupos de acuerdo a la similitud de especies encontradas entre estaciones; siendo las E2 y E3 las que presentaron la mayor similitud (36%), la estación uno (E1), presentó la similitud más baja con respecto al resto de estaciones (Figura 134 A). Se debe señalar que similitudes por debajo del 50% entre grupos, como en este caso, dan cuenta de lo heterogénea que es la avifauna del gradiente evaluado. En el Índice de Sorensen, se presentó el mismo patrón anterior, aunque con similitudes un tanto mayores, las estaciones E2 y E3, con 53% fueron las más similares. Por el contrario, se evidenció una baja similitud entre E1 y E4 con 10% (Figura 133 B). Para el Índice Bray-Curtis basado en abundancia, la diversidad beta mostró una tendencia algo distinta de los análisis anteriores; E3 y E4 presentaron, 42% de similitud, por el contrario la similitud más baja se presentó entre E1 y E4 con el 5% (Figura 135). 247 Figura 134. Agrupamiento con base en la composición de la avifauna, A: índice de Jaccard y B: índice Sorensen. Rioblanco (Tolima). Figura 135. Índice de Bray- Curtis: agrupamiento con base en la composición y abundancia de la avifauna del transecto altitudinal Rioblanco (Tolima) Índice de Whittaker En este análisis se muestra un recambio de especies en las estaciones muestreadas. E4 contrastada con E1, tienen una mayor disimilitud (Tabla 70), así mismo, se evidencia cómo la similitud en la composición cambia conforme aumenta la distancia entre las comunidades de aves. Este patrón muestra que la 248 similitud disminuye y el recambio de especies aumenta con la distancia (Calderón et al. 2012, Anderson et al. 2011). Tabla 70. Indice de Whittaker para el transecto altitudinal de Rioblanco (Tolima) Estaciones y elevaciones E1 (3520) E2 (3420) E3 (3320) E4 (3220) E1 (3.520) E2 (3.420) E3 (3.320) E4 (3.220) 0 0 0,53333 0,76 0,46237 0,84848 0,61905 0 0,47475 0 De acuerdo con el análisis de diversidad beta, se evidencia una mayor similitud entre las estaciones más próximas, por ejemplo, E1 y E2 compartieron cuatro especies: E. derby, Aglaeactis cupripennis, Ochthoeca fumicolor y Urothraupis stolzmanni; E2 y E3 compartieron siete especies, entre ellas: Uromyias agilis, Buthraupis montana y Hemispingus verticalis. Lo anterior indica, que debido a la composición y estructura del ensamblaje de aves en las diferentes estaciones, se evidencia un recambio de especies a medida que se asciende en el gradiente altitudinal, de esta manera no es claro marcar una línea o altitud donde se establezca un recambio, pero es claro que en la estación más alta (E1) se registraron especies comunes de áreas abiertas donde existen dominancia de matorrales, frailejonales, chuscales y pajonales; esto indica que la composición y estructura de aves en la alta montaña está relacionada con la estructura vegetal encontrada. Una de las razones para este patrón, pueden ser las condiciones ambientales, que cambian conforme aumenta la distancia en el gradiente altitudinal; hay una disminución de la similitud ambiental con la distancia, lo que implica que exista una separación de las especies con diferentes características fisiológicas. Otro factor que puede influenciar, está relacionado con la configuración del ambiente y el tiempo, ya que puede influir en el movimiento de las especies (Calderón et al. 2012). A mayor número de barreras, la similitud decrece más abruptamente que en un sitio topográficamente abierto y homogéneo (Nekola & White 1999, Soininen et al. 2007). 249 6.4.2 Gremios Tróficos Los gremios tróficos fueron asignados con base en Renjifo (1999b) con modificaciones, de acuerdo a la dieta de cada especie (Tabla 71). Tabla 71. Gremios tróficos de Aves transecto de Rioblanco (Tolima) Tipo de alimentación Rapaz diurna Frutos Frutos e insectos Frutos, insectos y néctar Néctar e insectos Insectos Semillas Abreviación R/D FR FR-I FR-I-N NI I SE En todas las estaciones los insectívoros fueron quienes predominaron en el muestreo, siendo la estación tres la que presentó mayor riqueza. Los nectarívoros mostraron un número importante en las estaciones más altas (E1 y E2), contrario sucedió con frugívoros que complementan su dieta con insectos, ya que en las estaciones más bajas mostraron mayor abundancia (Figura 136). La disponibilidad de recursos alimenticios es uno de los factores determinantes en la dinámica y estructuración de las comunidades de aves (Nocedal 1984, Wolda 1990). Su composición en función de los gremios alimenticios, está estrechamente relacionada con la estructura de la vegetación (Laurance & Bierregaard 1997). Los hábitats con una estructura vegetal compleja y formada por varios estratos de cobertura, presentan principalmente especies de hábitos insectívoros, frugívoros y nectarívoros (Rappole et al. 1993). De acuerdo con lo anterior, en todo el transecto altitudinal fueron representativos estos tres gremios. Los datos obtenidos en los análisis de gremios tróficos, apoyan la información generada en los análisis de diversidad beta, ya que las aves nectarívoros como los colibríes fue uno de los gremios más representativos en las estaciones más elevadas, y los insectívoros, aunque fueron relevantes en todo en transecto, fueron más abundantes en las estaciones tres y cuatro. Se destacan las aves nectarívoras de la familia Trochilidae, ya que fueron abundantes en las dos primeras estaciones principamente, esto se debe a la existencia de especies de plantas de la familia Ericaceae, Rubiaceae, Melastomataceae, entre otras, que ofrecen alimento de forma constante durante los periodos de floración. La etapa de floración de las plantas y el tiempo seco, permitió que se presentara una mayor abundancia de insectos, favoreciendo que aves de este gremio fueran más abundantes en todas las estaciones. 250 E1(3.520m) E2(3.320m) E3(3.120m) E4(2.920m) N° especies 20 15 10 5 0 I NI FR-I FR-I-N FR SE CAR RD Gremios Figura 136. Número de especies de acuerdo a los gremios tróficos en cada una de las estaciones del transecto altitudinal de Rioblanco (Tolima). 6.4.3 Conclusiones Durante el trabajo de campo se registraron dos especies de aves con especial interés para la conservación, por estar amenazadas de extinción, L. branickii y A. hypoglauca (Vu). De acuerdo con los índices de diversidad, la estación (E3) presentó los valores más altos, con relación a las estaciones que se encontraban en elevaciones mayores, indicando la importancia de la cobertura vegetal en la dinámica y el establecimiento de las poblaciones de aves, ya que en estos gradientes la complejidad vertical de la vegetación promueven una mayor cantidad de nichos. Se encontró un recambio de especies a medida que se desciende en el gradiente altitudinal, y cuando las características de la cobertura vegetal cambian, principalmente entre los 3520 m. (E1 aves) y 3320 m. (E2 aves). 251 6.5 CONSIDERACIONES FINALES TRANSECTO MUNICIPIO DE RIOBLANCO Los tres índices de similitud muestran dos grupos claros que están relacionados con las estaciones de la parte alta del transecto (E1 a E4) y las estaciones de formaciones boscosas de la parte baja (E5 y E6). Los grupos, uno con E1 a E4, con un 40% de similitud (Sorensen) y 26% (Jaccard); y un segundo grupo, con las E5 y E6, similares en un 58% (Sorensen) y 42% (Jaccard). A diferencia de los demás análisis (Sorensen y Jaccard), encuentran relación entre E1 y E2 con un 68% y 50% respectivamente. Posteriormente E3 y E4 tienen un corte de similitud de 37% (Sorensen) y 24% (Jaccard). Los resultados arrojados por el índice de Bray-Curtis, agrupan las estaciones (E1 a E4) con 35% de diferente manera, estableciendo similitudes entre E2 y E3 con un 60%. Sin embargo, lo más notable es la baja relación entre los dos grupos diferenciados por este método, toda vez que su agrupamiento es inferior al 10%. En síntesis, los bajos niveles de similitud entre las parejas de elevaciones parecen sugerir afinidades por proximidad más que debidas al parámetro analizado (incidencia o abundancia). Las mayores afinidades se evidencian en las E1 y E2 con un 68% (Sorensen) y en las estaciones E5 y E6 con un 58% (Jaccard); tal vez estos resultados se deban a la dominancia que presentan algunas especies en estas estaciones. En contraste, las estaciones subsiguientes parecen tener relaciones menos estrechas entre sí. Las cuatro estaciones más elevadas (3520 a 3280 m.), tuvieron predominio de estratos vegetales rasante y herbáceo con especies como: B. loxense, Prionodon sp., M. cf. panamensis, H. obtusifolia, C. tessellata, Calamagrostis sp. D. cf. schultzii, R. cf. caucana, D. cf. Acuminatum. En las estaciones más bajas (entre 3200 y 3120 m) predominaron los arbolitos, arbustos y árboles, con especies como: W. mariquitae, Brunellia sp., Maytenus sp., M. guianensis, C. ovalifolia, Miconia sp2., Cyathea sp., F. reticulata, S. cf. uribei. A partir de E5, ubicada a 3.200 m, la composición, diversidad y estratos vegetales cambiaron. El estrato vegetal rasante, compuesto por formas de crecimiento como rosetas y talófitalíquen, sólo se encontró en las cuatro primeras estaciones. El estrato vegetal de arbustos se presentó en todas las estaciones, aunque, su mayor abundancia se encontró en las estaciones E5 y E6. Las estaciones E1-E4 presentan dominancia de especies arbustivas y leñosas de porte bajo y medio, que conforman un páramo bajo por dispersión y colonización en sitios de topografía quebrada y escarpada con alta heterogeneidad. Hacia las estaciones E3 - E4 se presenta la zona de transición páramo bajo-bosque, franja en la cual se pueden presentar también zonas de páramo con herbazal-frailejonal, aunque son azonales hacia esta cota comprendida entre las E3 – E4. Es posible que los bancos de semillas y dispersión de las especies de estas coberturas estén siendo desfavorecidas para su dispersión y colonización de nuevos hábitats, dentro de los procesos naturales de sucesión o diversificación del páramo. Además, las condiciones biofísicas y microclimáticas pueden favorecer la dispersión y establecimiento de arbustos más que de hierbas o frailejonales. 252 El análisis de conglomerados de la edafofauna con el índice de Jaccard, con un nivel de 30%, identifica un primer grupo en E1, otro conformado por tres estaciones E3-E5-E6, y dos altitudes que se separan por su composición de especies, en un grupo, E4 y E2. No obstante, estas segregaciones presentaron un bajo porcentaje de similaridad, lo que disminuye la confianza en los grupos generados. Por su parte el índice Sorensen-Dice, genera los mismos grupos que Jaccard, mostrando una similitud del 45% entre los grupos. Si bien el porcentaje de similitud es bajo, es posible que los pequeños cambios en composición derivados del nivel de la jerarquía taxonómica tratada, estén mostrando una "tendencia" de recambio, desde la segunda estación. La riqueza de la edafofauna tuvo 19 especies por encima de las reportadas para el transecto realizado en Tuluá. El inventario realizado en las seis estaciones altitudinales arroja un elevado número de especies, mostrando alta riqueza en la zona. Se recolectaron seis morfoespecies de la familia Carabidae, un número alto frente a la riqueza de especies de coleópteros y frente a otras familias. Este grupo presentó una tendencia al aumento en riqueza de especies con la disminución de la altura. Las estrategias alimenticias fueron proporcionalmente semejantes entre transectos, mostrando consistencia en los sitios evaluados. Los principales artrópodos componentes de la fauna edáfica son los herbívoros, seguidos por los de hábito depredador. Tanto la riqueza como la abundancia aumentaron a medida que disminuyó la elevación. No se presentaron especies generalistas en todo el transecto. Por el contrario, se detectó una elevada presencia de especies únicas. A pesar de existir pocas diferencias, se establecieron tres grupos altitudinales separados según la composición presente en las cinco estaciones altitudinales: uno formado por E1, el segundo formado por E3-E5 y E6, el tercero por E4 y un último formado por E2. Igual que en otros transectos, este resultado muestra un rápido recambio en la parte más alta del transecto (de E1 a E2), que continua cambiando al paso hacia E3 y finalmente se estabiliza en las cuatro estaciones posteriores. Los índices de similitud de Bray-curtis, Jaccard y Sorensen muestran las agrupaciones que se ajustan al recambio de las especies en el gradiente de altitud. El índice de Bray-curtis, basado en abundancias muestra las estaciones E4-E5 como las más similares en un mismo grupo, compartiendo entre el 60% y 80% de su contenido en los modelos de incidencia. Luego se agrupan allí las estaciones E3 y E6. Finalmente la E1 y E2 se agrupan con las anteriores pero con un nivel de similitud muy bajo. El índice de Jaccard agrupa las estaciones E1–E2 en un nivel de similitud del 100% como respuesta a la similitud en composición de las especies entre estas estaciones. Luego, a medida que se desciende en el gradiente altitudinal, las estaciones se van agrupando en pares en orden ascendente. El agrupamiento arrojado por Sorensen muestra el mismo esquema de asociaciones que Jaccard pero con un nivel de asociación mayor. Se puede identificar como las estaciones E1-E2 difieren del agrupamiento que se da entre las estaciones E3-E4 y E5-E6. Los diferentes análisis demuestran que algunas 253 especies de anfibios son dependientes de la cobertura vegetal, y las condiciones climáticas. Especies como P. obmutescens y Osornophryne sp. se asocian exclusivamente a la estructura de pajonal-arbustal. El estrato vegetal preferido por las ranas en las estaciones de la E1 a E4 es la vegetación rasante, mientras que en las estaciones E5 y E6 se asocian a la estructura herbácea. Durante el trabajo de campo se registraron dos especies de interés para la conservación y con alguna categoría de amenaza: L. branickii y A. hypoglauca. De acuerdo con los índices de diversidad, la estación (E3) presentó los valores más altos, con relación a las estaciones que se encontraban en elevaciones mayores, indicando la importancia de la cobertura vegetal en la dinámica y el establecimiento de las poblaciones de aves. Se evidenciaron dos grupos con el Índice de Jaccard de acuerdo a la similitud de especies encontradas entre estaciones; siendo las E2 y E3 las que presentaron la mayor similitud (36%). E1, presentó la similitud más baja con respecto al resto de estaciones. Se debe señalar que similitudes por debajo del 50% entre grupos, como en este caso, dan cuenta de lo heterogénea que es la avifauna del gradiente evaluado. En el Índice de Sorensen, se presentó el mismo patrón anterior, aunque con similitudes un tanto mayores, las estaciones E2 y E3, con 53% fueron las más similares. Por el contrario, se evidenció una baja similitud entre E1 y E4 con 10%. Para el Índice Bray-Curtis basado en abundancia, se encontró una tendencia distinta de los análisis anteriores; E3 y E4 presentaron 42% de similitud, por el contrario la similitud más baja se presentó entre E1 y E4 con el 5%. En el trabajo realizado se encontró un recambio de especies a medida que se desciende en el gradiente altitudinal, y cuando las características de la cobertura vegetal cambian, principalmente entre los 3520 m. (E1 aves) y 3320 m. (E2 aves). 254 255 7. RESULTADOS TRANSECTO ALTITUDINAL, FINCA LA VICTORIA, VEREDA LA NEVERA, MUNICIPIO DE PALMIRA (VALLE DEL CAUCA) 7.1 VEGETACIÓN En el municipio de Palmira, el estudio se realizó en un gradiente altitudinal (transecto) comprendido entre 3420 y 3100 m.s.n.m, correspondientes a la finca la Victoria, donde además de áreas destinadas a la producción bovina de doble propósito (carne y leche), existen importantes áreas de bosque y páramo en condiciones naturales y diferentes estados sucesionales (Figura 137). Figura 137. Panorámicas de la finca la Victoria, área de influencia transecto altitudinal de Palmira (Valle del Cauca) 7.1.1 Descripción de las estaciones 7.1.1.1 Estación uno - E1 (3420 m.s.n.m) En la estación uno se presentaron coberturas vegetales de porte bajo y abiertas a semiabiertas, como frailejonales-herbazales-arbustales, dominados por Espeletia hartwegiana, plantas de la familia Poaceae (Calamagrostis sp., Achiachne aff. pulvinata, Cortaderia sp.), Cyperaceae (Rhynchospora cf. caucana), Puya trianae, Bejaria resinosa, Hypericum laricifolium, helechos (Blechnum loxense, Jamesonia alstonii), Diplostephium cf. schultzii, Cavendishia bracteata, Gaultheria sclerophya, Disterigma spp., Vaccinium floribundum, Pernettya prostrata, Selaginella tarapotensis y Gaiadendron punctatum. Esta estación se encuentra cerca al borde superior del arbustal denso-bosque, a medida que se desciende en altitud. El estrato rasante presenta un tapizado de musgos (Prionodon sp.), Licopodiaceae (Lycopodium jussiaei, Huperzia sp.), Poaceae (Achiachne aff. pulvinata), Lachemilla cf. orbiculata y Nertera granatensis (Anexo 15). Estas coberturas se encuentran moderada a levemente intervenidas, tal vez fueron utilizadas en décadas pasadas para ganadería extensiva, asociada 256 con prácticas como las quemas, sin embrago, actualmente se encuentran en procesos de regeneración natural (Figura 138). A B Figura 138. Área de influencia de E1 (3420 m.s.n.m). A) Pajonales, herbazales y frailejonales, B) Equipo de trabajo de flora tomado datos. Palmira (Valle del Cauca). Estratos vegetales estación uno Las tres parcelas evaluadas presentaron una pendiente de 5-50%, con plantas entre <0,1 y 1,6 m, que conforman tres estratos vegetales, que se describen a continuación: Rasante (<0,3 m): dominado por Poaceae (Calamagrostis sp., Achiachne aff. pulvinata), Disterigma empetrifolium, Vaccinium floribundum, Nertera granatensis, Pernettya postrata, Iridaceae (Sisyrinchium sp.), musgos (Prionodon sp.), Licopodiaceae (Lycopodium jussiaei, Huperzia sp.), helechos (Jamesonia alstonii), Selaginella tarapotensis y Lachemilla cf. orbiculata. Herbáceo (0,3-1,5 m): dominado por Poaceae (Calamagrostis sp., Cortaderia nitida), Cyperaceae (Rhynchospora cf. caucana), helechos (Blechnum loxense), Hypericum laricifolium, Espeletia hartwegiana, Bejaria resinosa y Lupinus cf. microphyllus. Arbustivo (1,5-5 m): dominado por Espeletia hartwegiana, Hypericum laricifolium, Gaiadendron punctatum, Diplostephium spp., Pentacalia spp. y Macleania rupestris (Figura 139). 257 Figura 139. Perfil de vegetación arbustiva en la E1, parcela uno (3420 m.s.n.m). 1. Gaiadendron punctatum, 2. Gaultheria sclerophylla, 3. Rynchospora cf. caucana, 4. Blechnum loxense, 5. Hypericum laricifolium, 6. Espeletia hartwegiana, 7. Prionodon sp., 8-9. Vaccinium floribundum, 10. Achiachne aff. pulvinata, 11. Pernettya prostrata, 12. Espeletia hartwegiana, 13. Macleania rupestris, 14. Maytenus sp., 15. Bejaria resinosa, 16. Espeletia hartwegiana, 17. Blechnum loxense, 18. Jamesonia alstonii, 19. Rynchospora cf. caucana, 20. Lupinus cf. microphyllus, 21. Sisyrinchium sp., 22. Bejaria resinosa, 23. Calamagrostis sp., 24. Achiachne aff. pulvinata, 25. Jamesonia alstonii, 26. Disterigma acuminatum, 27. Vaccinium floribundum, 28. Espeletia hartwegiana, 29. Rynchospora cf. caucana, 30. Blechnum loxense, 31. Nertera granatensis, 32. Achiachne aff. pulvinata. Eje x, longitud del transecto (m); eje y, altura de la vegetación (m). Ilustración Yoao Palchukan (2015). 258 7.1.1.2 Estación dos – E2 (3340 m.s.n.m) Predominaron los arbustales de porte medio-alto y semiabiertos a muy cerrados, de 3-7 m de altura, con dosel discontinuo a moderadamente continuo, con algunos arbolitos dispersos. Fueron comunes las plantas de la familia Ericaceae (Bejaria resinosa, Cavendishia bracteacta, C. nitida, Disterigma acuminata, Gaultheria sclerophylla, Vaccinium floribundum), Melastomataceae (Brachyotum ledifolium, Miconia spp.); y especies como: Weinmannia mariquitae, Hesperomeles ferruginea, Oreopanax discolor, Maytenus sp., Cortaderia nitida, Hedyosmum cf. cuatrecazanum, Brunellia goudotii, Drimys granadensis, Freziera canescens, Myrica pubescens, Clethra revoluta, Geissanthus cf. bogotensis, Myrsine dependens, Monnina angustata, Vallea stipularis, Gaiadendron punctatum, Pentacalia sp. El estrato rasante presentó un tapizado denso de Disterigma acuminata, orquídeas (Stelis spp., Pleurothallis spp.) y musgos (Prionodon sp.) (Anexo 15). Estas coberturas se encuentran levemente intervenidas. La topografía del terreno es leve a moderadamente quebrada, con pendientes medias a bajas (Figura 140). Figura 140. Arbustales, área de influencia E2 (3340 m.s.n.m). Palmira (Valle del Cauca). 259 Estratos vegetales estación dos Las tres parcelas evaluadas presentaron una pendiente de 15-80%, con plantas entre <0,1 y 8 m, que conforman cuatro estratos vegetales, que se describen a continuación: Rasante (<0,3 m): dominado por orquídeas (Stelis spp., Pleurothallis spp.), musgos (Prionodon sp.), Oxalis medicaginea y licopodios (Lycopodium jussiaei). Herbáceo (0,3-1,5 m): dominado por Cyperaceae (Cortaderia sp.), Oxalis medicaginea, helechos (Thelypteris sp., Pleopeltis sp.), Ericaceae (Vaccinium floribundum, Gaultheria sclerophylla), Alstroemeriaceae (Bomarea linifolia), Scrophulariaceae (Calceolaria cf. microbefaria) y Cyperaceae (Rynchospora cf. caucana). Arbustivo (1,5-5 m): dominado por Ericaceae (Bejaria resinosa, Gaultheria sclerophylla, Cavendishia spp.), Melastomataceae (Miconia spp., Brachyotum ledifolium, Tibouchina mollis), Primulaceae (Geissanthus cf. bogotensis, Myrsine dependens), Asteraceae (Gynoxis sp., Pentacalia sp.); Oreopanax discolor, Hesperomeles ferruguinea, Escallonia paniculata, Blechnum loxense, Dendrophthora cf. clavata, Berberis sp., Maytenus sp. Arbolitos (5-12 m): dominado por Freziera canescens,Vallea stipularis, Miconia spp.) y Drimys granadensis (Figura 141). 260 Figura 141. Perfil de vegetación arbustiva en la E2, parcela tres (3340 m.s.n.m). 1. Munnozia sp., 2. Hesperomeles ferruginea, 3. Gaultheria sclerophylla, 4. Cavendishia bracteata, 5. Peperomia sp., 6. Prionodon sp., 7. Hymenophyllum sp., 8. Rubus gachetensis, 9. Peperomia sp., 10. Weinmannia mariquitae, 11. Prionodon sp., 12. Selaginella toropotensis, 13. Thelypteris sp., 14. Maytenus sp., 15. Drimys granadensis, 16. Myrcianthes cf. orthostemon, 17. Blechnum loxense, 18. Oxalis medicaginea, 19. Prionodon sp., 20. Stelis sp. 21. Pteridium aquilinum, 22. Hedyosmum cf. cuatrecazanum, 23. Brunellia goudotii, 24. Myrsine dependens. 25. Miconia sp.8, 26. Selaginella toropotensis, 27. Pleopeltis sp., 28. Stelis sp., 29. Geissanthus cf. bogotensis, 30. Pleurothallis sp., 31. Pleopeltis sp. 32. Bejaria resinosa, 33. Gamochaeta americana, 34. Pentacalia sp. Eje x, longitud del transecto (m); eje y, altura de la vegetación (m). Ilustración Yoao Palchukan (2015). 261 7.1.1.3 Estación tres – E3 (3260 m.s.n.m) En la estación tres predominaron las coberturas de porte medio y alto, cerradas, conformadas por bosques maduros, secundarios, y achaparrados, en estados sucesionales intermedios a avanzados, con dosel más o menos continuo de hasta 15-20 m de altura. En esta cota, los bosques se observan como parches o relictos, que en su mayoría han sido cercados para protección. Es notoria la dominancia de Freziera canescens y F. reticulata, principalmente en los bordes, en terrenos degradados, pedregosos, pendientes y con procesos erosivos, conformando formaciones boscosas de 10-12 m de altura; se presenta un moderado epifitismo de orquídeas (Stelis spp., Pleurothallis spp.) sobre troncos y suelo, anturios (Anthurium oxybelium) y bromelias (Tillandsia spp.) (Figura 142). Otras de las familias y especies de plantas características en esta estación fueron: Ericaceae (Cavendishia cf. nitida, C. bracteata, Gaultheria sclerophylla, Bejaria resinosa), Lauraceae (Aiouea cf. sp., Persea mutisii), Melastomataceae (Axinaea macrophylla, Miconia spp.), Araliaceae (Oreopanax discolor, O. floribundum), Clethraceae (Clethra ovalifolia, C. revoluta), Araliaceae (Schefflera cf. uribei, Schefflera cf. bejucosa); Weinmannia mariquitae, Hedyosmum cf. cuatrecazanum, Ruagea hirsuta, Palicourea cf. ovalis, Saurauia ursina, Cythea sp., Brunellia goudotii, Viburnum pichinchense, Drimys granadensis, Geissanthus cf. bogotensis, Prunus villegasiana y Maytenus sp. (Anexo 15). En este sector se presenta fragmentación de los bosques por la apertura de áreas para el establecimiento de potreros, destinados a la ganadería bovina, la mayoría de relictos boscosos en la finca la Victoria, han sido cercados para su protección en proyectos liderados por el Parque Nacional Natural Las Hermosas y el apoyo del propietario de la finca. Los bosques presentan diferentes estados sucesinales. Estratos vegetales estación tres Las tres parcelas evaluadas presentaron una pendiente de 30-80% o superior, con plantas entre 1,2 y 20 m, conformando cinco estratos vegetales, que se describen a continuación. Rasante (<0,3 m): dominado por musgos (Prionodon sp.), Oxalis medicaginea y helechos (Pleopeltis sp.). 262 Herbáceo (0,3-1,5 m): dominado por helechos (Thelypteris sp.), Pilea sp., y Rynchospora cf. caucana. Arbustivo (1,5-5 m): dominado por Ericaceae (Cavendishia cf. nitida, C. bracteata, Gaultheria sclerophylla), Miconia sp., Maytenus sp., Palicourea cf. ovalis, Hedyosmum cf. cuatrecazanum, Freziera canescens, F. reticulata, Schefflera cf. uribei, Schefflera cf. bejucosa, Prunus villegasiana, Oreopanax floribundum y Begonia sp. Arbolitos (5-12 m): dominado por Freziera reticulata, F. canescens, Weinmannia mariquitae, Ericaceae (Cavendishia cf. nitida, C. bracteata), Araliaceae (Oreopanax discolor, O. floribundum), Hedyosmum cf. cuatrecazanum, Miconia spp., Tournefortia fuliginosa, Viburnum pichinchense, Vallea stipularis y Maytenus sp. Estrato arbóreo inferior (12-25 m): dominado por Ruagea hirsuta, Maytenus sp.), Lauraceae (Aiouea cf. sp., Persea mutisii), Myrcianthes cf. orthostemon y Clethra revoluta (Figura 143). Figura 142. Área de influencia E3 (3260 m.s.n.m), A) Panorámica de formaciones boscosas, B) Interior de bosque. Palmira (Valle del Cauca). 263 Figura 143. Perfil de vegetación arbustiva en la E3, parcela dos a 3260 m.s.n.m. 1. Tournefortia fuliginosa, 2. Oreopanax floribundum, 3-4. Palicourea cf. ovalis, 5-6. Oreopanax floribundum, 7. Viburnum pichinchense, 8. Oreopanax floribundum, 9. Palicourea cf. ovalis, 10. Persea mutisii, 11. Myrcianthes cf. orthostemon, 12. Hedyosmum cf. cuatrecazanum, 13. Lippia hirsuta var. moritzii, 14. Maytenus sp., 15. Weinmannia mariquitae, 16. Vallea stipularis, 17. Daphnopsis cf. bogotensis, 18. Prunus villegasiana, 19. Tournefortia fuliginosa. Eje x, longitud del transecto (m); eje y, altura de la vegetación (m). Ilustración Yoao Palchukan (2015). 264 7.1.1.4 Estación cuatro - E4 (3.180 m.s.n.m) En la estación cuatro predominaron coberturas de porte medio y alto, cerradas, conformadas por bosques maduros y secundarios, en estados sucesionales intermedios a avanzados, con dosel más o menos continuo de hasta 12-18 m de altura. Al igual que la estación anterior, los bosques son franjas relativamente angostas donde predominan Freziera canescens y F. reticulata. Algunas de las familias botánicas con mayor número de especies fueron: Ericaceae (Cavendishia bracteata, Gaultheria sclerophylla, Vaccinium floribundum, Bejaria resinosa), y Melastomataceae (Axinaea macrophylla, Miconia spp., Brachyotum ledifolium, Tibouchina mollis, T. lepidota); y especies como, Persea mutisii, Clethra revoluta, Weinmannia mariquitae, W. rollotii, Freziera cf. bonplandiana, Brunellia goudotii, Oreopanax discolor, O. floribundum, Hesperomeles ferruguinea, Monnina angustata, Escallonia paniculata, Hedyosmum cf. cuatrecazanum, Myrcianthes cf. orthostemon, Vallea stipularis, Maytenus sp., Palicourea cf. ovalis, Saurauia ursina, Cythea sp., Viburnum pichinchense y Ternstroemia cf. meridionalis (Anexo 15). En este sector, las formaciones boscosas se encuentran intervenidas y entresacadas de maderas finas, como Podocarpus oleifolius, especie de la que se observaron solo individuos pequeños (Figura 144). Estratos vegetales estación cuatro Las tres parcelas evaluadas presentaron una pendiente de 20-80%, con plantas entre 1,3 y 25 m, conformando cinco estratos vegetales, que se describen a continuación: rasante (<0,3 m), herbáceo (0,3-1,5 m), arbustivo (1,5-5 m) y subarbóreo o de arbolitos (5-12 m). Rasante (<0,3 m): dominado por Oxalis medicaginea, Tillandsia sp., Disterigma acuminatum, selaginelas (Selaginella tarapotensis), helechos (Elaphoglossum sp.) y Peperomia sp. Herbáceo (0,3-1,5 m): dominado por helechos (Thelypteris sp., Blechnum loxense, Cyathea sp.) y Gaiadendron punctatum. Arbustivo (1,5-5 m): dominado por Viburnum pichinchense, Cyathea sp., Gaiadendron punctatum, Hedyosmum cf. cuatrecazanum, Hesperomeles ferruguinea, Monnina angustata, Tibouchina mollis, Miconia spp. y Ericaceae (Cavendishia bracteata, Gaultheria sclerophylla, Vaccinium floribundum). 265 Arbolitos (5-12 m): dominado por Freziera reticulata, F. canescens, Weinmannia mariquitae, W. rollotii, Brunellia goudotii, Oreopanax discolor, Escallonia paniculata, Hedyosmum cf. cuatrecazanum, Miconia spp., Myrcianthes cf. orthostemon, Vallea stipularis, Ternstroemia cf. meridionalis y Maytenus sp. Estrato arbóreo inferior (12-25 m): dominado por Freziera reticulata, F. canescens, F. cf. bonplandiana, Vallea stipularis, Oreopanax floribundum, Brunellia goudotii, Ternstroemia cf. meridionalis, Maytenus sp., y Ocotea heterochroma (Figura 145). Figura 144. Formaciones boscosas, área de influencia E4 (3180 m.s.n.m), Palmira (Valle del Cauca). 266 Figura 145. Diagrama de perfil de vegetación en la E4, parcela tres a 3180 m.s.n.m 1. Cyathea sp., 2. Viburnum pichinchense, 3-4. Cyathea sp., 5. Miconia lehmannii, 6-7. Weinmannia mariquitae., 8. Maytenus sp., 9. Hedyosmum cf. cuatrecazanum, 10. Cavendishia bracteata, 11. Ternstroemia cf. meridionalis, 12. Gaiadendron punctatum, 13. Oreopanax floribundum, 14. Gaiadendron punctatum, 15. Freziera cf. bonplandiana, 16. Vallea stipularis. Eje x, longitud del transecto (m); eje y, altura de la vegetación (m). Ilustración Yoao Palchukan (2015). 267 7.1.1.5 Estación cinco – E5 (3100 m.s.n.m) En la estación cinco se encontraron coberturas de porte medio y alto, cerradas, conformadas por bosques maduros y secundarios, en estados sucesionales intermedios a avanzados, con dosel discontinuo a moderadamente continuo de hasta 15-20 m de altura. Al igual que las estaciones anteriores, en esta cota, los bosques son relictos, confinados y divididos por potreros, regeneraciones intermedias y rastrojos, por estar cerca a fincas, caminos y zonas de producción. Las especies dominantes son Freziera reticulata, F. canescens, F. cf. bonplandiana, Brunellia goudotii, Oreopanax discolor, O. floribundum, Escallonia paniculata, Hedyosmum cf. cuatrecazanum, Vallea stipularis, Maytenus sp., Myrsine coriacea, Clethra revoluta, Myrcia sp., Persea mutisii, Aiouea cf. sp., Ocotea heterochroma, Roupala pachypoda, Axinaea macrophylla, Miconia spp., Ruagea hirsuta, Hedyosmum cf. cuatrecazanum, Meliosma sp., Palicourea cf. ovalis, Saurauia ursina, Cythea sp., Lippia hirsuta, Geissanthus cf. bogotensis, Prunus villegasiana, Ceroxylon parvifrons, Viburnum pichinchense y Turpinia sp. (Anexo 15). Se presenta moderado a alto epifitismo de bromelias (Tillandsia spp.), orquídeas (Pleurothallis spp., Stelis spp., Epidendrum spp.) y anturios (A. martae, Anthurium oxybelium). Estas coberturas se encuentran moderada a altamente intervenidas, la topografía del terreno es quebrada a escarpada, con pendientes medias a altas (Figura 146). Estratos vegetales estación cinco Las tres parcelas evaluadas presentaron una pendiente superior al 20%, con plantas entre 1,4 y 20 m de altura, conformando cinco estratos vegetales, que se describen a continuación: Rasante (<0,3 m): dominado por plegaderas (Hydrocotile sp.); Oxalis medicaginea, musgos (Prionodon sp.); anturios (Anthurium oxybelium), Begonia sp.). Herbáceo (0,3-1,5 m): dominado por helechos (Thelypteris sp.) y cortaderas (Carex cf. pichinchensis). Arbustivo (1,5-5 m): dominado por Miconia pustulata, Persea mutisii, Meliosma sp., Cythea sp., Prunus villegasiana, Ruagea hirsuta, Roupala pachypoda, Lippia hirsuta, Oreopanax floribundum, Palicourea ovalis. 268 Arbolitos (5-12 m): dominado por Palicourea ovalis, Clethra revoluta, Sessea sp., Solanum cf. ovalifolium, Gynoxis sp., Geissanthus cf. bogotensis, Ceroxylon parvifrons, Ruagea hirsuta, Roupala pachypoda, Viburnum pichinchense, Turpinia sp., Hedyosmum cf. cuatrecazanum, Meliosma sp., Maytenus sp. y Miconia spp. Se presenta moderado a alto epifitismo de bromelias (Tillandsia spp.), orquídeas (Pleurothallis spp., Stelis spp., Epidendrum spp.) y anturios (Anthurium oxybelium, A. martae). Arbóreo inferior (12-25 m): dominado por Oreopanax discolor, Roupala pachypoda, Sessea sp., Clethra revoluta, Myrsine coriacea, Freziera canescens y Persea mutisii, Aiouea sp., Ocotea heterochroma (Figura 147). Figura 146. Formaciones boscosas y palma de cera (Ceroxylon parvifrons) en el área de influencia de la E5 (3100 m.s.n.m). Palmira (Valle del Cauca). 269 Figura 147. Perfil de vegetación boscosa en la E5, parcela tres a 3100 m.s.n.m 1. Escallonia paniculata, 2-3. Miconia sp. 1, 4 Myrcia sp., 5. Miconia sp. 1, 6. Aiouea sp., 7. Meliosma sp., 8. Roupala pachypoda, 9. Myrsine coriacea, 10. Berberis sp., 11. Roupala pachypoda, 12. Clethra revoluta, 13-14. Roupala pachypoda, 15. Viburnum pichinchense, 16. Ocotea heterochroma, 17. Clethra revoluta, 18. Geissanthus cf. bogotensis. Eje x, longitud del transecto (m); eje y, altura de la vegetación (m). Ilustración Yoao Palchukan (2015). 270 7.1.2 Curva de representatividad de los muestreos El muestreo fue significativo en las seis estaciones con valores mayores al 85%, para el estimador de riqueza de especies Boostrap. En cuanto al estimador basado en la abundancia (Chao 1), E1, E2, E3 y E5 fueron representativas con un 87%, 81%, 89% y 81% respectivamente, mientras que la estación E4 llegó al 50% de efectividad (Figura 148). 271 Observadas Chao 1 Bootstrap 80 60 Riqueza 60 Riqueza Observadas Chao 1 Bootstrap 80 40 40 20 20 A 0 0 1 2 B 0 0 3 1 Observadas Chao 1 Bootstrap 60 Riqueza Riqueza Observadas Chao 1 Bootstrap 80 60 40 20 40 20 C 0 0 1 2 D 0 3 0 1 Unidades de muestreo 2 3 Unidades de muestreo Observadas Chao 1 Bootstrap 80 E1 E2 E3 E4 E5 80 60 Riqueza 60 Riqueza 3 Unidades de muestreo Unidades de muestreo 80 2 40 40 20 20 E 0 0 1 2 F 0 0 3 1 2 3 Unidades de muestreo Unidades de muestreo Figura 148. Curvas de acumulación de especies de la riqueza observada y la riqueza estimada por Bootstrap y Chao 1. A. E1 (3420 m.s.n.m), B. E2 (3340 m.s.n.m), C. E3 (3260 m.s.n.m), D. E4 (3180 m.s.n.m), E. E5 (3100 m.s.n.m), F. Curvas con el estimador Chao 1 para cada estación. Palmira (Valle del Cauca). 272 7.1.3 Riqueza y composición florística La E2 tuvo el mayor número de especies (66), géneros (61), familias (42) e individuos (275), respecto a las demás estaciones, ya que es una zona donde se encuentran elementos de páramo y de bosque, con especies de arbustos, hierbas y rasantes, dándole una configuración más compleja, que le otorga una considerable riqueza y abundancia de plantas (Figuras 148 y 149). Sin embargo, la E3 para su bajo número de especies (32), géneros (26), familias (21) en el transecto, presenta una cantidad considerable de individuos (275) con respecto a las demás estaciones, este hecho puede estar ligado con la notoria abundancia de Palicourea cf. ovalis, Freziera canescens, Hedyosmum cf. cuatrecazanum y Oreopanax floribundum (Figuras 149 y 150). Ninguna familia botánica presentó más de nueve especies en el transecto, siendo Ericaceae la que registró el mayor número, en las estaciones E2 (9), E1 (6) y E4 (5); posteriormente Orchidaceae se destacó con seis especies en la E2, y Melastomataceae, con 6 especies en la E5; el resto de las familias oscilaron entre 1 y 4 especies (Figura 151). Familias como Ericaceae y Asteraceae fueron representativas en E1 y E2 ubicadas a mayor altitud (3420–3340 m.s.n.m) en el transecto, ya que presentaron más de dos especies cada una. Otras familias como, Melastomataceae, Araliaceae tuvieron mayor representatividad con más de dos especies en las estaciones más bajas del transecto (E3, E4 y E5), según autores como Gentry (1995) y Rangel (1995) estas últimas familias son típicas de ecosistemas boscosos (Figura 151). 273 Especies 6 70 5 60 4 50 3 2 Riqueza Riqueza 7 Géneros Familias 40 30 1 20 0 10 0 Estaciones E1 (3520 m) E2 (3440 m) E3 (3360 m) E4 (3280 m) E5 (3200 m) E6 (3120 m) Familias por Estaciones Figura 149. Riqueza y composición florística en el transecto de Palmira (Valle del Cauca). 300 275 250 Abundacias 205 200 177 150 176 127 100 50 0 Estaciones Figura 150. Abundancia florística en el transecto de Palmira (Valle del Cauca). 274 Riqueza 10 9 8 7 6 5 4 3 2 1 0 E1 (3420 m) E2 (3340 m) E3 (3260 m) E4 (3180 m) E5 (3100 m) Familias por Estaciones Figura 151. Familias botánicas con mayor número de especies en las estaciones del transecto altitudinal de Palmira (Valle del Cauca). 7.1.3.1 Diversidad Alfa () Los valores más altos de diversidad se presentaron en E1 y E2, con 3,13 y 3,91 respectivamente para Shannon-Wiener (H`), y 0,95 y 0,98 para Simpson (S), estos altos niveles de diversidad probablemente se deban al número de especies (E1-34 y E2-66); los valores más bajos los presentaron las estaciones E3 y E4 con un índice H`= 2,87 y 2,99 (Tabla 72) y con un índice S= 0,92 y 0,93, respectivamente, quienes cuentan con un bajo número de especies (E3-32 y E4-35) y alta cantidad de individuos en pocas especies. E1 y E2 ubicadas en las partes altas del transecto se conforman por coberturas vegetales donde habita un considerable número de especies con poca dominancia (Tabla 72), no obstante las estaciones E3 y E4 localizadas en las zonas bajas del transecto compuestas por coberturas boscosas, presentaron baja diversidad además de la gran dominancia de unas pocas especies. Estos análisis se corroboraron por medio de una prueba t, en la que muestra que, si hay cierta diferencia entre las E1 y E2, es baja (-10.246); en la E2 se muestra diferencias significativas claras (P< 0,05 en todos los casos), con las estaciones E3, E4 y E5 (Tabla 73), que a su vez estas últimas no tienen diferencias significativas entre sí y las hace diferentes al resto de estaciones. 275 Tabla 72. Índice de Dominancia de Simpson (S) e Índice de Diversidad de ShannonWiener (H`) para las estaciones estudiadas en el transecto de Palmira. Índices de Diversidad E1 E2 E3 E4 E5 Simpson (Inverso) 0,95 0,98 0,92 0,93 0,94 Sannon-Wiener (ln) 3,13 3,91 2,87 2,99 3,11 Tabla 73. Prueba de t Índice de Diversidad de Shannon-Wiener (H`) para las estaciones estudiadas en el transecto de Palmira. E1 E1 (3420 m) E2 E3 E4 E5 -10,246 2,7741 1,7216 0,70874 E2 (3340 m) 3,36E-17 E3 (3260 m) 5,86E-03 1,09E-23 E4 (3180 m) 8,61E-02 6,15E-21 3,33E-01 E5 (3100 m) 4,79E-01 1,05E-15 0,079893 10,965 10,124 8,6792 0,96984 -1,7574 -0,83357 4,05E-01 7.1.3.2 Diversidad beta () Los dendogramas ilustrados en la Figura 152 A y C, forman dos grupos con los índices de similitud de Sorensen en un corte de 30% y Jaccard en un corte de 20%: uno de ellos lo comprenden las estaciones E1-E2, con un 35% de similitud (Sorensen) y un 22% (Jaccard), para el segundo grupo las estaciones E3, E4 y E5 se asimilan en un 48% (Sorensen) y 32% (Jaccard). Los resultados arrojados por el índice de similitud de Bray-Curtis con un corte de similitud del 24%, agrupan de manera diferente el cladograma, estableciendo similitudes en las estaciones E3, E4 y E5 con un 30% (Figura 152 B), y las estaciones E1 y E2 como grupos individuales. En síntesis, las mayores afinidades se evidencian en las estaciones de la parte baja del transecto (E3-E5) ubicadas en formaciones boscosas, entre 3260 y 3100 m.s.n.m, y ciertas semejanzas en las E1 y E2 ubicadas en la parte alta del transecto entre 3420 y 3.340 m.s.n.m. 276 Figura 152. Índices de similitud para vegetación, A. Sorensen, B. Bray-Curtis y C. Jaccard. Palmira (Valle del Cauca). Índice de Whittaker De acuerdo con este índice, E1 y E2 difieren en más del 62% con las estaciones E3, E4 y E5, siendo la E1 la que más alejada está de las demás estaciones (Tabla 74). Esto explica que la composición de especies entre dichas zonas es totalmente compartida ya que a medida que aumenta la distancia entre los ensamblajes disminuye la similitud. Por otro lado, las estaciones E3, E4 y E5 se complementan en menos del 59% (Tabla 74), debido a las especies en común entre esas estaciones, apoyando los resultados de los análisis anteriores. 277 Tabla 74. Índice de Whittaker para el transecto de Palmira (Valle del Cauca). E1 (3420 m) E2 (3340 m) E3 (3260 m) E4 (3180 m) E5 (3100 m) E1 E2 E3 E4 E5 0 0,66 0,85 0,74 0,94 0 0,67 0,62 0,74 0 0,43 0,48 0 0,59 0 7.1.3.3 Estratos vegetales El estrato herbáceo predominó en las E1 y E2 con un 52% y 57% de individuos respectivamente, la E1 además de presentar dominancia de hierbas, también es representada por estratos rasantes, a comparación de la E2, donde se empieza a notar un considerable número de arbustos (31%) y comienza a disminuir los individuos rasantes (Figura 153). Los estratos de arbustos y arbolitos empiezan a destacarse en las estaciones bajas (E3, E4 y E5), los arbustos tienden a reducir a medida que disminuye la elevación altitudinal, de un 65% en la E1 a un 43% en la E5, en cambio los arbolitos empiezan a aumentar su número de un 28% (E3) a un 45% y 41% en las E4 y E5, este comportamiento aplicó de manera similar con el estrato arbóreo (Figura 153). 278 70 Arbóreo Porcentaje de individuos 60 Arbolitos 50 40 Arbustivo 30 Herbáceo 20 Rasante 10 0 Estaciones Figura 153. Distribución de individuos según estratos vegetales por estación, en el transecto de Palmira. 7.1.3.4 Índice de Valor de Importancia (IVI) La dominancia relativa en general para todo el transecto es variable, en donde sobresale, Calamagrostis sp. en E1 (40,33), Clethra revoluta en E5 (27,91) y Freziera reticulata en la E4 (24,61), que además son las primeras en ocupar el IVI en cada estación, con 52,13, 45,18 y 42,39 respectivamente (Tabla 75, Figura 154). Para la densidad relativa, sobresalen las estaciones E3, E4 y E5, donde se destacan especies como: Palicourea cf. ovalis, con 17,51 (E3); Freziera reticulata y F. canescens, con 14,20 cada una (E4); y Clethra revoluta y Roupala pachypoda, con 11,81 cada una (E5), estas especies forman poblaciones comunes en estas alturas (3260 a 3100 m.s.n.m). E1 y E2, presentan densidades que no varían mucho, pero dominancias variables que definen sus valores de IVI. En cuanto las frecuencias relativas por su parte tienen poca fluctuación en todas las estaciones (Figura 154). En las tres estaciones más bajas (E3 a E5) ubicadas en coberturas boscosas, fue muy variable la dominancia y la densidad (Figura 153), comprendiendo especies con altos valores de IVI, por su alta densidad y dominancia, como: Hedyosmum cf. cuatrecazanum (E3 y E5); en la E4, por su considerable dominancia, F. reticulata presentó un alto valor de IVI; y finalmente por su dominancia relativa, Clethra revoluta, presentó el mayor IVI en la E5 (Tabla 76, Figura 154). 279 Tabla 75. Especies con mayor Índice de Valor de Importancia en E1 y E2 del transecto de Palmira (Valle del Cauca). Familia Especie Estaciones IVI/E1 IVI/E2 Poaceae Calamagrostis sp. 52,13 Asteraceae Espeletia hartwegiana 19,79 Poaceae Achiachne aff. pulvinata 19,73 Ericaceae Bejaria resinosa 19,73 Selaginellaceae Selaginella tarapotensis 17,11 Ericaceae Disterigma acuminatum 20,60 Celastraceae Maytenus sp. 14,69 Ericaceae Cavendishia bracteata 13,34 Rosaceae Hesperomeles ferruginea 13,03 Ericaceae Gaultheria sclerophylla 12,17 Tabla 76. Especies con mayor Índice de Valor de Importancia en las E3 a E5 del transecto de Palmira (Valle del Cauca). Familia Especie Estaciones IVI/E3 IVI/E4 IVI/E5 Clethraceae Clethra revoluta 45,18 Proteaceae Roupala pachypoda 25,44 Chloranthaceae Hedyosmum cf. cuatrecazanum Lauraceae Ocotea heterochroma 23,78 Sabiaceae Meliosma sp. 13,28 Pentaphylacaceae Freziera reticulata Pentaphylacaceae Freziera canescens Cyatheaceae Cyathea sp. Celastraceae Maytenus sp. Adoxaceae Viburnum pichinchense Rubiaceae Palicourea cf. ovalis 28,22 Myrtaceae Myrcianthes cf. orthostemon 26,52 30,67 24,93 42,39 22,22 31,48 28,44 25,76 280 16,42 15,78 60 Densidad relativa Frecuencia relativa Dominancia relativa 50 I.V.I 40 30 20 10 0 E1 (3420 m) E2 (3340 m) E3 (3260 m) E4 (3180 m) E5 (3100 m) Especies Figura 154. Especies que presentaron el mayor valor en el Índice de Valor de Importancia (IVI) para el transecto altitudinal de Palmira (Valle del Cauca). 7.1.3.5 Conclusiones En las estaciones E1 y E2 ubicadas a mayor altitud (3420 y 3340 m.), predominaron estratos vegetales rasante y herbáceo; en las tres estaciones ubicadas a menor altitud (entre 3260 y 3100 m.) predominaron estratos vegetales de arbolitos, arbustos y árboles. Lo anterior indica que a partir de E3, ubicada a 3260 m., la composición, diversidad y estratos vegetales cambian. Igualmente, a partir de esta estación la diversidad de Shannon-Wiener disminuyó y se evidenció un recambio de especies según el índice de Whittaker. El estrato vegetal rasante, compuesto por formas de crecimiento como rosetas y talófita-líquen, sólo se encontró en las dos primeras estaciones. El estrato vegetal de arbustos se presentó en todas las estaciones, sin embargo, su mayor abundancia se encontró en las estaciones E3, E4 y E5. El páramo se ubicó por encima de la estación E2, predominando las coberturas abiertas como herbazales-frailejonales. 281 Las estaciones E2 y E3, presentan un subpáramo, delimitado por arbustales densos de porte medio-alto que forman una franja bien definida, con inclusiones de especies propias de subpáramo y algunas de bosque. Esta zona presenta un buen estado de conservación, gracias a las condiciones de manejo y de topografía, las cuales pueden influenciar este aspecto. Las estaciones E3-E4 corresponden al límite inferior presentan coberturas predominantes de porte medio y alto formadas por bosques y arbustales. Predominan especies arbóreas de bosque altoandino y algunas de subpáramo. La cercanía de esta cota a las zonas de producción de los predios y fincas, ha generado una moderada a alta fragmentación de las coberturas boscosas, en especial por el desmonte para expansión de las áreas de ganadería y potreros. Actualmente muchos de estos relictos están cercados para su conservación, y algunos se asocian a fuentes de agua y quebradas. La conectividad entre estos fragmentos es baja. La cota entre las estaciones E4-E5 corresponde con coberturas boscosas de porte alto, con predominancia de especies altoandinas arbóreas y algunas de subpáramo. Esta cota presenta también procesos de fragmentación por su cercanía a los predios y áreas de producción o pastizales, viéndose estos bosques confinados a zonas de alta pendiente o riberas de quebradas. El estado de sucesión de estas coberturas es intermedio a avanzado. 7.2 EDAFOFAUNA 7.2.1 Riqueza y composición de especies en el transecto altitudinal Se colectaron 2293 individuos, los cuales se clasificaron en 51 morfoespecies, distribuidas en 7 órdenes y aproximadamente 33 familias. La especie con mayor número de individuos fue una hormiga del género Labidus sp.67 con 1302 individuos, seguida por un grillo del género Gryllus sp.2 con 224 individuos, tres escarabajos de la familia Carabidae (Bembidion sp.10 con 167, Bembidion sp.22 con 77 y Bradycellus sp.1 con 68 individuos), una araña (Araneomorphae sp.18) con 57 individuos y otro carabido (Dercylus sp.21) con 51 individuos. El resto de morfoespecies presentan menos de 50 individuos (Anexo 16). Se observó que la especie más abundante Labidus sp.67, se encuentra presente desde la tercera estación altitudinal, hasta la quinta, siendo dominante en E3 (Anexo 16). La importancia de este registro, radica en que este grupo de hormigas pertenece a una subfamilia conocida como “legionarias” (Formicidae: Ecitoninae), las cuales se caracterizan por cazar en enjambres compuestos por millares de individuos que se desplazan por el suelo (Hölldobler y Wilson 1990) y por presentar fases nómadas en su comportamiento. Su estrategia de forrajeo implica incluso la probabilidad de explotar nuevamente aquellas zonas en las que 282 recientemente cazaron y evitar desplazarse por áreas que fueron usadas por otras, aumentando así la cantidad de nuevas rutas dentro de un paisaje (Franks y Fletcher 1983). Este comportamiento implica el movimiento de una gran cantidad de fauna tras sus rutas de forrajeo, tales como aves, otros vertebrados y artrópodos. Por lo que su presencia está relacionada a un área amplia y con estabilidad ecosistémica para lograr su desempeño. Los órdenes de mayor riqueza fueron: Coleoptera y Diptera con 25 y 11morfoespecies, seguidos por Araneae y Orthoptera con 4 morfoespecies, los demás órdenes presentaron entre dos y una morfoespecies. En especial los órdenes más abundantes, mostraron patrones diferentes de variación altitudinal. El orden Coleoptera presentó baja abundancia en la primera estación altitudinal, su abundancia fue alta en las dos estaciones intermedias (E2 y E3) y disminuyó de nuevo en las dos estaciones subsiguientes (E4 y E5). Por otro lado, el orden díptera se mostró diferente al mantenerse relativamente estable en todo el transecto altitudinal (Figura 155). Dentro de los insectos encontrados, los coleópteros y las hormigas son grupos clave por su gran cantidad de especies, el relativo buen conocimiento de su historia natural, la sencillez de su muestreo, y la gran cantidad de funciones ecológicas que cumplen (Erwin 1982, World Conservation Monitoring Centre 1992). 14 No de especies 12 10 Coleoptera Diptera 8 6 4 2 0 E1 (3420) E2 (3340) E3 (3260) E4 (3180) E5 (3100) Estaciones altitudinales Figura 155. Número de especies de los dos órdenes más ricos de la edafofauna presente en cinco estaciones de muestreo, transecto Palmira (Valle del Cauca). Riqueza de Carabidae en las estaciones altitudinales Se colectaron siete morfoespecies de coleópteros de la familia Carabidae, los cuales difieren en abundancia en las diferentes estaciones del gradiente altitudinal (Figura 156). La morfoespecie Carabidae sp.51 se presentó exclusivamente en las 283 dos primeras estaciones altitudinales, mientras Bradycellus sp.11 apareció solo en E4. El resto de morfoespecies presentaron individuos en toda la franja, pero consistentemente no presentaron individuos en E1. Además, cada especie presentó picos de abundancia en diferente estación altitudinal; de ellos resaltan por su dominancia Bembidion sp.10, que presenta su máxima abundancia en E4 y Bradycellus sp.1, que la presenta en E3 (Figura 156). Según Terborg (1971), existen tres modelos con capacidad para predecir los patrones de distribución de las especies a lo largo de gradientes altitudinales. El modelo 1 predice que puede deberse a la amplitud ecológica de las especies, el modelo 2 dice que es por exclusión competitiva y el 3 por discontinuidades en el hábitat. En este caso, es posible que la amplitud de cada especie responda a cambios graduales de condiciones favorables a lo largo del gradiente; siendo así, es posible que la posibilidad de expansión de las especies está siendo expuesta, a la intensidad de factores controladores que se oponen a su natural tendencia de dispersión (Camero y Chamorro 1999). 80 70 No de especies 60 50 40 Bradycellus sp.1 Bembidion sp. 10 Bradycellus sp.11 Dercylus sp. 21 Bembidion sp. 22 Carabidae sp.51 30 20 10 0 E1 (3420) E2 (3340) E3 (3260) E4 (3180) E5 (3100) Estaciones altitudinales Figura 156. Abundancia de seis morfoespecies de la familia Carabidae con preferencias altitudinales en cinco estaciones de muestreo, transecto Palmira (Valle del Cauca). Es de esperarse que existan diferencias en la composición de las especies de carábidos a lo largo de gradientes altitudinales, donde la selección de poblaciones por factores externos genera cambios intraespecíficos en su historia evolutiva, y la diferenciación de poblaciones seleccionadas produce poblaciones de especies distintas, emparentadas entre sí al menos en un mínimo de variaciones corporales (Krekeler 1962). Particularmente, la diversidad de este grupo presentó una tendencia a incrementar a medida que disminuye el gradiente altitudinal (Figura 157). 284 120 No de especies 100 Carabidae 80 60 40 20 0 E1 (3420) E2 (3340) E3 (3260) E4 (3180) Estaciones altitudinales E5 (3100) Figura 157. Abundancia neta de especies de la familia Carabidae a través del gradiente altitudinal muestreado, transecto Palmira (Valle del Cauca). Se cree que los coleópteros responden a los mismos factores que las plantas, o las diferencias en la composición de sus ensambles podrían deberse a asociaciones con la identidad de la flora (Werenkraut 2010). Siendo así, muy posiblemente las variaciones altitudinales están también mostrando cambios en la composición y la estructura vegetal que se pueden estar presentando en cada estación evaluada. 7.2.1.1 Diversidad alfa Representatividad y esfuerzo de muestreo Según los índices Chao1 (abundancia) y Chao2 (incidencia), el muestreo tuvo una representatividad entre el 60% y el 65% respectivamente. La curva de acumulación de especies Chao2 para todo el transecto presenta tendencia a seguir creciendo, con lo que se asume que es posible seguir encontrando algunas especies. Por el contrario, la tendencia asintótica de las curvas de las especies que se encuentran con un solo indivíduo (Singletons) con 49% y las que se encuentran con dos indivíduos (Doubletons) con 18%, predicen que no se seguirán encontrando nuevas especies si se continúan realizando más muestreos (Figura 158, esquema de la parte superior). 285 250 Transecto No de morfoespecies 200 S(est) Singletons Mean Doubletons Mean Chao 2 Mean Chao 1 Mean 150 100 50 0 0 1 2 3 4 5 Estaciones altitudinales 40 40 No de morfoespecies E1 E2 30 30 20 20 10 10 0 0 0 5 10 286 0 5 10 50 60 E3 40 No de morfoespecies E4 50 40 30 30 20 20 10 10 0 0 0 5 0 10 No de morfoespecies 10 Unidades de muestreo Unidades de muestreo 30 5 E5 20 10 0 0 5 10 Unidades de muestreo Figura 158. Curvas de acumulación de especies para la Edafofauna epígea realizada para las cinco estaciones de muestreo, transecto Palmira (Valle del Cauca). Analizando la incidencia Chao2 en cada estación altitudinal, se observan estaciones con un alto porcentaje de muestreo como E1 (91%) y E2 (83%), estaciones con un muestreo aceptable como E5 (79%); y estaciones con un muestreo bajo, como es el caso de E3 68% y E4 (42%) (Figura 157). Chao 1 no presentó mayores diferencias en esta tendencia. 287 Riqueza y abundancia de especies por estación altitudinal Se observó que la riqueza es mayor en las estaciones E2 y E3 y menor en E1, mientras que la abundancia es mayor en E4 e igualmente menor en E1. Como tendencia general, la riqueza fue muy estable a medida que se desciende en el gradiente altitudinal (Figura 157), pero la abundancia presenta sesgos por ciertas estaciones altitudinales (entre E2 y E5). Es muy posible que estos valores además estén influenciados, por los bajos porcentajes de muestreo obtenidos desde E3 hasta E5 (Figura 159). Riqueza Abundancia 90 80 No de individuos No de morfoespecies 30 20 10 70 60 50 40 30 20 10 0 0 E1 E2 E3 E4 E5 (3420) (3340) (3260) (3180) (3100) E1 E2 E3 E4 E5 (3420) (3340) (3260) (3180) (3100) Estaciones altitudinales Estaciones altitudinales Figura 159. Riqueza y Abundancia de especies de Edafofauna, en cinco estaciones altitudinales, transecto Palmira (Valle del Cauca). Se pudo observar en la Tabla 77, una diferencia notable entre los valores de la abundancia neta y la abundancia relativa. Este comportamiento se pudo explicar dada la presencia de una especie de hormiga (Labidus sp.67) en E3 y E5, la cual incrementa notablemente la abundancia del conjunto total de especies. Esto sumado a la presión depredadora que ejercen, les da un carácter relevante a las hormigas legionarias en los ecosistemas de alta montaña. 288 Tabla 77. Diversidad Alfa en Edafofauna epígea de cinco estaciones altitudinales, transecto Palmira (Valle del Cauca). Estación Altitudinal Shannon H´ Simpson 1-D Riqueza Abundancia Abund/ relativa E1 2,418 0,8777 18 62 42 E2 2,519 0,8884 23 158 71 E3 2,522 0,8953 24 1199 80 E4 2,206 0,8259 21 338 85 E5 2,409 0,8713 21 543 66 Índices Shannon y Simpson Según el índice Shannon E3 (3260 m.s.n.m) fue la estación más diversa en especies y con las más altas dominancias; no obstante, los valores de diversidad y dominancia no difieren mucho de los del resto de estaciones (Tabla 77). Estadísticamente por medio de una prueba t se encontraron pocas diferencias significativas entre estaciones, E1 fue la única estación que presenta diferencias significativas con casi todas las demás estaciones (E3, E4 y E5, Tabla 78). Aunque se hace la salvedad de que esto posiblemente sea un efecto de la baja incidencia de individuos en las especies colectadas. Tabla 78. Valores t student y P valor para las medias de la riqueza observada en cada estación altitudinal, transecto Palmira (Valle del Cauca). Estaciones E1 E1 E2 E3 E4 E5 -1,896 -2,249 -2,012 -2,141 -1,170 -1,663 -1,663 -0,980 0,718 E2 P: 0,063 E3 P: 0,028 P: 0,247 E4 P: 0,049 P: 0,102 P: 0,331 E5 P: 0,032 P: 0,102 P: 0,718 1,315 P: 0,194 *Los números subrayados hacen referencia a estaciones con diferencias significativas Comportamiento de la diversidad a lo largo del gradiente altitudinal Tal como lo predice Janzen (1993), el aumento de la altitud en ecosistemas naturales, se refleja en cambios en la composición natural de las especies de artrópodos. En ese sentido la sensibilidad estará ligada a los atributos propios de la especie, como el grado de especialización ecológica, tamaño del cuerpo y patrón de desplazamiento propios de esta (Fuentes y Camero 2006). Los 289 resultados señalan que existen picos en la diversidad y la riqueza de especies entre los 3260-3180 m.s.n.m, lo cual muestra que la diversidad en este ecosistema no decrece necesariamente de manera monótona en función del gradiente altitudinal, sino que pueden existir respuestas diferenciadas a elevaciones medias. Rangos de abundancia Se determinaron dos especies como abundantes (aquellas observadas en las cinco estaciones), 15 como comunes (observadas entre tres y cuatro estaciones), nueve como poco comunes (observadas en dos estaciones) y 25 especies como escasas (las que fueron observadas una sola vez) (Figura 160). Se observó que el 49% de las especies se agrupan dentro del rango de especies escasas, lo que muestra un elevado porcentaje de especies con bajas densidades en el total de especies muestreadas (Figura 160). Esto nos muestra que en los ecosistemas de alta montaña existen poblaciones que por sus bajas densidades son más vulnerables a los efectos adversos sobre el ecosistema. Estaciones / Incidencia 6 5 4 3 2 1 Cf. Amphimallon sp.120 Carabidae sp.116?? Cf. Pelidnota sp.114 Elateridae sp.108 Calliphoridae sp.101 Cantharidae sp.80 Hymenoptera sp.98 Elateridae sp.64 Araneomorphae sp.55 Curculionidae Tipula sp25 Araneomorphae sp12 Phoridae sp.9 Acrididae sp.113 Acrididae sp.52 Ichneumonidae sp.50 Curculionidae sp.19 Coleoptera sp.118 Gryllidae sp.43 Dercylus sp. 21 Muscidae sp.16 Coleoptera sp.97 Bembidion sp. 22 Bembidion sp. 10 Bembidion Isopoda sp.4 0 Morfoespecies Figura 160. Curvas de diversidad-dominancia de las morfoespecies de edafofauna epigea, transecto Palmira (Valle del Cauca). En cuanto al análisis por estación altitudinal se determinaron como especies abundantes aquellas observadas en los 10 puntos muestreados, comunes las observadas entre nueve y cinco puntos, poco comunes las observadas entre cuatro y dos puntos y especies escasas las que fueron colectadas en un solo punto por estación (Figura 160). Se observó un número relativamente alto de especies escasas y poco comunes frente al número total de especies por estación 290 altitudinal (la mitad de las especies colectadas, (Figura 161), lo que indica una alta proporción de fauna edáfica con individuos raros, poco abundantes y restringidos propios de estos ecosistemas altoandinos. Por el contrario, se observaron menos especies abundantes; y solo dos especies comunes en las estaciones E3 y E4. Consistentemente ambas especies comunes, Gryllus sp.2 y Bembidion sp.10, tuvieron su mayor abundancia en rangos altitudinales que oscilan entre los 3300 y los 3200 m.s.n.m. en los transectos realizados en Sevilla y en Tuluá. En el transecto realizado en Río Blanco, Gryllus sp.2 mostró ser dominante a lo largo de toda la franja altitudinal, con un claro aumento desde los 2800 m.s.n.m hacia las estación más baja (E6 con 3120 m.s.n.m). En particular, se observó que la distribución de las especies escasas se segrega hacia las estaciones altitudinales más altas (E1, E2 y E3) y que las abundantes lo hacen en las estaciones intermedias E3 y E4 (Figura 161). Figura 161. Curvas de diversidad-dominancia de las morfoespecies de Edafofauna epígea colectadas en cinco estaciones altitudinales, transecto Palmira (Valle del Cauca). Nota: Los números pertenecen al código de cada una de las morfoespecies que se encuentran en el Anexo 16. 7.2.1.2 Recambio de especies (diversidad β) Índice de Whittaker Según Whittaker, se espera que cuanto menor es el número de especies compartidas entre dos biomas, que en este caso son estaciones altitudinales, mayor será el recambio de especies o la diversidad β. Teniendo en cuenta esto, se observa que el mayor recambio se da entre las dos primeras estaciones (de E1 a E2) mostrando una primera zona de recambio. Subsecuentemente los porcentajes son muy semejantes hasta llegar a las dos últimas estaciones, donde se da el menor índice de recambio (entre E4 y E5) (Tabla 79). 291 Tabla 79. Recambio entre pares de estaciones altitudinales según Whittaker Estaciones altitudinales E1 E2 0,55 E3 0,80 0,48 E4 0,79 0,54 0,50 E5 0,74 0,50 0,36 E2 E3 E4 0,29 Análisis de disimilitud SIMPER (Bray-Curtis) La disimilitud por medio del análisis SIMPER (Bray-Curtis), muestra valores semejantes a los calculados por medio de Whittaker, calculando que el mayor porcentaje de recambio de diversidad de edafofauna en la zona, se da entre las estaciones E1 y E2 (Tabla 80, resaltado), con valores cercanos en las estaciones siguientes. No obstante, con este análisis se distinguen mayores diferencias entre las dos estaciones finales (E4 y E5), mostrando diferencias con lo calculado con Whittaker (Tabla 80). Tabla 80. Porcentaje de disimilitud entre pares de alturas por medio del análisis SIMPER. Estaciones altitudinales E1 E2 55% E3 80% 48% E4 79% 55% 50% E5 74% 69% 51% E2 E3 E4 55% Análisis de agrupamiento (Jaccard) El análisis de conglomerados (Cluster) con el índice de Jaccard, sugiere tres grupos (o zonas) con las cinco estaciones, mostrando una separación en E1, una segunda formada por E2 y un tercer grupo formado por E3-E4 y E5 con una semejanza del 36% (Figura 162 A). Este mismo índice muestra altos porcentajes de disimilitud en el paso de la estación E1 a E2, sustentando la primera zona de recambio predicha por Whittaker y SIMPER. 292 Similarity 0,96 0,80 0,64 0,48 0,32 0,16 A. 1 (3520) 2 (3440) 3 (3280) 4 (3200) 5 (3120) Similarity 0,96 0,80 0,64 0,48 0,32 B. 1 (3520) 2 (3440) 3 (3280) 4 (3200) 5 (3120) Figura 162. Clúster de similitud (Jaccard) de la edafofauna epígea presente en cinco estaciones altitudinales, transecto Palmira (Valle del Cauca). Nota: La línea vertical negra muestra el punto de corte de semejanza para el grupo E2- E3-E4. El índice Sorensen-Dice le da mayor solidez a los grupos sugeridos con el índice Jaccard, mostrando incluso una similitud del 60% para el grupo formado por las estaciones E3-E4-E5 (Figura 162 B). 293 Agrupamiento de las estaciones Se observa que aunque se sugieren unos sitios de recambio entre E1 y E2 tanto con Whittaker como con SIMPER (Tabla 79 y 80), los porcentajes de recambio siguen siendo bajos; lo cual puede ser un sesgo para hacer generalizaciones. De igual forma los clusters generados con Jaccard y Sorensen-Dice, muestran separaciones que llevan a formar los grupos E1, E2 y E3-E4-E5, con lo que se supone que las dos zonas de recambio se dan entre E1 y E2 y entre E2 y E3. No obstante aunque estos resultados estén mostrando que se trata de comunidades diferentes en composición de edafofauna, los índices son bajos, lo cual puede estar influenciado por el efecto de la baja incidencia de especies colectadas en todo el transecto altitudinal. 7.2.2 Hábitos ecológicos En este transecto se encontró que 33% de las familias de artrópodos colectadas presentan un hábito alimenticio herbívoro, seguidos por artrópodos con hábitos principalmente depredadores los cuales constituyeron el 29% depredadores, omnívoros con 8%, parásitos 4% y finalmente un 14% para otras estrategias alimenticias (saprófitos, detritívoros y carroñeros) (Tabla 81). Entre los depredadores encontrados, las hormigas se ubican en diferentes niveles de la cadena trófica (Jaffe et al. 1993); pero en especial el género de hormigas legionarias encontrado (Labidus sp.67), hace parte de un grupo sumamente eficientes como depredadoras en el ecosistema. Sus columnas de forrajeo arrasan con toda la fauna depredable de una zona, obligando a la colonia a migrar continuamente en busca de nuevos ambientes; por lo que su presencia está indicando una disponibilidad considerable de hábitat para su desempeño. Su presión depredadora es tan importante, que muchos organismos han desarrollado evolutivamente, mecanismos de defensa específicos contra ellas, mientras otros organismos aprovechan su capacidad depredadora como una estrategia de beneficio propio. Así se sabe de aves que siguen las columnas exploradoras, alimentándose de los insectos, artrópodos e incluso vertebrados que huyen de ellas (Jaffe et al. 1993). 294 Tabla 81. Número de individuos según los principales hábitos alimenticios por estación altitudinal, transecto Palmira (Valle del Cauca). Gremio E1 (3540) E2 (3460) E3 (3380) E4 (3300) E5 (3220) Herbívoros Depredadores Omnívoro Saprófagos/Carroñeros Parásitos/parasitoides 7 3 0 4 3 10 4 1 8 1 5 9 0 6 1 2 8 2 3 2 2 8 1 6 1 Realizando un análisis más detallado del comportamiento de los grupos tróficos por estación altitudinal, se observó que mientras la riqueza de herbívoros tiende a ser mayor en las dos primeras estaciones (E1 y E2), la riqueza de depredadores aumenta en sentido opuesto hacia las tres últimas estaciones (E3 a E5); comportamiento que tiende a evidenciarse igualmente en los omnívoros (Tabla 82). 7.2.3 CONCLUSIONES Se recolectó el mayor número de individuos respecto del transecto realizado en Sevilla, que hasta el momento había sido el más abundante. Se encontró la hormiga legionaria Labidus sp.67, mostrando que en la zona hay buenas condiciones naturales. Aunque la tendencia general del grupo de carábidos (Coleoptera: carabidae) es a aumentar a medida que se desciende en la franja altitudinal, las siete especies encontradas presentan picos de abundancia a diferentes niveles altitudinales; mostrando que cada especie exhibe preferencias altitudinales distintas, a pesar de pertenecer a la misma familia. La riqueza general de especies aumentó, mientras que la abundancia disminuyó a medida que disminuyó el gradiente de altitud. La riqueza de herbívoros tiende a aumentar en lo alto del gradiente (estaciones E1 y E2), mientras que la riqueza de depredadores lo hace hacia el final del gradiente (estaciones E3 a E5). Esta última tendencia se observa semejante en los omnívoros. El número de especies escasas y poco comunes fue relativamente alto, en relación con las especies comunes y abundantes. 295 Se establecieron tres grupos altitudinales en cuanto a la composición de especies: E1, E2 y el último formado por E3-E4-E5. Igual que en los transectos de Sevilla, Tuluá y Rioblanco, se observa un rápido recambio de especies en la parte más alta del transecto (entre E1 a E2), que se tiende a estabilizar hacia el final del transecto, mostrando que la zona alta la diversidad cambia rápidamente a medida que disminuye la altura. 7.3 ANFIBIOS 7.3.1 Riqueza y composición de especies En el transecto altitudinal de Palmira se registró un total de 16 individuos (11 Adultos y 5 Juveniles) que se agrupan en cuatro especies de anuros, todos de la familia Craugastoridae. Ninguna de las especies fue catalogada como abundante de acuerdo al índice de abundancia relativa. Entre estaciones la abundancia de las especies es similar. En la E1, Pristimantis buckleyi fue la que obtuvo mayor número de registros, mientras que en la E5 fue P. piceus (Tabla 82). De las especies observadas se colectó un individuo que pasará a ser voucher del estudio en lo que corresponde al transecto de Palmira. También será usado para obtener tejido y con esto complementar la investigación a través de rasgos funcionales, por parte del laboratorio de diversidad funcional del IAvH, y finalmente será usado para confirmar su identidad taxonómica (Anexo 17). Tabla 82. Riqueza, abundancia absoluta y abundancia relativa de los anfibios adultos registrados en el transecto de Palmira (Valle del Cauca). Estaciones/m.s.n.m Familia/Especie E1/3420 E2/3340 E3/3260 E4/3180 E5/3100 Pristimantis buckleyi 3 (Pc) 0 1 (Ra) 0 0 Pristimantis racemus 2 (Ra) 0 0 0 0 Pristimantis peraticus 0 1 (Ra) 0 1 (Ra) 1 (Ra) Pristimantis piceus 0 5 0 1 0 1 0 1 2 (Ra) 3 Craugastoridae Total individuos El índice de Abundancia Relativa se muestra entre paréntesis; sus categorías son: Ab= Abundante; Co= Común; Pc= Poco común y Ra= Rara. Algunos machos en el área de estudio estaban vocalizado, de ellos solo se detectaron dos bajo este comportamiento (1 P. piceus; 1 P. buckleyi) uno en la noche y el otro en el día respectivamente. Se realizó un gráfico de frecuencias para identificar en que rango de hora se detectó la mayor cantidad de individuos por especie (Figura 163). El macho de P. buckleyi que estaba vocalizando fue el único que se registró durante el día. 296 Figura 163. Frecuencia de detección de individuos por rangos de hora en el transecto de altitud de Palmira, Valle del Cauca. Entre las especies observadas, ninguna está catalogada con algún nivel de riesgo de acuerdo a la lista roja de especies amenazadas, versión 2014.3 (IUCN 2014). A pesar de contar con información en listas rojas mundiales (IUCN) que demuestran el nivel de amenaza de algunas especies y su endemismo para la cordillera Central de Colombia, se evidencia la existencia de vacíos de información en literatura nacional especializada en cuanto a los criterios para definir el nivel de amenaza de las especies. Taxonómicamente hablando, es posible que existan especies sin categoría de amenaza porque se describieron recientemente o se sabe poco de sus poblaciones debido a limitantes en la investigación taxonómica y a restricciones de acceso a las áreas donde habitan (Fernández 2011; RiveraCorrea 2012). Además, teniendo en cuenta el tipo de ecosistema en el que habitan estas ranas y el aislamiento por grandes barreras geográficas, se observa la restringida distribución de dos especies que fueron registradas para el estudio y que además son endémicas para Colombia, específicamente en la cordillera Central. En el caso de P. piceus, es una especie endémica para Colombia pero se distribuye en dos cordilleras, y P. buckleyi tiene una estrecha distribución entre Colombia y Ecuador, de manera que se cataloga como casi endémica (Tabla 83). Desde hace algunos años se viene documentando que la distribución aislada es comúnmente observada en las ranas del género Pristimantis que habitan en las cordilleras. Son ranas que tienen áreas de distribución restringidas debido a la estrecha relación que se genera entre los individuos y el ecosistema que habitan, dando como resultado a nivel regional que estos organismos soporten procesos únicos que son 297 expresados en una alta endemicidad (Lynch et al. 1997; Lynch 1999; Ardila y Acosta 2000). Ninguna de las especies ha sido objeto del comercio de fauna silvestre, de manera que no están catalogadas dentro de ningún apéndice del CITES en el 2015 (www.checklist.cites.org/#/en). Tabla 83. Endemismo y categorías de amenaza de los anfibios registrados en el transecto de Palmira (Valle del Cauca). Estado de Amenaza por fuente Taxón Endemismo* IUCN 2014.3 RuedaAlmonacid et al. 2004 Resolución 192 de 2014 CastroHerrera y BolívarGarcía. 2010 Craugastoridae Pristimantis buckleyi Casi-endémico LC - - LC Pristimantis peraticus Endémico LC - - LC Pristimantis racemus Endémico LC - - LC Pristimantis piceus Endémico LC - - LC El endemismo fue basado en la base de datos virtual de la IUCN 2014.3 LC: preocupación menor, NT: casi amenazada, VU: vulnerable. Los microhábitats preferidos por los individuos para percharse y refugiarse fueron los estratos de vegetación rasante y herbáceo (representados en su mayoría por plantas de las familias Araceae y Asteraceae). En menor medida se observó el uso de otros microhábitats como hojarasca (Tabla 84). Para los anfibios se hace evidente que dependiendo del tipo de ecosistema en el que se encuentren los individuos, hacen uso de un hábitat específico, y en el caso de las poblaciones paramunas, además de esto, deben reducir su exposición a la radiación solar como medida de protección. Precisamente en las estaciones ubicadas en este tipo de estructuras (Frailejonal, pajonal y arbustal) solo se observó un individuo en el día y estaba asociado a un conjunto de frailejones que le brindaban protección. Esto concuerda con las observaciones de Navas (1999), quien afirma que las especies de anuros están asociadas a las características del ambiente que explotan y en el caso de condiciones extremas, las poblaciones son obligadas a refugiarse en un microhábitat específico para evitar efectos de la radiación solar, bajas y altas temperaturas. A nivel general, la composición de especies se puede estratificar de acuerdo a la disponibilidad de microhábitats. Por ejemplo, las especies que habitan en las E1 y E2 (Pristimantis buckleyi y P. racemus) prefieren asociarse a frailejones, mientras que las observadas en las E3, E4 y E5 (P. peraticus, P. piceus y P. buckleyi), a hojarasca y perchas en vegetación diferente a frailejones. Este comportamiento es observado en otras especies por Muñoz-Guerrero et al. (2007) quienes encuentran que dependiendo de la disponibilidad de microhábitats en diferentes ambientes, las especies aprovechan un recurso específico. 298 Tabla 84. Uso de microhábitats por adultos de las especies de anfibios observados en el transecto de Palmira, departamento del Valle del Cauca. Las estaciones se agrupan en (1-2) y (3-4-5) Especie Estaciones 1 y 2 Estrato (Abundancias) Microhábitat Pristimantis buckleyi Rasante (3) Pristimantis peraticus Herbáceo (1) Frailejón Pristimantis racemus Herbáceo (2) Frailejón Pristimantis buckleyi Rasante (1) Hojarasca Pristimantis peraticus Rasante (1) Perchada en hojas Herbáceo (1) Perchada en hojas Rasante (1) Hojarasca Herbáceo (1) Perchada en hojas Frailejón Hojarasca Estaciones 3, 4 y 5 Pristimantis piceus 7.3.1.1 Representatividad del muestreo Los registros fueron obtenidos con un esfuerzo de muestreo total de 150 horas/observador en los transectos y 30 horas/observador con la técnica de búsqueda libre fuera del área abarcada por los transectos. El esfuerzo de muestreo fue igual para cada estación (30 h/obs. transectos y 6 h/obs. búsqueda libre por estación). Las curvas de acumulación de especies se agruparon por estaciones (1-2; 3-4-5) para aumentar la muestra, por lo tanto la primera curva queda con 12 unidades de muestreo y la segunda con 18. Los estimadores usados fueron Chao 1, ACE y Jackknife 1. Los resultados sugieren que para los pares de estaciones (1-2) y (3-4-5) la representatividad del muestreo fue de 65% y el 75% respectivamente para los estimadores ACE y Jackknife 1. El Estimador de Chao 1 exhibe el mismo comportamiento de los observados. Los estimadores no logran una asíntota definida y los singletons y doubletons no logran estabilizarse (Figura 164 a y b). De manera que los muestreos permitieron obtener solo una muestra de la riqueza de anfibios en este transecto, ya que en las E1-E2 se registraron dos especies y se esperaría encontrar 3; en las E3-E4-E5 se registraron tres especies y se esperarían cuatro, según los estimadores. Todo esto demuestra que se espera que a través de repeticiones y aumentando el esfuerzo de muestreo se registren más especies en el tiempo. 299 a) b) Figura 164. Curvas de acumulación de especies para el ensamblaje de anfibios en las estaciones a) E1-E2 y b) E3-E4-E5. Transecto de Palmira (Valle del Cauca). Si se observa la Tabla 82 de riqueza de especies, se encuentra que entre las estaciones (1-2) se registran tres especies. En la curva de acumulación de especies de este par de estaciones solo aparecen dos especies en observados. Esto es debido a que la otra especie fue vista en búsqueda libre y esta metodología no está incluida en las curvas como unidades de muestreo. 300 7.3.1.2 Diversidad Alfa (α) En cuanto al ensamblaje de anfibios, los índices muestran que la diversidad de Shannon-Wiener Exp. (H) es más alta en las estaciones E1 y E5 ya que presentan más especies y la abundancia de cada una de ellas tiende a ser homogénea, de manera que son las estaciones con mayor Equidad (J) también. En las E2, E3 y E4 solo se observó una especie por estación, esto limita la interpetacion de los índices ya que seria especulativo afirmar algo cuando el muestreo fue en tan poco tiempo. (Tabla 85). Tabla 85. Patrones de diversidad en los ensamblajes de anfibios registrados en el transecto de Palmira, Valle del Cauca. Índices/estación E1 (3520) E2 (3440) E3 (3360) E4 (3280) E5 (3200) Riqueza 2 1 1 1 2 Abundancia 5 1 1 1 3 Shannon Exp (H) 1,95 1 1 1 1,89 Equidad (J) 0,97 - - - 0,92 Simpson inverso 1,92 1 1 1 1,81 * Modificación del índice de Shannon acorde a Jost (2006). Exp (H). Con los valores estimados de diversidad se realizó la prueba t que determina si existen diferencias numéricas de la diversidad entre estaciones. Los datos obtenidos solo permitieron comparar el par de estaciones E1-E5 y se observa que no existen diferencias significativas (Tabla 86). Tabla 86. Prueba t para comparar valores de diversidad (Índice de Shannon-Wienner) entre pares de estaciones en el transecto de Palmira, Valle del Cauca. Valores arriba de la diagonal indican el valor del estadístico t, valores debajo de la diagonal corresponden al valor P. Estaciones E1 E1 E2 E3 E4 E5 - - - 0,11 - - - - - E2 - E3 - - E4 - - - E5 0,92 - - - Algunas especies tienden a ser abundantes, mientras que otras tienden a ser escasas o raras dependiendo de la estación en la que se encuentren (Figura 165). Se logra observar que de acuerdo a la estructura vegetal de las estaciones, en cada una de ellas predomina una especie en particular, encontrándose que en la estación E1 de frailejonal, pajonal y arbustal, es más dominante P. buckleyi, mientras que en la E5 de bosque, es P. piceus que habita principalmente este tipo de ecosistema (Lynch y Suárez-Mayorga 2002). Debido a que solo se registró una 301 especie en las estaciones (E2-E3-E4) estas curvas de diversidad-abundancia muestran solo un punto en la figura. Figura 165. Curvas de diversidad-dominancia de anfibios. Las especies se representan a través de letras en la figura; A= P. bickleyi; B= P. racemus; C= P. peraticus; D= P. piceus. 7.3.1.3 Diversidad Beta El ensamblaje de los anfibios cambió su configuración entre estaciones de manera muy sutil a medida que se desciende altitudinalmente (Figura 166). Siendo los registros más representativos los de P. buckleyi que se observó en las E1 y E3 sin registrarse en las estaciones más bajas, y el caso contrario, con P. piceus que sólo se registró en la E5. Se registra P. peraticus como una especie que se encuentra en distintas coberturas vegetales del gradiente altitudinal, es decir, en las estaciones de frailejonal-pajonal y en las de estructura boscosa. Lynch y Suárez-Mayorga (2002) ubican esta especie como exclusiva de páramo, y en el presente estudio se registro en las estaciones con formaciones boscosas. La familia Craugastoridae es una de las más representativas en los ecosistemas de páramo, y dentro de ella el género Pristimantis está mejor representado desde el piedemonte hasta los páramos debido a características que han favorecido su distribución (Veintimilla et al. 2014). En el presente estudio se registraron especies de anfibios que hacen parte de ese grupo de ranas, lo cual demuestra que la composición de anfibios a nivel altitudinal, especialmente en los páramos se identifican características similares en su ensamblaje. 302 Figura 166. Recambio en el ensamble de anfibios del gradiente altitudinal comprendido entre los 3420 (E1) y 3100 m.s.n.m (E5) transecto de Palmira, Valle del Cauca. Fotografías por: Wolfgang Buitrago-González y Carlos Londoño-Guarnizo. Similitud La especie P. racemus se observó en las formaciones de frailejonal-pajonal, arbustal y P. piceus solo en bosque, mientras que P. buckleyi y P. peraticus se registraron tanto en la cobertura de bosque como en la de frailejonal-pajonal, arbustal. Estas tendencias se observan en el gráfico de agrupamiento de las estaciones a través de los índices de similitud de Jaccard y Sorensen, siendo el segundo de mayor ajuste (Figura 167 b y c). Las estaciones E1 y E3 debido a la presencia de P. buckleyi son agrupadas en una ramificación, y las demás en otro que es influenciado por la presencia de P. peraticus. El conglomerado con BrayCurtis es diferente debido a que es un índice que trabaja con abundancias y esto genera que se reagrupen las estaciones en otro orden, sin embargo, sigue agrupando las estaciones E2-E4-E5 y en este caso aísla a la E1 debido a que P. racemus solo está en esa estación (Figura 167 a). Los agrupamientos describen la tendencia del recambio de las especies altitudinalmente de acuerdo al tipo de estructura vegetal. En la literatura se reporta que especies como P. racemus y P. peraticus son exclusivas de páramo; P. 303 buckleyi es de páramo, pero no se restringe a él, y P. piceus es principalmente de cobertura de boscosa. Esto concuerda con lo observado excepto con P. peraticus que también se encontró en cobertura de bosque (Lynch y Suárez-Mayorga 2002; Castro et al. 2004 a, f, g; Yánez-Muñoz et al. 2010, en www.iucnredlist.org, versión 2014.3, consultada en 11/05/2015). B A C Figura 167. Cluster de similitud entre estaciones del transecto de Palmira, departamento del Valle del Cauca. Índice de similitud de Bray-Curtis (A); Jaccard (B); Sorensen (C). Los números de cada rama corresponden a la elevación en metros de las estaciones. Recambio de especies La complementariedad (grado de disimilitud) de la composición de especies entre pares de biotas fue calculada con el índice de reemplazo de especies de Whittaker (Tabla 87). El análisis indica que hay pares de estaciones donde se demuestra que el recambio es alto o bajo sin importar que tan cerca o lejos estén. Al comparar las estaciones más distantes (E1-E5) se observa que la disimilitud aumenta considerablemente con respecto a las demás demostrando lo diferentes que son esos pares de estaciones. Sin embargo, también sucede con estaciones cercanas (E1-E2). De manera que aún no queda muy claro si la fauna de anfibios en estructuras de bosques es más similar entre sí que con respecto a la presente en las estaciones de frailejonal-pajonal y arbustal. 304 Existe un recambio de especies a medida que se asciende altitudinalmente en las pendientes andinas, de manera que en ecosistemas de páramo la riqueza de fauna anura disminuye y es diferente a la de bosque (Lynch 1999; Lynch y SuárezMayorga 2002; Bernal y Lynch 2008). Con los datos obtenidos en el transecto altitudinal se puede identificar que la tendencia no es muy clara como para que se aproxime a estos supuestos. Posiblemente esto se deba a que el gradiente altitudinal estudiado es estrecho y el tiempo establecido para hacer el muestreo fue corto. Tabla 86. Índice de complementariedad de Whittaker entre estaciones para los anuros del transecto altitudinal de Palmira, Valle del Cauca. Estaciones E1 E1 E2 E3 E4 E5 1 0,33 1 1 1 0 0,33 E2 E3 1 E4 1 0,33 E5 7.3.2 Datos importantes De acuerdo al listado de anfibios paramunos de Colombia (Anexo 2), tres de las cuatro especies reportadas en el transecto de Palmira, coinciden con la preferencia de ecosistema en el que habitan (páramo o bosque). Solo Pristimatis peraticus difiere de lo reportado en el listado de anfibios paramunos de Colombia (Lynch y Suárez-Mayorga 2002), ya que lo ubican como exclusivo de páramo, y en el presente estudio se reportó también en las estaciones con formaciones boscosas. 7.3.3 Conclusiones Se documenta que de las cuatro especies observadas, tres son endémicas para Colombia y la otra es casi-endémica. Los individuos de anfibios se refugian en microhábitats específicos dependiendo de la estructura vegetal que predomine. En las estaciones uno y dos, prefirieron refugiarse entre frailejones y en las estaciones, tres, cuatro y cinco en perchas de hojas en plantas. Pristimantis racemus es exclusiva del ecosistema con presencia de arbustal, frailejonal-pajonal. 305 7.4 AVES 7.4.1 Riqueza y composición de especies Se obtuvieron 619 registros durante 288 horas/red y 36 horas/observador, los registros representaron 87 especies agrupadas en 25 familias (Anexo 18). Las familias con mayor riqueza fueron: Thraupidae (17), Trochilidae (12) y Tyrannidae (10). Entre las 87 especies motivo de análisis, 31 especies fueron registros únicos en las estaciones, 10 en la estación uno, siete en las E2 y E3, y nueve en la estación cuatro; seis especies se registraron en todo el gradiente altitudinal: Andigena hypoglauca, Anisognathus lacrymosus, Myioborus ornatus, Orochelidon murina, Streptoprocne zonaris y Tangara vassorii. Se obtuvo un total de 124 registros de 33 especies por vocalizaciones, y 250 registros de 62 especies mediante observaciones directas; 22 especies se registraron de ambas maneras; 14 especies se registraron únicamente mediante vocalizaciones y 41 especies se registraron únicamente mediante observaciones directas. En el gradiente se encontraron tres especies amenazadas de extinción, según lo definido en Renjifo et al. 2014. Además, se encontraron diez especies casiendémicas, de acuerdo a Chaparro-Herrera et al. 2014 (Tabla 88). Las 12 especies de la familia Trochilidae y tres de Psittacidae registradas en el transecto, se encuentran en el apéndice II de la Convención Internacional sobre el Comercio de Fauna y Flora Amenazadas (CITES 2013) (Anexo 18). 7.4.1.1 Representatividad del muestreo Las curvas resultado del análisis con el estimador Chao 2 para el método con redes de niebla (Figura 168), permiten identificar que E1 y E4 tuvieron un comportamiento alejado de las demás estaciones, una circunstancia derivada de la baja tasa de captura en estas estaciones. La E3 se comportó en claro ascenso dado a la alta riqueza encontrada con este método. En los puntos de conteo las curvas se comportaron asintóticas, la E2 mostró menos estabilidad, un comportamiento dado por la baja riqueza encontrada en esta estación, por otro lado, las demás estaciones parecen estabilizarse a partir de la mitad de unidades de muestreo. 306 Tabla 87. Aves amenazadas de extinción y endémicas registradas en el transecto de Palmira, Valle del Cauca. Familia Especie Categoría de amenaza Nivel de Endemismo Trochilidae Eriocnemis mosquera Casi-endémico Trochilidae Heliangelus exortis Casi-endémico Ramphastidae Andigena hypoglauca VU Psittacidae Leptosittaca branickii VU Psittacidae Pionus chalcopterus Casi-endémico Rhinocryptidae Scytalopus spillmanni Casi-endémico Corvidae Cyanolyca armillata Casi-endémico Troglodytidae Cinnycerthia unirufa Casi-endémico Thraupidae Urothraupis stolzmanni Casi-endémico Insertae cedis Saltator cinctus Emberizidae Atlapetes pallidinucha Casi-endémico Parulidae Myoborus ornatus Casi-endémico Fringillidae Sporagra spinescens Casi-endémico VU VU: vulnerable. Figura 168. Curvas de acumulación de especies basadas en Chao 2, transecto Palmira, Valle del Cauca. A: Redes de niebla y B: Puntos de Conteo. 307 Estación uno - E1 (3420 m.s.n.m) La complementariedad metodológica que se utilizó, dio resultados contrastantes entre los métodos. En las redes de niebla la representatividad del muestreo fue de 77% para Chao 1 y 76% para Chao 2. En general los dos estimadores calculados predicen un mayor número de especies y no se observa aproximación a una asíntota. Por su parte en los puntos de conteo la representatividad de cada uno de los estimadores, mostró una mayor tendencia hacia la asíntota, aunque no se nota explícita (Tabla 88, Figura 169). Tabla 88. Comparación de los estimadores Chao 1 y 2, Aves registradas en el transecto altitudinal de Palmira, Valle del Cauca Redes Puntos conteo Chao 1 Chao 2 Chao 1 Chao 2 Estaciones/m.s.n.m E1(3420) E2(3295) E3(3170) 77% 81% 56% 76% 66% 30% 85% 75% 81% 72% 64% 76% E4(3045) 61% 44% 84% 83% Figura 169. Curva de acumulación de especies observadas y estimadas: Chao1 y Chao2, E1 (3.420m). A: Redes de niebla y B: Puntos de conteo. Transecto altitudinal Palmira, Valle del Cauca. Durante el muestreo en esta estación se registraron 30 especies agrupadas en 16 familias, siendo las más representativas, Trochilidae con cinco especies y Thraupidae con seis. Se consideraron seis especies como abundantes, ya que se registraron en más de cinco oportunidades, estas fueron: Aglaeactis cupripennis (23), Diglossa lafresnayii (11), Cistothorus platensis (12), Diglossa humeralis (8), Grallaria quitensis (8) y L. branickii (6) (Figura 170 A). Entre las especies 308 0,15 0,10 0,05 Abundancia relativa ni/N 0,05 Abundancia relativa ni/N 0,10 0,00 T. fuscater B. montana A. mercenaria M. ornatus H. exortis A. cupripennis A. lacrymosus M. squamiger D. humeralis M. leucophrys A. schistaceus C. riefferii G. nuchalis H. frontalis P. riefferii C. lutetiae S. latrans A. rubrocristatus C. cheriway C. torquata E. mosquera P. carunculatus P. arcuata S. spillmanni A. hypoglauca C. eximia C. platensis C. armillata D. lafresnayii H. superciliaris H. verticalis P. fasciata P. boissonneautii S. zonaris Z. capensis A. assimilis M. nigrocristata C. inornata C. aura C. sitticolor D. cyanea G. quitensis G. squamigera M. poecilocercus M. tyrianthina M. williami M. senilis O. fumicolor O. underwoodii O. murina T. personatus A. cupripennis D. lafresnayii C. platensis D. humeralis G. quitensis L. branickii G. nuchalis T. fuscater A. lacrymosus O. murina C. coruscans S. latrans A. palidinucha E. mosquera G. squamigera P. carunculatus P. chalcopterus R. microrhynchum S. zonaris A. striatus A. orthonyx A. hypoglauca A. igniventris C. herrani G. melanoleucos G. jardinii I. rufivertex M. ornatus S. spinescens T. vassorii Abundancia relativa ni/N 0,15 O. rufipectoralis T. fuscater G. nuchalis M. ornatus Z. capensis A. hypoglauca C. riefferii P. fasciata C. atratus C. armillata H. exortis O. murina T. serranus A. mercenaria D. albilatera L. lafresnayi M. leucophrys A. schistaceus C. unirufa M. tyrianthina O. fumicolor P. riefferii T. solstitialis A. lacrymosus C. cheriway C. rubiginosus D. tyrannina E. frantzii M. fumigatus O. underwoodii P. boissonneautii S. zonaris T. vassorii A. rubrocristatus B. montana C. torquata C. coruscans D. cyanea D. lafresnayii M. ralloides M. senilis O. cinnamomeiventris S. cinctus S. latrans T. personatus U. stolzmanni T. fuscater M. ornatus G. nuchalis H. verticalis Z. capensis B. nigrocristatus C. torquata M. squamiger O. diadema O. rufipectoralis P. carunculatus A. rubrocristatus A.schistaceus H. exortis P. chalcopterus T. vassorii A. cupripennis A. hypoglauca A. igniventris C. coruscans C. sitticolor C. atratus D. albilatera H. superciliaris M. eucophrys O. cinnamomeiventris O. frontalis O. fumicolor S. latrans A. lacrymosus C. cheriway C. leucocephalus G. quitensis G. rufocinerea H. gularis H. frontalis L. lafresnayi M. poecilocercus M. senilis O. underwoodii O. murina P. fasciata P. arcuata P. boissonneautii P. ruficeps S. xanthogastra T. solstitialis Abundancia relativa ni/N consideradas raras por ser registradas entre una y dos veces, se encuentran: A. hypoglauca, Chalcostigma herrani y Glaucidium jardinii (Anexo 18). Se registraron 10 especies únicamente en esta estación, entre estas están: Acropternis orthonyx, Accipiter striatus y Ramphomicron microrhynchum. A B 0,20 0,20 0,20 0,00 309 0,15 0,10 0,05 0,00 C 0,20 D 0,15 0,10 0,05 0,00 Figura 170. Abundancia de especies, A: E1, B: E2, C: E3 y D: E4. Transecto altitudinal Palmira, Valle del Cauca. Estación dos – E2 (3295 m.s.n.m) Las representatividad para el método redes de niebla en esta estación fue la más alta (Tabla 88 y Figura 171), probablemente como resultado de tener las mayores riquezas y abundancias de todo el gradiente evaluado. No obstante, la representatividad fue menor para los dos estimadores con la metodología de puntos de conteo. Figura 171. Curva de acumulación de especies observadas y estimadas: Chao 1 y Chao 2, E2 (3295 m.s.n.m.). A: Redes de niebla y B: Puntos de Conteo. Transecto altitudinal Palmira, Valle del Cauca En la E2, se registraron 51 especies, ubicadas en 20 familias, de las cuales, Thraupidae (12) y Trochilidae (8) fueron las que presentaron el mayor número de especies. Para el muestreo en esta estación, 10 especies se consideraron abundantes, entre estas están: T. fuscater (26), B. montana (21) y Amazona mercenaria (15). En cuanto a las especies consideradas raras por el número de registros se destacan: Conirostrum sitticolor, Grallaria squamigera y Trogon personatus (Figura 170 B). Siete especies fueron exclusivas de esta elevación: Arremon assimilis, Catamenia inornata, Cathartes aura, Cnemathraupis eximia, Coeligena lutetiae, Metallura williami y Scytalopus spillmanni. Estación tres –E3 (3170 m.s.n.m.) Las curvas de acumulación para el muestreo en esta estación con el método de redes de niebla, arrojaron una representatividad baja, la mayoría de la actividad de los organismos se concentró en el dosel. Lo anterior contrasta con la alta representatividad en los puntos de conteo (Tabla 88, Figura 172), donde la detección de las aves de forma directa e indirecta aumentó el número de registros. 310 Figura 172. Curva de acumulación de especies observadas y estimadas, Chao 1 y Chao 2, E3 (3170 m.s.n.m). A. Redes de niebla y B. Puntos de Conteo. Transecto altitudinal Palmira, Valle del Cauca En E3, se registraron 47 especies pertenecientes a 19 familias, donde Tyrannidae contó con ocho especies y Trochilidae con seis. Entre las especies abundantes por presentar más de cinco registros se encontraron: T. fuscater (12), M. ornatus (9) y G. nuchalis (8). Con uno o dos registros se encontraron especies como: Ocreatus underwoodii, Hellmayrea gularis y Pipreola arcuata (Figura 170 C). Siete detecciones fueron exclusivas de esta estación: Cinclus leucocephalus, Grallaria rufocinerea, Hellmayrea gularis, Ochthoeca diadema, Ochthoeca frontalis, Pseudotriccus ruficeps y Sporagra xanthogastra. Estación cuatro – E4 (3045 m.s.n.m) Las curvas de acumulación para el muestreo en esta estación, para redes de niebla, presentaron una representatividad baja en ambos indicadores comparado con el método de puntos de conteo (Tabla 88, Figura 171). De esta manera las redes permiten predecir una fracción de la riqueza predicha por los puntos de conteo. Claramente en los puntos de conteo se evidencia una tendencia a estabilizarse las curvas con un poco más de la mitad del esfuerzo empleado. 311 Figura 171. Curva de acumulación de especies observadas y estimadas: Chao 1 y Chao 2, E4 (3.045m). A: Redes de niebla y B: Puntos de Conteo En E4, el total de especies registradas fue de 46, pertenecientes a 21 familias, entre las cuales, las que presentaron el mayor número de especies fueron Trochilidae con seis y Thraupidae con ocho. Entre las especies abundantes se encuentran: Ochthoeca rufipectoralis (18), T. fuscater (17), G. nuchalis (8) y M. ornatus (7). Entre las especies con menos registros se encontraron: B. montana, Coeligena torquata y Colibri coruscans (Figura 170 D). En esta elevación el número de taxones registrado exclusivamente lo conforman nueve especies de diversos hábitos, como: Cinnycerthia unirufa, Colaptes rubiginosus, Dendrocincla tyrannina, Elaenia frantzii, Myadestes ralloides, Myiotheretes fumigatus, Saltator cinctus, Turdus serranus y Urothraupis stolzmanni. De acuerdo a lo encontrado en el transecto altitudinal, se destaca el registro de tres especies con alguna categoría de amenaza, se hace énfasis en el registro de Saltator cinctus, ave con distribución discontinua, desde los Andes colombianos hasta el centro de Perú. Esta especie se registró en la estación cuatro (E4), estación ubicada dentro del rango de su distribución altitudinal conocida, la fragmentación de los bosques y al parecer su fuerte relación con Podocarpus oleifolius, son los factores preponderantes que inciden en el estado actual de sus poblaciones. La gran diferencia en la representatividad de los muestreos, se debe principalmente a la baja proporción de captura de las redes con respecto a los puntos de conteo. Las redes de niebla son una técnica complementaria que permite registrar especies raras y poco conspicuas por movilizarse entre el estrato rasante y sotobosque; contrario a los punto fijos, que permiten visualizar individuos de especies conspicuas y abundantes que forrajean principalmente en el dosel y muchas veces formando bandadas mixtas, que aseguran un mayor registro. Sin 312 embargo, con las redes de niebla se lograron obtener datos importantes que contribuyeron a robustecer el muestreo en esta área, además de aportar los datos de rasgos funcionales que se sistematizaron en la Plataforma Institucional de Datos (I2D), para posteriores análisis por parte del laboratorio diversidad funcional del IAvH. De acuerdo a la riqueza encontrada en cada una de las estaciones, la estación uno (E1) presentó el menor número de especies, esto se puede deber a las condiciones climáticas y a su cobertura vegetal, ya que las estaciones presentes en gradientes más bajos presentaron coberturas complejas en su estructura vegetal, generando mayor oferta de hábitats para las aves, siendo esto un atributo típico de bosque. 7.4.1.2 Diversidad alfa Índices de Diversidad Según el índice de Shannon (H´), la E3 presentó el mayor valor de este índice, con la E2 fueron las elevaciones donde se presentó la mayor riqueza, esto supone junto con la abundancia una proporción equitativa de las especies, donde se presentó una mínima diferencia entre las E1, E3 y E4, y estuvieron por encima de la E1 (Tabla 89). Se evidencia una dominancia de especies de aves comunes en estos ecosistemas dominados por coberturas vegetales de porte más bajo como arbustos de la familia Ericaceae, frailejonales y pajonales, tal es el caso de especies como: A. cupripenis, D. lafresnayii y C. platensis. De acuerdo a la prueba t, se presentaron diferencias significativas entre la diversidad (H´) encontrada entre E1 y el resto de las estaciones, al igual que entre la E2 y la E4 en el transecto altitudinal (P-valor <0,05) (Tabla 90); esto es un factor que explica la tendencia de los índices encontrados, siendo la diversidad en la estación uno la más baja y con mayor dominancia de especies (1-D) con relación a la riqueza encontrada. Estos resultados explican la heterogeneidad de las áreas boscosas, complejas en su estructura tanto horizontal como vertical (MacArthur 1961, Nocedal 1984), encontradas a partir de la E2 hasta la E4, ya que estas coberturas generan una mayor disponibilidad de hábitats y nichos ecológicos para las aves. 313 Tabla 89. Diversidad alfa para las cinco estaciones en el transecto altitudinal de Palmira, Valle del Cauca Estaciones E1(3.420m) E2(3.295m) E3(3.170m) E4(3.045m) Riqueza 30 51 47 46 Abundancia 122 206 124 167 Diversidad(H´) 2,898 3,471 3,565 3,487 Dominancia(1-D) 0,9192 0,9528 0,9627 0,9577 Tabla 90. Tabla de doble entrada para la prueba t (student) y P valor para los índices de diversidad de Shannon-Wiener. E1(3.420m) E1(3.420m) E2(3.295m) E3(3.170m) E4(3.045m) -4,85 -4,91 4,91 -0,27 0,98 E2(3.295m) 2,11E-06 E3(3.170m) 1,67E-06 0,782 E4(3.045m) 1,67E-06 2,30E-02 0,25 0,79 7.4.1.3 Diversidad Beta En el Índice de Jaccard se evidencian un grupo conformado por las E2, E3 y E4 de acuerdo a la similitud de especies encontradas entre estaciones; siendo las E2 y E3 las que presentaron la mayor similitud (44%), la estación uno (E1) presentó una baja similitud con las demás estaciones (menos de 22%) (Figura 172 A). Es de señalar que similitudes por debajo el 50% entre grupos, como en este caso, dan cuenta de lo heterogénea que es la avifauna del gradiente evaluado. En el Índice de Sorensen, se presentó el mismo patrón anterior, aunque con similitudes un tanto mayores, en el caso de la E2 y E3 presentaron la mayor similitud (62%), de igual forma la estación uno (E1) presentó la menor similitud con las demás estaciones (Figura 172 B). Para el Índice Bray-Curtis, basado en abundancia, la diversidad beta mostró una tendencia poco distinta de los análisis anteriores; en el caso de las E3 y E4 presentaron la mayor similitud (46%), así mismo la estación uno se presentó aislada con respecto a las demás (Figura 173). 314 Figura 172. Agrupamiento con base en la composición de la avifauna. A: índice de Jaccard y B: Sorensen. Transecto altitudinal Palmira, Valle del Cauca. Figura 173. Índice de Bray- Curtis: Agrupamiento con base en la composición y abundancia de la avifauna del transecto altitudinal de Tuluá Índice de Whittaker. Como se aprecia en la tabla 91, el análisis de complementariedad, no permite identificar una diferencia notable entre pares de elevaciones. Un resultado llamativo, toda vez que los puntos de muestreo diferían por 200 m de elevación entre ellos. 315 Tabla 89. Análisis de disimilitud de Whittaker para las estaciones del transecto altitudinal de Tuluá. Estaciones y elevaciones E1(3.420m) E2(3.295m) E3(3.170m) E4(3.045m) E1(3420m) E2(3295m) E3(3170m) 0 0,38776 0,40206 0 0,41935 E4(3045m) 0 0,60494 0,63636 0,71053 0 De acuerdo con el análisis de diversidad beta, se evidencia una mayor similitud entre las estaciones más próximas, por ejemplo, E1 y E2 compartieron cuatro especies: C. platensis, D. humeralis, G. squamigera y E. mosquera; mientras que E1 y E3 compartieron dos especies: A. igniventris y P. chalcopterus; respectivamente la estación uno (E1) y la última estación (E4) no compartieron ninguna especie. Lo anterior indica, que debido a la composición y estructura del ensamblaje de aves en las diferentes estaciones, se evidencia un recambio de especies a medida que se asciende en el gradiente altitudinal, de esta manera no es claro marcar una línea o gradiente donde se establece un recambio, pero es claro que en las estaciones más altas (E1 y E2) se registraron especies comunes de áreas abiertas donde existen dominancia de matorrales, frailejonales, chuscales y pajonales; esto indica que la composición y estructura de aves en la alta montaña está relacionada con la estructura vegetal encontrada. Una de las razones que explica este patrón, pueden ser las condiciones ambientales, que cambian conforme aumenta la distancia en el gradiente altitudinal; hay una disminución de la similitud ambiental con la distancia, lo que implica que exista una separación de las especies con diferentes características fisiológicas. Otro factor que puede influenciar, está relacionado con la configuración del ambiente y el tiempo, ya que puede influir en el movimiento de las especies (Calderón et al. 2012). A mayor número de barreras, la similitud decrece más abruptamente que en un sitio topográficamente abierto y homogéneo (Nekola & White 1999, Soininen et al. 2007). Es de resaltar que los patrones antes mencionados se han presentado en los análisis realizados en otras zonas del complejo Hermosas y en los complejos Chilí-Barragán y Nevados estudiados por la Fundación las Mellizas, en convenio con el IAvH. 316 7.4.2 Gremios Tróficos Los gremios tróficos fueron asignados con base en Renjifo (1999b) con modificaciones, de acuerdo a la dieta de cada especie (Tabla 92). Tabla 90. Gremios tróficos de Aves transecto de Sevilla. Tipo de alimentación Rapaz diurna Frutos Frutos e insectos Frutos, insectos y néctar Néctar e insectos Insectos Semillas Abreviación R/D FR FR-I FR-I-N NI I SE En toda la franja altitudinal, los insectívoros (I) fueron quienes predominaron en el muestreo, seguidos por los frugívoros que complementan su dieta con insectos, principalmente desde la segunda estación (Figura 174). Se obtuvo un registro de una rapaz diurna (Geranoaetus melanoleucus), en la estación uno (E1), ave considerada de gran importancia en ecosistemas de zonas abiertas La disponibilidad de recursos alimenticios es uno de los factores determinantes en la dinámica y estructuración de las comunidades de aves (Nocedal 1984, Wolda 1990). Su composición en función de los gremios alimenticios, está estrechamente relacionada con la estructura de la vegetación (Laurance & Bierregaard 1997). Los hábitats con una estructura vegetal compleja y formada por varios estratos de cobertura, presentan principalmente especies de hábitos insectívoros, frugívoros y nectarívoros (Rappole et al. 1993). De acuerdo con lo anterior, en todo el transecto altitudinal fueron representativos estos tres gremios. Se destacan las aves nectarívoras de la familia Trochilidae, ya que fueron abundantes en todo el transecto altitudinal, esto se debe a la existencia de especies de plantas de la familia Ericaceae, Rubiaceae, Melastomataceae, entre otras, que ofrecen alimento de forma constante durante los periodos de floración. La etapa de floración de las plantas y el tiempo seco, permitió que se presentara una mayor abundancia de insectos, favoreciendo que aves de este gremio fueran más abundantes en todas las estaciones. 317 E1(3.420m) E2(3.295m) E3(3.170m) E4(3.045m) N° especies 20 15 10 5 0 FR FR-I FR-I-N I NI RD SE Gremio Figura 174. Número de especies de acuerdo a los gremios tróficos en cada una de las estaciones en el transecto altitudinal de Tuluá. 7.4.3 Conclusiones Durante el trabajo de campo se registraron tres especies de aves con especial interés para la conservación, por estar amenazadas de extinción: A. hypoglauca, L. branickii y S. cinctus. De acuerdo con los índices de diversidad, la estación E3 presentó los valores más altos con relación a las estaciones que se encontraban en elevaciones mayores. Se encontró un recambio de especies a medida que se desciende en el gradiente altitudinal, cuando las características de la cobertura vegetal cambian, principalmente entre los 3420 y 3295 m.s.n.m. 7.5 CONSIDERACIONES FINALES TRANSECTO MUNICIPIO DE PALMIRA Los resultados de los análisis de agrupamiento, arrojan dos grupos con los índices de similitud de Sorensen (30%) y Jaccard (17%), uno de ellos lo comprenden las estaciones E1-E2, con un 35% de similitud (Sorensen) y 22% (Jaccard), para el segundo grupo las estaciones E3, E4 y E5 se asemejan en 48% (Sorensen) y 32% (Jaccard). Las estaciones más semejantes son E3 y E4, 57% (Sorensen), 40% (Jaccard). Los resultados del índice de Bray-Curtis con un corte del 24%, agrupan de manera diferente las estaciones, estableciendo similitudes en las estaciones E3, E4 y E5 con un 30%, y las estaciones E1 y E2 como grupos individuales; E2 adicionándose a 25%, mientras que E1, se suma por debajo del 10%. En síntesis, 318 las mayores afinidades se evidencian en las estaciones de la parte baja del transecto (E3-E5) ubicadas en formaciones boscosas, entre 3260 y 3100 m. y ciertas semejanzas en las E1 y E2 ubicadas en la parte alta del transecto entre 3420 y 3.340 m. De acuerdo con el análisis de complementariedad, E1 y E2 difieren en más del 62% con las estaciones E3, E4 y E5, siendo E1 la que más alejada está de las demás estaciones. Por otro lado, las estaciones E3, E4 y E5 se complementan en menos del 59%, debido a las especies en común entre esas estaciones, apoyando los resultados de los análisis anteriores. En las estaciones E1 y E2 ubicadas a mayor elevación (3420 y 3340 m.), predominaron los estratos vegetales rasante y herbáceo, representados por: Calamagrostis sp., Espeletia hartwegiana, Bejaria resinosa, Maytenus sp., Hesperomeles ferruginea, Cavendishia bracteata, Gaultheria sclerophylla, Achiachne aff., pulvinata y Selaginella tarapotensis. En las tres estaciones bajas (entre 3260 y 3100 m.) predominaron los estratos vegetales arbolitos, arbustos y árboles, como: Palicourea cf. ovalis, Hedyosmum cf. cuatrecazanum, Freziera canescens, Freziera reticulata, Viburnum pichinchense, Clethra revoluta, Roupala pachypoda y Cyathea sp. Lo anterior indica que a partir de E3, ubicada a 3260 m., la composición, diversidad y estratos vegetales cambian. Igualmente, se evidenció un recambio de especies según el índice de Whittaker. El estrato vegetal rasante, compuesto por formas de crecimiento como rosetas y talófita-líquen, sólo se encontró en las dos primeras estaciones. El estrato vegetal de arbustos se presentó en todas las estaciones, sin embargo, su mayor abundancia se encontró en las estaciones E3, E4 y E5. El páramo, se ubicó por encima de la estación E2, predominando las coberturas abiertas de herbazales-frailejonales. Hacia las estaciones E2 y E3, se encontró subpáramo, delimitado por arbustales densos de porte medio-alto que forman una franja bien definida, con inclusiones de especies propias de subpáramo y algunas de bosque, lo que podría corresponder con el límite superior de una franja de transición. Esta zona tiene un buen estado de conservación, dadas las condiciones de manejo y topográficas. Estas coberturas de arbustales al tener una estructura tan densa y definida juegan un papel importante en la estabilidad del páramo, situado inmediatamente sobre él. En los análisis de conglomerados de edafofauna con el índice de Jaccard, se sugieren tres grupos con las cinco estaciones, mostrando una separación en E1, una segunda E2 y un tercer grupo formado por E3-E4 y E5 con una semejanza del 36%. Este mismo índice muestra altos porcentajes de disimilitud en el paso de la estación E1 a E2, por debajo de 20%. El índice Sorensen-Dice presenta la misma topología de grupos sugeridos por Jaccard, aunque mostrando niveles de similitud del 60% para el grupo formado por las estaciones E3-E4-E5. Se observó que aunque se sugieren unos sitios de recambio entre E1 y E2 tanto con Whittaker como con SIMPER, los porcentajes de recambio son muy bajos. De igual forma los agrupamientos generados con Jaccard y Sorensen-Dice, muestran separaciones que llevan a formar los grupos E1, E2 y E3-E4-E5, con lo que se supone que las dos zonas de recambio se dan entre E1 y E2 y entre E2 y E3. No 319 obstante aunque estos resultados estén sugiriendo que se trata de comunidades diferentes en composición, los índices son bajos, lo que implica un pobre soporte. Esta recolecta de la fauna edáfica presentó muchos individuos más que los registrados en el transecto realizado en Sevilla, que hasta el momento había sido el más abundante. Se detectó la presencia de la hormiga legionaria Labidus sp.67, una especie depredora. Aunque la tendencia general del grupo de carábidos (Coleoptera: Carabidae) es a aumentar a medida que se desciende en la franja altitudinal, las siete especies encontradas presentan picos de abundancia a diferentes niveles altitudinales; al parecer ilustrando que cada especie tiene preferencias altitudinales distintas. La riqueza general de especies aumentó, mientras que la abundancia disminuyó a medida que se descendió en el gradiente altitudinal. Igual que lo sucedido con la familia Carabidae, es posible que la diversidad en este ecosistema no decrece de manera continua en función del gradiente. La riqueza de herbívoros por su parte tendió a aumentar en las estaciones E1 y E2, mientras que la riqueza de depredadores lo hizo hacia las estaciones E3 a E5. Esta última tendencia se replicó en los omnívoros. El número de especies escasas y poco comunes fue relativamente alto, en relación con las especies comunes y abundantes. Igual que en los transectos de Sevilla, Tuluá y Rioblanco, se observa un rápido recambio de especies en la parte más alta del transecto (entre E1 a E2), que se tiende a estabilizar hacia el final del transecto, mostrando que la zona alta la diversidad cambia rápidamente a medida que disminuye la altura. En el caso de la anurofauna los análisis de agrupamiento de las estaciones a través de los índices de similitud de Jaccard y Sorensen, permiten describir que las estaciones E1 y E3 son agrupadas en una ramificación debido a la presencia de P. buckleyi y las demás estaciones en otra, lo cual es influenciado por la presencia de P. peraticus. El conglomerado con Bray-Curtis es diferente debido a que es un índice de abundancias y esto genera que se reagrupen las estaciones en otro orden; sin embargo, sigue agrupando las estaciones E2-E4-E5 y en este caso aísla a E1 debido a que P. racemus solo está en esa estación. Los agrupamientos describen la tendencia del recambio altitudinal de las especies de acuerdo al tipo de estructura vegetal. En la literatura se reporta que especies como P. racemus y P. peraticus son exclusivas de páramo; P. buckleyi es de páramo, pero no se restringe a él, y P. piceus es principalmente de cobertura de boscosa. Esto concuerda con lo observado excepto con P. peraticus que también se encontró en cobertura de bosque. La complementariedad (grado de disimilitud) de la composición de especies (análisis de Whittaker) indica que hay pares de estaciones donde se demuestra que el recambio es diferente, sin importar qué tan cerca o lejos estén. Al comparar las estaciones más distantes (E1-E5) se observó que la disimilitud aumentó con respecto a las demás, demostrando lo diferentes que son esos pares de estaciones. Sin embargo, también sucedió entre estaciones cercanas (E1-E2). De tal forma que no quedó claro si la fauna de anfibios en estructuras boscosas es más similar entre sí que con respecto a la 320 presente en las estaciones de frailejonal-pajonal y arbustal. Asimismo, se documentó que de las cuatro especies observadas, tres son endémicas para Colombia y la otra es casi-endémica. Los individuos de anfibios se refugiaron en microhábitats específicos en función de la estructura vegetal predominante. En las estaciones uno y dos, se refugiaron entre frailejones y las estaciones, tres, cuatro y cinco en perchas de hojas en plantas. Respecto de la avifauna, los análisis realizados con el Índice de Jaccard, arrojaron como resultado un grupo conformado por las E2, E3 y E4 de acuerdo a la similitud de especies encontradas entre estaciones; siendo E2 y E3 las que presentaron la mayor similitud (44%); E4 se adiciona luego (42%), mientras que E1, presentó una baja similitud con las demás estaciones (menos de 22%). Es de señalar que similitudes por debajo el 50% entre grupos, como en este caso, deben ser tomados con cautela por el nivel de certidumbre de tales asociaciones. En el Índice de Sorensen, se presentó el mismo patrón anterior, aunque con similitudes mayores, en el caso de la E2 y E3 presentaron la mayor similitud (58%); se adiciona (56%). De igual forma, la estación E1 presentó la menor similitud con las demás estaciones, por debajo de 30%. Para el Índice Bray-Curtis, basado en abundancia, la diversidad beta mostró una tendencia distinta de los análisis anteriores; en el caso de las E3 y E4 presentaron la mayor similitud (46%), pero E2 se adiciona a 45%. Así mismo la estación uno se presentó aislada con respecto a las demás sumándose apenas por encina de 20%. El análisis de complementariedad, no permitió identificar una diferencia entre pares de elevaciones, un resultado interesante, toda vez que los puntos de muestreo diferían por 200 m de elevación entre ellos. Durante el trabajo de campo se registraron tres especies de interés para la conservación y con alguna categoría de amenaza: A. hypoglauca, L. branickii y S. cinctus. De acuerdo con los índices de diversidad, E3 presentó los valores más altos con relación a las estaciones que se encontraban en elevaciones mayores, indicando la importancia de la cobertura vegetal en la complejidad vertical. Se encontró un recambio de especies cuando las características de la cobertura vegetal cambiaron, principalmente entre los 3420 y 3295 m. 321 Bibliografía Acosta Galvis, Andrés. 2015. Lista de los Anfibios de Colombia: Referencia en línea .V.05.2015.0. Consultada 15/04/2015. Página web accesible en www.batrachia.com; Batrachia, Villa de Leyva, Boyacá, Colombia. Aguirre A.A. y M. Lampo. 2006. Protocolo de bioseguridad y cuarentena para prevenir la transmisión de enfermedades en anfibios. Pp: 73-91 En: Angulo, A., J. V. Rueda Almonacid, J. V. Rodríguez Mahecha, E. La Marca (Eds). Técnicas de inventario y monitoreo para los anfibios de la región tropical andina. Serie manuales de campo. Conservación Internacional. Bogotá D.C, Colombia. Aguayo, R. 2000. Ecología de la comunidad de anuros en dos pisos bioclimáticos del Parque Nacional Carrasco (Cochabamba – Bolivia). Universidad Mayor de San Simón, Facultad de Ciencias y Tecnología, Tesis de licenciatura, Carrera de Biología, Cochabamba. Álvarez M., V. Caro, O. Laverde y A.M. Cuervo. 2007. Guía Sonora de las Aves de los Andes Colombianos (CD´s). Banco de sonidos animales del Instituto de Investigación de Recursos Biológicos Alexander von Humboldt y la librería de sonidos, Macaulay Library, Cornell Laboratory of Ornithology de la Universidad de Cornell, Nueva York. Amat, G. y O. Vargas. 1991. Caracterización de microhábitats de la artropofauna en páramos del Parque Nacional Natural Chingaza, Cundinamarca, Colombia. Caldasia, 16(79): 539-550. Ardila M.C y A.R. Acosta. 2000. Anfibios. Pp: 617-628. En: Rangel-Ch, J.O. (Ed). Colombia Diversidad Biótica III, La región de vida paramuna. Universidad Nacional de Colombia, Instituto de Ciencias Naturales, Bogotá, Colombia. Baquero, J.C., J.M. Duque., J.H. López., N. Osorno., J.W Parra. 2011. Actualización de Información Biológica (Plantas, Aves y Mamíferos) de los ecosistemas de alta montaña del municipio de Génova, Quindío, Zona Norte, Vereda Río Rojo, Reserva Natural de la Sociedad Civil Serbia. Informe Técnico. Fundación Ecológica las Mellizas. Armenia., 34 pp. Bernal, M. H. y J. D. Lynch. 2008. Review and analysis of altitudinal distribution of the Andean anurans in Colombia. Zootaxa. 1826: 1-25. Bernal, M.H., C. A. Páez y M.A. Vejarano. 2005. Composición y distribución de los anfibios de la Cuenca del Río Coello (Tolima), Colombia. Actualidades Biológicas, vol. 27: 87-92. 322 Boulenger, G.A. 1882. Catalogue of the Batrachia Salientias. Ecaudata in the Collection of the British Museum. Second Edition. London: Taylor and Francis. Brown, J.H. y M.V. Lomolino. 1998. Biogeography, 2nd (Ed). Sinauer Associates, Sunderland, Massachustts. USA. Inc. Bustamante, M., S. Ron y L. Coloma. 2005. Cambios en la diversidad en siete comunidades de anuros en los Andes de Ecuador. Biotropica Vol. 37 no. 2: 180189. Camero, R.E., C. Chamorro. 1999. La fauna edáfica en bosques y plantaciones de coníferas de la estación San Lorenzo – Sierra Nevada de Santa Marta. Acta Biológica Colombiana, 4:35–45. Camero, R.E. 2003. Caracterización de la fauna de carábidos (Coleoptera: Carabidae) en um perfil altitudinal de la Sierra Nevada de Santa Nevada, Colômbia. Revista de la Academia Colombiana de Ciencias, 27: 491-516. Calderón-Patrón, J.M., C.E. Moreno y I. Zuria. 2012. La Diversidad Beta: medio siglo de avances. Revista Mexicana de Biodiversidad. 83: 879-891. Calderón, E., G. Galeano & N. García (eds). 2005. Libro Rojo de Plantas de Colombia. Volumen 2: Palmas, Frailejones y Zamias. Serie Libros Rojos de Especies Amenazadas de Colombia. Bogotá, Colombia. Instituto Alexander von Humboldt - Instituto de Ciencias Naturales de la Universidad Nacional de Colombia – Ministerio de Ambiente Vivienda y Desarrollo Territorial. 454 pp. Cañas, D. 2000. Variación de la diversidad florística en un mosaico sucesional en la cordillera Central Andina (Antioquia, Colombia). Instituto de botánica Darwiniana. Buenos Aires, Argentina, vol. 38: 1-2. ISSN 1850-1702. Cardona-Botero V.E., R. A. Viáfara-Vega, A. Valencia-Zuleta, A. EcheverryBocanegra, O. D. Hernández-Córdoba, A. F. Jaramillo-Martínez, R. GalvisCruz, J. A. Gutiérrez, F. Castro-Herrera. 2013. Diversidad de la herpetofauna en el Valle del Cauca (Colombia): un enfoque basado en la distribución por ecorregiones, altura y zonas de vida. Biota Colombiana 14 (2): 156-233. Castro-Herrera, F. y F. Vargas-Salinas. 2008. Anfibios y reptiles en el departamento del Valle del Cauca. Biota Colombiana. Vol. 9 no. 2: 251-277. ISSN 0124-5376 Castro-Herrera, F. y W. Bolívar-García. 2010. Libro Rojo de los Anfibios del Valle del Cauca. Cali, Colombia. Feriva Impresores SA. 200 pp. ISBN: 978-958-833237-6 pp. 323 Castro, F., M. I. Herrera y J. Lynch 2004a. Pristimantis peraticus. The IUCN Red List of Threatened Species. Versión 2014.3. <www.iucnredlist.org>. Consultada el día 18/11/2014. Castro, F., M. I. Herrera y J. Lynch 2004b. Pristimantis simoterus. The IUCN Red List of Threatened Species. Versión 2014.3. <www.iucnredlist.org>. Consultada el día 18/11/2014. Castro, F., M. I. Herrera y J. Lynch 2004c. Pristimantis vicarius. The IUCN Red List of Threatened Species. Version 2014.3. <www.iucnredlist.org>. Consultada el 11/05/2015. Castro, F., M. I. Herrera y J. Lynch 2004d. Pristimantis leptolophus. The IUCN Red List of Threatened Species. Versión 2014.3. <www.iucnredlist.org>. Consultada el 11/05/2015. Castro, F., M. I. Herrera y J. Lynch 2004e. Pristimantis obmutescens. The IUCN Red List of Threatened Species. Version 2014.3. <www.iucnredlist.org>. Consultada el 11/05/2015. Castro F., M. I. Herrera y J. D. Lynch. 2004f. Pristimantis piceus. The IUCN Red List of Threatened Species. Version 2014.3. <www.iucnredlist.org>. Downloaded on 25 May 2015. Castro F., M. I. Herrera y J. D. Lynch. 2004g. Pristimantis racemus. The IUCN Red List of Threatened Species. Version 2014.3. <www.iucnredlist.org>. Downloaded on 25 May 2015. Clarke, K.R. y Ainsworth, M. A. 1993. Method of linking multivariate community structure to environmental variables. Mar. Ecol. Prog. Ser, 92, 205–219. Cleef, A. M. 1980. Secuencia altitudinal de la vegetación de los páramos de la cordillera Oriental de Colombia. Revista Instituto Geográfico Agustín Codazzi. vol. 7, no. 2: 50-67. Cleef, A. M. 1981. The vegetation of the páramos of the Colombian cordillera Oriental. Dissertationes Botanicae. vol. 61, 320. Corporación Suna Hisca. 2012. Parque Ecológico Distrital de Montaña Entrenubes. Tomo I. Componente Biofisico. Entomofauna. www.sentidonatural.org/Publicaciones%20HJ/Entomofauna%20Parque%20Entr enubes.pdf Cortez, C. F; Suárez Mayorga y A. M. López. 2006. Preparación y preservación de material científico. Pp: 173-220. En: Angulo, A., J.V. Rueda Almonacid, J.V. 324 Cortez-Fernández. 2006. Variación Altitudinal De La Riqueza Y Abundancia Relativa De Los Anuros Del Parque Nacional Y Área Natural De Manejo Integrado Cotapata-Bolivia. Ecología en Bolivia, 41(1): 46-64, Julio de 2006. Crump, M. L. y N.J. Scott. 1994. Visual encounter surveys. Pp: 84-92. En: Heyer, W. R., Donnelly, M. A., McDiarmid, R. W., Hayek, L.-A. C., and Foster, M.S. (Eds.). Measuring and Monitoring Biological Diversity. Standard Methods for Amphibians. Smithsonian Institution Press. Washington and London. Cuatrecasas, J. 1934.Observaciones geobotánicas en Botánicano. 27. Museo Nacional Ciencias Naturales. 144. Colombia. Serie Cuatrecasas, J. 1958. Aspectos de la vegetación natural de Colombia. Revista de la Academia Colombiana de Ciencias Exactas Físicas y Naturales, no.10: 221268. Chaparro-Herrera, S., M.A. Echeverry-Galvis., S. Córdoba-Cordoba., A. SuaBecerra. 2013. Listado actualizado de las aves endémicas y casi-endémicas de Colombia. Biota Colombiana, Vol. 14, No. 2. Chao, A., R. L. Chazdon, R. K. Colwell, and T.-J. Shen. 2005. A new statistical approach for assessing compositional similarity based on incidence and abundance data. Ecology Letters 8:148-159. Devia, W., A. Castaño., J.B. Adarve., G. Parra., N. Gómez., G.A Ospina. 2007. Elaboración del estudio sobre el estado actual de páramos (EEAP) y del plan de manejo ambiental de los páramos (PMA) del área de jurisdicción de la Corporación Autónoma Regional del Valle del Cauca (CVC). Informe técnico. Instituto para la Investigación y Preservación del Patrimonio Cultural y Natural del Valle del Cauca (INCIVA) y Corporación Autónoma Regional del Valle del Cauca (CVC). Santiago de Cali., 391 pp. Díaz, J., G. Amat y O. Vargas. 2007. Caracterización de la artropofauna epigea de zonas intervenidas en los predios del embalse de Chisacá. Pp: 199-214. En: Vargas O. (Ed.). Restauración ecológica del bosque altoandino. Estudios diagnósticos y experimentales en los alrededores del embalse de Chisacá (Localidad de Usme, Bogotá D.C.). Universidad Nacional de Colombia. Bogotá, 516 pp. Erwin T. L., G.E Ball, D. R. Whitehead y A. L. Halpern (Eds.). 1979. Carabid beetles: their evolution, natural history, and classification Proceedings of the first International Symposium of Carabidology, The Hague: Dr. W.Junk. 634 pp. Erwin T. L.1991. Natural history of the carabid beetles at the BIOLAT Biological Station, Rio Manu, Pakitza, Revista Peruana de Entomología, Perú, 33:1-85. 325 Erwin, T. 1982. Tropical forests: their richness in Coleoptera and other arthropod species. Coleopterists bulletin 36:580-592 Fernández F. 2011. The greatest impediment to the study of biodiversity in Colombia. Caldasia, 33 (2): iii-v. Finol, H. 1976. Estudio fitosociológico de las unidades 2 y 3 de la Reserva Forestal de Carapo. Pp: 15-103. Acta Botánica Venezuelica, vol.10 nos.1,2,3 y 4. Estado de Barinas. Fuentes, P.V. y Camero-Rubio, E., 2006.- Estudio de la fauna de escarabajos coprófagos (Coleoptera: Scarabaeidae) en un Bosque Húmedo Tropical de Colombia. Entomotropica, 26: 133-143. Franks N.R. y Fletcher, C. 1983. Spatial patterns in army ant foraging and migration:Eciton burchelli on barro colorado island, Panama. Behav Ecol Sociobiol. 12(4): 261-270. García, J.C., H. Cárdenas, y F. Castro. 2007. Relación entre la diversidad de anuros y los estados sucesionales de un bosque muy húmedo montano bajo del Valle del Cauca, suroccidente colombiano. Caldasia, 29: 363-374. Gardner, M. 2013. Podocarpus oleifolius. The IUCN Red List of Threatened Species. Versión 2015.1 www.iucnredlist.org. Consultada 2015/06/03. Gentry H. A. 1995. Diversity and floristic composition of neotropical dry forests. Pp: 146-194. En: Bullock S. H., Mooney H. A. y Medina E. Cambridge University Press. Gentry, H.A. 1993. A field guide to the families and genera of woody plants of Northwest South America. Conservation International, Washington. Gorny, M. y L. Grum (Eds.). 1993. Methods in Soil Zoology. Elsevier - Polish Scientific Publishers PWN Ltd. Poland, 459 pp. Gotelli, N.J. y R.K Colwell 2011. Estimating species richness. Pp. 39-54. En: Magurran, A. y B.J Mcgill (Eds.). Biological diversity. Frontiers in measurements and assessment. Oxford University Press, New York. Guarnizo, C. E., C. Escallón, D. Cannatella, y A. Amézquita. 2012. Congruence between acoustic traits and geanological history reveals a new species of Dendropsophus (Anura: Hylidae) in the high Andes of Colombia. En: Herpetologica. vol. 68, p. 523-540. 326 Gutiérrez-Cardenas, P.D. 2005. Diversidad y segregación de nichos en anfibios de montaña en la Reserva La Forzosa (Anorí: Antioquia). Tesis de maestria. Universidad de Antioquia, Medellín, Colombia. Halffter, G. y C. E. Moreno. 2005. Significado biológico de las diversidades Alfa, Beta y Gamma. Pp 242. En: Halffter, G., (Ed.). Sobre diversidad biológica: el significado de las diversidades Alfa, Beta y Gamma. Volumen 4. Zaragosa: Monografías tercer milenio. Halffter, G. y Moteno, C. E. 2005. Significado biológico de las diversidades Alfa, Beta y Gamma. Pp: 242. En: Halffter, G. (Ed). Sobre diversidad biológica: el significado de las diversidades Alfa, Beta y Gamma. Volumen 4. Zaragoza: Monografías Tercer Milenio. Hammer, O., D.A.T. Harper, y P. D. Ryan. 2001. PAST: paleontological statistics software package for education and data analysis. Paleontología electrónica. vol. 4: 1-9. Hilty, S.L., y W.L. Brown., 2001. Guía de las Aves de Colombia. SAO, Universidad del Valle y American Bird Conservancy – ABC, Cali, Colombia., 1030 pp. Hill, M. 1973. Diversity and evenness: a unifying notation and its consequences. Ecology, 54.2: 427-432. Hölldobler, B y Wilson E.O. 1990.The Ants. Cambridge, Massachusetts: Harvard University Press. Hutter, C. R., et al. 2013. Explaining Andean megadiversity: the evolutionary and ecological causes of glassfrog elevational richness patterns. En: Ecology Letters. Vol.16, p. 1135-1144. Janzen, D. 1993. Sweep samples of tropical foliage insects: effects of seasons, vegetation types, elevation, time of day, and insularity. Ecology, 54 (3):687-708. Jaffé, K., Lattke, J. y Pérez, E. 1993. El mundo de las hormigas. Venezuela. Universidad Simón Bolívar, Equinoccio Ediciones, 196 p. Jost, L. 2006. Entropy and diversity. Oikos, vol. 113: 363-375. Jiménez-Valverde, A. & Hortal, J. 2003. Las curvas de acumulación de especies y la necesidad de evaluar la calidad de los inventarios biológicos. Revista Ibérica de Aracnología, 8, 151-161. Kattan G.H y L.M. Renjifo. 2002. Grallaricula lineifrons. Pp: 329-330. En: Renjifo, L.M., Franco-Maya, A.M., Amaya-Espinel. J.D., Kattan. G.H., López-Lanús (Eds). Libro rojo de aves de Colombia. Serie Libros Rojos de Especies 327 Amenazadas de Colombia. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt y Ministerio del Medio Ambiente. Bogotá, Colombia. Kattan,G. 1992. Rarity and vulnerability: The birds of the cordillera Central of Colombia. Conservation Biology. 6:64-70. King, M. 1993. Species Evolution. The rol of chromosome change. Cambridge University Press. Cambridge. Köhler, J. 2000. Amphibian diversity in Bolivia: a study wwith special reference to montane forest regions. Zoologisches Forschungsinstitut und Museum Alexander Koenig. Bonn. 281 p. Krekeler, C. 1962. Dispersal of cavernicolous beetles. Systematic Zoology (3):119-130. 8 Laurance, W. F. y Bierregaard junior, R. O. 1997. Tropical forest remnants: ecology, management, and conservation of fragmented communities. University of Chicago, Chicago EEUU. Leaky, R. J. G., J. Proctor 1987. Invertebrates in the litter and soil at a range of altitudes in Gunung Silam, a small ultrabasic mountain in Sabah. Journal of Tropical Ecology 3: 119-129 pp. Lomolino, M.V. 2001. Elevation gradients of species–density historical and prospective views. Global Ecology and Biogeography, No 10, 3–13. López, J.H. y A.L García. 2014. Recopilación de información secundaria componente biótico, complejo de páramos las Hermosas. Informe técnico. Fundación Ecológica Las Mellizas e Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. Armenia., 67 pp. López, J.H., A. Ospina., J.W Parra., W.A Cardona., F. Vargas., W.E Buitrago., L.F Rivera., R.C Silva., J.M Duque., D.F Londoño., J.M Baos., V. Rojas., O.A León. 2104. Estudio de Flora, Edafofauna Epígea, Anfibios y Aves en bosques altoandinos y páramos del departamento del Quindío. Transectos altitudinales complejo de páramos Chilí-Barragán, municipios de Calarcá, Córdoba y Génova. Informe técnico. Fundación Ecológica Las Mellizas e Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. Armenia., 260 pp. López-Lanus, B., P.W Salaman., T.P Cowley., S. Arango. y L.M. Renjifo 2000. The threatened birds of the río Toche, Cordillera Central, Colombia. Cotinga. 14:1723. 328 Lozano, F.H. (Ed). 2009. Herramientas de manejo para la conservación de biodiversidad en paisajes rurales. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt y Corporación Autónoma Regional de Cundinamarca (CAR). Bogota, D.C., Colombia, 238 pp. Lynch, J. D. 1999. Ranas Pequeñas, la geometría de evolución, y la especiación en los andes colombianos. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales. Marzo Vol. 23. no. 86: 143-159. Lynch, J. D. y A. Suárez-Mayorga. 2002. Análisis biogeográfico de los anfibios paramunos. Caldasia. vol. 24: 471-480. Lynch, J., P. Ruiz y M. Ardila. 1997. Biogeographic patterns of Colombian frogs and toads. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales. Julio Vol. 21 no. 80: 237-248. Lynch, J.D. 1979. The identity of Eleutherodactylus vertebralis (Boulenger) with the description of a new species from Colombia and Ecuador (Amphibia: Leptodactylidae). Journal of Herpetology 13: 411–418. Lynch, J.D. 1980. New species of Eleutherodactylus of Colombia (Amphibia: Leptodactylidae). I: Five new species from the paramos of the cordillera central. Caldasia, vol. 13: 165-188. Lynch, J.D. 1991. New diminutive Eleutherodactylus from the Cordillera Central of Colombia (Amphibia: Leptodactylidae). Journal of Herpetology 25(3): 344-352. Lynch, J. D., & P. M. Ruiz-Carranza. 1983. New frogs of the genus Eleutherodactylus from the Andes of southern Colombia. Transactions of the Kansas Academy of Science 86 (4): 99–112. Macarthur, R. H. 1961. et al. On bird species diversity. Ecology, vol. 42: 594-598. Magurran, A. 1988. Ecological diversity and its measurement. Princeton University Press. New Jersey,179 pp. Magurran, A. E. 2004. Measuring biological diversity. Blackwell Publishing, 257 pp. Marín, C., D. Jiménez., G. Medina., M.V. Sarmiento., O.A León. 2014. Propuesta Metodológica para los Estudios Bióticos para la Identificación y Delimitación de los Complejos de Páramos a escala 1:25.000., 53 pp. Martínez, C. y J. Ball. 2003. Los Platynini (Coleoptera: Carabidae) de Colombia. Biota Colombiana, vol. 4, No. 2, 175-186 pp. Maveety, S.A., R.A. Browne, & T.L. Erwin. 2011. Carabidae diversity along an altitudinal gradient in a Peruvian cloud forest (Coleoptera). In T. Erwin (Ed.). 329 Proceedings of a symposium honoring the careers of Ross and Joyce Bell and their contributions to scientific work. Burlington, Vermont, 12–15 June 2010. ZooKeys 147:651–666. Mayr, E. 1963. Animal Species and Evolution. Harvard University Press. Cambridge. Mcmullan, M., T.M Donegan., A. Quevedo. 2010. Field Guide to the Birds of Colombia. Fundación Proaves. 225 pp. Méndez, L. E., J. H. López, y M. P. Ramírez. 2005. Inventario de flora y fauna de la zona de páramo del municipio de Pijao (Quindío). Ventana de trabajo, predio río azul (vereda río azul alto). Fundación Ecológica Reserva Las Mellizas., pp. 54. Ministerio de Ambiente y Desarrollo Sostenible de Colombia. Resolución 192 (22, febrero, 2014). Por la cual se establece el listado de las especies silvestres amenazadas de la diversidad biológica colombiana que se encuentran en el territorio nacional, y se dictan otras disposiciones. Diario Oficial. Bogotá, D.C., 2014. no. 49.072. pp.16 Moller, P. y L. Yánez. 1999. Catalogue of the vascular plants of Ecuador. Missouri Botanical Garden, USA. Mora O., L. E. y Sturm, H. 1998. Estudios ecológicos del páramo y del bosque altoandino cordillera Oriental de Colombia. Academia Colombiana de Ciencias Exactas Físicas y Naturales. Bogotá D.C. Morales M., J. Otero., Van der Hammen T., A. Torres., C. Cadena., C. Pedraza., N. Rodríguez., C. Franco., J.C Betancourth., E. Olaya., E. Posada E y L. Cárdenas 2007. Atlas de páramos de Colombia. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. Bogotá, D. C. 208 pp. Moreno, C. E. 2001. Métodos para medir la biodiversidad. Zaragoza: M&TManuales y Tesis SEA, vol. 1: 84. Mueses-Cisneros, J. J. y I. V. Perdomo-Castillo. 2011. Hyloscirtus tigrinus una especie amenazada. Con comentarios sobre su distribución geográfica e historia natural. En: Mueses Cisneros y Anganoy Criollo. Herpetotropicos, Vol. 5, p. 93-103. Muñoz-Guerrera, J., V. Serrano y M. Ramírez. 2007. Uso de microhábitat, dieta y tiempo de actividad en cuatro especies simpátricas de ranas Hílidas neotropicales (Anura: Hylidae). Caldasia. Vol. 29. no. 2: 413-425. 330 Navas, C. 1999. Biodiversidad de Anfibios y Reptiles en el Páramo: Una visión eco-fisiológica. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales. Suplemento especial 23: 465-474. Nekola, J. C. y White, P. S. 1999. The distance decay of similarity in biogeography and ecology. Journal of Biogeography, vol. 26: 867-878. Nocedal, J. 1984. Estructura y utilización del follaje de las comunidades de pájaros en bosques templados del Valle de México. Acta Zoológica Mexicana, vol. 6: 1-37. Ocampo L.A., J.J. Rivera., L.E. Ramírez., J.R. Vaquiro., P.D. Alabarán., E.R. Bobadilla., Q. Rodríguez., M.I. Mazuera., K. Ardila., L.J. Trujillo., S.L Rubio. 2009. Informe Técnico. Estudio de Estado Actual (EEA) y Plan de Manejo (PM) de los Páramos del departamento del Tolima. Corporación Colombiana de Investigación Agropecuaria (Corpoica - Nataima) y Corporación Autónoma Regional del Tolima. Espinal., 274 pp. Pearson, D. 1994. Selection indicator taxa for the cuantitative assessment of biodiversity. Philosophical Transactions of the Royal Society of London. vol. 345, no. 1311, 75-79. Pedraza, P. J. Betancur & P Franco. 2004. Chisacá, Un Recorrido Por Los Páramos Andinos. Instituto de Ciencias Naturales Universidad Nacional de Colombia e Instituto de Investigación de Recursos Biológicos Alexander Von Humboldt. Bogotá, D. C. 340 pp. Peracca, M. G. 1904. Viaggio del Dr. Enrico Festa nell’ Ecuador e regioni vicine. Rettili ed anfibi. Bollettino dei Musei di Zoologia e Anatomia Comparata della R. Universita di Torino 19 (465): 1–41. Pounds, J., M. Fogden, J. Savage & G.Gorman. 1997. Tets of null models for amphibian declines on a tropical mountain. Conservation Biology 11: 13071322. Rahbek, C. 1995. The elevational gradient of species richness: A uniform pattern?. Ecography, 18(2): 200–205. Rangel-Ch, J.O y A. Velázquez, 1997. Métodos de estudio de la vegetación. Pp: 59-87. En: Rangel-Ch, J.O., P. Lowy-C, M. Aguilar-P. (Eds.), Diversidad Biótica II. Tipos de Vegetación en Colombia. Universidad Nacional de ColombiaInstituto de Ciencias Naturales, Instituto de Hidrología, Meteorología y Estudios Ambientales (IDEAM), Ministerio del Medio Ambiente, Comité de Investigaciones y Desarrollo Científico-CINDEC.U.N, Academia Colombiana de Ciencias Exactas, Físicas y Naturales. Bogotá, D.C. ,436 pp. 331 Rangel-Ch, J.O. 2000. Colombia diversedidad biótica III. La región de vida paramuna. Universidad Nacional de Colombia, Falcultad de Ciencias, Instituto de Ciencias Naturales ICN, Bogotá DC. Rangel-Ch, J.O. 1995. La diversidad florística en el espacio andino de Colombia. Pp: 187-205. En: S. Churchil., H. Balslev., E. Forero., J. Luteyn (Eds). Biodiversity and conservation of neotropical montane forest. The New York Botanical garden. New York. Rappole, J. H., E. S. Morton, T. E. Lovejoy III y J. R. Ruos. 1993. Aves migratorias neárticas en los neotrópicos. Conservation and Research Center. National Zoological Park. Front Royal, BC, Canadá. Raves, G. R y J.A. Giraldo. 1987. Population status of the Rufousfronted parakeet (Bolborhynchus ferrugineifrons), a Colombian endemic. LeGerfaut. 77:89-92. Reichardt, H. A. 1977. Synopsis of genera of neotropical Carabidae (Insecta:Coleoptera). Questiones Entomologicae, 13:346-493. Renjifo, L. M. 1999. Composition changes in a sub andean avifauna after long-term forest fragmentation. Conservation Biology, vol.13, no. 5: 432-449. Renjifo, L.M., Franco-Maya, A.M., Amaya-Espinel. J.D., Kattan. G.H., LópezLanús (Eds). 2002. Libro rojo de aves de Colombia. Serie Libros Rojos de Especies Amenazadas de Colombia. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt y Ministerio del Medio Ambiente. Bogotá, Colombia., 561 pp. Renjifo, L.M., Gómez, M.F., Velásquez-Tibat, J., Amaya-Villarreal, A.M., Kattan. G.H., Amaya-Espinel. J.D., y Burbano-Jirón, J. (Eds). 2014. Libro rojo de aves de Colombia, Volumen I: Bosques húmedos de los Andes y la costa Pacífica. Editotial Pontificia Universidad Javeriana e Instituto Alexander von Humboldt. Bogotá D.C., Colombia., 465 pp. Ribera, I. y G. Foster. 1993. Uso de coleópteros acuáticos como indicadores biológicos (Coleoptera). Elytron, 6: 61-75. Ridgely, R.S. 1981. The current distribution and status of mainland neotropical parrots. Pp. 233-384. En: R. F. Pasquier, (Ed). Conservation of New World parrots. Smithsonian Institution. Press for the International Council for Bird Preservation (Tech. Pub. 1). Washington D. C. USA. Rincón F. y F. Castro. 1998. Aspectos ecológicos de una comunidad de Eleutherodactylus (Anura: Leptodactylidae) en un bosque de niebla del occidente de Colombia. Caldasia. vol. 20: 193-202. 332 Rivera-Correa, M. 2012. Colombian Amphibians: Cryptic diversity and cryptic taxonomy. Froglog. Estados Unidos Froglog Newsletter Of The Uicn Ssc Amphibian Specialist Group Asg. ISSN: 1026-0269 ed: v.100 fasc. 36–37. Rivera-Pedroza, L.F., M.P. Ramírez. 2005. Una extensión de la distribución del Tororoi Medialuna Grallaricula lineifros (Formicariidae) en Colombia. Ornitología Colombiana No. 3: 81-83. Rodríguez Mahecha, E. La Marca (Eds). Técnicas de inventario y monitoreo para los anfibios de la región tropical andina. Conservación Internacional, Serie de manuales de campo. Bogotá D.C. Rueda-Almonacid, J. V., J. D. Lynch, y A. E. Amézquita (Eds). 2004. Libro Rojo de los Anfibios de Colombia. Serie Libros de Especies Amenazadas de Colombia. Conservación Internacional Colombia, Instituto de Ciencias Naturales Universidad Nacional de Colombia, Ministerio del Medio Ambiente. Bogotá, Colombia., 384 pp. Rueda-Solano, L. A. y F. Vargas-Salinas. 2010. Amphibia, Anura, Strabomantidae, Geobatrachus walkeri (Ruthven, 1915): Altitudinal extension and new habitat, Colombia. Check list 6:454-455. Rueda-Solano, L. A. y F. Vargas-Salinas. 2010. Pristimantis cristinae and P. ruthveni. En: Lynch y Ruíz-Carranza; Increase of altitudinal distribution and páramo habitat use in the Sierra Nevada de Santa Marta, Colombia. Herpetozoa. vol. 23, p. 88-90. Ruíz-Carranza, P. M., M. C. Ardila-Robayo, y J. D. Lynch. 1996. Actualized checklist of the amphibian fauna of Colombia. Revista de la Academia Colombiana de Ciencias Exactas Físicas y Naturales. vol. 20: 365-415. Salazar-Ortega, J. 2008. Estudio de la entomofauna sucesional asociada a la descomposición de un cadáver de cerdo doméstico (Sus scrofa) en condiciones de campo. Universitas Scientiarum, Vol 13, No 1. Sanders, N. 2002. Elevational Gradients in Ant Species Richness: Area, Geometry, and Rapoport´s rule. Ecography 25: 25- 32. Sánchez–Ramos, G.,J. Lobo; M. Lara–Villalón y P. Reyes–Castillo. 1993. Distribución altitudinal y estacional de la entomofauna necrófila en la Reserva de la Biosfera "El Cielo", Tamaulipas, México, Biotam, 13-22. Sánchez-Reyes, U.J., S. Niño-Maldonado., R.W Jones. 2014. Diversity y altitudinal distribution of Chrysomelidae (Coleoptera) in Peregrina Canyon, Tamaulipas. En: Mexico. ZooKeys, 417: 103–132. doi: 10.3897/zookeys.417.7551 333 Sandoval, A. y G. Fagua. 2006. Estructura de las comunidades de Orthoptera (Insecta) en un gradiente altitudinal de un bosque andino. En: Revista Colombiana de Entomología, 32(2): 200-213. Sarmiento, C., C. Cadena, M. Sarmiento, J. Zapata y O. León. 2013. Aportes a la conservación estratégica de los páramos de Colombia: Actualización de la cartografía de los complejos de páramo a escala 1:100.000. Instituto de Investigación de Recursos biológicos Alexander von Humboldt. Bogotá, D.C. Colombia. 87 pp. Sklënár, P; J. L Luteyn, C. Ulloa Ulloa, P, M Jorgensen & M. O. Dilor. 2005. Flora Genérica de los Paramos. Guía ilustrada de plantas vasculares. Memoris of the New York Botanic. Gard. Vol. 92. Snyder, N., McGowan, P., J. Gilardi y A. Grajal. (eds). 2000. Parrots: status survey and conservation action plan 2000 – 2004. International Union for Conservation of Nature and Natural Resources. Cambridge. U.K. ISBN: 2-83170504-5. Sociedad Caldense de Ornitología (SCO). 2011. Mergantta, boletín informativo de la Sociedad Caldense de Ornitología. No. 048 Soininen, J.; Mcdonald, R. y Hillebrand, H. 2007. The distance decay of similarity in ecological communities. Ecography, no. 30: 3-12. Southwood,T.R.E. 1978. Ecological Methods with particular reference to the study of insect populations. 2 ed. Chapman and Hall. London. 391 pp. Stiles, F. G. 1998. Especies de aves endémicas y casi-endémicas de Colombia. En: Chaves, M.E. y Arango, N. (Eds.) Informe Nacional sobre el estado de la biodiversidad 1998-Colombia. Instituto Alexander von Humboldt Bogotá, PNUMA, Ministerio de medio Ambiente. Terborgh, J. 1971. Distribution on environmental gradients: theory and a preliminary interpretation of distributional patterns in the avifauna of the cordillera Vilcabamba, Peru. Ecology, 52(1):23-40. Ulloa, C. y P. Moller. 1993. Árboles y arbustos de los Andes del Ecuador. Aarhus, AAU reports. Uribe, M. y L. F. Vallejo. 2013. Diversidad de escarabajos Carabidae y Scarabaeidae de un bosque tropical en el magdalena medio colombiano. Museo de Historia Natural Universidad de Caldas Boletín Científifico, 17: 2. Vargas, W. 2002. Plantas de las Montañas del Quindío y los Andes Centrales. Universidad de Caldas. Manizales, 813 pp. 334 Vásquez, A. y A.C Buitrago (Eds). 2011. El gran libro de los páramos. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. Proyecto Páramo Andino. Bogotá, D. C. Colombia., 208 pp. Velásquez, E., B. E., F. Castro, W. Bolívar y M. I. Herrera. 2008. Infección por el hongo quitrido Batrachochytrium dendrobatidis en anuros de la Cordillera Occidental de Colombia. (Infection by the chytrid fungus Batrachochytrium dendrobatidis in anurans from Cordillera Occidental in Colombia). Herpetotropicos, 4(2), 65-70. Vélez, C. 1992. Flora del Quindío, I parte, Familia Compositae, Informe final de investigación. Universidad del Quindío. Armenia, Quindío. Veintimilla D., K. Salinas y N. Aguirre. 2014. Patrones de diversidad de Anuros en el ecosistema páramo del Parque Nacional Podocarpus. Revista CEDAMAZ. Vol. 2. p. 31 – 39. Villareal H., M. Álvarez, S. Córdoa, F. Escobar, G. Fagua, F. Gast, H. Mendoza, M. Ospina y A. M. Umaña. 2004. Manual de métodos para el desarrollo de inventarios de biodiversidad. Programa de Inventarios de Biodiversidad. Instituto de investigación de recursos biológicos Alexander von Humboldt. Bogotá, Colombia, 236 pp. Villarreal H., M. Álvarez, S. Córdoba, F. Escobar, G. Fagua, F. Gast, H. Mendoza, M. Ospina y A.M. Umaña. Segunda edición. 2006. Manual de métodos para el desarrollo de inventarios de biodiversidad. Programa de Inventarios de Biodiversidad. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. Bogotá, Colombia. 236 pp. Whittaker, R. H. 1960. Vegetation of the Siskiyou Mountains, Oregon and California. Ecological Monographs, 30:279–338. Whittaker, R. H. 1972. Evolution and measurement of species diversity. Taxon, vol. 21: 213-251. Werenkraut, V. Patrones altitudinales en la diversidad de coleópteros y hormigas epígeos del noroeste de la Patagonia argentina. Facultad de Ciencias Exactas y Naturales. Universidad de Buenos Aires. 2010, http://digital.bl.fcen.uba.ar/gsdl282/cgi-bin/library.cgi?a=d&c=tesis&d=Tesis_4785_Werenkraut. Wolda, H. 1990. Food availability for an insectivore and how to measure it. Pp: 3843. En: Morrison, M. L., C.J Ralph., J. Verner y J.R Jehl (Eds). Avian foraging: Theory, methodology, and applications. Studies in Avian Biology 13. World Conservation Monitoring Centre. 1992. Global Biodiversity. Status of the Earth’s Living Resources (Groombridge, ed.) Chapman y Hall. 335 Yánez-Muñoz, M., D. Almeida, F. Castro, L. A. Coloma, S. Ron y W. Bolívar 2010. Pristimantis buckleyi. The IUCN Red List of Threatened Species. Version 2014.3. <www.iucnredlist.org>. Consultada en 2015-05-11. 336 Anexo 1 Recopilación de información secundaria componente biótico, complejo de páramos las Hermosas Estudios de Flora, Edafofauna Epígea, Anfibios y Aves, en bosques altoandinos y páramos de los departamentos del Valle del Cauca y Tolima, con influencia en el complejo de páramos las Hermosas Componente Biótico, Convenio de cooperación No. 14-13-014-184CE Instituto de Investigación de Recursos Biológicos Alexander von Humboldt – Fundación Ecológica Reserva las Mellizas Producto 2, documento que contenga la información biótica existente en el complejo de páramo “Las Hermosas” departamentos del Valle del Cauca y Tolima. Fundación Ecológica las Mellizas1 1Jorge Hernán López Guzmán y Alba Lorena García Parra. 1 Octubre, 2014 TABLA DE CONTENIDO TABLA DE FIGURAS........................................................................................................ 4 LISTADO DE ANEXOS ..................................................................................................... 5 INTRODUCCIÓN ............................................................................................................... 6 1. DESCRIPCIÓN GENERAL COMPLEJO DE PÁRAMOS LAS HERMOSAS................ 7 1.1 PÁRAMOS DEL DEPARTAMENTO DEL VALLE DEL CAUCA EN EL COMPLEJO LAS HERMOSAS .................................................................................................................................... 7 1.2 PÁRAMOS DEL DEPARTAMENTO DEL TOLIMA EN EL COMPLEJO LAS HERMOSAS ........................................................................................................................................... 10 2.1 VALLE DEL CAUCA .................................................................................................................... 12 2.1.1 Diagnóstico socioeconómico y determinación de áreas de manejo especial con participación comunitaria en el área de páramo de la cordillera Central del Valle, jurisdicción CVC .............................................................................................................................................. 12 2.1.2 Elaboración del estudio sobre el estado actual de páramos (EEAP) y del plan de manejo ambiental de los páramos (PMA) del área de jurisdicción de la Corporación Autónoma Regional del Valle del Cauca-CVC ................................................................................ 17 2.1.3 Inventario de especies silvestres de fauna y flora en el Parque Natural Regional del Nima (PNR) ................................................................................................................................................ 18 2.1.4 Avifauna registrada en el ecosistema de páramo del Parque Natural Regional (PNR) del Nima ................................................................................................................................................ 20 2.1.5 Resultados de la compilación de documentos avifauna en el área de influencia del complejo de páramos Las Hermosas, en el Valle del Cauca ........................................... 22 2.1.6 Resultados de la compilación de reportes de anfibios en el Valle del Cauca, en el complejo de páramos Las Hermosas .............................................................................................. 24 2.2 DEPARTAMENTO DEL TOLIMA ............................................................................................ 25 2.2.1 Estudio de estado actual (EEA) y plan de manejo (PM) de los páramos del departamento del Tolima ............................................................................................................................ 25 2.2.1.1 Reportes de flora ............................................................................................................................................... 25 2.2.1.2 Reportes de avifauna....................................................................................................................................... 29 2.2.1.3 Anfibios reportados en ecosistemas de alta montaña del departamento del Tolima ........ 31 2.2.1.4 Mamíferos reportados .................................................................................................................................... 35 2.2.2 Plan de Ordenamiento de la cuenca hidrográfica del río Hereje. Estudio corregimiento de la Herrera, municipio de Río Blanco, páramo del Meridiano ............... 38 2.2.2.1 Anfibios reportados en el páramo del Meridiano .............................................................. 40 3. BIBLIOGRAFÍA ........................................................................................................ 41 2 4. ANEXOS .................................................................................................................. 43 TABLA DE ILUSTRACIONES Tabla 1. Complejo páramos Las Hermosas .................................................................................................. 7 Tabla 2. Páramos del Valle del Cauca ............................................................................................................. 9 Tabla 3. Áreas del complejo de páramos Las Hermosas en el departamento del Tolima .. 10 Tabla 4. Estudios de flora, aves y anfibios realizados en los departamento del Valle del Cauca y Tolima.......................................................................................................................................................... 14 Tabla 5. Listado de flora en el páramo del Parque Regional Natural del Nima ........................ 18 Tabla 6. Aves reportadas en el ecosistema de páramo del PRN del Nima ................................ 20 Tabla 7. Reportes de avifauna en el Valle del Cauca, en el complejo de páramos Las Hermosas ..................................................................................................................................................................... 23 Tabla 8. Reportes de anfibios en el Valle del Cauca, en el complejo de páramos Las Hermosas ..................................................................................................................................................................... 24 Tabla 9. Composición florística en páramos del departamento del Tolima............................... 25 Tabla 10. Familias botánicas con mayor número de especies en páramos del departamento del Tolima ...................................................................................................................................... 26 Tabla 11. Especies de flora endémicas reportadas en páramos del Tolima ............................. 26 Tabla 12. Especies de flora amenazadas de extinción en páramos del Tolima ...................... 27 Tabla 13. Familias de aves con mayor número de especies en ecosistemas de alta montaña del departamento del Tolima .......................................................................................................... 29 Tabla 14. Aves endémicas y casi endémicas presentes en ecosistemas de alta montaña del departamento del Tolima .............................................................................................................................. 29 Tabla 15. Especies de aves migratorias y amenazadas de extinción en los bosques altoandinos y páramos del departamento del Tolima ............................................................................ 30 Tabla 16. Anfibios registrados en bosques altoandino y páramos del departamento del Tolima ............................................................................................................................................................................. 33 Tabla 17. Listado de mamíferos registrados en los páramos del departamento del Tolima ........................................................................................................................................................................................... 35 Tabla 18. Mamíferos amenazados de extinción presentes en los páramos del Tolima ...... 37 3 Tabla 19. Plantas registradas en el páramo del Meridiano ................................................................. 38 Tabla 20. Especies amenazadas de extinción registradas en la cuenca del río Hereje ...... 40 Tabla 21. Especies de anfibios registrados en el páramo del Meridiano .................................... 40 TABLA DE FIGURAS Figura 1. Complejo de páramos Las Hermosas .......................................................................................... 8 Figura 2. Páramos del Valle del Cauca en el área del complejo Las Hermosas ........................ 9 Figura 3. División político administrativa de las zonas de páramo en el departamento del Tolima ............................................................................................................................................................................. 11 Figura 4. Familias botánicas con mayor número de especies en los páramos de los municipios de Tuluá, Pradera, El Cerrito, Ginebra y Buga ................................................................. 16 Figura 5. Riqueza florística en páramos de los municipios de Tuluá, Pradera, El Cerrito, Ginebra y Buga.......................................................................................................................................................... 16 Figura 6. Riqueza florística en cuatro localidades de páramo del Valle del Cauca................ 17 Figura 7. Familias con mayor número de especies, en el páramo del PNR Nima ................. 19 Figura 8. Perfil de vegetación paramuna en una parcela de 10 m2 (5x2) en el Parque Regional Natural del Nima ................................................................................................................................... 20 Figura 9. Abundacia de especies por familia en el páramo del PRN del Nima ........................ 21 Figura 10. Uso de hábitat de la avifauna en el páramo del PRN del Nima ................................ 22 Figura 11. Número de especies de plantas registradas en diferentes hábitats de páramo en el departamento del Tolima .......................................................................................................................... 28 Figura 12. Uso de hábitat de avifauna en ecosistemas de alta montaña del departamento del Tolima ..................................................................................................................................................................... 30 Figura 13. Número de especies de aves registradas en diferentes ecosistemas de alta montaña del departamento del Tolima .......................................................................................................... 31 Figura 14. Familias de anfibios con mayor número de especies registradas para los páramos del Tolima ................................................................................................................................................. 32 4 Figura 15. Especies de anfibios registrados en diferentes ecosistemas de alta montaña del departamento del Tolima ...................................................................................................................................... 35 Figura 16. Familias de mamíferos con mayor número de especies registradas en los ecosistemas de alta montaña del departamento del Tolima .............................................................. 37 Figura 17. Familias con mayor número de especies en el páramo del Meridiano .................. 39 LISTADO DE ANEXOS Anexo A. Flora registrada en el “Diagnóstico socioeconómico y determinación de áreas de manejo especial con participación comunitaria en el area de páramo de la cordillera Central del Valle, jurisdiccion CVC”. Anexo B. Flora registrada en el Estudio sobre el estado actual de páramos (EEAP) y del plan de manejo ambiental de los páramos (PMA) del área de jurisdicción de la Corporación Autónoma Regional del Valle del Cauca-CVC. Anexo C. Consolidado de aves reportadas en el complejo de Páramos Las Hermosas en el Valle del Cauca. Anexo D. Consolidado de anfibios reportados en el complejo de Páramos Las Hermosas en el Valle del Cauca. Anexo E. Listado de Aves de los páramos del Tolima . 5 INTRODUCCIÓN El Instituto de Investigación en Recursos Biológicos Alexander von Humboldt (IAvH) y la Fundación Ecológica Las Mellizas, suscribieron el convenio de cooperación No. 14-13-014-184CE, a realizarse entre el mes de agosto del año 2014 y febrero de 2015, con el propósito de aunar esfuerzos técnicos, científicos, administrativos y financieros para la elaboración de los estudios bióticos a escala 1:25.000 del complejo de páramos Las Hermosas. Teniendo en cuenta el propósito general del convenio, que consiste en identificar la franja de transición entre el bosque altoandino y el páramo, a través del estudio de cuatro grupos biológicos: flora, edafofauna epígea, anfibios y aves, la Fundación Ecológica Las Mellizas elaboró, a partir de revisión bibliográfica, el presente documento que expone la línea base de los estudios realizados en estos grupos biológicos en el complejo de páramos las Hermosas. Durante la la recopilación de información se accedió a 12 documentos relacionados con los grupos biológicos enunciados, en ecosistemas de alta montaña de los departamentos del Valle del Cauca y Tolima. Los estudios revisados corresponden principalmente a informes de convenios suscritos entre las Corporaciones Autonomas Regionales del Valle del Cauca (CVC) y Tolima (Cortolima) con organizaciones no gubernamentales (ONG) e institutos, para la realización de estudios como el estado actual y plan de manejo de los páramos en cada departamento, planes de manejo de áreas protegidas y ordenación de cuencas. Para el grupo de edafofauna epígea no se encontró información durante la revisión bibliográfica realizada, por lo que se estima que este grupo no ha sido investigado para el área de este complejo. 6 1. DESCRIPCIÓN GENERAL COMPLEJO DE PÁRAMOS LAS HERMOSAS El complejo de páramos Las Hermosas está ubicado en los Andes colombianos, sector de la cordillera Central. Comprende 8 municipios del departamento del Valle del Cauca, tres del Tolima y uno del Cauca, en una franja altitudinal comprendida entre los 3.000 y 4.000 m de altitud aproximadamente y posee una extensión total de 208.011 hectáreas (Ha) (Tabla 1 y Figura 1) (Sarmiento et al.2013). En este complejo el clima es característico de las zonas de páramo, con temperaturas entre 0 y 8 ºC y precipitación de 2.000 mm/año para las zonas ubicadas por encima de los 2.800 m de altitud (Morales, 2007). Tabla 1. Complejo páramos Las Hermosas Departamento Cauca Municipio Miranda Área (Has) 110 Sub total Cauca 110 Valle del Cauca 20.338 4.392 10.269 2.873 16.090 5.257 1.285 8.423 68.928 39.100 46 99.828 138,973 208.011 Buga El Cerrito Florida Ginebra Palmira Pradera Sevilla Tuluá Sub total Valle del Cauca Chaparral Tolima Planadas Río Blanco Sub total Tolima Total complejo Fuente: Sarmiento et al. 2013 1.1 PÁRAMOS DEL DEPARTAMENTO DEL VALLE DEL CAUCA EN EL COMPLEJO LAS HERMOSAS En el departamento del Valle del Cauca, los páramos se distribuyen sobre las cordilleras Central y Occidental. En el sector de la cordillera Central, existen 68.928 Ha de páramos aproximadamente (Sarmiento et al.2013), de las cuales el 35% (24.135 Ha) hacen parte del Parque Nacional Natural las Hermosas. En el estudio sobre el estado actual de los páramos en el Valle del Cauca, se tomó la cota de 2.800 m de altitud como área de influencia y la de 3.400 como páramo propiamente dicho (Álvarez et al. 2007). Para el sector de la cordillera Central en este departamento se reportan las siguientes áreas de páramo: Peñas Blancas (municipio de Sevilla), Barragán 7 - Santa Lucía y Japón (Tuluá), Combia - Pan de Azúcar (El Cerrito), Las Domínguez (Buga, Ginebra y El Cerrito), La Nevera (Palmira) y Tinajas (Palmira, Pradera y Florida) (Tabla 2 y Figura 2). Figura 1. Complejo de páramos Las Hermosas Fuente: Sarmiento et al.2013 8 Tabla 2. Páramos del Valle del Cauca Estudio páramos CVC- Inciva 2007 Municipio Área Páramo Buga El Cerrito Florida Ginebra Palmira Pradera Sevilla 1.812,4 4.287.1 9.369 2.147,4 2.682,9 4.637,8 5.999,7 Área Influencia 5.595,7 8.262,1 4.430,7 3.385 3.253 3.738,8 4.854,1 Tuluá Total 4.260,2 35.196,5 15.587,4 49106.8 Total Libro Páramos – gGTP 2005 7.408,1 12.549,1 13.799,7 5.532,4 5.936.1 8.376,6 10.853,8 27.302,1 13.775,1 13.786,2 5.561,4 21.223.3 8.388,9 10.868,2 19847,6 84.303,4 21.960,9 122.863 Fuente: Álvarez et al. 2007 y GTP - CO 2005. Figura 2. Páramos del Valle del Cauca en el área del complejo Las Hermosas Fuente:Álvarez et al. 2007. 9 1.2 PÁRAMOS DEL DEPARTAMENTO DEL TOLIMA EN EL COMPLEJO LAS HERMOSAS Los páramos del Tolima están ubicados en la cordillera Central y se distribuyen en el departamento de norte a sur, limitando con los departamentos de Caldas, Risaralda y Quindío en el sector del Parque Nacional Natural (PNN) Los Nevados; con el Valle del Cauca, en el sector del PNN Las Hermosas; con los departamentos de Cauca y Huila en el sector del PNN del Nevado del Hulia y con Cundinamarca en el PNN Sumapaz (Ocampo et al. 2009) (Figura 3). En este departamento, el complejo de páramos las Hermosas, se ubica en los municipios de Chaparral, Río Blanco y Planadas (Sarmiento, et al. 2013). De acuerdo con el estudio sobre el Estado actual y plan de manejo de los páramos del departamento del Tolima (Ocampo et al. 2009), el municipio que presenta la mayor extensión en páramo es Rio Blanco y el de menor área es planadas (Tabla 3). Tabla 3. Áreas del complejo de páramos Las Hermosas en el departamento del Tolima Municipio Chaparral Rio Blanco Planadas Vereda Alto Ambeima Argentina Hermosas El Cairo El Davis La Aurora Hermosas Lg Río San Fernanado San Jose de Las Hermosas Sector Tequendama PNN Las Hermosas Sub total Albania Campo Hermoso La Playa La Reina Las Mercedes Lg Territorios Nacionales Yarumales Subtotal Lg Marquetalia Peñarrica Resguardo Indígena Subtotal Total Fuente: Ocampo et al.2009. 10 Área (has) 721,45 417,13 913,06 265,26 711,12 378,45 5,70 1.775,32 7.720,20 1.235,24 28.044,33 42.187,26 513,53 2530,20 1661,64 295,05 726,66 579,45 79.982,92 102,10 86.391,55 86,04 0,46 33,40 133,52 253.4 128.832,21 Figura 3. División político administrativa de las zonas de páramo en el departamento del Tolima Fuente: Ocampo et al.2009. 11 Para los páramos del departamento del Tolima, se han definido las siguientes unidades climáticas: Páramo Alto Húmedo, en alturas mayores a los 3.700 m y temperaturas inferiores a los 7ºC; Páramo Bajo Superhúmedo, entre 3.200 y 3.700 m y temperatura entre 7 y 12°C; Páramo Bajo Húmedo y semi Húmedo, entre los 3.200 y 3.700 m y temperatura entre los 7 y 12°C y Nieves Perpetuas, en alturas superiores a 5.000 m (Ocampo et al. 2009). 2. ESTUDIOS DE FLORA, AVES Y ANFIBIOS EN EL COMPLEJO DE PÁRAMOS LAS HERMOSAS Durante la revisión bibliográfica realizada para la elaboración del presente documento, se accedió a 12 documentos relacionados con ecosistemas de alta montaña en el Valle del Cauca (ocho documentos) y Tolima (dos); dos documentos integran diferentes localidades de páramo en la región centro occidente. Los estudios están enfocados principalmente en el conocimiento de la composición de especies, sin embargo, en algunos de ellos se hacen aproximaciones importantes en la definición de especies propias de franjas altitudinales como bosques altoandinos y páramos (Tabla 4). A continuación se presenta una síntesis por departamento de los documentos considerados de mayor relevancia para plantas, anfibios, aves y mamíferos en el área de influencia del complejo de páramos Las Hermosas. 2.1 VALLE DEL CAUCA 2.1.1 Diagnóstico socioeconómico y determinación de áreas de manejo especial con participación comunitaria en el área de páramo de la cordillera Central del Valle, jurisdicción CVC En este documento se relacionan especies de plantas, aves y anfibios registradas para los páramos de los municipios de Tuluá (Barragán, Santa Lucía y picos del Japón), Pradera (cuenca alta río Bolo Blanco), El Cerrito, Ginebra y Buga (Pan de Azúcar y las Domínguez), en un gradiente altitudinal comprendido entre 3.300 y 3.800 m aprox. De acuerdo al estudio, en las zonas evaluadas fue difícil determinar diferencias entre los bosques altoandinos y páramos, ya que debido a la alta intervención humana, la flora característica de páramo (frailejonales y pajonales) se encuentra asociada con vegetación relictual de bosque altoandino. Al interior de algunas coberturas de frailejonales y pajonales se encuentran troncos de árboles, lo que sugiere que originalmente en esas zonas existían formaciones boscosas (Arana et al. 1999). En el sector de los páramos de Barragán, Santa Lucía y los picos del Japón,se reportó un total de 185 especies pertenecientes a 134 géneros y 61 familias bótanicas. Las más representativas son: Asteraceae, con 29 especies; Melastomataceae, con 9; Polipodiaceae, con 8; las familias Bromeliaceae, Ericaceae, Poaceae, Rosaceae, Solanaceae tienen 7 especies cada una. En el páramo del municipio de Pradera, en la cuenca alta del río Bolo Blanco, se identificaron 126 especies pertenecientes a 97 géneros y 44 familias botánicas; las mas representativas son: Asteraceae, con 17 especies, Ericaceae, Solanaceae y Rosaceae 12 con ocho cada una; Melastomataceae, con seis; Bromeliaceae y Scrophulariaceae con cuatro. 13 Tabla 4. Estudios de flora, aves y anfibios realizados en los departamento del Valle del Cauca y Tolima No. 1 2 Documento Elaboración del estudio sobre el estado actual de páramos (EEAP) y del plan de manejo ambiental de los páramos (PMA) del área de jurisdicción de la Corporación Autónoma Regional del Valle del Cauca – CVC. Inventario de especies de fauna y flora en el Parque Natural Regional (PNR) del Nima, municipio de Palmira, departamento del Valle del Cauca. Localidad Grupos biológicos estudiados Sevilla, Tuluá, Buga, El Anfibios, Cerrito, Ginebra, aves,mamíferos Palmira, Florida y flora. Pradera. Vereda La Nevera, predios La Camelia, La Sirena y Bellanista. y Flora y aves Páramos de las cordilleras Central y Occidental de Colombia. Páramos del centro occidente de Colombia, incluye departamentos del Tolima y Valle del Cauca. Flora, aves y mamíferos 4 Páramos del departamento del Valle del Cauca. Colombia Páramos del Duende,Farallones de Calí, Las Hermosas, Barragán - Santa Lucía, Pan de Azucar y Las Domínguez. Flora, aves, mamíferos y anfibios 5 Páramos de Letras, Normandía, Carrizales, Línea, Anaime, Proyecto conservación de ecosistemas de alta La Chilí, montaña en los departamentos de Caldas, Quindío, Barragán, Yerbabuena, Miraflores, Flora, aves, Valle del Cauca y Tolima, un aporte a las Meridiano, Las mamíferos y anfibios ecorregiones estratégicas. Hermosas, los Valles, PNN Los Nevados, Las Hermosas y parte del nevado del Huila. 3 6 7 Cuencas ríos Nima y Amaime, municipios de Palmira y El Cerrito. Diagnóstico socioeconomico y determinación de Florida, Pradera, áreas de manejo especial con participacion Palmira, El Cerrito, Caracterización y diagnóstico del ecosistema Andino y Subandino de La UMC Nima – Amaime 14 Flora, aves, herpertos (anfibios y reptiles). Flora,aves, mamíferos y Tipo de documento Informe convenio Informe convenio Libro Libro/Serie Informe convenio Informe convenio Informe convenio Autores DEVIA ÁLVAREZ, Wilson, et al. 2007. GÓMEZ BARREIRO, Francisco, et al. 2011. GRUPO DE TRABAJO EN PÁRAMOS CENTRO OCCIDENTE (GTP CO) y CORPORACIÓN AUTÓNOMA REGIONAL DEL VALLE DEL CAUCA (CVC). 2005. GOMÉZ, H, Natalia ,et al. 2009. BARRIOS RODRÍGUEZ, Luís Fernando. 2002. CELIS, Marcela, et al. 2002. OSPINA-ANTE, Omaira y VARGAS, William. 2000. ARANA, Ana Elvia, et al. 1999. No. 8 Documento comunitaria en el área de páramo de la cordillera Central del Valle del Cauca, jurisdicción CVC. Aunar esfuerzos técnicos y económicos para fortalecer el Sistema Departamental de Áreas Protegidas (SIDAP) a través de la formulación del plan de manejo del Parque Natural Regional de Nima y el establecimiento de reservas naturales de la sociedad civil en la zona de influencia del parque, municipio de Palmira. Plan de Manejo de la Reserva Forestal Sonso Guabas 9 10 11 12 Localidad Buga, Ginebra, Tuluá y Sevilla. Grupos biológicos estudiados Plan de ordenación y manejo de la cuenca hidrográfica del río Hereje. Autores anfibios. Cuenca media alta del río Nima, bosque sub- Flora, aves, andino, bosque Andino y mamíferos, anfibios páramo. Informe convenio Municipios de Ginebra, Guacarí y Buga, bosque Flora, Andino, sub-andino y aves,mamíferos y páramo, Pan de Azúcar anfibios. y Las Domínguez. Informe convenio ARISTIZABAL Hugo, et al. 2009. Base de datos CORPORACIÓN AUTÓNOMA REGIONAL DEL VALLE DEL CAUCA (CVC). Base de datos, listados históricos de especies. Corporación Autonóma Regional del Valle del Cauca Palmira, Pradera, Flora, aves, anfibios (CVC). Florida y Tuluá y mamíferos. Estudio de estado actual (EEA) y plan de manejo (PM) de los páramos del departamento del Tolima. Tipo de documento Municipios: Herveo, Casabianca, Villahermosa, Murillo, Santa Isabel, Flora, aves, Anzoátegui, Ibagué, mamíferos, Anfibios. Cajamarca, Roncesvalles, Rovira, San Antonio, Chaparral, Rioblanco y Planadas. Municipio de Rio Blanco, corregimiento de Flora, Anfibios Herrera, departamento del Tolima. Fuente: Elaboración propia, 2014. 15 CORREA CARDENAS, Andrés Felipe, et al. 2010. OSSA, OCAMPO OSORIO, Luís Augusto, et al. 2009. Informe convenio Informe convenio CORPORACIÓN AUTÓNOMA REGINAL DEL TOLIMA (CORTOLIMA). 2010. En el páramo de Pan de Azúcar y las Domínguez se identifcaron 122 especies pertenecientes a 91 géneros y 44 familias bótanicas; las más representativas fueron: Asteraceae con 15 especies; Ericaceae y Solanaceae, con ocho cada una; Rubiaceae con siete y Melastomataceae con seis. En las figuras 4 y 5 se presenta la composición de familias botánicas y riqueza florística de los páramos de Barragán, Bolo Blanco y Pan de Azúcar en los municipios de Tuluá, Pradera, El Cerrito, Ginebra y Buga. Número de Especies Figura 4. Familias botánicas con mayor número de especies en los páramos de los municipios de Tuluá, Pradera, El Cerrito, Ginebra y Buga 200 180 160 140 120 100 80 60 40 20 0 185 126 122 134 97 91 Especies 61 Géneros 44 44 Familias Páramo Barragán Páramo Bolo Blanco Páramo Pan de Azucar Familias Botánicas Fuente: Arana et al. 1999. Figura 5. Riqueza florística en páramos de los municipios de Tuluá, Pradera, El Cerrito, Ginebra y Buga Número de Especies 35 Tuluá 30 Pradera 25 El Cerrito, Ginebra y Buga 20 15 10 5 0 Familias Fuente: Arara et al. 1999. En el anexo A se relacionan la flora registrada en este estudio. 16 2.1.2 Elaboración del estudio sobre el estado actual de páramos (EEAP) y del plan de manejo ambiental de los páramos (PMA) del área de jurisdicción de la Corporación Autónoma Regional del Valle del Cauca-CVC Los inventarios de flora presentados en este estudio corresponden a zonas de alta montaña (2.800 y 3.800 m de altitud aprox.) en los municipios de Sevilla (Peñas Blancas), El Cerrito, Ginebra y Buga (Pan de Azúcar), Palmira (La Nevera) y Tuluá (Barragán–Santa Lucía). En el páramo de Peñas Blancas se registraron 60 especies, 35 géneros y 14 familias (Figura 6). Las familias con mayor número de especies fueron: Asteraceae con 16, Melastomataceae con 15, Myrsinaceae y Myrtaceae con 5, y Araliaceae con 4 especies (Anexo B). En el páramo de Pan de Azúcar se identificaron 106 especies, pertenecientes a 78 géneros y 39 familias botánicas (Figura 6). Las familias con mayor número de especies fueron: Asteraceae con 28, Ericaceae con 11, Melastomataceae y Rosaceae con cinco, e Iridaceae, Scrophulariaceae,Solanaceae y Lamiaceae, con cuatro especies cada una (Anexo B). En el páramo de la Nevera se registraron 14 especies, 12 géneros y 10 familias botánicas (Figura 6). La familia con mayor número de especies fue Rubiaceae, con cuatro (Anexo B). En el páramo de Barragán - Santa Lucía, se identificaron 330 especies, pertenecientes a 161 géneros y 78 familias botánicas (Figura 6). Las familias con mayor número de especies fueron: Asteraceae con 59, Rosaceae y Solanaceae con 22, Melastomataceae con 17, Ericaceae con 16, Rubiaceae con 10; Piperaceae, Lamiaceae, Bromeliaceae y Myrsinaceae, con 7; Passifloraceae y Polygalaceae con 6; Verbenaceae, Poaceae, Scrophulariaceae y Araliaceae con 5. Figura 6. Riqueza florística en cuatro localidades de páramo del Valle del Cauca 330 Número de Especies 350 300 250 200 161 150 100 50 0 Especie 106 60 78 35 78 39 14 Familia 14 12 10 Páramo de Páramo Pan de Peñas Blancas Azucar Páramo la Nevera Familias Botánicas Fuente: Álvarez et al. 2007. 17 Gènero Páramo de Barragán y Santa Lucia 2.1.3 Inventario de especies silvestres de fauna y flora en el Parque Natural Regional del Nima (PNR) Este estudio se realizó en tres ecosistemas: páramo, bosque altoandino y bosque sub-andino. En el páramo, el trabajo se realizó en el predio la Camelia de la vereda La Nevera, entre 3.273 y 3.884 m de altitud. Allí se se registraron 52 especies de plantas, pertenecientes a 48 géneros y 25 familias botánicas (Tabla 5). Las familias que presentaron el mayor número de especies fueron: Asteraceae con 11, Melastomataceae con 5, Ericaceae con 4; Poaceae y Scrophulariaceae, con 3 especies cada una. (Figura 7) Tabla 5. Listado de flora en el páramo del Parque Regional Natural del Nima Familia Especie Familia Especie APIACEAE Eryngium humile ERICACEAE Macleania rupestris APIACEAE Myrrhidendron glaucescens ERICACEAE Thibaudia floribunda ARACEAE ARALIACEAE Anthurium nigrescens Oreopanax discolor ERICACEAE HYPERICACEAE Vaccinium floribundum Hypericum laricifolium ARALIACEAE Oreopanax tolimanum LYCOPODIACEAE Lycopodium jussiaei ASTERAECAE LYCOPODIACEAE Huperzia tetragona ASTERAECAE Espeletia hartwegiana subsp centroandina Diplostephium schultzii MELASTOMATACEAE Miconia salicifolia ASTERAECAE Loricaria colombiana MELASTOMATACEAE Tibouchina grossa ASTERAECAE Senecio formosus MELASTOMATACEAE Tibouchina andreana ASTERAECAE Xenophyllum crassum MELASTOMATACEAE Axinaea macrophylla ASTERAECAE Ageratina tinifolia MELASTOMATACEAE Tibouchina mollis ASTERAECAE Pentacalia vaccinioides MYRSINAECAE Myrsine dependens ASTERAECAE Pentacalia sp ORCHIDACEAE Epidendrum frutex ASTERAECAE Gynoxys laurata POACEAE Chusquea tessellata ASTERAECAE Pentacalia weinmannifolia POACEAE Calamagrostis effusa ASTERAECAE Bidens triplinervia POACEAE Cortaderia nítida BERBERIDACEAE Berberis verticillata POLYGALACEAE Monnina bracteata BLECHNACEAE Blechnum loxense POLYGONACEAE Rumex tolimensis BROMELIACEAE Puya trianae PTERIDACEAE Jamesonia canescens BROMELIACEAE Racinaea penlandii ROSACEAE Hesperomeles ferruginea CLETHRACEAE Clethra fimbriata RUBIACEAE Arcytophyllum aristatum CUNONIACEAE Weinmannia mariquitae SCROPHULARIACEAE Castilleja integrifolia CUNONIACEAE Weinmannia tolimensis SCROPHULARIACEAE Bartsia orthocarpiflora CYPERACEAE Rhynchospora caucana SCROPHULARIACEAE Pedicularis incurva ELAEOCARPACEAE Vallea stipularis ERICACEAE Pernettya prostrata VALERIANACEAE Valeriana bracteata WINTERACEAE Drymis granadensis Fuente: Gómez, et al. 2011. 18 Número de Especies Figura 7. Familias con mayor número de especies, en el páramo del PNR Nima 12 11 10 8 6 5 4 4 3 3 2 0 Familias Fuente: Gómez, et al.2011. El páramo estudiado en el PRN del Nima presentó altos niveles de intervención antrópica, evidenciada por quemas y pastoreo de bovinos. Como consecuencia de lo anterior, dominan coberturas de pajonales y pastizales, con especies como: Calamagrostis effusa, Cortaderia nitida y Chusquea tessellata, asociadas con frailejonales de la especie Espeletia hartwegiana subsp. Centroandina. Los frailejones presentan bajas alturas (<2,5m), tallos desprovistos de hojas y con evidencias de quemas (Gómez, et al. 2011) (Figura 8). En sectores pendientes y de difícil acceso, se observaron frailejonales en mejores condiciones de conservación, con hojas secas recubriendo sus tallos y presencia de algunas especies de plantas de interés para este ecosistema, como Loricaria colombiana, Puya trianae, Senecio formosus, Bidens triplinervia y Chuquiraga jussieui. Entre las especies arbustivas y arvenses comunes en el páramo se encontraron, Hypericum laricifolium, Miconia salicifolia, Vaccinium floribundum y Tibouchina grossa, plantas que proporcionan una importante oferta alimenticia para las aves (Gómez, et al. 2011). En los límites inferiores del páramo se encontraron bosques bajos densos o bosques achaparrados, caracterizados por su bajo porte, altos niveles de epifitismo con musgos y líquenes, doseles continuos y dominio de arbolitos, como Hesperomeles ferruginea, Wienmannia mariquitae, Geissanthus andinus y Mysine dependes (Gómez, et al. 2011). Listado de especies del perfil de vegetación paramuna en el PRN Nima, figura 8 1. 2. 3. 4. 5. 6. 7. 8. 9. Chusquea tessellata. POACEAE Calamsgrostis effusa . POACEAE Lycopodium jussiaei. LYCOPODIACEAE Espeletia hartwegiana subsp. centroandania. ASTERACEAE Hypericum laricifolium. HYPERICACEAE Loricaria colombiana. ASTERACEAE Lachemilla sp. ROSACEAE Rhynchospora caucana. CYPERACEAE Diplostephium schultzii. ASTERACEAE 19 Figura 8. Perfil de vegetación paramuna en una parcela de 10 m2 (5x2) en el Parque Regional Natural del Nima Fuente: Gómez, et al. 2011 2.1.4 Avifauna registrada en el ecosistema de páramo del Parque Natural Regional (PNR) del Nima En el PRN del Nima se realizaron análisis de la información obtenida acerca de avifauna en diferentes escosistemas: subandino, andino y páramo, obteniendo para este último un total de 36 especies, pertenecientes a 20 familias (Tabla 6). Las familias que presentaron el mayor número de especies en el páramo, fueron: Trochilidae,Furnariidae, Thraupidae y Emberizidae (Figura 9). Tabla 6. Aves reportadas en el ecosistema de páramo del PRN del Nima* No. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Familia ANATIDAE ANATIDAE ACCIPITRIDAE FALCONIDAE SCOLOPACIDAE COLUMBIDAE APODIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE Especie Anas andinum Oxyura jamaicensis Geranoaetus melanoleucus Phalcoboenus carunculatus Gallinago cf. stricklandii Patagioenas fasciata Streptoprocne zonaris Aglaectis cupripennis Coeligena lutetiae Metallura tyrianthina Metallura williami Colibri coruscans Ramphomicron microrhynchum Colibri thalassinus Pterophanes cyanopterus 20 No. 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 Familia PICIDAE FURNARIIDAE FURNARIIDAE FURNARIIDAE GRALLARIIDAE TYRANNIDAE TYRANNIDAE COTINGIDAE HIRUNDINIDAE TROGLODYTIDAE CINCLIDAE TURDIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE EMBERIZIDAE EMBERIZIDAE EMBERIZIDAE EMBERIZIDAE PARULIDAE FRINGILLIDAE Especie Colaptes rivolii Asthenes flammulata Margarornis squamiger Schizoeca fuliginosa Grallaria quitensis Ochtoeca fumicolor Myiotheretes striaticollis Ampelion rubrocristatus Orochelidon murina Troglodytes solsticialis Cinclus leucocephalus Turdus fuscater Tangara vassori Diglossa humeralis Hemispingus verticalis Arremon torquatus Zonotrichia capensis Phrygilus unicolor Atlapetes pallidinucha Myioborus ornatus Carduelis spinescens Fuente: Gómez, et al. 2011 * Clasificación taxonómica actualizada de acuerdo a: South American Classification Commite (SACC), noviembre de 2014. http://www.museum.lsu.edu/~Remsen/SACCBaseline11.htm Figura 9. Abundacia de especies por familia en el páramo del PRN del Nima 9 Número de Especies 8 8 7 6 5 4 4 3 3 3 2 1 0 Trochilidae Emberizidae Furnariidae Familias Fuente: Gómez, et al. 2011 21 Thraupidae Se establecieron rangos de frecuencia relativa para la algunas especies, entre las cuales, seis fueron consideradas comunes: Ochthoeca fumicolor, Turdus fuscater, Asthenes flammulata, Orochelidon murina, Troglodytes solstitialis y Phrygilus unicolor. Respecto a los usos de hábitat, el 63% de las aves utilizaron el bosque achaparrado como percha, protección contra el viento y como sitio de alimentación; el 11% utilizó los frailejones como percha, este fue el caso de Asthenes flammulata, Schizoeca fuliginosa, Troglodytes solstitialis y Diglossa humerales. En cuanto a los hábitat acuáticos, cuatro especies los utilizaron para alimentarse: Oxyura jamaicensis, Anas andinum, Cinclus leucocephalus y Orochelidon murina (Figura 10). Otros ambientes empleados en menor medida, fueron los pajonales, utilizados principalmente como refugio por tres especies: Gallinago cf.stricklandii, Arremon torquatus y Phrygilus unicolor. Finalmente, los hábitat antrópicos fueron empleados por dos especies: P. carunculatus y O. murina (Gómez et al. 2011). Figura 10. Uso de hábitat de la avifauna en el páramo del PRN del Nima 6% 9% Bosque Achaparrado Frailejón 11% Hábitat Acuatico 11% 63% Pastizales Hábitat Antrópico Fuente: Gómez, et al. 2011 2.1.5 Resultados de la compilación de documentos relacionados con avifauna en el área de influencia del complejo de páramos Las Hermosas, en el Valle del Cauca Con base en la revisión de cinco estudios relacionados con avifauna en alta montaña del Valle del Cauca (entre 2.800 y 3.875 m de elevación) realizados en los municipios de Tuluá, Sevilla, El Cerrito, Ginebra, Buga, Palmira, Pradera y Florida (Tabla 7), se consolidó una lista de 132 especies, pertenecientes a 32 familias2. Las familias que presentaron el mayor número de especies fueron Thraupidae, con 21;Trochilidae, con 20; Tyrannidae, con nueve; Psittacidae, con ocho; Emberezidae, con siete y Furnariidae, con seis (Anexo C). 2Una especie, correspondiente a Saltator sinctus, sin familia determinada de acuerdo a la clasificación de South American Classification Commite (SACC), noviembre de 2014. http://www.museum.lsu.edu/~Remsen/SACCBaseline11.htm 22 Entre las especies de aves reportadas para los ecosistemas de alta montaña del Valle del Cauca se encuentran cuatro amenazadas de extinción: Leptosittaka branickii, Hapalopsittaca sp., Bolborhynchus sp., y Ognorhynchus icterotis, todas pertenecientes a la familia Psittacidae. Aunque para dos de estos Psittacidos no se precisó la especie en los documentos consultados, se cree que corresponden a H. fuertesi y B. ferrugineifros, ya que han sido registradas en ecosistemas similares en los departamentos del Quindío y Tolima. Entre el listado de aves consolidado a partir de la revisión de información, es importante que se confirme la presencia de 11 especies en el gradiente altitudinal considerado, ya que solo se conocen reportes por debajo de los 2.800 m de elevación (Hilty y Brown, 1986; McMullan, et al. 2010), estas especies son: Penelope perspicax, Claravis cf. mondetoura, Leptotila verreauxi, Chlorostilbon mellisugus, Aulacorhynchus haematopygus, Sirystes sibilator3, Cyphorhinus thoracicus, Chlorospingus canigularis, Chlorospingus ophthalmicus, Myioborus miniatus y Haplospiza rustica. P. perspicax es una especie endémica de Colombia y catalogada en peligro de extinción (EN), ha sido reportada principalmente entre 1.000 y 2.000 m de elevación, con un reporte a 650 m y otro a 2.690 m (Ríos, et al. “EN” Renjifo et al.2014). El reporte a mayor altura (2.690 m) corresponde a la cuenca del río Nima, ubicada en el municipio de Palmira, una de las localidades consideradas en la elaboración del presente listado. Tabla 7. Reportes de avifauna en el Valle del Cauca, en el complejo de páramos Las Hermosas Municipio Sector de páramo No. de especies de aves 46 No. de Familias 23 Fuente Tuluá Barragán-Santa Lucía y picos del Japón. El Cerrito, Ginebra y Buga Pan de Azúcar y las Domínguez. 40 17 Pradera Cuenca alta río Bolo. 29 17 Páramos del Valle del Cauca sin localidad específica. 110 30 DEVIA ÁLVAREZ, Wilson, et al. 2007. Palmira PRN* Nima, vereda La Nevera, predio La Camelia. 36 20 GÓMEZ BARREIRO, Francisco, et al. 2011. Pradera Laguna Teresa. 6 6 Quiceno, 1989 1990,”EN” base datos CVC. Florida Sin localidad específica 5 4 Acevedo, C.I. et al. 3Ave ARANA, Ana Elvia, et al. 1999. y de reportada por debajo de 600 m de elevación y no para la cordillera Central (Hilty y Brown, 1986, traducido por Álvarez-López, 2006; McMullan, et al. 2010). 23 No. de especies de aves No. de Familias Palmira 8 4 Pradera 11 7 Municipio Sector de páramo Fuente 1989, “EN” base de datos CVC. Tuluá Barragán. 1 1 Florida La Diana. 3 3 Velasco, E. et al. 1989. “EN” base de datos CVC. 1 1 Barrios, Luís Fernando. 2002. Pradera Cuenca Blanco. Alta Bolo El Cerrito Tenerife. 2 2 Tuluá Sin localidad específica 12 7 Palmira 4 4 Sevilla 2 2 Ginebra 3 3 Fuente: elaboración propia, 2014. 2.1.6 Resultados de la compilación de reportes de anfibios en el Valle del Cauca, en el complejo de páramos Las Hermosas A partir de la revisión de dos documentos y una base de datos relacionada con reportes de anfibios para ecosistemas de alta montaña de Valle del Cauca, se consolidó un listado de 12 especies, pertenecientes a cuatro familias (Tabla 8, Anexo D). Tabla 8. Reportes de anfibios en el Valle del Cauca, en el complejo de páramos Las Hermosas Municipio Tuluá Sector de páramo No. de anfibios No. de familias Barragán, Santa- Lucía y picos del Japón 2 1 Fuente ARANA, Ana Elvia, et al. 1999. El Cerrito, Ginebra, Buga Pan de Azúcar y las Domínguez 2 1 Pradera Cuenca alta río Bolo 2 1 10 4 Páramos del Valle del Cauca sin localidad específica 24 DEVIA ÁLVAREZ, Wilson, et al. 2007. Municipio No. de anfibios Sector de páramo Palmira No. de familias 4 El Cerrito Tenerife Fuente Kattan, G. 1984. “EN” base de datos CVC. 2 3 Lync, J. D. 1980; Restrepo, J. H. (JHR-558). 1985; Restrepo, J.H. (JHR521). 1985 y Kattan, G. 1984. "EN" base de datos CVC 1 Fuente: elaboración propia, 2014. 2.2 DEPARTAMENTO DEL TOLIMA 2.2.1 Estudio de estado actual (EEA) y plan de manejo (PM) de los páramos del departamento del Tolima El estudio hace referencia a la información registrada de flora y fauna en los ocho municipios con área de páramo en el departamento del Tolima. 2.2.1.1 Reportes de flora. Se han registrado un total 337 especies de plantas no vasculares (líquenes, musgos, hepáticas, helechos y afines) y 789 especies de plantas vasculares (espermatofitos)(Tabla 9). Tabla 9. Composición florística en páramos del departamento del Tolima Número de Familias 19 Número de Géneros 39 Número de Especies 56 Musgos 37 80 113 Hepáticas 26 49 107 Helechos y afines 16 20 61 Espermatofitos 89 280 789 187 468 1.126 Grupo Líquenes Total Fuente: Ocampo, et al. 2009 Las familias de plantas vasculares que presentan el mayor número de especies son: Asteraceae, Poaceae, Orchidaceae, Rosaceae y Melastomataceae (Tabla 10). De las especies de plantas reportadas, 21 son endémicas (Tabla 11). 25 Tabla 10. Familias botánicas con mayor número de especies en páramos del departamento del Tolima Familia Especie Género Familia Especie Género Apiaceae 23 10 Poaceae 51 21 Asteraceae 174 52 Rubiaceae 19 9 Bromeliaceae 17 6 Rosaceae 35 7 Ericaceae 27 10 Scrophulariaceae 25 8 Melastomataceae 34 7 Solanaceae 19 8 Orchidaceae 45 18 Fuente: Ocampo, et al. 2009 Tabla 11. Especies de flora endémicas reportadas en páramos del Tolima Familia Especie ARALIACEAE Oreopanax ruizianum Cuatrec ASTERACEAE Diplostephium eriophorum Wedd ASTERACEAE Diplostephium rupestre (Kunth) Wedd ASTERACEAE Diplostephium tolimense Cuatrec ASTERACEAE Diplostephium violaceum Cuatr ASTERACEAE Espeletia hartwegiana subsp. centro andina Cuatrec ASTERACEAE Senecio rubrilacunae Cuatrec BERBERIDACEAE Berberis Verticellata Turcz BRASSICACEAE Draba pennell-hazenii O.E Schulz BROMELIACEAE Greigianubigena L.B.Sm BROMELIACEAE Greigia exserta L.B. Sm BROMELIACEAE Puya cuatrecasasii L.B Sm BROMELIACEAE Puya santosii Cuatrec CAMPANULACEAE Siphocampylusbenthamianus Walp FABACEAE Lupinus ruizensis C.P. Sm FABACEAE Lupinus tolimensis C.P. Sm GENTIANACEAE Gentiana dasyantha (Gilg) Fabris LAMIACEAE Salvia tolimensis Kunth MELASTOMATACEAE Tibouchina andreana Cogn PASSIFLORACEAE Passiflora quindiensis Killip VALERIANACEAE Valeriana quindiensis Killip Fuente: Ocampo, et al. 2009. 26 En la tabla 12 se registran 69 especies de plantas amenazadas: 10 especies en la categorías de Peligro Crítico (CR); tres especies en Peligro (EN); nueve especies en categoría Vulnerable (VU); una especie en Datos Insuficientes (DD); 14 especies en Preocupación Menor (LC); 11 especies en Menor Riesgo (LR); 9 especies Casi Amenazadas (NT), y 12 especies Raras (R) (Ocampo, et al. 2009). Tabla 12. Especies de flora amenazadas de extinción en páramos del Tolima Familia ARECACEAE ARECACEAE ASTERACEAE ASTERACEAE ASTERACEAE ASTERACEAE ASTERACEAE BASELLACEAE BERBERIDACEAE BIGNONIACEAE BRUNELLIACEAE BRUNELLIACEAE ERICACEAE ERICACEAE ERICACEAE ERICACEAE ERICACEAE EUPHORBIACEAE FABACEAE HYPERICACEAE ORCHIDACEAE ORCHIDACEAE POACEAE POACEAE PODOCARPACEAE ROSACEAE ROSACEAE ROSACEAE SCROPHULARIACEAE SCROPHULARIACEAE SCROPHULARIACEAE CLADONIACEAE PARMELIACEAE LEJEUNEACEAE PLAGIOCHILACEAE PLAGIOCHILACEAE CRYPHAEACEAE DICRANACEAE NECKERACEAE ORTHOTRICHACEAE POLYTRICHACEAE ASPLENIACEAE Especie Ceroxylon parvifrons H. Wendl Geonoma jussieuana Mart Ageratina popayanensis (Hieron) R.M King & H. Rob Baccharis paramicola Cuatr Chuquiraga jussieui J.F. Gmel Culcitium rufescens Bonpl Libanothamnus occultus(S.F Blake) Cuatr Tournonia hookeriana Moq Berberis diazzii L. A Camargo Eccremocarpus longiflorus Ruíz & Pav.H. & B Brunellia boqueronensis Cuatr Brunellia goudotii Tul Cavendischia macrocephala A.C. Sm Gaultheria buxifolia Willd Gaultheria erecta Vent Gaultheria sclerophylla Cuatrec Gaultheria strigosa Benth Hyeronima cf. macrocarpa Muell. Arg Lupinus ruizensis C.P. Sm Hypericum relictum N. Robson Masdevallia assugens Luer &Escobar Masdevallia strumifera Rchb.f Bromus pitensis Kunth Calamagrostis pittieri Hack Podocarpus oleifolius D.Don Hesperomeles pachyphylla (Pittier) Killip Polylepis cf. cuadrijuga Bitter Prunus aff. Integrifolia (Presl.) Walp Calceolaria colombiana Pennell Calceolaria microbefaria Kraenzl Castilleja breviflora Benth Cladonia bacillaris Nyl Oropogon diffractaicus Essl Microlejeunea bullata (Taylor) Steph Plagiochila comiculata (Dumort) Plagiochila hookeriana Lindenb Cryphaea pilifera Mitt Dicranum peruvianum H. Rob Neckera urnigera cf. Mull. Hall Zygodon nivalis Hampe Notoligotrichum trichodon Hook.f. & Wilson Asplenium haenkeanum (Presl.) Hieron 27 Categoría de amenaza LR: Menor riesgo NT: Casi amenazado R: Raro LR: Menor riesgo LR: Menor riesgo CR: En peligro crítico CR: En peligro crítico DD: Datos Insuficientes VU: Vulnerable LR: Menor riesgo CR: En peligro crítico LR: Menor riesgo CR: En peligro crítico VU: Vulnerable LR: Menor riesgo CR: En peligro crítico LR: Menor riesgo R: Raro EN: En peligro CR: En peligro crítico VU: Vulnerable LR: Menor riesgo VU: Vulnerable LR: Menor riesgo LR: Menor riesgo R: Raro VU: Vulnerable LR: Menor riesgo R: Raro R: Raro VU: Vulnerable CR: En peligro crítico CR: En peligro crítico R: Raro R: Raro R: Raro VU: Vulnerable NT: Casi amenazado NT: Casi amenazado CR: En peligro crítico NT: Casi amenazado R: Raro Familia Especie Categoría de amenaza Isoetes colombiana (Palmer) Fuchs Elaphoglossum corderoanum (Sod.) Christ Elaphoglossum tectum (H & B. ex Willd.) T.Moore Selaginella popayanensis Hieron Salvia camarefolia Benth Salvia tolimensis Kunth Greigia columbiana L.B. Sm Greigia nubigena L.B.Sm Greigia vulcanica André Greigia exserta L.B. Sm Guzmania multiflora (André) André ex Mez Puya cuatrecasasii L.B. Sm BROMELIACEAE Puya hamata L.B. Sm BROMELIACEAE Puya santosii Cuatrec BROMELIACEAE Puya Trianae Baker BROMELIACEAE Racinaea penlandii (L. B. Sm.) M.A. Spencer & L.B. Sm BROMELIACEAE Racinaea ropalocarpa (Andre) M.A.Spencer & L.B. Sm BROMELIACEAE Racinaea tetrantha (Ruíz& Pav.) M.A Spencer &L.B.Sm BROMELIACEAE Racinaea subalata (Andre) M.A.Spencer & L.B. Sm BROMELIACEAE Tillandsia compacta Griseb BROMELIACEAE Tillandsia complanata Benth BROMELIACEAE Tillandsia stipitata L.B. Sm BROMELIACEAE Vriesea tequendamae (André) L.B. Sm BROMELIACEAE Passiflora aff. cumbalensis (Karst.) Harms PASSIFLORACEAE Passiflora gracillima Killip PASSIFLORACEAE Passiflora mixta Linn PASSIFLORACEAE Passiflora quindiensis PASSIFLORACEAE Fuente: Ocampo, et al. 2009. ISOETACEAE LOMARIOPSIDACEAE LOMARIOPSIDACEAE SELAGINELLACEAE LAMIACEAE LAMIACEAE BROMELIACEAE BROMELIACEAE BROMELIACEAE BROMELIACEAE BROMELIACEAE R: Raro VU: Vulnerable R: Raro R: Raro EN: En peligro VU: Vulnerable NT: Casi amenazado CR: En peligro crítico NT: Casi amenazado EN: En peligro LC: Preocupación menor NT: Casi amenazado LC: Preocupación menor NT: Casi amenazado LC: Preocupación menor LC: Preocupación menor LC: Preocupación menor LC: Preocupación menor LC: Preocupación menor LC: Preocupación menor LC: Preocupación menor NT: Casi amenazado LC: Preocupación menor LC: Preocupación menor LC: Preocupación menor LC: Preocupación menor LC: Preocupación menor En el estudio se determinaron tres tipos de hábitat: bosque, páramo y humedales. En el bosque se registraron 378 especies, en el páramo 547 y en humedales 90. Compartiendo el bosque y el páramo se registraron 182; el páramo y los humedales, 44 (Figura 11). Número de Especies Figura 11. Número de especies de plantas registradas en diferentes hábitats de páramo en el departamento del Tolima 547 600 500 400 378 300 182 200 90 100 44 0 Bosque Páramo Humedales Hábitat Fuente: Ocampo, et al. 2009 28 Bosque y Páramo Páramo y Humedal 2.2.1.2 Reportes de avifauna. En bosques altoandinos y páramos del departamento del Tolima, se ha registrado un total de 141 especies de aves, distribuidas en 34 familias (Ocampo et al. 2009). Las familias con mayor número de especies son: Trochilidae, Tyrannidae y Furnariidae (Tabla 13) (Anexo. E). Entre las especies de aves, tres son endémicas y ocho casi endémicas (Tabla 14), seis migratorias y doce amenazadas de extinción de acuerdo al Libro Rojo de Aves de Colombia. (Tabla 15). Tabla 13. Familias de aves con mayor número de especies en ecosistemas de alta montaña del departamento del Tolima No. Familia No. de especies 1 Trochilidae 16 2 Tyrannidae 13 3 Furnariidae 13 4 Thraupidae 11 5 Fringillidae 10 6 Accipitridae 6 7 Psittacidae 6 8 Caprimulgidae 5 Fuente: Ocampo, et al. 2009. Tabla 14. Aves endémicas y casi endémicas presentes en ecosistemas de alta montaña del departamento del Tolima Familia Psittacidae Psittacidae Nombre científico Endémicas Bolborhynchus ferrugineifrons X Hapalopsittaca fuertesi X Casi Endémicas Psittacidae Ognorhynchus icterotis Icteridae Hypopyrrhus pyrohypogaster Falconidae Phalcoboenus carunculatus X Trochilidae Eriocnemis mosquera X Trochilidae Eriocnemis derbyi X Trochilidae Oxypogon guerinii X Tyrannidae Anairetes agilis X Parulidae Myioborus ornatus X Thraupidae Urothraupis stolzmanni. X Fuente: Ocampo, et al. 2009. 29 X X Tabla 15. Especies de aves migratorias y amenazadas de extinción en los bosques altoandinos y páramos del departamento del Tolima Familia Nombre científico Migratorias Amenaza Anatidae Anas discors Anatidae Oxyura ferruginea EN Cathartidae Vultur gryphus EN Scolopacidae Tringa solitaria X Scolopacidae Gallinago delicata X X Caprimulgidae Chordeiles minor X Apodidae Chaetura pelágica X Turdidae Catharus fuscescens X Accipitridae Espizaetus isidori EN Psittacidae Bolborhynchus ferrugineifrons VU Psittacidae Hapalopsittaca fuertesi CR Psittacidae Leptosittaca branickii VU Psittacidae Ognorhynchus icterotis CR Trochilidae Eriocnemis derbyi NT Ramphastidae Andigena hypoglauca VU Ramphastidae Andigena nigrirostris NT Icteridae Hypopyrrhus pyrohypogaster EN Thraupidae Buthraupis wetmorei VU Fuente: Ocampo, et al. 2009. Respecto al uso de hábitat se determinaron cinco: bosque (Bo), páramo (Pa), potreros (Pot), humedales (Hu) y espacio aéreo (EsA). Los hábitat con mayor número de especies corresponden a bosque y páramo (Figura 12). Número de Especies Figura 12. Uso de hábitat de avifauna en ecosistemas de alta montaña del departamento del Tolima 80 70 60 50 40 30 20 10 0 72 41 7 7 5 2 Hábitat Fuente: Ocampo, et al. 2009. 30 2 3 1 1 Para definir la distribución altitudinal de las aves, se realizó un análisis entre el número de especies y las franjas altitudinales de alta montaña. Se registraron 128 especies para la franja del bosque altoandino (entre 2.800 y 3.200m de altitud); 140 especies en el subpáramo (3.200 a 3.600 m); 73 especies en el páramo (3.600 a 4.100 m), y 12 especies en el superpáramo,(>4.100 m) (Figura 13). Figura 13. Número de especies de aves registradas en diferentes ecosistemas de alta montaña del departamento del Tolima Superpáramo > 4.100 msnm 12 Páramo 3600 a 4100 msnm 73 Subpáramo 3200 a 3600 msnm 140 Bosque de Alta Montaña 128 0 20 40 60 80 100 120 140 160 Número de Especies Fuente: Ocampo, et al. 2009. 2.2.1.3 Anfibios reportados en ecosistemas de alta montaña del departamento del Tolima. Para el departamento del Tolima se ha registrado un total de 18 especies de anfibios pertenecientes a siete géneros y cuatro familias (Tabla 16). La familia con mayor número de especies es Brachycephalidae con 14, seguida por Bufonidae con 2, y las demás con una especie (Figura 14); el género que presenta el mayor número de especies es Pristimantis, con 12 (Ocampo et al. 2009). Entre las especies de anfibios reportados para el departamento del Tolima, 12 son endémicas de la cordillera Central y una amenazada de extinción bajo la categoría de vulnerable (VU). Once especies han sido reportadas en bosques altoandinos y páramos y siete únicamente en este último ecosistema (Ocampo et al. 2009) (Tabla 16). 31 Número de Especies Figura 14. Familias de anfibios con mayor número de especies registradas para los páramos del Tolima 16 14 12 10 8 6 4 2 0 14 2 1 Familias Fuente: Ocampo, et al. 2009. 32 1 Tabla 16. Anfibios registrados en bosques altoandino y páramos del departamento del Tolima Familia Nombre científico Bufonidae Osornophryne percrassa Ruiz-C.& Hernandez-C.1976 Bufonidae Endémicas Categoría de Amenaza E VU Orobioma BAM SUB PAR x x x Atelopus ebenoides Rivero, 1963 x x x Centrolenidae Centrolene buckleyi (Boulenger, 1882) x x Hylidae Hyloscirtus larinopygion Duellman, 1972 x x Brachycephalidae Hypodactylus latens Lynch, 1989 x x Pristimantis boulengeri Lynch, 1981 x x Pristimantis buckleyi (Boulenger, 1882) x x E Pristimantis obmutescens Lynch, 1980 E x x Pristimantis permixtus Lynch, Ruiz-C. & Ardila-R.,1994 E x x Pristimantis piceus Lynch, Ruiz-C. & Ardila-R., 1996 E x x 33 SUP Familia Nombre científico Endémicas Categoría de Amenaza Orobioma BAM SUB PAR Pristimantis racemus Lynch, 1980 E x x Pristimantis scopaeus Lynch, Ruiz-C.&Ardila-R., 1996 E x x Pristimantis simoteriscus Lynch, Ruiz-C.&Ardila-R., 1997 E x x Pristimantis simoterus Lynch, 1980 E x x Pristimantis supernatis Lynch, 1980 E x x Pristimantis uranobates Lynch, 1991 E x x x x Pristimantis w - nigrum (Boettger, 1892) Phrynopus adenobrachius Ardila-R., Ruiz-C.& BarreraR., 1996 E x Fuente: Ocampo, et al. 2009. 34 SUP x En el sub-páramo (entre 3.200 y 3.600 m de altitud) se registró el mayor número de anfibios y en el súper páramo (>4.100 m), el menor número (Figura 15). Figura 15. Especies de anfibios registrados en diferentes ecosistemas de alta montaña del departamento del Tolima Superpáramo > 4.100 msnm 1 Páramo 3600 a 4100 msnm 6 Subpáramo 3200 a 3600 msnm 18 Bosque de Alta Montaña 13 0 2 4 6 8 10 12 14 16 18 20 Número de Especies Fuente: Ocampo, et al. 2009. 2.2.1.4 Mamíferos reportados. Se ha registrado un total de 34 especies de mamíferos, pertenecientes a 29 géneros, 18 familias y 10 órdenes (Tabla 17).Las familias con mayor número de especies son: Sigmodontinae, Felidae y Cervidae (Figura 16). De acuerdo al Libro Rojo de los Mamíferos de Colombia, nueve especies presentan alguna categoría de amenaza de extinción, dos son endémicas del país: Cryptotis colombiana (distribución altitudinal de 1.800 a 3.600 m) y Akodon affinis (1.300 a 3.000 m) (Alberico, et al., 2000, citado por Ocampo, et al. 2009). Tabla 17. Listado de mamíferos registrados en los páramos del departamento del Tolima Orobioma Familia Nombre Científico BAM SUB PAR SUP Didelphidae Didelphis albiventris Lund, 1840 X X X Caenolestidae Caenolestes fuliginosus (Tomes, 1863) X X X Sorocidae Cryptotis colombiana Woodman & Timm, 1993 X X Dasypodidae Dasypus novemcinctus Linnaeus, 1758 X X Glossophaginae Anoura cultrata Handley, 1960 X X X Glossophaginae Anoura geoffroyi Gray, 1838 X x x Vespertilionidae Eptesicus brasiliensis (Desmarest, 1819) X x x 35 Orobioma Familia Nombre Científico BAM SUB PAR SUP Vespertilionidae Histiotus montanus (Philippi & Landbeck, 1861) X X X Canidae Cerdocyon thous (Linnaeus, 1766) X X X Ursidae Tremarctos ornatus (F.G. Cuvier, 1825) X X X Procyonidae Nasua nasua (Linnaeus, 1766) X X X Procyonidae Nasuella olivacea (Gray, 1865) X X X Mustelidae Eira barbara (Linnaeus, 1758) X X X Mustelidae Mustela frenata Lichtenstein, 1831 X X X Felidae Herpailurus yagouarondi (Lacepede, 1809) Felidae Leopardus pardalis (Linnaeus, 1758 X X X Felidae Leopardus tigrinus (Schreber, 1775) X X X Felidae Puma concolor (Linnaeus, 1771) X X X Tapiridae Tapirus pinchaque (Roulin, 1829) X X X Cervidae Mazama rufina (Bourcier & Pucheran, 1852) X X X Cervidae Odocoileus virginianus (Zimmermann, 1780) X X X Cervidae Pudu mephistophiles (de Winton, 1896) X X X Sigmodontinae Akodon affinis (J.A. Allen, 1912) X X Sigmodontinae Chilomys instans (Thomas, 1895) X X Sigmodontinae Microryzomys altissimus (Ossgood, 1933) X X X Sigmodontinae Microryzomys minutus (Thomas, 1860) X X X Sigmodontinae Reithrodontomys mexicanus (Saussure, 1860) X X Sigmodontinae Thomasomys laniger (Thomas, 1895) X X Sigmodontinae Thomasomys aureus (Tomes, 1860) X X Sigmodontinae Thomasomys cinereiventer J.A. Allen, 1912 X X Erethizontidae Coendou rufescens (Gray, 1865) X X Dinomyidae Dinomys branickii Peters, 1873 X X X Agoutidae Agouti taczanowskii (Stolzmann, 1865) X X X 36 X Orobioma Familia Nombre Científico BAM SUB PAR SUP Sylvilagus brasiliensis (Linnaeus, 1758) Leporidae X X X X Fuente: Ocampo, et al. 2009. Número de Especies Figura 16. Familias de mamíferos con mayor número de especies registradas en los ecosistemas de alta montaña del departamento del Tolima 9 8 7 6 5 4 3 2 1 0 8 4 3 2 2 2 2 Familias Fuente: Ocampo, et al. 2009. Tabla 18. Mamíferos amenazados de extinción presentes en los páramos del Tolima Especie Categoria de Amenaza Caenolestes fuliginosus Casi Amenazado (NT) Tremarctos ornatus Vulnerable (VU) Leopardus pardalis Casi Amenazado (NT) Leopardus tigrinus Vulnerable (VU) Puma concolor Casi Amenazado (NT) Tapirus pinchaque En Peligro (EN) Odocoileus virginianus En Peligro Crítico (CR) 37 Pudu mephistophiles Casi Amenazado (NT) Dinomys branickii Vulnerable (VU) Fuente: Ocampo, et al. 2000. 2.2.2 Plan de Ordenamiento de la cuenca hidrográfica del río Hereje. Estudio corregimiento de la Herrera, municipio de Río Blanco, páramo del Meridiano En este documento se registró un total de 45 especies de plantas, pertenecientes a 39 géneros y 24 familias (Tabla 19). Las familias con mayor número de especies fueron: Asteraceae, Ericaceae, Valerianaceae y Fabaceae (Figura 17). Las especies que presentaron la mayor abundancia relativa, fueron: Huperzia lingifolia, Miconia salicifolia, Peduncularis incurva y Gualtheria anastomosans, entre otras(Tabla 19). Tabla 19. Plantas registradas en el páramo del Meridiano Familias Especies No Individuos Alstroemeliaceae Apiaceae Asteraceae Asteraceae Asteraceae Asteraceae Asteraceae Asteraceae Asteraceae Asteraceae Asteraceae Berberidaceae Caprifoliacaeae Cyperaceae Ericaceae Ericaceae Ericaceae Escallonacea Fabaceae- Faboide Fabaceae- Faboide Fabaceae- Faboide Gentianaceae Gentianaceae Bomarea hirsuta Daucus montanus Dyplostephyum cayumbens Dyplostephyum bicolor Pentacalia vacinioides Hypochaeris sessiliflora Pentacalia vernicosa Bidens trplinervia Loricaria colombiana Gnaphalium antenarioides Chuquiraga jussieui Berberis hallii Drimaria sp. Carex pinchinchensi Gualtheria anostomosans Thibavia sp. Cavendishia sp. Escallonia resinosa Lupynus microphyllus Trifolium repens Lupinus sp. Hellenia adpressa Hellania sp 38 3 8 5 4 8 9 6 6 5 6 3 4 3 5 15 3 6 4 3 6 11 8 2 % AR 0,94936709 2,53164557 1,58227848 1,26582278 2,53164557 2,84810127 1,89873418 1,89873418 1,58227848 1,89873418 0,94936709 1,26582278 0,94936709 1,58227848 0,94936709 0,94936709 1,89873418 1,26582278 0,94936709 1,89873418 3,48101266 2,53164557 0,63291139 Familias Especies Hypericaceae Hydrocotillaceae Juncaceae Lamiaceae Loranyhaceae Lycopodiaceae Lycopodiaceae Melastomataceae Polygalaceae Rosaceae Rosaceae Rosaceae Rubiaceae Sccrophulariaceae Sccrophulariaceae Sccrophulariaceae Solanaceae Solanaceae Tiliaceae Valerinaceae Valerinaceae Valerinaceae No Individuos Hypericum laricifolium Hydrocotyle umbellata Juscussp Stachys lamioides Gaiadendron punetatum Huperzia lingifolia Huperzia sp2 Miconia salicifolia Monnina aestuans Acaeria elongata Rubus compactus Lachemila hispidula Arcytophyllum aristatum Bartsia orthocarpiflora Bertsia orthocarphyloides Peduncularis incurva Saracha quitensis Solanumsp Triunfetta sp Valerina bracteata Valerina longifolia Valeriana sp 9 8 6 6 2 25 6 23 3 6 4 7 6 12 4 16 6 2 7 14 8 3 % AR 2,84810127 2,53164557 1,89873418 1,89873418 0,63291139 7,91139241 1,89873418 7,27848101 0,94936709 1,89873418 1,26582278 2,21518987 1,89873418 3,79746835 1,26582278 5,06329114 1,89873418 0,63291139 2,21518987 4,43037975 2,53164557 0,94936709 Fuente: CORTOLIMA, 2010. Figura 17. Familias con mayor número de especies en el páramo del Meridiano Número de Especies 10 9 8 6 4 3 3 3 2 0 Asteraceae Ericaceae Fabaceae Familia Fuente: CORTOLIMA, 2010. 39 Valerinaceae Entre las especies de flora registradas en el páramo del Meridiano, tres están amenazadas de extinción (CORTOLIMA, 2010) (Tabla 20). Tabla 20. Especies amenazadas de extinción registradas en la cuenca del río Hereje Especies Familia Categoría Gualtheria anastomosans Ericaceae LR Chuquiraga jussieui Asteraceae LR Espeletia hartwegiana Asteraceae LC Fuente: CORTOLIMA, 2010. LC: Riesgo menor, LR: Preocupación menor 2.2.2.1 Anfibios reportados en el páramo del Meridiano. En este páramo, se reportaron cuatro especies de anfibios; se destaca un alto número de individuos de la familia Centrolenidae, seguido por la familia Strabomantidae; se registró un individuo de la familia Bufonidae (Tabla 21). Tabla 21. Especies de anfibios registrados en el páramo del Meridiano Orden Familia Especie No de Individuos STRABOMANTIDAE Pristimantis uranobates 2 LC 3200 STRABOMANTIDAE Pristimantis simoterus 8 LC 3550 CENTROLENIDAE Centrolene bukleyi 14 LC 3200 BUFONIDAE Atelopus marinkellei 1 CR 3200 Categoria de Amenaza Distribucion Altitudinal ANURA Fuente: CORTOLIMA, 2010. 40 3. BIBLIOGRAFÍA ARANA, Ana Elvia, et al. Diagnóstico socioeconómico y determinación de áreas de manejo especial con participación comunitaria en el área de páramo de la cordillera Central del Valle, jurisdicción Corporación Autónoma del Valle del Cauca (CVC). [s.l.]: Fundación Trópico y CVC, 1999. 305 p. ARISTIZABAL OSSA, Hugo, et al. Plan de manejo de la Reserva Forestal Sonso Guabas Ginebra, Valle del Cauca. [s.l.]: Asociación de Usuarios de la Cuenca Hidrográfica del Río Guabas (Asoguabas) y Corporación Autónoma Regional del Valle del Cauca, Convenio de Asociación No.062 de 2008, 2009. 252 p. BARRIOS, Luis Fernando. Base de datos informe final componente fauna, proyecto, Conservación de los ecosistemas de alta montaña en la cordillera Central, departamentos de Caldas, Quindío, Valle del Cauca y Tolima, un aporte a las ecorregiones estratégicas. Corporación Autónoma Regional del Quindío (CRQ). Armenia: CRQ, 2002.147 p. BARRIOS, Luis Fernando. Informe final componente fauna, proyecto, Conservación de los ecosistemas de alta montaña en la cordillera Central, departamentos de Caldas, Quindío, Valle del Cauca y Tolima, un aporte a las ecorregiones estratégicas. Corporación Autónoma Regional del Quindío (CRQ). Armenia: CRQ, 2002.147 p. CELIS, M. Informe final componente flora, proyecto, conservación de los ecosistemas de alta montaña en la cordillera Central, departamentos de Caldas, Quindío, Valle del Cauca y Tolima, un aporte a las ecorregiones estratégicas. Armenia: CRQ, 2002. CORPORACIÓN AUTÓNOMA REGIONAL DE TOLIMA (CORTOLIMA). Plan de ordenación y manejo de la cuenca hidrográfica del río Hereje. [s.l.]: CORTOLIMA, 2010. 105 p. CORPORACIÓN AUTÓNOMA REGIONAL DEL VALLE DEL CAUCA (CVC). Base de datos listados históricos de especies. Cali: CVC, 2014. 6 p. CORREA CÁRDENAS, Andrés Felipe, et al. Aunar esfuerzos técnicos y económicos para fortalecer el Sistema Departamental de Áreas Protegidas (SIDAP), a través de la formulación del plan de manejo del Parque Natural Regional de Nima y el establecimiento de reservas naturales de la sociedad civil, en la zona de influencia del Parque, municipio de Palmira. Municipio de Palmira y Corporación Autónoma Regional del Valle del Cauca (CVC), Convenio de Asociación No. 070 de 2008 y Convenio 057 de 2008, Comite ProNima, Palmira. Palmira: CVC, 2010. 256 p. DEVIA ÁLVAREZ, Wilson, et al. Informe final, Elaboración del estudio sobre el estado actual de páramos (EEAP) y del plan de manejo ambiental de los páramos (PMA) del área de jurisdicción de la Corporación Autónoma Regional del Valle del Cauca (CVC). Santiago de Cali: Instituto para la Investigación y Preservación del Patrimonio Cultural y Natural del Valle del Cauca (INCIVA) y Corporación Autónoma Regional del Valle del Cauca (CVC), 2007. 391 p. GÓMEZ BARREIRO, Francisco, et al. Informe final, inventario de especies de fauna y flora en el Parque Natural Regional del Nima, municipio de Palmira, Departamento del Valle del 41 Cauca. Palmira: Fundación Ambiente Colombia y Corporación Autónoma Regional del Valle del Cauca (CVC), Convenio de Asociación No. 092 de 2010, 2011. 211 p. GÓMEZ H., N., et al. Páramos del departamento del Valle del Cauca, Colombia. Santiago de Cali: Corporación Autónoma Regional del Valle del Cauca CVC, 1999. 60 p. GRUPO DE TRABAJO EN PÁRAMOS CENTRO OCCIDENTE (GTP CO) y CORPORACIÓN AUTÓNOMA REGIONAL DEL VALLE DEL CAUCA (CVC). Páramos de las cordilleras Central y Occidental de Colombia: Informe de Región del grupo de trabajo de páramos, Centro Occidente de Colombia. Santiago de Cali: GTP CO y CVC, 2005. 240 p. HILTY, S. L. y BROWN, W. L. Guía de las aves de Colombia. Traducido al español por H. Álvarez López. Santiago de Cali: American Bird Conservancy, 2001. 1030 p. KATTAN, G. Ranas del Valle del Cauca. Citado CORPORACIÓN AUTÓNOMA REGIONAL DEL VALLE DEL CAUCA (CVC). Base de datos listados históricos de especies. Cali: CVC, 2014. 6 p. McMULLAN, M.; DONEGAN, T. M. y QUEVEDO, A. Guía de aves de Colombia. [s.l.]: Fundación ProAves, 2010. MORALES M., et al. Atlas de páramos de Colombia. Bogotá, D. C.: Instituto de Investigación de Recursos Biológicos Alexander von Humboldt, 2007. 208 p. OSPINA ANTE, Omaira y VARGAS, Willian. Informe final, caracterización y diagnóstico del Ecosistema Andino y Subandino de La UMC Nima – Amaime. Santiago de Cali: Corporación Autonoma Regional de Valle del Cauca (CVC), Contrato No. 0209-99, 2000. 175 p OCAMPO OSORIO, Luis Augusto, et al. Estudio de estado actual y plan de manejo de los páramos del departamento del Tolima. Espinal, Tolima: Corporación Colombiana de Investigación Agropecuaria (CORPOICA) y Corporación Autónoma Regional del Tolima, 2009. 274 p. SARMIENTO, C., et al. Aportes a la conservación estratégica de los páramos de Colombia: Actualización de la cartografía de los complejos de páramo a escala 1:100.000. Bogotá, D.C., Colombia: Instituto de Investigación de Recursos Biológicos Alexander von Humboldt, 2013. 42 4. ANEXOS Anexos A. Flora registrada en el “Diagnóstico socioeconómico y determinación de áreas de manejo especial con participación comunitaria en el area de páramo de la cordillera Central del Valle, jurisdiccion CVC.” Flora Páramillo de Barragán Familia Especie Familia Especie ACANTHACEAE Habracanthus sp. POLYPODIACEAE Elaphoglossum aff. lingua ACTINIDIACEAE Saurauia ursina POLYPODIACEAE Cheilanthes lendigera APIACEAE Eryngium sp. POLYPODIACEAE Grammitis moniliformis APIACEAE Hydrocotyle sp1 POLYPODIACEAE Jamesonia bogotensis APIACEAE Hidrocotyle sp2 POLYPODIACEAE Jamesonia imbricata AQUIFOLIACEAE Ilex colombiana POLYPODIACEAE Ophioglossum crotalophoroides ARACEAE Anthuriun scandens POLYPODIACEAE Pleopeltis macrocarpa ARACEAE Anthurium microspadix RUBIACEAE Galium sp. ARACEAE Anthurium sp. RUBIACEAE Palicourea sp. ARALIACEAE Oreopanax ruizianum RUBIACEAE Arcytophyllum sp. ARALIACEAE Oreopanax discolor RUBIACEAE Relbunium hipocarpium ARALIACEAE Oreopanax aff. Floribundum RUBIACEAE Psychotria sp- ARECACEAE Ceroxylon parvifrons SOLANACEAE Saracha quitoensis ARECACEAE Ceroxylon quindiuense SOLANACEAE Sessa crassivenosa ASTERACEAE Aequatorium sinuatifolium SOLANACEAE Sessea sp. ASTERACEAE Aequatorium verrucosum SOLANACEAE Solanum sp. ASTERACEAE Ageratina popayanensis SOLANACEAE Solanum ovalifolium ASTERACEAE Ageratina tinifolia SOLANACEAE Solanum sp. ASTERACEAE Baccharis latifolia SOLANACEAE Solanum colombianum ASTERACEAE Baccharis sp. BUDDLEJACEAE Buddleja bullata ASTERACEAE Baccharis tricuneata CARIOPHYLLACEAE Arenaria sp. ASTERACEAE Chuquiraga jussieui CARIOPHYLLACEAE Cerastium sp. ASTERACEAE Dasyphyllum colombianum CHLORANTHACEAE Hedyosmum aff. goudotianum ASTERACEAE Diplostephium bicolor CHLORANTHACEAE Hedyosmum puracensis ASTERACEAE Diplostephium schultzii CLETHRACEAE Clethra revoluta ASTERACEAE Diplostephium sp CUNONIACEAE Weinmannia mariquitae ASTERACEAE Diplostephium sp1. CUNONIACEAE Weinmannia pubescens ASTERACEAE Espeletia hartwegiana CYATHEACEAE Cyathea sp. ASTERACEAE Gnaphalium sp CYPERACEAE Carex sp. ASTERACEAE Gnaphalium sp1. CYPERACEAE Luzula sp. ASTERACEAE Gnaphalium sp2. CYPERACEAE Rhynchospora caucana ASTERACEAE Gynoxys lindenii ELAEOCARPACEAE Vallea stipularis ASTERACEAE Gynoxys sp. EQUISETACEAE Equisetum bogotense 43 Flora Páramillo de Barragán Familia Especie Familia Especie ASTERACEAE Jungia ferruginea ERICACEAE Befaria resinosa ASTERACEAE Llerasia lindenii ERICACEAE Gaultheria erecta ASTERACEAE Mikania sp. ERICACEAE Disterigma empetrifolium ASTERACEAE Mutisia clematis ERICACEAE Pernettya prostrata ASTERACEAE Senecio formosus ERICACEAE Pernettya sp. ASTERACEAE Senecio pachypus ERICACEAE Sphyrospermum cordifolium ASTERACEAE Senecio sp. ERICACEAE Sphypermum sp. ASTERACEAE Verbesina nudipes FABACEAE Lupinus colombianus ASTERACEAE Werneria crassa FLACOURTIACEAE Abatia parviflora ASTERACEAE Oritrophium peruvianus GENTIANACEAE Gentiana sedifolia BEGONIACEAE Begonia ferruginea GERANIACEAE Geranium sp. BERBERIDACEAE Berberis valleanus GROSSULARIACEAE Escallonia myrtilloides BETULACEAE Alnus acuminata HYPERICACEAE Hypericum laricifolium BROMELIACEAE Guzmania sp. HYPERICACEAE Hypericum sp. BROMELIACEAE Guzmania sp. HYPERICACEAE Hypericum sp. BROMELIACEAE Pittcairnia sp. IRIDACEAE Orthosanthus chimboracensis BROMELIACEAE Tillandsia sp. IRIDACEAE Sisyrinchium sp. BROMELIACEAE Vriesea aff tequendamae IRIDACEAE Sisyrinchium sp. BROMELIACEAE Puya sp. ISOETACEAE Isoetes novogranadensis BROMELIACEAE Vriesea sp. LAMIACEAE Salvia scutellaroides MYRSINACEAE Geissanthus andinus LAMIACEAE Satureja brownei MYRSINACEAE Myrsine dependens LAMIACEAE Satureja nubigena MYRTACEAE Myrcia sp. LAMIACEAE Stachys sp. MYRTACEAE Myrcianthes orthostemon LAURACEAE Licaria sp. MYRTACEAE Myrcianthes rhopaloides LAURACEAE Persea mutisii MYRTACEAE Myrteola nummularia LAURACEAE Ocotea sp. OENOTERACEAE Fuchsia hirtella LAURACEAE Ocotea infrafoveolata OENOTERACEAE Fuchsia caucana LOBELIACEAE Centropogon latisepalus OENOTERACEAE Fuchsia sp. LOBELIACEAE Syphocampilus sp. PASSIFLORACEAE Passiflora bogotensis LORANTHACEAE Dendrphthora clavata PASSIFLORACEAE Passiflora cumbalensis LORANTHACEAE Gaiadendron punctatum PASSIFLORACEAE Passiflora mixta LORANTHACEAE Dendrophthora sp. PASSIFLORACEAE Passiflora trinervia LORANTHACEAE Triterix longebracteatus PODOCARPACEAE Podocarpus oleifolius LYCOPODIACEAE Lycopodium reflexum POLYGALACEAE Monnina angustata LYCOPODIACEAE Lycopodium clavatum. POLYGALACEAE Monnina sp. LYCOPODIACEAE Huperzia sp POLYGALACEAE Monnina sp. POLYGONACEAE Muehlenbeckia tamnifolia POLYPODIACEAE Blechnum loxense 44 Plantas más comunes en el Paramo de Bolo Blanco Familia Especie Familia Especie AMARILLIDACEAE Bomarea Linifolia LORANTHACEAE Gaiadendron punctatum AMARILLIDACEAE Bomarea sp. LORANTHACEAE Psyttacanthus sp. APIACEAE Azorella crenata LYCOPODIACEAE Lycopodium reflexum Licopodio APIACEAE Eryngium humboldtii LYCOPODIACEAE Lycopodium sp Licopodio APIACEAE Niphogetum Ternata LYCOPODIACEAE Lycopodium sp. ASTERACEAE Aequatorium verrucosusm LORANTHACEAE Dendrophthora Sp2 ASTERACEAE Ageratina tinifolia Chilco MELASTOMATACEAE Miconia curviteca ASTERACEAE Baccharis sp. MELASTOMATACEAE Miconia myrtillifolia ASTERACEAE Baccharis tricuneata MELASTOMATACEAE Miconia puracensis ASTERACEAE Chuquiraga jussieui MELASTOMATACEAE Tibouchina grossa ASTERACEAE Diplostephium bicolor MYRICACEAE ASTERACEAE Diplostepium floribundum MYRSINACEAE Myrica pubencens Geissanthus quindiensis Huesito ASTERACEAE MYRSINACEAE Myrsine dependens ASTERACEAE Diplostephium tolimense Espeletia hartwegiana var centroandina MYRTACEAE Myrciantes orthostemon ASTERACEAE Gnaphalium sp. MYRTACEAE Myrteola nummularia ASTERACEAE Mikania sp. MYRTACEAE Ugni myricoides ASTERACEAE Mutisia clematis OENOTHERACEAE Fuchsia caucana ASTERACEAE Olygactis volubilis OENOTHERACEAE Fuchsia sp. ASTERACEAE Pentacalia vaccinioides ORCHIDACEAE Dichaea sp Orquídea ASTERACEAE Senecio formosus ORCHIDACEAE Elleanthus sp Orquídea ASTERACEAE Senecio Pachypus ORCHIDACEAE Epidendron sp. ASTERACEAE Werneria pigmaea PASSIFLORACEAE Passiflora mixta BERBERIDACEAE Berberis velleanus POACEAE Calamagrostis effusa BLECHNACEAE Blechnum loxense POACEAE Calamagrostis intermedia BROMELIACEAE Guzmania sp. POACEAE Cortaderia nitida BROMELIACEAE Puya trianae POACEAE Neurolepis elata BROMELIACEAE Greigia vulcanica POLYGALACEAE Monnina revoluta BROMELIACEAE Tillandsia compacta POLYGALACEAE Monnina onnina arborescens BRUNELLIACEAE Brunellia goudoti POLYGONACEAE Muechlembeckia volcanica BUDDLEJACEAE Buddleja incana POLYPODIACEAE Jamesonia sp Helecho CARIOPHYLLACEAE Arenaria sp. POLYPODIACEAE Polypodium sp. CARIOPHYLLACEAE Cerastium s.p RANUNCULACEAE Ranunculus peruvianus CELASTRACEAE Maytenus myricoides ROSACEAE Acanea Aff. Elongata CLETHRACEAE Clethra ovalifolia ROSACEAE Hesperomeles pernettyioides CLETHRACEAE Clethra revoluta ROSACEAE Hesperomeles ferruginea CYPERACEAE Carex sp. ROSACEAE Hesperomeles glabrata CYPERACEAE Luzula sp. ROSACEAE Lachemilla orbiculata 45 Plantas más comunes en el Paramo de Bolo Blanco Familia Especie Familia Especie CYPERACEAE Rhynchospora sp ROSACEAE Lachemilla sp. ROSACEAE Rubus guianensis Mora DESFONTAINIACEAE Desfontainia spinosa ELAEOCARPACEAE Vallea stipularis ROSACEAE Rubus glabratus ERICACEAE Befaria resinosa RUBIACEAE Arcytophyllum capitatum ERICACEAE Cavendishia nitida RUBIACEAE Arcytophyllum muticum ERICACEAE Disterigma empetrifolium RUBIACEAE Palicourea sp. ERICACEAE Gaultheria cordifolia SAXIFRAGACEAE Ribes leptostachyus ERICACEAE Gaultheria aff. sclerophylla SCROPHULARIACEAE ERICACEAE Pernettya prostrata SCROPHULARIACEAE Bartsia lanifolia Calceolaria microbefaria var microbefaria ERICACEAE Pernettya sp SCROPHULARIACEAE Castilleja fissifolia ERICACEAE Sphyrospermum cordifolium SCROPHULARIACEAE Pedicularis incurva GENTIANACEAE Gentianella dasyntha SOLANACEAE Cestrum sp. GENTIANACEAE Halenia foliosa SOLANACEAE Jaltomata viridiflora GENTIANACEAE Halenia tolimae SOLANACEAE Salpichroa tristis GROSSULARIACEAE Escallonia myrtilloides tibar SOLANACEAE Saracha quitoensis GROSSULARIACEAE Escallonia aff. Myetilloides SOLANACEAE Sessea crassivenosa HYPERICACEAE Hypericum laricifolium SOLANACEAE Sessea sp. HYPERICACEAE SOLANACEAE Solanum hipoleurotrychum IRIDACEAE Hypericum lancioides Orthrosanthus chinborascensis SOLANACEAE Solanum psychotriaefolium IRIDACEAE Sisyrinchium trinerve SYMPLOCACEAE Simplocos cundinamarcensis IRIDACEAE Sisyrinchium sp. SYMPLOCACEAE Symplocos sp. ISOETACEAE Isoetes sp. VALERIANACEAE Valeriana bracteata LAMIACEAE Marsypianthes sp. VALERIANACEAE Valeriana microphylla LAMIACEAE Salvia sp. LENTIBULARIACEAE LOBELIACEAE Pinguicula antarctica Centropogon wolldenowianus LORANTHACEAE Dendrophthora sp1 46 Listado de las especies registradas en el páramo de Pan de Azúcar. Familia Especies Familia Especies AMARILLIDACEAE Bomarea linifolia LYCOPODIACEAE Lycopodium reflexum AMARILLIDACEAE Bomarea sp. LYCOPODIACEAE Lycopodium sp. APIACEAE Azorella crenata LYCOPODIACEAE Lycopodium sp. APIACEAE Eryngium sp. LORANTHACEAE Gaiadendron punctatum ASTERACEAE Aequatorium verrucosusm MELASTOMATACEAE Brachyotum lindenii ASTERACEAE Ageratina tinifolia MELASTOMATACEAE Miconia Aff. Latifolia ASTERACEAE Baccharis sp. MELASTOMATACEAE Miconia curviteca ASTERACEAE Chuquiraga jussieui MELASTOMATACEAE Miconia myrtillifolia ASTERACEAE Diplostephium bicolor MELASTOMATACEAE Miconia puracensis ASTERACEAE Diplostepium floribundum MELASTOMATACEAE Tibouchina grossa ASTERACEAE Diplostephium sp. MYRICACEAE Myrica pubescens ASTERACEAE Espeletia hartwegiana MYRSINACEAE ASTERACEAE Gnaphalium sp. MYRSINACEAE Myrsine dependens Geissanthus quindiensis Huesito ASTERACEAE Mikania sp. MYRTACEAE Myrciantes orthostemon ASTERACEAE Mutisia clematis MYRTACEAE Myrteola nummularia ASTERACEAE Olygactis volubilis MYRTACEAE Ugni myricoides ASTERACEAE Pentacalia vaccinioides OENOTHERACEAE Fuchsia caucana ASTERACEAE Senecio formosus OENOTHERACEAE Fuchsia sp. ASTERACEAE Werneria pigmaea ORCHIDACEAE Dichaea sp . BERBERIDACEAE Berberis valleanus ORCHIDACEAE Elleanthus sp . BLECHNACEAE Blechnum loxense ORCHIDACEAE Epidendron sp. BROMELIACEAE Guzmania sp. PASSIFLORACEAE Passiflora mixta BROMELIACEAE Puya aff. occidentalis POACEAE Calamagrostis effusa BRUNELLIACEAE Brunellia goudoti POACEAE Calamagrostis intermedia BUDDLEJACEAE Buddleja incana POACEAE Cortaderia nitida CARIOPHYLLACEAE Arenaria sp. POACEAE Neurolepis elata CARIOPHYLLACEAE Cerastium sp. POLYGALACEAE CELASTRACEAE Maytenus myricoides POLYGALACEAE Monnina revoluta Monnina onnina arborescens CLETHRACEAE Clethra ovalifolia POLYGONACEAE Muechlembeckia volcanica CLETHRACEAE Clethra revoluta POLYPODIACEAE Jamesonia sp CYPERACEAE Carex sp POLYPODIACEAE Polypodium sp CYPERACEAE Luzula sp RANUNCULACEAE Ranunculus peruvianus CYPERACEAE Rhynchospora sp ROSACEAE DESFONTAINIACEAE Desfontainia spinosa ELAEOCARPACEAE Valllea stipularis ROSACEAE Acanea Aff. Elongata Hesperomeles pernettyioides ERICACEAE Befaria resinosa ROSACEAE Hesperomeles ferruginea ERICACEAE Cavendishia nitida Uvito ROSACEAE Hesperomeles glabrata 47 Listado de las especies registradas en el páramo de Pan de Azúcar. Familia Especies Familia Especies ERICACEAE Disterigma empetrifolium ROSACEAE Lachemilla sp. ERICACEAE Gaultheria cordifolia Uvito ROSACEAE Rubus guianensis Mora ERICACEAE Gaultheria aff. Sclerophylla ROSACEAE Rubus glabratus ERICACEAE Pernettya prostrata RUBIACEAE Arcytophyllum capitatum ERICACEAE Pernettya sp. RUBIACEAE Arcytophyllum muticum ERICACEAE Sphyrospermum cordifolium RUBIACEAE Palicourea sp. GENTIANACEAE Gentianella dasyntha SAXIFRAGACEAE Ribes leptostachyus GENTIANACEAE Halenia foliosa SCROPHULARIACEAE GENTIANACEAE Halenia tolimae SCROPHULARIACEAE Bartsia lanifolia Calceolaria microbefaria var microbefaria GROSSULARIACEAE Escallonia myrtilloides tibar SCROPHULARIACEAE Castilleja fissifolia GROSSULARIACEAE Escallonia Aff. myrtilloides SCROPHULARIACEAE Pedicularis incurva HYPERICACEAE Hypericum laricifolium SOLANACEAE Cestrum sp. HYPERICACEAE SOLANACEAE Jaltomata viridiflora IRIDACEAE Hypericum lancioides Orthrosanthus chinborascensis SOLANACEAE Salpichroa tristis IRIDACEAE Sisyrinchium sp. SOLANACEAE Saracha quitoensis IRIDACEAE Sisyrinchium sp. SOLANACEAE Sessea crassivenosa ISOETACEAE Isoetes sp. SOLANACEAE Sessea sp. LAMIACEAE Marsypianthes sp Salvia SOLANACEAE Solanum hipoleurotrychum LAMIACEAE Salvia sp SOLANACEAE LENTIBULARIACEAE SYMPLOCACEAE LOBELIACEAE Pinguicula antarctica Centropogon willdenowianus Solanum psychotriaefolium Simplocos cundinamarcensis SYMPLOCACEAE Symplocos sp. LORANTHACEAE Dendrophthora sp1 VALERIANACEAE Valeriana bracteata LORANTHACEAE Dendrophthora sp2 48 Anexo B. Flora registrada en el Estudio sobre el estado actual de páramos (EEAP) y del plan de manejo ambiental de los páramos (PMA) del área de jurisdicción de la Corporación Autónoma Regional del Valle del Cauca-CVC. FAMILIA ACTINIDACEAE ACTINIDACEAE AMARANTHACEAE AMARANTHACEAE APIACEAE AQUIFOLIACEAE AQUIFOLIACEAE ARALIACEAE ARALIACEAE ARALIACEAE ARALIACEAE ARECACEAE ARECACEAE ARECACEAE ASTERACEAE ASTERACEAE ASTERACEAE ASTERACEAE ASTERACEAE ASTERACEAE ASTERACEAE ASTERACEAE ASTERACEAE ASTERACEAE ASTERACEAE ASTERACEAE ASTERACEAE ASTERACEAE ASTERACEAE ASTERACEAE Listado de Flora Pàramo de Peñas Blancas Sevilla FAMILIA ESPECIE Saurauia cuatrecasana MELASTOMATACEAE Saurauia ursina MELASTOMATACEAE Alternanthera aff. lanceolata MELASTOMATACEAE Iresine sp MELASTOMATACEAE Myrridendron pennellii MELASTOMATACEAE Ilex colombiana MELASTOMATACEAE Ilex sp MELASTOMATACEAE Oreopanax floribundum MELASTOMATACEAE Oreopanax discolor MELASTOMATACEAE Oreopanax tolimanum MELASTOMATACEAE Oreopanax glabrifolium MELASTOMATACEAE Geonoma undata MELASTOMATACEAE Ceroxylon quindiuense MELASTOMATACEAE Chamaedorea poeppigiana MELASTOMATACEAE Erato vulcanica MELASTOMATACEAE Aequatorium sinuatifolium MONIMIACEAE Aequatorium sp. MONIMIACEAE Mutisia grandiflora MORACEAE Ageratina sp. MYRICACEAE Barnadesia espinosa MYRSINACEAE Bacharis latifolia MYRSINACEAE Bacharis nitida MYRSINACEAE Bacharis tricuneata MYRSINACEAE Bacharis sp. MYRSINACEAE Diplostephium schultzii MYRTACEAE Diplostephium sp1 MYRTACEAE Diplostepium sp2 MYRTACEAE Espeletia hartweggiana MYRTACEAE Critoniopsis sp. MYRTACEAE Joseanthus trichotomus MIMOSACEAE ESPECIE Tibouchina mollis Axinaea macrophylla Meriania aff. tomentosa Miconia pustulata Miconia ochracea Miconia chlorocarpa Miconia minutiflora Miconia salicifolia Miconia aff. myrtillifolia Miconia Jahnii Miconia sp1 Miconia sp2 Miconia sp3 Brachyotum lindenii Leandra melanodesma Siparuna sp . Siparuna echinata Ficus sp. Myrica pubescens Geissanthus serrulatus Myrsine dependens Myrsine coriacea Myrsine ferruginea Myrsine guianensis Myrcianthes orthostemoa Myrcianthes rhopaloides Myrcia sp. Ugni myricoides Myrteola nummularia Inga sp. Flora representativa del páramo de Pan de Azúcar – Combia FAMILIA ESPECIE FAMILIA ESPECIE ALSTROEMERIACEAE Bomarea linifolia FABACEAE Lupinus falsorevolutus APIACEAE Eryngium humile GENTIANACEAE Gentianella dasyantha APIACEAE Niphogeton ternata GENTIANACEAE Halenia foliosa ARALIACEAE Oreopanax ellsworthii GROSSULARIACEAE Escallonia myrtilloides ASTERACEAE Aequatorium verrucosum HYPERICACEAE Hypericum lancioides ASTERACEAE Ageratina theaefolia HYPERICACEAE Hypericum laricifolium ASTERACEAE Baccharis barragensis IRIDACEAE Orthrosanthus acorifolius ASTERACEAE Baccharis latifolia IRIDACEAE Sisyrinchium jamesonii ASTERACEAE Baccharis lehmannii IRIDACEAE Sisyrinchium trinerve ASTERACEAE Baccharis rupicola IRIDACEAE Sisyrinchium unispathaceum ASTERACEAE Baccharis rupicola LAMIACEAE Minthostachys tomentosa 49 Flora representativa del páramo de Pan de Azúcar – Combia FAMILIA ESPECIE FAMILIA ESPECIE ASTERACEAE Baccharis tricuneata LAMIACEAE Salvia pauciserrata ASTERACEAE Calea glomerata LAMIACEAE Satureja nubigena ASTERACEAE Chuquiraga jussieui LAMIACEAE Stachys lamioides ASTERACEAE LILIACEAE Eccremis coarctata LORANTHACEAE Phrysilanthes corymbosa ASTERACEAE Conyza uliginosa Diplostephium cinerascens Diplostephium floribundum MELASTOMATACEAE Brachyotum lindenii ASTERACEAE Diplostephium pittieri MELASTOMATACEAE Miconia latifolia ASTERACEAE Diplostephium tolimense MELASTOMATACEAE Miconia myrtillifolia ASTERACEAE Espeletia hartwegiana MELASTOMATACEAE Miconia puracenis ASTERACEAE Espeletia hartwegiana MELASTOMATACEAE Tibouchina grossa ASTERACEAE Gynoxys baccharoides MYRSINACEAE Geissanthus quindiensis ASTERACEAE Gynoxys lindenii MYRSINACEAE Myrsine dependens ASTERACEAE Llerasia caucana ONAGRACEAE Fuchsia caucana ASTERACEAE Monticalia arbutifolia ORCHIDACEAE Elleanthus aurantiacus ASTERACEAE Monticalia vaccinioides ORCHIDACEAE Epidendrum frutex ASTERACEAE Mutisia clematis PASSIFLORACEAE Passiflora mixta ASTERACEAE Oligactis coriacea PASSIFLORACEAE Passiflora tenerifensis ASTERACEAE Pentacalia arborea PHYTOLACCACEAE Phytolacca sanguinea ASTERACEAE Pentacalia sylvicola POACEAE Festuca azucarica ASTERACEAE Pentacalia weinmannifolia POLYGALACEAE Monnina arborenscens ASTERACEAE Senecio formosus RANUNCULACEAE Ranunculus peruvianus ASTERACEAE Senecio vaccinioides ROSACEAE Hesperomeles ferruginea ASTERACEAE Verbesina nudipes ROSACEAE Hesperomeles glabrata BEGONIACEAE Begonia umbellata ROSACEAE Hesperomeles pernettyoides BERBERIDACEAE Berberis valleanus ROSACEAE Lachemilla orbiculata BROMELIACEAE Puya cuatrecasasii ROSACEAE Rubus macrocarpus BROMELIACEAE Puya hamata RUBIACEAE Arcytophyllum capitatum BRUNELLIACEAE Brunellia goudotii RUBIACEAE Arcytophyllum muticum BUDDLEJACEAE SAXIFRAGACEAE Ribes leptostachyum CAMPANULACEAE Buddleja incana Centropogon willdenowianus SCROPHULARIACEAE Bartsia pedicularioides CLETHRACEAE Clethra revoluta SCROPHULARIACEAE Calceolaria microbefaria CYPERACEAE Isolepis cernua SCROPHULARIACEAE Castilleja fissifolia ELAEOCARPACEAE Vallea stipularis SCROPHULARIACEAE Pedicularis incurva ERICACEAE Bejaria glauca SOLANACEAE Jaltomata viridiflora ERICACEAE Bejaria resinosa SOLANACEAE Salpichroa tristis ERICACEAE Cavendishia bracteata SOLANACEAE Saracha quitensis ERICACEAE Disterigma acuminatum SOLANACEAE Solanum hypoleurotrichum ASTERACEAE 50 Flora representativa del páramo de Pan de Azúcar – Combia FAMILIA ESPECIE FAMILIA ESPECIE ERICACEAE Disterigma empetrifolium SYMPLOCACEAE Simplocos cundinamarcensis ERICACEAE Gaultheria anastomosans VALERIANACEAE Valeriana microphylla ERICACEAE Gaultheria erecta VISCACEAE Dendrophthora clavata ERICACEAE Gaultheria strigosa ERICACEAE Pernettya prostrata ERICACEAE Plutarchia monantha ERICACEAE Psammisia graebneriana Listado de plantas reportadas en el páramo de la Nevera. FAMILIA ESPECIE ASTERACEAE Monticalia trichopus ASTERACEAE Monticalia vaccinioides BIGNONIACEAE Delostoma integrifolium BRUNELLIACEAE Brunellia goudotii ERICACEAE Bejaria glauca GESNERIACEAE Capanea affinis LAMIACEAE Lepechinia bullata POLYGONACEAE Muehlenbeckia tamnifolia RUBIACEAE Guettarda chiriquiensis RUBIACEAE Palicourea amenthystina RUBIACEAE Palicourea stipularis RUBIACEAE Psychotria hartwegiana THEACEAE Freziera canescens WINTERACEAE Drimys granadensis FAMILIA Páramo de Barragán - Santa Lucía - Flora representativa ESPECIE FAMILIA ESPECIE ACTINIDIACEAE Saurauia bullosa MELASTOMATACEAE Meriania nobilis ACTINIDIACEAE Saurauia ursina MELASTOMATACEAE Meriania splendens ALSTROEMERIACEAE Bomarea hirsuta MELASTOMATACEAE Miconia curvitheca ALSTROEMERIACEAE Bomarea patacocensis MELASTOMATACEAE Miconia jahnii ANACARDIACEAE Mauria simplicifolia MELASTOMATACEAE Miconia myrtillifolia APIACEAE Eryngium humboldtii MALVACEAE AQUIFOLIACEAE Ilex colombiana MELASTOMATACEAE Brachyotum lindenii AQUIFOLIACEAE Ilex pernervata MELASTOMATACEAE Leandra melanodesma AQUIFOLIACEAE Ilex uniflora MELASTOMATACEAE Miconia ochracea 51 FAMILIA Páramo de Barragán - Santa Lucía - Flora representativa ESPECIE FAMILIA ESPECIE ARACEAE Anthurium microspadix MELASTOMATACEAE Miconia orcheotoma ARACEAE Anthurium pulchrum MELASTOMATACEAE Miconia pustulata ARACEAE Anthurium scandens MELASTOMATACEAE Miconia salicifolia ARALIACEAE Oreopanax argentatus MELASTOMATACEAE Miconia theaezans ARALIACEAE Oreopanax chrysoleucus MELASTOMATACEAE Miconia versicolor ARALIACEAE Oreopanax discolor MELASTOMATACEAE Monochaetum glanduliferum ARALIACEAE Oreopanax floribundum MELASTOMATACEAE Tibouchina mollis ARALIACEAE Oreopanax ruizianum MELASTOMATACEAE Axinaea macrophylla ARECACEAE Ceroxylon parvifrons MELASTOMATACEAE Miconia tinifolia ARECACEAE Ceroxylon quindiuense MELIACEAE Cedrela montana ARECACEAE Geonoma densa MELIACEAE Ruagea hirsuta ASTERACEAE Aequatorium sinuatifolium MIMOSACEAE Acacia melanoxylon ASTERACEAE Aequatorium verrucosum MONIMIACEAE Siparuna echinata ASTERACEAE Ageratina glyptophlebia MONIMIACEAE Siparuna valenzuelae ASTERACEAE Ageratina popayanensis MORACEAE Ficus carica ASTERACEAE MYRICACEAE Myrica pubescens ASTERACEAE Ageratina tinifolia Asplundianthus pseudostuebelii MYRSINACEAE Geissanthus andinus ASTERACEAE Baccharis barragensis MYRSINACEAE Geissanthus barraganus ASTERACEAE Baccharis buddlejoides MYRSINACEAE Geissanthus goudotianus ASTERACEAE Baccharis latifolia MYRSINACEAE Geissanthus kalbreyeri ASTERACEAE Baccharis prunifolia MYRSINACEAE Geissanthus quindiensis ASTERACEAE Baccharis rupícola MYRSINACEAE Myrsine coriácea ASTERACEAE Baccharis tricuneata MYRSINACEAE Myrsine dependens ASTERACEAE Baccharis weinmannifolia MYRTACEAE Myrcianthes orthostemom ASTERACEAE Barnadesia spinosa MYRTACEAE Myrcianthes rhopaloides ASTERACEAE Chuquiraga jussieui Dasyphyllum colombianum MYRTACEAE Myrteola nummularia NYCTAGINACEAE Colignonia ovalifolia ONAGRACEAE Fuchsia canescens ONAGRACEAE Fuchsia caucana ASTERACEAE Diplostephium bicolor Diplostephium cinerascens Diplostephium rhododendroides ONAGRACEAE Fuchsia corollata ASTERACEAE Diplostephium schultzii ORCHIDACEAE Epidendrum gastropodium ASTERACEAE ORCHIDACEAE Odontoglossum pardinum ASTERACEAE Diplostephium tolimense Ericentrodea corazonensis OXALIDACEAE Oxalis subintegra ASTERACEAE Espeletia hartwegiana PAPAVERACEAE Bocconia frutescens ASTERACEAE Gynoxys buxifolia PAPAVERACEAE Bocconia pearcei ASTERACEAE Gynoxys florulenta PAPAVERACEAE Bocconia somnífera ASTERACEAE Gynoxys induta PASSIFLORACEAE Passiflora bogotensis ASTERACEAE ASTERACEAE ASTERACEAE 52 FAMILIA Páramo de Barragán - Santa Lucía - Flora representativa ESPECIE FAMILIA ESPECIE ASTERACEAE Gynoxys laurata PASSIFLORACEAE Passiflora cumbalensis ASTERACEAE Gynoxys lindenii PASSIFLORACEAE Passiflora mixta ASTERACEAE Jungia ferruginea PASSIFLORACEAE Passiflora mollissima ASTERACEAE Llerasia caucana PASSIFLORACEAE Passiflora tenerifensis ASTERACEAE Llerasia lindenii PASSIFLORACEAE Passiflora trinervia ASTERACEAE Mikania leiostachya PHYTOLACCACEAE Phytolacca bogotensis ASTERACEAE Monticalia andicola PHYTOLACCACEAE Phytolacca rugosa ASTERACEAE Monticalia arbutifolia PHYTOLACCACEAE Phytolacca sanguínea ASTERACEAE Monticalia vaccinioides PIPERACEAE Peperomia hartwegiana ASTERACEAE Munnozia jussieui PIPERACEAE Peperomia porriginifera ASTERACEAE Munnozia senecionidis PIPERACEAE Peperomia saligna ASTERACEAE Mutisia clematis PIPERACEAE Peperomia trinervula ASTERACEAE Oritrophium peruvianum PIPERACEAE Piper barbatum ASTERACEAE Pentacalia arborea PIPERACEAE Piper bogotense ASTERACEAE Pentacalia barkleyana PIPERACEAE Piper lacunosum ASTERACEAE Pentacalia breviligulata PLANTAGINACEAE Plantago australis ASTERACEAE Pentacalia kleinioides PLANTAGINACEAE Plantago linearis ASTERACEAE Pentacalia mutisii PLANTAGINACEAE Plantago rigida ASTERACEAE Pentacalia sylvicola POACEAE Calamagostis intermedia ASTERACEAE Pentacalia theifolia POACEAE Calamagrostis effusa ASTERACEAE Pentacalia vaccinioides POACEAE Chusquea scandens ASTERACEAE Pentacalia vallecaucana POACEAE Chusquea serrulata ASTERACEAE POACEAE Cortaderia nítida ASTERACEAE Pentacalia weinmannifolia Plagiocheilus solivaeformis POACEAE Deyeuxia effusa ASTERACEAE Schistocarpha sinforosi PODOCARPACEAE Podocarpus oleifolius ASTERACEAE Senecio formosus POLYGALACEAE Monnina angustata ASTERACEAE Senecio formosus POLYGALACEAE Monnina oleifolius ASTERACEAE Senecio hypsobates POLYGALACEAE Monnina pennellii ASTERACEAE Senecio pachypus POLYGALACEAE Monnina salicifolia ASTERACEAE Sonchus oleraceus POLYGONACEAE Muehlenbeckia tamnifolia ASTERACEAE Trixis proustioides POLYGONACEAE Rumex acetosella ASTERACEAE Verbesina nudipes PROTEACEAE Roupala obovata ASTERACEAE Vernonia trichotoma PROTEACEAE Roupala pachypoda ASTERACEAE Werneria crassa RANUNCULACEAE Clematis haenkeana BEGONIACEAE Begonia ferruginea RANUNCULACEAE Clematis serícea BEGONIACEAE Begonia umbellata RANUNCULACEAE Thalictrum podocarpum BERBERIDACEAE Berberis cuatrecasasii ROSACEAE Acaena elongata BERBERIDACEAE Berberis goudotii ROSACEAE Acaena ovalifolia 53 FAMILIA Páramo de Barragán - Santa Lucía - Flora representativa ESPECIE FAMILIA ESPECIE BERBERIDACEAE Berberis huertasii ROSACEAE Fragaria indica BERBERIDACEAE Berberis valleanus ROSACEAE Hesperomeles ferruginea BERBERIDACEAE Berberis verticillata ROSACEAE Hesperomeles glabrata BETULACEAE Alnus acuminata ROSACEAE Hesperomeles goudotiana BETULACEAE Alnus jorullensis ROSACEAE Hesperomeles lanuginosa BIGNONIACEAE Delostoma integrifolium ROSACEAE Hesperomeles pernettyoides BIGNONIACEAE Eccremocarpus longiflorus ROSACEAE Lachemilla andina BIGNONIACEAE Eccremocarpus longiflorus ROSACEAE Lachemilla aphanoides BROMELIACEAE Greigia vulcanica ROSACEAE Lachemilla hispidula BROMELIACEAE Puya hamata ROSACEAE Lachemilla mutisii BROMELIACEAE Puya trianae ROSACEAE Lachemilla nivalis BROMELIACEAE Racinaea tetrantha ROSACEAE Lachemilla orbiculata BROMELIACEAE Tillandsia cuatrecasasii ROSACEAE Lachemilla paludícola BROMELIACEAE Tillandsia turneri ROSACEAE Lachemilla vulcanica BROMELIACEAE Vriesea tequendamae ROSACEAE Prunus falcata BRUNELLIACEAE Brunellia goudotii ROSACEAE Prunus opaca BUDDLEJACEAE Buddleja bullata ROSACEAE Prunus pérsica CAMPANULACEAE Centropogon latisepalus ROSACEAE Rubus compactus CAMPANULACEAE ROSACEAE Rubus robustus ROSACEAE Rubus roseus CAMPANULACEAE Centropogon ozotrichus Centropogon willdenowianus Siphocampylus benthamianus RUBIACEAE Cinchona pubescens CAPRIFOLIACEAE Viburnum jamesonii RUBIACEAE Faramea flavifolia CAPRIFOLIACEAE Viburnum undulatum RUBIACEAE Galium fraseri CHLORANTHACEAE Hedyosmum luteynii RUBIACEAE Galium hypocarpium CLETHRACEAE Clethra fimbriata RUBIACEAE Galium obovatum CLETHRACEAE Clethra rugosa RUBIACEAE Galium piliferum CORIARIACEAE Coriaria thymifolia RUBIACEAE Nertera granadensis CUNONIACEAE Weinmannia haenkeana RUBIACEAE Palicourea amenthystina CUNONIACEAE Weinmannia mariquitae RUBIACEAE Psychotria hartwegiana CUNONIACEAE Weinmannia pubescens RUBIACEAE Relbunium hirsutum CUNONIACEAE Weinmannia tolimensis SABIACEAE Meliosma arenosa CYPERACEAE Oreobolus ecuadorensis SAPOTACEAE Chrysophyllum lanatum CYPERACEAE Rhynchospora caucana SCROPHULARIACEAE Alonsoa meridionalis ELAEOCARPACEAE Vallea stipularis SCROPHULARIACEAE Bartsia pedicularioides ERICACEAE Bejaria aestuans SCROPHULARIACEAE Calceolaria perfoliata ERICACEAE Bejaria resinosa SCROPHULARIACEAE Castilleja fissifolia ERICACEAE Disterigma empetrifolium SCROPHULARIACEAE Digitalis purpurea ERICACEAE Gaultheria anastomosans SOLANACEAE Cyphomandra betacea CAMPANULACEAE 54 FAMILIA Páramo de Barragán - Santa Lucía - Flora representativa ESPECIE FAMILIA ESPECIE ERICACEAE Gaultheria erecta SOLANACEAE Dunalia solanácea ERICACEAE Gaultheria foliolosa SOLANACEAE Dunalia solanácea ERICACEAE Gaultheria sclerophylla SOLANACEAE Iochroma gesnerioides ERICACEAE Gaultheria strigosa SOLANACEAE Jaltomata viridiflora ERICACEAE Macleania rupestris SOLANACEAE Physalis peruviana ERICACEAE Pernettya prostrata SOLANACEAE Salpichroa tristis ERICACEAE Plutarchia dichogama SOLANACEAE Saracha quitensis ERICACEAE Plutarchia monantha SOLANACEAE Sessea corymbiflora ERICACEAE Plutarchia rigida Sphyrospermum cordifolium SOLANACEAE Sessea corymbosa SOLANACEAE Sessea crassivenosa SOLANACEAE Solanum aureum ERICACEAE Thibaudia floribunda Vaccinium corymbodendron SOLANACEAE Solanum brachystachys FABACEAE Lupinus colombiensis SOLANACEAE Solanum brevifolium FABACEAE Otholobium mexicanum SOLANACEAE Solanum colombianum FABACEAE Trifolium dubium SOLANACEAE Solanum hispidum FLACOURTIACEAE Abatia parviflora SOLANACEAE Solanum hypoleurotrichum GENTIANACEAE Gentiana sedifolia SOLANACEAE Solanum moscopanum GENTIANACEAE Gentianella selaginifolia SOLANACEAE Solanum nigrescens GENTIANACEAE Halenia gentianoides SOLANACEAE Solanum ochranthum GESNERIACEAE Alloplectus peruvianus SOLANACEAE Solanum ovalifolium GROSSULARIACEAE Escallonia myrtilloides SOLANACEAE Solanum tuberosum GROSSULARIACEAE Ribes leptostachyum STAPHYLEACEAE Turpinia occidentalis HALORAGACEAE Gunnera magellanica STYRACACEAE Styrax lauraceus HALORAGACEAE Gunnera pilosa SYMPLOCACEAE Simplocos cundinamarcensis HYPERICACEAE Hypericum laricifolium SYMPLOCACEAE Simplocos serrulatus IRIDACEAE Orthrosanthus acorifolius Orthrosanthus chimboracensis THEACEAE Freziera canescens THEACEAE Gordonia fruticosa THEACEAE Laplacea pubescens IRIDACEAE Sisyrinchium convolutum Sisyrinchium unispathaceum URTICACEAE Pilea mutisiana LAMIACEAE Minthostachys tomentosa URTICACEAE Urtica ballotifolia LAMIACEAE Salvia amelophylla URTICACEAE Urtica longispica LAMIACEAE Salvia scutellaroides VALERIANACEAE Valeriana bracteata LAMIACEAE Satureja brownei VALERIANACEAE Valeriana microphylla LAMIACEAE Satureja grisea VERBENACEAE Citharexylum subflavescens LAMIACEAE Satureja nubigena VERBENACEAE Duranta lineata LAMIACEAE Stachys lamioides VERBENACEAE Duranta mandonii LAURACEAE Ocotea floribunda VERBENACEAE Duranta mutisii ERICACEAE ERICACEAE IRIDACEAE IRIDACEAE 55 FAMILIA Páramo de Barragán - Santa Lucía - Flora representativa ESPECIE FAMILIA ESPECIE LAURACEAE Ocotea infrafoveolata VERBENACEAE Lippia citriodora LAURACEAE Persea mutisii VIOLACEAE Viola scandens LENTIBULARIACEAE Pinguicula calyptrata VISCACEAE Dendrophthora clavata LORANTHACEAE Aetanthus nodosus VISCACEAE Phoradendron undulatum LORANTHACEAE Tristerix longebracteatus WINTERACEAE Drimys granadensis LORANTHACEAE Gaiadendron punctatum XYRIDACEAE Xyris subulata 56 Anexo C. Consolidado de aves reportadas en el complejo de Páramos Las Hermosas en el Valle del Cauca ANATIDAE Merganetta armata Podiceps occipitalis Nothocercus julius Chamaepetes goudotii Penelope montagnii Aburria aburri* Penelope perspicax* Coragyps atratus Geranoaetus melanoleucus Elanus leucurus Rupornis magnirostris Leucopternis princeps Buteo platypterus Falco sparverius Caracara cheriway Falco deiroleucus Phalcoboenus carunculatus Gallinago sp. Gallinago cf. stricklandii PODICIPEDIDAE TINAMIDAE CRACIDAE CRACIDAE CRACIDAE CRACIDAE CATHARTIDAE ACCIPITRIDAE ACCIPITRIDAE ACCIPITRIDAE ACCIPITRIDAE ACCIPITRIDAE FALCONIDAE FALCONIDAE FALCONIDAE FALCONIDAE SCOLOPACIDAE SCOLOPACIDAE X X X X X Ginebra (6) Pradera (5) Florida (5) Tuluá (5) Pradera (4) X Palmira (4) X Florida (4) X Sevilla (6) 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 X Palmira (6) Oxyura jamaicensis Tuluá (6) 2 ANATIDAE El Cerrito (5) Anas andinum Pradera (4) ANATIDAE Palmira (3) 1 Páramos Valle Cauca (2) Especie Pradera (1) Familia El Cerrito ,Ginebra y Buga (1) No. Tuluá (1) Municipios y reportes de aves en el Valle del Cauca, entre 2.800 y 3.875 m de altitud X X X x X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X 57 X X X X X X X X X X X X X X X X X Ginebra (6) Sevilla (6) Palmira (6) Tuluá (6) El Cerrito (5) Pradera (5) Florida (5) Tuluá (5) X Pradera (4) X Palmira (4) X Florida (4) X X X Pradera (4) Vanellus cf. resplandescens Patagioenas fasciata Claravis cf. mondetoura* Leptotila verreauxi* Leptosittaka branickii** Hapalopsittaca sp.*** Bolborhynchus sp.*** Pionus chalcopterus Aratinga wagleri Amazona mercenaria Pionus tumultuosus Ognorhynchus icterotis*** Tyto alba Ciccaba sp. Megascops choliba* Systellura longirostris Nyctidromus albicollis Streptoprocne zonaris Aglaectis cupripennis Coeligena lutetiae Chalcostigma herrani Eriocnemis derbyi Eriocnemis mosquera Haplophaedia aureliae Palmira (3) CHARADRIIDAE COLUMBIDAE COLUMBIDAE COLUMBIDAE PSITTACIDAE PSITTACIDAE PSITTACIDAE PSITTACIDAE PSITTACIDAE PSITTACIDAE PSITTACIDAE PSITTACIDAE TYTONIDAE STRIGIDAE STRIGIDAE CAPRIMULGIDAE CAPRIMULGIDAE APODIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE Páramos Valle Cauca (2) 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 Especie Pradera (1) Familia El Cerrito ,Ginebra y Buga (1) No. Tuluá (1) Municipios y reportes de aves en el Valle del Cauca, entre 2.800 y 3.875 m de altitud X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X 58 X X X X X X X X X X X X X X X X X 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROGONIDAE RAMPHASTIDAE RAMPHASTIDAE RAMPHASTIDAE RAMPHASTIDAE PICIDAE PICIDAE PICIDAE FURNARIIDAE FURNARIIDAE X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X 59 X X X X X X X X X X X X X X X Ginebra (6) Sevilla (6) Palmira (6) Tuluá (6) El Cerrito (5) Pradera (5) Florida (5) Tuluá (5) Pradera (4) Palmira (4) Florida (4) Pradera (4) X X Palmira (3) Metallura tyrianthina Metallura williami Colibri coruscans Lafresnaya lafresnayi Heliangelus exortis Adelomyia melanogenys Chlorostilbon mellisugus* Lesbia nuna Ocreatus underwoodii Phaethornis sp. Ramphomicron microrhynchum Colibri thalassinus Pterophanes cyanopterus Ensifera ensifera Pharomachrus auriceps Andigena hypoglauca Aulacorhynchus haematopygus* Andigena nigrirostris Aulacorhynchus prasinus Colaptes rivolii Veniliornis nigriceps Melanerpes formicivorus Asthenes flammulata Hellmayrea gularis Páramos Valle Cauca (2) Especie Pradera (1) Familia El Cerrito ,Ginebra y Buga (1) No. Tuluá (1) Municipios y reportes de aves en el Valle del Cauca, entre 2.800 y 3.875 m de altitud X X X X X X X X X X X X X X X X X X X X X Ginebra (6) Sevilla (6) El Cerrito (5) Pradera (5) Florida (5) Tuluá (5) Pradera (4) X X 60 X X X X X X X X X X X X Palmira (4) X X X X X X X X X X X X X X X X Florida (4) X Pradera (4) X Palmira (6) X X Tuluá (6) Margarornis squamiger Schizoeca fuliginosa Synallaxis azarae Lepidocolaptes lacrymiger Grallaria quitensis Grallaria rufula Grallaria ruficapilla Grallaria rufocinerea Ochtoeca fumicolor Mecocerculus leucophrys Sirystes sibilator* Elaenia frantzi Phyllomyias nigrocapillus Pyrrhomyias cinnamomea Sayornis nigricans Serpophaga cinerea Myiotheretes striaticollis Lipaugus fuscocinereus Ampelion rubrocristatus Orochelidon murina Pygochelidon cyanoleuca Troglodytes solsticialis Cyphorhinus thoracicus* Cinclus leucocephalus Palmira (3) FURNARIIDAE FURNARIIDAE FURNARIIDAE FURNARIIDAE GRALLARIIDAE GRALLARIIDAE GRALLARIIDAE GRALLARIIDAE TYRANNIDAE TYRANNIDAE TYRANNIDAE TYRANNIDAE TYRANNIDAE TYRANNIDAE TYRANNIDAE TYRANNIDAE TYRANNIDAE COTINGIDAE COTINGIDAE HIRUNDINIDAE HIRUNDINIDAE TROGLODYTIDAE TROGLODYTIDAE CINCLIDAE Páramos Valle Cauca (2) 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 Especie Pradera (1) Familia El Cerrito ,Ginebra y Buga (1) No. Tuluá (1) Municipios y reportes de aves en el Valle del Cauca, entre 2.800 y 3.875 m de altitud TURDIDAE TURDIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE EMBERIZIDAE Turdus fuscater Turdus serranus Anisognathus igniventris Anisognathus lacrymosus Hemispingus superciliaris Tangara vassori Urothraupis stolzmani Buthraupis montana Iridosornis rufivertex Diglossa humeralis Diglossa albilatera Diglossa lafresnayi Diglossa cyanea Chlorospingus canigularis* Chlorospingus ophthalmicus* Hemispingus verticalis Conirostrum sitticolor Sericossypha albocristata Tangara heinei Tangara labradorides Tangara nigroviridis Tangara xanthocephala Thraupis cyanocephala Arremon torquatus X X X X X X X X X X X X X X X X X X X X X X X 61 Ginebra (6) Sevilla (6) Palmira (6) Tuluá (6) El Cerrito (5) Pradera (5) Florida (5) Tuluá (5) X Pradera (4) X X X Palmira (4) X X X X X X X X X X X X X X X X Florida (4) X Pradera (4) X Palmira (3) X Páramos Valle Cauca (2) Especie Pradera (1) 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 Familia El Cerrito ,Ginebra y Buga (1) No. Tuluá (1) Municipios y reportes de aves en el Valle del Cauca, entre 2.800 y 3.875 m de altitud (1) (2) (3) (4) (5) (6) Zonotrichia capensis Phrygilus unicolor Catamenia inornata Atlapetes schistaceus Atlapetes rufinucha Atlapetes pallidinucha Myioborus ornatus Basileuterus coronatus Myioborus miniatus* Icterus chrysater Carduelis spinescens Euphonia saturata Euphonia sp. Haplospiza rustica* Saltator cinctus X Ginebra (6) Sevilla (6) X Palmira (6) X Tuluá (6) X El Cerrito (5) X X Pradera (5) X X X X X X X X X X X X X X Florida (5) X Tuluá (5) X X X X X Pradera (4) X Palmira (4) X Florida (4) X Pradera (4) X Palmira (3) EMBERIZIDAE EMBERIZIDAE EMBERIZIDAE EMBERIZIDAE EMBERIZIDAE EMBERIZIDAE PARULIDAE PARULIDAE PARULIDAE ICTERIDAE FRINGILLIDAE FRINGILLIDAE FRINGILLIDAE FRINGILLIDAE INCERTAE SEDIS Páramos Valle Cauca (2) 118 119 120 121 122 123 124 125 126 127 128 129 130 131 132 Especie Pradera (1) Familia El Cerrito ,Ginebra y Buga (1) No. Tuluá (1) Municipios y reportes de aves en el Valle del Cauca, entre 2.800 y 3.875 m de altitud X X X X X ARANA, Ana Elvia, et al. 1999. GRUPO DE TRABAJO EN PÁRAMOS CENTRO OCCIDENTE (GTP CO) y CORPORACIÓN AUTÓNOMA REGIONAL DEL VALLE DEL CAUCA (CVC). 2005. GÓMEZ BARREIRO, Francisco, et al. 2011. CORPORACIÓN AUTÓNOMA REGIONAL DEL VALLE DEL CAUCA (CVC). DEVIA ÁLVAREZ, Wilson, et al. 2007 y ARANA, Ana Elvia, et al. 1999. BARRIOS RODRÍGUEZ, Luis Fernando. 2002. * Especies por confirmar en el rango altitudinal considerado para el listado, ya que su distribución altitudinal está registrada por debajo de 2.800 m de altitud (Hilty y Brown, 1986, traducido por Álvarez-López, 2006; McMullan, et al. 2010). ** Especies amenazadas de extinción. *** Especies endémicas y amenazadas de extinción. 62 ANEXO D. Consolidado de anfibios reportados en el complejo de Páramos Las Hermosas en el Valle del Cauca 1 LEPTODACTYLIDAE Eleutherodactylus racemosus 2 LEPTODACTYLIDAE Eleutherodactylus peraticus Eleutherodactylus 3 LEPTODACTYLIDAE obmutescens 4 LEPTODACTYLIDAE Eleutherodactylus buckleyi 5 LEPTODACTYLIDAE Eleutherodactylus sp1. 6 LEPTODACTYLIDAE Eleutherodactylus w-nigrum 7 LEPTODACTYLIDAE Eleutherodactylus supernatis 8 LEPTODACTYLIDAE Eleutherodactylus cabrerai 9 PLETHODONTIDAE Bolitoglossa sp1. 10 CENTROLENIDAE Centrolene buckleyi Hyla colombiana 11 HYLIDAE Hyla larinopygium 12 HYLIDAE (1) (2) (3) (4) X X X X X X X X X X X X El Cerrito (Tenerife) (4) Palmira (3) Páramos Valle Cauca (2) Especie Pradera (1) Familia Tuluá (1) No. El Cerrito ,Ginebra y Buga (1) Municipios y localidades de páramo en el Valle del Cauca X X X X X X X X X X X ARANA, Ana Elvia, et al. 1999. GRUPO DE TRABAJO EN PÁRAMOS CENTRO OCCIDENTE (GTP CO) y CORPORACIÓN AUTÓNOMA REGIONAL DEL VALLE DEL CAUCA (CVC). 2005. GÓMEZ BARREIRO, Francisco, et al. 2011. CORPORACIÓN AUTÓNOMA REGIONAL DEL VALLE DEL CAUCA (CVC). 63 ANEXO E. Listado de Aves de los Páramos del Tolima Rango Altitudinal 2800 - 4100 msnm Familia Especies Anatidae Merganetta armata (Gould 1842) Anatidae Anas andium (Sibley & Monroe 1990) Anatidae *Anas discors (Linnaeus 1766) Anatidae Oxyura ferruginea (Eyton 1838) Anatidae Coragyps atratus (Bechstein 1793) Cathartidae Vultur gryphus (Linnaeus 1758) Cathartidae Geranoaetus melanoleucus (Vieillot 1819) Cathartidae Buteo platypterus (Vieillot 1823) Cathartidae Buteo brachyurus (Vieillot 1816) Cathartidae Buteo leucorrholus (Quoy & Gaimard 1824) Accipitridae Buteo polyosoma (Quoy & Gaimard 1824) Accipitridae Espizaetus Isidori (Des Murs 1845) Falconidae Phalcoboenus carunculatus (Des Murs 1853) Falconidae Falco sparverius (Linnaeus 1758) Falconidae Falco columbarius (Linnaeus 1758) Rallidae Fulica ardesiaca (Tschudi, 1843) Rallidae Fulica americana columbiana (Chapman 1914) Cracidae Penélope montagnii (Bonaparte 1856) Cracidae Chamaepetes goudotii (Lesson 1828) Charadriidae Vanellus resplendens (Tschudi 1843) Charadriidae Vanellus chilensis (Molina 1782) Scolopacidae *Tringa solitaria (Wilson, A 1813) Scolopacidae Gallinago nobilis (Sclater, PL 1856) Scolopacidae *Gallinago delicata (Linnaeus 1758) Columbidae Patagioenas fasciata (Say 1823) Psittacidae Bolborhynchus lineola (Cassin 1853) Psittacidae Bolborhynchus ferrugineifrons (Lawrence 1880) Psittacidae Hapalopsittaca fuertesi (Chapman 1912) Psittacidae Leptosittaca branickii (Belepsch & Stolzmann 1894) Psittacidae Ognorhynchus icterotis (Bonaparte 1857) Psittacidae Amazona mercenaria (Tschudi 1844) Strigidae Megascops albogularis (Cassin 1849) Strigidae Bubo virginianus (Gmelin 1788) Caprimulgidae Lurocalis semitorquatus (Gmelin 1789) Caprimulgidae Lurocalis rufiventris (Taczanowski 1884) Caprimulgidae *Chordeiles minor (Foster 1771) Caprimulgidae Caprimulgus longirostris (Bonaparte 1825) 64 Rango Altitudinal 2800 - 4100 msnm Familia Especies Caprimulgidae Uropsalis segmentata (Cassin 1849) Apodidae Streptoprocne zonaris (Shaw 1796) Apodidae *Chaetura pelagica (Linnaeus 1758) Trochilidae Amazilia saucerrottei (De Lattre & Bourcier 1846) Trochilidae Aglaeactis cupripennis (Bourcier 1843) Trochilidae Lafresnaya lafresnayi (Boissonneau 1840) Trochilidae Pterophanes cyanopterus (Fraser 1848) Trochilidae Coeligena torquata (Boissonneau 1840) Trochilidae Coeligena lutetiae (Delattre & Bourcier 1846) Trochilidae Heliangelus exortis (Fraser 1840) Trochilidae Eriocnemis mosquera (De Lattre & Bourcier 1846) Trochilidae Eriocnemis derbyi (De Lattre & Bourcier 1846) Trochilidae Ramphomicron microrhynchum (Boissonneau 1840) Trochilidae Metallura williami (De Lattre & Bourcier 1846) Trochilidae Metallura tyrianthina (Loddiges 1832) Trochilidae Chalcostigma herrani (De Lattre & Bourcier 1846) Trochilidae Oxypogon guerinii (Boissonneau 1840) Trochilidae Ensifera ensifera (Boissonneau 1840) Trochilidae Opisthoprora euryptera (Arcangeli 1932) Trogonidae Trogon personatus (Gould 1842) Ramphastidae Andigena hypoglauca (Gould 1833) Ramphastidae Andigena nigrirostris (Weterhouse 1839) Picidae Colaptes rivolii (Boissonneau 1840) Picidae Veniliornis nigriceps (Orbigny 1840) Furnariidae Cinclodes excelsior (Sclater, PL 1860) Furnariidae Cinclodes fuscus (Vieillot 1818) Furnariidae Leptasthenura andicola (Sclater, PL 1870) Furnariidae Synallaxis azarae (Chapman 1914) Furnariidae Synallaxis unirufa (Lafresnaye 1843) Furnariidae Hellmayrea gularis (Lafresnaye 1843) Furnariidae Schizoeaca fuliginosa (Lafresnaye 1843) Furnariidae Asthenes flammulata (Jardine 1850) Furnariidae Margarornis squamiger (Orbigny & Lafresnaye 1838) Furnariidae Premnornis guttuligera (Sclater 1864) Furnariidae Pseudocolaptes boissonneautii (Lafresnaye 1840) Furnariidae Thripadectes flammulatus (Eyton 1849) Furnariidae Dendrocolaptes picumnus (Linchtenstein 1820) Formicariidae Grallaria squamigera (Prevost & Des Murs 1846) Formicariidae Grallaria rufula (Lafresnaye 1843) 65 Rango Altitudinal 2800 - 4100 msnm Familia Especies Formicariidae Grallaria quitensis (Lesson 1844) Rhinocryptidae Scytalopus canus (Chapman 1915) Rhinocryptidae Scytalopus latebricola (Bangs 1899) Rhinocryptidae Scytalopus magellanicus (Gmelin 1789) Rhinocryptidae Myornis senilis (Lafresnaye 1840) Rhinocryptidae Acropternis orthonyx (Lafresnaye 1843) Cotingidae Ampelion rubrocristatus(Orbigny & Lafresnaye 1837) Tyrannidae Phyllomyias nigrocapillus (Lafresnaye 1845) Tyrannidae Phylloscartes poecilotis (Sclater 1862) Tyrannidae Poecilotriccus ruficeps (Kaup 1852) Tyrannidae Pseudotriccus ruficeps (Lafresnaye 1843) Tyrannidae Mecocerculus leucophrys(Orbigny& Lafresnaye1837) Tyrannidae Mecocerculus poecilocercus (Sclater & Salvin1873) Tyrannidae Mecocerculus stictopterus (Sclater 1858) Tyrannidae Anairetes agilis (Sclater 1856) Tyrannidae Ochthoeca fumicolor (Sclater, PL 1856) Tyrannidae Ochthoeca frontalis (Lafresnaye 1847) Tyrannidae Ochthoeca rufipectoralis(Orbigny & Lafresnaye1837) Tyrannidae Myiotheretes striaticollis (Sclater, PL 1853) Tyrannidae Muscisaxicola alpina (Jardine 1849) Hirundinidae Notiochelidon murina (Cassin 1853) Corvidae Cyanolyca armillata (Gray, GR 1845) Cinclidae Cinclus leucocephala (Tschudi 1844) Troglodytidae Cistothorus platensis (Latham 1790) Troglodytidae Troglodytes solstitialis (Sclater, PL 1859) Troglodytidae Thryothorus nigrocapillus (Sclater 1860) Troglodytidae Cyphorhinus thoracicus (Tshudi 1844) Troglodytidae Cinnycerthia unirufa (Lafresnaye 1840) Turdidae *Catharus fuscescens (Stephens 1817) Turdidae Turdus fuscater (Lafresnaye & Orbigny 1837) Turdidae Turdus serranus (Tschudi 1844) Turdidae Amblycercus holosericeus (Deppe 1830) Icteridae Hypopyrrhus pyrohypogaster (Tarrangon 1847) Parulidae Myioborus ornatus (Boissonneau 1840) Parulidae Basileuterus coronatus (Tshudi 1844) Parulidae Basileuterus luteoviridis (Bonaparte 1845) Parulidae Basileuterus nigrocristatus (Lafresnaye 1840) Coerebidae Conirostrum sitticolor (Lafresnaye 1840) Coerebidae Diglossa cyanea (Lafresnaye 1840) 66 Rango Altitudinal 2800 - 4100 msnm Familia Especies Coerebidae Diglossa humeralis (Fraser 1840) Coerebidae Diglossa lafresnayii (Boissonneau 1840) Coerebidae Diglossa albilatera (Lafresnaye 1843) Thraupidae Iridosornis rufivertex (Lafresnaye 1842) Thraupidae Anisognathus igniventris (Orbigny & Lafresnaye1837) Thraupidae Anisognathus lacrymosus(Du Bus de Gisignies1846) Thraupidae Buthraupis montana (Orbigny & Lafresnaye 1837) Thraupidae Buthraupis wetmorei (Moore 1934) Thraupidae Buthraupis eximia (Boissonneau 1840) Thraupidae Urothraupis stolzmanni(Tacz. & Berlepsch1885) Thraupidae Hemispingus atropileus (Lafresnaye 1842) Thraupidae Hemispingus verticalis (Lafresnaye 1840) Thraupidae Hemispingus superciliares (Lafresnaye 1840) Thraupidae Tangara vassori (Boissonneau 1840) Catamblyrhynchidae Catamblyrhinchus diadema (Lafresnaye 1842) Fringillidae Atlapetes pallidinucha (Boissonneau 1840) Fringillidae Atlapetes schistaceus (Boissonneau 1840) Fringillidae Catamenia analis (Lafresnaye y d’ Orbigny 1837) Fringillidae Catamenia homochroa (Sclater, PL 1858) Fringillidae Catamenia inornata (Lafresnaye 1847) Fringillidae Haplospiza rustica (Tschudi 1844) Fringillidae Phrygilus unicolor (Bonaparte 1853) Fringillidae Zonotrichia capensis (Muller, PLS 1776) Fringillidae Carduelis spinescens (Bonaparte 1850) Fringillidae Carduelis magellanica (Cabanis 1866) 67 Anexo 2. Especies de anfibios paramunas en Colombia (basado en Lynch y Suárez-Mayorga 2002; Bernal et al. 2005, Méndez-Vargas et al. 2005; Bernal y Lynch 2008, Rueda-Solano y Vargas-Salinas 2010a, b; Mueses-Cisneros y Perdomo-Castillo 2011; Guarnizo et al. 2012; Cardona-Botero et al. 2013). Se señalan con asterisco (*) y doble asterisco (**) aquellas especies potenciales o confirmadas para los páramos del departamento del Valle del Cauca, respectivamente. Taxonomía actualizada acorde a Frost (2014). Riesgo de amenaza catalogado acorde a Rueda-Almonacid et al. (2004). Las especies resaltadas en gris corresponden a aquellas observadas en los seis transectos (cuatro localidades) del presente estudio (ver tablas 18, 39, 60 y 83 para más detalles de registro). Familia/Especies Exclusivas de páramo No Principalmente exclusivas en Bosques de páramo andinos Riesgo de amenaza Bufonidae Atelopus carrikeri ● CR Atelopus ebenoides ● CR Atelopus guitarraensis ● Atelopus ignescens ● Atelopus lozanoi ● Atelopus leoperezi ● Atelopus muisca ● Osornophryne bufoniformis* CR CR ● Osornophryne percrassa* NT ● VU Centrolenidae Centrolene buckleyi** ● Craugastoridae Geobatrachus walkeri ● Pristimantis alalocophus** ● Pristimantis buckleyi** ● Pristimantis calcarulatus** ● Pristimantis cristinae ● Pristimantis curtipes ● Pristimantis duende** ● Pristimantis elassodiscus ● Pristimantis elegans Pristimantis lasallorum ● ● Pristimantis leoni ● Pristimantis leptolophus ● EN 1 Familia/Especies Exclusivas de páramo Pristimantis myersi No Principalmente exclusivas en Bosques de páramo andinos amenaza ● Pristimantis nervicus ● Pristimantis nicefori ● Pristimantis obmutescens** ● Pristimantis ocreatus ● Pristimantis peraticus** ● Pristimantis permixtus** ● Pristimantis piceus** ● Pristimantis racemus** ● Pristimantis repens ● EN Pristimantis ruthveni ● Pristimantis satagius ● Pristimantis scopaeus ● Pristimantis simoteriscus** ● Pristimantis simoterus* ● Pristimantis supernatis** Pristimantis thymelensis Riesgo de ● ● Pristimantis thectopternus** ● Pristimantis uranobates** ● Pristimantis vicarius ● Pristimantis xeniolum** ● Pristimantis xestus ● Niceforonia adenobrachia* ● Niceforonia brunneus ● Niceforonia nana ● Dendrobatidae Colostethus brachistriatus Hyloxalus edwardsi ● ● EN Hyloxalus lehmanni** ● Hyloxalus pinguis ● Hyloxalus subpunctatus ● Hemiphractidae Gastrotheca argenteovirens** Gastrotheca espeletia ● ● EN 1 Familia/Especies Gastrotheca helenae Exclusivas de páramo No Principalmente exclusivas en Bosques de páramo andinos ● Riesgo de amenaza 1 DD Gastrotheca orophylax ● EN Hylidae Dendropsophus labialis ● LC Hyloscirtus bogotensis ● Hyloscirtus larinopygion ● Hyloscirtus tigrinus ● Plethodontidae Bolitoglossa adspersa ● Bolitoglossa hypacra ● Bolitoglossa hiemalis** ● Bolitoglossa vallecula** 1. ● CR: peligro crítico, LC: baja alarma, NT: cerca de estar amenazada, EN: en peligro, DD: datos deficientes, VU: vulnerable. ANEXO 3. Lista de especies vegetales reportadas en el transecto de Sevilla, Valle del Cauca. Las Especies señaladas con * indican las que no se encontraron en las unidades de muestreo (parcelas), pero que hicieron parte de observaciones generales No. FAMILIAS ESPECIE Estaciones/ No. de individuos 1 2 3 4 5 No. Total de 6 individuos 1 Actinidiaceae Saurauia ursina 7 7 2 Adoxaceae Viburnum pichinchense 2 2 3 Apiaceae Myrrhidendron cf. pennellii 4 Araceae *Anthurium oxybelium 5 Araliaceae Oreopanax caricaefolium 6 Araliaceae Oreopanax discolor 7 Asteraceae Baccharis tricuneata 6 8 Asteraceae Diplostephium cf. schultzii 3 9 Asteraceae 2 15 11 Asteraceae Diplostephium sp. 2 Espeletia hartwegiana subsp. centroandina Pentacalia sp. 2 12 Asteraceae Pentacalia vaccinioides 7 6 13 13 Blechnaceae *Blechnum sp. 14 Blechnaceae Blechnum loxense 5 7 12 15 Boraginaceae Tournefortia cf. polystachia 16 Bromeliaceae *Racinaea tetrantha 17 Bromeliaceae *Tillandsia compacta 18 Bromeliaceae *Tillandsia stipitata 19 Bromeliaceae Puya trianae 20 Brunelliaceae Brunellia goudotii 21 Buddlejaceae Buddleja incana 22 Celastraceae Maytenus cf. myricoides 23 Chloranthaceae Hedyosmum cf. cumbalense 24 Chloranthaceae Hedyosmum cf. goudotianum 1 25 Chloranthaceae Hedyosmum cuatrecazanum 5 26 Chloranthaceae Hedyosmum cumbalense 27 Cladoniaceae Cladonia sp. 28 Clethraceae Clethra ovalifolia 29 Clethraceae Clethra revoluta 30 Cunoniaceae Weinmannia mariquitae 31 Cunoniaceae 32 Cyatheaceae 10 Asteraceae 1 1 1 1 1 1 3 5 1 1 4 6 5 8 1 3 13 28 3 3 5 9 9 1 1 1 1 1 10 1 2 2 3 1 3 1 1 11 12 5 4 5 8 18 14 4 7 1 3 5 13 9 Weinmannia pubescens 1 1 6 Cyathea sp. 4 10 1 25 2 3 25 2 10 15 Amenaza No. FAMILIAS ESPECIE 33 Cyperaceae Rynchospora cf. caucana 34 Dryopteridaceae *Elaphoglossum sp. 35 Elaeocarpaceae Vallea stipularis 36 Ericaceae Bejaria resinosa 37 Ericaceae Cavendishia bracteata 38 Ericaceae Disterigma empetrifolium 39 Ericaceae Gaultheria sclerophylla 40 Ericaceae Pernettya prostrata 41 Ericaceae Estaciones/ No. de individuos 1 2 3 4 5 6 5 individuos 5 2 1 2 9 5 9 1 8 No. Total de 1 8 16 3 3 18 32 Themistoclesia cf. mucronata 1 1 42 Ericaceae Vaccinium floribundum 2 2 43 Fabaceae Lupinus cf. microphyllus 6 2 8 44 Gentianaceae Gentiana sedifolia 3 45 Gentianaceae Macrocarpaea macrophylla 46 Hypericaceae Hypericum laricifolium 47 Iridaceae Ortosanthus chimboracensis 48 Iridaceae Sisyrinchium cf. trinerve 49 Lauraceae indet. sp.1 50 Lauraceae Ocotea infrafoveolata 51 Lauraceae Ocotea sp. 1 52 Lauraceae Ocotea sp. 2 53 Loasaceae *Nasa puracensis 54 Loranthaceae Gaiadendron punctatum 55 Lycopodiaceae Huperzia cf. callitrichaefolium 1 56 Lycopodiaceae Huperzia sp. 2 3 5 57 Lycopodiaceae Lycopodium jussiaei 15 11 26 58 Melastomataceae Axinaea macrophylla 59 Melastomataceae Brachyotum ledifolium 4 60 Melastomataceae Miconia chlorocarpa 3 61 Melastomataceae Miconia pletorica 62 Melastomataceae Miconia pustulata 63 Melastomataceae Miconia salicifolia 64 Melastomataceae Miconia sp. 1 65 Melastomataceae Miconia sp. 4 66 Melastomataceae Miconia sp. 6 67 Melastomataceae Miconia theaezans 68 Meliaceae Ruagea hirsuta 69 Myrtaceae Myrcianthes cf. orthostemon 70 Myrtaceae Myrteola nummularia 71 Orchidaceae *Epidendrum sp. 14 3 1 15 4 1 13 28 7 7 1 5 1 2 8 1 3 10 13 4 14 2 2 5 5 1 2 9 4 1 6 2 12 10 7 3 24 1 1 1 1 1 1 8 8 2 1 18 7 10 1 1 3 3 1 11 4 1 1 7 10 7 1 Amenaza No. FAMILIAS ESPECIE 72 Orchidaceae *Oncidium sp. 73 Orchidaceae *Stelis sp. Estaciones/ No. de individuos 1 2 3 74 Pentaphylacaceae Freziera sp. 1 4 5 6 4 No. Total de individuos 4 75 Piperaceae Piper sp. 5 76 Plagiogyriaceae *Plagiogyria semicordata 77 Poaceae *Chusquea cf. scandens 78 Poaceae *Neurolepis sp. 79 Poaceae Achiachne aff. pulvinata 3 1 4 80 Poaceae Calamagrostis sp. 15 13 28 81 Poaceae Chusquea scandens 82 Poaceae Chusquea tessellata 3 15 9 5 3 24 83 Podocarpaceae Podocarpus oleifolius 2 84 Polypodiaceae *Polypodium sp. 85 Primulaceae Geissanthus bogotensis 1 10 4 86 Primulaceae Geissanthus cf. andinus 15 6 2 87 Primulaceae Myrsine coriacea 88 Primulaceae Myrsine dependens 89 Pteridaceae Jamesonia alstonii 90 Rosaceae Prunus villegasiana 91 Rosaceae Rubus gachetensis 92 Rubiaceae *Notopleura sp. 93 Rubiaceae Palicourea cf. andaluciana 94 Rubiaceae Palicourea ovalis 95 Rubiaceae 2 1 16 23 1 5 1 6 6 9 14 1 4 1 4 14 1 1 23 38 16 26 87 Palicourea sp. 4 1 1 96 Santalaceae Cervantesia tomentosa 1 1 97 Selaginellaceae *Selaginella sp. 98 Siparunaceae *Siparuna echinata 99 Smilacaceae *Smilax sp. 100 Solanaceae Cestrum cf. sp. 1 1 101 Solanaceae Cestrum sp. 1 1 102 Solanaceae Cestrum sp. 1 103 Solanaceae Cestrum sp. 2 104 Sphagnaceae *Sphagnum sp. 105 Theaceae Gordonia sp. 106 Thymelaeaceae Daphnopsis cf. bogotensis 107 Urticaceae *Pilea sp. 108 Valerianaceae Valeriana microphylla 1 4 2 Amenaza 1 3 3 1 5 1 1 2 LC (UICN 2014), VU (M. Ambiente 2014) No. FAMILIAS ESPECIE 109 Verbenaceae Lippia hirsuta var. moritzii 110 Winteraceae Drimys granadensis Estaciones/ No. de individuos 1 2 3 1 1 4 5 6 No. Total de individuos 2 4 2 6 Totales 161 193 88 112 116 117 787 Categoría de amenaza: The IUCN Red List of Threatened Species. Versión 2015.1. <www.iucnredlist.org>. Consultada en 2015/06/06. Ministerio del Medio Ambiente y Desarrollo Sostenible. Resolución 0192 de 2014, “Por el cual se establece el listado de las especies silvestres amenazadas de la diversidad biológica colombiana que se encuentran en el territorio nacional, y se dictan otras disposiciones”. Amenaza Anexo 4. Listado de morfoespecies de edafofauna epigea, clasificadas a orden y con el grupo trófico al que pertenecen. Finca La Traviata, vereda Miraflores. Sevilla (Valle del Cauca). No Orden Morfoespecie Grupo trófico E1 E2 E3 E4 E5 E6 48 1 Coleoptera Dyscolus sp1 Depredador No. de individuos 1 5 36 2 Orthoptera Gryllus sp2 Omnívoro 6 2 14 27 34 3 Coleoptera Staphylinidae sp3 Depredador 17 4 8 7 4 Isopoda Philosciidae sp4 Omnívoro 3 5 6 5 11 5 Collembola Entomobryidae sp5 Omnívoro 7 7 2 6 Superfamilia Muscoidea sp6 Herbívoro 1 1 3 7 Diptera Foridae sp7 Saprófagos 1 8 Empididae Hilara sp8 Depredador 1 8 8 6 6 9 Diptera Foridae sp9 Parásito 2 3 1 10 Coleoptera Glyptolenus sp10 Depredador 11 1 1 11 Coleoptera Dyscolus sp11 Depredador 1 2 2 12 Araneae Araneomorphae sp12 Depredador 2 3 4 6 13 Diptera Empididae sp13 Depredador 2 1 17 14 Diptera Sciaridae sp14 Herbívoro 1 1 2 15 Diptera Muscoidea sp15 Omnívoro 1 2 1 1 16 Coleoptera Cantharidae sp16 Depredador 1 17 Diptera Lauxaniidae sp17 Saprófagos 1 1 18 Suborden Araneomorphae sp18 Depredador 1 2 2 1 6 19 Coleoptera Curculionidae sp19 Herbívoro 4 1 20 Opiliones Opilionida sp20 Depredador 2 2 3 1 21 Coleoptera Carabidae sp21 Herbívoro 3 4 22 Coleoptera Chrysomelidae sp22 Herbívoro 1 23 Coleoptera Curculionidae sp23 Herbívoro 1 24 Coleoptera Coleoptero sp24 - 1 25 Diptera Tipula sp25 Saprófagos 1 26 Collembola Hypogastruridae sp26 Omnívoro 1 27 Coleoptera Phengodidae sp27 Depredador 1 28 Diptera Psychodidae sp28 Parásitos 1 1 29 Hemiptera Membracidae sp29 Herbívoro 1 30 Blattodea Blattellidae sp30 Omnívoro 4 2 1 31 Diptera Mycetophilidae sp31 Depredador 1 1 32 Coleoptera Coleoptera sp32 - 1 6 33 Coleoptera Carabidae sp33 Depredador 1 4 34 Coleoptera Ptilodactyla sp34 Herbívoro 2 35 Opiliones Opilionida sp35 Depredador 1 5 3 36 Microcoryphia sp36 1 Carabidae sp37 Herbívoromicófago Depredador 37 Microcoryphi a Coleoptera 1 38 Coleoptera Melolonthidae sp38 Herbívoro 1 39 Dermaptera Anisolabididae sp39 Omnívoro 1 1 40 Coleoptera Scarabaeidae sp40 Saprófagos 1 41 Diptera Muscoidea sp41 Saprófagos 1 1 1 42 Coleoptera Curculionidae sp42 Herbívoro 1 1 43 Orthoptera Gryllus sp43 Omnívoro 4 1 44 Coleoptera Curculionidae sp44 Herbívoro 1 1 45 Diptera Nematocera sp45 Depredador 1 4 1 46 Hemiptera Membrecidae sp46 Herbívoro 1 2 47 Diptera Tachinidae sp47 Parásito 1 1 48 Coleoptera Carabidae sp48 Depredador 1 49 Diptera Foridae sp49 Posible parásito 1 50 Hymenoptera Microhymenoptero sp50 Depredador 1 51 Coleoptera Carabidae sp51 Depredador 1 52 Orthoptera Acrididae sp52 Herbívoro 19 53 Araneae Lycosidae sp53 Depredador 2 54 Araneae Araneomorphae sp54 Depredador 3 3 2 55 Araneae Araneomorphae sp55 Depredador 13 2 56 Diptera Dolichopodidae sp56 Depredador 6 57 Hemiptera Membrecidae sp57 Herbívoro 2 58 Hymenoptera Microhymenoptero sp58 Depredador 1 59 Diptera Muscoidea sp59 Omnívoro 1 Anexo 5. Listado de especies de anfibios colectadas en el transecto altitudinal de Sevilla, Valle del Cauca Especie Código de Colector Fecha Hora Estación/ Transecto LRC Peso (g) Pristimantis simoterus WBG - 31 25/09/2014 10:41 1/2 29,8 2 Pristimantis simoterus WBG - 32 25/09/2014 13:29 1/3 31,32 2,4 Osornophryne bufoniformis WBG - 33 25/09/2014 17:56 1/BL 34,08 4,1 Pristimantis simoterus WBG - 34 30/09/2014 20:37 2/1 30,31 2,5 Pristimantis peraticus WBG - 35 25/09/2014 14:50 4/6 16,51 0,37 Pristimantis peraticus WBG - 36 25/09/2014 16:56 4/1 17,12 0,48 Pristimantis peraticus WBG - 37 25/09/2014 20:35 4/BL 18,02 0,43 Pristimantis peraticus WBG - 38 25/09/2014 20:45 4/BL 17,47 0,47 Pristimantis peraticus WBG - 39 25/09/2014 20:52 4/BL 18,61 0,38 Pristimantis peraticus WBG - 40 25/09/2014 21:46 4/BL 26,17 1,45 Pristimantis peraticus WBG - 41 25/09/2014 22:03 4/BL 19,76 0,4 Pristimantis buckleyi WBG - 42 25/09/2014 7:50 6/BL 22,07 0,82 Pristimantis buckleyi WBG - 43 26/09/2014 2:40 6/BL 38,67 5,02 Pristimantis peraticus WBG - 44 26/09/2014 2:41 6/BL 16,49 0,41 Pristimantis buckleyi WBG - 45 26/09/2014 2:55 6/BL 40,65 5,72 Osornophryne bufoniformis WBG - 46 27/09/2014 21:27 5/4 19,06 0,62 Pristimantis peraticus WBG - 47 26/09/2014 22:25 4/2 17,31 0,43 Pristimantis peraticus WBG - 48 28/09/2014 15:55 5/BL 18,84 0,49 Pristimantis buckleyi WBG - 49 28/09/2014 17:30 5/BL 33,12 2,61 Pristimantis aff. supernatis WBG - 50 30/09/2014 22:48 5/BL 21,11 1 BL: Búsqueda libre (la búsqueda libre se hizo al azar en cada estación) Anexo 6. Lista de especies de Aves registradas en el transecto altitudinal de Sevilla, Valle del Cauca. No. Familia Especies Estación (m.s.n.m)/ No. De individuos Total Endemismo 1 2 3 4 5 3.520 3.420 3.320 3.220 3.120 0 0 0 0 0 2 Casi-Endé 0 0 3 4 0 7 1 2 ANATIDAE CRACIDAE Anas andium* Penelope montagnii 3 4 5 6 7 8 9 10 11 ACCIPITRIDAE SCOLOPACIDAE COLUMBIDAE COLUMBIDAE STRIGIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE Geranoaetus albicaudatus* Gallinago nobilis Zentrygon linearis Patagioenas fasciata Glaucidium jardinii Aglaeactis cupripennis Chalcostigma herrani Coeligena lutetiae Coeligena torquata 0 0 0 2 0 0 5 0 0 0 2 0 0 0 0 1 0 0 0 0 0 0 0 0 0 1 4 0 0 0 0 1 0 0 0 3 0 0 1 0 0 2 0 1 0 1 2 1 2 1 2 6 2 7 12 TROCHILIDAE Colibri coruscans Eriocnemis derbyi 0 0 0 0 1 1 13 14 15 16 17 18 19 TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE 0 2 0 0 2 1 0 2 2 2 0 2 1 0 2 11 3 0 6 1 1 3 0 1 4 2 12 2 3 0 3 0 5 0 4 10 15 9 4 17 15 7 20 21 22 23 24 25 26 27 28 TROCHILIDAE TROCHILIDAE RAMPHASTIDAE RAMPHASTIDAE PICIDAE FALCONIDAE PSITTACIDAE PSITTACIDAE PSITTACIDAE 1 0 0 0 0 0 2 0 0 0 0 0 0 0 0 0 0 0 0 0 3 0 0 0 0 0 0 0 0 1 0 0 0 0 3 0 0 0 1 0 0 0 0 1 17 1 1 5 2 1 1 2 4 17 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 GRALLARIIDAE GRALLARIIDAE GRALLARIIDAE GRALLARIIDAE GRALLARIIDAE RHINOCRYPTIDAE RHINOCRYPTIDAE RHINOCRYPTIDAE FURNARIIDAE FURNARIIDAE FURNARIIDAE TYRANNIDAE TYRANNIDAE TYRANNIDAE TYRANNIDAE TYRANNIDAE TYRANNIDAE TYRANNIDAE COTINGIDAE COTINGIDAE 0 3 0 1 0 0 2 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 6 0 0 0 0 0 4 0 0 0 0 0 4 0 0 0 0 0 0 0 3 0 3 0 0 0 1 0 9 0 0 0 3 2 0 1 0 1 0 1 0 1 0 0 1 1 0 1 12 0 0 1 0 0 1 3 3 1 0 0 0 0 0 0 1 0 4 1 21 1 1 0 0 0 0 0 0 2 3 1 10 1 3 2 2 1 9 2 42 1 1 1 7 2 1 4 3 Eriocnemis mosquera Heliangelus exortis Lafresnaya lafresnayi Metallura tyrianthina Metallura williami Ocreatus underwoodii Ramphomicron microrhynchum Ensifera ensifera* Andigena hypoglauca Andigena nigrirostris* Campephilus pollens* Falco sparverius* Bolborhynchus ferrugineifrons Hapalopsittaca fuertesi Ognorhynchus icterotis Grallaria nuchalis Grallaria quitensis Grallaria ruficapilla Grallaria rufula Grallaria squamigera Acropternis orthonyx Myornis senilis Scytalopus spillmanni Hellmayrea gularis Margarornis squamiger Synallaxis azarae Mecocerculus leucophrys Mecocerculus poecilocercus Ochthoeca cinnamomeiventris Ochthoeca frontalis Ochthoeca fumicolor Pseudotriccus ruficeps Pyrrhomyias cinnamomeus Pipreola arcuata Pipreola riefferii Amenaza Gremio trófico I FR RD I FR FR RD NI NI NI NI Casi-Endé Casi-Endé NI Casi-Endé Casi-Endé Casi-Endé NI NI NI NI NI NI NI Casi-Endé VU NT Endémico Endémico Casi-Endé CR EN NI NI FR FR I RD FR FR FR I I I I I I I I I I I I I I I I I I FR No. Familia 49 50 51 TROGLODYTIDAE TROGLODYTIDAE TURDIDAE 52 53 54 55 56 57 58 59 THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE 60 61 62 63 64 65 66 67 68 69 70 THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE EMBERIZIDAE EMBERIZIDAE EMBERIZIDAE CARDINALIDAE PARULIDAE ICTERIDAE FRINGILLIDAE Especies Cistothorus platensis Troglodytes solstitialis Turdus fuscater Anisognathus igniventris Anisognathus lacrymosus Anisognathus somptuosus Buthraupis montana Diglossa cyanea Diglossa humeralis aterrima Thraupis cyanocephala* Diglossa lafresnayii Tangara vassorii Urothraupis stolzmanni Iridosornis rufivertex Hemispingus superciliaris Atlapetes schistaceus Phrygilus unicolor Zonotrichia capensis Piranga rubriceps* Myioborus ornatus Icterus chrysater Sporagra spinescens Total Estación (m.s.n.m)/ No. De individuos Total 1 2 3 4 5 3.520 3.420 3.320 3.220 3.120 23 4 0 0 0 27 0 0 0 2 0 2 6 3 1 4 21 35 0 0 0 0 0 8 0 3 0 5 0 0 0 4 0 2 2 5 0 0 0 0 0 0 8 0 2 0 0 0 0 1 16 3 0 15 1 0 0 0 26 13 2 15 1 12 1 6 0 0 2 0 0 18 0 0 0 0 7 88 4 4 2 0 0 0 0 0 5 0 1 60 0 0 0 0 0 0 0 0 7 0 0 72 1 0 0 0 0 0 1 0 11 0 0 92 5 0 2 4 1 0 5 0 7 1 0 150 10 4 6 4 1 18 6 2 30 1 8 473 Clasificación taxonómica basada en Remsen www.museum.lsu.edu/~Remsen/SACCBaseline.html et al. Endemismo Amenaza I I FR-I FR-I FR-I FR-I FR-I FR-I-N FR-I-N FR-I FR-I-N FR-I FR-I FR-I I FR-I SE SE FR-I I I SE Casi-Endé Casi-Endé 2015 (agosto) - Categorias de amenaza basadas en Renjifo et al. 2014. En peligro crítico: CR; En peligro: EN; Vulnerable: VU; Casi amenazada: NT. Nivel de endemismo: Chaparro et al. 2013. Casi endémico: Casi-Endé. Gremio trófico: Rapáz diurna:RD; Frugívoro: FR; Frutos e insectos: FR-I; Frutos, insectos y néctar: FR-I-N; Néctar e insectos: NI; Insectos: I; Semillas: SE. Las especies señaladas con asterisco (*) indican las observadas por fuera de las unidades de muestreo (redes de niebla o puntos de conteo). Gremio trófico ANEXO 7. Lista de especies vegetales reportadas en el transecto altitudinal de Tuluá. * Especies que no entraron en las unidades de muestreo, pero que hicieron parte de observaciones generales en el área de estudio FAMILIAS Estaciones/ No. de individuos ESPECIE 1 No. 2 3 4 1 1 1 Actinidiaceae 2 Araliaceae Saurauia ursina Triana & Planch. 3 Araliaceae 4 Araliaceae Oreopanax discolor (Kunth) Decne. & Planch. 5 Asteraceae 6 Asteraceae Ageratina tinifolia (Kunth) R.M. King & H. Rob 1 Baccharis rupícola Kunth 4 1 7 Asteraceae 8 Asteraceae Diplostephium cf. pittieri Cuatrec. 6 25 Espeletia hartwegiana 16 5 No. Total de individuos 2 *Oreopanax cf. floribundum Decne. & Planch. 1 Oreopanax tolimanum Cuatrec. 4 1 2 4 1 1 32 16 9 Asteraceae 10 Asteraceae Gynoxys cf. littlei Cuatrec. 1 11 Asteraceae 12 Asteraceae Pentacalia sp.3 1 1 Pentacalia vaccinioides (Kunth) Cuatrec. 7 7 13 Asteraceae 14 Berberidaceae Senecio formosus Kunth 4 15 Boraginaceae 16 Bromeliaceae Tournefortia fuliginosa Kunth 17 Bromeliaceae 18 Bromeliaceae Puya hamata L.B.Sm. 19 Bromeliaceae 20 Brunelliaceae *Tillandsia stipitata L.B. Sm. Pentacalia cf. trichopus (Benth) Cuetrec. 15 4 4 Berberis verticillata Turcz. 20 4 4 3 4 3 10 1 1 *Greigia vulcanica André 6 6 *Tillandsia compacta Griseb. Brunellia goudotii Tul. 1 1 13 2 16 Amenaza FAMILIAS 1 No. 21 Celastraceae 22 Chloranthaceae 23 Chloranthaceae 24 Cladoniaceae 5 No. Total de individuos 1 6 15 148 Estaciones/ No. de individuos ESPECIE Maytenus myricoides Triana & Planch. Hedyosmum cf. goudotianum Solms-Laubach var. goudotianum *Hedyosmum cumbalense H. Karst. Cladonia sp. 2 3 4 5 3 2 128 1 1 25 Clethraceae 26 Columelliaceae Clethra revoluta (R. et P.) Sprengel 2 1 7 3 13 27 Cunoniaceae 28 Cunoniaceae Weinmannia mariquitae Szyszyl 7 9 7 4 27 29 Cyperaceae 30 Cyperaceae *Carex sp. 31 Dryopteridaceae 32 Elaeocarpaceae *Elaphoglossum sp. 33 Ericaceae 34 Ericaceae Cavendishia cf. nítida (Kunth) A.C.Sm. Disterigma empetrifolium (Kunth) Drude 2 2 35 Ericaceae 36 Ericaceae Gaultheria sclerophylla Cuatrec. 5 5 37 Ericaceae 38 Ericaceae Pernettya prostrata (Cav.) DC. Plutarchia monantha A.C.Sm. 1 1 39 Escalloniaceae 40 Fabaceae Escallonia myrtilloides L.f. 3 3 41 Grossulariaceae 42 Gunneraceae *Ribes leptostachyum Benth. 43 Hypericaceae 44 Iridaceae Hypericum laricifolium Juss. 15 Sisyrinchium cf. trinerve Baker 8 45 Lamiaceae Aegiphila bogotensis (Spreng.) Mold. *Desfontainia spinosa Ruiz & Pav. *Weinmannia pubescens Kunth Rhynchospora cf. caucana B.et K. 9 9 Vallea stipularis L.f. 1 3 Gaultheria sp. 7 13 Lupinus cf. microphyllus Desr. 2 3 3 7 13 2 2 *Gunnera sp. 1 8 2 2 16 2 Amenaza FAMILIAS Estaciones/ No. de individuos ESPECIE 1 No. 2 3 46 Lamiaceae 47 Lauraceae Lippia hirsuta var. moritzii (Turcz.) López-Palacios 48 Lycopodiaceae 49 Lycopodiaceae *Huperzia sp. 50 Melastomataceae 51 Melastomataceae Axinaea macrophylla Triana 1 Brachyotum ledifolium (Desr.) Triana 6 52 Melastomataceae 53 Melastomataceae Brachyotum lindenii Cong. 54 Melastomataceae 55 Melastomataceae Miconia plethorica Naudin 56 Melastomataceae 57 Melastomataceae *Miconia salicifolia Naudin Ocotea infrafoveolata van der Weff 4 Lycopodium jussiaei Desv. 4 5 2 2 1 5 11 11 3 5 2 Miconia polyneura Tr. 4 6 5 Miconia chlorocarpa Cong. No. Total de individuos 1 3 1 1 2 8 29 1 40 Miconia sp.1 55 22 1 4 82 58 Melastomataceae 59 Monimiaceae Tibouchina grossa (L.f.) Cong. 4 1 Siparuna echinata (Kunth) A. DC. 1 1 60 Myrtaceae 61 Orchidaceae Myrcianthes cf. orthostemon (O. Berg.) Grifo 4 4 62 Orchidaceae 63 Orchidaceae *Pleurothallis sp. 64 Orquidiaceae 65 Orquidiaceae Cyrtochilum cf. annulare (Rchb. f.) Kraenzl. 2 2 Gomphichis cf. caucana Schltr. 1 1 5 *Epidendrum sp. *Stelis sp. *Oxalis cf. subintegra R. Knuth 66 Oxalidaceae Pentaphylacaceae Freziera longypes Tul. 67 1 5 6 68 Piperaceae 69 Poaceae Piper sp. 2 Achiachne aff. pulvinata Benth. 4 4 70 Poaceae 71 Poaceae Calamagrostis sp. 15 15 Chusquea sp. 1 3 2 1 Amenaza FAMILIAS Estaciones/ No. de individuos ESPECIE 1 No. 72 Poaceae 73 Poaceae *Chusquea tessellata Munro 74 Poaceae 75 Polygalaceae *Neurolepis sp. 76 Primulaceae 77 Primulaceae Geissanthus andinus Mez. Cortaderia sp. 2 3 4 5 7 Monnina angustata Triana & Planch. No. Total de individuos 7 2 1 Geissanthus bogotensis Mez. 9 13 17 78 Primulaceae 79 Pteridaceae Myrsine dependens (Ruiz & Pav.) Spreng. 4 7 Jamesonia alstonii A.F. Tryon 9 9 80 Rosaceae 81 Rosaceae Acaena elongata L. 2 2 82 Rosaceae 83 Rosaceae Hesperomeles ferruginea (Pers.) Benth. 2 Hesperomeles cf. sp. 20 2 1 2 4 23 11 2 4 Amenaza 2 4 10 Hesperomeles glabrata Kunth 1 1 84 Rosaceae 85 Rosaceae Hesperomeles obtusifolia (Pers.) Lindl. 5 5 86 Rubiaceae 87 Rubiaceae *Nertera granadensis (Mutis ex L. f.) Druce 88 Rubiaceae 89 Rubiaceae 90 Sabiaceae 91 Selaginellaceae Meliosma sp. 92 Solanaceae 93 Solanaceae Cestrum sp.1 94 Symplocaceae 95 Theaceae Symplocos cf. sp. 96 Valerianaceae 97 Winteraceae Valeriana microphylla Kunth *Rubus gachetensis A. Berger Palicourea cf. andaluciana Standl. 23 7 65 Palicourea cf. ovalis Standl. 4 4 Palicourea sp. 23 23 7 11 1 28 1 7 2 *Selaginella sp. 8 Saracha quitensis (Hook) Miers 2 Gordonia humboldtii H. Keng. 3 11 2 2 7 9 4 4 15 Drimys granadensis L.f. 15 3 4 3 En FAMILIAS 1 2 3 4 5 No. Total de individuos 175 146 211 224 85 836 Estaciones/ No. de individuos ESPECIE No. Totales Categoría de amenaza: Rangel-Ch et al. 2000. 5 Amenaza Anexo 8. Listado de morfoespecies de edafofauna epigea, clasificadas a orden y con el grupo trófico al que pertenecen. Finca La Cascada, Vereda Miraflores, Tuluá (Valle del cauca). *No: corresponde a el código interno de colección No Orden Morfoespecie Estaciones altitudinales/ No. de Individuos Grupo trófico 1 2 3 4 5 1* 2* 3* 4* 5* 1 Coleoptera Bradycellus sp.1 Granívoro-depredador 1 10 5 1 1 0 0 0 0 0 1b Coleoptera Dyscolus sp. 1b Granívoro-depredador 0 0 0 0 0 0 6 8 8 2 2 Orthoptera Gryllus sp.2 Omnívoro 0 0 0 22 19 0 0 1 16 17 3 Coleoptera Staphylinidae sp.3 Depredador 0 10 2 1 4 3 15 15 4 8 4 Malacostraca Isopoda sp.4 Detritívoro 3 3 7 8 9 2 2 18 4 4 5 Diptera Tachinidae sp.5 Parasitoide/depredador 0 0 0 0 0 0 0 0 0 6b Diptera Muscoidea sp.6 0 0 0 0 0 0 0 1 0 0 8 Diptera Phoridae sp.8 Saprófago 1 1 0 2 4 12 5 2 0 1 9 Diptera Phoridae sp.9 Saprófago 0 0 8 0 2 0 1 5 0 0 10 Coleoptera Bembidion sp. 10 Depredador 0 0 4 0 0 0 0 0 0 0 11 Coleoptera Bradycellus sp.11 Granívoro-depredador 0 0 0 1 0 0 0 0 0 0 10b Coleoptera Goniocellus sp.10b Depredador 0 0 0 0 0 0 5 17 23 3 11b Coleoptera Oxytrechus sp.11b Depredador 0 0 0 0 0 0 3 0 0 0 12 Araneae Araneae sp.12 Depredador 0 0 2 0 0 0 1 1 0 0 13 Diptera Empididae sp.13 Herbívoro 0 0 1 2 0 0 0 1 3 8 14 Diptera Sciaridae sp.14 Herbívoro 0 0 6 3 1 0 0 0 0 0 15 Diptera Muscidae sp.15 Omnívoro 3 0 0 0 0 0 0 0 0 0 14b Diptera Diadocidiidae sp.14 Fungívoro 0 0 0 0 0 0 5 9 2 8 15b Diptera Drosophilidae sp.15 Herbívoro 0 0 0 0 0 1 1 0 0 0 17 Diptera Muscidae sp.16 0 1 0 0 0 2 0 0 0 1 18 Araneae Araneae sp.18 Depredador 0 0 3 3 2 5 0 0 1 1 19 Coleoptera Curculionidae sp.19 Herbívoro 0 0 2 0 0 0 1 0 1 0 20 Opilionida Opilionida sp.20 3 5 2 3 0 1 0 0 0 0 21 Coleoptera Dercylus sp. 21 Depredador 0 12 7 5 1 1 2 2 4 0 22 Coleoptera Bembidion sp. 22 Depredador 0 14 5 1 0 0 8 12 3 0 23 Coleoptera Curculionidae sp.23 Herbívoro 0 0 0 0 0 0 0 0 1 0 28 Diptera Psychodidae sp.28 Parásito-hematófago 0 0 0 0 0 1 0 0 0 0 30 Blattodea Blattidae sp.30 Omnívoro 0 0 0 1 1 0 0 0 0 1 32 Coleoptera Chrysomelidae sp.32 Herbívoro 0 1 0 0 0 0 0 0 0 0 32a Coleoptera Languriidae sp.32a Herbívoro 0 0 4 0 0 0 0 0 0 0 32b Coleoptera Silphidae sp.32b Carroñeros 0 0 0 0 0 0 1 3 0 0 33 Coleoptera Coleoptera sp.33 0 0 0 0 0 1 0 0 0 0 34 Coleoptera Ptilodactylidae sp.34 0 1 0 0 0 0 1 1 0 0 35 Opilionida Opilionida sp.35 2 0 0 0 0 0 0 0 0 0 38 Coleoptera Melolonthinae sp.38 Estercolero 0 0 0 0 0 0 6 1 0 7 39 Dermáptera Forficulidae sp.39 Omnívoras o saprófagas 0 0 0 0 0 3 3 1 0 7 42 Coleoptera Curculionidae sp.42 Herbívoro 0 4 0 0 0 0 0 0 0 0 43 Orthoptera Gryllidae sp.43 Herbívoro 0 0 0 7 0 0 0 0 0 0 Herbívoro 44 Coleoptera Entiminae sp.44 Herbívoro 4 0 0 0 0 1 3 1 0 0 46 Homoptera Cicadellidae sp.46 Herbívoro 0 0 0 0 1 1 0 0 0 0 47 Diptera Muscidae sp.47 0 0 0 1 0 0 0 0 0 0 49 Diptera Phoridae sp.49 Parasitoide 0 0 0 0 0 0 0 0 0 0 50 Hymenoptera Ichneumonidae sp.50 Parasitoide 0 1 0 1 0 0 0 0 0 0 51 Coleoptera Chrysomelidae sp.51 Herbívoro 1 1 0 0 0 0 0 0 0 0 54 Araneae Araneae sp.54 Depredador 11 0 0 0 0 0 0 0 0 0 56 Coleoptera Chrysomelidae sp.56 Herbívoro 1 0 0 0 0 0 0 0 0 0 57 Homoptera Cicadellidae sp.57 Herbívoro 1 2 0 0 0 0 0 0 0 0 58 Hymenoptera Diapriidae sp.58 Parasitoide 1 0 1 0 0 0 0 0 0 0 59 Coleoptera Meloidae sp.59 Depredador-fitófago 3 0 0 0 0 0 0 0 0 0 60 Coleoptera Curculionidae sp.60 Herbívoro 2 0 0 0 0 0 0 0 0 0 61 Orthoptera Cyrtacanthacridinae sp.61 Herbívoro 2 0 0 0 0 0 0 0 0 0 62 Diptera Empididae sp.62 Depredador 1 1 0 0 0 0 0 0 0 0 63 Coleoptera Curculionidae sp.63 Herbívoro 1 0 0 0 0 0 0 0 0 0 64 Coleoptera Elateridae sp.64 Herbívoro 1 0 0 0 0 0 0 0 0 0 65 Hymenoptera Pheidole sp.65 Omnívoro 1 0 0 0 0 0 0 0 0 0 66 Coleoptera Melyridae sp.66 Herbívoro 0 0 1 0 0 0 0 0 0 0 67 Coleoptera Nitidulidae sp.1 Herbívoro 0 0 1 0 0 0 0 0 0 0 66b Coleoptera Coleoptera sp.66 0 0 0 0 0 0 0 0 1 1 67b Coleoptera Silphidae sp. 67 Carroñeros 0 0 0 0 0 0 1 0 0 1 68 Diptera Cecidomyiidae sp.68 Herbívoro 0 0 0 0 5 0 0 0 0 69 Hymenoptera Labidus sp.69 Depredador 0 0 0 0 1 0 0 0 0 0 70 Diptera Tipulidae sp.70 Saprófagos 0 1 0 0 0 0 0 0 0 0 71b Coleoptera Curculionidae sp.71b Herbívoro 0 2 0 0 0 0 0 0 0 0 72b Coleoptera Alticinae sp.72b Herbívoro 0 0 0 0 0 0 0 0 0 1 73b Coleoptera Cantharidae sp.73b Herbívoro 0 0 0 0 0 1 0 0 0 0 74b Coleoptera Cetoniinae sp.74b Estercolero 0 0 0 0 0 1 0 0 0 0 Anexo 9. Listado de anfibios colectados en el transecto altitudinal de Tuluá, Valle del Cauca Especie Código de Colector Fecha Hora Estación/ Transecto LRC Peso (g) Pristimantis uranobates WBG - 51 2014-10-25 20:48 4/BL 29 2,62 Pristimantis simoterus WBG - 52 2014-10-25 21:23 4/1 33,9 3,21 Pristimantis uranobates WBG - 53 2014-10-25 19:31 5/4 16,87 0,2 Pristimantis peraticus WBG - 54 2014-10-25 23:39 1/EO - - Pristimantis peraticus WBG - 55 2014-10-25 23:43 1/EO - - BL: Búsqueda Libre; EO: Encuentro Ocasional. Los datos de la búsqueda libre y encuentro ocasional se obtuvieron al azar en cada estación Anexo 10. Lista de Aves registradas en el transecto altitudinal del municipio de Tuluá, Valle del Cauca No. Familia Especie Estación (m.s.n.m)/ No. De individuos 1 2 3 4 3.500 3.375 3.250 3.125 Total Endemismo Amenaza Gremio trófico 1 CRACIDAE Penelope montagnii 2 18 2 4 26 2 CRACIDAE Chamaepetes goudotii 1 0 2 0 3 FR 3 ACCIPITRIDAE Accipiter striatus 1 0 0 0 1 RD 4 SCOLOPACIDAE Gallinago jamesoni 2 0 0 0 2 I 5 STRIGIDAE Glaucidium jardinii 2 5 7 0 14 RD 6 CAPRIMULGIDAE Systellura longirostris* 0 0 0 0 1 I 7 TROCHILIDAE Adelomyia melanogenys* 0 0 0 0 1 NI 8 TROCHILIDAE Coeligena lutetiae 0 0 1 1 2 NI 9 TROCHILIDAE Coeligena torquata 0 0 0 1 1 10 TROCHILIDAE Eriocnemis mosquera 5 1 4 1 11 11 TROCHILIDAE Heliangelus exortis 2 1 0 5 8 NI 12 TROCHILIDAE Lafresnaya lafresnayi 2 0 0 0 2 NI 13 TROCHILIDAE Metallura tyrianthina 3 7 15 5 30 NI 14 TROCHILIDAE Metallura williami 3 7 0 0 10 NI 15 TROCHILIDAE Aglaiocercus kingii 0 0 0 2 2 NI 16 TROGONIDAE Trogon personatus 2 1 0 0 3 FR-I 17 RAMPHASTIDAE Andigena hypoglauca 0 1 0 0 1 18 PICIDAE Colaptes rivolii 1 0 1 0 2 I 19 FALCONIDAE Phalcoboenus carunculatus 2 0 0 0 2 20 PSITTACIDAE Hapalopsittaca fuertesi 0 0 2 0 2 RD FR 21 PSITTACIDAE Leptosittaca branickii 4 0 0 0 4 22 PSITTACIDAE GRALLARIIDAE Pionus tumultuosus 0 4 4 2 10 FR Grallaria ruficapilla Grallaria nuchalis 2 0 0 0 2 I GRALLARIIDAE 1 1 10 7 19 I 25 GRALLARIIDAE Grallaria quitensis 3 3 3 0 9 I 26 GRALLARIIDAE Grallaria squamigera 27 GRALLARIIDAE Grallaria rufula 2 3 3 3 1 0 0 0 6 6 I I 28 GRALLARIIDAE Grallaricula lineifrons 0 0 0 1 1 0 2 1 5 I 23 24 FR NI Casi-endé NI VU Endémico VU Casi-endé FR FR I 29 RHINOCRYPTIDAE Acropternis orthonyx 2 30 RHINOCRYPTIDAE Scytalopus latrans 1 3 9 2 15 I 31 RHINOCRYPTIDAE Scytalopus spillmanni 0 2 0 2 4 I 32 FURNARIIDAE Asthenes flammulata 1 0 0 0 1 I 33 FURNARIIDAE Hellmayrea gularis 0 1 0 0 1 I 34 FURNARIIDAE Margarornis squamiger 3 0 3 1 7 I Thripadectes holostictus 0 1 0 0 1 I 1 1 0 2 I 35 FURNARIIDAE 36 FURNARIIDAE Synallaxis unirufa 0 37 TYRANNIDAE Mecocerculus leucophrys Mecocerculus poecilocercus 4 10 19 3 36 I 38 TYRANNIDAE 0 0 1 0 1 I 39 TYRANNIDAE Ochthoeca frontalis 1 1 1 2 5 I Ochthoeca fumicolor 3 0 1 0 4 I Pseudotriccus ruficeps 0 0 0 1 1 I 40 41 TYRANNIDAE TYRANNIDAE Gremio trófico No. Familia 42 TYRANNIDAE Myiotheretes striaticollis 43 TYRANNIDAE Phyllomyias nigrocapillus 1 2 1 0 4 I 44 COTINGIDAE Pipreola arcuata 0 0 4 7 11 FR 45 CORVIDAE Cyanolyca armillata 0 0 2 0 2 46 HIRUNDINIDAE Orochelidon murina 2 0 3 3 8 I 47 TROGLODYTIDAE Cistothorus platensis 20 0 0 0 20 I Troglodytes solstitialis 4 0 0 2 6 I Cinnycerthia unirufa 0 3 2 2 7 I 1 3 0 4 I 48 49 TROGLODYTIDAE TROGLODYTIDAE Especie Estación (m.s.n.m)/ No. De individuos 1 2 3 4 3.500 3.375 3.250 3.125 3 0 0 0 Total Endemismo Amenaza 3 I Casi-endé FR-I 50 TROGLODYTIDAE Cinnycerthia olivascens 0 51 TURDIDAE Turdus fuscater 8 5 5 2 20 FR-I 52 TURDIDAE Turdus serranus Anisognathus igniventris 0 1 0 1 2 FR-I 53 THRAUPIDAE 16 13 6 1 36 FR-I 54 THRAUPIDAE Anisognathus lacrymosus 3 6 8 8 25 FR-I Buthraupis montana 0 0 0 11 11 FR-I 0 1 4 5 FR-I 55 THRAUPIDAE 56 THRAUPIDAE Cnemathraupis eximia 0 57 THRAUPIDAE Tangara vassorii 11 21 3 3 38 FR-I 58 THRAUPIDAE Conirostrum sitticolor 0 0 3 0 3 FR-I-N 59 THRAUPIDAE Diglossa cyanea 2 2 4 0 8 FR-I-N 60 THRAUPIDAE Diglossa humeralis 6 1 1 0 8 FR-I-N 61 THRAUPIDAE Diglossa albilatera 0 1 2 0 3 FR-I-N Hemispingus atropileus 0 0 0 5 5 I Hemispingus frontalis 0 0 0 3 3 I 0 0 4 4 I I 62 63 THRAUPIDAE THRAUPIDAE 64 THRAUPIDAE Hemispingus superciliaris 0 65 THRAUPIDAE Hemispingus verticalis 6 1 0 2 9 66 THRAUPIDAE Phrygilus unicolor* 0 0 0 0 1 67 THRAUPIDAE Catamenia inornata 4 0 0 0 4 FR 68 EMBERIZIDAE Atlapetes pallidinucha 0 0 5 3 8 FR-I 69 EMBERIZIDAE Atlapetes schistaceus 3 4 2 0 9 FR-I Arremon torquatus 5 0 4 0 9 FR-I Zonotrichia capensis* 0 0 0 0 1 9 23 10 43 70 71 EMBERIZIDAE EMBERIZIDAE SE 72 PARULIDAE Myioborus ornatus 1 73 PARULIDAE Myiothlypis nigrocristata 6 2 0 0 8 I 74 ICTERIDAE Cacicus chrysonotus* 0 0 0 0 1 I Total 159 146 171 Clasificación taxonómica basada en Remsen www.museum.lsu.edu/~Remsen/SACCBaseline.html 112 et Casi-endé I 593 al. 2015 (agosto) - Categorías de amenaza basadas en Renjifo et al. 2014. Vulnerable: VU. Nivel de endemismo: Chaparro et al. 2013. Casi endémico: Casi-Endé. Las especies señaladas con asterisco (*) indican las observadas por fuera de las unidades de muestreo (redes de niebla o puntos de conteo). Anexo 11. Lista de familias y especies registradas en el transecto altitudinal de Rioblano, Tolima. FAMILIAS No. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 ESPECIE 1 Actinidiaceae Alstroemeriaceae Apiaceae Araceae Araliaceae Arecaceae Asclepiadaceae Asteraceae Saurauia ursina Triana & Planch. Bomarea linifolia (Kunth) Baker Niphogeton sp. Anthurium oxybelium Schott Anthurium cf. bogotense Schott Oreopanax cf. caricaefolium Decne Oreopanax discolor (Kunth) Decne. & Planch. Oreopanax tolimanum Cuatrec. Schefflera cf. uribei Cuatrec. Geonoma sp. Cynanchum cf. sp. Ageratina cf. popayanensis (Hier.) Kunth Ageratina tinifolia (Kunth) R.M. King & H. Rob Baccharis tricuneata (L.f.) Pers. Diplostephium bicolor S.F. Blake Diplostephium cf. schultzii Wedd. Diplostephium sp. *Espeletia hartwegiana Cuatrec. Gynoxys laurata Cuatrec. Gynoxys cf. littlei Cuatrec. Gynoxys sp. Hipochaeris radicata L. Munnozia sp. Pentacalia cf. sp. Pentacalia sp.1 Pentacalia sp.2 Pentacalia cf. nítida (Kunth) Cuatrec. 2 Estaciones/ No. de individuos 2 3 4 5 1 1 4 5 1 1 3 2 6 2 4 4 2 1 1 1 3 12 1 2 9 15 8 2 1 7 4 1 7 3 7 5 1 1 5 2 1 1 2 2 5 2 Total ind. 3 7 5 2 4 7 4 8 2 1 8 4 4 21 28 7 11 5 1 1 5 2 1 1 2 Grado amenaza FAMILIAS No. 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 Begoniaceae Berberidaceae Blechnaceae Bromeliaceae Brunelliaceae Campanulaceae Celastraceae Chloranthaceae Cladoniaceae Clethraceae Clusiaceae Cunoniaceae Cyatheaceae Cyperaceae Elaeocarpaceae Equisetaceae Ericaceae ESPECIE Pentacalia vaccinioides (Kunth) Cuatrec. Begonia sp. Berberis sp. Blechnum loxense (Humb. & Bonpl. ex Kunth) Hook. ex Salomon *Blechnum sp. Greigia sp. Tillandsia sp. *Tillandsia compacta Griseb. *Tillandsia stipitata L. B. Sm. *Brunellia goudotii Tul. Brunellia sp. Sp. Maytenus cf. myricoides Triana & Planch. Maytenus cf. sp. Maytenus sp. Hedyosmum cf. cuatrecazanum Occhioni Hedyosmum cf. goudotianum Solms-Laubach Cladonia sp. Clethra revoluta (R. et P.) Sprengel Clethra ovalifolia Turcz. Clusia cf. alata Triana & Planch. Weinmannia mariquitae Szyszyl Weinmannia rollottii Killip Cyathea sp. Carex bonplandii Kunth Rhynchospora cf. caucana B.et K. *Vallea stipularis L.f. Equisetum bogotense H.B.K. Cavendishia bracteata (Ruiz & Pav. ex J. St.-Hil.) Hoerold 1 3 Estaciones/ No. de individuos 2 3 4 5 5 1 3 3 3 3 15 15 4 2 6 6 9 3 9 10 46 3 3 9 3 5 10 13 15 2 5 5 13 6 6 2 5 2 3 3 2 1 3 4 7 5 4 10 8 5 4 17 6 43 15 14 4 14 1 1 7 14 3 1 1 1 Total ind. 1 3 1 10 3 14 2 28 15 5 1 1 9 Grado amenaza FAMILIAS No. 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 ESPECIE Disterigma cf. acuminatum (Kunth) Nied. Disterigma empetrifolium (Kunth) Drude Gaultheria sclerophylla Cuatrec. Gaultheria sp. Gaultheria buxifolia Willd. *Macleania rupestris (Kunth) A.C. Sm. Pernettya prostrata (Cav.) DC. Plutarchia monantha A.C.Sm. Themistoclesia cf. mucronata (Benth.) Sleumer Vaccinium floribundum Kunth Escalloniaceae Escallonia myrtilloides L.f. Gentianaceace Macrocarpa macrophylla (Kunth) Gilg. Gesneriaceae *Columnea sp. Grossulariáceas Ribes leptostachyum Decne. *Hypericum laricifolium Juss. Hypericaceae Hypericum strictum Kunth Iridaceae *Sisyrinchium cf. trinerve Baker Lauraceae Ocotea infrafoveolata van der Weff Lomariopsidaceae Elaphoglossum sp. Gaiadendron punctatum Loranthaceae (Ruiz & Pav.) G. Don Lycopodiaceae Lycopodium jussiaei Desv. Marcgraviaceae Indet. Axinaea macrophylla Triana Brachyotum ledifolium (Desr.) Triana Miconia chlorocarpa Cong. Miconia plethorica Naudin Melastomataceae Miconia sp.1 Miconia sp.2 Miconia sp.6 Miconia sp.7 Miconia sp.8 Estaciones/ No. de individuos 1 2 3 4 5 11 8 2 12 4 10 12 1 1 4 2 5 12 11 2 4 10 3 9 3 8 1 6 5 2 1 6 Total ind. 33 27 5 2 5 33 1 16 24 2 3 2 8 1 1 2 7 4 3 1 7 14 4 9 27 12 1 1 2 15 1 13 9 4 8 4 16 6 11 5 9 2 2 2 2 1 2 2 10 5 12 3 4 21 10 3 5 1 2 1 3 14 Grado amenaza FAMILIAS No. 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 ESPECIE 1 Miconia theaezans *Tibouchina mollis (L.f.) Cong. Monimiaceae *Siparuna echinata (Kunth) A. DC. *Myrcianthes cf. orthostemon (O. Berg.) Grifo Myrtaceae Ugny myricoides (Kunth) O. Berg Cyrtochilum sp. Epidendrum sp.1 Orquidiaceae Epidendrum sp.2 Pleurothallis sp. *Stelis sp. Oxalidaceae Oxalis medicaginea Kunth Passifloraceae Passiflora cumbalensis (H. Karst.) Harms *Freziera cf. bonplandiana Tul. Pentaphylacaceae Freziera reticulata H. et. B. Piperaceae Piper cf. cyprium Trel. & Yunck. Achiachne aff. pulvinata Benth. Calamagrostis sp. Chusquea sp. Poaceae Chusquea tessellata Munro Cortaderia sp. Neurolepis sp. Monnina angustata Triana & Planch. Polygalaceae Monnina revoluta Kunth Geissanthus serrulatus Mez Myrsine dependens (Ruiz & Pav.) Spreng. Primulaceae Myrsine cf. panamensis (Cuatr.) Pipoly Myrsine guianensis (Aublet) Kuntze Prionodontaceae Prionodon sp. Pteridaceae Jamesonia alstonii A.F. Tryon Hesperomeles ferruginea (Pers.) Benth. Rosaceae Hesperomeles obtusifolia (Pers.) Lindl. Rubus gachetensis Berger Estaciones/ No. de individuos 2 3 4 5 6 1 1 4 1 6 1 1 4 1 4 1 12 1 15 10 5 6 3 6 1 5 15 13 2 3 1 6 14 1 7 15 7 8 2 9 2 1 7 7 5 11 14 15 15 11 1 1 1 2 12 2 1 2 2 10 3 2 14 Total ind. 12 1 2 7 1 16 4 2 27 5 53 7 6 3 4 1 14 33 12 47 23 3 36 10 Grado amenaza FAMILIAS No. 123 124 125 126 127 128 129 130 131 132 133 134 135 136 ESPECIE 1 Rubiaceae Scrophulariaceae Solanaceae Theaceae Thelipteridaceae Tropaeolaceae Urticaceae Total *Elaeagia sp. Galium hipocarpium (L.) Endl. ex Griseb. Nertera granatensis (Mutis ex L.f.) Druce *Notopleura sp. Palicourea cf. andaluciana Standl. Palicourea ovalis Standl. Bartsia sp. Indet. Solanum sp. Gordonia cf. humboldtii H. Keng. Ternstroemia cf. sp. Thelypteris sp. *Tropaeolum sp. *Pilea sp. Estaciones/ No. de individuos 2 3 4 5 6 2 6 Grado amenaza 2 6 3 1 1 2 2 1 1 Total ind. 1 1 1 199 207 153 284 146 87 4 1 2 2 1 2 1 1 1076 * Especies que no entraron en las unidades de muestreo pero que hicieron parte de observaciones generales en el área de estudio. Anexo 12. Listado de morfoespecies de edafofauna epigea, clasificadas a orden y con el grupo trófico al que pertenecen. Las Mercedes, río blanco (Tolima). Páramo El Meridiano. *No: corresponde a al código interno de colección. * Representa las estaciones de la réplica temporal en las mismas estaciones. No Orden Morfoespecie Grupo trófico Estaciones altitudinales/ No. de individuos 1 2 3 4 5 6 1 * 2 * 3 * 1 4 * 5 5 * 6 * 3 5 2 0 2 5 1 4 1 1 2 4 7 2 4 4 2 1 1 3 0 9 2 3 4 2 1 7 1 1 1 6 2 2 9 2 2 1 1 2 2 2 1 3 1 Coleoptera Bradycellus sp.1 2 Orthoptera Gryllus sp.2 Granívorodepredador Omnívoro 3 Coleoptera Staphylinidae sp.3 Depredador 4 4 Isopoda sp.4 Detritivoro 5 5 Malacostra ca Diptera Tachinidae sp.5 Parasitoide/depred ador 6 Diptera Muscoidea sp.6 8 Diptera Phoridae sp.8 Saprógago 9 Diptera Phoridae sp.9 Saprófago 11 Coleoptera Carabidae sp11 Depredador 12 Araneae Araneae sp.12 Depredador 13 Diptera Empididae sp.13 14 Diptera Sciaridae sp.14 17 Diptera Muscidae sp.16 7 1 0 4 6 6 4 3 2 2 9 Herbívoro 2 Herbívoro 1 1 7 4 1 1 1 1 1 1 1 2 1 1 1 1 1 18 Araneae Araneae sp.18 Depredador 1 19 Coleoptera Curculionidae sp.19 Herbívoro 1 2 3 20 Opilionida Opilionida sp.20 21 Coleoptera Dercylus sp. 21 Depredador 22 Coleoptera Bembidion sp. 22 Depredador 27 Coleoptera Phengodidae sp.27 Depredador 2 30 Dyctioptera Blattidae sp.30 Omnívoro 2 31 Diptera Mycetophilidae sp.31 Parásitohematófago 33 Coleoptera Coleoptera sp.33 34 Coleoptera Ptilodactylidae sp.34 Herbívoro 38 Coleoptera Melolonthinae sp.38 Estercolero 39 Forficulidae sp.39 Omnívoras o saprófagas 41 Dermapter a Diptera 42 Coleoptera Curculionidae sp.42 Herbívoro 1 43 Orthoptera Gryllidae sp.43 Herbívoro 1 45 Diptera Mycetophilidae sp.45 Parásitohematófago 47 Diptera Muscoidea sp.47 49 Diptera Phoridae sp.49 Parasitoide 50 Ichneumonidae sp.50 Parasitoide 51 Hymenopte ra Coleoptera Chrysomelidae sp.51 Herbívoro 52 Orthoptera Acrididae sp.52 Herbívoro 9 2 1 1 1 3 1 1 5 3 1 3 7 8 2 6 1 1 1 3 1 1 4 2 3 1 5 3 0 1 1 1 8 3 1 2 1 1 5 4 6 1 5 1 2 1 1 1 1 Muscoidea sp.41 1 1 7 4 1 2 2 7 1 1 2 1 2 2 4 1 2 2 1 1 2 53 Araneae Lycosidae sp.53 Depredador 54 Araneae Araneae sp.54 Depredador 55 Araneae Araneae sp.55 Depredador 58 Diapriidae sp.58 Parasitoide 59 Hymenopte ra Coleoptera 61 Orthoptera 69 Formicidae Cyrtacanthacridinae sp.61 Labidus sp.69 75 Dermaptera sp.75 76 Dermapter a Hemiptera 77 Diptera Diptera sp.77 78 Coleoptera Curculionidae sp.78 Herbívoro 1 79 Hemiptera Cercopidae sp.79 Herbívoro 2 80 Coleoptera Cantharidae sp.80 Herbívoro 2 81 Diptera Mycetophilidae sp.81 Saprofagos 2 2 82 Diptera Empididae sp.82 Saprofagos 1 83 Coleoptera Staphylinidae sp.83 Depredador 1 1 0 1 3 84 Braconidae sp.84 Parasitoide 85 Hymenopte ra Coleoptera Chrysomelidae sp.85 Herbívoro 86 Coleoptera Erotylidae sp.86 Herbívoro 1 Melyridae sp.59 Cercopidae sp.76 1 1 1 2 2 1 4 1 1 2 3 1 1 1 1 Herbívoro 1 1 1 Depredador Omnívoras o saprófagas Herbívoro 3 1 1 1 1 6 1 3 1 1 1 1 6 3 4 4 1 1 1 87 Coleoptera Erotylidae sp.87 Herbívoro 1 88 Ichneumonidae sp.88 Parasitoide 1 89 Hymenopte ra Hemiptera Reduviidae sp.89 Depredador 1 90 Coleoptera Melyridae sp.90 Herbívoro 1 91 Diptera Dicladocera macula Parásito 1 93 Dermaptera sp.93 Araneae sp.94 Omnívoras o saprófagas Depredador 1 94 Dermapter a Araneae 1 95 Diptera Tabanidae sp.95 Parásito 1 96 Diptera Tachinidae sp.96 Parasitoide/depred ador 97 Coleoptera Coleoptera sp.97 98 Hymenopte ra Coleoptera Hymenoptera sp.98 Orthoptera Acrididae sp.100 Herbívoro 1 Diptera Calliphoridae sp.101 Carroñeros 1 Coleoptera Curculionidae sp.102 Herbívoro 1 Diptera Tachinidae sp.103 Hymenopte ra Coleoptera Ichneumonidae sp.104 Passalus variiphylus Parasitoide/depred ador Parasitoide Coleoptera Coleoptera 99 10 0 10 1 10 2 10 3 10 4 10 5 10 6 10 1 1 1 1 Depredador 1 Coleoptera sp.99 3 2 1 2 1 2 3 1 xilófago 2 Staphylinidae sp.106 Depredador 1 Erotylidae sp.107 Herbívoro 1 7 10 8 10 9 11 0 11 1 11 2 11 3 11 4 11 5 11 6 11 7 Coleoptera Elateridae sp.99 Herbívoro 1 Phasmatod ea Hemiptera Phasmatodea sp.109 Herbívoro 1 Reduviidae sp.89 Herbivoro 1 Coleoptera Staphylinidae sp.111 Depredador 1 Diptera Muscoidea sp.112 Diptera Muscoidea sp.113 Coleoptera Carabidae sp.114 Coleoptera Erotylidae sp.115 Coleoptera Carabidae sp.116 Hymenopte ra Ichneumonidae sp.117 1 2 Granívorodepredador Herbívoro Granívorodepredador Parasitoide 1 3 4 1 1 4 1 1 2 1 6 Anexo 13. Listado de anfibios colectados en el transecto de Rioblanco, Tolima Especie Código de Colector Fecha Hora Estación/ Transecto LRC Peso (g) Pristimantis cf. vicarius WBG-56 2015-01-08 23:35 3/EO 17,98 0,52 Pristimantis buckleyi WBG-57 2015-01-09 21:04 2/2 54,2 14,3 Pristimantis cf. obmutescens WBG-58 2015-01-09 21:58 2/3 43 8,6 Pristimantis leptolophus WBG-59 2015-01-09 23:52 5/EO 21,8 1 Osornophryne sp. WBG-60 2015-01-10 17:00 3/1 22 0,9 Pristimantis cf. vicarius WBG-61 2015-01-11 21:10 4/1 34,1 3,5 Pristimantis peraticus WBG-62 2015-01-11 21:40 4/1 21,9 0,8 Pristimantis cf. vicarius WBG-63 2015-01-11 23:17 4/BL 28,96 2,52 Pristimantis leptolophus WBG-64 2015-01-12 21:17 5/1 18,4 0,5 Pristimantis cf. obmutescens WBG-65 2015-01-08 20:28 1/4 24,79 1,36 Pristimantis cf. obmutescens WBG-66 2015-01-08 21:08 1/5 30,48 2,78 Pristimantis peraticus WBG-67 2015-01-09 20:41 2/5 28,27 1,88 Osornophryne sp. WBG-68 2015-01-10 17:24 3/5 22,85 1,08 Pristimantis leptolophus WBG-69 2015-01-11 22:23 4/6 26,8 1,2 Pristimantis cf. vicarius WBG-70 2015-02-16 1:13 6/EO 42,8 6,5 Pristimantis peraticus WBG-71 2015-02-16 19:30 1/6 31,5 2,3 Pristimantis peraticus WBG-72 2015-02-17 20:21 4/5 25,77 1,5 Pristimantis peraticus WBG-73 2015-02-17 14:30 4/EO 19,78 0,4 Pristimantis leptolophus WBG-74 2015-02-19 20:01 6/4 18,58 0,5 Osornophryne sp. WBG-75 2015-02-14 16:39 1/1 27,12 1,56 Pristimantis peraticus WBG-76 2015-02-14 16:39 1/1 22,44 1,14 Pristimantis peraticus WBG-77 2015-02-14 20:59 1/2 23,58 1,22 Pristimantis cf. obmutescens WBG-78 2015-02-14 22:05 1/3 26,51 1,56 Osornophryne sp. WBG-79 2015-02-15 17:30 2/2 24,07 1,22 BL: Búsqueda Libre; EO: Encuentro Ocasional. Los datos de la búsqueda libre y encuentro ocasional se obtuvieron al azar en cada estación Anexo 14. No. Listado de Aves reportadas en el transecto altitudinal del municipio de Rioblanco, Tolima Familia 1 2 3 4 5 6 7 CRACIDAE CATHARTIDAE COLUMBIDAE 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROGONIDAE TROGONIDAE RAMPHASTIDAE PICIDAE PICIDAE FALCONIDAE PSITTACIDAE PSITTACIDAE GRALLARIIDAE GRALLARIIDAE CAPRIMULGIDAE APODIDAE TROCHILIDAE TROCHILIDAE RHINOCRYPTIDAE RHINOCRYPTIDAE RHINOCRYPTIDAE RHINOCRYPTIDAE RHINOCRYPTIDAE FURNARIIDAE FURNARIIDAE FURNARIIDAE FURNARIIDAE TYRANNIDAE TYRANNIDAE TYRANNIDAE TYRANNIDAE TYRANNIDAE TYRANNIDAE TYRANNIDAE TYRANNIDAE TYRANNIDAE Especie Chamaepetes goudotii Coragyps atratus Patagioenas fasciata Systellura longirostris Streptoprocne zonaris Colibri coruscans Adelomyia melanogenys Ramphomicron microrhynchum Chalcostigma herrani Metallura tyrianthina Metallura williami Eriocnemis vestita Eriocnemis derbyi Eriocnemis mosquera Aglaeactis cupripennis Coeligena torquata Coeligena lutetiae Lafresnaya lafresnayi Trogon collaris Trogon personatus Andigena hypoglauca Colaptes rivolii Campephilus pollens Phalcoboenus carunculatus Amazona mercenarius Leptosittaca branickii Grallaria nuchalis Grallaria rufula Acropternis orthonyx Myornis senilis Scytalopus latrans Scytalopus spillmanni Scytalopus opacus Margarornis squamiger Hellmayrea gularis Asthenes flammulata Asthenes fuliginosa Phyllomyias nigrocapillus Mecocerculus poecilocercus Mecocerculus leucophrys Uromyias agilis Pseudotriccus ruficeps Mionectes striaticollis Pyrrhomyias cinnamomeus Sayornis nigricans Myiotheretes fumigatus Estación (m.s.n.m)/ No. De individuos 1 3.520 0 0 0 1 0 0 0 2 3.320 0 0 4 0 0 0 0 3 3.120 1 3 1 0 6 0 1 4 2.920 1 1 3 0 5 5 0 0 2 1 7 2 1 0 1 3 1 0 0 0 0 0 0 0 0 0 0 0 0 2 0 0 0 0 1 0 0 0 1 0 0 0 0 0 0 0 0 0 6 20 4 1 2 11 5 0 0 0 0 3 0 0 0 0 0 0 0 0 1 1 1 1 0 0 0 0 0 1 0 6 3 0 0 0 0 0 1 6 1 0 0 2 0 0 1 0 0 0 1 0 2 1 0 0 2 0 0 0 7 2 0 7 2 1 0 0 2 4 2 3 0 17 0 0 Total Endemismo Amenaza Gremio trófico 2 4 8 1 11 5 1 FR CAR FR I I NI NI 0 3 NI 0 0 0 0 0 0 0 1 0 4 1 2 2 1 0 1 4 10 0 0 0 0 0 0 0 2 1 0 0 0 0 2 0 0 2 11 1 2 14 28 6 1 3 16 6 1 1 4 1 5 3 1 2 2 4 10 2 2 1 1 8 3 1 9 3 1 1 1 2 12 5 3 2 28 1 2 NI NI NI NI NI NI NI NI NI NI FR-I FR-I FR I I RD FR FR I I I I I I I I I I I I I I I I I I I I Casi-endé Casi-endé VU VU Casi-endé Casi-endé No. Familia 47 TYRANNIDAE 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 TYRANNIDAE TYRANNIDAE TYRANNIDAE COTINGIDAE COTINGIDAE CORVIDAE HIRUNDINIDAE HIRUNDINIDAE TROGLODYTIDAE TROGLODYTIDAE TROGLODYTIDAE TROGLODYTIDAE TURDIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE EMBERIZIDAE EMBERIZIDAE EMBERIZIDAE PARULIDAE PARULIDAE ICTERIDAE FRINGILLIDAE Especie Ochthoeca frontalis Ochthoeca cinnamomeiventris Ochthoeca rufipectoralis Ochthoeca fumicolor Pipreola riefferii Pipreola arcuata Cyanolyca armillata Pygochelidon cyanoleuca Orochelidon murina Troglodytes solstitialis Cistothorus platensis Cinnycerthia unirufa Henicorhina leucophrys Turdus fuscater Hemispingus atropileus Hemispingus superciliaris Hemispingus frontalis Hemispingus verticalis Cnemoscopus rubrirostris Buthraupis montana Cnemathraupis eximia Anisognathus lacrymosus Anisognathus igniventris Anisognathus somptuosus Dubusia taeniata Iridosornis rufivertex Thraupis cyanocephala Tangara vassorii Conirostrum sitticolor Diglossa lafresnayii Diglossa humeralis aterrima Diglossa albilatera Diglossa cyanea Catamblyrhynchus diadema Urothraupis stolzmanni Catamenia inornata Zonotrichia capensis Atlapetes schistaceus Atlapetes pallidinucha Myiothlypis nigrocristata Myioborus ornatus Cacicus chrysonotus Sporagra magellanica TOTAL Estación (m.s.n.m)/ No. De individuos 1 3.520 2 2 3.320 0 3 3.120 0 4 2.920 1 0 0 4 0 1 0 0 0 0 4 0 0 0 0 1 0 0 0 0 0 0 0 0 1 0 2 0 0 0 6 10 4 0 6 0 0 0 3 0 2 0 2 2 0 0 4 0 0 0 10 1 0 0 0 1 2 0 0 0 0 0 0 0 50 13 13 0 0 8 0 1 4 8 2 4 12 0 4 0 0 0 18 1 19 0 1 214 Total Gremio trófico Endemismo Amenaza 3 I 1 5 I 1 0 1 0 3 0 0 13 0 0 1 16 8 0 0 1 1 9 1 0 0 0 1 0 13 0 12 0 0 7 16 1 1 1 0 1 0 0 1 2 1 3 3 13 4 31 10 4 8 39 9 1 1 4 2 11 1 I I FR FR FR-I I I I I I I FR-I FR-I FR-I FR-I FR-I FR-I FR-I FR-I 13 21 3 1 0 0 2 3 2 1 1 5 7 0 0 2 3 7 16 44 7 0 274 4 1 0 0 1 1 2 0 0 0 1 1 0 0 0 13 2 3 1 20 0 1 168 32 37 3 1 13 1 5 7 20 4 6 18 7 5 2 15 5 28 18 83 7 2 706 Clasificación taxonómica basada en Remsen www.museum.lsu.edu/~Remsen/SACCBaseline.html et al. Casi-endé Casi-endé FR-I FR-I FR-I FR-I FR-I FR-I FR-I FR-I-N FR-I-N FR-I-N FR-I-N FR-I-N FR-I FR-I FR SE FR-I FR-I I I I SE Casi-endé Casi-endé Casi-endé 2015 (agosto) - Categorias de amenaza basadas en Renjifo et al. 2014. En peligro crítico: CR; En peligro: EN; Vulnerable: VU; Casi amenazada: NT. Nivel de endemismo: Chaparro et al. 2013. Casi endémico: Casi-Endé. Gremio trófico: Rapáz diurna:RD; Frugívoro: FR; Frutos e insectos: FR-I; Frutos, insectos y néctar: FR-I-N; Néctar e insectos: NI; Insectos: I; Semillas: SE. Las especies señaladas con asterisco (*) indican las observadas por fuera de las unidades de muestreo (redes de niebla o puntos de conteo). Anexo 15. Lista de familias y especies reportadas en el transecto altitudinal de Palmira, Valle del Cauca FAMILIAS 1 No. 1 2 3 4 Actinidiaceae Adoxaceae Alstroemeriaceae Apiaceae 5 6 Araceae 7 8 9 Araliaceae 10 11 12 13 Arecaceae Asclepiadaceae 14 15 16 17 18 Estaciones/ No. de individuos ESPECIE Asteraceae Saurauia ursina Triana & Planch. Viburnum pichinchense Benth. *Bomarea linifolia (Kunth) Baker Niphogeton sp. *Anthurium oxybelium Schott *Anthurium cf. bogotense Schott *Anthurium martae Croat & Castaño-Rubiano Oreopanax discolor (Kunth) Decne. & Planch. Oreopanax floribundum Decne. & Planch. Schefflera cf. bejucosa Cuatrec. Schefflera cf. uribei Cuatrec. *Ceroxylum parvifrons (Engel) H. Wendl. Cynanchum cf. tenellum L. f. *Ageratina tinifolia (Kunth) R.M. King & H. Rob Diplostephium cf. schultzii Wedd. Espeletia hartwegiana Cuatrec. Gamochaeta americana (Mill.) Wedd. *Gynoxys cf. littlei Cuatrec. 2 5 3 4 3 1 9 15 Total ind. 5 4 5 2 34 2 2 3 4 15 2 9 2 19 1 1 1 1 NT 3 3 1 1 15 15 3 4 3 19 Gynoxys sp. 20 *Hipochaeris radicata L. 21 Munnozia sp. 7 7 22 Pentacalia sp. *Pentacalia vaccinioides (Kunth) Cuatrec. 6 6 23 Grado amenaza 3 7 FAMILIAS 1 No. 24 Begoniaceae *Begonia sp. 25 Berberidaceae 26 Blechnaceae Berberis sp. Blechnum loxense(Humb. & Bonpl. ex Kunth) Hook. ex Salomon *Blechnum sp. Tournefortia fuliginosa Kunth Puya trianae Baker 27 28 Boraginaceae 29 30 31 Bromeliaceae 32 33 Brunelliaceae 34 Celastraceae 35 36 Chloranthaceae 37 38 Clethraceae 39 40 41 Clusiaceae Cunoniaceae 42 47 Dioscoreaceae 48 Elaeocarpaceae Vallea stipularis L.f. Ericaceae Bejaria resinosa Mutis Cavendishia bracteata (Ruiz & Pav. ex J. St.-Hil.) Hoerold Cavendishia cf. nitida (Kunth) A.C.Sm. 44 Cyatheaceae Tillandsia sp. *Tillandsia compacta Griseb. *Tillandsia stipitata L. B. Sm. Brunellia goudotii Tul. *Maytenus cf. myricoides Triana & Planch. Maytenus sp. Hedyosmum cf. cuatrecazanum *Hedyosmum cf. goudotianum SolmsLaubach Clethra revoluta (R. et P.) Sprengel Clethra ovalifolia Turcz. *Clusia cf. alata Triana & Planch. Weinmannia mariquitae Szyszyl Weinmannia rollottii Killip Cyathea sp. *Carex cf. pichinchensis Kunth Rhynchospora cf. caucana B.et K. Pteridium aquilinum (L.) Kuhn Diocorea sp. 43 Cyperaceae 45 46 Dennstaedtiaceae 49 50 51 Estaciones/ No. de individuos ESPECIE 2 3 4 5 5 7 Total ind. 1 1 1 9 3 3 3 3 1 1 4 1 1 5 15 6 11 4 37 8 22 9 12 51 3 9 3 15 30 1 1 4 2 1 8 15 6 1 5 12 1 1 13 4 18 1 9 2 2 1 1 3 2 2 4 3 1 23 5 17 12 2 3 10 2 Grado amenaza FAMILIAS No. 73 Disterigma acuminatum (Kunth) Nied. Disterigma empetrifolium (Kunth) Drude Gaultheria sclerophylla Cuatrec. Gaultheria sp. Macleania rupestris (Kunth) A.C. Sm. Pernettya prostrata (Cav.) DC. *Plutarchia monantha A.C.Sm. *Themistoclesia cf. mucronata (Benth.) Sleumer Vaccinium floribundum Kunth *Escallonia myrtilloides L.f. Escalloniaceae Escallonia paniculata (Ruiz & Pav.) Roem. & Schult. Lupinus cf. microphyllus Fabaceae Desr. *Ribes leptostachyum Grossulariáceas Decne. Hymenophyllaceae Hymenophyllum sp. Hypericum laricifolium Juss. Hypericaceae Hypericum strictum Kunth Orthrosanthus chimboracensis (Kunth) Iridaceae Baker Sisyrinchium sp. Lippia hirsuta var. moritzii Lamiaceae (Turcz.) López-Palacios Aiouea sp. Ocotea heterochroma Mez Lauraceae & Sodiro Persea mutisii Kunth 74 Lomariopsidaceae 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 75 76 77 78 Loranthaceae Lycopodiaceae Melastomataceae Estaciones/ No. de individuos ESPECIE *Elaphoglossum sp. Gaiadendron punctatum (Ruiz & Pav.) G. Don Huperzia sp. Lycopodium jussiaei Desv. Axinaea macrophylla Triana 1 2 3 4 8 4 11 4 Total ind. 5 12 2 10 27 2 2 1 1 2 9 4 5 18 15 4 1 20 1 2 12 15 3 12 3 3 1 16 1 1 2 2 4 4 4 1 1 5 5 1 2 1 6 1 2 6 6 7 13 5 12 3 13 3 1 1 14 1 2 2 6 Grado amenaza FAMILIAS Estaciones/ No. de individuos ESPECIE 1 No. 80 Brachyotum ledifolium (Desr.) Triana Miconia lehmannii Cogn. 81 Miconia plethorica Naudin 82 Miconia sp.1 83 *Miconia sp.7 84 Miconia sp.8 85 86 79 2 3 4 Total ind. 5 9 9 7 5 1 1 4 8 1 11 Miconia pustulata Naudin 4 4 1 11 93 Miconia theaezans Tibouchina mollis (L.f.) Cong. Tibouchina lepidota (Bonpl.) Baill. Ruagea hirsuta (C. de C.) Harms. Myrica pubescens Humb. & Bonpl. ex Willd. Myrcia sp. Myrcianthes cf. orthostemon (O. Berg.) Grifo Dichaea sp. 94 Epidendrum sp.1 95 98 Epidendrum sp.2 Gomphichis cf. caucana Schltr. Oncidium cf. jamiesonii Lindl. Pleurothallis sp. 99 Stelis sp. 87 88 89 90 Meliaceae Myricaceae 91 Myrtaceae 92 96 Orquidiaceae 97 2 12 1 106 Peperomia sp. Achiachne aff. pulvinata Benth. Calamagrostis sp. 107 108 Poaceae 109 110 Chusquea sp. *Chusquea tessellata 1 1 1 1 3 1 1 9 1 1 2 1 1 4 1 1 4 1 5 2 11 13 2 Oxalis medicaginea Kunth Passiflora cumbalensis (H. Passifloraceae Karst.) Harms 101 Freziera cf. bonplandiana Tul. 102 Pentaphylacaceae Freziera canescens Bonpl. 103 Freziera reticulata H. et. B. 104 Piper sp. 9 6 100 Oxalidaceae 105 Piperaceae 2 2 2 2 7 7 5 5 6 6 1 1 1 22 25 11 25 1 1 36 1 6 48 1 6 12 12 15 15 1 1 Grado amenaza FAMILIAS Estaciones/ No. de individuos ESPECIE No. 1 2 2 5 3 4 Total ind. 5 Munro 111 Cortaderia sp. 112 *Neurolepis sp. Monnina angustata Triana & Planch. Pleopeltis sp. 113 114 115 Polygalaceae Polypodiaceae 116 117 Primulaceae 118 119 Prionodontaceae 120 121 Proteaceae Pteridaceae 122 123 124 Rosaceae 125 126 127 128 129 Rubiaceae 130 131 Sabiaceae 132 133 Selaginellaceae Scrophulariaceae 134 135 Solanaceae 136 137 Staphyleaceae Polypodium sp. Geissanthus cf. bogotensis Mez. Myrsine dependens (Ruiz & Pav.) Spreng. Myrsine coriacea (Sw.) R. Br. ex Roem. & Schult. Prionodon sp. Roupala pachypoda Cuatrec. Jamesonia alstonii A.F. Tryon Hesperomeles ferruginea (Pers.) Benth. Hesperomeles glabrata Kunth Hesperomeles obtusifolia (Pers.) Lindl. Lachemilla cf. orbiculata (Ruiz & Pav.) Rydb. Prunus villegasiana Pilg. Rubus gachetensis Berger Galium hipocarpium (L.) Endl. ex Griseb. Nertera granatensis (Mutis ex L.f.) Druce Palicourea cf. ovalis Standl. Meliosma sp. Selaginella tarapotensis Baker Bartsia pedicularoides Benth. Calceolaria cf. microbefaria Kraenzl. Sessea sp. *Solanum cf. ovalifolium Dunal Turpinia sp. 7 3 11 7 7 1 1 4 1 6 1 2 14 1 6 1 7 4 5 4 6 15 14 1 14 13 2 5 21 1 1 4 4 1 1 2 1 3 6 6 7 7 2 2 3 11 15 31 2 36 10 10 4 15 1 1 3 3 2 2 2 2 Grado amenaza FAMILIAS 1 No. 138 Theaceae 139 Thelipteridaceae 140 Thymelaeaceae 141 Urticaceae 142 Estaciones/ No. de individuos ESPECIE Viscaceae 143 Winteraceae Total Ternstroemia cf. meridionalis Mutis ex L. f. Thelypteris sp. Daphnopsis cf. bogotensis Meisn. *Pilea sp. Dendrophthora cf. clavata (Benth.) Urb. Drimys granadensis L.f. 2 3 4 Total ind. 5 7 4 1 209 7 4 2 3 1 1 1 1 275 Grado amenaza 177 186 127 974 Categoría de amenaza: Calderón et al. 2005 NT: Casi amenazada. * Especies que no entraron en las unidades de muestreo pero que hicieron parte de observaciones generales en el área de estudio. Anexo 16. Listado de morfoespecies de edafofauna epigea, clasificadas a orden y con su el grupo trófico al que pertenecen. La Nevera, transecto Palmira (Valle del Cauca). No Orden Morfoespecie Grupo trófico E1 E2 E3 E4 E5 No. de individuos 1 Coleoptera Bradycellus sp.1 Granívoro-depredador 10 39 14 5 2 Orthoptera Gryllus sp.2 Omnívoro 21 34 112 57 3 Coleoptera Staphylinidae sp.3 Depredador 5 27 11 4 Malacostraca Isopoda sp.4 Detritívoro 6 Diptera Muscoidea sp.6 8 Diptera Phoridae sp.8 Saprófago 9 Diptera Phoridae sp.9 Saprófago 10 Coleoptera Bembidion sp. 10 Granívoro-depredador 11 Coleoptera Bradycellus sp.11 Depredador 12 Araneae Araneomorphae sp12 Depredador 1 13 Diptera Empididae sp.13 Herbívoro 4 14 Diptera Empididae sp.13 Herbívoro 17 Diptera Muscoidea sp.16 Omnívoro 18 Araneae Araneomorphae sp.18 Depredador 19 Coleoptera Curculionidae sp.19 Herbívoro 21 Coleoptera Dercylus sp. 21 22 Coleoptera Bembidion sp. 22 25 Diptera Tipula sp25 Saprófagos 27 Coleoptera Phengodidae sp.27 Depredador 2 13 1 8 12 3 5 6 17 12 2 4 70 55 1 28 14 2 1 2 3 1 16 2 2 Depredador 6 29 Depredador 29 16 1 20 21 16 11 21 21 8 1 2 30 Blattodea Blattidae sp.30 Omnívoro 44 Coleoptera Curculionidae sp.44 Herbívoro 43 Orthoptera Gryllidae sp.43 Herbívoro 47 Diptera Muscoidea sp.47 Parásito 50 Hymenoptera Ichneumonidae sp.50 Parasitoide 51 Coleoptera Carabidae sp.51 Herbívoro 6 2 52 Orthoptera Acrididae sp.52 Herbívoro 2 1 54 Araneae Araneomorphae sp.54 Depredador 2 55 Araneae Araneomorphae sp.55 Depredador 7 56 Diptera Dolichopodidae sp56 Depredador 59 Coleoptera Melyridae sp.59 Omnívoro 13 64 Coleoptera Elateridae sp.64 Herbívoro 2 67 Coleoptera Silphidae sp. 67 Herbívoro 1 69 Formicidae Labidus sp.69 Depredador 71 Coleoptera Curculionidae sp.71b Herbívoro 80 Coleoptera Cantharidae sp.80 Herbívoro 81 Diptera Mycetophilidae sp.81 Saprófagos 97 Coleoptera Coleoptera sp.97 6 98 Hymenoptera Hymenoptera sp.98 4 13 16 8 2 1 1 1 2 2 1000 3 3 4 1 301 1 1 4 3 Depredador 1 8 3 1 2 1 99 Coleoptera Coleoptera sp.99 11 101 Diptera Calliphoridae sp.101 Carroñeros 105 Coleoptera Passalus variiphylus Xilófago 1 1 108 Coleoptera Elateridae sp.108 Herbívoro 112 Dermaptera Dermaptera sp.112 Depredador 2 113 Orthoptera Acrididae sp.113 Herbívoro 2 114 Coleoptera Cf. Pelidnota sp.114 Saprófita-xilófaga 1 115 Coleoptera Melolonthidae sp.115 Herbívoro 1 116 Coleoptera Chrysomelidae sp.116 Herbívoro 1 117 Opilionida Opilionida sp.117 118 Coleoptera Coleoptero sp.118 119 Coleoptera Coleoptero sp.119 120 Coleoptera Cf. Amphimallon sp.120 1 1 2 3 1 6 3 2 Herbívoro 1 Anexo 17. Anfibio colectado en el transecto altitudinal de Palmira Valle del Cauca Especie Código de Colector Fecha Hora Estación/ Transecto LRC Peso (g) Pristimantis racemus WBG - 80 04/03/2015 19:52 1/BL 30,56 2,7 BL: Búsqueda libre (la búsqueda libre se hizo al azar en cada estación) Anexo 18. No. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 Listado de Aves registradas en el transecto altitudinal del municipio de Palmira, Valle del Cauca. Familia CATHARTIDAE CATHARTIDAE COLUMBIDAE ACCIPITRIDAE ACCIPITRIDAE STRIGIDAE APODIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROCHILIDAE TROGONIDAE RAMPHASTIDAE PICIDAE FALCONIDAE FALCONIDAE PSITTACIDAE PSITTACIDAE PSITTACIDAE GRALLARIIDAE GRALLARIIDAE GRALLARIIDAE GRALLARIIDAE RHINOCRYPTIDAE RHINOCRYPTIDAE RHINOCRYPTIDAE RHINOCRYPTIDAE FURNARIIDAE FURNARIIDAE FURNARIIDAE FURNARIIDAE TYRANNIDAE TYRANNIDAE TYRANNIDAE TYRANNIDAE TYRANNIDAE TYRANNIDAE TYRANNIDAE TYRANNIDAE TYRANNIDAE TYRANNIDAE COTINGIDAE COTINGIDAE Especie Cathartes aura Coragyps atratus Patagioenas fasciata Accipiter striatus Geranoaetus melanoleucus Glaucidium jardinii Streptoprocne zonaris Aglaeactis cupripennis Chalcostigma herrani Coeligena lutetiae Coeligena torquata Colibri coruscans Eriocnemis mosquera Heliangelus exortis Lafresnaya lafresnayi Metallura tyrianthina Metallura williami Ocreatus underwoodii Ramphomicron microrhynchum Trogon personatus Andigena hypoglauca Colaptes rubiginosus Caracara cheriway Phalcoboenus carunculatus Amazona mercenarius Leptosittaca branickii Pionus chalcopterus Grallaria nuchalis Grallaria quitensis Grallaria squamigera Grallaria rufocinerea Acropternis orthonyx Myornis senilis Scytalopus spillmanni Scytalopus latrans Hellmayrea gularis Margarornis squamiger Dendrocincla tyrannina Pseudocolaptes boissonneautii Mecocerculus leucophrys Mecocerculus poecilocercus Ochthoeca cinnamomeiventris Ochthoeca frontalis Ochthoeca fumicolor Ochthoeca diadema Ochthoeca rufipectoralis Pseudotriccus ruficeps Myiotheretes fumigatus Elaenia frantzii Pipreola arcuata Pipreola riefferii Estación (m.s.n.m)/ No. De individuos 1 2 3 4 3.420 3.295 3.170 3.045 1 1 1 1 2 23 1 2 2 1 2 7 2 4 3 3 2 5 6 2 4 2 1 1 3 1 1 1 1 5 4 3 1 2 1 2 2 3 8 2 1 2 6 2 5 8 2 3 3 15 5 1 1 1 4 1 6 2 2 4 3 8 1 8 1 1 3 1 3 4 7 3 6 1 1 1 1 2 1 4 1 1 2 1 2 2 2 4 4 1 2 2 4 1 3 18 2 2 3 5 1 3 Total 1 7 9 1 1 1 6 32 1 4 8 6 5 16 5 4 1 4 2 2 11 2 6 9 19 6 5 26 10 3 1 1 3 3 10 1 11 2 6 12 2 3 2 6 4 22 1 2 2 4 8 Endemismo Amenaza Casi-endé Casi-endé VU VU Casi-endé Casi-endé Gremio trófico RD RD FR RD RD RD I NI NI NI NI NI NI NI NI NI NI NI NI FR-I FR I RD RD FR FR FR I I I I I I I I I I I I I I I I I I I I I I FR FR No. 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 Familia COTINGIDAE CORVIDAE HIRUNDINIDAE TROGLODYTIDAE TROGLODYTIDAE TROGLODYTIDAE CINCLIDAE TURDIDAE TURDIDAE TURDIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE THRAUPIDAE INSERTAE CEDIS EMBERIZIDAE EMBERIZIDAE EMBERIZIDAE EMBERIZIDAE PARULIDAE PARULIDAE FRINGILLIDAE FRINGILLIDAE Especie Ampelion rubrocristatus Cyanolyca armillata Orochelidon murina Cistothorus platensis Troglodytes solstitialis Cinnycerthia unirufa Cinclus leucocephalus Turdus fuscater Myadestes ralloides Turdus serranus Anisognathus igniventris Anisognathus lacrymosus Buthraupis montana Diglossa cyanea Diglossa humeralis Diglossa lafresnayii Diglossa albilatera Tangara vassorii Urothraupis stolzmanni Iridosornis rufivertex Hemispingus superciliaris Hemispingus frontalis Hemispingus verticalis Catamenia inornata Chlorornis riefferii Cnemathraupis eximia Conirostrum sitticolor Saltator cinctus Atlapetes schistaceus Atlapetes pallidinucha Zonotrichia capensis Arremon assimilis Myioborus ornatus Myiothlypis nigrocristata Sporagra spinescens Sporagra xanthogastra Total Estación (m.s.n.m)/ No. De individuos 1 2 3 4 3.420 3.295 3.170 3.045 4 12 3 2 1 2 3 1 5 5 1 1 5 26 1 4 11 13 3 3 1 12 7 21 1 7 2 17 1 5 2 1 2 1 1 1 4 2 1 2 3 1 1 2 5 2 1 5 2 1 2 1 7 5 3 1 3 2 1 9 1 5 7 9 4 7 6 2 2 1 1 122 206 1 124 167 Total 7 7 11 14 4 3 1 60 1 5 3 14 22 2 18 16 6 6 1 1 4 6 9 1 11 2 3 1 11 2 14 1 26 5 1 1 619 Endemismo Amenaza FR FR-I I I I I I FR-I FR-I FR-I FR-I FR-I FR-I FR-I-N FR-I-N FR-I-N FR-I-N FR-I FR-I FR-I I FR-I FR-I FR FR-I FR-I FR-I FR FR-I FR-I SE FR-I I I SE SE Casi-endé Casi-endé Casi-endé VU Casi-endé Casi-endé Clasificación taxonómica basada en Remsen www.museum.lsu.edu/~Remsen/SACCBaseline.html et al. 2015 (agosto) - Categorias de amenaza basadas en Renjifo et al. 2014. Vulnerable: VU. Nivel de endemismo: Chaparro et al. 2013. Casi endémico: Casi-Endé. Gremio trófico: Rapáz diurna:RD; Frugívoro: FR; Frutos e insectos: FR-I; Frutos, insectos y néctar: FR-I-N; Néctar e insectos: NI; Insectos: I; Semillas: SE. Las especies señaladas con asterisco (*) indican las observadas por fuera de las unidades de muestreo (redes de niebla o puntos de conteo). Gremio trófico