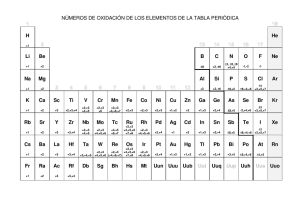
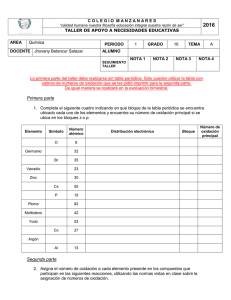
UNIVERSIDAD NACIONAL DE INGENIERIA FACULTAD DE CIENCIAS UNIDAD DE POSGRADO MAESTRIA EN QUIMICA CURSO: FISICOQUIMICA AVANZADA PROFESORA: ANGELICA BAENA ALUMNA: MARIA ISABEL IRRIBARREN 2020 INTRODUCCION El interés en los compuestos naturales, va en aumento, debido a sus beneficios potenciales para la salud humana, con mecanismos de acción antioxidantes. Fig.1 Diversos Productos Naturales Las betalaínas son pigmentos presentes en plantas que contienen nitrógeno en su estructura y son solubles en agua, encontrándose presentes en la mayoría de las plantas, tanto en elementos comestibles como frutos y tubérculos o en elementos no comestibles como flores, tallos, hojas o raíces, además se encuentran en semillas, como las de quinua que tienen una amplia gama de colores y también ha sido descrita su presencia en algunos hongos como en Amanita muscaria. En la mayoría de plantas y flores los pigmentos son antocianos y de hecho hasta 1957 las betalaínas se consideraron que eran antocianos que contenían nitrógeno, lo realmente curioso es que son dos tipos de pigmentos que se autoexcluyen, así las plantas que tienen betalaínas no producen antocianos y las que tienen antocianos no producen betalaínas, esta segregación no tiene, a día de hoy, una clara explicación evolutiva. Las betalaínas se establecieron como grupo independiente que contenían en su estructura un sistema 1,7-diazaheptametilen puesto que todas contienen una molécula de ácido betalámico condensada con un grupo amino formando una base de Schiff. Esta independencia en el año 1957 marca que la investigación sobre betalaína comenzará ese año. La betanidina es una betalaína de color rojo a violeta perteneciente al grupo de las betacianinas. En la naturaleza se encuentra generalmente glicosilada en la forma de betanina. La betanina se utiliza generalmente como colorante de alimentos y pinturas. Fig.2 Molécula de Betanidina La medición electroquímica es un método muy útil para la determinación de parámetros fisicoquímicos de antioxidantes, que permite la deducción de sus vías redox. Una de las técnicas de uso frecuente es la voltamperometría cíclica, que indica la capacidad de los compuestos para donar electrones con el potencial de una onda anódica. Esta técnica se utiliza para evaluar la actividad de barrido de muchos compuestos frecuentemente estudiados como los polifenoles y también para estimar la capacidad antioxidante total de los productos alimenticios. CONTENIDO Debido a los grupos hidroxilos contenidos en la estructura de la Betanidina, se realizó el estudio la actividad antirradical mediante voltamperometría cíclica. La preparación del Extracto fue de la siguiente manera: Una porción de 100 g de extracto de raíz de betarraga que contiene betalaínas se sometió a una limpieza de extracción en fase sólida en cartuchos C-18 antes del fraccionamiento preparativo por HPLC. La betanina purificada se sometió a hidrólisis enzimática, catalizada por β-glucosidasa y seguida de limpieza en extracción en fase sólida en cartuchos C-18 antes del fraccionamiento preparativo por HPLC. Los eluidos se concentraron bajo presión reducida a 25°C y sometido a fraccionamiento preparativo por HPLC. Las mediciones de voltamperometría cíclica se llevaron a cabo: Se utilizó un analizador electroquímico (modelo EA9 / M151E) de MTM-ANKO (Cracovia, Polonia) con un electrodo de trabajo de carbón vitreo de 1,8 mm de diámetro, un electrodo auxiliar de platino y un electrodo de referencia Ag / AgCl. Usando tampón de ácido acético 0,1 M de pH con un rango de 3,0 a 8,0. Todas las muestras (15 ml) de la solución acuosa se purgaron con un argón durante 5 minutos para realizar nuevas mediciones. Los parámetros voltamétricos generales fueron los siguientes: potencial inicial, -0.2 mV; potencial final, 1,2 mV; La velocidad de exploración varió de 5 a 1000 mV / s. Todos los datos experimentales fueron recolectados y analizados de acuerdo al software del equipo. Antes de cada medición, el electrodo de trabajo se pulió cuidadosamente con pasta de alúmina de 0,3 μm seguido de pasta de alúmina de 0,05 μm, con unas gotitas de agua. Se obtuvo el siguiente voltamperograma: Fig. 3 Voltamperograma de Betanidina El bajo potencial de oxidación observable para el primer pico indica propiedades de oxidación muy fuertes, a velocidades medias 50 mV. Gracias a los valores obtenidos en el Voltamperograma, se puede deducir el siguiente mecanismo de oxidación para la Betanidina: Fig. 4 Mecanismo de Oxidación para la Betanidina La oxidación inicial de la betanidina genera el catión radical transitorio, que pierde rápidamente un protón, formando un radical fenoxi neutro. Sin embargo, ocurre la deshidrogenación y descarboxilación del intermediario 1, produciendo un segundo intermediario. La oxidación adicional con la pérdida de un protón y un electrón resulta muy probable en la formación de una forma oxidada, la o-quinona. CONCLUSION • Por lo tanto, se puede afirmar que los protones que participan en el mecanismo electro oxidativo y su concentración producen cambios significativos en los perfiles voltamperométricos de betanidina. • El reordenamiento de los sistemas cromóforos conjugados da como resultado la formación de derivados con capacidad oxidativas. BIBLIOGRAFIA Wybraniec, S., Stalica, P., Sporna, A., Nemzer, B., Pietrzkowski, Z., & Michazowski, T. (2011). Antioxidant Activity of Betanidin: Electrochemical Study in Aqueous Media. Journal of Agricultural and Food Chemistry, 59, 12163–12170.