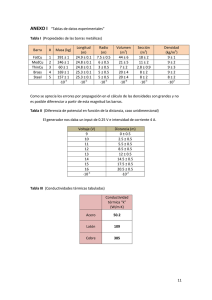
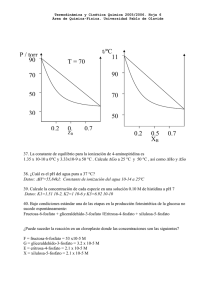
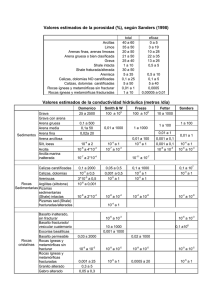
GEOMETRÍAS PARES TOTALES PARES COMPARTIDOS PARES LIBRES GEOMETRÍA PARES TOTALES PARES COMPARTIDOS PARES LIBRES GEOMETRÍA 2 3 2 3 0 0 Lineal Trigonal plana / Triangular 5 5 5 4 0 1 3 4 4 4 2 4 3 2 1 0 1 2 Angular/forma de “V” Tetraédrica Piramidal/pirámide trigonal Angular/forma de “V” 5 5 6 6 6 3 2 6 5 4 2 3 0 1 2 Bipirámide trigonal Tetraedro irregular/sube y baja Forma de “T” Lineal Octaédrica Pirámide base cuadrada Cuadrada REGLAS DE SOLUBILIDAD MOLÉCULAS, ÁTOMOS, IONES Compuestos solubles Excepciones Todos los compuestos que contienen iones de metales alcalinos y el ión amonio Compuestos insolubles Excepciones Todos los carbonatos Menos los compuestos que contienen iones de metales alcalinos y del ion amonio Todos los fosfatos Menos los compuestos que contienen iones de metales alcalinos y del ion amonio Todos los cromatos Menos los compuestos que contienen iones de metales alcalinos y del ion amonio Todos los sulfuros Menos los compuestos que contienen iones de metales alcalinos y del ion amonio Todos los hidróxidos Menos los compuestos que contienen iones de metales alcalinos CONCENTRACIONES ppm g soluto g totales x 10 Todos los nitratos 6 Todos los bicarbonatos Todos los cloratos CÁLCULO DE pH 14=pH+pOH pH=-log[H+] pOH=-log[OH-] Kw =1 x 10-14 Todos los halogenuros Menos los de Ag+, Hg22+, Pb2+ y Hg2+(solo con bromuros y yoduros) Todos los sulfatos Menos los de Ag+, Ca2+, Sr2+, Ba 2+,Pb2+, Hg22+ ELECTROQUÍMICA o o o E E o Ecelda Ecátodo Eanodo Q Ecelda o 0.0592V log K eq n 0.0592V log Q n C c Dd Aa Bb CONSTANTES DE DISOCIACIÓN DE ÁCIDOS A 25º C Nombre Acético Acetilsalicílico Arsénico Arsenioso Ascórbico Benzoico Bórico Butanoico Carbónico Cianhídrico Ciánico Cítrico Cloroacético Cloroso Cromato ácido, ion Fenol Fluorhídrico Fórmico Fosfórico Hidrazoico Hipobromoso Hipocloroso Hipoyodoso Láctico Malónico Nitroso Oxálico Paraperyódico Pirofosfórico Propiónico Selenato ácido ion Selenioso Sulfhídrico Sulfúrico Sulfuroso Tártarico Yódico Fórmula HC2H3O2 HC9H7O4 H3AsO4 H3AsO3 HC6H7O6 HC7H5O2 H3BO3 HC4H7O2 H2CO3 HCN HCNO H3C6H5O7 HC2H2O2Cl HClO2 HCrO4HC6H5O HF HCHO2 H3PO4 HN3 HBrO HClO HIO HC3H5O3 H2C3H3O4 HNO2 H2C2O4 H5IO6 H4P2O7 HC3H5O2 HSeO4H2SeO3 H2S H2SO4 H2SO3 H2C4H4O6 HIO3 Ka1 1.8 x 10-5 3.0 x 10-4 5.6 x 10-3 5.1 x 10-10 8.0 x 10-5 6.5 x 10-5 5.8 x 10-5 1.5 x 10-5 4.2 x 10-7 4.9 x 10-10 3.5 x 10-4 7.4 x 10-4 1.4 x 10-3 1.1 x 10-2 3.0 x 10-7 1.3 x 10-10 7.1 x 10-4 1.7 x 10-4 7.5 x 10-3 1.9 x 10-5 2.5 x 10-9 3.0 x 10-8 2.3 x 10-11 1.4 x 10-4 1.5 x 10-3 4.5 x 10-4 6.5x 10-2 2.8 x 10-2 3.0 x 10-2 1.3 x 10-5 2.2 x 10-2 2.3 x 10-3 9.5 x 10-8 Ácido fuerte 1.7 x 10-2 1.0 x 10-3 1.7 x 10-1 Ka2 Ka3 1.0 x 10-7 3.0x 10-12 1.6x 10-12 4.8 x 10-11 1.7x 10-5 4.0 x 10-7 6.2 x 10-8 4.8 x 10-13 2.0x 10-6 6.1x 10-5 5.3 x 10-9 4.4 x 10-3 5.3 x 10-9 1 x 10-19 1.3x 10-2 6.3 x 10-8 4.6 x 10-5 CONSTANTES DE DISOCIACIÓN DE BASES A 25º C Nombre Amoniaco Anilina Cafeína Dimetilamina Etilamina Hidrazina Fórmula NH3 C6H5NH2 C8H10N4O2 (CH3)2NH CH3CH2NH2 H2N-NH2 Kb 1.8 x 10-5 3.8 x 10-10 5.3 x 10-14 5.4 x 10-4 5.6 x 10-4 1.3 x 10-6 Nombre Hidroxilamina Metilamina Piridina Trimetilamina Urea Fórmula OH-NH2 CH3NH2 C5H5N (CH3)3N NH2(CO)NH2 Kb 1.1 x 10-8 4.4 x 10-4 1.7 x 10-9 6.4 x 10-5 1.5 x 10-14 TABLA DE POTENCIALES DE REDUCCIÓN ESTÁNDAR Semirreacción F2(g) + 2 e- 2 F-(ac) O3(g) + 2 H+(ac) + 2 e- O2(g) + H2O(l) Co3+(ac) + 1 e- Co2+(ac) H2O2(ac) + 2 H+(ac) + 2 e- 2 H2O(l) PbO2(s) + 4 H+(ac) + SO42-(ac) + 2 e- PbSO4(s) + 2 H2O(l) Ce4+(ac) + 1 e- Ce3+(ac) MnO4-(ac) + 8 H+(ac) + 5 e- Mn2+(ac) + 4 H2O(l) Au3+(ac) + 3 e- Au(s) Cl2(g) + 2 e- 2 Cl-(ac) Cr2O72-(ac) + 14 H+(ac) + 6 e- 2 Cr3+(ac) + 7 H2O(l) MnO2(s) + 4 H+(ac) + 2 e- Mn2+(ac) + 2 H2O(l) O2(g) + 4 H+(ac) + 4 e- 2 H2O(l) Br2(l) + 2 e- 2 Br-(ac) NO3-(ac) + 4 H+(ac) + 3 e- NO(g) + 2 H2O(l) 2 Hg2+(ac) + 2 e- Hg22+(ac) Hg22+(ac) + 2 e- 2 Hg(l) Ag+(ac) + 1 e- Ag(s) Fe3+(ac) + 1 e- Fe2+(ac) O2(g) + 2 H+(ac) + 2 e- H2O2(ac) MnO4-(ac) + 2 H2O(l) + 3 e- MnO2(s) + 4 OH-(ac) I2(s) + 2 e- 2 I-(ac) O2(g) + 2 H2O(l) + 4 e- 4 OH-(ac) Cu2+(ac) + 2 e- Cu(s) AgCl(s) + 1 e- Ag(s) + Cl-(ac) SO42-(ac) + 4 H+(ac) + 2 e- SO2(g) + 2 H2O(l) Cu2+(ac) + 1 e- Cu+(ac) Sn4+(ac) + 2 e- Sn2+(ac) 2H+(ac) + 2e- H2(g) Pb2+(ac) + 2 e- Pb(s) Sn2+(ac) + 2 e- Sn(s) N2(g) + 5 H+(ac) + 4 e- N2H5+(ac) Ni2+(ac) + 2 e- Ni(s) Co2+(ac) + 2 e- Co(s) PbSO4(s) + 2 e- Pb(s) + SO42-(ac) Cd2+(ac) + 2 e- Cd(s) Fe2+(ac) + 2 e- Fe(s) Cr3+(ac) + 3 e- Cr(s) Zn2+(ac) + 2 e- Zn(s) 2 H2O(l) + 2 e- H2(g) + 2 OH-(ac) Mn2+(ac) + 2 e- Mn(s) Al3+(ac) + 3 e- Al(s) Be2+(ac) + 2 e- Be(s) Mg2+(ac) + 2 e- Mg(s) Na+(ac) + 1 e- Na(s) Ca2+(ac) + 2 e- Ca(s) Sr2+(ac) + 2 e- Sr(s) Ba2+(ac) + 2 e- Ba(s) K+(ac) + 1 e- K(s) Li+(ac) + 1 e- Li(s) E° (V) + 2.87 + 2.07 + 1.82 + 1.77 + 1.70 + 1.61 + 1.51 + 1.50 + 1.36 + 1.33 + 1.23 + 1.23 + 1.07 + 0.96 + 0.92 + 0.85 + 0.80 + 0.77 + 0.68 + 0.59 + 0.53 + 0.40 + 0.34 + 0.22 + 0.20 + 0.15 + 0.13 0.00 - 0.13 - 0.14 - 0.23 - 0.25 - 0.28 - 0.31 - 0.40 - 0.44 - 0.74 - 0.76 - 0.83 - 1.18 - 1.66 - 1.85 - 2.37 - 2.71 - 2.87 - 2.89 - 2.90 - 2.93 - 3.05