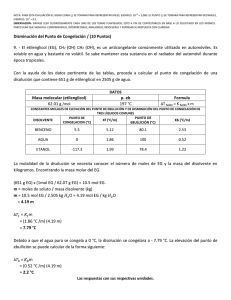
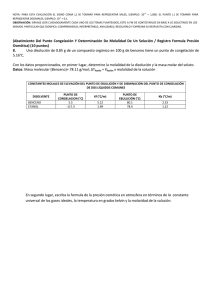
Propiedades coligativas propiedades de las soluciones que dependen sólo del número de partículas de soluto disueltas Sin importar el tipo de partículas presentes... preferentemente en soluciones diluidas <0.2M y a las que contienen solutos no volátiles. Tres tipos de Comportamiento Electrolítico de las soluciones Electrolito Fuerte Electrolito Débil No electrolito p.e. Del agua=100oC p.c. Del agua=0oC p.e.=100.512oC p.c.=-1.86oC p.e.=100.512oC p.c.=-1.86oC 1m urea 1m NaCl p.e.=101.024oCo p.c.=-3.72 C 1m sacarosa Propiedades coligativas de las soluciones Abatimiento de la presión de vapor Elevación del punto de ebullición Abatimiento del punto de congelación Presión osmótica P1 = X1 P 10 P 01 - P1 = ∆P = Si la solución contiene 0 X2P1 P 10 = Presión de vapor del solvente puro X1 = fracción molar del solvente solo un soluto: X1 = 1 – X2 X2 = fracción molar del soluto P10 P1 Solvente Solución ¿Cuál de los vasos tiene la menor presión de vapor 90 g agua 100 g agua 10 g NaCl Si el 10% de las moléculas son del soluto no volátil, entonces la presión de vapor disminuye 10% con respecto a la del solvente puro... 1. El naftaleno C8H10, se utiliza para hacer bolas para combatir la polilla. Suponga una solución que se hace disolviendo 0.515 g de naftaleno en 60.8 g de cloroformo CHCl3, calcule el descenso de la p. v. del cloroformo a 20 C en presencia del naftaleno. La p. v. del cloroformo a 20 C es 156 mm Hg. Se puede suponer que el naftaleno es no volátil comparado con el cloroformo. ¿Cuál es la presión de vapor de la solución?. µC8H10= 128; µCHCl3= 119.35 P1 = X1 P 01 El punto de ebullición normal del etanol (C2H5OH) es 78.4°C. Cuando se disuelven 9.15 g de un no electrolito en 100 g de etanol, la presión de vapor a esa temperatura fue de 740 Torr. Calcular 0 a) El abatimiento de la presión de vapor ∆P= P1°-P1 = X2 P 1 b) La fracción molar del soluto y del solvente. c) La masa molar del soluto P1 = X1 P 01 En el punto de ebullición normal, la presión del solvente puro es de 1 atm o 760 Torr a) ∆P= P1°-P1= (760 - 740) mm de Hg= 20 mm Hg P1 740torr X1 = 0 = = 0.97 P1 760torr b) X2 = 1 – X1=1- 0.97 = 0.03 9.15 nsoluto µ = 0.03 X2 = = (nsoluto + nsolvente ) 9.15 100 + 46 µ µ =152 g/mol Elevación del punto de ebullición ∆Te = Te – T e 0 T e0punto de ebullición del solvente puro T e punto de ebullición de la solución Te > T e0 ∆Te > 0 ∆Te = Ke mi Ke constante molal de ebullición (0C/m) o ebulloscópica i(soluto)=1 para no electrólitos; para electrólitos es el no. de iones que libera el soluto en la solución Constantes molales de elevación del punto de ebullición y de disminución del punto de congelación de varios líquidos comunes 0.1 m NaCl 0.1 m Na+ iones & 0.1 m Cl- iones 0.1 m NaCl 0.2 m iones en solución factor van’t Hoff (i) = Número de partículas en la soln después de la dis Número de unidades formulares antes de la dis i debe ser No electrólitos NaCl CaCl2 1 2 3 Una aplicación de la elevación del punto de ebullición 3. ¿Cuál es el punto de ebullición de una solución que contiene 478 g de etilenglicol en 3202 g de agua? etilenglicol= 62.01 g/mol ∆Te = Ke mi moles de solute m = kg de solvente µ del Ke agua = 0.52 0C/m 478 g x 1 mol 62.01 g = = 2.41 m 3.202 kg solvente ∆Te = Kemi = 0.520C/m x 2.41 m (1) = 1.25 0C ∆Te= T e – Te° Te= ∆Te +Te° = 1.25 0C + 100 0C = 101.250C 4. ¿Qué punto de ebullición tiene una solución 0.2 m de CaCl2 en agua? . Ke=0.512 °C.Kg/mol R=100.3°C La constante molal de elevación del punto de ebullición del benceno es 2.53 °C.Kg/mol. Si la concentración de un soluto no electrólito en benceno es de 0.1 m ¿Qué punto de ebullición tendrá la solución?. El punto de ebullición del benceno puro es de 80.10°C. R=80.3°C Abatimiento del punto de congelación ∆Tc = T0c – Tc T 0c punto de congelación del solvente puro T c punto de congelación de la solución T 0c > Tc ∆Tc> 0 ∆Tc = Kc mi m molalidad de la solución Kc constante molal de congelación o constante crioscópica (0C/m) i(soluto)=1 para no electrólitos; para electrólitos es el no. de iones que libera el soluto en la solución 1.- REFRIGERANTE, eleva el punto de ebullición ante el calor excesivo, su acción evita la pérdida de líquidos por evaporación y sobre calentamiento, su alta capacidad antiebullente alcanza hasta 112°C. 2.- ANTICONGELANTE, protege del congelamiento por bajas temperaturas eliminando los daños que sufre el motor al aumentar el volumen del líquido, dificultando la circulación del mismo, protección hasta -24° C. COLOR: Verde Fluorescente. TF MILENIUM TF MILENIUM ANTICONGELANTE REFRIGERANTE ECOLÓGICO EXTRA PROTECCIÓN. TF MILENIUM, ANTICONGELANTE REFRIGERANTE, IDEAL PARA AUTOS NUEVOS 5.¿Cuál es el punto de congelación de una solución acuosa que contiene 39.5 g de etilenglicol (anticongelante) disueltos en 1 L de agua? µ (g/mol) del etilenglicol= 62.01 ∆Tc = Kc mi moles de soluto m = Kg de solvente Kcagua = 1.86 0C/m 39.5 g x 1 mol 62.01 g = = 0.637 m 1 kg solvente ∆Tc= Kc m = 1.86 0C/m x 0.637 m = 1.185 0C ∆Tc = T0c – Tc Tc = T 0c – ∆Tc = 0.00 0C – 1.185 0C = -1.18 0C Problema: 7. El punto de congelación de una solución que contiene 1.00 g de un compuesto desconocido (A) disuelto en 10.0 g de benceno es 2.07 °C. El punto de congelación del benceno puro es de 5.48°C. La constante de depresión molal del punto de congelación es de 5.12 °C/molal. ¿Cuál es el peso molecular del compuesto desconocido? Estrategia: Paso 1: Calcular la depresión del punto de congelación de la solución. ∆Tf = (Punto de congelación del solvente puro) - (Punto de congelación de la solución) (5.48 oC) - (2.07 oC) = 3.41 oC Paso 2: Calcular la concentración molal de la solución usando la depresión del punto de congelación. ∆Tf = (Kf) (m)(i) m = (3.41 oC) / [(5.12 oC/molal)(1)] m = 0.666 molal Paso 3: Calcular el peso molecular desconocido usando la concentración molal. m = 0.666 molal # moles.de. A = (m) x( Kg .de.solvente) moles A = (0.66 mol A / kg benceno) (0.0100 kg benceno) = 6.66 X 10-3 mol A µA = 1.00 g gA = # moles A 6.66 X 10 −3 mol µ=150.1 g/mol Osmosis y Presión Osmótica (π) membrana semipermeable Un incremento de volumen de la solución El aumento de peso ejerce una presión hacia abajo llamada PRESION OSMOTICA ésta empuja el agua de regreso e impide otro incremento volumen Paso del solvente de una solución diluida hacia una más concentrada a través de una membrana semipermeable... Diluída Más concentrada Membranas semipermeables: Membranas que sólo permiten la migración de especies químicas concretas a través de ellas, siendo impermeables a las demás. sacarosa al 2% sacarosa al 8% 2% ¿Qué solución ejercerá mayor presión osmótica? ¿en que dirección fluye el agua inicialmente? ¿En qué lado se produce el aumento de volumen? DISOLUCIONES EXTRACELULARES vs FLUIDOS CELULARES. TONICIDAD Presión osmótica efectiva de una determinada disolución respecto a una membrana semipermeable y otra disolución concretas. Disoluciones • Isotónicas: Disoluciones que tienen igual tonicidad. • Paratónicas: Disoluciones que tienen distinta tonicidad. Pueden ser: Hipertónicas: Tonicidad de la disolución > Tonicidad del fluido celular El disolvente fluye hacia el exterior de la célula. Hipotónicas: Tonicidad de la disolución < Tonicidad del fluido celular El disolvente fluye hacia el interior de la célula. Una célula en : Solución isotónica Solución hipotónica Solución hipertónica Presión Osmótica (π) M = Molaridad de la solución R = constante de los gases en L.atm mol-1K-1 T = Temperatura en K n = moles de soluto V = volumen de solución en litros π= presión osmótica en atmósferas i = factor de van´t Hoff π = MRTi π V= nRT i 8. Una solución se prepara disolviendo 0.5 g de un polímero en tolueno hasta un volumen final de 200 ml. La solución tiene una presión osmótica de 0.582 torr a 20°C. ¿Cuál es la masa molar del polímero? π = MRTi 1atm 0.582torr π 760torr = = 3.18 X 10 −5 mol / L M= RTi (0.082 L.atm / mol.K )(293K )(1) # moles.de. polímero = MV = (3.18 X 10 −5 mol / L) X (0.20 L) = 6.38 X 10 −6 mol # moles = g µ g 0.50 g µ= = −6 # moles 6.38 X 10 mol µ = 7.8X104 g/mol Las propiedades coligativas proporcionan un medio para determinar la masa molar de un soluto... En la práctica sólo se emplean la disminución del punto de congelacion y presión osmótica Propiedades coligativas de las soluciones Abatimiento de la presión de vapor P1 = X1 P 10 X1 = 1 – X2 ∆P = P 01 - P1 = X2 P 10 Elevación del punto de ebullición ∆Te = Te – T e0 ∆Te = Ke mi Abatimiento del punto de congelación ∆Tc = T0c – Tc Presión osmótica ∆Tc = Kc mi π = MRTi