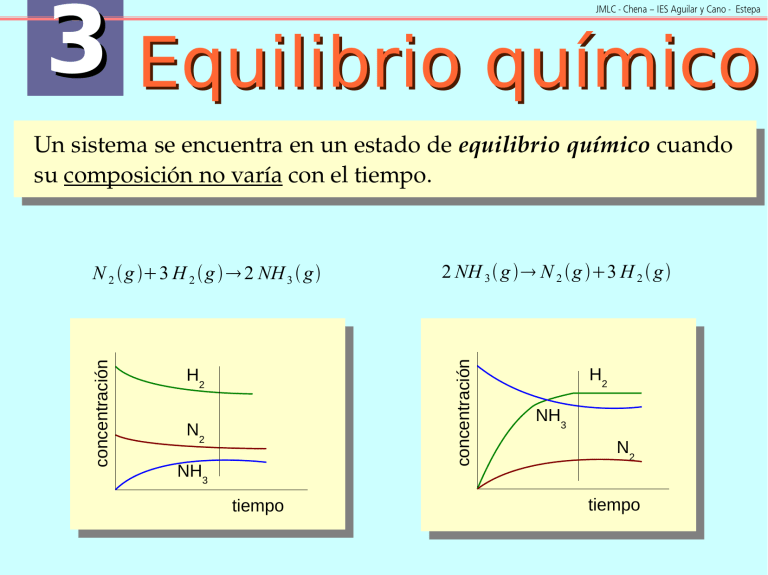
3 Equilibrio químico JMLC - Chena – IES Aguilar y Cano - Estepa Un sistema se encuentra en un estado de equilibrio químico cuando su composición no varía con el tiempo. 2 NH 3 g N 2 g 3 H 2 g concentración concentración N 2 g 3 H 2 g 2 NH 3 g H2 N2 NH3 tiempo H2 NH3 N2 tiempo 3 Equilibrio químico JMLC - Chena – IES Aguilar y Cano - Estepa Características Sólo puede existir en un sistema cerrado, que es el que permite el contacto mutuo entre reactivos y productos. Es reversible, por eso puede alcanzarse partiendo de los reactivos o de los productos. N 2 g 3 H 2 g 2 NH 3 g Es dinámico, la velocidad a la que ocurre la reacción directa es igual a la de la reacción inversa. 3 Equilibrio químico JMLC - Chena – IES Aguilar y Cano - Estepa Termodinámica y equilibrio cC d D aA bB 0 G reacción = G reacción RT ln Al cociente pCc pdD a A p p b B c d a b pC p D p A pB se le denomina cociente de reacción (Q) y permite evaluar en qué sentido evolucionará una reacción química de forma espontánea, teniendo en cuenta la composición en un momento determinado. 3 Equilibrio químico JMLC - Chena – IES Aguilar y Cano - Estepa Termodinámica y equilibrio Cuando se alcance el equilibrio 0 = G 0reacción RT ln G reacción=0 p cC p dD p aA p bB eq 0 = G 0reacción RT ln K p Kp = p cC pdD p aA pbB Es la constante de equilibrio expresada en función de las presiones parciales de cada una de las sustancias que intervienen en la reacción cuando se alcanza el equilibrio. 0 G 0reacción = − RT ln K p Kp = e G reacción − RT 3 Equilibrio químico JMLC - Chena – IES Aguilar y Cano - Estepa Constante de equilibrio y temperatura G 0 = H 0 − T S 0 = − RT ln K p ln K p 0 H 1 = S 0− R T H0 y S0 de una reacción apenas varían con la temperatura, con lo que la relación entre las constantes de equilibrio a diferentes temperaturas se puede obtener a partir de la ecuación de Van't Hoff: 0 K'p H 1 1 ln = − Kp R T T' 3 Equilibrio químico JMLC - Chena – IES Aguilar y Cano - Estepa La constante de equilibrio Ley de acción de masas (LAM) o ley del equilibrio: Cuando se alcanza el equilibrio, el cociente entre las concentraciones de productos elevadas a sus coeficientes estequiométricos y las concentraciones de reactivos elevadas a los suyos tiene un valor constante a una determinada temperatura. (Guldberg y Waage) cC d D aA bB K c= [C ]ceq [ D]deq [ A]aeq [ B ]beq 3 Equilibrio químico JMLC - Chena – IES Aguilar y Cano - Estepa La constante de equilibrio cC d D aA bB Kp = pcC pdD [C ]c [ D]d K c= a b [ A] [ B] p aA pbB n RT pV = n RT p = V Kp K p = K c RT cd −ab = K c RT n [C ]c R T c [ D]d RT d = [ A]a RT a [ B]b RT b K p = K x p n 3 Equilibrio químico JMLC - Chena – IES Aguilar y Cano - Estepa La constante de equilibrio Las unidades de la constante de equilibrio depende de su definición, así que con carácter general, la constante de equilibrio se utiliza como un número adimensional. La constante de equilibrio de una reacción química, además de la temperatura, depende de cómo se exprese estequiométricamente: N2 3H2 2 NH 3 2 K= [ NH 3 ] [ N 2 ][ H 2 ] 3 K = K ' 2 1 3 N2 H2 NH 3 2 2 K' = [ NH 3 ] 1 2 [ N 2] [ H 2] K ' = K 3 2 2 NH 3 N2 3H2 K'' = K'' = [ N 2 ][ H 2 ]3 1 K [ NH 3 ]2 3 Equilibrio químico JMLC - Chena – IES Aguilar y Cano - Estepa Evolución hacia el equilibrio cC d D aA bB c d [C ] [ D] Q= [ A]a [ B ]b Cociente de reacción K c= [C ]ceq [ D]deq [ A]aeq [ B ]beq Constante de equilibrio Si Q < Kc [C]c[D]d < ([C]c[D]d)eq [A]a[B]b > ([A]a[B]b)eq Reactivos Productos Si Q > Kc [C]c[D]d > ([C]c[D]d)eq [A]a[B]b < ([A]a[B]b)eq Productos Reactivos Si Q = Kc Sistema en equilibrio No evoluciona 3 Equilibrio químico JMLC - Chena – IES Aguilar y Cano - Estepa Equilibrios homogéneos Son en los que todas las sustancias que forman el sistema se encuentran en el mismo estado y fase: todas son gases, todas son líquidas miscibles o todas están en disolución. Todas estas sustancias deben estar en la expresión de su constante de equilibrio. Equilibrios heterogéneos Son en los que no todas las sustancias que forman el sistema se encuentran en el mismo estado o en la misma fase: sustancias sólidas o líquidas en equilibrio con gases, o sustancias sólidas en equilibrio con sustancias en disolución. En la expresión de la constante de equilibrio solo aparecen las sustancias cuya concentración o presión parcial varía en el proceso, es decir, los gases y las sustancias en disolución. 3 Equilibrio químico JMLC - Chena – IES Aguilar y Cano - Estepa Equilibrios en varias etapas Si una reacción se puede expresar como la suma de dos o más reacciones, la constante de equilibrio de la reacción global está determinada por el producto de las constantes de equilibrio de las reacciones parciales. Si se restan, las constantes se dividen. Si se multiplican por un mismo coeficiente, la constante queda elevada a dicho número. Grado de disociación (): fracción de mol en que se disocia una sustancia, esto es, parte de un mol que reacciona. Al multiplicarlo por 100 tendremos el porcentaje de disociación de una sustancia. 3 Equilibrio químico JMLC - Chena – IES Aguilar y Cano - Estepa Factores que afectan al equilibrio. Principio de Le Chatelier “Si un sistema en equilibrio es sometido a una perturbación que modifique cualquiera de los factores que determinan el estado de equilibrio, el sistema evolucionará de tal forma que disminuirá al mínimo el efecto de la perturbación.” Los factores que determinan el estado de equilibrio son los ya conocidos: Concentración de las sustancias. Presión­volumen del sistema. Temperatura. 3 Equilibrio químico JMLC - Chena – IES Aguilar y Cano - Estepa Cambios en la concentración N2 3H2 2 NH 3 H =−92,2 kJ 3 Equilibrio químico JMLC - Chena – IES Aguilar y Cano - Estepa Cambios en la concentración N2 3H2 2 NH 3 H =−92,2 kJ Aumenta Aumentalala[ [CC] ] Consumo Consumode de[ [CC] ] Disminuye Disminuyelala[ [CC] ] Producción Producciónde de[ [CC] ] 3 Equilibrio químico JMLC - Chena – IES Aguilar y Cano - Estepa Cambios en la presión­volumen N2 3H2 2 NH 3 H =−92,2 kJ 3 Equilibrio químico JMLC - Chena – IES Aguilar y Cano - Estepa Cambios en la presión­volumen N2 3H2 2 NH 3 Aumenta Aumentalalapp Disminuye DisminuyeelelVV Disminuye Disminuyelalapp Aumenta AumentaelelVV H =−92,2 kJ Disminución Disminuciónde denn(gases) (gases) Aumento Aumentode denn(gases) (gases) 3 Equilibrio químico JMLC - Chena – IES Aguilar y Cano - Estepa Cambios en la temperatura N2 3H2 2 NH 3 H =−92,2 kJ 3 Equilibrio químico JMLC - Chena – IES Aguilar y Cano - Estepa Cambios en la temperatura N2 3H2 2 NH 3 H =−92,2 kJ Aumenta AumentalalaTT Proceso Procesoendotérmico endotérmico Disminuye DisminuyelalaTT Proceso Procesoexotérmico exotérmico 3 Equilibrio químico JMLC - Chena – IES Aguilar y Cano - Estepa Cambios en la temperatura N2 3H2 2 NH 3 K'p H ln = Kp R 0 H =−92,2 kJ 0 1 1 − T T'









