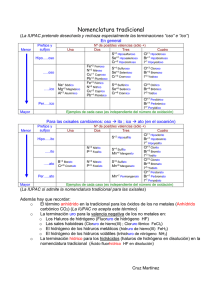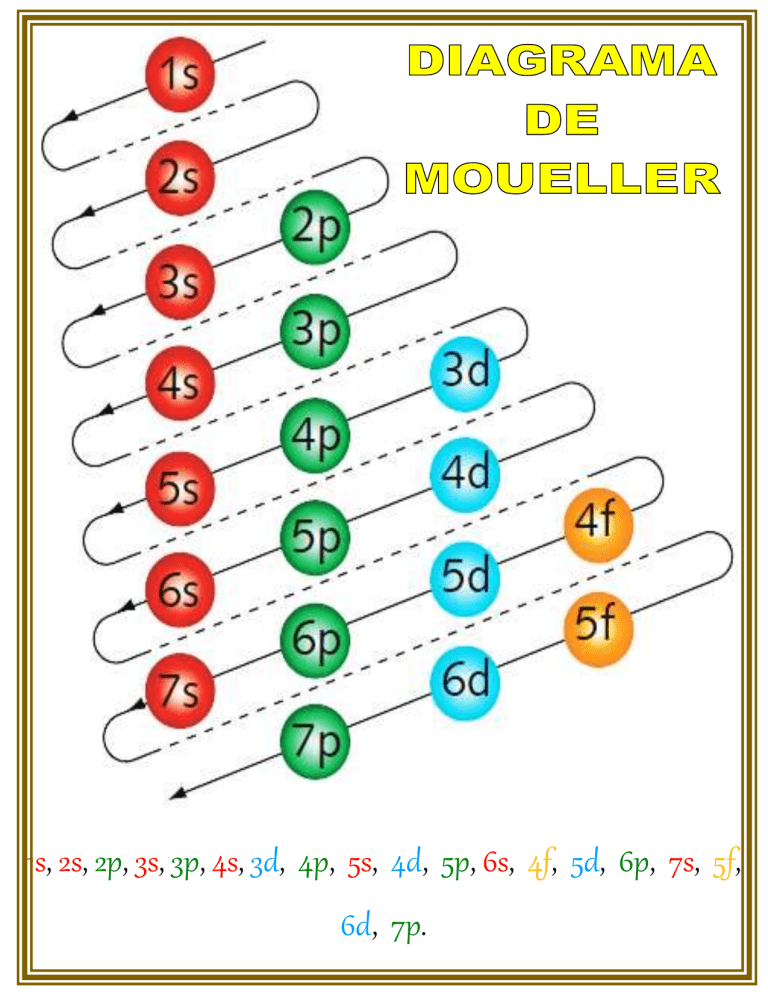
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p. Notación de los Elementos: los elementos se respetan mediante los símbolos. Símbolo: Son abreviatura de los nombres de los elementos. Cada símbolo representa un solo átomo y tiene valor universal, y consta de una o dos letras siendo la primera MAYUSCULA y la segunda MINUSCULA. a) Elementos que tienen como símbolo la primera letra de su nombre que necesariamente debe de ser MAYUSCULA tales como: Boro B Carbono C Flúor F Nitrógeno N Oxigeno O Hidrogeno H b) Elementos que tienen la misma letra inicial se diferencian en su símbolo añadiendo a la letra inicial MAYUSCULA una segunda letra MINUSCULA. No existen símbolos con mas de dos letras. Actinio Ac Aluminio Al Argón Ar Astato At Arsénico As Americio Am Son compuestos binarios que forman al combinarse un metal con el hidrogeno que trabaja con el numero de oxidación de -1 METAL + HIDROGENO → HIDRURO METALICO Nomenclatura tradicional.- Se antepone la palabra genérica hidruro seguido del nombre del metal correspondiente, si tiene una sola valencia. Si el metal tiene dos valencias, se utilizan las terminaciones oso para la menor, ico para la mayor valencia. Ejemplos: CoH3 Hidruro cobáltico MgH2 Hidruro de magnesio Nomenclatura Stock.- Se escribe la palabra hidruro de y luego el nombre del metal, seguido de su valencia en números romanos entre paréntesis. Si el metal tiene una sola valencia, se quita el paréntesis y el número romano Ejemplos: CoH3 Hidruro de cobalto (III) MgH2 Hidruro de magnesio (II) Nomenclatura sistemática de la IUPAC.- Se usan los prefijos: mono, di, tri, etc. para indicar el número de átomos de cada elemento. Ejemplos: CoH3 Trihidruro de cobalto MgH2 Dihidruro de magnesio Son compuestos formados por HIDRÓGENO y un NO METAL de los grupos 6A y 7A. El hidrógeno presenta un estado de oxidación 1+ por lo que el no metal tomará un estado de oxidación negativo, para conservar la neutralidad del compuesto. Estos compuestos se encuentran en forma natural en estado gaseoso. Se les llama hidrácidos debido a que al disolverse en agua y disociarse generan soluciones ácidas. Nomenclatura tradicional.- Se nombra como en sistemática si están estado gaseoso pero si el gas disuelve en agua, al producir disoluciones ácidas, nombran con la palabra ácido seguida de la raíz del metal terminada en -hídrico. Ejemplos: HF Ácido fluorhídrico HCl Ácido clorhídrico H2S Ácido sulfhídrico H2Te Ácido telurhídrico la se se no Nomenclatura sistemática de la IUPAC.- Se empieza con el nombre del no metal terminado en uro, la preposición de hidrógeno. Ejemplos: HF HCl H2S Fluoruro de hidrógeno Cloruro de hidrógeno Sulfuro de hidrógeno COMPUESTOS BINARIOS CON NOMBRE PROPIO: Existen compuestos binarios formados por un no metal y el hidrógeno que tienen nombres propios. Estos compuestos que no se pueden considerar hidrácidos pues cuando se disuelven en agua no producen soluciones ácidas. El amoníaco, por ejemplo, al disolverse en agua produce una solución alcalina. Nomenclatura tradicional. - Todos tienen nombres especiales. BH3 Borano B2H6 Diborano CH4 Metano SiH4 Silano Si2H6 Disilano AsH3 Arsina PH3 Fosfina NH3 Amoníaco Nomenclatura sistemática de la IUPAC.- Se empieza con el nombre genérico hidruro precedido de los prefijos: mono, di, tri, etc. para indicar el número de hidrógenos presentes y elemento no metal , la preposición de y el nombre del no metal con su prefijo multiplicativo correspondiente. BH3 B2H6 CH4 SiH4 Si2H6 AsH3 PH3 NH3 Trihidruro de boro Hexahidruro de diboro Tetrahidruro de carbono Tetrahidruro de silicio Hexahidruro de disilicio Trihidruro de arsénico Trihidruro de fósforo Trihidruro de nitrógeno VALENCIA ESTADO DE OXIDACION PREFIJO SUFIJO Uno Único - ICO o el nombre del elemento OSO ICO OSO OSO ICO OSO OSO ICO ICO HIDRICO URO Menor Mayor Mínima HIPO Tres Menor Mayor Mínima HIPO Menor Cuatro Mayor Máxima PER Significa valencia negativa sin oxigeno Significa valencia negativa sin oxigeno Dos mono di o bi tri tetra penta hexa 1 2 3 4 5 6 hepta octa nona deca undeca dodeca 7 8 9 10 11 12 La UNIÓN INTERNACIONAL DE QUÍMICA PURA Y APLICADA, más conocida por sus siglas en inglés IUPAC (International Union of Pure and Applied Chemistry), es un grupo de trabajo que tiene como miembros a las sociedades nacionales de química.