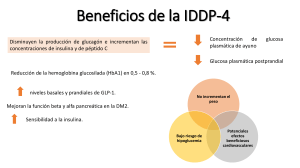
La insulina recombinante es insulina producida con el uso de la tecnología de ADN recombinante, donde los recortes del ADN se insertan en organismos para animarles a que produzcan las proteínas medicamente útiles. La insulina es el primer caso de proteínas producidas por ingeniería genética aprobada para uso en humanos, desde 1982. En la actualidad varios laboratorios farmacéuticos producen insulina humana, tanto a partir de bacterias como de bacterias como de levaduras y sin ningún riesgo para la salud. La diabetes se trata con insulina obtenida por ingeniería genética, un medicamento biológico idéntico a la insulina humana. Fue el primer medicamento biotecnológico y se usa con éxito desde los años 80, que consiste en inyectar insulina externa, para lograr nivelar el nivel de glucosa en la sangre (Chanfrau, 2011). 60 años después del primer ensayo realizado en humanos, la insulina que se administraba a los diabéticos se obtenía de vacas y cerdos, con un efecto muy similar al producido por la variante humana, pero también con numerosos problemas de tipo alérgico derivados de la impurezas con las que se obtenia, como por ejemplo erupciones cutáneas. En 1963, la insulina se convirtió en la primera proteína en ser sintetizada in vitro, por Meinhofer y colaboradores. En 1978, gracias al desarrollo de la ingeniería genética se consigue la síntesis de insulina mediante técnica biotecnológicas. El procedimiento llevado a cabo fue muy ingeniosos, utilizando las bacterias Escherichia coli (E. coli) como factorías en miniatura para producir de forma separada las cadenas A y B de la insulina humana, introduciendo para ello los genes que las codifican en las bacteria mediante un vector (pBR322). Posteriormente se lleva a cabo la purificación, plegamiento y unión in vitro de las cadenas, mediante la oxidación de las cisteínas para formar los puentes de disulfuros de la proteína activa. El resultado fue una insulina humana (comercialmente denominada Humulin) siendo la primera proteína recombinante aprobada como medicamento. (Planelles, 2012) Introducción. La insulina humana es una proteína compuesta por 51 aminoácidos con un peso molecular de 5808 Da, que es producida por las células β del páncreas, y juega un rol esencial en la regulación del metabolismo de glúcidos y grasas. Se sintetiza como preproinsulina y se dirige por un péptido, señal que lleva incorporado en su secuencia al retículo endoplasmático. (M & Redwam., 2014) La primera fue clonada en 1978 y la segunda en 1979 en Escherichia coli para facilitar su expresión; y precisamente la primera licencia obtenida para un producto obtenido a través de la tecnología del DNA recombinante fue la de la insulina, desarrollada por Genetech y licenciada y llevada al mercado por Eli Lily en 1982. Previamente al desarrollo de la tecnología del DNA recombinante, los pacientes diabéticos, ya desde los años veinte, eran tratados con insulina, la cual se purificaba del páncreas de vacas y cerdos. Actualmente, la insulina humana recombinante tiene múltiples plataformas de expresión siendo las más desatacadas la ya mencionada Escherichia coli, y la levadura Saccharomyces cerevisiae. (A & Baeshen, 2012). Material y métodos Se prepararon diluciones (rango 20–1.000 mU/l) de glulisina, detemir, insulina soluble e insulina NPH. Se analizaron con los inmunoanálisis de insulina Elecsys/E170 (Roche) y Architect (Abbott). Se calculó la reactividad cruzada (%) para cada dilución.