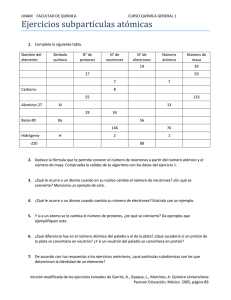
S.E.P. S.E.S. T.N.M. INSTITUTO TECNOLOGICO DE AGUASCALIENTES SUBDIRECCIÓN ACADEMICA Evidencias 1er unidad Fundamentos de Química Fecha: 9 de septiembre del 2019 Alumno: Abraham Cortez Hernández Maestra: M en P Amelia Vidales Olivo Química La Química es la ciencia que estudia la estructura, la composición y las propiedades de la materia, así como las transformaciones que ésta experimenta durante las reacciones químicas. “La química y sus aplicaciones”. Universidad Ramon Llull. 2015 Materia ¿Qué es la materia? Llamamos materia a todo aquello que ocupa un lugar determinado en el universo, posee una cantidad determinada de energía y está sujeto a interacciones y cambios en el tiempo, que pueden ser medidas. Desde un punto de vista químico, la materia es el conjunto de los elementos constituyentes de la realidad perceptible, o sea, lo que constituye las cosas a nuestro alrededor y a nosotros mismos. Entre las principales propiedades químicas de la materia están: - - - - El pH. La corrosividad de los ácidos y la causticidad de las bases tiene que ver con el pH de la materia, o sea, su nivel de acidez o alcalinidad, su capacidad de donar o recibir electrones cuando está en contacto con ciertos materiales, como los metales o como la materia orgánica. La reactividad. De acuerdo a su constitución atómica, la materia puede ser más o menos reactiva, es decir, más o menos propensa a combinarse con otras sustancias. En el caso de las formas más reactivas, como los metales cesio (Ce) y francio (Fr), es raro verlos en formas puras, casi siempre son parte de compuestos con otros elementos. Inflamabilidad. Algunas sustancias pueden inflamarse, es decir, generar una explosión de calor que conduce a las llamas, en presencia de una fuente de calor o en reacción con otras sustancias. Radiactividad. No todos los átomos de la materia son estables. Algunos adquieren formas inestables que liberan partículas u ondas de energía, en forma de radiación ionizante, altamente peligrosa para la vida. Esto es la radiactividad. Entre las principales propiedades físicas de la materia están: - - Temperatura. La temperatura es el grado de energía cinética que presentan las partículas de un material. Estado de agregación. La materia puede aparecer en tres “estados por su temperatura o la presión a la que esté sometida. Estos tres estados son: sólido (partículas muy juntas, baja energía cinética), líquido (partículas menos juntas, energía cinética suficiente para que fluya la materia, sin separarse del todo) y gaseoso (partículas muy alejadas, alta energía cinética). Conductibilidad. Existen dos formas de conductibilidad: la térmica (calor) y la eléctrica y en ambos casos se trata de la capacidad de los materiales de permitir el tránsito de la energía a través de sus partículas. Los materiales de alta conductibilidad se conocen como conductores, a los de baja conductibilidad como semiconductores y a los de nula conductibilidad como aislantes. - Punto de fusión. Es el grado de temperatura en que un sólido puede cambiar de estado de agregación y tornarse líquido. Punto de ebullición. Es el grado de temperatura en que un líquido puede cambiar de estado de agregación y tornarse gaseoso. "Materia". Autor: María Estela Raffino. Para: Concepto de. Átomo El átomo es una estructura en la cual se organiza la materia en el mundo físico o en la naturaleza. Los átomos forman las moléculas, mientras que los átomos a su vez están formados por constituyentes subatómicos como los protones (con carga positiva), los neutrones (sin carga) y los electrones. (con carga negativa) Partes de un átomo Distinguimos dos partes de un átomo: núcleo y corteza. El núcleo es la parte central de la estructura del átomo. En la parte del núcleo se encuentran los protones (partículas con carga positiva) y los neutrones (partículas sin carga eléctrica). En la corteza, la parte exterior del átomo se encuentran los electrones (partículas con carga eléctrica negativa). Los protones, neutrones y electrones son las partículas subatómicas que forman la estructura del átomo. Lo que diferencia a un átomo de otro es la relación que se establecen entre ellas. Los electrones, de carga negativa, son las partículas subatómicas más ligeras. Los protones, de carga positiva, pesan unas 1.836 veces más que los electrones. Los neutrones, los únicos que no tienen carga eléctrica, pesan aproximadamente lo mismo que los protones. Los protones y neutrones se encuentran agrupados en la parte central del átomo formado el núcleo atómico. Por este motivo también se les llama nucleones. De este modo, la parte central del átomo, el núcleo atómico, tiene una carga positiva en la que se concentra casi toda su masa, mientras que en el escorzo alrededor del núcleo atómico hay un cierto número de electrones, cargados negativamente. La carga total del núcleo atómico (positiva) es igual a la carga negativa de los electrones, de modo que la carga eléctrica total del átomo sea neutra. Átomo. Energía nuclear. Castillo. 19 de abril de 2019 Elemento Un elemento químico es una sustancia pura (o especie química definida) cuyas propiedades intrínsecas lo diferencian de otros elementos. Por ejemplo: el elemento oro tiene unas propiedades que son diferentes a las del elemento hierro o el elemento oxígeno. Sustancia constituida por átomos cuyos núcleos tienen el mismo número de protones, cualquiera que sea el número de neutrones. RAE. RAE. 2019 Compuesto Un compuesto químico es una sustancia formada por la unión de dos o más elementos de la tabla periódica,[1] en una razón fija. Una característica esencial es que tiene una fórmula química. Por ejemplo, el agua es un compuesto formado por hidrógeno y oxígeno en la razón de 2 a 1 (en número de átomos). Física y Química. Dulce María Andrés Cabrerizo, Dulce María Andrés. 2019 Mezcla Una mezcla resulta de la combinación de dos o más sustancias donde la identidad básica de cada una no se altera, es decir, no pierden sus propiedades y características por el hecho de mezclarse, porque al hacerlo no ocurre ninguna reacción química. Homogénea Las mezclas homogéneas se llaman también disoluciones. Tienen una apariencia totalmente uniforme por lo que sus componentes no pueden distinguirse a simple vista. Se dice que este tipo de mezclas tiene una sola fase. En química se denomina fase a una porción de materia con composición y propiedades uniformes. Por ejemplo, el agua de mar está formada por agua y muchas sales solubles, donde se observa una sola fase. Heterogénea Las mezclas heterogéneas presentan una composición no uniforme, sus componentes pueden distinguirse a simple vista, en otras palabras, se observan diferentes sustancias en la mezcla. Los componentes de este tipo de mezcla existen como regiones distintas que se llaman fases. Una mezcla heterogénea se compone de dos o más fases. Si observas la piedra de granito, puedes ver zonas de distinto color que indican que la roca está formada de cristales de distintas sustancias. Clasificación de la materia. José Enrique Garza González. UNAM. 2019 Coloides Los coloides son mezclas heterogéneas de por lo menos dos fases diferentes con la materia de una de las fases en forma finamente dividida (sólido, líquido o gas), denominada fase dispersa, mezclada con la fase continua (sólido, líquido o gas), denominada medio de dispersión. Fenómenos. Fenómenos físicos o cambios físicos: Son procesos en los que no cambia la naturaleza de las sustancias ni se forman otras nuevas. Ejemplos: Cambios de estado: Si aplicamos una fuente de calor de forma constante, el agua hierve y se transforma en vapor de agua. (En ambos casos, la sustancia implicada en el proceso es agua que, en un caso está líquida y en el otro está gaseosa; esto es, sus partículas están ordenadas de diferente manera según la teoría cinética de la materia). Mezclas: Si disolvemos sal en agua observaremos que la sal se disuelve fácilmente en agua y la disolución resultante presenta un gusto salado. (Las sustancias iniciales - sal y agua - siguen presentes al final; este hecho es demostrable pues si calentamos la disolución hasta que hierva el agua, nos queda la sal en el fondo). Fenómenos o Cambios Químicos: Son procesos en los que cambia la naturaleza de las sustancias, además de formarse otras nuevas. Ejemplos: Combustión: Si quemamos un papel, se transforma en cenizas y, durante el proceso, se desprende humo. (Inicialmente, tendríamos papel y oxígeno, al concluir el cambio químico tenemos cenizas y dióxido de carbono, sustancias diferentes a las iniciales). Corrosión: Si dejamos un trozo de hierro a la intemperie, se oxida y pierde sus propiedades iniciales. (Las sustancias iniciales serían hierro y oxígeno, la sustancia final es óxido de hierro, con unas propiedades totalmente diferentes a las de las sustancias iniciales). “Fenómenos”. La ciencia. Ismael L. 2008 Isótopo Los isótopos son átomos cuyos núcleos atómicos tienen el mismo número de protones pero diferente número de neutrones. No todos los átomos de un mismo elemento son idénticos y cada una de estas variedades corresponde a un isótopo diferente. Cada isótopo de un mismo elemento tiene el mismo número atómico (Z) pero cada uno tiene un número másico diferente (A). El número atómico corresponde al protones en el núcleo atómico del átomo. El número másico corresponde a la suma de neutrones y protones del núcleo. Esto significa que los diferentes isótopos de un mismo átomo se diferencian entre ellos únicamente por el número de neutrones. Los isótopos ligeros (con pocos protones y neutrones) tienen a igualar la cantidad de neutrones y protones, mientras que los isótopos pesados suelen tener más neutrones que protones. Que cada isótopo de un mismo elemento tenga el mismo número atómico significa que tienen el mismo número de protones en el núcleo atómico. Los átomos de un mismo elemento tienen el mismo número de protones y de electrones, pero pueden tener diferente número de neutrones. Se pueden encontrar isótopos con exceso o carencia de neutrones. Estos átomos pueden existir durante algún tiempo, pero son inestables. Los átomos inestables son radioactivos: sus núcleos cambian o se desintegran emitiendo radiaciones. Isótopo. Energía nuclear. Castillo. 2 de noviembre, 2016. CUESTIONARIO DE LA UNIDAD Identifique si los siguientes son elementos, compuestos o mezclas: leche(coloide), oro(Elementos) , sal común(compuesto), tinta(mezcla), jugo(mezcla), aire(mezcla) , refresco(mezcla), arena de mar(mezcla), agua de mar(mezcla), hidrógeno(Elemento) , oxígeno (elemento), fierro(elemento), acero inoxidable(compuesto), alcohol(mezcla), yogurt(coloide). Dentro del paréntesis escribe una F si el fenómeno es físico o una Q si es químico. (F) El movimiento de los cuerpos. (Q) La acción del aire húmedo sobre el fierro. (Q) La combustión del magnesio. (F) Estirar una liga. (Q) El cambio que presenta la leche al agriarse. (F) El paso de la corriente eléctrica por un alambre. (Q) La combustión del cerillo. (F) Doblar un alambre. (F) Cortar la madera. (F) Solidificación del agua. (Q) La Fusión de la parafina. Llene los espacios vacíos, con un el nombre del material, según el estado que pide. SÓLIDAS 1. Sal de mesa 2. Diamante 3. Hielo 4. Ámbar 5. Azufre 6. Cuarzo 7. Perlas 8. Hierro 9. Azúcar 10. Plásticos duros LIQUIDAS 1. Agua 2. Glicerina 3. Acetona 4. Leche 5. Formol 6. Vinagre 7. Metal fundido 8. Aceite comestible 9. Aceite de girasol 10. Jugos de frutas GASEOSAS 1. Oxígeno 2. Hidrógeno 3. Vapor de agua 4. Nitrógeno 5. Argón 6. Helio 7. Monóxido de carbono 8. Cloro 9. Flúor 10. Butano