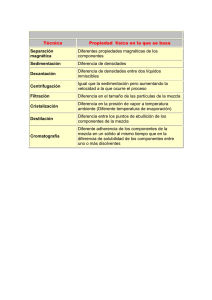
FICHA DE IDENTIFICACIÓN DE TRABAJO DE INVESTIGACIÓN Título Autor/es Fecha Carrera Asignatura Grupo Docente Periodo Académico Subsede DENSIDAD Nombres y Apellidos RUTH RENJIFO CONDE JOSE CRUZ SALAMANCA BELEN NOEMI SALTO TORREZ 02/11/2019 Bioquímica y farmacia Química A1 Yenni Ximena Chambi Delgado II/2019 LA PAZ Código de estudiantes 61615 62070 61416 Título: DENSIDADES Autor/es: RENJIFO, CRUZ, SALTO Copyright © (2019) por (RENJIFO, CRUZ, SALTO). Todos los derechos reservados. . RESUMEN: El líquido es uno de los tres estados de agregación de la materia. Un líquido es un fluido (además de los gases) cuyo volumen es constante bajo condiciones de temperatura y presión constantes. Las moléculas de los líquidos y gases no se mantienen en posiciones fijas, como ocurre con los sólidos, se pueden mover libremente deslizándose unas sobre otras y esto impide que la materia en dichos estados tenga forma propia; por lo cual un líquido toma la forma del recipiente que lo contiene. Esta diferencia entre sólidos y líquidos se debe a la fuerza de unión entre sus moléculas. En los sólidos dicha fuerza es lo suficientemente grande para mantenerlas en una misma posición, en los líquidos es muy débil para dejarlas fijas, aunque lo suficientemente grande para mantenerlas unidas. Palabras clave: Viscosidad, tensión superficial, cohesión, adhesión, densidad, ABSTRACT: The liquid is one of three conditions of aggregation of the matter. A liquid is a fluid (besides the gases) whose volume is constant under constant conditions of temperature and pressure. The molecules of the liquids and gases are not kept in fixed positions, since it happens with the solid ones, can move freely slipping some on others and this prevents that the matter in the above mentioned conditions has own form; for which a liquid takes the form of the container that contains it. This difference between solid and liquid owes by force of union between his molecules. In the solid ones the above mentioned force is the sufficiently big thing to support them in the same position, in the liquids it is very weak to make them fixed, though the sufficiently big thing to keep them close Key words: Viscosity, superficial tension, cohesion, adhesion, density, relative density Asignatura: QUIMICA GENERAL E INORGANICA Carrera: BIOQUIMICA Y FARMACIA Página 2 de 31 Título: DENSIDADES Autor/es: RENJIFO, CRUZ, SALTO Tabla De Contenidos Introducción ............................................................................................................................... 4 Capítulo 1. Planteamiento del Problema .................................................................................... 5 1.1. Formulación del Problema ........................................................................................ 5 1.2. Objetivos ................................................................................................................... 5 1.3. Justificación .............................................................................................................. 5 1.4. Planteamiento de hipótesis ........................................................................................ 5 Capítulo 2. Marco Teórico ......................................................................................................... 6 2.1 Área de estudio/campo de investigación ...................................................................... 6 2.2 Desarrollo del marco teórico ........................................................................................ 6 Procedimiento experimental.- .................................................................................................. 13 Primer experimento .- comparación de densidad de aceite y agua .......................................... 14 Segundo experimento.-Comparación de densidades entre aceite, agua, alcohol y miel ( juego de colores) ..................................................................................................................................... 17 Capítulo 3. Método................................................................................................................... 21 3.1 Tipo de Investigación ................................................................................................. 21 3.2 Técnicas de Investigación ........................................................................................... 21 3.3 Cronograma de actividades por realizar ..................................................................... 21 Capítulo 4. Resultados y Discusión ......................................................................................... 22 Capítulo 5. Conclusiones ......................................................................................................... 23 RECOMENDACIONES .......................................................................................................... 24 Referencias ............................................................................................................................... 25 Asignatura: QUIMICA GENERAL E INORGANICA Carrera: BIOQUIMICA Y FARMACIA Página 3 de 31 Título: DENSIDADES Autor/es: RENJIFO, CRUZ, SALTO Introducción La densidad de una sustancia homogénea es una propiedad física que la caracteriza y está definida como el cociente entre la masa y el volumen de la sustancia que se trate. Esta propiedad depende de la temperatura, por lo que al medir la densidad de una sustancia se debe considerar la temperatura a la cual se realiza la medición. En el caso de sustancias no homogéneas lo que obtenemos al dividir la masa y el volumen es la densidad promedio. Por otra parte, si se desea determinar con mayor precisión la densidad de una sustancia liquida. Esto nos sirve para comparar las densidades de entre líquidos diferentes, basta con pesar con cada líquido por separado y comparando sus masas. Es usual comparar la densidad de un líquido respecto a la densidad del agua pura a una temperatura determinada, por lo que al dividir la masa de un líquido dentro de la masa correspondiente de agua, obtendremos la densidad relativa del líquido respecto a la del agua a la temperatura de medición , los cambios de concentración de sales en el agua, por lo que se usa para determinar la salinidad del agua, la densidad de líquidos biológicos en laboratorios de análisis clínicos, entre otras aplicaciones. El propósito de este informe es con el objetivo de demostrar lo aprendido en el laboratorio de química El informe que a continuación presentamos contiene la teoría necesaria para el entendimiento de dicho tema y del desarrollo de la práctica que tiene como tema la densidad de liquidos. Para encontrar la densidad hicimos uso de la siguiente expresión: densidad = masa/ volumen. Se hizo uso de diferentes métodos para determinar la densidad de materiales y liquidos. Para llevar a cabo la densidad relativa de los sólidos y líquidos utilizamos como referencia la densidad del agua. Asignatura: QUIMICA GENERAL E INORGANICA Carrera: BIOQUIMICA Y FARMACIA Página 4 de 31 Título: DENSIDADES Autor/es: RENJIFO, CRUZ, SALTO Capítulo 1. Planteamiento del Problema 1.1. Formulación del Problema Plantea el problema y la magnitud del mismo y a partir de ello elabora la pregunta general de investigación. 1.2. Objetivos Objetivo General: Nuestro objetivo fue observar la densidad de distintas disoluciones y como influya la manera en que están acomodadas. Objetivos Específicos: 1.- Identificar El Principios Básicos De La Densidad, Conceptos Generales Y Medidas 2.- Determinar La Variación De La Densidad De Diferentes Líquidos 3.-Discutir, A Partir De Los Resultados Experimentales 4.-Identificar Las Variables Que Afectan Las Mediciones A Realizar Para Determinar La Densidad 1.3. Justificación La densidad es una propiedad básica de cualquier líquido, y se define como la masa por unidad de volumen. En este trabajo investigativo donde se muestra un método sencillo de determinación de la densidad de un líquido, a través de la utilización métodos ideado con este fin. Se va a describir el procedimiento experimental, así como los cálculos necesarios para obtener finalmente la densidad del líquido ensayado. 1.4. Planteamiento de hipótesis - Si la densidad un cuerpo es menor que de un líquido, el cuerpo flotara - Su relación es masa / volumen - Si la densidad de un objeto en mayor que un liquido , este se hundirá Asignatura: QUIMICA GENERAL E INORGANICA Carrera: BIOQUIMICA Y FARMACIA Página 5 de 31 Título: DENSIDADES Autor/es: RENJIFO, CRUZ, SALTO Capítulo 2. Marco Teórico 2.1 Área de estudio/campo de investigación /Investigación experimental / química 2.2 Desarrollo del marco teórico 2.3 Historia en la relación a la densidad Según una historia popular, Arquímedes recibió el encargo de determinar si el orfebre de Hierón II de Siracusa desfalcaba el oro durante la fabricación de una corona dedicada a los dioses, sustituyéndolo por otro metal más barato (proceso conocido como aleación).1 Arquímedes sabía que la corona, de forma irregular, podría ser aplastada o fundida en un cubo cuyo volumen se podía calcular fácilmente comparado con la masa. Pero el rey no estaba de acuerdo con estos métodos, pues habrían supuesto la destrucción de la corona del rey. Arquímedes se dio un relajante baño de inmersión, y observando la subida del agua caliente cuando él entraba en ella, descubrió que podía calcular el volumen de la corona de oro mediante el desplazamiento del agua. Hallado el volumen, se podía multiplicar por la densidad del oro hallando el peso que debería tener si fuera de oro puro (la densidad del oro es muy alta, 19 300 kg/m³, y cualquier otro metal, aleado con él, la tiene menor), luego si el peso no fuera el que correspondería si fuera de oro, significaría que la corona tendría aleación de otro metal. Supuestamente, al hacer este descubrimiento salió corriendo desnudo por las calles gritando: «¡Eureka! ¡Eureka!» (Εύρηκα! en griego, que significa: «Lo encontré»). Como resultado, el término "Eureka» entró en el lenguaje común, y se utiliza hoy para indicar un momento de iluminación. La historia apareció por primera vez de forma escrita en De Architectura, de Marco Vitruvio, dos siglos después de que supuestamente tuviese lugar.2 Sin embargo, algunos estudiosos han Asignatura: QUIMICA GENERAL E INORGANICA Carrera: BIOQUIMICA Y FARMACIA Página 6 de 31 Título: DENSIDADES Autor/es: RENJIFO, CRUZ, SALTO dudado de la veracidad de este relato, diciendo (entre otras cosas) que el método habría exigido medidas exactas que habrían sido difíciles de hacer en ese momento.34 Otra versión de la historia dice que Arquímedes notó que experimentaba un empuje hacia arriba al estar sumergido en el agua, y pensó que, pesando la corona, sumergida en agua, y en el otro platillo de la balanza poniendo el mismo peso en oro, también sumergido, la balanza estaría equilibrada si la corona era, efectivamente, de oro. Ciertamente, el empuje hacia arriba del agua sería igual si en los dos platillos había objetos del mismo volumen y el mismo peso. Con ello, la dificultad de conocer con exactitud el volumen del sólido de forma irregular, en la época, se dejaba de lado. De esta otra versión nació la idea del principio de Arquímedes. Mucho más tarde, nació el concepto de densidad entre los científicos, en tiempos en que las unidades de medida eran distintas en cada país. Para evitar expresarlo en términos de las diversas unidades de medida usuales para cada cual, y no tener que hacer las necesarias conversiones, los físicos asignaron a cada materia un número, adimensional, que era la relación entre la masa de esa materia y la de un volumen igual de agua pura, sustancia que se encontraba en cualquier laboratorio (densidad relativa). Cuando se fijó la unidad de peso en el sistema métrico decimal, el kilogramo, como un decímetro cúbico (un litro) de agua pura, la cifra empleada hasta entonces, coincidió con la densidad absoluta (si se mide en kilogramos por litro, unidad de volumen en el viejo sistema métrico decimal, aunque aceptada por el SI, y no en kilogramos por metro cúbico, que es la unidad de volumen en el SI). En física y química, la densidad (del latín densĭtas, -ātis) es una magnitud escalar referida a la cantidad de masa en un determinado volumen de una sustancia o un objeto sólido. Usualmente se simboliza mediante la letra rho ρ del alfabeto griego. La densidad media es la relación entre la masa de un cuerpo y el volumen que ocupa en el espacio exterior. Asignatura: QUIMICA GENERAL E INORGANICA Carrera: BIOQUIMICA Y FARMACIA Página 7 de 31 Título: DENSIDADES Autor/es: RENJIFO, CRUZ, SALTO Si un cuerpo no tiene una distribución uniforme de la masa en todos sus puntos, la densidad alrededor de un punto dado puede diferir de la densidad media. Si se considera una sucesión de pequeños volúmenes decrecientes (convergiendo hacia un volumen muy pequeño) centrados alrededor de un punto, siendo la masa contenida en cada uno de los volúmenes anteriores, la densidad en el punto común a todos estos volúmenes es: La unidad es kg/m³ en el SI. Como ejemplo, un objeto de plomo es más denso que otro de corcho, con independencia del tamaño y masa. Definición de densidad absoluta: La densidad o densidad absoluta es la magnitud que expresa la relación entre la masa y el volumen de un cuerpo. Su unidad en el Sistema Internacional es el kilogramo por metro cúbico (kg/m3), aunque frecuentemente se expresa en g/cm3. La densidad es una magnitud intensiva Definición de gravedad específica: Relación entre la densidad de una sustancia y la de otra, tomada como patrón, generalmente para sólidos y líquidos se emplea el agua destilada y para gases, el aire o el hidrógeno. También llamada peso específico. La gravedad específica es una medida relativa de la densidad de un elemento y dependerá de la concentración de masa por unidad de volumen de cada elemento. Dicha concentración de masa estará afectada por la estructura tridimensional molecular y número másico de los átomos. Asignatura: QUIMICA GENERAL E INORGANICA Carrera: BIOQUIMICA Y FARMACIA Página 8 de 31 Título: DENSIDADES Autor/es: RENJIFO, CRUZ, SALTO Medición de densidad La densidad puede obtenerse de forma indirecta y de forma directa. Para la obtención indirecta de la densidad, se miden la masa y el volumen por separado y posteriormente se calcula la densidad. La masa se mide habitualmente con una balanza, mientras que el volumen puede medirse determinando la forma del objeto y midiendo las dimensiones apropiadas o mediante el desplazamiento de un líquido, entre otros métodos. Entre los instrumentos más comunes para la medida de densidades tenemos: El densímetro, que permite la medida directa de la densidad de un líquido El picnómetro, que permite la medida precisa de la densidad de sólidos, líquidos y gases picnómetro de gas. La balanza hidrostática, que permite calcular densidades de sólidos. La balanza de Mohr (variante de balanza hidrostática), que permite la medida precisa de la densidad de líquidos. Otra posibilidad para determinar las densidades de líquidos y gases es utilizar un instrumento digital basado en el principio del tubo en U oscilante Variables que influyen en la densidad Son el peso del objeto y el volumen que ocupa en el espacio, también llega a influir la presión ambiental y la temperatura, debido a que estos dos últimos pueden llegar a variar el volumen del objeto. Es muy fácil alterar la densidad de un gas, o incluso de un líquido, simplemente aumentando la presión (reduciendo el volumen) a la que estén sometidos, pero es complicado cambiar la densidad de un sólido. Medida de la densidad de un líquido Conocida la masa del cuerpo y el volumen de la parte sumergida, podemos determinar la densidad del líquido. En esto se basan los aerómetros o flotadores de masa conocida que se sumergen en el líquido de densidad desconocida. Disponen de una escala graduada, que nos proporcionan mediante lectura directa la densidad del líquido. La superficie libre del líquido marca el valor de la densidad en la escala del aerómetro. Asignatura: QUIMICA GENERAL E INORGANICA Carrera: BIOQUIMICA Y FARMACIA Página 9 de 31 Título: DENSIDADES Autor/es: RENJIFO, CRUZ, SALTO Dependiendo de la aplicación concreta los aerómetros reciben nombres específicos: alcohómetros, sacarímetros, etc. Nuestro aerómetro es un sólido de forma cilíndrica de 25 cm de altura y densidad 0.5 g/cm 3 que se sumerge parcialmente en el líquido cuya densidad se quiere determinar. Midiendo en la escala graduada la parte del cilindro que está sumergida podemos fácilmente determinar la densidad del fluido. El cuerpo está en equilibrio flotando en el líquido, bajo la acción de dos fuerzas, su peso y el empuje del fluido. Donde es la densidad del cuerpo sólido, S su sección, h su altura. f es la densidad del fluido y x la parte del sólido que está sumergido en el líquido. Medida de la densidad de un sólido Se ha estudiado el procedimiento de medida de la densidad de un cuerpo sólido, con una balanza ordinaria: Asignatura: QUIMICA GENERAL E INORGANICA Carrera: BIOQUIMICA Y FARMACIA Página 10 de 31 Título: DENSIDADES Autor/es: RENJIFO, CRUZ, SALTO 1. Se pesa el cuerpo sólido y se anota la lectura en gramos m=F de los indicadores de la balanza cuando su brazo está horizontal en equilibrio. 2. Se sumerge el cuerpo completamente en agua (densidad 1.0 g/cm3), y se anota la lectura F’ La diferencia V=F-F’ es el volumen del cuerpo expresado en cm3. La densidad es el cociente ρ=m/V (g/cm3) En esta sección, se mide la densidad ρ>1.0 de un cuerpo sólido por otro procedimiento, empleando una balanza electrónica. 1. Llenamos un recipiente parcialmente de agua y lo colocamos sobre una balanza electrónica, poniendo a cero el indicador del peso. 2. Atamos un hilo a un cuerpo sólido, lo sumergimos completamente en agua pero sin tocar el fondo, anotamos la lectura de la balanza V. 3. Soltamos el cuerpo, dejando de tirar del hilo, de modo que descanse en el fondo del recipiente, anotamos la lectura de la balanza m. Asignatura: QUIMICA GENERAL E INORGANICA Carrera: BIOQUIMICA Y FARMACIA Página 11 de 31 Título: DENSIDADES Autor/es: RENJIFO, CRUZ, SALTO La densidad del cuerpo es el cociente entre la segunda lectura y la primera. ρ=m/V DENSIDAD La densidad o densidad absoluta es la magnitud que expresa la relación entre la masa y el volumen de un cuerpo. Su unidad en el Sistema Internacional es el kilogramo por metro cúbico (kg/m3) los métodos que se utilizan para determinar la densidad en líquidos y sólido son: el densímetro, que permite la medida directa de la densidad de un líquido, el picnómetro, que permite la medida precisa de la densidad de sólidos, líquidos y gases picnómetro de gas, la balanza hidrostática, que permite calcular densidades de sólidos, la balanza de Mohr (variante de balanza hidrostática). La densidad de sustancias sólidas y liquidas varía en cantidades muy pequeñas con la temperatura, por lo cual generalmente se considera constante en un rango de temperatura de 0°C a 30°C. En cálculos muy precisos se debe considerar que la densidad disminuye al aumentar la temperatura, esto se debe a la dilatación o aumento de volumen que experimentan las sustancias al ser calentadas. APLICACIONES La densidad tanto en líquidos como en solido se lo aplica para saber cuánto pesas cada unidad de volumen de una sustancia, para calcular la relación masa-volumen de los cuerpos, Se ha tomado el agua como referente de 1 y de aquí por salen todas las demás densidades para las diferentes sustancias, la densidad es una medida utilizada por la física y la química para determinar la cantidad de masa contenida en un determinado volumen. Asignatura: QUIMICA GENERAL E INORGANICA Carrera: BIOQUIMICA Y FARMACIA Página 12 de 31 Título: DENSIDADES Autor/es: RENJIFO, CRUZ, SALTO Procedimiento experimental.- MATERIALES . 1.- probeta 2.- agitador /mezclador 3.-vaso precipitado 4.- vasos de vidrio 5.- colorantes Soluciones.- Agua - Aceite - Alcohol - Miel Asignatura: QUIMICA GENERAL E INORGANICA Carrera: BIOQUIMICA Y FARMACIA Página 13 de 31 Título: DENSIDADES Autor/es: RENJIFO, CRUZ, SALTO Primer experimento .- comparación de densidad de aceite y agua Procedimiento .1.- se vierte la primera solución ( aceite ) solo hasta la mitad del vaso. 2.- se vierte a segunda solución ( agua) hasta completar el vaso. 3.- se observa dicha reacción Por qué el agua y el aceite no se mezclan No importa cuánto lo mezcles, siempre volverá a quedar el aceite en gotas redondas sobre el agua.Cuando solemos mezclar agua con aceite, pensamos que ambos al ser líquidos se unirán y formarán una sustancia uniforme sin problema alguno. No obstante, cada sustancia contiene composiciones químicas diferentes entre sí, lo que hace que para estos dos sea imposible unificarse de manera homogénea. El aceite y el agua La composición química del aceite está formada principalmente por átomos de carbono e hidrógeno que se unen entre ellos. Además de esto, el aceite posee uniones no polares, por lo cual no posee fuerza de atracción. De igual forma, las moléculas de aceite son de mayor tamaño que las de agua. A diferencia del aceite, el agua posee moléculas dipolares, por lo cual está cargado de forma positiva y negativa. Además de esto, los enlaces que se forman en el agua son mucho más fuertes. Explicación química Químicamente, mezclar dos líquidos involucra principalmente mezclar sus moléculas, al poseer moléculas de estructuras diferentes, estas se hacen imposibles de mezclar como es el caso del agua y el aceite. Asignatura: QUIMICA GENERAL E INORGANICA Carrera: BIOQUIMICA Y FARMACIA Página 14 de 31 Título: DENSIDADES Autor/es: RENJIFO, CRUZ, SALTO A este fenómeno químico se le conoce como “líquidos inmiscibles”. De igual forma se presenta otro fenómeno llamado tensión superficial, el cual consiste en que los hidrógenos de una sustancia, comienzan a experimentar una tensión muy alta. En el caso del agua y el aceite, ambos líquidos experimentan tensiones superficiales altas, lo cual impide el paso de uno al otro líquido impidiendo que estos al mezclarse formen una sustancia uniforme. Cabe resaltar que la razón por la cual el aceite forma gotas redondas en el agua es debido a la tensión superficial, donde los hidrógenos forman una red, tratando de ocupar el menor espacio posible. De igual forma, para que dos líquidos pueden unificarse, sus enlaces químicos deben romperse, de manera que estos pueden unirse con las moléculas del nuevo líquido. Necesita mucha energía Dado que las moléculas del agua poseen enlaces dipolares y el aceite enlaces polares, el aceite necesitaría una gran cantidad de energía para poder romper las moléculas del agua y poder mezclarse. Además de poseer enlaces débiles, el aceite es un hidrófobo, lo cual quiere decir que sus moléculas no poseen carga, lo cual no permite que pueda unificarse con las sustancias que posean agua. Así como existen los hidrófobos, existen los hidrófilos, los cuales son sustancias que sus moléculas poseen una gran cantidad de carga, por lo cual sienten atracción por al agua y pueden mezclarse de forma rápida. No obstante, aún después de saber cómo se mezclan los líquidos, puedes preguntarte porque es el aceite el que flota y no el agua. Asignatura: QUIMICA GENERAL E INORGANICA Carrera: BIOQUIMICA Y FARMACIA Página 15 de 31 Título: DENSIDADES Autor/es: RENJIFO, CRUZ, SALTO En química hay algo que se conoce como la densidad de los elementos, la cual mide la masa de los elementos. En el caso del agua y el aceite, este último posee una menor densidad, permitiendo que este suba a la superficie y flote sobre el agua. No obstante, puedes modificar la densidad del aceite para que este posea una mayor y se sumerja en el agua, como por ejemplo con sal. De igual forma con químicos especiales, se podría lograr mezclar el aceite con el agua. Este fenómeno producido entre el aceite y el agua, es muy común y fácil de observar, además de esto por ser tan interesante también es utilizado en juegos y de forma decorativa como lo son las lámparas de lava. Asignatura: QUIMICA GENERAL E INORGANICA Carrera: BIOQUIMICA Y FARMACIA Página 16 de 31 Título: DENSIDADES Autor/es: RENJIFO, CRUZ, SALTO Segundo experimento.-Comparación de densidades entre aceite, agua, alcohol y miel ( juego de colores) La materia tiene propiedades y una de ellas es la densidad, que se define como la relación que existe entre la masa y el volumen de un cuerpo. Cuando se mezclan varios líquidos, las que tienen menor densidad tienden a ponerse encima de otro de mayor densidad. Para demostrar esta propiedad, vamos a hacer un experimento que demuestra que los líquidos tienen distintas densidades. Procedimiento Vierta los 25 ml de aceite en un probeta Inclina el probeta y añada la misma cantidad de agua con unas gotas de colorante azul, haciéndole caer por las paredes del vaso. Asignatura: QUIMICA GENERAL E INORGANICA Carrera: BIOQUIMICA Y FARMACIA Página 17 de 31 Título: DENSIDADES Autor/es: RENJIFO, CRUZ, SALTO Endereza el probeta y observa que el aceite flota encima del agua , porque es menos densa que ella y se forma una mezcla heterogénea de dos fases ( aceite y agua coloreada). Luego, añada los 25 ml de miel , inclinando en el probeta y haciéndole caer también por las paredes del probeta. Como se puede observar que las sustancias no se combinan, sino que se separan por diferencia de densidad de los líquidos, formándose una mezcla heterogénea de tres fases (miel, agua coloreada y aceite). Por último, añada el alcohol cuidadosamente, de a pocos, haciéndole caer también por las paredes el probeta. Como se observará no se combinan los líquidos, formándose un mezcla heterogénea de cuatro fases (miel, agua coloreada, alcohol y aceite). Asignatura: QUIMICA GENERAL E INORGANICA Carrera: BIOQUIMICA Y FARMACIA Página 18 de 31 Título: DENSIDADES Autor/es: RENJIFO, CRUZ, SALTO Puede ver el video: en archivo adjunto al trabajo de investigación La explicación de por qué no se mezclan Tiene que ver con la estructura molecular de los líquidos. Si los extremos de las moléculas de un líquido son afines con los del otro, se atraerán, “se pegarán” unas a otras formando una mezcla, como pasa con el alcohol y el agua. En cambio, si no hay atracción, las moléculas no se unen y el líquido menos denso quedará sobre el más denso, como en el caso del agua y el aceite. El agua, el alcohol, la miel son polares y pueden mezclarse entre sí. Asignatura: QUIMICA GENERAL E INORGANICA Carrera: BIOQUIMICA Y FARMACIA Página 19 de 31 Título: DENSIDADES Autor/es: RENJIFO, CRUZ, SALTO El aceite es apolar. La miel, y el agua se mantienen separados (si se hace con cuidado) por la diferencia de densidad. El agua y el aceite por ser polar y apolar y se “colocan” según densidad. El aceite y el alcohol se separan por la misma razón que el agua y el aceite. Si lo remueves todo, se mezcla todo lo polar y queda separado del aceite. Por ello es importante hacerlo con mucho cuidado y sobre todo divertirse en el proceso. Asignatura: QUIMICA GENERAL E INORGANICA Carrera: BIOQUIMICA Y FARMACIA Página 20 de 31 Título: DENSIDADES Autor/es: RENJIFO, CRUZ, SALTO Capítulo 3. Método 3.1 Tipo de Investigación Estudio Experimental 3.2 Técnicas de Investigación EXPERIMENTAL VARIABLES.- Peso de los objetos - Cantidad de sustancia usadas - Densidad de las sustancias 3.3 Cronograma de actividades por realizar Consiste en hacer una tabla en la que se distribuye el tiempo por etapas (meses, semanas, días) según la duración de la investigación Asignatura: QUIMICA GENERAL E INORGANICA Carrera: BIOQUIMICA Y FARMACIA Página 21 de 31 Título: DENSIDADES Autor/es: RENJIFO, CRUZ, SALTO Capítulo 4. Resultados y Discusión Todos los líquidos tienen una densidad de diferentes magnitudes o valores. Los que son menos densos permanecerán por encima de otros más densos y parecerán como si flotaran. En el experimento se demuestra que la miel es más densa que el agua y ésta que los dos líquidos que flotan sobre ella. Es decir, a menor densidad mayor flotación. Los objetos sólidos y líquidos menos densos que el agua flotan en ella siempre que no se mezclen. Un líquido menos denso flotará encima de otro más denso. Vamos a comprobar entonces que los líquidos de distintas densidades flotan uno encima de otro formando capas que no se mezclan entre si. PRECAUCIÓN: Tienes que ser muy cuidadoso, porque si no las disoluciones se mezclarán Un líquido ligero (menos denso) flotará encima de otro más pesado (más denso). No hay más que comparar una sustancia que tenga moléculas grandes y compactas con una segunda de moléculas pequeñas y espaciadas. La primera sustancia tendrá una masa mayor por volumen y por eso será más densa que la segunda. Como resultado final obtenemos una serie de bandas o capas en el vaso. Cada líquido forma una capa porque es menos denso que el líquido inferior y más que el superior. Si ahora introducimos un pequeño objeto, como una chincheta o una bolita, se hundirá hasta que encuentran un líquido de mayor densidad que la suya. Asignatura: QUIMICA GENERAL E INORGANICA Carrera: BIOQUIMICA Y FARMACIA Página 22 de 31 Título: DENSIDADES Autor/es: RENJIFO, CRUZ, SALTO Capítulo 5. Conclusiones Se llega a la conclusión que las soluciones o disoluciones resultan de mucha importancia ya que se realizan diariamente en nuestras labores cotidianas, porello nace la necesidad de estudiarlas, como se ha hecho en éste experimento. •La finalidad con la que se realizó la práctica se basaba en observar la solubilidad de los compuestos de la solución, lo cual queda demostrado en los cálculos realizados teniendo así que sí se cumple con el objetivo propuesto. •Por otro lado, se llegó a determinar que, a mayor cantidad de soluto presente en la disolución, mayor será su concentración (esto se evidencia con los respectivos cálculos) .•Finalmente podemos decir que para que la práctica se realice con éxito es necesario manejar los materiales de la manera más adecuada posible y más que todo ser éticos al momento de tomar los datos ya que se requieren de cálculos para poder expresar las concentraciones antes mencionadas, los cuales deben ser precisos y si realizamos un arreglo en los valores expresados experimentalmente esto no se podrá cumplir Asignatura: QUIMICA GENERAL E INORGANICA Carrera: BIOQUIMICA Y FARMACIA Página 23 de 31 Título: DENSIDADES Autor/es: RENJIFO, CRUZ, SALTO RECOMENDACIONES Manejar los materiales cuidadosamente, para evitar así posibles percances al momento de realizar la práctica. No pipetear con la boca, utilizar las peras disponibles en el laboratorio, ya que se trabaja con reactivos, por ende se debe velar por la integridad física de todos los participantes en la práctica. Al proceder a aforar las sustancias tener la debida precisión para proporcionar valores lo más exactos posibles, en caso de cometer un error en ésta parte se debe tirar la muestra y repetirla ya que si se realiza un “maquillaje de datos” los posteriores cálculos no serán los correctos. Tener el debido cuidado al momento de depositar las soluciones en sus respectivos recipientes para evitar así posibles derrames, lo cual provocaría fallas en los cálculos posteriores Asignatura: QUIMICA GENERAL E INORGANICA Carrera: BIOQUIMICA Y FARMACIA Página 24 de 31 Título: DENSIDADES Autor/es: RENJIFO, CRUZ, SALTO Referencias 1.-Schackelford, J. F. Introducción a la ciencia de los materiales para ingenieros, 6.ª ed., 2008. ISBN .2.- De ahí que el hielo, más frío que el agua, flote sobre ella. «Mecánica de fluidos - Tabla de densidades». Consultado el 1 de diciembre de 2019. 3.-, GILBERT W, Fisicoquímica, Addison – Wesley Iberoamericana, Segunda Edición, 1987. 4.- ATKINS, P. W., Fisicoquímica, Addison – Wesley Iberoamericana, Tercera Edición, 1992. 5.- MARON Y PRUTTON, Fundamentos de Fisicoquímica, Limusa, Décima – quinta reimpresión, 1984. 6.- PONZ MUZZO, GASTON, Tratado de Química Física, A.F.A, Segunda Época. Primera Edición, 2000. Asignatura: QUIMICA GENERAL E INORGANICA Carrera: BIOQUIMICA Y FARMACIA Página 25 de 31 Título: DENSIDADES Autor/es: RENJIFO, CRUZ, SALTO ANEXOS Asignatura: QUIMICA GENERAL E INORGANICA Carrera: BIOQUIMICA Y FARMACIA Página 26 de 31 Título: DENSIDADES Autor/es: RENJIFO, CRUZ, SALTO Asignatura: QUIMICA GENERAL E INORGANICA Carrera: BIOQUIMICA Y FARMACIA Página 27 de 31 Título: DENSIDADES Autor/es: RENJIFO, CRUZ, SALTO Asignatura: QUIMICA GENERAL E INORGANICA Carrera: BIOQUIMICA Y FARMACIA Página 28 de 31 Título: DENSIDADES Autor/es: RENJIFO, CRUZ, SALTO Asignatura: QUIMICA GENERAL E INORGANICA Carrera: BIOQUIMICA Y FARMACIA Página 29 de 31 Título: DENSIDADES Autor/es: RENJIFO, CRUZ, SALTO Asignatura: QUIMICA GENERAL E INORGANICA Carrera: BIOQUIMICA Y FARMACIA Página 30 de 31 Título: DENSIDADES Autor/es: RENJIFO, CRUZ, SALTO Asignatura: QUIMICA GENERAL E INORGANICA Carrera: BIOQUIMICA Y FARMACIA Página 31 de 31