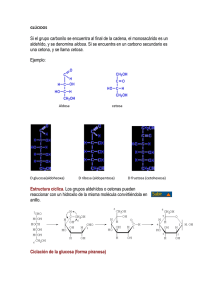
lOMoARcPSD|4051389 METABOLISMO DEL GLUCOGENO Bioquímica (Universitat Internacional de Catalunya) StuDocu no está patrocinado ni avalado por ningún colegio o universidad. Descargado por Leslie Ruiz ([email protected]) lOMoARcPSD|4051389 Bioquímica – metabolismo del glucógeno 1. INTRODUCCION Glucosa en sangre es vital para la vida- Fuente preferida del cerebro - Fuente de energía para células sin mitocondrias como los eritrocitos - Fuente de energía para el musculo en ejercicio Obtención glucosa: dieta, gliconeogenesis, glucógeno Glucógeno: moléculas lineales de glucosa y algunas ramificaciones - Mecanismo que ha desarrollado el organismo para almacenar glucosa en una forma rápidamente movilizable ya que la gluconeogénesis puede proporcionar una sítesis mantenida de glucosa pero responde con cierta lentitud a un descenso de la glucemia - En ausencia de una fuente alimetaria de glucosa, este azuca ser libera rapidamente a partir de glucógeno hepático y renal, también hay glucógeno muscular para proveerlo de E cuando está haciendo ejercicio físico. - Cuando las reservas de glucógeno están agotadas, tejidos específicos sintetizan glucosa de novo usando AA de las proteínas del cuerpo como fuente principal de C para la ruta gluconeogénica. Las fuentes principales de glucógeno son: - Provee de glucosa al resto de órganos Mantiene niveles de glucemia (en particular primeras etapas del ayuno) SI depende de la insulina - Hígado - Músculo esquelético (para consumo propio) - Aunque no son los únicos tejidos que pueden acumularla ya que otros también, pero muy poquito, lo suficiente para satisfacer pequeñas necesidades puntuales. - Se almacenan como pequeños gránulos de glucógeno, estas se encuentran cerca de enzimas de degradación del glucógeno (esto facilita la reacción) Descargado por Leslie Ruiz ([email protected]) lOMoARcPSD|4051389 Bioquímica – metabolismo del glucógeno 2. METABOLISMO DEL GLUCOGENO 2.1. Glucógeno del músculo Fluctuaciones de las reservas de glucógeno La contracción muscular favorece la absorción de glucosa del torrente sanguíneo. Glucógeno muscular no varía demasiado en las primeras horas de ayuno (si no hemos hecho ejercicio físico) el glucógeno muscular se mantiene. Disminuye moderadamente en el ayuno prolongado (semanas) - - Las fibras musculares rojas (bien vascularizadas y con abundantes mitocondrias) la obtención de ATP será más elevada, y los Carbonos tendrán dirección hacia la mitocondria Fibras blancas (menos riego sanguíneo y menos mitocondrias) estos C servirán para formar lactato. 2.2. Glucógeno en el hígado En ayuno (estado postprandial), las reservas de glucógeno hepático están casi agotadas, por lo tanto cuando hacemos ejercicio se degrada antes las grasas. El hígado se sobrecarga porque le exigimos más producción de glucosa de la que toca. El aspecto del hígado puede variar mucho. 2.3. Síntesis de glucógeno (glicogénesis) Se sintetiza a partir de moléculas α-D-glucosa, tiene lugar en el citosol y requiere ATP (para la fosforilación de la glucosa cuando entra dentro de la célula) y UTP (trifosfato de uridina). Glucogenina 1. Síntesis de UDP-glucosa: Una vez se fosforila la glucosa (Glucosa 1P) se une al UTP mediante la acción de la UDP-glucosa pirofosforilasa Para que las enzimas glucógeno sintasas la reconozcan y sinteticen el ADP, cuando la glucosa1P va a pasar a UDP glucosa se liberan dos fosfato. Uno viene del UTP, el otro de la glucosa. Esto da la energía necesaria para que se produzca la reacción sin necesidad de consumir ATP. Descargado por Leslie Ruiz ([email protected]) lOMoARcPSD|4051389 Bioquímica – metabolismo del glucógeno 2. Síntesis de un cebador para iniciar la síntesis de glucógeno. La glucógeno sintasa (responsable de hacer enlaces α1-4) no puede iniciar la síntesis usando glucosa libre como aceptor de UDP-glucosa, sólo puede alargar cadenas de glucosa ya existentes (necesita un pequeño cebador). Cebadores - Un fragmento de glucógeno (si no están agotadas las reservas) puede servir de cebador, una tirosina que deja un extremo OH libre al cual se le agrega la UDP glucosa gracias a la Glucogenina (tiene autoactividad catalítica, capaz de coger una UDP glucosa y agregarla) 3. Elongación de las cadenas de glucógeno por acción de la glucógeno sintasa Descargado por Leslie Ruiz ([email protected]) lOMoARcPSD|4051389 Bioquímica – metabolismo del glucógeno 2.4. Degradación del Glucógeno (GLUCOGENÓLISIS) NO es la ruta inversa de las reacciones sintéticas, precisa un conjunto distinto de enzimas citosólicas. - Acortamiento de las cadenas: la enzima Glucógeno Fosforilasa escinde enlaces glucosídicos (fosforilación simple – utiliza fosfatos para llevar a cabo la reacción) y produce Glucosa 1-fosfato. - Eliminación de las ramificaciones, actividad transferasa de la enzima desramificante y posteriormente cuando se llega al enlace 1-6 se utiliza la actividad glucosidasa de la misma enzima desramificante - Conversión de la Glucosa 1P en glucosa 6P: Tiene lugar en el citosol. - En el hígado la Glucosa 6P es translocada hacia interior del REL por la Glucosa 6P Translocasa. Ahí se convierte en glucosa libre por la Glucosa 6 Fosfatasa (misma enzima que en gluconeogénesis). Ahora la glucosa vuelve al citosol y los hepatocitos la liberan para mantener los niveles de glucemia. - En el músculo, la Glucosa 6P no puede ser desfosforilada por una carencia de Glucosa 6 Fosfatasa. En cambio, entra en la glucolisis y proporciona energía para la contracción muscular. Todo lo relacionado con el glucógeno se da en el citosol a excepción de la transformación de Glucosa 6P a Glucosa libre, mediante la acción de la Glucosa 6 Fosfatasa - Degradación lisosómica del glucógeno: tan sólo una pequeña cantidad. Pero la carencia de esta enzima provoca acumulación de glucógeno (glucogenosis tipo II, enfermedad de Pompe) 2.5. ¿Qué pasa cuando hay problemas en el almacenamiento de glucógeno? Ejemplo: - Enfermedad de Von-Gierke: déficit de glucosa 6-fosfatasa. tienen muy poca glucosa pero tienen (debido a la desramificación del glucógeno) esto garantiza un mínimo de glucosa en el torrente sanguíneo sin control sin ser desfosforilada. Descargado por Leslie Ruiz ([email protected]) lOMoARcPSD|4051389 Bioquímica – metabolismo del glucógeno - Enfermedad de POMPE, glucogénesis tipo II, disfunción de la encima maltasa ácida alfa 1, 4-glucopsiasa 2.6. Regulación del glucógeno Activación de la DEGRADACIÓN del glucógeno por la ruta dirigida por el AMPc El glucagón o la adrenalina se unen a receptores de la membrana plasmática e indican la necesidad de degradación del glucógeno, ya sea para elevar la glucemia o para proporcionar energía al músculo en ejercicio. La Insulina activa la Proteinfosfatasa -1 y otras enzimas que degradan el AMPc, es decir que se opone a los efectos del glucagón y adrenalina. Regulación alostérica de la síntesis y la degradación del glucógeno Además de las señales hormonales, la Glucógeno Sintasa y Glucógeno Fosforilasa responden a los niveles de metabolitos y necesidades de engría de la célula. - Estimulación Glucogénesis: cuando hay disponibilidad de sustrato y niveles altos de ATP Estimulación Glucogenólisis: cuando niveles de glucosa y ATP son bajos Activación de la degradación de glucógeno por el calcio: - Músculo: El calcio se libera en el citoplasma de los miocitos durante la contracción muscular y activa la Glucógeno fosforilasa muscular. Hígado: se libera Ca2+ en respuesta a llegada de adrenalina, estimula Glucógeno fosforilasa hepática. Activación de la degradación del glucógeno muscular por el AMP: El AMP es un indicador de que se están agotando las reservas de ATP, por lo tanto se debe degradar el glucógeno para seguir con la contracción muscular. Descargado por Leslie Ruiz ([email protected]) lOMoARcPSD|4051389 Bioquímica – metabolismo del glucógeno 3. SEGREGACIONDE GLUCOSA: GLUCONEOGÉNESIS Exclusivo del hígado y riñones - Ayuno nocturno: 90% gluconeogénesis hepática, 10% renal Ayuno prolongado: 60% gluconeogénesis hepática, 40% renal Algunos tejidos (cerebro, eritrocitos, médula renal, cristalino, córnea, testículos, músclo en ejercicio) necesitan glucosa constantemente. El glucógeno hepático (fuente post prandial) sólo satisface estas necesidades unos 10-18h en ausencia de ingesta de carbohidratos. Cuando se agotan las reservas de glucógeno debido a un ayuno prologado, se mpieza sintetizar glucosa a partir de precursores como Lactato, piruvato, glicerol (procedente del esqueleto carbonatado de los trigliceroles) y los α-cetoácidos (proceden del catabolismo de los AA glucógenos) La formación de glucosa no es una simple inversión de la glucólisis sino que se sintetiza mediante una ruta especial (gluconeogénesis anabolismo) que necesita enzimas mitocondriales y citosólicas. Es un proceso en el que se invierte energía (proviene de la degradación de loa AG). En un estado de ayunas, los AG aparte de dar energía a los tejidos, da energía al hígado para que pueda llevar a cabo la gluconeogénesis. A medida que pasan las horas de ayuno, las reservas de glucógeno van disminuyendo. Cuando se va consumiendo el glucógeno va aumentando de forma progresiva la gluconeogénesis. Por lo tanto cuando se prolongan los días de ayuno, la única fuente de glucosa que tenemos es la gluconeogénesis. Fas e I II III IV V Origen de Glucosa Sanguínea Exógeno Glucógeno Gluconeogén esis hepática Gluconeogén esis hepática Glucógeno Tejidos que Principal utilizan Glucosa Combustible del Cerebro Todos Glucosa Todos excepto Glucosa hígado Músculo y Tj. Adiposo en pequeña proporción Todos excepto hígado Músculo y Tj. Adiposo en proporciones intermedias entre II y IV Gluconeogén Cerebro, esis hepática eritrocitos, y renal médula renal, cristalino, córnea, testículos, músculo en pequeña cantidad Gluconeogén El cerebro en esis hepática pequeña y renal cantidad, eritrocitos, médula renal Descargado por Leslie Ruiz ([email protected]) Glucosa Glucosa, cuerpos cetónicos Cuerpos cetónicos Glucosa. lOMoARcPSD|4051389 Bioquímica – metabolismo del glucógeno - I Fase cuando aún tenemos glucosa y AG se consume la glucosa exógena, y todos los tejidos son capaces de utilizarla. II Fase: musculo y tejido adiposo empiezan a consumir menos glucosa y las células con mitocondrias empiezan a consumir AG. El hígado empieza la gluconeogénesis. IV Fase: Las células sin mitocondrias consumen cueros cetónicos. La gluconeogénesis del hígado empieza a escasear, y los riñones también la empiezan a llevar acabo. 3.1. Fuentes de Gluconeogénesis No es exactamente el proceso de la glucolisis al revés, los precursores glucogénicos abarcan productos intermedios de la glucólisis y CK. En un estado de déficit de energía, empezamos a romper todas aquellas moléculas que podamos y que en condiciones normales no tocaríamos. Glicerol: Obtenido de la hidrólisis de los triglicéridos en el tejido adiposo y pasa al hígado por la sangre Glicerol Cinasa Glicerol Fosforila Dihidroxiacetona Fosfato Glicerol 3-P Glicerol Fosfato Deshidrogenasa Oxida (Intermediario de glucólisis) Los adipocitos no pueden fosforilar el glicerol porque carecen de Glicerol Cinasa. Excepciones de que las grasas no puedan convertirse en glúcidos: Concretamente el glicerol de los AG sí que es un precursor gloconeogenico. El Propionil CoA es un producto de AG cadena impar y AG raros (impares, cadenas de metilo…) que entra en la gluconeogénesis a través de precursores del CK. Lactato: El músculo esquelético en ejercicio y células sin mitocondrias (eritrocitos) convierten el esqueleto carbonado de la glucosa en lactato y lo liberan a la sangre, llega al hígado donde vuelve a ser convertido en glucosa. Fructosa y galactosa son hexosas que pueden entrar en la ruta gluconeogénica. Aminoácidos: Las proteínas también pueden ser fuente de glucosa. Cuando las personas llevan muchos días de ayuno la fuente más importante de glucosa son los AA de hidrolizar proteínas (que se encuentran en los músculos). Estos α- Cetoácidos entran el CK y forman Oxalacetato (precursor del Fosfoenol Piruvato) - - Compuestos que dan lugar a la Acetil-CoA no pueden producir una síntesis neta de glucosa debido a la naturaleza irreversible de la reacción de la Piruvato Deshidrogenasa que convierte el Piruvato en Acetil-Coa. Estos compuestos dan lugar a cuerpos cetónicos (cetógenos) como Leucina o Lisina. Descargado por Leslie Ruiz ([email protected]) lOMoARcPSD|4051389 Bioquímica – metabolismo del glucógeno 3.2. Ruta de la alanina: Es casi más importante la Alanina en los músculos. Permite generar nuevas moléculas de glucosa a partir de la Alanina y eliminar el exceso de nitrógeno del músculo. Cuando el músculo hace proteólisis, se generan grandes cantidades de nitrógeno (amoniaco y ion amonio) esto es toxico. Para enviar esta sustancia de la forma menos toxica posible, lo hace a través de la Alanina. Envía el piruvato al hígado y ahí se convierte a glucosa. No tenemos regeneración de NAD, pero eliminamos el N. La alanina y ATP (inhiben la glucolisis) ya que si al hígado le llegan concentración alta de alanina significa que el musculo se está quedando sin reservas de glucógeno (le indica que forme glucógeno para otros órganos) 3.3. Reacciones Únicas para la Gluconeogénesis 7 reacciones glucolíticas son reversibles y se emplean en la síntesis de glucosa, pero 3 son irreversibles y deben sortearse mediante 4 reacciones alternativas que favorecen energéticamente la síntesis de glucosa. 1. Carboxilación del piruvato La reacción irreversible de PEP- Fosfoenol Piruvato a Piruvato por la Piruvato Cinasa es el primer obstáculo. Utilizan el Oxalacetato para favorecer la reacción Posteriormente el PEP experimentará reacciones glucolíticas en dirección inversa hasta que se convierta en fructosa 1,6 Bifosfato. Descargado por Leslie Ruiz ([email protected]) lOMoARcPSD|4051389 Bioquímica – metabolismo del glucógeno 2. Desfosforilación de la Fructosa 1,6-Bifosfato Proporciona una ruta energéticamente favorable para la formación de Fructosa 6P. Otro paso irreversible es el de la PFK1 (Fosfofructocinasa 1), para contrarrestar esto, interviene la enzima Fructosa 1-6bifosfatasa. Regulación por niveles de energía en el interior de la célula: - Niveles elevados de AMP (indica estado de poca energía) Ia Fructosa 1,6Bifosfatasa. Niveles bajos de AMP (altos de ATP) estimulan la gluconeogénesis (vía que requiere E) Regulación por la fructosa 2,6 Bisfosfato (inhibe la Fructosa 1,6-Bifosfatasa) 3. Desfosforilación de la Glucosa 6-Fosfato Otro paso irreversible es aquel catalizado por la hexocinasa. Pero conseguimos proporcionar una ruta alternativa energéticamente favorable para la formación de glucosa libre. El hígado y el riñón son los únicos órganos que liberan glucosa libre a partir de Glucosa 6Fosfato 3.4. Regulación de la Gluconeogénesis Control hormonal principalmente mediante la insulina y glucagón, y por la disponibilidad de sustratos glucogénicos. Una alteración de la velocidad de síntesis o degradación enzimática provocan cambios adaptativos lentos en la actividad enzimática. Insulina: activa la subunidad fosfatasa de la PFK Descargado por Leslie Ruiz ([email protected]) lOMoARcPSD|4051389 Bioquímica – metabolismo del glucógeno Glucagón: Se sintetiza en las células α-pancreáticas, estimula Gluconeogénesis - Reduce el nivel de fructosa 2,6-bifosfato , lo que provoca la activación de la Fructosa 1,6-Bifosfatasa y la inhibición de la PFK1 - Se une a un receptor (proteína G) y a través de una elevación de AMPc estimula la activación = fosforilación de la Piruvato Cinasa que desvía el PEP hacia la síntesis de glucosa (en vez de convertirlo en piruvato. Cuando hay glucosa se desarrolla una respuesta intracelular, la acción de glucagón sobre el receptor amplificará la señal - Aumenta la transcripción del gen de la PEP-carboxicinada (aumenta disponibilidad de enzima) Descargado por Leslie Ruiz ([email protected]) lOMoARcPSD|4051389 Bioquímica – metabolismo del glucógeno Disponibilidad de sustratos - Disponibilidad de precursores gluconeogénicos (particurarmente AA glucógenos) influyen en velocidad de síntesis de glucosa hepática. - Niveles reducidos de insulina favorecen la movilización de AA desde proteínas musculares y proporcionan los esqueletos carbonados. - Coenzimas-cosustratos, ATP y NADH necesarios son proporcionados por catabolismo AG Activación alostérica por el Acetil-CoA - La activación de la Piruvato Caorboxilasa por el Acetil CoA se produce durante el ayuno - Como consecuencia de una lipólisis aumentada en el T.Adiposo, el hígado se carga de AG - La velocidad de formación de Acetil CoA por β-oxidación de estos AG supera capacidad oxidación del hígado - Como resultado de acumula AcetilCoA e induce a una activación de la Piruvato Carboxilasa Inhibición alostérica por el AMP - La enzima Fructosa 1,6-Bifosfatasa es inhibida por la AMP La enzima PFK1 es activada por el AMP Hay una regulación recíproca de glucólisis y gluconeogénesis (igual que la Fructosa 2,6 bifosfato), permite que las reacciones no se den a la vez La alanina y ATP (inhiben la glucolisis) ya que si al hígado le llegan concentración alta de alanina significa que el musculo se está quedando sin reservas de glucógeno (le indica que forme glucógeno para otros órganos) Regulación fructosa 2-6 difosfato Es un metabolismo que está en medio de la glucolisis y gluconeogénesis. Permite que las dos reacciones no se den a la vez. - Activa la glicolisis mediante la PFK1 inhibe la gluconeogénesis por la FBP-1 Quien permite que haya fructosa 2-6 difosfato? La PFK2. Cuando hay insulina, la PFK2 aumenta la cantidad fructosa 2-6 difosfato y esto permite que se dé la glucolisis, ya que estará activando la PK1. Cuando hay glucagón, aumenta la cantidad de FBP-2 y disminuye la fructosa 2-6 difosfato, entonces no se da la glicolisis pero si la gluconeogénesis. Descargado por Leslie Ruiz ([email protected]) lOMoARcPSD|4051389 Bioquímica – metabolismo del glucógeno PFK1: Tiene dos unidades: - Actividad Quinada = fosforila Actividad Fosfatasa = desfosforila Cuando acabamos de comer queremos favorecer la glucolisis. Insulina elevada y glucógeno bajo con aumento de la insulina se favorece la fructosa 2,6 fosfato, la subunidad cinasa fosforila cuando la PFK 2 esta fosforilada (inactiva) con grandes niveles de insulina, la PFK 2 esta desfosforilada. Entonces la fructosa será fosforilada y se formara fructosa 2.6P que a su vez activara la PFK1. El glucagón elevado activa a un receptor. La subunidad PFK esta inactiva, entonces la fosfatasa esta activa y retira fosfatos de la fructosa 2.6 fosfato. Si dejamos de fosforilar cada vez hay menos 2,6 difosfato Si no hay fructosa 2,6 P no hay glicolisis y entonces se favorece la gluconeogénesis. Glycolysis: phosphofructokinase-1 (PFK-1) Descargado por Leslie Ruiz ([email protected]) lOMoARcPSD|4051389 Bioquímica – metabolismo del glucógeno Glyconeogenesis: fructose1,6 biphosphatase (FBP-1) Descargado por Leslie Ruiz ([email protected])