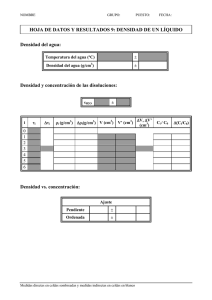
Unidad 6: Soluciones Actividades de aprendizaje 1. El volumen de una solución preparada a partir de 15 g de soluto y 80 g de agua es 90 ml. Calcular su concentración en: a) % m/V b) % m/m. 2. El vinagre que se utiliza, entre otras cosas, para condimentar las ensaladas es una solución de ácido acético al 5% m/V. a) ¿Cuántos mililitros de vinagre se necesitan para preparar 25 ml de una solución acuosa al 0,5 % m/v? b) ¿Cuál es la molaridad de la solución obtenida en el inciso a)? 3. Si disolvemos 80 g de sal común en agua hasta completar 250 ml de solución. ¿Cuál será la concentración, expresada en g/l, de la solución preparada? 4. Disponemos una solución que indica 3 g/l. Si el recipiente que la contiene posee 750 ml de solución, ¿qué cantidad de soluto habremos disuelto? 5. La povidona yodada es un antiséptico que contiene yodo. Si leemos en un frasco: “100 ml de solución contienen 10 g de povidona yodada”. Calcula la concentración de la solución en g/l. 6. Una persona ingiere dos cervezas de 250 cm3, cuya concentración es de 4,8 %(4,8º) en volumen (%V/V) a) ¿Cuántos ml de alcohol etílico se bebió? b) Suponiendo que todo el alcohol etílico ingerido pasa a la sangre y si la densidad del alcohol etílico es de 790 g/l ¿qué cantidad d e alcohol tendrá en su sangre? c) Si suponemos que en nuestro organismo tenemos cinco litros de sangre y que la máxima cantidad permitida en sangre es de 0,5 g/l. ¿podrían ponerle una multa si conduce? 7. Indicar a qué volumen deben diluirse 50 cm3 de un jugo de naranjas concentrado al 50% m/V para obtener un jugo bebible al 10 % m/V. 8. ¿Qué volumen de solución antiséptica al 70% habrá que emplear para preparar 350 ml de una solución al 40%? ¿Cuánta agua se tiene que usar? 9. Indicar si las afirmaciones siguientes son verdaderas o falsas, Justificar: a) Un recipiente que contiene una solución 2 M de glucosa siempre tiene mayor masa de soluto que otro que contiene una solución 1 M de glucosa. b) Un recipiente que contiene un litro de solución acuosa 0,50 M siempre tiene el doble de la masa de soluto que otro recipiente que contiene un litro de solución acuosa 0,25 M. c) Decir que una solución tiene una densidad de 1,085 g / cm3 significa que 1085 g de soluto ocupan un volumen de 1000 cm3. d) Al evaporar parte del solvente en una solución de soluto no volátil disminuye su concentración. e) Si se tiene una solución 1,00 M de NaCl, para obtener una solución 0,50 M deben agregarse 500 cm3 de solvente. 10. La glucosa, uno de los componentes del azúcar, es una sustancia sólida soluble en agua. La solución de glucosa en agua (suero glucosado) se usa para alimentar a los enfermos cuando no pueden comer. En la etiqueta de una botella de suero de 500 cm3 aparece: “Solución de glucosa en agua, concentración 55 g/l”. a) ¿Cuál es el solvente y cuál el soluto en la solución? b) Ponemos en un plato 50 cm3. Si dejamos que se evapore el agua, ¿Qué cantidad de glucosa quedará en el plato? c) Un enfermo necesita tomar 40 g de glucosa cada hora ¿Qué volumen de suero de la botella anterior se le debe inyectar en una hora? 11. En una bebida alcohólica leemos: 13,5 % V/V a) ¿Qué significa ese número? b) Si la botella contiene 700 ml de la bebida ¿Qué volumen de alcohol contiene? 12. Queremos preparar 250 cm3 de solución de sal en agua, con una concentración de 5 g/l. ¿Qué cantidad de sal debemos disolver en agua? 13. Tenemos una solución de azúcar en agua, de concentración desconocida. Tomamos con una pipeta 10 ml de esa solución, los colocamos en un cristalizador, y medimos que, cuando se evapora el agua, quedan 0,65 g de azúcar. ¿Qué concentración tiene la solución? 14. 120 ml de una solución contienen 4,32 g de glucosa (C6H12O6), siendo la densidad 1,05 g/ml. Calcular: a) Molaridad b) % m/V c) % m/m 15. Se necesita preparar una solución acuosa al 15 % m/m y sólo se dispone de 45 g de sólido. ¿Qué cantidad (en gramos) de solución podrá prepararse y cuánta masa de agua deberá emplearse? 16. ¿Cuál de las siguientes soluciones es más concentrada?: a) 0,0004 moles de sacarosa (C12 H22O11) en 0,05 moles de agua. b) 1 g de sacarosa en 1000 g de agua. 17. ¿Hasta qué volumen se deben diluir 100 cm3 de solución de KCl 1,00 M para obtener una solución 0,500 M? 18. Calcular el volumen y la concentración de la solución resultante de mezclar 25 ml de una solución 0,2 M con 35 ml de una solución 0,3 M del mismo compuesto.