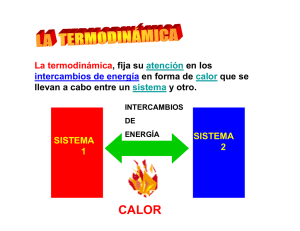
Entalpía (del griego ἐνθάλπω [enthálpō], «agregar calor»; formado por ἐν [en], «en» y θάλπω [thálpō], «calentar») es una magnitud termodinámica, simbolizada con la letra H mayúscula, definida como «el flujo de energía térmica en los procesos químicos efectuados a presión constante cuando el único trabajo es de presión-volumen»,1 es decir, la cantidad de energía que un sistema intercambia con su entorno. En palabras más concretas, es una función de estado de la termodinámica donde la variación permite expresar la cantidad de calor puesto en juego durante una transformación isobárica, es decir, a presión constante en un sistema termodinámico, teniendo en cuenta que todo objeto conocido se puede entender como un sistema termodinámico. Se trata de una transformación en el curso de la cual se puede recibir o aportar energía (por ejemplo la utilizada para un trabajo mecánico). En este sentido la entalpía es numéricamente igual al calor intercambiado con el ambiente exterior al sistema en cuestión. Dentro del Sistema Internacional de Unidades, la entalpía se mide habitualmente en julios que, en principio, se introdujo como unidad de trabajo. Lo que hace la entalpía es reflejar la cantidad de energía que un cuerpo intercambia con el entorno. Sus fluctuaciones, de este modo, revelan el nivel energético que el cuerpo libera o absorbe. Las variaciones de la entalpía, en definitiva, expresan la cantidad de calor que un sistema termodinámico (un cuerpo) pierde o gana durante el desarrollo de un proceso isobárico (es decir, a presión constante). El sistema en cuestión, según el caso, aporta o recibe energía que intercambia con el ambiente externo. En principio consideraremos el calor absorbido o cedido a presión constante se llama variación de entalpía (ΔH). La entalpía (H) es una función de estado y su valor y su variación depende de las condiciones inicial y final. En termodinámica, la entropía (simbolizada como S) es una magnitud física para un sistema termodinámico en equilibrio. Mide el número de microestados compatibles con el macroestado de equilibrio, también se puede decir que mide el grado de organización del sistema, o que es la razón de un incremento entre energía interna frente a un incremento de temperatura del sistema. La entropía es una función de estado de carácter extensivo y su valor, en un sistema aislado, crece en el transcurso de un proceso que se da de forma natural. La entropía describe lo irreversible de los sistemas termodinámicos. La palabra entropía procede del griego (ἐντροπία) y significa evolución o transformación. entropía se conoce la tendencia natural a la pérdida de orden en un sistema. magnitud física que mide la parte de la energía que no puede utilizarse para realizar trabajo y que, en consecuencia, se pierde. Así, en un sistema aislado, siempre una pequeña cantidad de energía se disipará fuera del sistema. Este valor, como tal, siempre tiende a crecer en el transcurso de un proceso que se produzca de forma natural. En este sentido, la entropía describe la irreversibilidad de los sistemas termodinámicos. Por ejemplo, cuando se pone un cubo de hielo en un vaso de agua a temperatura ambiente, al cabo de unos minutos, el cubo pasará a estado líquido, pues aumentará su temperatura, mientras que el agua se enfriará, hasta ambos alcanzar el equilibrio térmico. Esto debido a que el universo tiende a distribuir la energía uniformemente, es decir, a maximizar la entropía. La entropía puede ser la magnitud física termodinámica que permite medir la parte no utilizable de la energía contenida en un sistema. Esto quiere decir que dicha parte de la energía no puede usarse para producir un trabajo. En termodinámica, la energía libre de Gibbs (nombre recomendado por IUPAC: energía de Gibbs o función de Gibbs; también conocida como entalpía libre [1] para distinguirla de la energía libre de Helmholtz) es un potencial termodinámico que se puede usar para calcular el máximo de trabajo reversible que puede realizarse mediante un sistema termodinámico a una temperatura y presión constantes (isotérmica, isobárica). La energía libre de Gibbs (ΔGº = ΔHº - TΔSº; J en unidades SI) es la cantidad máxima de trabajo de no expansión que se puede extraer de un sistema cerrado termodinámicamente (uno que puede intercambiar calor y trabajo con su entorno, pero no materia). Este máximo solo se puede alcanzar en un proceso completamente reversible. Cuando un sistema se transforma reversiblemente de un estado inicial a un estado final, la disminución de la energía libre de Gibbs equivale al trabajo realizado por el sistema en su entorno, menos el trabajo de las fuerzas de presión. [2] La energía de Gibbs (también conocida como G) es también el potencial termodinámico que se minimiza cuando un sistema alcanza el equilibrio químico a presión y temperatura constantes. Su derivada con respecto a la coordenada de reacción del sistema se desvanece en el punto de equilibrio. Como tal, una reducción en G es una condición necesaria para la espontaneidad de los procesos a presión y temperatura constantes. En termodinámica, la energía de Gibbs (antiguamente denominada "energía libre de Gibbs", "energía libre" o "entalpía libre") es un potencial termodinámico, es decir, una función de estado extensiva con unidades de energía, que da la condición de equilibrio y de espontaneidad para una reacción química (a presión y temperatura constantes).Se simboliza con la letra G mayúscula. De acuerdo a la segunda ley de la termodinámica, una reacción será espontánea siempre y cuando la entropía del universo aumente, por lo que para predecir la espontaneidad de una reacción deberíamos conocer tanto la entropía del sistema como la entropía del entorno, sin embargo, esta última es muy difícil de medir. Sin embargo, favorablemente la entropía del entorno está relacionada con la entalpía del sistema, lo que fue propuesto por J. Williard Gibbs, quien introdujo una magnitud, denominada Energía libre de Gibbs. Esta función de sestado, se relaciona con la energía útil que posee un sistema para realizar trabajo y determina si una reacción es espontánea en un sentido o en el sentido inverso Condición de Equilibrio: Una reacción se encuentra en el equilibrio, cuando en determinado momento durante la reacción, está invierte su sentido. Quiere decir que se van formando productos y en determinado momento, los productos comienzan a producir los reactantes. Esto solo ocurrirá cuando la variación de la Energía libre de Gibbs sea igual a cero. Lo que nos permite establecer la siguiente ecuación: El cociente de reacción, Q, en la condición de equilibrio se conoce como Constante de Equilibrio y se denota con la letra K, luego la ecuación anterior se escribe de la manera siguiente: 5- ¿Qué relación hay entre la energía libre de Gibbs y el equilibrio químico? Una pila o una batería son dispositivos que en su interior contienen sustancias que reaccionan y forman productos cada vez que se utilizan. Cuando la pila está nueva los reactivos se encuentran en mayor concentración, pero cuando está agotada y no posee energía útil, los reactivos están en su concentración más baja y los productos en su concentración más baja. Lo anterior ocurre porque la energía de Gibbs depende de las concentraciones de los reactivos y productos, y si las concentraciones cambian también lo hace la energía libre. Esto queda de manifiesto, a través de la siguiente expresión: ΔG = ΔG° + RTlnQ Donde: ΔG= Energía libre de la reacción en condiciones no estándar. ΔG°= Energía libre estándar, que se obtiene a partir de datos tabulados en condiciones estándar. R =Constante del gas ideal de valor 8,314 J/mol K. T= Temperatura absoluta en K (a la que ocurre el proceso). Q= Cociente de la reacción que corresponde a la mezcla específica. El cociente de la reacción Q se define como la relación proporcional entre los valores específicos de productos y reactantes: Por ejemplo, para la reacción: aA+bB → cC+dD Se puede establecer que: Sin embargo, cuando una reacción alcanza el equilibrio, las concentraciones de productos y reactivos permanecen constantes, por lo que el cociente de reacción Q se reemplaza por la constante de equilibrio Keq. La constante de equilibrio se expresa en términos del cociente de reacción, con la diferencia de que las concentraciones de reactivos y productos corresponden a las concentraciones en el equilibrio. Su valor en una reacción química depende de la temperatura, por lo que ésta siempre debe especificarse. La expresión de una reacción genérica es: aA+bB → cC+dD Estableciéndose que la constante de equilibrio corresponde a: Cuando se trata de mezclas gaseosas, es más adecuado describir la composición en términos de presiones parciales. Por lo que en vez de adaptar la expresión de la constante de equilibrio en términos de concentraciones (Kc), se adapta a presiones parciales (Kp). De esta manera, cuando el sistema está en equilibrio se sabe que: - ΔG = 0 - En lugar del cociente de reacción se escribe la constante de equilibrio De todo lo anterior, se puede deducir lo siguiente: - Si ΔG° es mayor que 0, la concentración de reactivos será superior a la de productos y el valor de Keq es menor que 1, y la reacción se desplaza a los reactivos. - Si ΔG° es menor que 0, la concentración de productos será superior a la de reactivos y el valor de Keq será mayor que 1, y la reacción se desplazará a los productos. - Si ΔG° es igual 0, la concentración de reactivos será equivalente a la de productos y el valor de Keq será igual a 1.