- Ninguna Categoria
Eje Endocrino Masculino: Regulación y Hormonas Sexuales
Anuncio
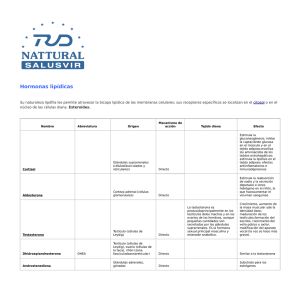
http://www.webfisio.es/fisiologia/endocrino/textos/ejehm.htm# El eje endocrino (figura) que regula las hormonas sexuales masculinas comienza en el hipotálamo con la secreción hipotalámica de Kisspeptina, hormona que participa de forma importante en el inicio de la pubertad, que a su vez regula la secreción de la GnRH o LHRH y el GAP (péptido asociado a la GnRH )(es un fragmento de ésta (1-13)), encargados de regular la secreción de las gonadotropinas adenohipofisarias LH y FSH, las cuales regulan a su vez la secreción de los andrógenos de origen testicular. Además, hay que tener en cuenta la prolactina que también participa en la regulación de la secreción de testosterona y su acción periférica, la hormona del crecimiento y la insulina. Regulación que a partir de la pubertad muestra un cambio en el patrón de secreción de la GnRH y LH haciéndose pulsátil, lo que determina la maduración y entrada en función de las gónadas masculinas. No todas las hormonas sexuales en el hombre son de origen testicular, sino que una parte procede de la capa reticular de las suprarrenales (andrógenos suprarrenales) y del tejido adiposo. http://www.webfisio.es/fisiologia/endocrino/textos/hm.htm ORÍGEN Y BIOSÍNTESIS El origen de los esteroides sexuales que se pueden medir en el plasma del hombre, es tanto del testículo, como de las suprarrenales, tejido adiposo y tejidos diana donde se produce la activación de estos esteroides (figura). Todos ellos forman parte del eje endocrino sexual masculino (figura). Son esteroides procedentes del colesterol que pertenecen a la familia de los C19 (figura). La testosterona circulante viene principalmente en el hombre de los testículos (figura) y la 5DHT (dehidrotestosterona) de la transformación de la testosterona en sus tejidos diana. Laandrostenodiona y el SDHEA (sulfato-dehidroepiandrostenodiona) fundamentalmente de las suprarrenales y el estradiol y la estrona de la aromatización de los andrógenos en tejido adiposo y tejidos diana. En las mujeres su orígen está en los ovarios (células de la Teca), placenta y cortex adrenal. En las células de Leydig la unión de la LH a su receptor incrementa el AMPc intracelular y la fosforilación consecuente de la proteíncinasa A (Brooks, 1975 (1b)), la cual activa la captación del colesterol circulante, la biosíntesis de novo del colesterol a partir de la acetil CoA, la desterificación del colesterol y su paso a la mitocondria para su transformación mediada por una desmolasa a pregnenolona, la cual pasa al retículo endoplásmico para su transformación en androstenediona por la vía de la dehidroepiandrosterona y por la vía de la 17-OH-progesterona. La androstenediona pasa a testosterona (Te) que es el principal producto secretado (el 95% de la testosterona circulante). Este proceso es potenciado por laprolactina. (Waterman and Keeney, 1992(1b)). Las células de Sertoli (localizadas en los túbulos seminífiros), están encargadas del control de la espermatogénesis y aromatizan parte de la testosterona procedente de las células de Leydig convirtiéndola en estradiol. Su función está regulada por la FSH y producen además, una proteína denominada proteína transportadora de andrógenos (ABP) que fija la testosterona en el testículo, facilitando su acción en la espermatogénesis y sirve como transportadora de la misma en el plasma. También producen una pequeña cantidad de Testosterona. Igualmente, la testosterona y la androstenodiona circulantes son aromatizadas respectivamente en estrona y estradiol en el tejido adiposo y tejidos diana. SECRECIÓN, TRANSPORTE Y METABOLIZACIÓN (figura) La secreción de la testosterona varía según la edad sexual del hombre, como puede verse en la gráfica. Los demás andrógenos procedentes de las suprarrenales están sujetos a la posible regulación adenohipofisaria de los mismos y respecto a los estrógenos, depende de la masa adiposa del sujeto. Estos esteroides masculinos circulan en sangre en un 2% libre, el resto va unido en diferentes porcentajes a la globulina fijadora de esteroides sexuales (SHBG) y a la albúmina. Respecto a la testosterona tenemos que diferenciar entre testosterona libre y testosterona biodisponible, pues aunque la libre es solo el 2% y por tanto la que tendría capacidad de actuar, dado que la unión Te-ALB es muy débil y fácilmente separable, aproximadamente un 50% del total tiene capacidad de actuar. La Te metabolizable es la libre y la unida a la albúmina. Una pequeña parte es transformada en estrógenos, otra es transformada en un derivado mucho más potente, el 5dihidrotestosterona y el resto es metabolizada a 17-cetosteroides (androsterona, epiandrosterona y etiocolanolona) con un 20% menos de actividad. La excreción se hace por la orina, donde los 2/3 son de origen suprarrenal y el resto testicular. MECANISMO DE ACCIÓN (figura) La testosterona ejerce su acción en los tejidos diana de tres formas. Una es directamente sobre sus receptores pertenecientes a la superfamilia de receptores esteroideos, receptores intracelulares que unidos a la hormona ejercen su acción sobre el ADN y su transcripción. Otra es bajo su conversión en 5-DHT mediante la 5 alfa reductasa (de la que se conocen dos tipos localizados en diferentes tejidos, la tipo 1 localizada en piel y cuero cabelludo y la tipo 2, localizada en piel de los genitales, próstata y otros tejidos genitales). Este compuesto tiene mayor actividad y está implicado en acciones importantes dependientes del sexo, como se verá más adelante. Por otra parte la unión Te-R es menos estable que la unión DHT-R. La última es mediante su aromatización en estradiol, ejerciendo las acciones propias de dicho estrógeno, en algunas de las características dependientes del sexo. No hay que olvidar el papel potenciador que tiene la prolactina sobre el número de receptores para la testosterona. Y la posibilidad de que la 5-DHT actué sobre receptores de membrana tipo gabaérgico que explicarían algunas de las acciones rápidas de esta hormona. ACCIONES (figura) (Mooradian et al., 1987 (5b)) En general la acción de la Testosterona afecta por un lado al metabolismo con efectos anabólicos y por el otro, al sexo con efectos androgénicos. Con efectos importantes para la salud y el bienestar general (Bassil et al., 2009 (9b)). Sus efectos anabólicos consisten en aumentar la masa ósea (Tuck and Francis 2009 (8b)) y muscular y su fuerza. Sus efectos androgénicos consisten en la maduración de los órganos sexuales y desarrollo de gran parte de los caracteres sexuales secundarios. Estos efectos varían según la edad. Durante el desarrollo embrionario la Te procedente de los genitales fetales es imprescindible para el desarrollo en la línea de la masculinización gonadal. Esta esteroidogénesis comienza en las células de Leydig a partir de la 7ª semana de gestación y está bajo el control de la HCG placentaria. La Te fetal también puede ser responsable de la transformación de las células germinales primordiales en espermatogonias que quedan silentes. Estimula el desarrollo de los conductos de Wolff en rete testis, epidídimo, conducto deferente y vesícula seminal. La 5-DHT estimula el desarrollo del aparato genital externo. Las células de Sertoli producen un factor inhibidor de los conductos de Müller, que evita su desarrollo en los órganos femeninos (útero, trompas de Falopio y parte superior de la vagina). La testoterona fetal participa en la conformación de la identidad de género (Swaab & Garcia-Falgueras 2009 (19b)). Tras el nacimiento se produce un incremento de gonadotrofinas producido por la falta de inhibición de los esteroides placentarios. Esto supone un incremento considerable de andrógenos hasta los seis meses postparto (Forest et al., 1973 (3b); Corbier et al., 1992 (4b)). Después los niveles de Te disminuyen a mínimos hasta la época puberal. Esta etapa se inicia por la aparición de pulsos episódicos de GnRH nocturnos. Los incrementos de Te observados durante el desarrollo fetal y tras el nacimiento parecen estar relacionados, además de con el desarrollo de los órganos sexuales masculinos e inhibición de los femeninos, con la "masculinización" del cerebro (Dankin et als., 2008 (30b), donde el cerebro del macho tiene una enzima que aromatiza la Te en estradiol, verdadera responsable de dicha masculinización pues es la única que puede pasar la barrera hematoencefálica sin problemas. En el cerebro de la hembra hay una alfa-fetoproteína que se une al estradiol y evita su acción cerebral. (Ver diferenciación sexual en humanos ). Efectos puberales, con niveles altos de andrógenos que si se mantienen durante un largo tiempo en hembras pueden facilitar su androgenización: Olor corporal de adulto. Incremento de las glándulas sebáceas que puede llevar a acné. Incremento fálico (o clitoromegalia) Incremento de la líbido y frecuencia de erección. Extensión del pelo púbico y su conformación masculina. Desarrollo del pelo facial. Pérdida de pelo en la cabeza (alopecia androgénica) Aparición de pelo característico masculino: pecho, periareolar y anal. Pelo en las piernas. Pelo axilar. Grasa subcutánea disminuída en la cara. Incremento de la masa y fuerza muscular (Bhasin et al., 1996 (6b)). Profundización de la voz. Incremento en la altura. Crecimiento de la nuez. Crecimiento del tejido espermatogénico, fertilidad masculina. Remodelación de las facciones masculinas de la cara. Ampliación de los hombros y de la caja costal. Finalización de la maduración ósea y término del crecimiento, indirectamente por la vía de los metabolitos del estradiol por lo que es más gradula en hombres que en mujeres. Durante la etapa adulta, sus efectos son más evidentes en machos que en hembras, pero igual de importante para ambos. Disminuyendo dichos efectos con la edad: Líbido y frecuencia erectiva tanto del pene como del clítoris. Regula el eje de los andrógenos suprarrenales (Metha et al., 2008 (7b)). Proporciona energía mental y física. Mantiene el trofismo muscular. Protege contra el cáncer de próstata (Morgentaler and Schulman 2009 (10b); Morgentaler, A. and A.M. Traish 2009 (11b)). Protege el sistema cardiovascular (Haddad et al., 2007 (12b); Stanworth and Jones 2008 (13b)). Ante un desafío regula la respuesta a la lucha (Mehta and Josephs 2006 (14b)). Regula la población de receptores al tromboxano A2, aumentando la agregación plaquetaria (Ajayi and Halushka 2005 (15b)). Es fundamental en la espermatogénisis. El desamor disminuye la Te en hombres y la aumenta en mujeres (Marazziti and Canale 2004 (16b)). Juega un importante papel en el riesgo frente a la toma de decisiones en los negocios (Sapienza et al., 2009 (17b)). La paternidad también disminuye los niveles de la testosterona en los hombres, lo que puede explicar los cambios emocionales y del comportamiento que promueven el cuidado paternal (Berg and Wynne-Edwards 2001 (18b)). En resumen las funciones de los andrógenos son: La Te es responsable de: - diferenciación fetal del epidídimo, conducto deferente y vesículas seminales - crecimiento explosivo puberal (junto a GH y T3) - aumento del pene y de las vesículas seminales y su secreción - cierre epifisario, por su transformación en estradiol (Te -> E2) - capacitación de una erección fisiológicamente completa (potencia) - inhibe crecimiento glándula mamaria - agrandamiento de la laringe - engrosamiento de las cuerda vocales (voz profunda) - estimula la hematopoyesis (incremento de eritropoyetina renal y acción en medula ósea) - actividad anabólica (proteica) (balance positivo de nitrógeno), incremento de la masa muscular, ósea y cardiaca. - regula la liberación de GnRH y LH - Activa la liberación de GH La DHT es responsable de: - estimular los folículos pilosos (barba, vello pubiano en forma de rombo, pelo corporal, regresión de la línea temporal del pelo) - incrementa la producción de sebo (acné) - diferenciación del pene, escroto, uretra peneana y próstata en el feto - crecimiento del pene y vesículas seminales en la pubertad - en la pubertad crecimiento del escroto y próstata y sus secreciones - incrementa el espesor de la piel - estimula la fijación de calcio en el hueso y su espesor Los andrógenos producen retención moderada de sodio, potasio, agua, sulfato y fósforo, y aumentan el tamaño de los riñones. Las tres juntas: - regulan la espermatogénesis (figura) - estimulan el comportamiento agresivo, activo y el interés por el sexo opuesto y la conducción sexual (libido), junto con otras hormonas como la oxitocina y la vasotocina. Importante componente de aprendizaje. REGULACIÓN (figura) El comienzo de la pubertad coincide con una liberación pulsátil de GnRH y por tanto de LH (cada 60 minutos), provocada por la liberación de la KISSPEPTINA [1], señal de origen hipotalámico (núcleo arqueado en el varón) cuya aparición marca la señal de inicio de la pubertad, actuando sobre las neuronas secretoras de GnRH, liberación que se mantiene durante la etapa adulta. La señal de su activación, es la leptina del tejido adiposo que indica el nivel adecuado de reserva grasa en el sujeto. Estas secreciones pulsátiles también afectan a la testosterona. Junto a este tipo de liberación se superpone una secreción circadiana con un pico máximo hacia las 20.00 h y un mínimo hacia las 8.00 h. La FSH sin embargo no presenta estos tipos de ritmos. Existe un retrocontrol negativo entre la testosterona y la LH y entre la inhibina, la folistatina (Robertson, 1992 (33b)) y la FSH. La testosterona disminuye la frecuencia de descarga de LH (actúa al nivel del hipotálamo), mientras que el estradiol disminuye la amplitud de descarga de la LH (actúa en el nivel de la hipófisis). Tanto la LH como la FSH son hormonas tróficas para las células de Leydig y las de Sertoli respectivamente. La FSH estimula y mantiene la espermatogénesis y estimula la síntesis y liberación en las células de Sertoli de otros moduladores como las inhibinas y las activinas, así como de la transformación de testosterona en estrógenos necesarios también para la maduración de los espermatozoides. La testosterona liberada por las células de Leydig pasa al túbulo seminífero donde es almacenada por las ABP, siendo esenciales para la maduración de los espermatozoides. La prolactina actúa de forma sinérgica con la LH en la producción de testosterona y a su vez tanto la testosterona como el estradiol estimulan la síntesis de prolactina. Por otra parte la prolactina potencia la acción de la testosterona en sus tejidos diana, incrementando el número de receptores para los andrógenos. La hormona del crecimiento tiene un efecto similar a la prolactina. La insulina potencia la acción de la LH/GCh. La IGF1 producida por las mismas células de Sertoli y de Leydig, regula la proliferación y desarrollo testicular. El factor beta de crecimiento tumoral (TGF-beta), producido por las células tecales y de Leydig y peritubulares, inhibe el número de receptores para la LH. Así mismo, el PDGF (factor de crecimiento derivado de plaquetas), estimula a las células de Sertoli. Además de lo anterior se sabe que la pérdida de estatus o dominación social supone una disminución de Te (Mehta and Josephs 2006 (20b)). También la motivación implícita del poder lleva a un aumento de la Te (Schultheiss, 1999 (21b)). El incremento de la edad reduce los niveles de Te (Liu et al., 2006 (22b)). El sueño REM incrementa los niveles de Te (Andersen & Tufik, 2008 (23b)), incrementados también por el entrenamiento de resistencia (Marin et al., 2006 (24b)), aunque en hombres mayores este tipo de incremento puede ser evitado por la ingestión de proteínas (Hulmi et al., 2008 (25b)). Las deficiencias de Zinc bajan los niveles de Te (Prasad et al., 1996 (26b)) y su suplemento en exceso no los mejora (Koehler et al., 2009 (27b)). También hay evidencias de que el ácido glicirrhizinico del regaliz disminuye, pero poco, la Te en la mujer (Armanini et al., 2004 (29b)), y también en el hombre aunque clínicamente no es significativo (Josephs et al., 2001 (28b)). También el té de menta verde reduce los niveles de testosterona (Grant, 2010 (31b))(Kumar et al., 2008 (32b)). Alteraciones en el eje hormonal sexual. (figura) Las alteraciones en los diferentes niveles del eje son por defecto o por exceso y su efecto siempre dependerá de si ocurren antes o después de la pubertad. Antes de la pubertad pueden llevar a retraso en su activación o a no alcanzarla nunca (hipogonadismo), o todo lo contrario a alcanzar antes de tiempo, con los problemas que ello acarrea en cuanto al cierre epifisario óseo. Si ocurre en el desarrollo embrionario se condicionaría una femenización de los genitales externos. Después de la pubertad, un déficit hormonal supondrá entre otros efectos una posible infertilidad dado el papel de las hormonas sexuales, entre otras, para la espermatogénesis(oligospermia (baja concentración de espermatozoides), azospermia (ausencia de espermatozoides). [1] A finales de los 90 se reportó la existencia de un péptido de 121 aa, el KISSPÉPTINA (del gen Kiss-1), de origen nervioso que interactúa con el receptor GPR54 (similar al receptor de Galanina) existente entre otros sitios, en las células productoras de GnRH (2003). Este péptido pertenece a una familia de péptidos denominados KISS y se considera responsable de la señal de inicio de la pubertad. Sujetos que no tienen este receptor son considerados como hipogonadismo hipogonadotrópico, aunque su GnRH puede liberarse normalmente por factores externos. El origen de las neuronas secretoras de esta hormona parecen estar en el núcleo arqueado, núcleo periventricular anteroventral, núcleo periventricular y núcleo preóptico anterodorsal. Las neuronas de estos núcleos son también diana de los esteroides sexuales plasmáticos y sobre todo de la leptina del tejido graso, siendo esta la señal que determina su liberación. Es decir, es una reserva grasa determinada en el adolescente, la que determina la señal de la activación del eje endocrino sexual..
Anuncio
Documentos relacionados
Descargar
Anuncio
Añadir este documento a la recogida (s)
Puede agregar este documento a su colección de estudio (s)
Iniciar sesión Disponible sólo para usuarios autorizadosAñadir a este documento guardado
Puede agregar este documento a su lista guardada
Iniciar sesión Disponible sólo para usuarios autorizados