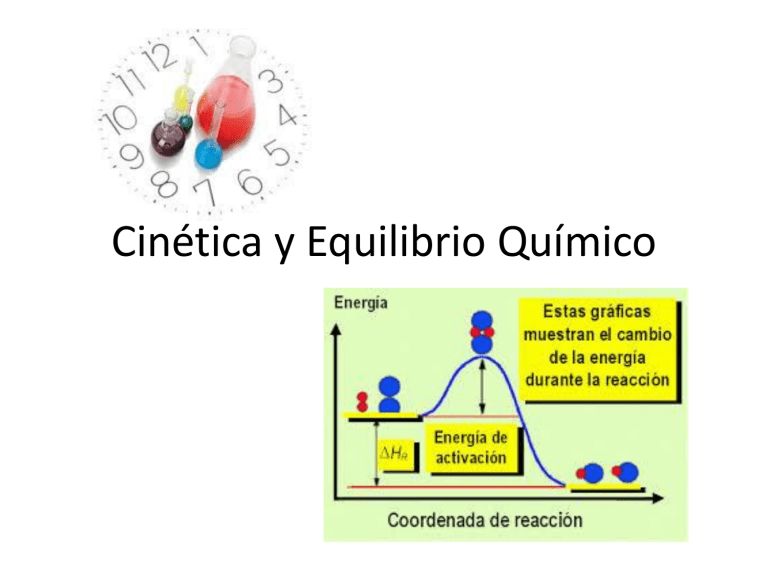
Cinética y Equilibrio Químico Velocidad de Reacción ¿Qué información te proporciona cada gráfico? ¿Qué variables representa? ¿Cómo definirías “velocidad” a partir del gráfico 1? A partir de gráfico 2, ¿Qué es la velocidad de reacción? Velocidad en un proceso químico • La cinética química es la rama de la química que estudia la velocidad de las reacciones químicas y sus mecanismos. Velocidad promedio • La velocidad de la reacción estará directamente asociada a: • A B • Siendo A los reactivos que deben colisionar efectivamente para que se obtengan los productos B y en la medida en que los A disminuyan los B aumentarán. Entonces podemos calcular la velocidad promedio en un punto determinado o en una variación. A B Ejercicios Velocidad Instantánea velocidad instantánea de una reacción química (velocidad en cualquier punto del tiempo) se puede determinar dibujando una tangente a la gráfica de concentración en función del tiempo, considerando que ésta (velocidad instantánea) es igual al valor de la pendiente de la gráfica. Naturaleza química y física de los reactantes ¿Qué debe ocurrir a los reactantes para que se produzcan los productos? Modelo de las colisiones 1. Las moléculas de los reactantes deben tener energía suficiente para que pueda ocurrir el rompimiento de enlaces, un reordenamiento de los átomos y luego la formación de los productos; de lo contrario, las moléculas colisionan pero rebotan unas con otras, sin formar los productos. Esta energía mínima se llama Energía de Activación. Ea 2. Los choques entre las moléculas deben efectuarse con la debida orientación en los reactante Perfil de una reacción Los perfiles de reacción química corresponden a un diagrama que permiten comprender fácilmente el desarrollo de una reacción química, pues describe cómo se comporta la energía en una reacción. Energía de Activación La energía de activación ( E ) corresponde a la mínima energía necesaria para que se inicie una reacción química. Por lo tanto, para que los choques entre las moléculas sean efectivos y produzcan una nueva sustancia, dichas moléculas deben poseer una energía cinética mayor o igual que la energía de activación • A Ley de velocidad B Experimentos [A] M [B] M V M/s I 0,100 0,100 4,0 x10-5 II 0,100 0,200 4,0 x10-5 III 0,200 0,100 16,0 x10-5 Problema • Se midieron los datos de la siguiente reacción • 2NO + 2H2 = N2 + 2H2O EXP NO [M] H2 [M] V M/S I 0,10 0,10 1,23X10-3 II 0,10 0,20 2,46X10-3 III 0,20 0,10 4,92X10-3 • a. Determina la ecuación de velocidad de esta reacción b. Calcule la constante de velocidad c. Calcule la velocidad cuando [NO]= 0,050 M y [H2]= 0,150M Factores que afectan la velocidad de reacción a. b. c. d. Grado de división de los reactivos Concentración Presión Temperatura Ecuación de Arrhenius • El científico sueco S. Arrhenius, quien en 1889 señaló que: “Al aumentar la temperatura se produce un incremento en el número de choques efectivos y, como consecuencia de ellos, en la velocidad ( v ) y en la constante de velocidad ( k ) de la reacción”. Por lo tanto, la dependencia en la constante de velocidad ( k ) de una reacción con respecto a la temperatura, se expresa mediante la siguiente ecuación (ecuación de Arrhenius): • • • • • A = factor de frecuencia e = función inversa del ln Ea= energía de activación en Kj/mol R cte 8,314 J/Kmol T = temperatura absoluta. Catalizadores Tipos de Catalizadores Los catalizadores son sustancias que modifican (aumenta) la rapidez de una reacción química sin sufrir un cambio químico permanente en el proceso, es decir, sin ser parte de los productos obtenidos. Los catalizadores se clasifican en positivos y negativos o inhibidores. Catalizadores En las catálisis (procesos químicos acelerados por la presencia de un catalizador) se pueden presentar catalizadores homogéneos o heterogéneos. Los primeros son aquellos que están en la misma fase que los reactivos y los segundos presentan un estado distinto al de los reactivos. Catálisis heterogénea Catálisis homogénea Catálisis enzimática Convertidor Catalítico Los convertidores catalíticos de los automóviles motorizados, corresponde a una aplicación actual de los catalizadores, en un proceso de catálisis heterogénea, que colabora en la lucha contra la contaminación ambiental. Constante de Equilibrio La constante de equilibrio corresponde al cociente entre los productos y los reactantes, que: 1. Permite calcular las concentraciones de reactivos y productos cuando se ha establecido el equilibrio, y 2. Predice la dirección en la que se llevará a cabo una reacción hasta alcanzar el equilibrio. Valores de la constante de equilibrio El cociente de reacción es una expresión análoga a la constante de equilibrio ( k eq ) , pero se calcula empleando las concentraciones iniciales de cada componente del sistema y no con las concentraciones en equilibrio. • Cuando Q > k eq las sustancias del lado derecho de la ecuación química reaccionan para formar sustancias en el izquierdo, desplazando la reacción de derecha a izquierda y viceversa. Lo anterior, permite también predecir como volver al estado de equilibrio. • Comparación entre el cociente de reacción ( Q ) y la constante de equilibrio: Principio de Le Chatelier El principio de Le Chatelier establece que si sobre un sistema en equilibrio se modifica cualquiera de los factores que influyen en una reacción química, dicho sistema se desplazará en la dirección que contrarreste el cambio. • Factores que modifican el equilibrio 1. Factor concentración 2. Factor presión 3. Factor temperatura 4. Catalizadores Henry Louis Le Châtelier Nace en París, Francia, el 8 de octubre de 1859. Muere en Miribel-les-Échelles, Francia, el 17 de septiembre de 1936). Fue un famoso químico francés. Es conocido por su Principio de los Equilibrios Químicos, mejor conocido como Principio de Le Châtelier Prof. S. Casas-Cordero E. 28 Principio de Le Chatelier • Establece que si un sistema en equilibrio es sometido a una perturbación o tensión, el sistema reaccionará de tal manera que disminuirá el efecto de la tensión. • Hay 3 formas de alterar la composición en el equilibrio de una mezcla de reacción en estado gaseoso para mejorar el rendimiento de un producto: Prof. S. Casas-Cordero E. 29 Cambio de concentración de reactivos o productos Composición en equilibrio de una mezcla Cambio de presión parcial de reactivos o productos Cambio de temperatura Prof. S. Casas-Cordero E. 30 Cambios en la Concentración; Remoción de productos o adición de reactivos “reactivos” “productos” Prof. S. Casas-Cordero E. Si se remueven los productos (como quitar agua del lado derecho del tubo) La reacción se desplazará hacia la derecha hasta que se reestablezca el equilibrio. 31 “reactivos” “productos” Si se agrega más reactivos (como agregar agua en el lado izquierdo del tubo) la reacción se desplazará hacia la derecha hasta que se reestablezca el equilibrio. Prof. S. Casas-Cordero E. 32 Ejemplo: CO(g) + 3 H2(g) CH4(g) + H2O(g) ¿Qué sucederá si se elimina el vapor de agua en la reacción anterior? CH4 x H2O Keq COx H2 Q < Keq; el equilibrio se desplaza hacia la derecha Prof. S. Casas-Cordero E. 33 Ejercicio: A 25 ºC la Keq de la reacción es 87,5 PCl5(g) === PCl3(g) + Cl2(g) ¿Qué concentración existirá para cada especie en el Equilibrio, si se inicia sólo con una concentración 2,0 M en PCl5? Condición de inicio: [PCl5] = 2,0 M [PCl3] = 0 [Cl2] = 0 PCl3 x Cl2 Condición de Equilibrio: Keq PCl5 [PCl5] = (2 – x) [PCl3] = (0 + x) = x Se obtiene una ecuación de 2º [Cl2] = (0 + x) = x Reemplazando en la Keq: 2 (x) x (x) x (2 x) (2 x) Dejando la expresión lineal: 87,5 87,5 x (2 - x) x 2 grado: x 2 87,5 x - 175 0 - 87,5 (87,5)2 - 4 x (1)x(-175) x 2x(1) Prof. S. Casas-Cordero E. 34 x 2 87,5 x - 175 0 - 87,5 (87,5)2 - 4 x (1)x(-175) x 2x(1) x1 = 1,956 y x2 = - 89,456 Ya que x representa concentración molar, se descarta el valor negativo Condición de Equilibrio: [PCl5] = (2 – x) [PCl3] = (0 + x) = x [Cl2] = (0 + x) = x Resultado final: [PCl5] = (2 – 1,956) = 0,044 M [PCl3] = 1,956 M [Cl2] = 1,956 M Prof. S. Casas-Cordero E. 35 Ejercicio: Kc tiene el valor 0,86 para la reacción en fase gaseosa; H2 + I2 == 2 HI ¿Hacia dónde se desplaza la reacción si se tiene: [H2] = 0,4 M, [I2] = 0,6 M y [HI] = 1,25 M? Aplicando criterio Q: 2 HI Kc 0,86 H2 xI2 (1,25)2 Q 6,5 (0,4)x(0,6 ) Como Q > Kc, la reacción tiende hacia reactante Prof. S. Casas-Cordero E. 36 ¿Cuáles serán las concentraciones cuando se logre el equilibrio? H2 + I2 == 2 HI Condición de Equilibrio [H2] = (0,4 + x) [I2] = (0,6 + x) [HI] = (1,25 – 2x) Condición de Inicio [H2] = 0,4 [I2] = 0,6 [HI] = 1,25 (1,25 - 2x) 2 0,86 (0,4 x)x(0,6 x) Reemplazando en Kc: Se obtiene la ecuación de 2º grado: 3,14x2 – 5,86x + 1,3561 = 0 X1 = 1,596 = 1,60 y X2 = 0,27 Prof. S. Casas-Cordero E. 37 X1 = 1,596 = 1,60 y X2 = 0,27 ¿Cuál valor se debe ocupar? Probando X1: [H2] = (0,4 + 1,60) = 2 M [I2] = (0,6 + 1,60) = 2,2 M [HI] = (1,25 – 2x1,60) = - 1,95 M Comprobando en Kc: Se rechaza X1 por resultar una concentración negativa Probando X2: [H2] = (0,4 + 0,27) = 0,67 M [I2] = (0,6 + 0,27) = 0,87 M [HI] = (1,25 – 2x0,27) = 0,71 M (0,71)2 Kc 0,8648 0,86 (0,67)x(0, 87) Prof. S. Casas-Cordero E. 38 Efecto del cambio de temperatura • La temperatura afecta de modo diferente si la reacción es exotérmica o endotérmica. • La velocidad de reacción normalmente se incrementa al aumentar la temperatura. • Se alcanza más rápidamente el equilibrio. • Cambia el valor de la constante de equilibrio, Keq. Prof. S. Casas-Cordero E. 39 N2O4 (g) Calor 2 NO2 (g) Aumenta T Prof. S. Casas-Cordero E. 40 Co(H2O)62+ + 4 Cl1- ↔ CoCl42- + 6 H2O • Efecto del cambio de temperatura sobre el equilibrio químico. Prof. S. Casas-Cordero E. 41 Co(H2O)62+ + 4 Cl1- ↔ CoCl42- + 6 H2O [Co(H2O)6]2+ + 4 Cl1- [CoCl4]2- + 6 H2O Prof. S. Casas-Cordero E. 42 Energía de activación Energía de activación Productos Reactivos H > 0 H < 0 Reactivos Productos Transcurso de la reacción Transcurso de la reacción Reacción exotérmica Reacción endotérmica Prof. S. Casas-Cordero E. 43 Efecto del cambio de presión • Los cambios de presión pueden afectar los sistemas gaseosos homogéneos en equilibrio. • Los cambios de presión no afectan sistemas homogéneos sólidos o líquidos, pero afectan los sistemas heterogéneos en los que interviene uno o más gases. • Los cambios que se producen en la presión interna no afectan el equilibrio. Prof. S. Casas-Cordero E. 44 • Un aumento en la presión externa hace evolucionar al sistema en la dirección del menor número de moles de gas. Una disminución lo hace reaccionar hacia donde existen mayor cantidad. • Un aumento en la presión del siguiente sistema: CO(g) + 3 H2(g) CH4(g) + H2O(g) obliga a que el sistema se desplace hacia la derecha, hay cuatro moles a la izquierda y solo dos a la derecha. Prof. S. Casas-Cordero E. 45 Prof. S. Casas-Cordero E. 46 2 NH3 (g) N2 (g) 3 H2 (g) ¿Qué esperaría en este caso? Prof. S. Casas-Cordero E. 47 • Ciertamente la reacción se favorece hacia reactante. • La formación de Amoniaco es un proceso industrial que se realiza a alta presión • Se conoce como proceso Haber N2(g) + 3H2(g) Prof. S. Casas-Cordero E. 2NH3(g) 48 Mecanismos de reacción • Cuando observamos una reacción química, sólo percibimos el cambio químico neto que tiene lugar, es decir, los reactantes que desaparecen y los productos que se forman, pero no sabemos cuan compleja es ni conocemos las reacciones elementales por las que tuvo que pasar para llegar a formar el producto. El conjunto de estas etapas constituye el mecanismo de reacción. • Mecanismo de reacción es la secuencia de etapas elementales que lleva a la formación de productos • Para describir el número de moléculas que reaccionan en una etapa determinada, se utiliza el término molecularidad Reacción de Formación del NO2 Molecularidad (cont) • Generalmente, en reacciones elementales, coincide con el orden de reacción. • Sin embargo, existen casos en los que no coinciden, como las reacciones de hidrólisis en los que interviene una molécula de agua ya que al ser [H2O] prácticamente constante la velocidad es independiente de ésta. • Es raro que una reacción intervengan más de tres moléculas pues es muy poco probable que choquen entre sí simultáneamente con la energía y orientación adecuadas. 51 Mecanismos de reacción • En la reacción elemental: H2 (g) + I2 (g) 2 HI (g) vista anteriormente, v = k · [H2 · [I2 • Sin embargo, la mayoría de las reacciones suceden en etapas. • El conjunto de estas etapas se conoce como “mecanismo de la reacción”. • Las sustancias que van apareciendo y que no son los productos finales se conocen como “intermedios de reacción”. • La velocidad de la reacción dependerá de las sustancias que reaccionen en la etapa más lenta. 52 Ejemplo de mecanismo de reacción • La reacción NO2 (g) + CO (g) NO (g) + CO2 (g) sucede en dos etapas: • 1ª etapa (lenta): 2 NO2 NO + NO3 • 2ª etapa (rápida): NO3 + CO NO2 + CO2 • La reacción global es la suma de las dos. • NO3 es un intermedio de reacción. • En la etapa lenta intervienen dos moléculas de NO2,, luego v = k · [NO22 53 Teoría de las colisiones. Energía de activación (Ea). • El número de moléculas de productos es proporcional al número de choques entre las moléculas de los reactivos. • De éstos, no todos son efectivos – Bien porque no tienen la energía necesaria para constituir el “complejo activado”. – Bien porque no tienen la orientación adecuada. • La energía de activación es la necesaria para formar el “complejo activado”, a partir del cual la reacción transcurre de forma natural. 54 © Grupo ANAYA S.A. Orientación en el choque 55









