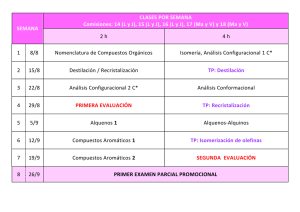
COLEGIO LICEO FEMENINO “MERCEDES NARIÑO” I.E.D QUÍMICA 11° J. M. Profesor: Juan Gabriel Perilla Jiménez Profesor Practicante: Andrés Felipe Romero TALLER: ALCOHOLES Y FENOLES Alcoholes. Alcoholes son aquellos compuestos orgánicos en cuya estructura se encuentra el grupo hidroxilo (OH), unido a un carbono que solo se acopla a otro carbono o a hidrógenos. Pueden ser alifáticos (R-OH) o aromáticos (Ar-OH) estos últimos se conocen como fenoles. Son un grupos de compuestos muy importantes, no solo por su utilidad industrial, de laboratorio, teórica, o comercial, si no también, porque se encuentran muy extensamente en la vida natural. Cuando en la molécula del alcohol hay más de un grupo hidroxilo se les llama polioles o alcoholes polihídricos. Si son dos grupos hidroxilos se llaman glicoles, tres, gliceroles, cuatro tetrioles y así sucesivamente. Nomenclatura Es común que los alcoholes se nombren usando la palabra alcohol como nombre, y con el "apellido" del grupo correspondiente a los alcanos básicos que le dan lugar, esta nomenclatura se ilustra a continuación. Regla 1. Se elige como cadena principal la de mayor longitud que contenga el grupo -OH y se numera dándole el localizador más bajo. El grupo hidroxilo tiene preferencia sobre cadenas carbonadas, halógenos, dobles y triples enlaces. Regla 2. El nombre del alcohol se construye cambiando la terminación -o del alcano con igual número de carbonos por -ol. Regla 3. El grupo -OH es prioritario frente a los alquenos y alquinos. La numeración otorga el localizador más bajo al -OH y el nombre de la molécula termina en -ol. Regla 4. Cuando en la molécula hay grupos grupos funcionales de mayor prioridad, el alcohol pasa a ser un mero sustituyente y se llama hidroxi-. Son prioritarios frente a los alcoholes: ácidos carboxílicos, anhídridos, ésteres, haluros de alcanoilo, amidas, nitrilos, aldehídos y cetonas. Fenoles Cuando uno de los hidrógenos de la estructura molecular de los hidrocarburos aromáticos se sustituye por el grupo hidroxilo (-OH), característico de los alcoholes, se les denomina fenoles. El mas simple de los hidrocarburos aromáticos es el benceno (C6H6), de estructura de resonancia en forma de anillo hexagonal. Cuando uno de los hidrógenos del benceno se sustituye por un grupo hidroxilo obtenemos el Fenol, el mas simple de los fenoles y al cual debe el nombre la clase. Los fenoles presentan algunas características comunes con los alcoholes pero se diferencian en otras muchas por eso son tratados como una clase aparte. Cuando dos hidrógenos del anillo del benceno se sustituyen por grupos hidroxilos, se dice que son dihídricos, y en general reciben nombres comunes. Nomenclatura Regla 1.Se nombran como los alcoholes, con la terminación "-ol" añadida al nombre del hidrocarburo, cuando el grupo OH es la función principal. Cuando el grupo OH no es la función principal se utiliza el prefijo "hidroxi-" acompañado del nombre del hidrocarburo. 1,2-bencenodiol o orto-dihidroxibenceno Regla 2. Si el benceno tiene varios substituyentes, diferentes del OH, se numeran de forma que reciban los localizadores más bajos desde el grupo OH, y se ordenan por orden alfabético. En caso de que haya varias opciones decidirá el orden de preferencia alfabético de los radicales. 2-etil-4,5-dimetilfenol PROPOSITO: Reconocer propiedades físicas - químicas y nombrar compuestos del grupo de los alcoholes y fenoles. 1. Nombre los siguientes compuestos: 2. Determine la fórmula de los siguientes compuestos 4,4,-dimetil-2-hexanol 3-isobutil-5-metil-1-heptanol 2-cloroetanol Alcohol isopropílico 3-fenil-1-butanol o-bromofenol 3-sec-butil-1,2-butanodiol p-metil fenol 1-bromo-6-etil-3,3-pentanodiol Fenol para-hidroxitolueno. 2-fenil-5-metil-4-octanol 3. Responda las siguientes preguntas a) ¿En que consiste la fusión alcalina de ácidos sulfónicos para obtención de fenoles? b) ¿Cómo se obtienen los alcoholes y fenoles según la reacción con reactivo de Grignard? Explique detalladamente. c) ¿Qué usos industriales tienen los alcoholes y fenoles? d) Explique el comportamiento acido-base de los alcoholes y fenoles. e) Esquematice en un mapa conceptual las reacciones químicas (propiedades químicas) de los alcoholes. 4. Relaciona los términos y las definiciones y escribe las letras entre los paréntesis según corresponda a) Alcohol b) Fenol c) Éter d) Alcohol primario e) Alcohol secundario f) Alcohol terciario ( ) Oxígeno con dos grupos funcionales ( ) Alcano en el cual un hidrógeno se reemplaza por OH( ) Anillo aromático con OH unido a él ( ) 2-metil-2-propanol ( ) 2-propanol 5. El fenol fue el primer antiséptico empleado por Joseph Lister en 1867, en una cirugía. También es usado como ingrediente en pomadas y ungüentos, pero tiene el inconveniente de que no solo destruye los organismos indeseables sino todo tipo de células. Por tal razón ha sido sustituido por el 4-hexilesorcinol, que se emplea en algunos enjuagues bucales. Explica: a) ¿Cuál es su fórmula estructural, si el nombre IUPAC del 4-hexilesorcinol es 1,3-dihidroxi- 4hexilbenceno? b) ¿Por qué razón el fenol ataca las células? COLEGIO LICEO FEMENINO “MERCEDES NARIÑO” I.E.D QUÍMICA 11° J. M. Profesor: Juan Gabriel Perilla Jiménez Profesor Practicante: Andrés Felipe Romero TALLER: ALDEHÍDOS Y CETONAS Los aldehídos y las cetonas son funciones en segundo grado de oxidación. Se consideran derivados de un hidrocarburo por sustitución de dos átomos de hidrógeno en un mismo carbono por uno de oxígeno, dando lugar a un grupo oxo (=O). Si la sustitución tiene lugar en un carbono primario, el compuesto resultante es un aldehído, y se nombra con la terminación -al. Si la sustitución tiene lugar en un carbono secundario, se trata de una cetona, y se nombra con el sufijo -ona. El grupo carbonilo (>C=O), común a aldehídos y cetonas, confiere polaridad a la moléculas, aunque en menor cuantía que el grupo hidroxilo. Los aldehídos y cetonas pueden, por captación de un átomo de hidrógeno de un carbono contiguo, dar lugar a una reacción intramolecular con formación de un doble enlace y una función hidroxilo, es decir, un enol. Este proceso es fácilmente reversible y se conoce con el nombre de tautomería cetoenólica. Una de las reacciones químicas más importantes del grupo carbonilo es la adición de una molécula de alcohol para dar hemiacetales. Nomenclatura para Aldehídos: Regla 1. Los aldehídos se nombran reemplazando la terminación -ano del alcano correspondiente por -al. No es necesario especificar la posición del grupo aldehído, puesto que ocupa el extremo de la cadena (localizador 1). Cuando la cadena contiene dos funciones aldehído se emplea el sufijo -dial. Regla 2. El grupo -CHO se denomina -carbaldehído o -formil. Este tipo de nomenclatura es muy útil cuando el grupo aldehído va unido a un ciclo. La numeración del ciclo se realiza dando localizador 1 al carbono del ciclo que contiene el grupo aldehído. Regla 3. Cuando en la molécula existe un grupo prioritario al aldehído, este pasa a ser un sustituyente que se nombra como oxo- o formil-. * Tanto -carbaldehído como formil- son nomenclaturas que incluyen el carbono del grupo carbonilo. carbaldehído se emplea cuando el aldehído es grupo funcional, mientras que formil- se usa cuando actúa de sustituyente. Regla 4. Algunos nombres comunes de aldehídos aceptados por la IUPAC son: Nomenclatura para Cetonas: Regla 1. Las cetonas se nombran sustituyendo la terminación -ano del alcano con igual longitud de cadena por -ona. Se toma como cadena principal la de mayor longitud que contiene el grupo carbonilo y se numera para que éste tome el localizador más bajo. Regla 2. Existe un segundo tipo de nomenclatura para las cetonas, que consiste en nombrar las cadenas como sustituyentes, ordenándolas alfabéticamente y terminando el nombre con la palabra cetona. Regla 3. Cuando la cetona no es el grupo funcional de la molécula pasa a llamarse oxo-. PROPOSITO: Reconocer propiedades físicas - químicas y nombrar compuestos del grupo de los aldehídos y cetonas. 1. Complete la siguiente tabla: Nombre Estructura 2-butanona butanaldehído CH3CH2COCH2 CH3CH2CHO 1,4-ciclohexanodiona 2,2dimetilciclohexanona 3-metil-3-fenilbutanal 2-metil-2-fenil-4heptanona 4-bromobenzaldehido 2. La oxidación y la reducción son procesos muy comunes que presentan los aldehídos y las cetonas. En la siguiente tabla indica el nombre de los compuestos que se forman según corresponda: Compuesto 2-pentanona Oxidacion Reduccion Heptanaldehído 3-heptanona Propanal Hexanaldehído 3-hexanona Octanal 3. El grupo carbonilo de los aldehídos y de las cetonas es un grupo que presenta alta reactividad química. Presenta reacciones de adición, sustitución y condensación. Escribe los reactivos o los productos faltantes en las siguientes ecuaciones químicas: 4. Las pruebas de Fehling, Tollens y haloformo se emplean en el laboratorio para identificar los aldehídos y las cetonas. Los resultados de una práctica de laboratorio se muestran a continuación: Precipitado de color rojo Coloración cobre del tubo Explica, con base en lo anterior: a) ¿Qué compuesto, aldehído o cetona, está presente en el tubo 1? b) ¿Qué compuesto, aldehído o cetona, está presente en el tubo 2? c) ¿Qué reactivos específicos para la identificación de aldehídos y cetonas se utilizaron para esta práctica de laboratorio? 5. Explique cada una de las reacciones químicas que sufren los aldehídos y cetonas con ejemplos. 6. Las quinonas son un grupo especial de cetonas cuyo comportamiento químico es diferente al que muestran las cetonas alifáticas, por lo tanto, se consideran como un grupo independiente. La hidroquinona es empleada en cosmetología por sus propiedades para desmanchar la piel. Explica: a) ¿Qué propiedades de la hidroquinona permiten la acción blanqueadora sobre la piel? b) ¿Cuál es la fórmula estructural de la hidroquinona? c) ¿En qué otros procedimientos industriales se utiliza la hidroquinona? COLEGIO LICEO FEMENINO “MERCEDES NARIÑO” I.E.D QUÍMICA 11° J. M. Profesor: Juan Gabriel Perilla Jiménez Profesor Practicante: Andrés Felipe Romero TALLER: ACIDOS CARBOXILICOS Los ácidos carboxílicos son funciones con grado de oxidación tres, es decir, en un mismo átomo de carbono se insertan un grupo oxo (=O) y un grupo hidroxilo (-OH), formando un grupo carboxilo. Se nombran sistemáticamente sustituyendo la terminación -o del hidrocarburo de procedencia por el sufijo -oico, pero la mayoría posee nombres vulgares consagrados por el uso. El grupo carboxilo es el responsable de la polaridad de la molécula y de la posibilidad de establecer enlaces de hidrógeno. El hidrógeno del hidroxilo puede disociarse y el compuesto se comporta como un ácido. Esta disociación se ve favorecida por la resonancia del ión carboxilato, ya que el doble enlace se deslocaliza y la carga negativa se distribuye entre los dos átomos de oxígeno. En la misma molécula pueden existir varios grupos carboxilo. El número de estos grupos se indica con los prefijos di, tri, tetra, etc. Los ácidos monocarboxílicos de cadena larga se llaman también ácidos grasos. Los ácidos carboxílicos pueden reaccionar con álcalis para dar lugar a sales (jabones). Asímismo, cuando reaccionan con alcoholes dan lugar a ésteres. Cuando el enlace éster se produce dentro de la misma molécula se origina una función lactona. Dos grupos carboxilo o un grupo carboxilo y un ácido inorgánico pueden condensar (con pérdida de agua) para originar un anhídrido. Nomenclatura Regla 1. La IUPAC nombra los ácidos carboxílicos reemplazando la terminación -ano del alcano con igual número de carbonos por –oico. Regla 2. Cuando el ácido tiene sustituyentes, se numera la cadena de mayor longitud dando el localizador más bajo al carbono del grupo ácido. Los ácidos carboxílicos son prioritarios frente a otros grupos, que pasan a nombrarse como sustituyentes. Regla 3. Los ácidos carboxílicos también son prioritarios frente a alquenos y alquinos. Moléculas con dos grupos ácido se nombran con la terminación -dioico. Regla 4. Cuando el grupo ácido va unido a un anillo, se toma el ciclo como cadena principal y se termina en -carboxílico. PROPOSITO: Reconocer propiedades físicas - químicas y nombrar compuestos del grupo de los ácidos carboxílicos. 1. Complete la siguiente tabla: Compuesto Acido fórmico Ácido acético Ácido propiónico Acido butírico Ácido Valerico Acido acrílico Formula ¿Para qué se usa? Ácido láctico Ácido cítrico Acido Benzoico 2. Explique el proceso de preparación de ácidos carboxílicos a partir de la oxidación de alcoholes primarios e hidrolisis de nitrilos. 3. Analice y explique las siguientes imágenes en relación a reactividad y sustitución nucleofilica: 4. ¿Cuáles son los derivados de los ácidos carboxílicos? Descríbalos. 5. La aspirina, conocida también como ácido acetil salicílico, posee una fuerte acción antiséptica, analgésica y antipirética. Gran cantidad de medicamentos la contienen para el tratamiento de dolores de cabeza combinada con otros agentes farmacológicos. Explica: a. b. c. d. ¿Para qué enfermedades se recomienda el uso de este medicamento? ¿Cómo se facilita la absorción de la aspirina por el tracto intestinal? ¿Por qué se recomienda la aspirina a personas con problemas circulatorios? ¿La aspirina es un ácido, al ingerirla produce problemas gástricos? Justifica tu respuesta 6. Los ácidos carboxílicos pueden reaccionar con los alcoholes, deshidratarse o hidrolizarse para formar diversos derivados o viceversa. Determina las sustancias formadas al reaccionar los siguientes compuestos con cada uno de dichos reactivos (recuerde nombrar cada compuesto): COLEGIO LICEO FEMENINO “MERCEDES NARIÑO” I.E.D QUÍMICA 11° J. M. Profesor: Juan Gabriel Perilla Jiménez Profesor Practicante: Andrés Felipe Romero TALLER: ÉTERES Y ESTERES Eteres Es un grupo funcional del tipo R-O-R', en donde R y R' son grupos alquilo, iguales o distintos, estando el átomo de oxígeno unido a éstos. Se puede obtener un éter de la reacción de condensación entre dos alcoholes (aunque no se suele producir directamente y se emplean pasos intermedios): ROH + HOR' → ROR' + H2O Normalmente se emplea el alcóxido, RO-, del alcohol ROH, obtenido al hacer reaccionar al alcohol con una base fuerte. El alcóxido puede reaccionar con algún compuesto R'X, en donde X es un buen grupo saliente, como por ejemplo yoduro o bromuro. R'X también se puede obtener a partir de un alcohol R'OH. RO- + R'X → ROR' + XAl igual que los ésteres, no forman puentes de hidrógeno. Presentan una alta hidrofobicidad, y no tienden a ser hidrolizados. Los éteres suelen ser utilizados como disolventes orgánicos. Suelen ser bastante estables, no reaccionan fácilmente, y es difícil que se rompa el enlace carbono-oxígeno. Normalmente se emplea, para romperlo, un ácido fuerte como el ácido yodhídrico, calentando, obteniéndose dos halogenuros, o un alcohol y un halogenuro. Una excepción son los oxiranos (o epóxidos), en donde el éter forma parte de un ciclo de tres átomos, muy tensionado, por lo que reacciona fácilmente de distintas formas. Nomenclatura Eteres: Regla 1.Los éteres pueden nombrarse como alcoxi derivados de alcanos (nomenclatura IUPAC sustitutiva). Se toma como cadena principal la de mayor longitud y se nombra el alcóxido como un sustituyente. Regla 2. La nomenclatura funcional (IUPAC) nombra los éteres como derivados de dos grupos alquilo, ordenados alfabéticamente, terminando el nombre en la palabra éter. Regla 3. Los éteres cíclicos se forman sustituyendo un -CH2- por -O- en un ciclo. La numeración comienza en el oxígeno y se nombran con el prefio oxa- seguido del nombre del ciclo. Esteres: Los ésteres proceden de condensar ácidos con alcoholes y se nombran como sales del ácido del que provienen. La nomenclatura IUPAC cambia la terminación -oico del ácido por -oato, terminando con el nombre del grupo alquilo unido al oxígeno. Los esteres de bajo peso molar son líquidos de olor agradable, similar al de la esencia de las frutas que los contienen. Los ésteres de ácidos superiores son sólidos cristalinos, inodoros. solubles en solventes orgánicos e insolubles en agua. Su densidad es menor que la del agua. Por lo general se encuentran en escencias naturales proveniente de flores y frutas. Nomenclatura Esteres. Regla 1. Los ésteres proceden de condensar ácidos con alcoholes y se nombran como sáles del ácido del que provienen. La nomenclatura IUPAC cambia la terminación -oico del ácido por -oato, terminando con el nombre del grupo alquilo unido al oxígeno. Regla 2. Los esteres son grupos prioritarios frente a aminas, alcoholes, cetonas, aldehídos, nitrilos, amidas y haluros de alcanoilo. Estos grupos se nombran como sustituyentes siendo el éster el grupo funcional. Regla 3. Ácidos carboxílicos y anhídridos tienen prioridad sobre los ésteres, que pasan a nombrarse como sustituyentes (alcoxicarbonil......) Regla 4. Cuando el grupo éster va unido a un ciclo, se nombra el ciclo como cadena principal y se emplea la terminación -carboxilato de alquilo para nombrar el éster. PROPOSITO: Reconocer propiedades físicas - químicas y nombrar compuestos del grupo de los éteres y esteres. 1. Los éteres pueden considerarse como derivados del agua, donde los átomos de hidrógeno han sido sustituidos por un radical arilo. En los éteres, los dos hidrógenos de la molécula de agua son sustituidos por radicales según la fórmula general R—O—R o R—O—Ar. Si los dos grupos R o Ar son iguales, se consideran éteres simétricos y si son diferentes, se denominan éteres asimétricos. Determina cuáles de los siguientes éteres son simétricos y nómbrelos: a. CH3CH2—O—CH2CH3 b. CH3CH2—O—CH3 c. CH3CH2CH2—O—CH2CH3 2. La deshidratación de alcoholes es un método que se utiliza para obtener éteres simétricos, de acuerdo con la siguiente ecuación: a. Dipropiléter b. Dioctiléter c. Diciclobutiléter d. Diciclopentiléter e. Dipentiléter 3. El éter dietílico fue usado como anestésico y en la actualidad se utiliza como disolvente de sustancias orgánicas, grasas y aceites. Su punto de ebullición es 36 °C y es una sustancia infl amable. a. ¿Qué consecuencias produce en el organismo este anestésico? b. ¿Por qué esta sustancia presenta baja reactividad química? c. ¿Qué precauciones se debe tener en la manipulación de este compuesto? 4. El acetato de etilo y el acetato de butilo son los ésteres más importantes a nivel comercial. Son utilizados como disolventes para la nitrocelulosa y como materia prima en la fabricación de lacas. Los ésteres sintéticos son usados como aromatizadores de alimentos, como por ejemplo, el acetato de amilo que se reconoce por el olor a banano y el acetato de octilo, que se reconoce por el olor a naranja. Consulta y responde: a. ¿Qué ésteres se utilizan par producir el olor a piña, a albaricoque, a almendra y a frambuesa? b. ¿En qué se diferencian sus fórmulas químicas? 5. Nombra o dibuje la estructura de los siguientes esteres y éteres: Nombre Ciclohexanil-naftalenil éter Difenil éter 3 - metilpentil isobutil éter Isopropoxibutano 2-Metoxipentano m-Etoxifenol 2-Clorofenil fenil éter Estructura BIBLIOGRAFIA http://www.quimicaorganica.org/ http://www.ehu.eus/biomoleculas/moleculas/grupos.htm#gf http://www.sinorg.uji.es/Docencia/QO/tema3QO.pdf (Documento para alcoholes) http://www.sinorg.uji.es/Docencia/QO/tema4QO.pdf (Documento para éteres ) http://www.sinorg.uji.es/Docencia/QO/tema10QO.pdf (Documento para aldehídos y cetonas) http://www.sinorg.uji.es/Docencia/QO/tema11QO.pdf (Documento para ácidos carboxílicos y esteres)